0 引言
【研究意义】以水样腹泻、呕吐、消瘦等为主要临床症状的传染性仔猪腹泻是一种高度接触性肠道传染病,是引起哺乳仔猪死亡和发育不良的重要因素,也是威胁生猪养殖业健康发展主要疾病之一[1,2],流行趋势逐年走高。流行病学调查显示,猪流行性腹泻病毒(PEDV)和传染性胃肠炎病毒(TGEV)是引起传染性仔猪腹泻的2种主要肠道病原,尤其是PEDV,因其发病率和死亡率高而广受关注[3,4]。近年来,传染性仔猪腹泻不仅在中国、韩国和日本等亚洲国家暴发流行[5,6,7],加拿大、德国、美国等欧美国家也面临严峻形势,仅2013—2014年间,美国就因暴发腹泻而导致800万仔猪死亡,直接经济损失达数亿美元[8,9]。传染性仔猪腹泻正在成为危害世界养猪业的主要疾病之一。【前人研究进展】PEDV和TGEV同属于α冠状病毒属,是一种具有囊膜的球形、单股正链RNA病毒[10]。成熟病毒粒子的囊膜中含有纤突蛋白S、膜蛋白M和包膜蛋白E三种主要结构蛋白,在病毒囊膜形成、出芽和分泌过程中发挥重要的协同作用[11]。由于冠状病毒基因组独特的套式转录机制使其在自然进化中非常容易发生基因变异,从而不断产生新的变种,甚至引起新的传染性疾病,如猪呼吸道冠状病毒(porcine respiratory coronavirus,PRCoV)即是TGEV的自然缺失突变体[12,13];而不同来源的PEDV野毒株,其S 基因存在大量碱基的删减、插入或缺失等突变现象,主要发生在S蛋白的N端区域,对病毒毒力有重要影响[14,15,16]。PEDV和TGEV主要通过粪-口途径传播,可在世界范围内感染各年龄段猪只而引起肠道疾病,因PEDV感染的临床症状、致病机理和病理变化与TGEV感染极为相似,且两种病毒通常存在混合感染、协同致病现象[17,18],给传染性仔猪腹泻的诊断和预防带来困难,在临床上建立一种特异、高效、敏感的鉴别检测 PEDV、TGEV两种病毒的方法对疾病防控具有重要意义。由于流行性腹泻病毒和传染性胃肠炎病毒引起传染性仔猪腹泻临床症状和病理组织变化极为相似,必须借助于实验室方法才能进行鉴别检测。目前常用的实验室鉴别诊断技术主要有微量血清中和试验、酶联免疫吸附试验(ELISA)、免疫组织化学等免疫学诊断技术和原位杂交、PCR等分子诊断技术[19,20]。免疫诊断时间短,操作方便,但由于PEDV、TGEV的抗原变异及交叉反应导致免疫诊断灵敏度和特异性都比较低,不利于及时准确地对猪腹泻病因进行调查和监测;分子诊断则因其高度特异性和敏感性而受到广泛关注,尤其是以PCR扩增为基础的RT-PCR[21]、Real-Time PCR[22]、多重PCR[23]和环介导等温扩增(LAMP)[24]等,在猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、PEDV等众多猪源性病毒的临床诊断中得到初步应用。【本研究切入点】尽管PCR是一种特异、敏感、简便、快速的分子诊断技术,但由于PCR指数扩增极易放大因样本、加样及气溶胶等因素引起的交叉污染而导致假阳性,而且对于不新鲜样本,存在因目的基因降解、中间断裂等原因而扩增不出的假阴性问题,假阳性和假阴性率偏高限制了其在临床诊断上的应用。针对PCR检测存在的问题,作者建立了基于单链置换的PCR检测技术[25],初步应用于PRRSV、CSFV 和猪圆环病毒2型(PCV2)等猪源性病毒的检测[26]和食源性单增李斯特菌的检测[27],并取得了良好效果,但由于检测探针设计的缺陷,导致临床应用效果并不理想,尤其是RNA病毒检测,漏检现象严重。【拟解决的关键问题】本研究中,主要根据PEDV和TGEV核蛋白基因(N)的高度保守型,以及PEDV和TGEV 两种病毒间N基因序列的差异性,优化探针设计方案,建立PEDV/TGEV环介导间接PCR快速鉴别诊断技术,为及时准确地对猪病毒性腹泻进行调查和监测提供有效工具。
1 材料与方法
试验于2016年8月至2017年7月在河南牧业经济学院生物技术实验室完成。1.1 毒株、试验病料及主要试剂
试验所用PEDV、TGEV野毒株、PCV2野毒株、猪A型轮状病毒(porcine group A rotavirus,RAV)由河南牧业经济学院大成动物研究院分离保存;PRRSV和CSFV活疫苗毒株购自洛阳莱普生信息技术有限公司;PRV、猪细小病毒(porcine parvovirus,PPV)购自中国兽药监察所;含有拟南芥TOC1基因(NM_125531.3)的重组质粒pMD18-T-TOC1由河南牧业经济学院生物技术实验室构建保存;Trizol试剂购自美国Invitrogen Corporation,Taq DNA Ligase购自英国NEB;Pfu DNA Polymerase、RNase Inhibitor和DL-2000购自宝生物工程(大连)有限公司。试验用157份疑似猪传染性胃肠炎和流行性腹泻病毒感染猪的肠内容物和肠黏膜样品由河南牧业经济学院大成动物研究院收集自郑州周边县市养殖场,所有样本均置于-80℃冻存。1.2 双探针设计及引物合成
以GenBank 收录的PEDV CV777株(DQ355221.1)和TGEV HN株(AY587884.1)N基因序列为参考,采用 Blastn 比对分析PEDV和TGEV N基因序列的保守性,分别选取PEDV和TGEV N基因一段长度为40—50bp保守区为杂交探针,将探针序列均分为左右两部分(L Probe和R Probe)形成双探针,分别标记拟南芥TOC1基因即获得标记的报告基因,试验中用到的探针、标记引物及反向PCR扩增引物均利用Primer Premier 5.0软件设计,由上海生工合成,序列见表1。Table 1
表1
表1标记引物和检测引物序列及特性
Table 1The sequences and characteristics of primers for labeling and amplifying by reverse PCR
| 引物Primers | 引物序列 Sequences of primers | 探针靶标 Targets of probes | 探针位置 Gene position of probesb | 产物长度 Length of products | 引物应用 Applications of primers | |
|---|---|---|---|---|---|---|
| P1 | TTTGCACGTGAAGCAGGAGGTGGTACCGAAAAACCCTAGT a | PEDV N 基因PEDV N gene | 509-530 bp | 404bp | 标记报告基因 Labeling reporter gene | |
| P2 | TTCGCGTAGCAGGAGTCGTGGCCCAGTATTATATCGATAT a | 531-552 bp | ||||
| P3 | GGCACTTTACCATCGAATTTCACTTCTTCTACTTTTGTATa | TEGV N基因 TEGV N gene | 417-437 bp | 252bp | ||
| P4 | AGGCGAATTTCAACTTGAAGTACACTCTGAAAGGAGAGTA a | 438-458 bp | ||||
| P5 | GTGTAAAGGAGGAGATGG | TOC1 | 494-511 bp | PEDV | 404bp | 反向PCR扩增 Amplifying by reverse PCR |
| P6 | TCACCGTTCAAATCCATGAT | 474-493 bp | TGEV | 252bp | ||
新窗口打开
1.3 核酸的分离
试验样本基因组DNA按参考文献[19]的方法分离提纯;样本(组织细胞、病料)总RNA则采用Trizol试剂一步法制备:取100mg组织/107细胞,加入1mL Trizol试剂,用力振荡后;加入100 μL氯仿,振荡;12 000 r/min离心10min后取上清;加入等体积异丙醇,置-20℃沉淀2h;12 000 r/min离心5min后弃上清;75%冷乙醇洗涤沉淀1次,再加入30μL RNase-free H2O溶解,-80℃保存备用。1.4 探针标记报告基因
采用常规PCR制备特异性探针标记的报告基因,分别以P1和P2、P3和P4为引物对,以重组质粒pMD18-T-TOC1为模板,扩增拟南芥TOC1基因片段,反应体系:10×Pfu Buffer 10 μL,dNTP(2.5mmol·L-1)8 μL,上下游引物(10μmol·L-1)各3 μL,pMD18-T- TOC1质粒2μL,Pfu DNA Polymerase(5U·μL-1)0.5 μL,加水补足100μL;扩增条件:94℃变性30s,60℃退火30s,72℃延伸30s,35个循环。琼脂糖凝胶电泳检测PCR扩增产物,并进行回收纯化,获得针对PEDV 和TGEV病毒 N基因的、特异性探针耦联的报告基因,经克隆测序验证后-20℃保存备用。1.5 一步环介导间接PCR鉴别试验
采用一步法在PCR反应管中进行单链置换、环化和反向PCR扩增,反应体系:10×Pfu Buffer 3μL,10 ×Taq DNA Ligase Reaction Buffer 3μL,RNase Inhibitor 0.5μL,Pfu DNA Polymerase(5U·μL-1)0.5 μL,Taq DNA Ligase 0.5 μL,dNTPs(各10mmol·L-1)1 μL,RNA溶液 2μL,两种特异性探针标记的报告基因各2μL,反向PCR引物 P5、P6(10μmol·L-1)各1μL,加入RNase-free H2O补足30μL;反应条件:95℃预变性5 min;95℃ 30s,53℃ 3min,10个循环; 95℃ 50s,53℃ 50s,72℃ 50s,25个循环。扩增产物经2%琼脂糖凝胶电泳检测,切胶回收特异性条带,T/A克隆后挑选阳性克隆送生工生物工程(上海)股份有限公司进行测序。1.6 特异性试验
分别以PEDV和TGEV混合物、以及PEDV、TGEV、PCV2、RAV、PRRSV、CSFV、PRV和PPV的核酸样品为模板,采用方法1.5的反应体系及循环条件进行环介导间接PCR扩增,观察交叉反应情况,依此评估该检测方法的特异性。1.7 灵敏度试验
将制备的PEDV和TGEV病毒核酸溶液用分光光度计进行浓度测定后,用RNase-free H2O调整RNA浓度至1 000 pg·μL-1,然后进行5倍倍比稀释,形成1 000、200、40、8、1.6和0.32 pg·μL-1 6个浓度梯度,分别进行PEDV、TGEV和PEDV+TGEV环介导间接PCR,并计算环介导间接PCR扩增能够检测到的核酸最低浓度,评估该检测方法的灵敏度。
1.8 临床样品检测
研究中用到的157份具有腹泻症状的病料,由河南牧业经济学院大成动物研究院采集自郑州市周边地区不同猪场,主要包括粪便和肠道组织,按方法1.3制备病料总RNA。分别采用环介导间接PCR、常规RT-PCR和SybrGreen实时PCR 3种方法进行PEDV和TGEV检测,观察感染情况,比较3种方法的阳性检出率,同时采用Kappa检验方法,比较分析环介导间接PCR和SybrGreen实时PCR检测结果的一致性。统计分析软件为SPSS13.0。2 结果
2.1 探针标记报告基因
以重组质粒pMD18-T- TOC1为模板,分别以引物P1和P2、P3和P4进行常规PCR扩增,以实现将引物携带的特异性L probe和 R probe与报告基因的耦联,其中用于PEDV检测的报告基因长度为404bp,TGEV报告基因252bp。电泳检测PCR产物,分别在250和500bp附近可见的清晰条带(图1),与预期片段大小一致;PCR产物经克隆测序后发现2个片段中间序列为拟南芥TOC1基因片段,而两端则为标记的、不同的特异性探针序列,与设想完全一致。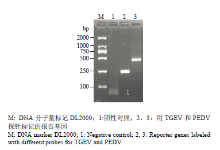 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1报告基因制备
-->Fig. 1Preparation of reporter genes
-->
2.2 一步环介导间接PCR鉴别试验
分别以PEDV、TGEV和PEDV+TGEV 的RNA溶液为模板,采用方法 1.5 进行一步环介导间接PCR扩增,根据探针和引物设计情况,PEDV扩增条带预期大小404bp,TGEV扩增条带预期大小为252bp。将上述PCR扩增产物进行电泳检测,结果如图2所示,PEDV和TGEV各有1条清晰特异性扩增条带,且与预期大小相一致,而PEDV和TGEV核酸混合样品则出现2条特异条带,且与PEDV和TGEV扩增条带大小一致;将上述2条特异性条带进行克隆测序,结果显示,大片段序列中含有一段长度为44bp PEDV N基因序列,小片段含有42bp TGEV N基因序列,且两个片段的两侧均为拟南芥TOC1基因片段,与设想完全一致。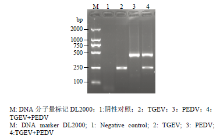 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2环介导间接PCR检测PEDV/TGEV结果
-->Fig. 2The results of detecting PEDV/TGEV by loop-mediated indirect PCR
-->
2.3 特异性试验
以方法1.5循环体系及条件,对PEDV、TGEV和PEDV+TGEV病毒核酸进行一步环介导间接PCR扩增,均可获得特异性目的条带,PEDV 404 bp,TGEV 252 bp;但正常的PCV2、RAV、PRRSV、CSFV、PRV和PPV等病毒核酸样品则未能扩增出任何条带(图3),表明该方法特异性好,与其它病原无交叉反应。2.4 灵敏度试验
敏感度试验结果(图4)表明,PEDV核酸样品的6个浓度梯度中,仅有0.32 pg·μL-1无法扩增任何条带,其余浓度的核酸样品均有特异性扩增,而TGEV核酸样品的6个浓度梯度中有两个无法扩增,且条带亮度随核酸浓度的增加而增加;若将两种病毒核酸混合后,不影响检测的灵敏度。结果表明所建立的PEDV、TGEV环介导间接PCR检测方法可检测的最低极限浓度分别为1.6和8pg·μL-1,该方法检测PEDV比TGEV灵敏度高。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3特异性试验
-->Fig. 3The results of specificity assay
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4灵敏度试验
-->Fig. 4The results of sensitivity assay
-->
2.5 临床样品应用检测
采用环介导间接PCR、常规RT-PCR和SYBR Green 实时RT-PCR 3种检测方法对157份疑似腹泻症状的病料进行了比较检测。结果显示(表2),在157份临床样品中,,环介导间接PCR检出PEDV阳性53份,TGEV阳性42份;常规RT-PCR检出PEDV阳性34份,TGEV阳性21份;SYBRGreen 实时RT-PCR检出PEDV阳性57份和TGEV阳性44份。3种方法的PEDV 检出率分别为33.76%、21.66%和36.31%,TGEV检出率分别为26.75%、13.38%和28.03%。采用kappa检验分析环介导间接PCR和SYBR Green 实时RT-PCR对157份临床样本检测结果的一致性,结果显示(表3),与SYBR Green 实时RT-PCR相比,环介导PCR对PEDV检测的敏感性、特异性分别为91.23%、98.22%,二者的符合度为96.18%(κ=0.91);对TGEV检测的灵敏度、特异性分别为90.91%、95.23%,二者的符合度为96.18%(κ=0.90)。结果表明,在临床样本检测中,环介导间接PCR对PEDV和TGEV检测敏感性与SYBR Green 实时RT-PCR相似,优于常规RT-PCR,而且环介导间接PCR与SYBR Green 实时RT-PCR检测符合度高。Table 2
表2
表2常规PCR、环介导间接PCR和SYBR Green实时RT-PCR 对临床样本的PEDV、TGEV检出率比较
Table 2Comparison of the detection rates of PEDV, TGEV infected preclinical fecal samples by conventional RT-PCR, loop- mediated indirect PCR and SYBR Green real-time RT-PCR assay
| 环介导间接PCR Loop-mediated indirect PCR | 常规RT-PCR Conventional PCR | SYBR Green 实时RT-PCR SYBR Green real-time RT-PCR | ||
|---|---|---|---|---|
| PEDV | 样品总数 Total number of tested samples | 157 | 157 | 157 |
| 阳性样品数 Number of positive samples | 53 | 34 | 57 | |
| 阴性样品数 Number of negative samples | 104 | 123 | 100 | |
| 阳性率 Positive rate (%) | 33.76 | 21.66 | 36.31 | |
| TGEV | 样品总数 Total number of tested samples | 157 | 157 | 157 |
| 阳性样品数 Number of positive samples | 42 | 21 | 44 | |
| 阴性样品数 Number of negative samples | 115 | 139 | 113 | |
| 阳性率 Positive rate (%) | 26.75 | 13.38 | 28.03 |
新窗口打开
Table 3
表3
表3环介导间接PCR和SYBR Green 实时RT-PCR对临床样本检测的敏感性、特异性分析
Table 3Sensitivity and specificity of loop-mediated indirect PCR as compared to SYBR Green real-time RT-PCR based on testing 170 clinical samples.
| SYBR Green 实时RT-PCR SYBR Green real-time RT-PCR | ||||
|---|---|---|---|---|
| 阳性 Positive | 阴性 Negative | 总数 Total | ||
| PEDV 环介导间接PCR Loop-mediated indirect PCR | 阳性 positive | 52 | 1 | 53 |
| 阴性 negative | 5 | 99 | 104 | |
| 总数 Total | 57 | 100 | 157 | |
| 敏感性:91.23,特异性:98.22,准确性:96.18,κ=0.91 Sensitivity: 91.23, Specificity: 98.22, Accuracy: 96.18 | ||||
| TGEV 环介导间接PCR Loop-mediated indirect PCR | 阳性 positive | 40 | 2 | 42 |
| 阴性 negative | 4 | 111 | 115 | |
| 总数 Total | 44 | 113 | 157 | |
| 敏感性:90.91,特异性:95.23,准确性:96.18,κ=0.90 Sensitivity: 90.91, Specificity: 95.23, Accuracy: 96.18 | ||||
新窗口打开
3 讨论
目前,猪流行性腹泻(PED)和传染性胃肠炎(TGE)是规模化猪场对猪群危害最严重的2种病毒性腹泻病,因发病时间短、传播速度快、仔猪发病率和死亡率高等特点而广受关注[28]。PEDV和TGEV同属于α冠状病毒属,临床上由于二者常常混合感染而引起仔猪腹泻,且临床症状、流行病学和病理学特征极为相似,给临床诊断和疾病预防带来一定困难。以PCR为基础的分子诊断技术因具有高效、快速、灵敏、准确等优点而广受重视,是目前病原学鉴别诊断常用方法。鉴于冠状病毒的高变异性,作者选择PEDV和TGEV病毒相对比较保守的核蛋白(N)基因为检测的目的基因,通过分析两种病毒N基因序列特征,分别选取PEDV和TGEV N基因一段高度保守区为检测探针,其中PEDV探针长度为44bp ,TGEV探针长度42bp ,且二者差异性较大。将检测探针序列分为左右两部分形成双探针(L Probe 和R Probe),分别标记于拟南芥TOC1基因而获得标记的报告基因。根据环介导间接PCR技术原理,当且仅当双探针同时与目的基因杂交结合后,才能将报告基因左右两端拉近而发生单链置换和环化反应,由于标记的报告基因长度不同(PEDV和TGEV报告基因的长度分别为404,252bp),形成的环化报告基因大小不同(PEDV 404bp,TGEV 252bp),通过反向PCR扩增环化报告基因而实现对PEDV/TGEV的鉴别诊断。试验结果表明,通过优化报告基因的用量和试验条件,获得了最佳反应条件,成功扩增了404、252bp的报告基因(图2),扩增条带清晰、单一,经测序分析发现,上述扩增片段中分别含有一段长度44bp PEDV N基因序列和42bp TGEV N基因序列,且与NCBI数据库中的PEDV和TGEV N基因的同源性达98.5%以上。试验结果表明,该方法检测特异性强,与CSFV、PRRSV、PRV、PPV和RAV等猪群中常见病原无明显交叉扩增(图3);灵敏度高,对PEDV、TGEV可检测的最低极限浓度分别为1.6 和8pg·μL-1(图4)。研究中,应用环介导间接PCR、常规RT-PCR和SYBR Green 实时RT-PCR 3种方法对157份疑似腹泻病料进行对比检测,评估3种检测方法的效果。结果发现(表2),3种方法对PEDV检出率分别为33.76%、21.66%、36.31%,对TGEV检出率分别为26.75%、13.38%、28.03%,在157份临床样本中,PEDV的阳性率明显高于TGEV,而且PEDV和TGEV混合感染的比例较高,说明PEDV仍然是当前河南省内仔猪腹泻的主要病原,同时存在较高比例的混合感染现象,与文献报道[29,30]相一致,提示在仔猪病毒性腹泻的防控中应结合疫病特点;而在阳性样本检出率上,环介导间接PCR明显优于常规RT-PCR,而接近SYBR Green 实时RT-PCR, 因常规RT-PCR检测敏感性依赖于RNA的完整性和反转录效率,而环介导PCR检测方法则通过双探针与目的基因杂交环化,链置换为报告基因,不需要反转录,探针杂交也仅需要40—50bp 的核酸序列,对RNA完整性要求不高,能有效克服因样品不新鲜导致核酸降解、中间断裂而引起漏检现象。kappa检验结果显示(表3),与SYBR Green 实时RT-PCR相比,环介导间接PCR检测技术对PEDV检测的敏感性、特异性分别为91.23%、98.22%,两种方法检测结果的符合度为96.18%(κ=0.91, 表3);对TGEV检测的灵敏度、特异性分别为90.91%、95.23%,两种方法检测结果的符合度为96.18%(κ=0.90,表3),kappa检验结果表明本研究所建立的环介导间接PCR与经典的SYBR Green实时RT-PCR与检测结果高度吻合(κ≥ 0.90),可以替代经典的SYBR Green实时RT-PCR用于临床上鉴别诊断PEDV和 TGEV引起的猪病毒腹泻。
4 结论
综合方法的特异性、敏感性及临床检测结果,表明本研究所建立的环介导间接PCR检测方法不仅适用于临床上鉴别诊断PEDV和 TGEV引起的猪病毒性腹泻,而且可以用于猪病毒性腹泻的分子流行病学调查。The authors have declared that no competing interests exist.
