0 引言
【研究意义】蛋白质很多功能性质,如溶解性、乳化性和凝胶特性等都取决于蛋白质和水的相互作用[1]。水分子通过与蛋白中的带电基团(离子-偶极相互作用)、酰胺基团(偶极-偶极相互作用)、羟基(偶极-偶极相互作用)等进行相互作用。蛋白质氧化是食品领域研究的热点课题,蛋白质在自由基或其他氧化物的作用下,氨基酸残基发生氧化效应,改变了其质子化程度,使得蛋白带电基团发生改变,进而改变蛋白表面的净电荷,影响蛋白持水力。另一方面,氧化导致蛋白主链及氨基酸残基侧链发生改变,如肽链的断裂、氨基酸残基侧链的氧化修饰、蛋白交联聚合等[2-3],使其一级、二级及高级结构发生变化,导致溶液中蛋白表面疏水残基和亲水残基的改变,从而影响蛋白与水的互作关系。因此,开展蛋白氧化基础理论研究,探索氧化效应对牛血清白蛋白水合特性的影响具有重要意义。【前人研究进展】对蛋白氧化的研究大多以肉蛋白、乳蛋白等为研究对象,且取得一定进展。PARK等[4-5]研究了3种氧化模拟体系中猪肉肌原纤维蛋白的变化,发现肌原纤维蛋白经不同程度氧化后,其羰基含量增加,蛋白的热稳定性下降以及蛋白交联聚合等。李银等[6]研究发现肌原纤维蛋白在羟基自由基氧化体系中,氨基酸含量下降,蛋白结构发生变化,蛋白持水力降低。HARRIS等[7]研究发现蛋白氧化能显著改变蛋白质的空间效应,从而影响肌肉的持水性。血清蛋白是动物体血浆中含量较为丰富的一种蛋白质,其分子量小、结构稳定、溶解度大,连接氨基残基的共价键有肽键及由两个半胱氨酸残基的侧链形成的二硫键,它可以使两条单独的肽链通过共价键交联[8-9]。大量文献表明,牛血清白蛋白(bovine serum albumin,BSA)是研究蛋白理化性质的理想模型[10-11]。目前关于BSA氧化的研究主要集中在生化研究等方面,程伶俐等[12]在研究牛血清白蛋白的光损伤和光氧化机理时发现SO4-·自由基是通过与BSA中的酪氨酸(Tyr)和色氨酸(Trp)发生电子转移反应来氧化BSA的。IONITA等[13]研究发现加入环糊精能够降低肼基自由基对BSA的氧化速率。ALEGRIA等[14]在研究环木质素醌对BSA的巯基氧化和其与BSA的共价结合时发现,在有MgCl2存在的情况下可以使环木质素醌介导的BSA的巯基氧化和共价结合作用增强。而以BSA为研究对象,研究其在羟基自由基氧化体系中的氧化机制却未见报道。【本研究切入点】目前,国内外关于蛋白氧化的研究大多集中在蛋白表观指标变化方面以及氧化对蛋白凝胶形成的影响。蛋白的氧化反应是一个电子转移过程,改变了蛋白的表面电荷状态,进而影响了蛋白中的带电基团与水分子之间的互作关系,常见食品体系复杂多样,为探讨和揭示蛋白氧化过程中电子转移机制而避免离子强度、pH等其他因素的干扰,本试验首先选择纯蛋白体系BSA为研究对象。【拟解决的关键问题】通过分析BSA在铁-抗坏血酸-过氧化氢(FeCl3-Vc-H2O2)羟基自由基氧化体系中,不同氧化程度条件下蛋白氨基酸残基、羰基含量、巯基含量、表面疏水性、Zeta电位值、蛋白二级结构及分子间作用力等指标变化,研究蛋白氧化过程中结构及水合特性的变化情况,探讨蛋白结构与蛋白水合特性之间的内在关系,为进一步揭示氧化对蛋白持水力的影响机制提供理论依据。1 材料与方法
1.1 试验时间及地点
试验于2015年6—12月在中国农业科学院农产品加工研究所肉品实验室和农业部农产品加工综合性重点实验室进行。1.2 主要试剂及仪器
1.2.1主要试剂 牛血清白蛋白(bovine serum albumin,BSA)、哌嗪-N,N'-双(2-乙磺酸)(piperazine- 1,4-bisethanesulfonic acid,PIPES)(美国Sigma公司),5,5'-二硫代双(2-硝基苯甲酸)(5,5'-Dithio bis-(2- nitrobenzoic acid),DTNB)、2,4-二硝基苯肼、三氯乙酸(trichloroacetic acid,TCA)、盐酸胍、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、三羟甲基氨基甲烷(Tris (hydroxymethyl) aminomethane,Tris)、磷酸二氢钠、磷酸氢二钠、氯化钠、尿素、溴酚蓝(Bromophenol blue,BPB)(分析纯,国药集团化学试剂有限公司)。1.2.2 主要仪器设备 电子天平(赛多利斯科学仪器(北京)有限公司),TXF200-S12 恒温循环水浴锅(英国 Grant公司),T6紫外可见分光光度计(北京普析通用仪器有限责任公司),L-8900 氨基酸自动分析仪(日本日立公司),Zeta电位分析仪(英国Malvern公司),X-12R高速冷冻离心机(美国Beckman公司),傅里叶变换红外光谱仪(德国Buruker公司)。
1.3 试验方法
1.3.1 FeCl3/Vc/H2O2(铁/抗坏血酸/过氧化氢)氧化体系构建 参考PARK等[15]方法构建以下氧化体系:反应历程为Vc+Fe3+→Fe2+,Fe2++H2O2→·OH,FeCl3浓度为0.01 mmol·L-1,Vc浓度为0.1 mmol·L-1,H2O2浓度分别为0(对照组)、0.5、1、5、10和20 mmol·L-1。牛血清白蛋白分散于上述氧化体系中(终质量浓度为40 mg·mL-1),在4℃条件下密封氧化12 h后用EDTA(终浓度为1 mmol·L-1)终止反应。以上氧化反应均在15 mmol·L-1 PIPES缓冲溶液(pH 6.0)中进行。1.3.2 氨基酸分析 取1 mL氧化的BSA溶液,加入10 mL 6 mol·L-1的盐酸溶液,充氮1 min排出管内空气并封口,水解管置于110℃的恒温箱内水解24 h后冷却至室温,过滤,并将滤液定容到50 mL容量瓶中。取1 mL液体氮吹,直到吹干后再加入5 mL 0.02 mol·L-1的盐酸复溶。混匀后过0.2 μm膜,用氨基酸自动分析仪测定氨基酸[6]。
1.3.3 羰基含量的测定 参考LEVINE等[16]方法测定羰基值。将氧化后的BSA浓度调整为2 mg·mL-1。取0.1 mL稀释后的蛋白溶液,然后加入0.5 mL含2,4-二硝基苯肼的2 mol·L-1 HCl溶液,空白样品中加入0.5 mL不含2,4-二硝基苯肼的2 mol·L-1 HCl溶液,在25℃下反应40 min。然后再加入0.5 mL 20%的三氯乙酸(Trichloroacetic acid,TCA),震荡后离心(11 000×g,5 min)弃去上清,用体积比为1﹕1的乙醇-乙酸乙酯溶液洗涤沉淀3次,挥发完溶剂后将蛋白质悬浮于1 mL 6 mol·L-1 盐酸胍溶液中,在37℃条件下水浴保温30 min。以空白为对照并于370 nm下测吸光值,蛋白质羰基衍生物的含量(nmol·mg -1蛋白)使用摩尔吸光系数22 000 M-1cm-1计算。
1.3.4 巯基含量的测定 总巯基含量的测定参考ELLMAN等[17]方法。将氧化后的BSA浓度调整为2 mg·mL-1。取1 mL稀释后的蛋白溶液,然后加入1 mL 50 mmol·L-1 Tris-HCl 缓冲液(pH 8.3)(含有6 mol·L-1盐酸胍、1 mmol·L-1 EDTA)与10 μL 100 mmol·L-1 Tris-HCl 溶液(pH 7.6)(含有10 mmol·L-1 DTNB)混匀,在25℃下静置25 min,并于412 nm下测定其吸光值,巯基含量(nmol·mg-1蛋白)使用摩尔吸光系数13 600 M-1cm-1计算。
1.3.5 傅里叶红外分析 采用傅里叶变换红外光谱(Fourier transform infrared,FTIR)分析BSA氧化后二级结构的变化。参照GANGIDI等[18]方法,并略作修改。采用多次衰减全反射技术(Attenuated total re?ection,ATR)进行测量,取适量氧化后的BSA溶液放于ATR附件上扫描,红外谱图记录采用OMNIC软件,测定范围4 000—400 cm-1,扫描次数100次,扫描速率0.63 cm·s-1,分辨率4 cm-1。红外光谱的数据处理采用PeakFit 4.12软件(SPSS Inc.,Chicago,IL,USA)。
1.3.6 表面疏水性 用20 mmol·L-1磷酸盐缓冲液将氧化的BSA浓度调整为2 mg·mL -1,取2 mL蛋白溶液并加入40 μL 1 mg·mL -1的溴酚蓝溶液,空白为2 mL磷酸盐缓冲液加入40 μL 1 mg·mL -1的溴酚蓝溶液,涡旋振荡混匀10 min后离心(4℃,4 000×g,15 min),取上清液于595 nm测定吸光值[19]。用结合态的疏水溴酚蓝结合量(总溴酚蓝与游离溴酚蓝的差值)作为表面疏水性指数。
$$S=40\times \frac{OD_{control}-OD_{sample}}{OD_{control}}$$
式中,S为表面疏水性(μg);ODcontrol为空白的吸光度值;ODsample为样品的吸光度值。
1.3.7 Zeta电位的测定 参考刘泽龙[20]的方法测定Zeta电位值,并略作修改。用15 mmol·L-1 PIPES缓冲溶液(pH 6.0)将氧化的BSA浓度调整为1 mg·mL-1。使用马尔文NanoZS型粒度仪中的SOP模式测定Zeta电位(mV)。
1.3.8 离子键、氢键的测定 参照GÓMEZ-GUILLÉN等[21]方法测定离子键和氢键含量,并略作修改。取2 mL经氧化的BSA溶液分别与10 mL 0.05 mol·L-1 NaCl(S1)、0.6 mol·L-1 NaCl(S2)、0.6 mol·L-1 NaCl + 1.5 mol·L-1尿素(S3)混合均匀,4℃静置1 h后离心(10 000×g,15 min,4℃)。按照双缩脲测定蛋白含量的方法测定各上清液的吸光值。离子键含量用S2溶液和S1溶液的吸光值之差来表示,氢键含量用 S3溶液和S2溶液的吸光值之差来表示。
1.4 数据分析
采用SAS9.2软件进行方差分析,不同处理间差异采用Duncan多重比较,显著水平为P<0.05,上述试验如未特殊说明均最少为6次平行并进行了3次重复,结果表示为“平均值±标准差”。2 结果
2.1 H2O2浓度对BSA氨基酸残基含量的影响
H2O2浓度对BSA氨基酸含量的影响如表1所示。随着H2O2浓度的提高,所有氨基酸残基含量基本呈下降趋势,但不同氨基酸对羟基自由基的敏感性不同。在H2O2浓度为1 mmol·L-1时,苏氨酸(Thr)和赖氨酸(Lys)含量表现出显著下降(P<0.05),较对照组分别下降了4.30%、4.22%,表明这两类氨基酸对羟基自由基体系下的氧化效应最为敏感。随着H2O2浓度的升高,各类氨基酸含量下降程度不同,当H2O2浓度升高到20 mmol·L-1时,蛋氨酸(Met)、酪氨酸(Tyr)和组氨酸(His)下降程度最大,分别为35.32%、19.19%和11.15%;其次为异亮氨酸(Ile),甘氨酸(Gly)和半胱氨酸(Cys),分别下降了10.62%、10.60%和10.35%。Table 1
表1
表1H2O2浓度对氨基酸含量的影响
Table 1Effect of H2O2 concentration on amino acids content
| 氨基酸 Amino acid (mg·g-1) | H2O2浓度 Concentration of H2O2 (mmol·L-1) | |||||
|---|---|---|---|---|---|---|
| 0 | 0.5 | 1 | 5 | 10 | 20 | |
| 天门冬氨酸 Asp | 95.09±1.93a | 94.43±1. 90a | 92.35±2.24a | 92.20±1.01a | 91.78±1.90a | 91.89±1.55a |
| 苏氨酸 Thr | 53.01±0.87a | 51.63±1.50ab | 50.73±1.11b | 50.64±0.81b | 50.29±0.46b | 49.77±0.96b |
| 丝氨酸 Ser | 38.60±0.57a | 37.71±1.49ab | 37.01±1.56ab | 36.47±0.98ab | 36.06±0.84b | 35.57±1.14b |
| 谷氨酸 Glu | 177.84±1.81a | 175.43±2.64a | 176.13±2.00a | 174.14±0.46ab | 171.36±2.93b | 170.33±2.32b |
| 甘氨酸 Gly | 18.02±0.48a | 17.61±1.15a | 17.32±0.48ab | 17.49±0.53ab | 16.96±0.07ab | 16.11±1.01b |
| 丙氨酸 Ala | 53.40±0.51a | 51.85±0.65ab | 51.29±1.55ab | 50.30±2.13b | 49.88±1.45b | 48.75±2.40b |
| 半胱氨酸 Cys | 48.29±0.92a | 48.22±0.86a | 47.27±1.46ab | 45.52±0.56bc | 44.40±1.44c | 43.29±2.02c |
| 缬氨酸 Val | 57.24±0.42a | 55.79±0.88ab | 55.32±1.07ab | 54.03±1.46b | 53.95±1.47b | 53.64±2.11b |
| 蛋氨酸 Met | 10.22±0.28a | 9.48±1.48ab | 8.55±1.23ab | 8.16±0.75bc | 7.64±1.01bc | 6.61±0.70c |
| 异亮氨酸 Ile | 23.26±0.45a | 22.98±0.22a | 22.01±0.59ab | 21.72±0.31ab | 21.97±0.10ab | 20.79±2.00b |
| 亮氨酸 Leu | 101.04±2.77a | 100.96±1.50a | 99.56±0.89a | 98.07±1.93a | 98.03±0.75a | 97.34±2.61a |
| 酪氨酸 Tyr | 44.03±1.14a | 42.79±1.00a | 41.74±2.62ab | 38.72±2.56bc | 36.66±1.98c | 35.58±1.36c |
| 苯丙氨酸 Phe | 60.72±1.69a | 59.79±1.97a | 58.79±1.53ab | 57.63±2.24ab | 56.27±1.43b | 55.92±1.14b |
| 赖氨酸 Lys | 117.8±0.86a | 117.08±2.00a | 112.83±2.40b | 111.822±1.01b | 111.34±0.60b | 109.58±2.37b |
| 组氨酸 His | 32.30±0.61a | 31.91±0.38a | 31.77±1.93a | 30.77±1.80ab | 30.30±1.34ab | 28.70±1.76b |
| 精氨酸 Arg | 52.55±0.93a | 50.77±0.91ab | 49.91±1.49ab | 49.15±1.15b | 49.02±2.23b | 48.01±2.54b |
| 脯氨酸 Pro | 202.48±2.18a | 200.32±2.28ab | 198.92±3.00ab | 197.38±3.05ab | 198.76±2.64ab | 196.17±3.34b |
| 总氨基酸 Total | 1185.86±9.33a | 1168.73±14.61ab | 1151.49±14.83ab | 1134.19±18.44ab | 1124.67±21.79b | 1108.14±10.73b |
新窗口打开
2.2 H2O2浓度对BSA羰基、巯基含量的影响
由图1-A可知,对照组中BSA的羰基含量为0.46 nmol·mg-1蛋白,当H2O2浓度为1 mmol·L-1时,羰基含量开始显著增加(P<0.05),当H2O2浓度升高到20 mmol·L-1,羰基含量为0.72 nmol·mg -1蛋白,较对照组增加了57.52%,表明蛋白氧化程度显著加剧。由图1-B可知,对照组中BSA的巯基含量为76.47 nmol·mg -1蛋白,随着H2O2浓度的增加,巯基含量呈显著下降趋势,在低浓度的H2O2条件下,巯基含量下降程度较低。当H2O2浓度为5 mmol·L-1时,巯基含量为32.72 nmol·mg -1蛋白,较对照组降低57.21%;当H2O2浓度升高到20 mmol·L-1,巯基含量为19.85 nmol·mg -1,较对照组降低74.04%。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1H2O2浓度对羰基、巯基含量的影响
-->Fig. 1Effect of H2O2 concentration on carbonyl content and sulfydryl content
-->
2.3 H2O2浓度对BSA二级结构的影响
采用FTIR分析蛋白氧化过程中二级结构的变化规律,BSA在红外区有明显的特征光谱吸收带,其中酰胺I带(1 600—1 700 cm-1)主要是由C=O的伸缩振动引起,此外C-N的伸缩振动也起部分作用,酰胺I带能非常敏感地反映出蛋白质中的二级结构变化[22-23]。图2为BSA的酰胺I带FTIR光谱图,与对照组相比,经不同浓度H2O2氧化后,该谱带半峰宽、强度及峰位有一定程度的变化,表明BSA的二级结构发生了改变。采用傅里叶自退卷积、二阶导数及曲线拟合等技术对BSA的酰胺I带进行处理,蛋白质二级结构的谱峰指认如下:1 646—1 661 cm-1为α-螺旋结构,1 615—1 637 cm-1和1 682—1 698 cm-1为β-折叠结构,1 661—1 681 cm-1为β-转角结构,1 637—1 645 cm-1为无规卷曲结构[24]。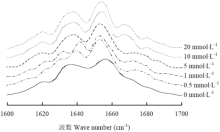 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2H2O2浓度对BSA红外光谱去卷积后酰胺I带的影响
-->Fig. 2Effect of H2O2 concentration on the amide I of BSA IR spectrum deconvolution
-->
H2O2浓度对BSA二级结构相对含量的影响如表2所示。随着H2O2处理浓度的升高,α-螺旋含量下降,当H2O2处理浓度升高到10 mmol·L-1和20 mmol·L-1时,α-螺旋含量分别下降了11.16 %和21.63%;H2O2处理浓度在0—1 mmol·L-1时,β-折叠含量与对照组相比无显著差异(P>0.05),在5—20 mmol·L-1时,β-折叠含量出现了显著增加(P<0.05),增幅为15.46 %—21.97 %;β-转角含量随着H2O2浓度的升高而显著增加(P<0.05),并存在·OH浓度效应;无规卷曲含量在H2O2浓度为0—1 mmol·L-1时基本保持不变,当H2O2浓度升高到5—20 mmol·L-1时含量显著降低(P<0.05)。
Table 2
表2
表2H2O2浓度对二级结构含量的影响
Table 2Effect of H2O2 concentration on the secondary structures
| H2O2浓度 Concentration of H2O2 (mmol·L-1) | ||||||
|---|---|---|---|---|---|---|
| 0 | 0.5 | 1 | 5 | 10 | 20 | |
| α-螺旋 α-helix | 40.42±0.163a | 40.07±1.096a | 39.63±1.523a | 39.07±0.809a | 35.91±2.139b | 31.68±1.179c |
| β-折叠 β-sheet | 21.48±2.282b | 21.26±1.461b | 21.78±1.260b | 24.80±0.592a | 26.35±0.614a | 26.20±0.729a |
| β-转角 β-turn | 12.53±0.160d | 13.22±0.356d | 14.15±0.806d | 17.23±0.122c | 19.74±2.005b | 23.91±1.069a |
| 无规卷曲 Random coil | 25.57±1.959a | 25.44±0.696a | 24.44±1.266a | 18.90±0.127b | 18.00±1.850b | 18.21±0.609b |
新窗口打开
2.4 H2O2浓度对BSA表面疏水性影响
羟基自由基氧化体系中H2O2浓度对BSA表面疏水性的影响如图3所示,对照组BSA吸附溴酚蓝(BPB)的量为13.39 μg,0.5 mmol·L-1 H2O2处理组BSA的表面疏水性与对照组无显著差异(P>0.05);随着H2O2处理浓度的升高,表面疏水性较对照组显著增加(P<0.05),当H2O2浓度为1 、5、10和20 mmol·L-1时,BSA吸附溴酚蓝的量分别为14.30 μg、15.73 μg、16.07 μg和16.46 μg。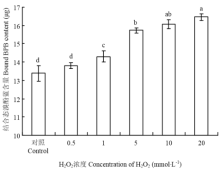 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3H2O2浓度对表面疏水性的影响
-->Fig. 3Effect of H2O2 concentration on surface hydrophobicity
-->
2.5 H2O2浓度对BSA的Zeta电位影响
图4为羟基自由基氧化体系条件下BSA中Zeta电位随H2O2浓度的变化情况。随着H2O2浓度的升高,Zeta电位的绝对值显著降低(P<0.05);对照组BSA的Zeta电位值为-8.61 mV,在0.5—5 mmol·L-1 H2O2氧化条件下,Zeta电位的绝对值降低缓慢;当H2O2处理浓度升高到10 mmol·L-1和20 mmol·L-1时,BSA的Zeta电位值分别为-7.34、-7.04 mV,电位的绝对值较对照组分别降低了14.75%、18.23 %。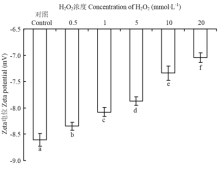 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4H2O2浓度对Zeta电位的影响
-->Fig. 4Effect of H2O2 concentration on Zeta potential
-->
2.6 H2O2浓度对BSA分子间作用力的影响
不同H2O2浓度氧化条件下BSA中离子键、氢键变化情况如图5-A、5-B所示。由图5-A可知,对照组中BSA的离子键含量为0.25,0.5 mmol·L-1和1 mmol·L-1 H2O2处理组离子键含量与对照组相比无显著差异(P>0.05);5、10和20 mmol·L-1 H2O2处理组离子键含量分别为0.16、0.12、0.10,均较对照组显著降低(P<0.05)。由图5-B可知对照组的氢键含量为0.37,当H2O2浓度为0.5 mmol·L-1时,BSA中的氢键含量与对照组相比无显著差异(P>0.05);当H2O2浓度为1、5、10和20 mmol·L-1时,各处理组氢键含量分别为0.30、0.27、0.21、0.19,较对照组显著降低(P<0.05)。表明受氧化影响,BSA溶液中离子键和氢键逐渐断裂。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5H2O2浓度对离子键(A)、氢键(B)的影响
-->Fig. 5Effect of H2O2 concentration on ionic bond and hydrogen bond
-->
3 讨论
自由基介导的蛋白质氧化致使多肽链氧化断裂和蛋白质侧链氨基酸发生氧化修饰。在活性氧(ROS)的作用下,会引起蛋白质某些特定的氨基酸残基发生反应,如羰基化合物的形成,巯基基团的损失,各类交联物的形成等[25],从而导致蛋白质的结构发生变化。然而蛋白氧化是与脂肪氧化相类似的自由基链式反应,其实质是一个电子转移过程。蛋白质氧化能够引起电子转移,改变蛋白的表面特性,最终改变蛋白带电基团与水分子间的相互作用[20]。蛋白氧化导致的氧化损伤,首先涉及的是氨基酸残基的破坏或修饰作用。理论上,所有的氨基酸侧链都有可能被自由基氧化,但是许多****指出,由于半胱氨酸(Cys)和蛋氨酸(Met)含有易被ROS攻击的活性基团,因此其为氧化反应中的敏感氨基酸[26]。其中蛋氨酸(Met)是必需氨基酸中唯一含硫的氨基酸,极易被氧化形成蛋氨酸亚砜衍生物;酪氨酸(Tyr)含有芳香环,·OH可氧化其生成二酪氨酸,半胱氨酸(Cys)含有巯基,极易被氧化形成二硫键[6]。然而,不同的氧化体系和蛋白质类型也会导致敏感氨基酸类型和氧化程度的不同[5]。AMICI等[27]指出,在金属离子催化的氧化系统中,组氨酸(His)、脯氨酸(Pro)、精氨酸(Arg)、赖氨酸(Lys)、苏氨酸(Thr)、酪氨酸(Tyr)、色氨酸(Trp)、半胱氨酸(Cys)都是容易被氧化的氨基酸。ELIAS等[28]认为,β-乳球蛋白中的半胱氨酸(Cys)比色氨酸(Trp)更易受氧化损伤,而蛋氨酸(Met)却具有一定的抗氧化特性。BSA在266 nm激光作用下,BSA中的色氨酸(Trp)残基首先以脱电子和发生分子内电子能级跃迁的形式受到破坏,进而通过分子内电子转移的形式氧化酪氨酸(Tyr)残基,最终其光损伤以这两种氨基酸自由基的形式表达出来[12]。本研究发现,随着氧化体系中H2O2浓度的升高,BSA中氨基酸残基遭受自由基攻击的程度加剧。其中,在低浓度 H2O2处理条件下,苏氨酸(Thr)和赖氨酸(Lys)为氧化敏感氨基酸;而在高浓度H2O2条件下, 蛋氨酸(Met)、酪氨酸(Tyr)、和组氨酸(His)的含量下降程度最大,然后依次为异亮氨酸(Ile)、甘氨酸(Gly)和组氨酸(Cys)。而李银等[6]指出半胱氨酸(Cys)、蛋氨酸(Met)及酪氨酸(Tyr)是肌原纤维蛋白中在研究羟基自由基体系条件下的氧化敏感氨基酸。同样的,PARK等[29]在研究肉蛋白中氨基酸的氧化情况时也得出了类似结论。这证实了不同的蛋白类型和氧化体系导致氨基酸敏感程度的差异较大,推测可能是由于不同蛋白质中氨基酸残基的暴露程度不同[28]或蛋白结构的差异导致了其抗氧化能力的不同。羰基的形成(醛基和酮基)以及巯基的减少被广泛用来评价蛋白的氧化程度[30]。带有NH-或NH2-的氨基酸残基侧链与肽链骨架,易受自由基氧化攻击,断裂生成羰基衍生物,蛋白质中羰基含量越高表明蛋白的氧化程度越高[31]。巯基和二硫键是维系蛋白分子构象的重要化学键,对于稳定BSA完整的空间结构具有重要作用,BSA分子由581个氨基酸残基组成,其中含有35个半胱氨酸,在肽链的第34位有一自由巯基[9]。巯基是蛋白质中最具反应活性的基团,在氧化过程中可发生可逆或不可逆反应,生成二硫键、次磺酸、亚磺酸和磺酸[32]。在MgCl2和邻醌同时存在的情况下,BSA巯基的被氧化程度变得更大[14]。本研究发现BSA在羟基自由基氧化体系中,随着H2O2浓度的升高,羰基含量显著增加(P<0.05),巯基含量显著降低(P<0.05)。崔旭海[33]、孙妍[34]等在研究自由基氧化体系下乳清蛋白和β-乳球蛋白的理化变化时发现,目标蛋白的巯基含量下降,羰基含量呈增加的趋势。姜晴晴等[35]在研究羟基自由基氧化体系对带鱼蛋白理化性质的影响时指出,随着氧化时间的延长,蛋白羰基含量显著增加(P<0.05),而巯基含量表现为先增加后减少,推测可能是在短时间的氧化条件下肌原纤维蛋白的结构发生变化,导致更多的巯基基团暴露,而随着氧化时间的延长巯基被氧化,含量随之降低。
蛋白质氨基酸残基的疏水性是评价蛋白质水合特性的一个重要指标,蛋白质表面疏水性反映了与外界极性水环境相连的蛋白质表面疏水性基团的数量,亦可用来衡量蛋白质的变性程度,蛋白表面疏水性越高,其结合水分的能力就越弱,变性程度越大[36]。氧化会导致蛋白的构象发生变化,随着氧化程度的增加其结构逐渐展开,包裹在分子内部的一些疏水性的芳香族和脂肪族氨基酸侧链基团逐渐暴露,导致溶液中极性与非极性基团数量的改变,蛋白表面疏水性增加[23]。本研究同时发现,α-螺旋结构含量下降,β-折叠和β-转角结构含量增加,证明氧化确实导致了BSA二级结构的改变。李艳青[37]在研究鲤鱼肌原纤维蛋白经自由基氧化后表面疏水性的变化情况时发现,整个氧化期间蛋白表面疏水性随着 H2O2浓度的升高、氧化时间的延长而不断增加(P<0.05);相同 H2O2浓度,蛋白表面疏水性随着氧化时间的延长而增加。李学鹏等[38]在研究羟基自由基氧化对草鱼肌原纤维蛋白的表面疏水性影响时发现,草鱼肌原纤维蛋白表面疏水性随着H2O2浓度的升高而逐渐增大。本研究发现随着氧化程度的加剧,蛋白表面疏水性显著增加, 这与SUN等[39]研究蛋白氧化导致蛋白表面疏水性增加结果一致。此外,表面疏水性的氧化依赖性增加与蛋氨酸亚砜和二酪氨酸的含量增加也是相关的[40]。
蛋白粒子表面存在的净电荷影响其界面周围的离子分布形成双电层[41]。Zeta电位是评价带电微粒表面电荷的特性表征参数,可反映出体系中带电粒子表面电荷的状态,粒子表面电荷基团的微小变化将引起 Zeta电位的改变[42]。Zeta电位同时也是表征溶液稳定性的重要指标,Zeta电位绝对值越大,体系越稳定;反之稳定性下降,溶液会出现凝结和聚集现象[43]。本研究结果表明随着氧化程度的加剧,BSA溶液的Zeta电位绝对值表现出显著降低,表明随着氧化程度的加深,BSA溶液氧化体系趋向于不稳定。蛋白质表面氨基酸所带电荷的多少和电荷的正负性影响着蛋白质表面电位,从而影响了蛋白质溶液的Zeta电位值。一般说来,蛋白质表面带正电荷的氨基酸多于带负电荷氨基酸,其蛋白溶液Zeta电位为正值;反之,蛋白质表面带负电荷的氨基酸多于带正电荷氨基酸,其蛋白溶液Zeta电位为负值[44]。叶林[45]在研究蛋白质氧化对花生蛋白乳液电位的影响时发现新鲜乳液的电位绝对值随着氧化程度的增加主要呈减小趋势,吴伟等[46]在研究过氧自由基氧化对大米蛋白Zeta电位的影响时发现,随着过氧自由基浓度的增加,大米蛋白Zeta电位绝对值显著下降(P<0.05)。本研究发现BSA经氧化后Zeta电位的绝对值表现出显著降低(P<0.05),这与叶林[45]和吴伟[46]等的研究结论是一致的,推测可能是氨基酸含量发生改变以及氨基酸残基侧链发生的羰基化反应,改变了蛋白表面的质子化程度,其表面净电荷随着氧化程度的加剧而减少,蛋白的极性降低,蛋白的持水能力降低。此外,蛋白氧化后表面净电荷的改变使得蛋白等电点发生偏移,亦会影响蛋白的持水能力[45]。α-螺旋、β-折叠、β-转角和无规卷曲是蛋白质中主要的二级结构[47]。氢键、范德华力以及疏水作用和离子键等对维持蛋白结构稳定以及蛋白与水的互作关系起到非常重要的作用[48],而静电作用形成的氢键在蛋白质的二级结构中起着稳定构象的重要作用。本研究结果表明氧化使BSA多肽链中的α-螺旋结构不断伸展而变成线性结构,β-折叠、β-转角含量显著增加(P<0.05)。推测可能是由于自由基的攻击使分子内部氢键的排列取向发生改变,维持蛋白α-螺旋结构的氢键断裂,各种分子内和分子间相互作用力的平衡被打破,蛋白质各部分的空间排列发生改变。这与本试验观察到的氢键含量随氧化程度增强而降低的结果相一致。
4 结论
氨基酸总含量随H2O2浓度增加呈下降趋势,其中苏氨酸(Thr)、赖氨酸(Lys)为低浓度H2O2条件下牛血清白蛋白(BSA)中的敏感氨基酸,蛋氨酸(Met)、酪氨酸(Tyr)和组氨酸(His)为高浓度H2O2条件下BSA中的敏感氨基酸。随着H2O2处理浓度的升高,蛋白羰基含量显著升高、巯基含量显著降低;BSA经氧化处理后,蛋白二级结构发生变化,α-螺旋、无规卷曲含量降低,多肽链中α-螺旋结构伸展变成线性结构,β-折叠、β-转角含量增加,同时蛋白表面疏水性增加,蛋白持水力降低。氧化作用改变了蛋白的表面电荷状态,Zeta电位绝对值显著下降,蛋白表面的电荷数降低,离子键和氢键作用力显著减弱,降低了蛋白-水分子相互作用力。The authors have declared that no competing interests exist.
