0 引言
【研究意义】植物的生长发育受到多种胁迫的影响,随着温室效应的加剧,全球气候逐渐变暖;高温已经成为威胁植物生长发育的主要因素之一,严重影响农作物的产量。因此,研究高温响应基因,探讨植物高温信号传导途径,对提高植物抗逆性、增加农作物的产量具有重要的意义。【前人研究进展】转录因子(transcription factor,TF)也称反式作用因子,是真核生物中能与顺式作用元件特异结合的DNA结合蛋白。转录因子最先是在玉米中发现的[1],之后相继得到多种转录因子,能够调控干旱、高盐、低温等非生物胁迫相关基因的表达[2]。锌指蛋白(Zinc finger protein,ZFP)转录因子是植物中最大的转录因子家族之一[3],是由锌原子作为核心、半胱氨酸或组氨酸环绕锌原子形成稳定的三维结构[4]。C2H2类锌指蛋白包含2个半胱氨酸和2个组氨酸,典型的结构为Cys- X2,4-Cys-X12-His-X3,4,5-His[5]。Di19(drought- induced)蛋白属于C2H2类锌指蛋白,包含C2H2类锌指结构域[6]、“DPLLSF”位点和“FVQDLVL”位点,这些结构域位点在单子叶和双子叶植物中都是十分保守的。在植物生长发育以及对非生物胁迫的响应中,Di19蛋白起到关键的作用[7-9]。Di19类蛋白首先是在拟南芥中发现的,并鉴定出了7个同源基因,这些Di19类基因在拟南芥组织中广泛表达,并且受胁迫诱导;其中Di19-1在干旱胁迫处理后表达量上升,Di19-2和Di19-4受盐胁迫迅速表达,Di19-3在ABA存在时也能调控植物对干旱和盐胁迫的响应[10]。AtDi19-7与光信号的调控有关,但它对非生物胁迫无响应[11]。水稻中有5个Di19类基因,被OsCDPK14磷酸化后的OsDi19-4通过调控ABA相关基因的表达来正向调控ABA胁迫[12]。另外,Di19锌指蛋白还能结合DNA元件[13],参与蛋白互作[14]。据报道,AtDi19-7能够与AtLKP2相互作用,AtLKP2是一种参与泛素介导的蛋白质降解的蛋白质[14-15];拟南芥7个Di19基因中5个己经证明能与AtCPK(一种结合Ca2+的蛋白激酶)相互作用并被后者磷酸化[6]。【本研究切入点】在之前的研究中,笔者已鉴定出7个大豆Di19基因[16],不同的大豆Di19基因能够对各种非生物胁迫以及植物激素产生不同的响应,其中GmDi19-5在盐、干旱、ABA和氧化胁迫的诱导下表达量上升比较明显,但尚未见GmDi19-5对高温胁迫响应的研究。【拟解决的关键问题】本研究通过实时荧光定量PCR鉴定GmDi19-5对高温胁迫的响应;另外,以pGBKT7- GmDi19-5为诱饵筛选大豆cDNA文库,得到一些可能与其互作的候选蛋白基因,并验证GmDi19-5与候选蛋白的互作关系。1 材料与方法
1.1 植物材料及胁迫处理
大豆(Glycine max)材料为铁丰8号,由中国农业科学院作物科学研究所邱丽娟老师赠送。将大豆种子播种于营养土中(蛭石﹕泥炭土=1﹕1),在适宜条件下(12 h光照/12 h黑暗、温度25℃、湿度70%)生长两周,然后对其进行高温和低温胁迫处理:将大豆幼苗分别置于42℃和4℃培养箱中[17-18],分别处理0、1、4、8、12和24 h后取样,迅速置于液氮低温处理后,-80℃保存备用。1.2 诱饵载体的构建及自激活验证
根据GmDi19-5的序列以及表达载体pGBKT7的限制性酶切位点(SmaⅠ和PstⅠ)设计引物,利用PCR技术扩增出包含有酶切位点的完整GmDi19-5读码框,同时对pGBKT7载体进行双酶切,将PCR产物及酶切产物连接后转化入大肠杆菌TOP10感受态细胞中(天根,北京)。酵母菌株AH109感受态细胞按照试剂盒说明书制备(Yeastmaker™ Yeast TransformationSystem 2 User Manual,Clontech公司)。将1 μg的pGBKT7- GmDi19-5重组质粒加入制备好的酵母感受态细胞中,再加入2.5 mL PEG/LiAc,轻轻混匀,30℃水浴30 min 诱导转化酵母感受态细胞;再加入20 μL DMSO,42℃水浴15 min;高速离心15 s弃上清,将菌体重悬于1 mL YPD液体培养基中,30℃震荡培养90 min;高速离心弃上清,将菌体重悬于1 mL NaCl中,取一定量菌液涂到SD/-Trp、SD/-Trp/-Ade和SD/-Trp/-His固体培养基上,验证pGBKT7-GmDi19-5重组质粒是否存在自激活。
1.3 共转化酵母感受态细胞及阳性克隆的筛选与分析
构建大豆cDNA文库:利用Trizol试剂盒提取大豆RNA,用1.2%的琼脂糖凝胶电泳检测RNA的完整性,将达到要求的RNA用反转录试剂盒反转得到第一链cDNA,以第一链cDNA为模板进行LD-PCR扩增,合成双链cDNA,并克隆到pGADT7载体上,分析cDNA插入片段,分析得到大豆cDNA文库[19]。将10 μg的诱饵载体pGBKT7-GmDi19-5质粒及10 μg的大豆cDNA文库质粒加入制备好的酵母感受态细胞中,再加入2.5 mL PEG/LiAc,轻轻混匀,30℃水浴30 min诱导共转化酵母感受态细胞。将共转化后的酵母感受态细胞涂布于营养缺陷型SD/-Trp/ -Leu/-His/-Ade固体培养基中,放于30℃培养箱中培养4 d左右,挑取直径大的酵母阳性单克隆,涂布于SD/-Trp/ -Leu/-His/-Ade/X-gal显蓝板上培养,筛选蓝色阳性单克隆。
筛选到的阳性酵母菌落挑取于1 mL YPDA液体培养基中,酵母培养箱30℃培养3—4 h后进行PCR检测。PCR反应条件参考于太飞等[20]方法,略有修改。跑胶后挑选其中大于750 bp的菌提取质粒并转化到大肠杆菌TOP10(天根,北京)中,送到北京博迈德生物公司测序,将测序结果在NCBI网站进行同源性比对分析,筛选出含有正确序列的目的基因。
1.4 RNA提取及实时荧光定量PCR分析
用试剂盒(天根,北京)提取大豆材料RNA,具体提取方法参考试剂盒说明书,提取好的RNA按照反转录合成试剂盒(天根,北京)合成单链cDNA,将反转录产物稀释至200 ng·μL-1作为cDNA模板待用。利用实时荧光定量PCR仪ABI7500检测目的基因GmDi19-5表达模式。反应体系参考ZHAO等[21]方法。以大豆Actin作为内参,每个反应3次重复。按照基因相对表达分析2-ΔΔCT方法分析GmDi19-5的相对表达量及其标准差。1.5 亚细胞定位
将GmDi19-5全序列与绿色荧光蛋白基因GFP连接,构建16318hGFP-GmDi19-5融合表达载体,用生长两周的拟南芥为材料制备原生质体,利用瞬时转染法将对照GFP空载体和重组质粒分别导入原生质体,室温培养16 h,通过激光共聚焦显微镜(Zeiss LSM700)观察GmDi19-5的定位情况,具体方法参考HE等[22]方法。1.6 GmDi19-5启动子分析
选取GmDi19-5起始密码子ATG上游1 206 bp的序列,在启动子分析软件PlantCARE(plant cis-acting regulatory elements, http://bioinformatics.psb.ugent.be/ webtools/ plantcare/html/)和PLACE(Plant cis-acting regulatory elements, http://www.biomedsearch.com/nih/ PLACE/)中对其启动子元件进行分析。将GmDi19-5启动子构建载体,待启动子区转基因拟南芥(Columbia-0)T2代长出第3、4片叶时,将其移入42℃培养箱高温处理1 h,对照为正常条件(22℃)生长的转基因幼苗;将植物材料置于离心管中,加入配置好的GUS染色工作液至完全覆盖材料,常温下避光过夜染色;染色结束后依次用25%、50%、75%、95%的酒精洗脱,之后在显微镜下观察报告基因的表达情况。
2 结果
2.1 GmDi19-5启动子的序列分析
前期研究发现GmDi19-5对干旱、高盐、氧化、ABA胁迫均有响应[16]。为了进一步解析GmDi19-5是否应答高温胁迫,首先分析了GmDi19-5启动子的顺式元件。通过对起始密码子ATG上游1 206 bp序列的分析显示,GmDi19-5的启动子区含有多个元件,其中包括启动子基本元件,如TATA-box和CAAT-box等;另外,GmDi19-5启动子含有一些胁迫相关元件,如光应答元件Box 4(ATTAAT)3个、Sp1(CC(G/A)CCC)、G-Box(CACGTT)等,分散在启动子区内;干旱诱导应答元件MBS(CAACTG)1个;茉莉酸甲酯响应顺式调控元件CGTCA-motif(CGTCA);水杨酸响应元件TCA-element(CCATCTTTTT)及其他一些调控序列。另外,还发现有热响应元件HSE(AAAAAATTTC)(图1),位于起始密码子上游803 bp位置,推测GmDi19-5启动子可能参与植物对高温胁迫的响应。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1GmDi19-5启动子顺式元件分析
HSE:热响应元件Heat shock response element;Box 4、chs-CMA1a、chs-CMA2a、GA-motif、GAG-motif、GT1-motif、Sp1、G-Box:光响应元件Light response elements;MBS:干旱诱导应答元件Drought induced element;TCA-element:水杨酸响应元件SA response element;Skn-1_motif:胚乳特异表达相关元件Endosperm specific expression-related element;E2Fa:细胞周期调控元件Cell cycle regulatory element;Box-W1:真菌诱导子相关元件 Fungal elicitor-related element
-->Fig. 1Cis-element analysis of GmDi19-5 promoter
-->
2.2 高温胁迫影响了大豆Di19-5基因的转录表达
为了进一步研究GmDi19-5对极端温度胁迫的响应,通过实时荧光定量PCR鉴定了温度对GmDi19-5表达的影响(图2)。结果显示,在高温胁迫下,大豆Di19-5上调表达,在胁迫处理12 h时表达量最高,为对照的6.39倍;而在低温胁迫处理时,GmDi19-5的表达无明显变化,说明GmDi19-5受高温胁迫的诱导表达。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2GmDi19-5在高温(42℃)和低温(4℃)胁迫处理下的表达模式分析
-->Fig. 2The expression pattern of GmDi19-5 under high temperature (42℃) and low temperature (4℃) treatments
-->
2.3 GmDi19-5在高温胁迫下的启动子活性分析
为了检测GmDi19-5启动子的活性,将GmDi19-5启动子构建到GUS表达载体,转化拟南芥,高温处理后进行组织化学染色,观察报告基因的表达情况。未经高温处理时,报告基因的表达量较低,除在子叶的维管组织有表达外,幼苗的其他组织几乎没有报告基因的表达;经高温处理后,报告基因的表达量明显升高,除新叶外,其表达几乎遍布植株的其他各个组织,无论是地上部分的子叶、叶原基,还是地下部分的根,均有报告基因的表达,尤其在子叶和根的维管组织表达量极为显著(图3),说明高温胁迫影响了GmDi19-5的组织特异性表达。2.4 亚细胞定位
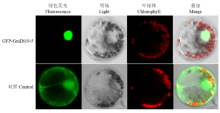
将GmDi19-5与绿色荧光蛋白基因GFP连接,构建GFP-GmDi19-5融合表达载体,利用瞬时转染法将其导入拟南芥原生质体细胞,通过共聚焦显微镜观察分析。结果显示,空GFP对照的绿色荧光分布在整个细胞中;而GFP-GmDi19-5融合蛋白的绿色荧光主要分布在细胞核中(图4),表明GmDi19-5蛋白定位在细胞核上。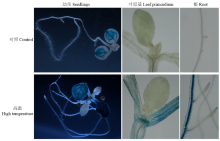 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3GmDi19-5在高温胁迫下的启动子活性分析
-->Fig. 3Analysis of GmDi19-5 promoter activities under high temperature treatments
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4GmDi19-5蛋白在拟南芥原生质体中的亚细胞定位分析
-->Fig. 4Subcellular localization of GmDi19-5 in Arabidopsis protoplasts
-->
2.5 诱饵载体pGBKT7-GmDi19-5的构建以及自激活验证
将GmDi19-5全长和表达载体pGBKT7由SmaⅠ和PstⅠ酶切位点双酶切,酶切产物纯化后由连接酶连接得到重组质粒pGBKT7-GmDi19-5。为了检测GmDi19-5是否存在自激活活性,将pGBKT7- GmDi19-5质粒转入酵母感受态细胞中,转化产物分别涂布于SD/-Trp、SD/-Trp/-Ade和SD/-Trp/-His培养基上培养3 d(图5),在SD/-Trp平板能长出酵母菌落,而在SD/-Trp/-Ade和SD/-Trp/-His平板上都没有菌落长出,表明重组质粒已转入酵母感受态细胞中,且GmDi19-5无自激活活性,可以用酵母双杂交系统筛选大豆cDNA文库。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5pGBKT7-GmDi19-5的自激活验证
-->Fig. 5Auto-activation identification of pGBKT7-GmDi19-5
-->
2.6 大豆cDNA文库的筛选以及候选互作蛋白序列分析
将诱饵载体pGBKT7-GmDi19-5质粒与大豆cDNA文库质粒共转化酵母感受态细胞,转化后的酵母感受态细胞涂布于营养缺陷型SD/-Trp/-Leu/-His/- Ade固体平板培养基中,放于30℃培养箱中培养4 d,挑取直径大于2 mm的酵母阳性单克隆,点涂于SD/-Trp/-Leu/-His/-Ade/X-gal显蓝板上培养,筛选蓝色阳性单克隆(图6)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6GmDi19-5互作蛋白的筛选
-->Fig. 6Screening of interacting proteins with GmDi19-5
-->
对筛选到的部分蓝色单克隆进行PCR检测,结果表明,不同克隆插入的片段大小不同,主要在750 bp左右,大部分克隆扩增结果为1条带,但还有一些克隆扩增结果为2条带,对于单一条带的克隆送于公司测序。测序结果在NCBI网站进行同源性比对分析,得到一些大豆候选基因序列(表1),其中,大部分能够参与植物对逆境胁迫的响应,比如超氧化物歧化酶基因;还有一些与能量代谢相关基因,比如氨基转移酶基因。这些基因可能参与不同的胁迫响应,调控大豆的生长发育;还有一些未知功能基因,也可能与大豆的生长发育有关,但尚不清楚功能。
Table 1
表1
表1候选基因的BLAST分析结果及其功能推测
Table 1BLAST analysis and predicted functions of candidate genes
| GmDi19-5互作基因 The genes interacting with GmDi19-5 | 基因序列号 Gene ID number | 功能 Functions |
|---|---|---|
| LEA 蛋白 Late embryogenesis abundant protein | Glyma10g02210 | 脱水保护剂,在胁迫条件下保护生物大分子,尤其是生物膜结构的稳定性 Dehydration protectant, protect biological macromolecules under stress conditions |
| JAB1蛋白 c-jun-activation-domain binding protein | Glyma15g01310 | 参与许多信号转导通路, 包括调节植物的光信号以及细胞周期 To participate in many signal transduction pathways, including plant light signals and cell cycle |
| DnaJ蛋白 DnaJ-like proteins | Glyma11g17930 | 辅助蛋白,通过激活热激蛋白70的ATP酶活性而调控其活性 Auxiliary protein, to activate the activity of HSP70 through regulate the activity of ATP enzyme activity of HSP70 |
| 组氨酸蛋白 Histone-like protein | Glyma04g20610 | 维持核小体的结构完整性,能与染色质相关蛋白结合,使染色质凝集 Maintaining structural integrity of the nucleosome, and binding of specific chromatin-associated proteins |
| 膜联蛋白D1 Annexin D1-related protein | Glyma13g01870 | 具有与磷脂膜可逆结合及与钙离子结合的能力 Reversibly bind to phospholipids and calcium ion |
| 氨基转移酶 Aminotransferase class I and II | Glyma16g26210 | 催化把α-氨基酸上的氨基转移给α-酮酸形成新的酮酸和氨基酸 Can form the new Keto acid and amino acid via catalytic transfer the amino of alpha amino acids to alpha keto acid |
| 脱氢酶 Fatty acid desaturase | Glyma03g30070 | 催化物质氧化还原反应 To catalyze redox reaction |
| 翻译起始因子 Translation initiation factor | Glyma09g001900 | 参与蛋白翻译的起始 Involved the initiation of translation |
| START结构域蛋白 START domain proteins | Glyma20g36050 | 参与类固醇生成与磷脂酰胆碱转移 Involved in steroidogenesis/phosphatidylcholine transfer |
| 超氧化物歧化酶 Superoxide dismutase | Glyma10g193500 | 减轻非生物胁迫造成的细胞膜质过氧化, 增强植株抵御非生物胁迫的能力 Alleviate the over-oxidation degree of cytoplasm membrane caused by abiotic stress, and enhance the abiotic tolerant capacity |
| 核糖体蛋白 Ribosomal protein | Glyma10g221600 | 与mRNA结合 Be combined with mRNA |
| 加双氧酶 Homogentisate 1,2-dioxygenase | Glyma12g20220 | 参与还原磷酸戊糖代谢途径,起固定CO2的催化作用 To catalyze the primary CO2 fixation step in the reductive pentose phosphate pathway |
| 核因子Y Nuclear factor Y | Glyma13g189400 | 参与ABA信号途径,和光周期的调控有关 Involved in ABA signaling pathway and regulating the photoperiod |
| 未知蛋白 Unknown protein |
新窗口打开
2.7 蛋白互作初步验证
经分析,其中一个筛选到的候选基因包含有完整的DnaJ结构域,命名为GmDnaJ(Glyma11g17930)。为了进一步验证GmDi19-5和GmDnaJ的互作,将GmDnaJ全长连接在pGADT7载体上,与诱饵载体pGBKT7-GmDi19-5共同转化酵母AH109感受态细胞,并将其涂布于SD/-Trp/-Leu和SD/-Trp/-Leu/-His/- Ade营养缺陷型培养基上。,在二缺板上,共转和对照都能长出状态良好的菌落(图7-A),说明质粒均已转进感受态细胞;而在四缺板上,只有当pGBKT7- GmDi19-5和pGADT7-GmDnaJ共同转化时,才有酵母菌株生长,且在不同浓度梯度下都能生长(图7-B),说明GmDi19-5和GmDnaJ在酵母水平上是互作的。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7不同浓度梯度下GmDi19-5与候选蛋白GmDnaJ在酵母细胞中的互作鉴定
-->Fig. 7Interaction identification of GmDi19-5 with candidate proteins GmDnaJ in yeast cells in dilution series
-->
2.8 候选蛋白的表达模式分析
为了进一步研究GmDi19-5候选蛋白编码基因对高温胁迫的响应,通过实时荧光定量PCR对其候选蛋白基因GmDnaJ进行表达模式分析(图8)。结果发现,在高温胁迫下,大豆GmDnaJ上调表达,当胁迫处理8 h时,其表达量达到最高,之后慢慢下降,说明GmDnaJ受高温胁迫诱导表达,表明GmDi19-5可能通过与GmDnaJ的互作参与高温响应。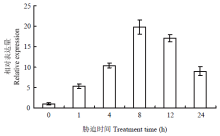 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8GmDnaJ在高温(42℃)胁迫处理下的表达模式分析
-->Fig. 8The expression pattern of GmDnaJ under high temperature (42℃) treatments
-->
3 讨论
转录因子是指能够结合在其他基因上游特异核苷酸序列上的蛋白质,能调控下游基因的转录,从而激活或抑制下游基因的表达,影响其功能发挥[23]。转录因子在植物的生长发育以及对非生物胁迫的响应中发挥着重要的作用[24],目前已发现多种转录因子,包括DREB、AP2/ERF、WRKY、bZIP、锌指蛋白等。其中,锌指蛋白转录因子在植物形态发生、转录激活和逆境胁迫等多种生物学进程中起重要作用。Di19蛋白包含C2H2结构域,属于锌指蛋白转录因子。Di19蛋白在植物体内分布广泛,受胁迫诱导,在维持植物正常的生长发育中起着重要作用。在之前的研究中,已从大豆基因组中鉴定出了7个Di19,其中,GmDi19-5可能与多种胁迫响应有关[16],但对高温的响应尚无报道。本研究发现GmDi19-5的启动子区域含有热响应元件HSE(图1),推测GmDi19-5对高温胁迫有响应。实时荧光定量PCR(图2)和GUS组织特异性表达分析(图3)表明,GmDi19-5受高温胁迫诱导表达。为了进一步研究GmDi19-5的作用机制,本研究通过酵母双杂交技术筛选到一些与GmDi19-5互作的候选蛋白基因,其中大部分能够参与植物对逆境胁迫响应,比如超氧化物歧化酶。据报道,高温打破了细胞内活性氧的产生与清除之间的平衡,加剧了膜脂过氧化作用,造成丙二醛和阴离子自由基等氧化物大量积累,引起膜蛋白与膜内脂的变化,从而引发细胞膜的通透性增大[25]。为了降低高温造成的伤害,植物体内的保护酶(超氧化物歧化酶SOD、过氧化酶POD和过氧化氢酶CAT等)活性改变,减轻膜脂过氧化带来的伤害[26-27]。然而SOD对植物的保护作用是有限的,随着温度的升高,酶活性下降,这种保护作用逐渐减小[28]。另外,据报道,水稻在高温胁迫处理时,叶片中的SOD活性持续下降[29]。因此,当温度升高时,SOD酶活性降低,对植株的保护作用也随之降低,生长发育受到抑制。
候选蛋白之一的DnaJ类蛋白最初是通过对热激反应的研究得到的,具有热激蛋白特性,高温诱导能使其表达量升高[30]。大量研究发现,DnaJ能与热激蛋白HSP70结合,形成分子复合体,在细胞中起分子伴侣的作用,参与植物对热激胁迫的响应[31-32]。也有研究表明DnaJ蛋白在应对盐胁迫[33]、重金属胁迫等方面发挥作用。本研究验证了GmDi19-5与GmDnaJ的互作(图7),推测GmDi19-5可能在转录后水平上与GmDnaJ的互作,精细调控植物在环境胁迫下的生长发育。
4 结论
GmDi19-5受高温胁迫诱导表达,GmDi19-5过表达增强了转基因拟南芥根系对高温胁迫的敏感性。The authors have declared that no competing interests exist.
