0 引言
【研究意义】开花是高等植物生长发育进程中一个非常关键的阶段,受多种因素的共同调控。绝大多数的植物在开花之前会持续一定时间的营养生长,不断长出新的叶片。但是,当内外因素变化时,尤其是光照时间长短的变化会导致植物结束营养生长阶段进入生殖生长阶段,继而开花、结果、繁衍后代[1-6]。研究植物开花的分子机理、调控模式以及控制开花重要基因的功能,最终实现人为干预植物的开花时间以及花期长短将对园艺园林具有十分重要的意义。此外,人为调节农作物的开花结果时间也将为农业增产增收提供保障。【前人研究进展】在植物从营养生长到生殖生长这一成花转化过程中,2个控制植物开花的同源基因TERMINAL FLOWER 1(TFL1)和FLOWERING LOCUS T(FT)扮演非常重要的角色[7-9]。二者同属于磷脂酰乙醇胺结合蛋白家族(phosphatidylethanolamine-binding protein,PEBP)[10],尽管它们的氨基酸序列具有60%的同源性,但是发挥的生理功能截然相反,TFL1抑制开花,而FT促进植物开花[11-15]。近年来,关于这对同源基因发挥相反功能的分子机制研究已经取得了一些突破性的进展。FT蛋白被称作开花素,在植物叶片中合成,经过韧皮部的运输到达植物的顶端分生组织处[7,16-18]。在顶端分生组织,FT蛋白与bZIP转录因子家族成员FD蛋白形成复合体调控下游基因AP1的表达[19-20]。在水稻中,过表达OsFD1与Hd3a(FT的同源基因)能够上调OsMADS15的表达[21]。目前,在一些物种中研究者们进一步证实FD与FT蛋白之间并不直接互作,而是由GRFs蛋白作为媒介介导形成复合体发挥作用[22-24]。番茄中GRFs的同源基因GRF/74与番茄中FT的同源基因SP相互作用。在水稻中,已经有4个GRFs的亚型被报道与FT的同源基因Hd3a相互作用[25-26]。GRFs蛋白是一类调节因子(general regulatory factors,GRFs),也被称作14-3-3蛋白,拟南芥中存在从GRF1—GRF15共15个成员,广泛参与调控生物体内的多种生理、生化,以及信号转导过程。比如,在BR信号转导过程中,转录因子BZR1存在磷酸化与脱磷酸化2种状态。脱磷酸化状态的BZR1能够与下游基因的启动子结合,调控基因表达。而磷酸化状态的BZR1会被GRFs蛋白结合而滞留在胞质内,不能进入细胞核内发挥转录因子的功能[27-28]。在拟南芥中,fd-2突变体植株晚花,tfl1-1突变体植株早花,而tfl1-1/fd-2双重突变体植株并没没有表现出明显的早花表型。由此说明,TFL1抑制开花可能也是依赖于FD的,TFL1也与FD形成蛋白复合体发挥功能[29-30]。【本研究切入点】拟南芥中TFL1与FD的作用是否同样需要GRFs作为媒介介导?拟南芥中TFL1是否也像FT一样与GRFs直接相互作用?关于这些问题目前还不十分清楚。【拟解决的关键问题】本研究拟采用酵母双杂交和双分子荧光互补(BiFC)2种技术研究拟南芥开花抑制因子TFL1与调节因子GRFs是否直接相互作用,分析拟南芥TFL1与FD之间的作用是否同样需要GRFs作为媒介介导,为进一步解答FT与TFL1如何协调控制植物开花时间提供新的证据和见解。1 材料与方法
1.1 试验材料
试验于2016年进行,载体PGBKT7和PGADT7,酵母菌株AH109由华北理工大学生命科学学院保存;酵母培养基和转化试剂购于美国Clontech公司;LR克隆试剂盒(11791020)和pCR8克隆试剂盒(K2520-20)购于美国Invitrogen公司;拟南芥Col-0种子购于ABRC。1.2 TFL1与GRFs酵母双杂交载体的构建
从拟南芥叶片中提取总RNA,通过反转录获得其cDNA。使用TFL1特异性上下游引物扩增TFL1(表1),与载体pCR8连接,转化DH5α,对长出的菌落进行菌落PCR检测及测序,鉴定获得TFL1入门载体(TFL1-pCR8)。利用LR重组试剂盒,将TFL1-pCR8与目标载体PGBKT7进行LR重组获得酵母双杂交载体TFL1/PGBKT7(TFL1-BD)。利用同样的方法分别将GRFs入门载体与酵母双杂交载体PGADT7重组。Table 1
表1
表1本研究所用引物
Table 1The primers used in this study
| 基因 Gene | 基因编号 Accession number | 引物序列 Primer sequences (5′-3′) |
|---|---|---|
| TFL1 | AT5G03840 | F:ATGGAGAATATGGGAACTAGAG |
| R:GCGTTTGCGTGCAGCGGTTTC | ||
| GRF7 | AT3G02520 | F:ATGTCGTCTTCTCGGGAAGAG |
| R:CTGCCCTGTCTCAGCTGGT | ||
| GRF4 | AT1G35160 | F:ATGGCGGCACCACCAGCAT |
| R:GATCTCCTTCTGTTCTTCAGCA |
新窗口打开
1.3 酵母双杂交
将1 µg TFL1-BD和1 µg GRFs-AD质粒加入200 µL酵母感受态细胞AH109中,室温孵育1—2 h,42℃热激30 min后,冰浴1—2 min。将酵母细胞涂布在-LT双缺固体培养基上,30℃培养2—3 d直至长出酵母克隆。利用同样的方法进行对照组TFL1-BD与AD、BD与AD、BD与GRFs-AD的转化。选取双缺培养基上生长较好的酵母单克隆于加有100 µL无菌水的EP管中混匀,吸取10 µL置于-LTHA四缺培养基,30℃继续培养2—3 d观察酵母生长情况。每个组合各选取3个酵母菌落作为3个重复。1.4 BiFC系统载体构建
将入门载体TFL1-pCR8、GRFs-pCR8分别与目标载体px-cYFP和px-nYFP进行LR重组,获得BiFC试验载体TFL1-cYFP、TFL1-nYFP、GRFs-cYFP、GRFs-nYFP,并转化农杆菌GV3101。1.5 烟草叶片注射与YFP荧光信号观察
室温离心过夜培养的农杆菌收集菌体,利用注射缓冲液(10 mmol·L-1 MES,pH5.6;150 µmol·L-1 acetosyringone;10 mmol·L-1 MgCl2)洗涤菌体沉淀2—3次后重悬至菌液的OD600为0.6—0.8,室温孵育4—6 h。将烟草从培养室取出,在试验台弱光条件下事先放置1—2 h,将要共同注射的2种农杆菌菌液等体积混匀,然后用不带针头的注射器注射入烟草叶片下表皮,并做好标记。将注射好的烟草在试验台继续弱光培养1—2 h后放回正常光照条件下培养36—48 h。在注射过的烟草叶片上距离针孔周围2—3 mm处剪下约1 cm见方的叶片,平放于载玻片上,然后荧光显微镜下观察有无YFP荧光信号。2 结果
2.1 TFL1与GRFs酵母双杂交载体的构建
利用TFL1特异性引物扩增得到534 bp的基因片段(图1-A),与入门载体pCR8连接,获得TFL1的入门载体TFL1-pCR8(图1-B)。将入门载体TFL1- pCR8与目标载体PGBKT7经过LR重组反应获得酵母双杂交载体TFL1/PGBKT7(TFL1-BD)。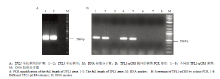 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1入门载体TFL1-pCR8的构建
-->Fig.1Construction of TFL1-pCR8 entry vector
-->
 显示原图|下载原图ZIP|生成PPT
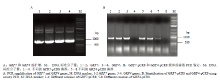
显示原图|下载原图ZIP|生成PPT图2入门载体GRF7-pCR8和GRF4-pCR8的构建
-->Fig.2Construction of GRF7-pCR8 and GRF4-pCR8 entry vectors
-->
利用基因特异性引物扩增得到888 bp的GRF4和798 bp的GRF7全长基因片段(图2-A),分别连接入门载体pCR8,经菌落PCR扩增检测(图2-B)和测序验证获得正确的入门载体GRF4-pCR8和GRF7-pCR8。将这两个入门载体分别与目标载体PGADT7重组,获得酵母双杂交载体GRF4-AD和GRF7-AD。
2.2 酵母双杂交验证TFL1与GRFs的相互作用情况
当所有酵母菌落在-LT双缺培养基上生长较好时,通过观察-LTHA四缺培养基上试验组与对照组的酵母菌落生长情况判断TFL1是否与GRFs直接互作。共同转化阴性对照组TFL1-BD与AD、BD与GRFs-AD、BD与AD质粒的酵母菌落在-LTHA四缺培养基上都不生长,而共同转化TFL1-BD与GRF4-AD或GRF7-AD质粒的酵母菌落在LTHA上正常生长(图3)。结果表明,在酵母中TFL1与GRF4、GRF7直接互作。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3在酵母中TFL1与GRF4、GRF7直接互作
-->Fig.3TFL1 directly interacts with GRF4 and GRF7 in yeast two hybrid assays
-->
2.3 BiFC验证TFL1与GRFs的相互作用情况
利用BiFC试验验证烟草中TFL1与GRFs是否直接相互作用。将转化TFL1-cYFP质粒的农杆菌分别与转化GRFs-nYFP质粒的农杆菌共同注射烟草叶片下表皮,培养48 h后均在烟草细胞核内有较强的YFP荧光信号(图4-A)。所有的阴性对照组,即转化px-cYFP空载体的农杆菌分别与转化GRF4- nYFP或GRF7-nYFP质粒的农杆菌共同注射烟草后没有出现YFP荧光信号;转化px-nYFP空载体与转化TFL1-cYFP质粒的农杆菌共同注射烟草后也未出现YFP荧光信号(图4-B)。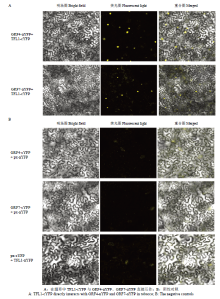 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4在烟草中TFL1-cYFP与GRF4-nYFP、GRF7-nYFP直接互作
-->Fig.4TFL1-cYFP directly interacts with GRF4-nYFP and GRF7-nYFP in tobacco
-->
为排除标签造成假阳性结果的可能,试验中交换标签后重新利用BiFC试验验证了TFL1与GRFs的互作情况。将转化TFL1-nYFP质粒的农杆菌分别与转化GRF4-cYFP或GRF7-cYFP质粒的农杆菌共同注射烟草后仍然在细胞核内出现较强的YFP荧光信号(图5-A)。所有的阴性对照组,即转化px-nYFP空载体的农杆菌分别与转化GRF4-cYFP或GRF7- cYFP质粒的农杆菌共同注射烟草后没有出现YFP荧光信号;转化px-cYFP空载体与转化TFL1-nYFP质粒的农杆菌共同注射烟草后也未出现YFP荧光信号(图5-B)。由此证实,在烟草中TFL1与GRF4、GRF7直接相互作用。
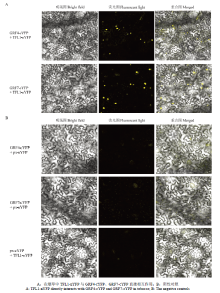 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5在烟草中TFL1-nYFP与GRF4-cYFP、GRF7-cYFP直接互作
-->Fig.5TFL1-nYFP directly interacts with GRF4-cYFP and GRF7-cYFP in tobacco
-->
3 讨论
蛋白质互作是生命体一项基本的生命活动,几乎发生在细胞中的每一个生理生化过程中,诸如DNA的包装、基因表达调控、细胞信号转导等。确定蛋白质间的相互作用在何时何处发生以及如何形成蛋白质复合体将为阐明蛋白质的生物学功能及其作用机制提供至关重要的线索。证实和阐明功能蛋白质间的互作关系对于研究蛋白质发挥的生物学功能,参与调控的生物学过程具有十分重要的意义。目前,研究蛋白质间互作的方法很多,如酵母双杂交、双分子荧光互补(BiFC)、免疫共沉淀和凝胶孵育等。其中,酵母双杂交技术是研究蛋白质间互作比较简便和灵敏的一种方法,并且可以精确地测定蛋白质之间微弱的相互作用,因其操作是在核酸水平上,不需要纯化大量的蛋白质,操作简单容易[31]。研究者们已经利用酵母双杂交技术在蛋白质组学、基因组学、细胞周期调控、细胞信号转导等众多领域取得了很重要的研究成果。但是,酵母双杂交技术存在一些自身缺陷,很明显的一个缺陷就是存在假阳性。所谓假阳性,即通过酵母双杂交观察到的蛋白质间的相互作用在其他互作系统验证中并不是阳性结果,在真实情况下不一定发生。因此,酵母双杂交验证的蛋白质相互作用往往还需要其他的试验证据进一步的支持。
双分子荧光互补技术是近些年发展起来的一项新技术,该方法较直观,利用荧光显微镜在最接近活细胞生理状态的条件下直接观察荧光信号的有无来判别目标蛋白质间是否存在直接相互作用,该方法已逐渐成为研究活细胞内蛋白质的动态关系和功能的一个强有力的工具[32]。但该技术存在的一个明显缺陷也是假阳性的存在,荧光片段在没有连接目标蛋白质时也可能发生自发互补互作,这也是该技术中背景信号的主要来源。因此需要通过连接不发生互作的蛋白以及各种合适的阴性对照来排除这种假阳性结果。
本研究中,利用酵母双杂交和双分子荧光互补2种技术互为补充,互相印证,更加确定了结果的真实性和可靠性。研究结果为进一步解析TFL1抑制植物开花的分子机制提供了新的证据,也为在农业生产上人为控制农作物的开花时间以及花期提供理论基础。
4 结论
酵母双杂交和双分子荧光互补2个试验共同证实了拟南芥开花抑制因子TFL1与调节因子蛋白GRFs家族的2个成员GRF4和GRF7直接相互作用,拟南芥中TFL1与FD之间的作用同样需要GRFs作为媒介介导。
The authors have declared that no competing interests exist.
