0 引言
【研究意义】东北黑土区是世界上3大黑土区之一,同时也是中国重要的商品粮基地,对国家粮食供应和食品安全至关重要[1],但由于连年追求高产以及长期不合理的施肥,导致农田质量退化,土壤理化性状变差,黑土退化的很大一部分原因是过度使用了氮肥等化学肥料[2]。化学肥料在提供植物生长所必需的养分的同时,也会对土壤微生物的群落结构产生影响[3],土壤微生物作为农田生态系统的关键组分,能够促进土壤有机质的分解以及土壤养分的转化,对维持土壤质量和土壤的健康发展具有十分重要的作用[4]。研究表明,根瘤菌与豆科作物共生固氮,可为豆科作物提供50%—90%的氮素营养,能够极大程度地减少化学氮肥的施用[5]。进行不同施肥处理对东北黑土细菌群落影响的研究,分析接种根瘤菌对土壤化学性质及细菌群落的影响,有利于进一步认识黑土细菌菌群的结构变化。【前人研究进展】土壤理化性质(pH等)、不同施肥制度和施肥措施等都会影响土壤细菌的群落结构,以土壤pH和施用氮肥对土壤细菌群落结构的影响较为深刻[6-7]。ZHOU等[8]研究表明,氮肥连续施用导致的土壤pH下降对细菌菌群的结构和规模有重要影响,土壤硝态氮的浓度也会改变细菌群落的构成;RAMIREZ等[9]研究发现,高氮量会使土壤中的细菌群落组成发生明显变化并会导致土壤中主要细菌生活史的改变;秦杰等[10]研究表明,长期不同施肥条件下土壤细菌和古菌的群落结构都发生了明显改变,土壤pH是影响土壤细菌和古菌菌群变化的主效环境因子。研究发现,接种根瘤菌会对根际微生物的群落结构产生一定的影响,有利于增加土壤中氮素类群微生物的数量,还能在很大程度上抑制病原真菌的生长,防止病害的发生[11-12]。【本研究切入点】东北黑土带是中国大豆主产区且长期以来都以连作种植为主,常年的化学氮肥施用虽然能够提高大豆产量但却降低了土壤的pH,使土壤变得酸化。已有研究表明大豆连作会造成严重的连作障碍,使土壤理化性状变差,土传病害加重,土壤微生物菌群发生变化[13-14],但对于连作条件下土壤细菌群落结构变化的研究却比较少。笔者结合土壤化学性状,对5年大豆连作条件下的4种不同施肥处理开展土壤细菌菌群变化研究,加入接种根瘤菌处理以探讨对化学氮肥替代减施的作用及其对土壤细菌菌群的影响。【拟解决的关键问题】以4种不同施肥处理的耕层土壤为研究对象,以16S rRNA基因V4区为分子标靶,借助高通量测序技术(Illumina HiSeq)和real-time PCR技术,表征不同施肥处理土壤细菌的群落结构特征和组成差异,并侧重分析接种根瘤菌处理的不同之处,分析土壤菌群与环境因子的相关关系及主效环境因子,为进一步了解连作条件下东北耕地土壤中细菌群落结构的变化以及大豆的高效种植和氮肥减施提供理论支持。1 材料与方法
1.1 试验地概况
试验地位于吉林省农科学院(公主岭院区)的现代农业产业技术示范基地(43°30′23″N,124°48′34″E,海拔220 m),于2011年开始建立接种根瘤菌的黑土大豆连作试验。土壤类型为淡黑钙土,成土母质为第四纪黄体状沉积物,地势平坦。试验地所在区域属寒温带大陆性季风气候,年平均气温5—6℃,无霜期110—140 d,年日照时数2 500—2 700 h,有效积温2 600—3 000℃,年降水量450—600 mm,其中4—9月份降水量占全年总量的80%以上,每年12月至第2年3月份为土壤冻结期,冻土层厚可达1.5 m左右。试验地属于一年一季雨养农区,种植作物以大豆为主。试验共设4个处理:CK(对照)、PK(施用磷钾肥料)、NPK(施用氮磷钾肥料)、PK+5821(施用磷钾肥料+接种Bradyrhizobium japonicum 5821(B. japonicum 5821分离自嫩江九三农场垦鉴豆28的大豆根瘤,20 mL/667 m2根瘤菌拌种处理,接种量为1.5×1010 CFU/mL)。具体施肥量如表1所示。每个处理3个重复,小区面积36 m2,小区行数12行,行长5 m,行距0.6 m。Table 1
表1
表1各个处理施肥情况
Table 1Fertilizer application in this study
| 处理Treatment | 施肥量Fertilizer added (kg·hm-2) |
|---|---|
| CK PK NPK PK+5821 | 0 P2O5, 75; K2O, 75 N, 60; P2O5, 75; K2O, 75 P2O5, 75; K2O, 75 |
新窗口打开
1.2 样品采集
土壤样品采集于2015年9月,大豆收获后取0—20 cm的耕层土壤,每个小区按“S”布点法取9个土壤样品,混合后作为该处理的一个样品,每个处理3个重复。土壤样品储存于保鲜自封袋中,一部分于-80℃冰箱保存,用于土壤微生物群落分析;另一部分室温风干研磨,分别过1 mm筛和0.25 mm筛,用于测定土壤化学性质。1.3 试验方法
1.3.1 土壤化学性质测定[15-16] pH用酸度计法测定(土水比1﹕2.5);全氮(total N,TN)用凯氏定氮法测定;有效磷(available P,AP)用碳酸氢钠浸提-钼锑抗比色法测定;速效钾(available K,AK)用乙酸铵浸提-原子吸收火焰光度法测定;有机质(SOM)用重铬酸钾容量法测定。1.3.2 总DNA的提取 使用DNA试剂盒(MOBIO Laboratories Inc.,Carlsbad,CA,USA)从0.25 g土壤中提取总DNA。为最大限度减小提取偏差,3个相继提取的DNA用试剂盒纯化。总DNA用1%的琼脂糖凝胶电泳检测,提取DNA的浓度和纯度(A260/280)用NanoDrop ND-1000 UVevis分光光度计检测(ThermoScientific,Rockwood,TN,USA)。
1.3.3 16S rRNA基因扩增和测序 使用Illumina Hiseq平台进行扩增和测序,选择16S rRNA基因V4区515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACVSGGGTATCTAAT-3′)为测序引物[17],两端引物都加有barode序列标签(12 mer)。PCR扩增体系条件如下:94℃ 2 min,94℃ 30 s共30个循环,50℃ 30 s,延伸时间72℃ 1 min,72℃ 6 min。
1.3.4 Real-time PCR测定 使用ABI 7500(ABI,USA)实时荧光定量PCR系统测定细菌16S rRNA基因拷贝的丰度。反应体系:FastFire qPCR PreMix 10 μL,正向引物515F(5′-GTGCCAGCMGCCGCGGTA A-3′)0.6 μL,反向引物806R(5′-GGACTACVSGGGT ATCTAAT-3′)0.6 μL,ROX Reference Dye 0.4 μL,1 μL DNA,补加ddH2O至20 μL。程序扩增:95℃ 1 min 40个循环,94℃ 15 s,55℃ 34 s,72℃ 15 s[18]。构建含有16S rRNA基因的重组pGEMR-T载体为标准质粒,质粒制备和后续方法参考文献[19]。
1.3.5 数据处理分析对原始测序数据进行质量控制,舍弃低质量序列.测序端前引物进行错配检查,去除模糊碱基大于0、单碱基高重复数大于6的序列,选择长度在400—800 bp的序列,使用uchime_ref法检测并去除嵌合体.将核苷酸相似度大于97%的序列作为一个OTU(操作分类单位),并进行单样品α多样性分析.土壤化学性质数据采用Excel2007和SPSS 19.1软件进行统处理和分析使用CANOCO软件对土壤化学性质和微生物群落结构进行冗余分析(RDA).
2.结果
2.1 土壤化学性质和大豆产量
3在4个处理中,NPK处理与PK+5821处理的大豆产量基本持平,比PK处理增产5.4%、比CK处理增产15.2%,表明在不施氮肥的情况下,接种大豆根瘤菌能够有效地提高大豆产量.由所测土壤化学性质可知,各施肥处理土壤的pH在5.66—5.76,以NPK处理最低,PK+5821处理最高;NPK处理的全氮含量与PK+5821处理基本持平,都显著高于其他两个处理;土壤有效磷和速效钾含量都以NPK处理最高,CK处理最低;土壤有机质含量以PK+5821处理最高,与其他处理差异显著(P<0.05)(表2).Table 2
表2
表2不同施肥处理土壤的化学性质和大豆产量
Table 2Soil chemical properties and soybean yield in different fertilization treatments
| 处理 Treatment | pH (1﹕2.5 H2O) | 全氮 Total N (g·kg-1) | 有效磷 Available P (mg·kg-1) | 速效钾 Available K (mg·kg-1) | 有机质 Organic matter (g·kg-1) | 大豆产量 Soybean yield (kg·hm-2) |
|---|---|---|---|---|---|---|
| CK | 5.72±0.02bc | 1.36±0.01a | 20.17±0.91a | 158.64±2.99a | 23.56±0.39a | 1699.2±280.1a |
| PK | 5.71±0.01b | 1.30±0.01b | 34.15±1.73b | 184.87±2.03b | 23.99±0.17a | 1865.0±143.8a |
| NPK | 5.66±0.02a | 1.60±0.02c | 46.25±1.56c | 194.12±11.82b | 23.74±0.18a | 1956.7±120.5a |
| PK+5821 | 5.76±0.04c | 1.61±0.02c | 35.53±0.76b | 185.43±3.77b | 24.64±0.45b | 1957.8±140.1a |
新窗口打开
2.2 细菌16S rRNA基因拷贝数
不同施肥处理细菌16S rRNA基因拷贝数为3.29×108—4.03×108 copies/g土(图1)。其中,PK+ 5821处理的细菌16S rRNA基因拷贝数最多,为4.03×108 copies/g土,比CK处理(3.33×108 copies/g土)增加了21%;其次是NPK处理,细菌16S rRNA基因拷贝数为3.61×108 copies/g土,比CK处理增加了8.5%;PK处理的细菌16S rRNA基因拷贝数最少,为3.29×108 copies/g土,比CK处理减少了0.1%。不同施肥处理细菌16S rRNA基因拷贝数与土壤化学性质的Spearman相关性分析显示,土壤全氮与细菌16S rRNA基因拷贝数呈极显著相关性,而其他4个土壤化学性质与细菌16S rRNA基因拷贝数无相关性(表3)。高通量测序的结果(表4)显示,根瘤菌(genus)在各施肥处理中的相对丰度依次为PK+5821>PK>CK>NPK,且PK+ 5821处理中根瘤菌的相对丰度显著高于其他3个处理(P<0.01)。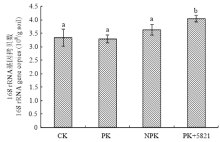 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同施肥处理细菌16S rRNA的基因拷贝数
-->Fig. 1Gene copy number of bacteria 16S rRNA treated with different fertilizations
-->
Table 3
表3
表3细菌16S rRNA基因拷贝数与土壤化学性质的Spearman相关性分析
Table 3Spearman’s correlation coefficients between gene copy number of bacteria 16S rRNA and soil physiochemical characteristics
| 理化性质 Soil property | pH (1﹕2.5 H2O) | 全氮 Total N (g·kg-1) | 有效磷 Available P (mg·kg-1) | 速效钾 Available K (mg·kg-1) | 有机质 Organic matter (g·kg-1) |
|---|---|---|---|---|---|
| 基因拷贝数Gene copy number | 0.085 | 0.734** | 0.392 | 0.161 | 0.469 |
新窗口打开
Table 4
表4
表4不同施肥处理中根瘤菌的相对丰度(属水平)
Table 4Relative abundance of rhizobia in different fertilization treatments (genus level)
| 处理Treatment | CK | PK | NPK | PK+5821 |
|---|---|---|---|---|
| 相对丰度 Relative abundance (%) | 0.19a | 0.28ab | 0.17a | 0.36b |
新窗口打开
2.3 不同施肥处理菌群多样性分析
2.3.1 细菌α多样性分析 12个土样细菌群落分析得到656 485条高质量序列(占95.2%,总共689 544条),97%的相似度覆盖率为0.976—0.99,表明序列读长的现有数量足以解释土壤细菌的多样性。由表5可知,4个施肥处理的土样OTU数在2 562—3 062,PK处理的总OTU最高,PK+5821处理的最低。PK处理与其他处理间细菌群落的丰富度和多样性在Chao1、ACE和香农指数中差异显著(P<0.05),但在辛普森指数中差异不明显。Chao1和香农指数均以PK处理最高,PK+5821处理最低;ACE指数以PK处理最高,CK处理最低;表明施肥会对细菌的丰富度和多样性产生影响,但其影响程度会因施肥种类的不同而产生较大差异。Table 5
表5
表516S rRNA基因OTU数、丰富度和多样性指数
Table 5Estimated 16S rRNA number of OTUs, richness and diversity
| 处理 Treatment | OTUs | 丰富度Richness | 多样性Diversity | ||
|---|---|---|---|---|---|
| Chao1 | ACE | 香农指数 Shannon | 辛普森指数 Simpson | ||
| CK | 2576±190a | 2904±236.4a | 2937±234a | 9.141±0.24a | 0.994±0.002a |
| PK | 3062±142b | 3321±59.9b | 3764±663b | 9.382±0.01b | 0.995±0a |
| NPK | 2645±80a | 2963±129.6a | 3040±146a | 9.065±0.02a | 0.992±0.001a |
| PK+5821 | 2562±48a | 2897±52.7a | 2950±55a | 9.031±0.04a | 0.994±0.001a |
新窗口打开
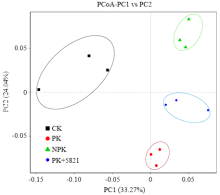
2.3.2 细菌β多样性分析 用基于含有丰度的Fast UniFrac距离矩阵得到的OTU做的PCoA图分析评估不同施肥处理的细菌群落变化。如图2所示,PC1和PC2两个轴分别解释了33.27%和24.04%的细菌群落变化。各处理土壤细菌群落在分布上存在着不同,3个施肥处理在PC1轴上的投影较为接近,而与CK处理相距较远,说明施肥是影响了细菌群落变化的主要因素;整体来看,PK+5821处理和PK处理的细菌群落结构都分布在右下方,而与左上方的CK处理和右上方的NPK处理是分开的,说明PK+5821处理和PK处理的细菌群落结构聚在了一起,是十分接近的。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同施肥处理主坐标分析
-->Fig. 2Principal coordinate analysis of different fertilization treatments
-->
2.4 细菌群落构成
不同施肥处理门水平的群落构成如图3所示,其中相对丰度最高的菌门为Proteobacteria(变形菌门),占34%—40.3%;随后依次是Actinobacteria(放线菌门,13.9%—23.4%)、Acidobacteria(酸杆菌门,12.3%—20.5%)、Gemmatimonadetes(芽单胞菌门,7.0%—9.3%)、Verrucomicrobia(疣微菌门,3.7%—7.6%)、Chloroflexi(绿弯菌门,3.2%—4.7%)、Planctomycetes(浮霉菌门,2.2%—4.6%)、Bacteroidetes(拟杆菌门,1.9%—5.6%)和Firmicutes(厚壁菌门,1.2%—5.4%)。CK处理中放线菌门的相对丰度明显高于其他3个处理,NPK处理中拟杆菌门和厚壁菌门的相对丰度明显高于其他3个处理,而PK处理中酸杆菌门和疣微菌门的相对丰度明显高于其他3个处理。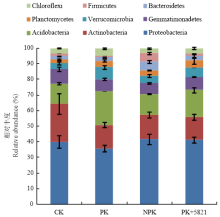 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同施肥处理相对丰度最高的9个菌门
-->Fig. 3Relative average abundances of the nine most abundant phyla across soils from different fertilizer treatments
-->
由表6可知,Alphaproteobacteria(α-变形菌纲)、Betaproteobacteria(β-变形菌纲)、Thermoleophilia(嗜热油菌纲)、Solibacteres和Saprospirae在处理间的差异不显著,其他菌纲在处理间的差异是显著的。值得注意的是,不同变形菌纲对不同施肥处理的响应不同,Gammaproteobacteria(γ-变形菌纲)在NPK和PK+5821处理中丰度要明显高于CK和PK处理,而其他3个变形菌纲在各肥料处理中的丰度变化差异不大。对放线菌门而言,各放线菌纲在CK处理中的相对丰度都要明显高于施肥处理,表明施肥可能会对放线菌的生长起到抑制作用。在酸杆菌门中,Acidobacteria-6和Acidobacteriia(嗜酸菌纲)在施肥处理中的相对丰度要明显高于CK处理,而其他两个酸杆菌纲并未发现这样的现象。在Spartobacteria和Planctomycetia(浮霉状菌纲)中,施肥处理的相对丰度要明显高于CK处理,而在Gemmatimonadetes(芽单胞菌纲)中恰好相反,表明不同菌群对肥料处理的响应是不同的。
Table 6
表6
表6不同施肥处理纲水平的相对丰度(相对丰度>1%)
Table 6Relative abundance of phylogenetic classes under different fertilization treatments (relative abundance>1%)
| 门 Phylum | 纲 Class | 处理 Treatment (%) | |||
|---|---|---|---|---|---|
| CK | PK | NPK | PK+5821 | ||
| Proteobacteria | Alphaproteobacteria | 21.38a | 17.19a | 19.54a | 18.99a |
| Betaproteobacteria | 10.07a | 9.43a | 9.53a | 10.27a | |
| Gammaproteobacteria | 2.98a | 2.56a | 7.58b | 6.99ab | |
| Deltaproteobacteria | 3.23b | 4.09c | 2.66ab | 2.44a | |
| Actinobacteria | Actinobacteria | 11.96b | 7.21a | 7.54a | 6.98a |
| Thermoleophilia | 9.16a | 5.54a | 5.99a | 5.47a | |
| Acidimicrobiia | 1.57b | 1.16ab | 1.01a | 1.10ab | |
| Gemmatimonadetes | Gemmatimonadetes | 7.82b | 6.18a | 5.88a | 7.02ab |
| Acidobacteria | Acidobacteria-6 | 3.65a | 6.63b | 4.16a | 6.14b |
| Acidobacteriia | 3.72a | 6.31b | 4.34a | 5.08ab | |
| Solibacteres | 2.76a | 2.81a | 2.50a | 2.69a | |
| Chloracidobacteria | 1.12a | 2.63c | 1.08a | 1.52b | |
| Verrucomicrobia | Spartobacteria | 2.68a | 5.68b | 3.51a | 4.33ab |
| Planctomycetes | Planctomycetia | 1.28a | 2.55b | 1.86ab | 2.31b |
| Bacteroidetes | Saprospirae | 1.64a | 1.32a | 1.70a | 1.52a |
新窗口打开
2.5 影响土壤细菌菌群结构的因子分析
通过CANOCO软件对各施肥处理和土壤化学性质进行RDA分析(图4),发现土壤全氮(F=3.2,P=0.002)对细菌群落的影响最显著,解释了24%的群落变化;其次是土壤有效磷(F=2.1,P=0.01),解释了14.5%的群落变化,所有理化因子总共解释了66.2%的群落变化,影响的顺序为土壤全氮>有效磷>速效钾>有机质>pH。RDA分析的前两个轴总共解释了41.68%的群落变化,第一个轴解释了25.8%,第二个轴解释了15.88%;沿第二轴看,3个施肥处理的细菌群落聚在一起,而与CK处理是分开的,表明施肥对土壤细菌的群落结构有很大影响。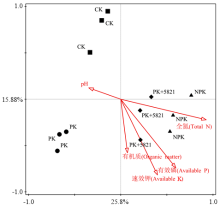 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同施肥处理土壤化学性质与细菌群落(门水平)的冗余分析
-->Fig. 4Results from redundancy analysis to explore the relationship between soil bacterial community (phylum) and soil physiochemical characteristics
-->
Table 7
表7
表7土壤优势菌群(门水平)与土壤化学性质的Spearman相关性分析
Table 7Spearman’s correlation coefficients between soil dominant bacteria (phylum) and soil physiochemical characteristics
| 门 Phylum | pH (1﹕2.5 H2O) | 全氮 Total N (g·kg-1) | 有效磷 Available P (mg·kg-1) | 速效钾 Available K (mg·kg-1) | 有机质 Organic matter (g·kg-1) |
|---|---|---|---|---|---|
| Proteobacteria | 0.134 | 0.734** | 0.28 | -0.063 | -0.077 |
| Actinobacteria | 0.039 | -0.168 | -0.531 | -0.51 | -0.615* |
| Acidobacteria | 0.183 | -0.336 | 0.119 | 0.434 | 0.685* |
| Gemmatimonadetes | 0.734** | -0.077 | -0.587* | -0.371 | 0.147 |
| Verrucomicrobia | 0.201 | -0.287 | 0.238 | 0.476 | 0.643* |
| Planctomycetes | -0.039 | -0.207 | 0.273 | 0.620* | 0.634* |
| Bacteroidetes | -0.296 | 0.622* | 0.566 | 0.343 | -0.105 |
| Firmicutes | -0.586* | 0.28 | 0.203 | -0.042 | -0.685* |
| Chloroflexi | 0.102 | -0.517 | -0.189 | 0.154 | 0.056 |
新窗口打开
对土壤中的优势菌群(门水平、相对丰度>1%)和土壤化学性质进行了Spearman相关性分析(表 7)。除了Chloroflexi(绿弯菌门)与所有化学指标都不存在相关性外,其他多数优势菌群都与土壤化学性质存在显著相关性。Gemmatimonadetes(芽单胞菌门)与土壤pH呈显著正相关,而Firmicutes(厚壁菌门)与土壤pH呈显著负相关;Proteobacteria(变形菌门)和Bacteroidetes(拟杆菌门)均与土壤全氮呈显著正相关;Gemmatimonadetes(芽单胞菌门)与土壤有效磷呈显著负相关,Planctomycetes(浮霉菌门)与土壤速效钾呈显著正相关;有5个优势菌门与土壤有机质呈显著相关性,Acidobacteria(酸杆菌门)、Verrucomicrobia(疣微菌门)和Planctomycetes(浮霉菌门)与土壤有机质呈显著正相关,而Actinobacteria(放线菌门)和Firmicutes(厚壁菌门)与土壤有机质呈显著负相关。
3 讨论
3.1 施肥对土壤养分和大豆产量的影响
所有的施肥处理均增加了大豆产量,PK+5821处理与NPK处理的大豆产量基本持平,增产效果明显,说明在不施氮肥的情况下接种根瘤菌也能为大豆生长提供足够的氮素营养,起到明显提高大豆产量的作用,这与刘丽等[20]的研究结果一致。林治安等[21]对连续22年长期定位实验的研究表明,施肥能够提高潮土中全氮、有效磷、速效钾和有机质的含量,这与本研究的结果一致。不同施肥处理对土壤pH的影响不同,与CK处理相比,NPK处理pH下降明显,可能为酰胺态氮肥尿素施入土壤中水解硝化逐年释放H+所致,许多研究也表明连续施用化学氮肥会降低土壤pH,造成土壤的酸化问题[22-23];而接种根瘤菌处理(PK+5821)的pH明显提高,表明根瘤菌共生固氮代替化学氮肥在一定程度上起到了缓解土壤酸化的作用。对于所有施肥处理土壤有机质都有所提高的现象,笔者归结为施肥促进了大豆生长,逐年落叶根茬翻耕还田转化积累所致。3.2 施肥对土壤细菌16S rRNA基因拷贝数和多样性的影响
通过对细菌16S rRNA基因拷贝数的分析(图1)可知,磷钾肥+接种根瘤菌处理(PK+5821)与不施肥处理(CK)相比细菌16S rRNA基因拷贝数增加了21%,而单施磷钾肥处理(PK)的细菌16S rRNA基因拷贝数与CK处理基本持平,表明接种根瘤菌显著提高了土壤细菌的16S rRNA基因拷贝数,这与TEIXEIRA等[24]的研究结果是一致的;笔者对各施肥处理中根瘤菌(genus)的相对丰度进行了统计,发现PK+5821处理中根瘤菌的相对丰度显著高于CK处理,而PK处理中根瘤菌的相对丰度虽然比CK处理要高,但并不显著,这可能是接种根瘤菌导致土壤细菌16S rRNA基因拷贝数提高的主要原因。分析同时发现,施用化学氮肥也能够在一定程度上提高土壤细菌的16S rRNA基因拷贝数,曾希柏等[25]对设施菜地细菌群落和丰度的研究也显示出施氮肥处理土壤细菌的16S rRNA基因拷贝数要显著高于CK处理,与本结果的研究一致。结合根瘤菌能与豆科作物共生固氮为其提供生长所需的氮素养分[26]与本研究结果,表明氮素是影响细菌16S rRNA基因拷贝数的重要因子,但影响的具体机制还有待于进一步研究。各个施肥处理对土壤细菌多样性的影响并不相同,表现为PK处理的土壤细菌多样性显著高于CK处理,而PK+5821和NPK处理与CK无明显差异。王佩雯等[27]对5年烟草连作施肥处理的土壤细菌群落分析表明,施肥对于连作土壤细菌群落多样性的影响并不明显;孙瑞波等[28]对长期施肥砂姜黑土的细菌群落研究发现,NPK施肥处理降低了土壤细菌群落的多样性。这与本研究对各施肥处理土壤细菌多样性影响的结果是不同的,分析可能是地域不同或施肥量不同导致的。
土壤细菌群落的β多样性分析(图3)得出,3个施肥处理的细菌群落结构在PC1轴上聚在了一起,而与CK处理是分开的,表明施肥是影响了细菌群落变化的关键因素,这与DING等[29]的研究结果一致。整体分析土壤细菌群落结构可知,PK+5821处理和PK处理的菌群聚在一起,而与CK和NPK处理是分开的,表明接种根瘤菌提供了氮素养分但并未对土壤细菌的菌群结构造成很大改变,有利于耕地土壤的可持续利用与发展。
3.3 施肥对土壤细菌群落组成的影响
不同施肥处理9大优势菌门的分析(图3)发现,Proteobacteria(变形菌门)、Actinobacteria(放线菌门)和Acidobacteria(酸杆菌门)是土壤中相对丰度最高的3个菌门,占所有优势菌门的70%以上,表明在土壤细菌菌群中,变形菌、放线菌和酸杆菌有较强的生长能力。在纲水平上,大多数菌群的相对丰度在处理间的差异显著(表6)。尹昌等[30]对东北黑土nirS型反硝化菌的系统发育分析表明,黑土中nirS型反硝化菌主要由α、β和γ-变形菌纲的微生物组成。本研究发现Gammaproteobacteria(γ-变形菌纲)在NPK和PK+5821处理中丰度要明显高于CK和PK处理,表明氮素可能是引起土壤中γ-变形菌纲变化的重要因子。各放线菌纲在CK处理中的相对丰度都要明显高于施肥处理,王伏伟等[31]对安徽砂姜黑土的研究表明,施肥增加了土壤中放线菌纲的相对丰度,这与本研究结果相反。AI等[32]对31年玉米-小麦轮作土壤细菌菌群的分析表明Acidobacteriia(嗜酸菌纲)在施肥处理中的相对丰度要明显高于CK处理,这与本研究结果是一致的。细菌群落与土壤化学因子的冗余分析(图4)表明,土壤全氮(F=3.2,P=0.002)对细菌群落的影响最显著,这与LIU等[33]的研究结果是一致的。土壤有效磷和速效钾也对细菌群落有很大的影响,这可能与本研究施肥处理中都施用了磷、钾肥有很大的关系。对土壤化学性质与细菌门水平丰富度的Spearman相关性(表7)分析发现,几乎所有的优势菌门都与土壤化学因子有一定的相关性,其中Gemmatimonadetes(芽单胞菌门)与土壤pH呈极显著正相关,它在各处理中的丰度为NPK处理低,CK和PK+5821处理处理高(图 2),这与所测的pH结果吻合;Proteobacteria(变形菌门)与土壤全氮呈极显著正相关,它在NPK和PK+5821处理中的丰度高(图 2),这与土壤全氮含量也是吻合的,表明土壤全氮可能是影响Proteobacteria丰度的重要因子。
4 结论
5年大豆连作下施肥明显改变了东北黑土的细菌群落结构,并在很大程度上改变了土壤的化学性状。全氮是影响土壤细菌群落结构变化的主效环境因子。对各施肥处理的综合分析表明,接种根瘤菌保持了良好的土壤细菌群落结构,明显提高了大豆产量,其固定的氮素能够在很大程度上减少化学氮肥的施用,在一定程度上缓解了土壤酸化,有利于大豆高效种植和农田土壤可持续利用。The authors have declared that no competing interests exist.
