0 引言
【研究意义】着色是鲜食葡萄重要的外观品质,不同品种有其独特的色泽特征,红色品种着色不足或着色过深都显著影响其经济效益。因此,开展鲜食葡萄着色调控的研究对指导葡萄生产具有重要意义。【前人研究进展】红色品种葡萄着色的物质基础是花青苷[1]。花青苷合成是通过类黄酮合成途径,受结构基因和调控基因的控制[2]。葡萄花青苷的合成从转色期启动,首先形成不稳定的花青素,后经糖苷化、甲基化和酰基化修饰,最终形成稳定的花青苷,并通过膜转运系统从细胞质进入液泡贮藏[3-6]。光是影响花青苷合成的重要因子[7],也是生产上调控果实着色的核心。一方面,可以通过套袋[8]、叶幕管理[9]、架遮阳网[10]和地面遮阴[11]等措施,削弱果实接受到的光照强度,减少花青苷合成,避免着色过深;另一方面,可以通过铺反光膜[12]和补光[13],提高果实接受到的光照强度,增加花青苷合成,促进果实着色。另外,LED补光和利用膜(袋)改变透射光或反射光光谱组成的研究表明光质对果实花青苷合成和内在品质也有很大影响[14-18]。植物对光信号的响应是复杂而精细的,目前已知植物有3种类型的光受体[19-20]:光敏色素感受红光/远红光(600—750 nm),隐花色素感受蓝光(400—450 nm)和UV-A(315—400 nm),UVR8感受紫外光UV-B(280—315 nm)。HY5和COP1是光受体下游信号元件,广泛参与了光形态建成和花青苷合成的调控[21]。光照条件下,HY5可以激活花青苷合成途径相关基因的表达,特别是CHS、DFR和LDOX,它们的启动子含有光响应元件[22-24],可以直接被光诱导表达;黑暗条件下,COP1可以泛素化降解HY5蛋白[25],从而抑制花青苷合成。【本研究切入点】葡萄套袋栽培可以改善果实外观品质,提高果面的光洁度,减少农药使用及降低农药残留,是环境友好型、优质化生产技术措施[26],但目前生产上使用的葡萄果袋仅仅改变了光照强度,光质选择透过型葡萄专用果袋的研究还处于起步阶段,果袋颜色对葡萄着色的影响及机理有待深入研究。【拟解决的关键问题】本研究以‘贝达’砧嫁接的鲜食葡萄主栽品种‘巨峰’为试材,在前期预试验的基础上,分析红色、绿色、蓝色和白色纸袋引起的光质差异对葡萄花青苷合成的影响,进一步分析花青苷合成途径结构基因VvCHS、VvLDOX、VvUFGT和调控基因VvmybA1以及光信号转录因子VvHY5表达量变化,以探明不同颜色果袋引起的光质差异对葡萄果实花青苷合成的影响及调控机理,为光质选择透过型葡萄专用果袋的研发提供理论依据。1 材料与方法
试验于2015—2016年在辽宁省兴城市中国农业科学院果树研究所葡萄课题组核心技术试验示范园进行。1.1 试验设计
以5年生‘贝达’砧‘巨峰’葡萄为试材。株行距0.8 m×4.0 m,斜干水平龙干形整形,树势中等,树盘覆盖黑色地膜,行间自然生草,田间土肥水和病虫害防治同常规。选择生长势相同的40株单株,从坐果后30 d(7月13日)开始套袋,每株随机选择大小相近的5串果穗分别进行不套袋(对照)、套白色纸袋、套红色纸袋、套绿色纸袋和套蓝色纸袋处理,从套袋日起每隔8 d采样一次,每个果穗采2—4个果粒,直到果实成熟(9月15日)结束。采样后立即剥取果皮,液氮冷冻后-75℃保存备用。1.2 果袋透光性测定
不同颜色果袋透射光谱分析使用StellarNet®微型光纤光谱仪。1.3 花青苷含量测定
花青苷含量的测定采用高效液相法。准确称取0.5 g果皮,用20 mL 1%的盐酸甲醇黑暗震荡提取24 h,37℃旋转蒸干,用1 mL 0.1%的盐酸水溶液回溶,过0.45 μm有机滤膜。HPLC条件:所用仪器为Thermo Scientific® QExactive高分辨液质联用仪,色谱柱为Acquity UPLC BEH C8(2.1 mm×50 mm,1.7 μm),流动相A液为乙腈,B液为1%甲酸水溶液。线性梯度洗脱:0→20 min,A液比例从6%→16%;30 min,A液比例为23.5%;40—45 min,A液比例为50%;46 min,A液比例降为6%。流速:0.3 mL·min-1。柱温28℃,进样量2 μL。PAD扫描波长范围200—600 nm。标准品测定:1 mg锦葵素-3-葡萄糖苷(Malvidin 3-O-glucoside)(北京索莱宝生物科技有限公司)溶于1 mL提取液,进一步稀释为0.1 mg·mL-1和0.01 mg·mL-1,分别上样测定。根据样品和标准品520 nm下的色谱图峰面积计算相对于锦葵素-3-葡萄糖苷的浓度。试验重复3次。1.4 基因表达量分析
果皮RNA的提取采用CTAB法。取2 μL RNA使用FastQuant RT Kit(With gDNase)试剂盒(天根生化科技(北京)有限公司)进行反转录。使用SuperReal PreMix(SYBR Green)试剂盒(天根生化科技(北京)有限公司)对花青苷合成基因VvCHS、VvLDOX、VvUFGT、VvMYBA1和光信号元件VvHY5的表达进行荧光定量分析。仪器为耶拿qTower 2.0荧光定量PCR仪,程序为:95℃ 15 min预变性;95℃ 10 s,60℃ 20 s,72℃ 20 s共40个循环;之后从60℃逐渐升温到95℃制作溶解曲线,升温幅度为6 s/℃。内参基因为葡萄看家基因Ubiquitin,所有引物使用Primer Premier 6.0进行设计,由生工生物工程(上海)股份有限公司合成。引物序列见表1。每个样品重复3次,相对表达量的计算采用2-ΔΔCT法[27]。Table 1
表1
表1葡萄花青苷合成相关基因和VvHY5的定量PCR引物序列
Table 1Quantitative PCR primer sequences of grape anthocyanin biosynthesis related genes and VvHY5
| 基因名称 Gene name | 正向引物(5′-3′) Forward primer | 反向引物(5′-3′) Reverse primer | 片段大小 Product size (bp) |
|---|---|---|---|
| VvUbiquitin | GCCAAGATCCAGGACAAGGAAGG | ACCACGAAGCCTCCGAACCA | 144 |
| VvCHS | TTTGGGCATCAAGGACTGGAACT | CGTGTCGTGTGGAGCGTAACT | 122 |
| VvLDOX | AGATACTATCGGTGCTATCGCTTGG | ATGTTGTGGAGGATGAAGGTGAGAG | 190 |
| VvUFGT | GCCTAACTCACTCTCCACCCATG | TTCCGAACACGATGCCTTCCTG | 155 |
| VvMYBA1 | GGGAGGTGAGGGTGATTTTCCATT | GGGAGTAGAGTATGAATGCAAGAAC | 140 |
| VvHY5 | AGAGGTGAGGGTCAAAGACTTGGA | CTCCTGCTTGCTGTGGTGTTCT | 120 |
新窗口打开
1.5 数据处理与分析
试验数据统计分析使用SPSS 20,单因素方差分析采用Duncan法,显著性水平设定为α=0.05。制图采用Microsoft excel 2003软件。2 结果
2.1 不同颜色果袋的透光性分析
由表2可以看出,不同颜色果袋的透射光谱不同。红袋、绿袋和蓝袋分别在红光(600—700 nm)、绿光(550—600 nm)和蓝光(400—500 nm)波段有较高透光率,而在其他波段透光率较低,说明红袋、绿袋和蓝袋对可见光的透过有选择性。白袋在各个波段透光率基本一致,说明白袋对光质的透过没有选择性。Table 2
表2
表2不同颜色果袋400-700 nm波段透射光谱分析
Table 2400-700 nm transmission spectrum analysis in different color fruit bags
| 袋型 Type of bag | 不同波段(nm)透光率Light transmittance of wavelength (%) | ||||||
|---|---|---|---|---|---|---|---|
| 400 | 450 | 500 | 550 | 600 | 650 | 700 | |
| 红袋 Red bag | 5.39 | 2.45 | 1.22 | 3.55 | 20.20 | 21.80 | 22.71 |
| 绿袋 Green bag | 5.55 | 4.57 | 7.84 | 15.15 | 10.97 | 8.56 | 10.32 |
| 蓝袋 Blue bag | 23.27 | 18.37 | 15.92 | 11.63 | 8.57 | 8.45 | 15.92 |
| 白袋 White bag | 23.14 | 22.90 | 22.65 | 22.14 | 22.81 | 22.80 | 22.90 |
新窗口打开
2.2 果皮花青苷含量分析
由图1可以看出,对照(不套袋)和白袋处理从7月29日开始快速积累花青苷,而绿袋和蓝袋处理从8月14日开始快速积累,红袋处理则是8月22日,说明红袋、绿袋和蓝袋明显推迟了葡萄的转色期。从转色期至8月30日,是花青苷快速积累期,不同纸袋处理的花青苷含量均低于对照,但不同纸袋处理间存在显著性差异,花青苷含量表现为蓝袋>绿袋>红袋。白袋处理虽然没有推迟转色期,但在8月30日花青苷含量低于蓝袋处理。果实发育后期(8月30日至9月15日),果皮花青苷积累量均表现为先下降后上升,且不同套袋处理及其与对照的差异发生变化,差距逐渐缩小,9月15日花青苷的积累量表现为蓝袋>白袋>对照>绿袋>红袋。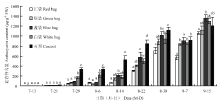 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同颜色果袋对花青苷合成的影响
图中所标不同小写字母表示差异显著(P<0.05)
-->Fig. 1Effect of different color fruit bags on anthocyanin biosynthesis
The different leter indicated extremely significant difference (P<0.05)
-->
2.3 花青苷合成相关基因表达量分析
由图2可知,套袋处理抑制或延缓了花青苷合成结构基因VvCHS、VvLDOX、VvUFGT和调控基因VvMYBA1表达量在果实发育早期的升高和后期的下降。在花青苷合成的初期(7月29日—8月6日),对照和白袋处理VvCHS、VvLDOX和VvUFGT的表达量均高于其他3种套袋处理;随着果实发育,红袋、绿袋和蓝袋处理VvCHS、VvLDOX和VvUFGT的表达量快速升高,表现为蓝袋>绿袋>红袋,在8月22—30日接近甚至超过对照和白袋,这与蓝袋、绿袋和红袋处理果皮花青苷含量的快速上升相一致(图1);8月30日后不同处理VvCHS、VvLDOX和VvUFGT的表达量均有所下降,特别是对照,9月7—15日对照的表达量持续下降(VvCHS和VvLDOX)或稳定在低值(VvUFGT),而4种纸袋处理的表达量依然较高,这可能是造成果实成熟后期套袋处理果皮花青苷含量接近甚至超过对照的原因。调控基因VvMYBA1的变化规律与结构基因VvCHS、VvLDOX和VvUFGT的变化规律基本一致,但VvMYBA1的表达高峰早于VvCHS、VvLDOX和VvUFGT,说明VvMYBA1对VvCHS、VvLDOX和VvUFGT的表达起重要的调控作用;另外VvMYBA1在9月7日后略有升高,说明葡萄在过熟期(9月15日后)可能会有第二次花青苷合成高峰。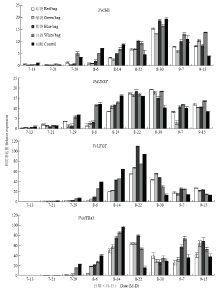 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同颜色果袋对花青苷合成相关基因表达量的影响
-->Fig. 2Effect of different color fruit bags on the gene expression of anthocyanin biosynthetic pathway
-->
2.4 光信号转录因子VvHY5表达量分析
VvHY5是光信号途径正调控因子。由图3可以看出,VvHY5在果实成熟过程中有两次表达高峰,分别在花青苷快速积累期(8月6—14日)和果实成熟后期(9月7—15日),这与花青苷的积累规律和合成调控基因VvMYBA1的表达规律基本一致(图1、图2)。8月14日前,4种纸袋处理VvHY5表达量均低于对照,其中白袋处理表达量最高,略低于对照,其次为蓝袋处理,红袋和绿袋处理表达量较低;8月14日后,4种纸袋处理及对照VvHY5的表达量均显著下降,特别是对照和白袋处理,8月22—30日蓝袋、红袋和绿袋处理VvHY5的表达量高于对照和白袋处理;9月7—15日VvHY5出现第二次表达高峰,其中蓝袋处理表达量最高,对照表达量最低。以上结果说明VvHY5可能是通过VvMYBA1参与了不同颜色果袋对葡萄果皮花青苷合成的调控,并且不同颜色纸袋对VvHY5的诱导效应不同。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同颜色果袋对光信号转录因子VvHY5表达量的影响
-->Fig. 3Effect of different color fruit bags on the expression of light signal transcription factor VvHY5
-->
3 讨论
越来越多的研究表明,光质调控是果实着色调控的有效手段。徐凯等[28]研究表明不同光质膜引起了‘丰香’草莓果实花青苷含量的差异,表现为红膜>蓝膜>黄膜>中性膜>绿膜;马策等[29]研究表明不同颜色果袋对‘云红梨2号’果皮花青苷组分没有影响,但明显改变了花青苷含量,表现为白袋>黄袋>红袋>蓝袋>紫袋>橙袋>绿袋,推测‘云红梨2号’可能是光敏色素型和紫外光反应型;张斌斌等[18]研究表明不同颜色无纺布果袋对‘夕空’桃果皮花青苷含量的影响不同,表现为白袋含量最高,其次是蓝袋和紫袋,黑袋含量最少。上述研究表明,改变果袋颜色是调控果实花青苷合成的简单有效的方法。本研究发现红色纸袋、绿色纸袋和蓝色纸袋改变了透射光的光谱组成,显著影响了‘巨峰’葡萄果皮花青苷含量,其中套蓝色纸袋花青苷含量最高,而套红色纸袋含量最低。这一结果与程建徽等[30]在‘红地球’葡萄上的研究结果基本一致。赵文东等[31]研究表明,补蓝光能明显提高延迟栽培‘巨峰’葡萄果实花青苷含量,而补红光效果较差。综合前人及本试验结果表明葡萄花青苷合成可能是蓝光诱导型。花青苷合成通过类黄酮合成途径,CHS是花青苷合成途径早期结构基因。拟南芥、芥菜、欧芹等植物中研究表明,CHS启动子含有光响应元件ACE(ACGT- containing element)和MRE(MYB recognition element),受紫外光和蓝光诱导表达[32-34];LDOX是花青苷合成途径晚期结构基因,GOLLOP等[35]研究表明葡萄LDOX的表达受光诱导,启动子序列分析发现有两个Unit I光响应元件,分别可以结合bZIP和MYB转录因子;UFGT催化花青素合成的最后一步,是葡萄花青苷合成的关键基因,仅在红色品种中表达[36];VvMYBA1是葡萄花青苷合成重要调控因子,可以调控CHS、LDOX和UFGT等结构基因的表达[37]。本研究中不同颜色果袋处理引起了花青苷合成结构基因VvCHS、VvLDOX和VvUFGT以及调控基因VvMYBA1的表达差异,在花青苷快速积累期,蓝袋和白袋处理表达量较高,绿袋处理次之,红袋处理较低,这可能是由于不同光质对葡萄花青苷合成基因表达的诱导能力不同。
不同波长的光被植物体内不同光受体感知,并通过光信号途径调控植物生长发育和次生物质代谢[19,38]。HY5编码一个bZIP类型的转录因子,是第一个被发现促进光形态建成的转录因子[39]。AZUMA等[40]研究表明葡萄VvHY5的表达受光诱导,并且果实不同发育阶段转录丰度不同。李慧峰等[41]研究表明苹果MdHY5能够被白光、蓝光、紫外光诱导,而红光对MdHY5表达没有明显诱导。但周波等[42]研究表明津田芜菁幼苗在UV-A、蓝光、红光和远红光照射下的BrHY5转录丰度几乎没有差异。本研究发现不同光质纸袋对‘巨峰’葡萄果皮VvHY5表达的诱导效应不同,在花青苷快速合成期表现为白袋>蓝袋>绿袋>红袋,说明葡萄VvHY5对光质的响应与苹果类似,白光和蓝光诱导能力较强,其次是绿光,红光效果最差。本研究还发现VvHY5在‘巨峰’葡萄果实发育过程中有两次表达高峰,分别在花青苷快速积累期和果实成熟后期,说明VvHY5的表达还与发育进程有关,且与花青苷的积累正相关。已有研究表明HY5可以诱导拟南芥花青苷合成转录因子MYB75/PAP1的表达[43]。本研究中VvMYBA1是拟南芥MYB75/PAP1的同源基因,其表达规律与VvHY5基本一致,说明不同颜色纸袋可能是通过光信号转录因子VvHY5调控VvMYBA1的表达,进而调控花青苷合成途径结构基因的表达,导致花青苷积累的差异。关于葡萄VvHY5对VvMYBA1的调控机制,有待深入研究。
4 结论
不同颜色果袋可以有效改变透射光的光谱特征,影响花青苷合成,调控葡萄着色。套蓝色纸袋最有利于花青苷合成,而套红色纸袋效果最差。不同颜色果袋对葡萄果实花青苷积累的调控可能是通过影响光信号转录因子VvHY5的表达,进而调控花青苷合成调控基因VvMYBA1和结构基因VvCHS、VvLDOX、VvUFGT等的表达,影响果皮花青苷的合成。The authors have declared that no competing interests exist.
