0 引言
【研究意义】甲烷(CH4)是大气中仅次于二氧化碳(CO2)的温室气体,其在百年时间尺度上对全球变暖的增温潜势是CO2的28倍[1],对温室效应的贡献达到20%左右。根据政府间气候变化专门委员会(IPCC)[1]的报道,自工业革命以来,大气中CH4等温室气体(GHG)的浓度不断上升,到2011年,大气中CH4的浓度达1 803 μg·L-1,并且每年以大约1.1%的速度增长,显示其源汇的不平衡。温室气体未来的变化、趋势对于预测未来气候变化及其对社会经济的影响至关重要[2]。因此,大气中CH4释放源的识别备受科学家的关注[3]。【前人研究进展】研究表明[4],大约50%的大气CH4是由水生生态系统贡献的。来自全球474个淡水生态系统和近期大量关于全球水区域的估算指出,同平均每年释放0.65 Pg C当量的CO2相比,淡水系统每年至少释放103 Tg的甲烷,抵消了陆地碳汇估算值的25%[5]。内陆水系(湖泊、水库、溪流和河流)是陆地甲烷重要的持续释放源,近年来,大量污染物通过地表径流、点源排入和其他方式进入河流,使河流系统成为一个巨大的碳汇。目前的研究认为河流CH4主要来自沉积物而不是水体本身[6],在水体沉积物的厌氧条件下,沉积物中的有机碳在产甲烷菌作用下分解生成CH4,然后分别通过沉积物-水界面、水-大气界面进入大气中[7]。河流水体溶存CH4浓度取决于CH4产生、氧化和排放之间的平衡,通常与DO呈负相关,与水温和DOC成正相关。河流水体CH4扩散通量则通常与水体溶存气体饱和度、水面风速以及水流速度呈正相关[8]。已有研究报道[9-12],由于有机物的降解作用,很多河流中的CH4处于过饱和状态,相对的,富碳河流也向大气中贡献更多的CH4[13-15]。河流中CH4的产生和氧化过程是微生物过程,受多个生物、化学和物理因素的控制,且一些环境因素存在明显的季节变异性[15-18]。鉴于此,研究较长时间尺度(1年或几年)上CH4循环对环境因素变化的反应十分必要。目前,关于河流溶存CH4浓度和扩散通量的研究还较少,河流系统中的甲烷负荷仍然不清楚[3]。国内外****对淡水系统溶存CH4浓度和扩散通量的研究空间上多集中在湖泊、入海河口和大型河流的个别点位,时间上则多集中在水体溶存甲烷浓度及扩散通量的日变化或某一季节的变化特征,缺乏在长时间尺度上对独立流域河流进行较为系统的研究。【本研究切入点】脱甲河为湘江的二级支流,具有独立的汇水系统,各等级河流有明显的差异,周围有大量稻田分布,为典型的亚热带农业小流域。本文选取脱甲小流域水系为研究对象,对其CH4浓度和扩散通量特性进行研究,【拟解决的关键问题】通过长期观测分析河流CH4扩散通量时空变化特征,统计分析环境因子与河流CH4扩散通量,探讨河流水体中CH4的产生机制。1 材料与方法
1.1 研究区概况
脱甲小流域位于湖南省长沙县金井镇境内,地处长沙、平江、浏阳、汨罗四县(市)的交界处,流域面积52.12 km2,地理坐标为27°55′—28°40′N,112°56′—113°36′E,海拔为56.0—434.8 m,为典型的红壤丘陵地貌。区内年平均气温17.2℃,年平均降水量1 200—1 400 mm,属中亚热带湿润季风气候。土地利用类型主要有稻田、茶园、果园、菜地和林地等5种。其中耕地(含茶园)以稻田、茶园和林地为主,分别占61.1%、4.5%和33.0%。除河流上游源头区域土地利用类型以林地为主,人类活动较少之外,河流沿途周围农业活动密布,河流渠道化严重,受农业面源污染明显。流域山溪性源头溪流特征以及人类活动影响的污染负荷效应均较为显著。1.2 样点布置
基于对脱甲小流域的实地考察,根据流域水系分级特征,采用Strahler Class河流分级方法[19],选择了4级河段作为研究对象:S1为金井伏岭一级河段,S2为金井伏岭和飞跃之间二级河段,S3为脱甲河飞跃段三级河段,S4为脱甲河下游四级河段。其分级思路为:最小不分支的河流属于第1级,当级别相同的河流交汇时,河网分级将升高,因此两条1级河流相交会创建一条2级河流,两条2级河流相交会创建一条3级河流,以此类推。分别在其上游(起始点附近)、中游和下游(与下一级河流交汇点)设定1个观测点,总共设置了12个采样点。每个采样点样品采集的位置为河流的中部位置,为保证观测精度,每个观测点进行3次重复取样。流域地理位置、水文特征及观测点详见图1。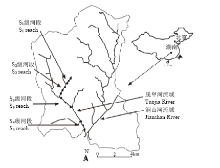 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1研究区域的位置及采样点分布
-->Fig. 1Location of the watershed and the distribution of sampling stations
-->
1.3 样品采集及检测
1.3.1 河水溶存CH4扩散通量 利用扩散模型法观测河水溶存CH4扩散通量。2014年4月13日至2015年4月12日一年周期内,于流域各级河段上中下游共12个观测点采集水样,重复3次,频率为每周1次,样品的采集工作在上午8:00—10:00时间内完成。采样时,先用水桶在样点位置河流中部0—20 cm深度范围内取水,然后用顶空60 mL医用注射器从水桶中的混合水体中抽取30 mL水样。水样在3 h内带回实验室,抽取30 mL高纯氦气(纯度>99.999%)注入水样注射器,使其中水样上方形成气室;在室温下将注射器剧烈震荡5 min,使溶解的CH4气体析出进入注射器上端;静置10 min,使气液两相达到平衡;最后将注射器上端的气体推入12 mL真空瓶,利用气相色谱(Agilent 7890A,美国)分析温室气体浓度C0。根据上一步提取的溶存CH4的浓度C0,计算水样中CH4原始浓度Cobs,计算公式如下[20]:
Cobs= C0×(βRT/22.4+ V0/ V1) (1)
式中,Cobs为平衡前水样的原始甲烷浓度(μmol·L-1);C0为平衡后测定甲烷的气相浓度(μmol·L-1);V0为平衡器气室的气体体积(30 mL);V1为平衡室气室的水样体积(30 mL);R为理想气体状态常数(0.082 L·atm·mol-1·K-1);T为平衡过程实际水温(K);β为CH4的Bunsen溶解系数(L·L-1·atm-1),通过公式(2)计算:
β=22.4×1016KH×Pg (2)
式中,KH表示平衡温度条件下CH4的Henry常数(μmol·L-1·atm-1);Pg为CH4纯气压力,即1 atm。
然后,根据Henry定律利用公式(3)和(4)计算当前大气气体分压与实际水温条件下纯水达到平衡时水体中甲烷浓度Ceq:
Ceq=KH×PA (3)
KH=KHθ×eKT (1/T-1/Tθ) (4)
式中,Ceq为当前大气的气体分压与实际水温条件下的纯水达到平衡时水体中甲烷的浓度;PA为甲烷气体的大气分压,约为2×10-6 atm;KH为采样时水温条件下的Henry常数(μmol·L-1·atm-1),其值由公式(4)根据实际水温计算确定。Tθ=298 K,T为实际水温绝对温度(K);KHθ为298 K和1 atm条件下的Henry常数,甲烷为1 308 μmol·L-1·atm-1;KT为表征Henry常数随温度变化的参数,甲烷取值为2 675。
在获得水样中甲烷原始浓度和平衡浓度后,分别根据公式(5)和(6)计算水气界面甲烷饱和度及释放通量。
Rr=Cobs/Ceq×100% (5)
Fs=c×kw×(Cobs-Ceq) (6)
式中,Rr为水体甲烷饱和度(%);Fs为水气界面甲烷释放通量(μmol·m-2·h-1);c为量纲转换系数;Kw为甲烷气体交换速率(cm·s-1),可根据测定的风速由经验公式计算得到(表1,表中U10为水体上方10 m高度的风速(m·s-1)),3种基于风速的计算模型分别来自Wanninkhof (1992,W92)、Liss and Merlivat (1986, LM86)和Raymond and Cole (2001,RC01)。释放通量Fs的数值为基于3种模型Kw值的计算结果的平均值。公式中甲烷的Sc数值由公式(7)利用水温(T,℃)数据计算。
Sc=2301.1-151.1×T+4.7364×T2-0.0059431×T2 (7)
式中,Sc为水的动力粘度与甲烷气体分子扩散速率之比,T为0—30℃范围内温度。
Table 1
表1
表1水-气界面气体扩散速率计算过程[
Table 1Computational process of diffusion rate at air-water interfaces
| 类别 Type | 公式 Formula | 风速 Wind U10 (m·s-1) |
|---|---|---|
| LM86 | Kw=0.17×U10(Sc/600)-2/3 | 0<U10≤3.6 |
| Kw=(2.85×U10-9.65)(Sc/600)-1/2 | 3.6<U10≤13 | |
| Kw=(5.9×U10-49.3)(Sc/600)-1/2 | U10>13 | |
| W 92 | Kw=0.31× | 短期风速 Short term wind speed |
| Kw=0.39× | 长期风速 Long term wind speed | |
| RC01 | Kw=1.91exp(0.35U10)(Sc/600)-1/2 | 任意风速 Arbitrary wind speed |
新窗口打开
1.3.2 河流水体环境因子监测 研究周期内,用ORION STAR A329pH/ISE/Conductivity/RDO/DO便携式多参数测量仪(Thermo Scientific公司,新加坡)对流域各级河段上中下游总共12个观测点进行现场水质检测,测量参数包括水温、溶解氧、pH、电导率、氧化还原电位。重复3次,频率为一周一次。另外,在每次气体取样的同时,于每个观测点采集表层水体(0—20 cm)水样,冷藏(1—4℃)或冷冻保存(-20℃)。冷藏保存的水样,直接用流动注射仪(FIA-500 star,福斯公司)测定铵态氮和硝态氮的质量浓度;用有机碳分析仪(TOC-vwp,岛津公司)测定DOC;冷冻保存的样品一个月集中测定一次,测定前先在冰箱冷藏室(4℃)条件下放置24 h进行解冻。
1.4 统计分析
数据统计分析和绘图使用R语言(version 3.1.3),首先对河流溶存CH4浓度和扩散通量及环境变量进行正态性检验(Shapiro-Wilk检验),包括CH4浓度和扩散通量在内的大部分变量不服从正态分布(P<0.05),从而采用非参数方法(Kruskal-Wallis秩和检验)对CH4浓度和扩散通量的时间及空间差异进行方差分析[21-22]。为研究影响河流CH4浓度和扩散通量的主要因素,首先对各环境因子与CH4浓度和扩散通量进行Spearman相关分析,寻找对CH4浓度和扩散通量具有显著影响的环境因子,然后分别以所得主要影响因子对CH4浓度和通量进行逐步回归。若无单独说明,均采用α=0.05显著性水平。2 结果
2.1 河流水质参数
研究周期内脱甲河水体NH4+-N、NO3--N和DOC浓度范围分别是:0.02—4.37(1.26±1.03)、0.24—2.66(1.43±0.55)和0.92—6.72(2.99±1.25)mg·L-1(图2)。其中,河流水体NH4+-N、NO3--N含量在冬季均处于较高水平(1.70±1.14、1.61±0.48 mg·L-1),而在夏季浓度较低(0.68±0.56、1.15±0.49 mg·L-1)。水体DOC含量则表现为秋季最高((3.29±1.33)mg·L-1),略高于春季((3.10±1.20)mg·L-1),冬季最低((2.84±1.15)mg·L-1)。脱甲河流域从上游到下游土地利用类型变迁特征可概括为农田面积及人类干扰活动的逐步增多,与此相对应的是污染负荷的逐渐升高。S2级河段所处区域周围人类活动的强烈干扰,尤其是畜禽养殖废水的排入,可能是导致该河段河流水体污染负荷尤其是NH4+-N含量((1.71±1.46)mg·L-1)急剧升高的原因,远大于源头区域((0.39±1.46)mg·L-1)。除NH4+-N含量在S2级河段急剧升高之外,河流水体硝态氮、DOC和盐度从S2级河段开始,变化幅度变小,河流污染负荷趋于稳定,呈缓慢增加的趋势。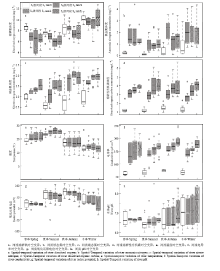 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2脱甲河环境因子时空变化
-->Fig. 2Temporal and spatial variation of environmental factors in Tuojia river
-->
水体pH在5.89—8.54(6.82±0.31)范围内波动变化,除在2014年11月下旬到2015年2月初时间段内呈弱碱性(7.68±0.44),其余时间内均表现为弱酸性(6.55±0.43)。水体温度在一年周期内的平均值为(19.04±6.25)℃,变化范围为5.49—29.36℃,但在4级河段之间无显著差异。另外水体DO浓度和电导率在一年周期内的变化范围分别是3.49—12.79(7.90±1.78)mg·L-1和50.36—248.43(138.37±47.54)μS·cm-1。
2.2 河流溶存CH4浓度和饱和度变化特征
图3为脱甲河河流溶存CH4浓度和饱和度在一年周期内的变化。脱甲小流域4级河段在一年周期内溶存CH4浓度变化范围为0.03—2.23(0.61±0.43)μmol·L-1。饱和度变化范围为1 335.23%—8 7802.57%(21 862.20%±15 685.31%),处于极高的过饱和状态。一年周期内,4级河段溶存CH4浓度和饱和度在空间上均呈现出显著的差异性(P<0.05),其中,CH4溶存浓度和饱和度在4级河段之间均值最大的均为S4河段((0.81±0.49)μmol·L-1,28 889.38%±16 4776.93%),均值最小的均为S1河段((0.18±0.11)μmol·L-1,6 757.51%±4 284.43%)。S3级河段溶存甲烷浓度((0.73±0.40)μmol·L-1)虽然大于S2级河段((0.71±0.35)μmol·L-1),但甲烷饱和度(25 538.92%± 12 907.34%)却小于S2河段(26 262.48%±15 106.81%)。另外,4级段河溶存CH4浓度和饱和度在不同季节之间也显示出了显著的差异(P<0.001)。脱甲小流域溶存CH4浓度和饱和度均表现为春季最大((0.74± 0.41)μmol·L-1,27 704.30%±16 520.53%),冬季最低((0.53±0.38)μmol·L-1,17 732.54%±12 505.60%),秋季大于夏季(秋:(0.67±0.50)μmol·L-1,22 490.15%±16 686.40%;夏:(0.55±0.41)μmol·L-1,22 151.04%±16 342.66%)。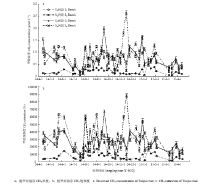 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3脱甲河CH4浓度和饱和度
-->Fig. 3CH4 concentration and saturation of Tuojia river
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4甲烷扩散通量时空变化特征
-->Fig. 4Temporal and spatial variation of CH4 flux
-->
Spearman相关分析显示(图5),在众多环境变量中,水体溶存CH4浓度与铵态氮、硝态氮、DOC、EC和pH呈显著正相关,与DO饱和度呈显著负相关。逐步回归分析显示脱甲小流域河流溶存甲烷浓度能更好的被水体DO饱和度、铵态氮和DOC模拟:
y=0.90-0.01×[DO]+0.14×[NH4+-N]+0.07×[DOC](R2=0.34,P<0.001)。
2.3 河流CH4扩散通量时空变化特征
脱甲河4级河段CH4扩散通量在一年周期内的变化为1.71—290.08(63.36±50.76)μgC·m-2·h-1,为CH4的净源(图4)。4级河段CH4扩散通量的季节趋势分析和非参数秩和检验显示,脱甲河小流域CH4扩散通量在研究周期内呈现出了明显的季节差异(Kruskal- Wallis秩和检验,P<0.001)。脱甲小流域CH4扩散通量在春季最高(93.58±65.24)μgC·m-2·h-1,其次是秋季(67.78±42.67)μgC·m-2·h-1和夏季(55.73±57.26)μgC·m-2·h-1,冬季(50.79±33.03)μgC·m-2·h-1,扩散通量最低。另外,除S1级河段CH4扩散通量季节变化表现为夏季>春季>秋季>冬季外,S2、S3、S4级河段CH4扩散通量的季节变化均与整个小流域季节变化的趋势一致。脱甲河小流域CH4扩散通量在四季中的贡献分别是:春季34.9%,夏季20.8%,秋季25.3%,冬季19.0%。一年周期内,4级河段CH4扩散通量的空间变异表现为S4>S3>S2>S1,通量最大的S4河段,其年均值为(82.39±47.37)μgC·m-2·h-1,远大于通量年均值最小的S1河段(17.70±11.84)μgC·m-2·h-1。另外,不同季节4级河段CH4扩散通量的空间变异分析显示,秋季和夏季4级河段CH4扩散通量的空间变异趋势与一年周期内的总趋势一致,而春季和夏季则表现为S2>S3>S4>S1。Spearman相关分析显示(图5),在众多环境变量中,CH4扩散通量与水体铵态氮、硝态氮、DOC和EC呈显著正相关,与DO饱和度呈显著负相关。逐步回归分析显示脱甲小流域河流CH4扩散通量能更好的被水体DO饱和度、铵态氮和硝态氮模拟:
y=133.49-1.28×[DO]+8.59×[NH4+-N]+18.57×[NO3--N](R2=0.24,P<0.001)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5甲烷浓度和扩散通量与环境变量间的相关矩阵
-->Fig. 5Scatterplot matrix among CH4 concentrations, fluxes and environmental variables
-->
3 讨论
3.1 河流溶存甲烷浓度及扩散通量比较
河流溶存CH4浓度和扩散通量都具有明显的时间和空间分布差异,不仅不同区域河流溶存CH4浓度和通量存在差异,在同一区域内,由于环境异质性等因素也会导致CH4通量和浓度的不同[23]。脱甲小流域河流溶存CH4浓度和扩散通量与国内外部分河流对比情况如表2,为方便比较,分别将CH4溶存浓度的单位换算为μmol·L-1,将CH4扩散通量的单位换算为μmol·m-2·h-1。水体溶存CH4浓度取决于甲烷产生和氧化的平衡,受流域水文、植被覆盖、微生物活动以及复氧速率的影响[24-25]。脱甲河CH4消耗的途径主要是水体微生物的氧化和水-气界面甲烷的扩散释放。UPSTILL-GODDARD等[24]通过对世界范围内20条河流甲烷浓度的数据进行整理,提出了一个较广泛的河流甲烷浓度范围:0.005—12 μmol·L-1。但已报道河流、河口甲烷浓度最高的是Adyar河,达153 μmol·L-1 [26]。脱甲河CH4扩散通量高于长江源头金沙江CH4通量,但是远低于三峡澎溪河和黄浦江上游和崇明岛河网CH4通量水平(表2)。现有研究显示,河流水体甲烷水-气界面的排放通量范围为0.1—6 701 μmol·m-2·h-1[4,27]。本研究脱甲河甲烷浓度和扩散通量的监测结果(0.03—2.23 μmol·L-1;1.71—290.08(63.36± 50.76)μmol·m-2·h-1)虽然落在此范围内,但其本身的浓度差异高达两个数量级,可能与所处人类和自然环境的变化有关。例如农田土壤水土流失、畜禽养殖和生活污水的排放等影响[4]。Table 2
表2
表2国内外河流CH4 溶存浓度和扩散通量对比
Table 2CH4 dissolved concentration and fluxes from the international and domestic rivers
| 位置 Site | 扩散通量 Diffused flux (μmol·m-2·h-1) | 溶存浓度 Dissolved concentration (μmol·L-1) | 研究时段 Time |
|---|---|---|---|
| 国内 Domestic | |||
| 长江徐六泾[3] Xuliujing Yangtze River | 28.79±12.15 | 0.16±0.09 | 2007.9-2008.8 |
| 澎溪河[30] Pengxi River | 1.2-530(均值Mean:110±95) | ||
| 黄浦江上游和崇明岛河网[33] The upper reaches of Huangpu River and Chongming Island river network | 778±59.8 | 0.30-6.66 | 2007.7 |
| 金沙江[31] Jinsha River | 0.18-5.80(均值Mean:3.23±2.35) | ||
| 长江三角洲上海地区和海河流域天津地区[6] Shanghai area of Yangtze River Delta and Tianjin area of Haihe River Basin | -1.36-665 | 0.04-25.3(均值Mean:0.86) | 2007.2-2007.3 |
| 珠江河口西部和南海北部[34] The west of the Pearl River Estuary and northern South China Sea | 珠江Pearl River:2.65±1.34 南海South China Sea:0.65±0.33 | 珠江Pearl River:0.007-0.17 南海South China Sea:0.002-0.006 | 2006.9 |
| 长江徐六泾[3] Xuliujing Yangtze River | 28.79±12.15 | 0.16±0.09 | 2007.9-2008.8 |
| 国外 Foreign | |||
| Amazon[18] | 192.71±36.46 | 1987.4 | |
| Gudena River[35] | 14.79 | 0.186-0.420 | 2000.2-2000.12 |
| Alsea River[9] | 8.08-184.90 | ||
| McKenzie River[9] | 3.13-9.38 | ||
| Willamette River[9] | 14.33-93.75 | ||
| Sitka River[36] | 16.93±3.91 | 2001.8-2002.7 | |
| Hudson River[10] | 350.00 | ||
| Lokka River[37] | 87.50 | ||
| Adyar River[26] | 0.1-2462.00 | 0.002-150 | 2003.8-2004.11 |
| Flood-gate Neuharlingersiel[25] | 0.83-8.49 | 2004 | |
| 本研究 | 总 Total:0.14-24.17(5.28±4.23) | 总 Total:0.03-2.23(0.61±0.43) | 2014.4-2015.4 |
| 春季 Spring:7.80±5.44 | 春季 Spring:0.74±0.41 | ||
| 夏季 Summer:4.64±4.77 | 夏季 Summer:0.55±0.41 | ||
| 秋季 Autumn:5.65±3.56 | 秋季 Autumn:0.67±0.50 | ||
| 冬季 Winter:4.23±2.75 | 冬季 Winter:0.53±0.58 |
新窗口打开
本研究发现,脱甲河溶存甲烷浓度和扩散通量在冬季均处于较低水平,与国内外众多研究的结果一致[26,28-29]。但是本研究结果中脱甲河溶存甲烷浓度及扩散通量最高均出现在春季,与大多数研究指出的河流、湖泊生态系统内CH4浓度及扩散通量冬低夏高的季节模式不一致[26, 28-29]。可能与研究区域降雨多集中在春季有关,降雨导致的河流水位上升能够为产甲烷菌创造更有利的缺氧环境[29],另外,脱甲河周边农田密布,降雨携带农田中大量的营养物质进入河流,导致河流污染负荷增高,可能也是脱甲河春季多雨季节甲烷浓度和扩散通量较高的原因。研究周期内,脱甲河4级河段甲烷扩散通量呈现从上游到下游波动增大的模式(图4),与大部分研究者研究的结果一致[30-32]。但是在不同季节,如夏季和秋季则表现为在S2河段扩散通量最大,可能与其水域生态系统特征、陆源污染输入等的季节变异有关[30]。
3.2 河流甲烷溶存浓度及扩散通量的影响因素
3.2.1 DO对河流CH4浓度及扩散通量的影响 脱甲河水系CH4浓度和扩散通量与水体DO均呈显著负相关(图5)。在水生态系统中,CH4由产甲烷菌产生于缺氧的河流沉积物中,先后通过沉积物-水、水-气界面扩散进入大气中,在扩散经过有氧的沉积物表层时,厌氧层产生的CH4超过90%可能因氧化而被消耗掉,而通过水体进入大气过程中CH4也会进一步被甲烷氧化菌氧化[29,33]。鉴于此,水体DO是控制河流CH4产生、传输和扩散的主要因子[38]。脱甲河春季水体DO浓度明显低于其他季节,而冬季水体DO含量最高。DO对河流水系CH4浓度及扩散通量的影响机制在于:一方面相对较低的DO条件能为沉积物创造有利的厌氧环境,可促进沉积物中产甲烷菌的活性,因而CH4产量变大;另一方面,水体中较低的DO含量,抑制了甲烷氧化菌的活性,水体对CH4的氧化能力减弱,使得CH4在水体传输过程中的消耗降低[34],这可能就是脱甲河小流域CH4浓度及通量春高夏低的原因之一。3.2.2 DOC对河流CH4浓度及扩散通量的影响 在水生态系统中,CH4主要产生于富含有机质的厌氧沉积物中,并通过沉积物-水界面交换扩散至水体[33,39],甲烷的产生过程依赖于有机物质的数量和性质、产甲烷菌的活性以及电子受体的有效性和性质[23],水体DOC含量能在一定程度上反映沉积物中有机质的含量状况。相关分析表明,脱甲河CH4浓度和扩散通量与水体DOC含量均呈显著正相关(图5)。水体中DOC含量与CH4排放通量的显著正相关关系已经被广泛报道[29, 40-41],有机碳既可以作为碳源直接促进CH4的产生,也可通过快速消耗环境中的O2来降低CH4的氧化量[29, 42]。本研究中各环境因子之间的相关分析也表明脱甲河水体DOC浓度与DO呈显著负相关(图5),支持了上述观点。但是也有研究表明,水体DOC中可能含有对产甲烷菌有害的黄酸[37],水体CH4扩散通量与DOC之间无明显相关关系[33, 43-44]。
3.2.3 氮素对河流CH4扩散通量的影响 本研究中,与河流溶存CH4浓度和扩散通量显著正相关的环境因子还有水体含氮水平(包括NH4+-N和NO3--N)(图5)。脱甲河CH4浓度及扩散通量与NH4+-N和NO3--N含量均呈显著正相关。较高的NO3-和NH4+可以抑制甲烷氧化酶的有效性,减少水体中CH4被氧化的量[6, 23]。另外,水体中的NH4+能够争夺甲烷氧化过程中最关键的酶(单-加氧酶),进而干扰甲烷的氧化[29]。丁维新等[45]指出氮肥对土壤中CH4产生的影响与土壤含氮水平、土壤性质(有机碳、C/N等)有关,氮对甲烷的产生具有一定的促进作用。但从理论上讲,产甲烷菌和甲烷氧化菌都是把NH4+作为氮源,其他形式的氮对甲烷的产生和氧化的影响都是间接的[23]。目前,对土壤环境中氮素对CH4通量的影响已有很多的报道[13],但是对于河流水体中氮素对CH4扩散通量的影响,报道还较少。沈李东[46]对水体亚硝酸盐型厌氧甲烷氧化(N-DAMO)微生物活动机制的研究,在一定程度上揭示了水体硝氮/亚硝氮含量对甲烷氧化过程的作用机制。
3.2.4 pH和EC对河流CH4浓度和扩散通量的影响 研究表明[23],水体pH主要是通过对产甲烷菌和甲烷氧化菌活性产生影响,从而影响河流溶存CH4浓度和扩散通量的。产甲烷菌对水体pH的变化较为敏感,大部分的产甲烷菌在pH为6—8的环境中才能进行产甲烷活动[29]。本研究检测的水样pH范围为5.89—8.54(均值6.82±0.31),几乎都处于产甲烷菌的最适pH生长范围内。因此,在脱甲小流域中水体pH对河流CH4扩散通量影响较弱(P>0.05),与河流溶存甲烷浓度呈正相关(P<0.05,r=0.20)。
许多研究表明[23, 29, 47-48],盐分对CH4产生潜力具有一定的抑制作用,主要原因可能是盐分增加了土壤中电子受体的数量以及高盐分下CH4微生物的活性受到抑制。但此结论大多是基于河口滨海湿地[3, 48]、红树林湿地等盐分较高且变异较大区域的结果,尤其是在河口地区观测到的水体CH4浓度随盐度增加而降低的现象,其原因是海水的稀释作用还是盐分对甲烷产生过程的影响仍存在争议[8]。关于淡水河流中盐度对河流CH4扩散通量影响的研究目前仍很少报道。本研究中,脱甲河小流域水体盐度对甲烷浓度和扩散通量都具有一定的正效应,呈显著正相关。
3.2.5 风速和水流流速对河流CH4扩散通量的影响 在水生生态系统气体扩散通量的计算中,气体传输速率k估测值的准确性仍是目前关注的关键性问题[8]。气体传输速率k值的估测可分为直接估测和间接估测。直接估测方法(如漂浮箱法)中遇到的问题在别的研究中已有讨论[20, 49]。在不稳定和流动水体条件下,间接方法(如模型法)被认为是更好的选择。目前用于估算气体传输速率k值的模型有基于风速的模型(如LISS and MERLIVAT, 1986;NIGHTINGALE et al., 2000;RAYMOND and COLE, 2001;RO and HUNT, 2006;WANNINKHOF, 1992)和基于水流流速的模型(如LANGBEIN and DURUM, 1967;O’CONNOR and DOBBINS, 1958;OWENS et al., 1964;WILCOCK, 1984),其估算的k值分别称为kwind和kcurrents。本研究使用的仍然是大多数研究采用的基于风速的k值估算模型LM 96、RC 01和W 92。由于风速的易变性和模型本身存在的缺点,使得k wind值在估算时存在不确定性,使用不同的模型计算出来的通量值可能存在一个数量级的差异[8]。因此本研究在计算CH4扩散通量时,分别计算了3种k wind估算模型条件下的扩散通量,然后取其平均值作为本研究中河流CH4扩散通量的值。尽管kwind和kcurrents之间存在更加复杂的关系,但有研究[7-8, 50]表明通过简单的线性公式ktotal = kwind + kcurrents能够得到更为有效的气体传输速率的估算值。RONALD S等[8]比较了单独使用kwind和使用kwind + kcurrents作为水体气体交换速率估算的气体扩散通量,发现前者估算的扩散通量值仅为后者的30%,说明了水流流速是影响水体气体交换速率的关键因子。同时表明脱甲河水体CH4扩散通量的实际值应大于本研究中基于风速模型估算的扩散通量值。然而到目前为止,很少有研究以kwind + kcurrents作为水体气体交换速率估算气体扩散通量[7,50]。鉴于此,为了更有效的对GHG进行估算,模型中气体交换速率k值的不确定性仍然是亟需解决的关键性问题。在这个问题解决之前,通过多重模型法对气体扩散通量进行估算将是比单独使用一种模型只产生一个单独的气体扩散通量估算值更为合适的方法。
4 结论
脱甲小流域作为典型的亚热带淡水小流域,在一年时间内水体中CH4持续处于过饱和状态,总体上表现为大气CH4的净源。脱甲河水系CH4扩散通量具有较大的季节和空间差异,时间上总体表现为春高冬低,空间上表现为随水流方向逐渐增加的趋势。环境因子主要通过影响CH4的产生和扩散过程最终影响CH4的浓度和扩散通量,DO、DOC、NH4+-N、NO3--N和盐度是控制河流溶存CH4浓度扩散通量的主导因素。水体DOC、NH4+-N、浓度和盐度与河流溶存CH4浓度及扩散通量均呈显著正相关,DO呈显著负相关。脱甲小流域水系CH4扩散通量最高能达到290.08 μgC·m-2·h-1,年均值为(63.362±59.415)μgC·m-2·h-1。作为淡水生态系统重要组成部分的河流生态系统,其溶存CH4浓度和扩散通量应该引起足够的重视。(责任编辑 杨鑫浩)
The authors have declared that no competing interests exist.
