0 引言
【研究意义】黄瓜靶斑病菌多主棒孢(Corynespora cassiicola)是半知菌亚门棒孢属(Corynespora)的植物病原真菌,其寄主范围十分广泛,可危害黄瓜、茄子、番茄、烟草、橡胶等多种蔬菜和经济作物。该病菌危害黄瓜叶片形成靶斑病,严重时也可侵染叶柄和茎蔓,已成为影响黄瓜生产的重要病害之一[1-2]。黄瓜炭疽病菌(Colletotrichum orbiculare)和丁香假单胞杆菌流泪病致病变种(Pseudomonas syringae pv. lachrymans)也是黄瓜上另外两个重要的病原菌,分别引起黄瓜炭疽病[3-4]和黄瓜细菌性角斑病[5]。黄瓜炭疽病从幼苗到成株期均可发病,严重时叶片干枯,茎蔓和叶柄染病;黄瓜细菌性角斑病主要危害叶片和瓜条。黄瓜靶斑病、炭疽病和细菌性角斑病早期在黄瓜叶片上常常会形成相似症状而难于区分,如黄瓜靶斑病在不同黄瓜品种上的早期症状表现为黄褐色小斑点,周围有时会有黄色晕圈,易与细菌性角斑病、炭疽病混淆[6],因此,生产上容易误将防治炭疽病或细菌性角斑病的农药用于靶斑病的防治,导致防治效果不佳,也耽误了正确用药的最佳时机。病害的早期防治对病害的发生及控制非常关键,因此在病害的发病初期进行准确快速的诊断具有重要意义。【前人研究进展】传统的病害诊断方法主要是根据植株的发病症状、病原的形态特征和柯赫氏法则[7-10],但是操作复杂、耗时,往往耽误病害防治的关键时期。近年来,PCR分子检测技术广泛应用于病害的诊断,使得病害诊断更加准确、快速、便捷[7],目前已经有利用多种PCR技术如常规PCR、实时荧光定量PCR和三重PCR快速分子检测黄瓜病原菌的报道。陈璐等[6]利用常规PCR特异扩增actin基因片段来检测黄瓜靶斑病菌;王伟青等[11]根据ITS序列开发出黄瓜靶斑病种子带菌的特异性PCR分子检测方法,可特异检测出带菌种子;高苇等[12]利用实时荧光定量PCR技术,建立了快速、准确、特异检测土壤中黄瓜靶斑病菌的方法;KUAN等[13-14]分别利用real-time PCR技术建立了特异检测炭疽病菌的方法;王哲等[15-16]分别利用PCR技术建立了快速检测黄瓜细菌性角斑病菌的方法;王楠等[17]利用三重PCR技术同时特异检测黄瓜炭疽病菌、菌核病菌和细菌性萎蔫病菌,提高了检测效率。【本研究切入点】上述研究主要是针对黄瓜靶斑病菌、炭疽病菌和细菌性角斑病菌中的单一病菌进行PCR分子检测,因此开发同时检测黄瓜靶斑病菌、炭疽病菌和细菌性角斑病菌的三重PCR特异检验方法可以提高黄瓜靶斑病、炭疽病和细菌性角斑病的早期诊断效率。【拟解决的关键问题】分别设计黄瓜靶斑病菌、炭疽病菌和细菌性角斑病菌的特异性引物,建立三重PCR检测方法并对其反应体系及反应条件进行优化,开发一种快速、灵敏的检测方法,为这3种病害的早期防控提供技术支持。1 材料与方法
试验于2014年9月至2015年12月在上海市农业科学院生态环境保护研究所完成。1.1 供试菌株
供试菌株的种名、来源及数量见表1,其中黄瓜靶斑病菌、炭疽病菌和细菌性角斑病菌为检测病菌。Table 1
表1
表1供试菌株
Table 1Fungal and bacterial strains used in this study
| 菌株Strain | 寄主Host | 来源Locality | 数量Number |
|---|---|---|---|
| 多主棒孢 Corynespora cassiicola | 黄瓜 Cucumber | SAAS | 3 |
| 黄瓜炭疽病菌 Colletotrichum orbiculare | 黄瓜 Cucumber | SAAS | 2 |
| 胶孢炭疽 Colletotrichum gloeosporioides | 草莓 Strawberry | SAAS | 3 |
| 丁香假单胞杆菌流泪致病变种 Pseudomonas syringae pv. lachrymans | 黄瓜 Cucumber | SAAS | 2 |
| 灰葡萄孢 Botrytis cinerea | 黄瓜 Cucumber | SAAS | 2 |
| 白粉菌 Sphaerotheca fuliginea * | 黄瓜 Cucumber | 发病叶片Infected leaf | 2 |
| 古巴假霜霉菌 Pseudoperonospora cubensis * | 黄瓜 Cucumber | 发病叶片Infected leaf | 3 |
| 链格孢 Alternaria alternata | 未知 Unknown | SAAS | 3 |
| 嗜酸菌西瓜亚种 Acidovorax citrulli | 西瓜 Watermelon | SAAS | 2 |
| 尖镰孢黄瓜专化型Fusarium oxysporum sp. cucumebrium | 黄瓜 Cucumber | SAAS | 3 |
| 串珠镰孢 Fusarium moniliforme | 水稻 Rice | SAAS | 4 |
| 新月弯孢霉 Curvularia lunata | 玉米 Maize | SJTU | 2 |
| 拟盘多毛孢 Pestalotiopsis clavispora | 草莓 Strawberry | SAAS | 2 |
| 辣椒疫霉 Phytophthora capsici | 辣椒 Pepper | SAAS | 2 |
新窗口打开
1.2 基因组DNA提取
1.2.1 病原真菌基因组DNA的提取 从上海田间新采集的黄瓜白粉病和黄瓜霜霉病发病叶片表面分别刮取专性寄生真菌白粉菌和古巴假霜霉菌孢子,参照HARJU等[18]的方法提取其基因组DNA。灰葡萄孢、链格孢、尖镰孢黄瓜专化型、新月弯孢霉、拟盘多毛孢、辣椒疫霉、串珠镰孢和胶孢炭疽等兼性寄生真菌分别在PDA平板上28℃黑暗培养7 d后,用接种针挑取适量菌丝,利用CTAB法[19]提取兼性寄生真菌基因组DNA。本文提取的所有基因组DNA均采用Infinite M200 PRO NanoQuant(TECAN,瑞士)进行浓度测定。1.2.2 病原细菌基因组DNA的提取 分别挑取黄瓜细菌性角斑病菌丁香假单胞杆菌流泪致病变种和瓜类细菌性果斑病菌嗜酸菌西瓜亚种单菌落接种于5 mL TSB培养基中,37℃振荡(200 r/min)培养至稳定期,参照SUO等[20]的方法提取其基因组DNA。
1.2.3 发病组织DNA的快速提取 黄瓜在温室大棚生长至16—18叶期时,分别接种黄瓜炭疽病菌和细菌性角斑病菌。采集发病早期即1级(病斑面积占整个叶面积的5%以下)或3级(病斑面积占整个叶面积的5%—10%)黄瓜炭疽病和细菌性角斑病的发病叶片,同时采集自然发病的1级或3级黄瓜靶斑病叶片和未发病的健康叶片。黄瓜靶斑病和炭疽病叶片病害分级标准参考国标GB/T 17980.112—2004,黄瓜细菌性角斑病叶片病害分级标准参考国标GB/T 17980.110—2004。从新鲜发病叶片和健康叶片上分别剪取等质量的发病组织和健康叶片,根据WANG等[21]的方法快速提取发病组织和健康叶片基因组DNA。
1.3 特异性引物设计
分别以多主棒孢、黄瓜炭疽病菌、灰葡萄孢、古巴假霜霉菌、白粉菌和链格孢等基因组DNA为PCR模板,用真菌ITS通用引物ITS1和ITS4[22]扩增它们的ITS序列。PCR反应体系为25.0 μL:2×HiffTM PCR plus Master Mix(With Dye)(上海翊圣生物科技有限公司)12.5 μL,ITS1/ITS4(10 μmol∙L-1)各1.0 μL,DNA模板2.0 μL,ddH2O 8.5 μL。PCR反应程序:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸45 s,35个循环;最后72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司进行序列测定。利用MEGA 4.0软件对上述各真菌ITS序列进行序列比对,再利用引物设计软件Primer Premier 5.0分别设计多主棒孢和黄瓜炭疽病菌的特异性引物(图1)。分别以丁香假单胞杆菌流泪致病变种及其近缘物种嗜酸菌西瓜亚种基因组DNA为PCR模板,用细菌16S rDNA通用引物F27/R1492[23]扩增其16S rDNA,PCR反应体系及条件同上。利用上述同样方法设计丁香假单胞杆菌流泪致病变种的特异性引物(图2)。本文所用引物序列如表2所示。
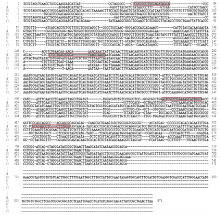 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1黄瓜靶斑病菌和炭疽病菌的特异引物设计
Ⅰ:多主棒孢 C. cassiicola;Ⅱ:黄瓜炭疽病菌 C. orbiculare;Ⅲ:古巴假霜霉菌 P. cubensis;Ⅳ:白粉菌 S. fuliginea;Ⅴ:灰葡萄孢 B. cinerea;Ⅵ:链格孢 A. alternata。方框Box:黄瓜靶斑病菌特异引物CC5F/5R和炭疽菌特异引物CL3F/5R的序列Sequences of specific primers CC5F/5R for C. cassiicola and CL3F/5R for C. orbiculare
-->Fig. 1Design of specific primers for C. cassiicola and C. orbiculare
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2黄瓜细菌性角斑病菌的特异引物设计
Ⅰ:丁香假单胞杆菌流泪致病变种 P. syringae pv. lachrymans;Ⅱ、Ⅲ:嗜酸菌西瓜亚种 A. citrulli。方框Box:黄瓜细菌性角斑病菌特异引物PS3F/4R的序列 Sequences of specific primers PS3F/4R for P. syringae pv. lachrymans
-->Fig. 2Design of specific primers for P. syringae pv. lachrymans
-->
Table 2
表2
表2引物及其序列
Table 2Primers used in this study
| 引物Primer | 序列Sequence (5'-3') | 靶标序列Target sequence | 来源Source |
|---|---|---|---|
| ITS1 | TCCGTAGGTGAACCTGCGG | 真菌ITS Fungus ITS | 文献[22] Reference [22] |
| ITS4 | TCCTCCGCTTATTGATATGC | 真菌ITS Fungus ITS | 文献[22] Reference [22] |
| F27 | AGAGTTTGATCCTGGCTCAG | 细菌16S rDNA Bacterium 16S rDNA | 文献[23] Reference [23] |
| R1492 | TACGGCTACCTTGTTACGACTT | 细菌16S rDNA Bacterium 16S rDNA | 文献[23] Reference [23] |
| CC5F | CGCCCCCTTCGAGATAGCA | 多主棒孢ITS C. cassiicola ITS | 本研究 This study |
| CC5R | GCCAATGCTTTTGAGGCGAGT | 多主棒孢ITS C. cassiicola ITS | 本研究This study |
| CL3F | CTTCTGAGTGGCACAAGCAAAT | 黄瓜炭疽病菌ITS C. orbiculare ITS | 本研究This study |
| CL5R | CGCAAAGGAGGCTCCGC | 黄瓜炭疽病菌ITS C. orbiculare ITS | 本研究This study |
| PS3F | GCGGCAGCACGGGTACT | 丁香假单胞杆菌流泪致病变种16S rDNA P. syringae pv. lachrymans 16S rDNA | 本研究This study |
| PS4R | TTCGCACCTCAGTGTCAGTATCA | 丁香假单胞杆菌流泪致病变种16S rDNA P. syringae pv. lachrymans 16S rDNA | 本研究This study |
新窗口打开
1.4 特异性引物筛选
分别以各病菌基因组DNA做PCR模板,筛选针对多主棒孢、黄瓜炭疽病菌和丁香假单胞杆菌流泪致病变种单一菌株的特异性引物。引物组合CC1F/ CC1R、CC2F/CC2R、CC3F/CC3R、CC4F/CC4R、CC5F/ CC5R分别扩增多主棒孢ITS;CL1F/CL1R、CL2F/CL2R、CL3F/CL3R、CL3F/CL4R、CL3F/CL5R、CL3F/CL6R、CL3F/CL7R分别扩增黄瓜炭疽病菌ITS;PS1F/PS1R、PS2F/PS2R、PS3F/PS3R、PS3F/PS4R、PS4F/PS3R、PS4F/PS4R分别扩增丁香假单胞杆菌流泪致病变种16S rDNA。PCR反应体系为25.0 μL:2×HiffTM PCR plus Master Mix(With Dye)12.5 μL,正向/反向引物(10 μmol∙L-1)各1.0 μL,DNA模板(2 ng∙μL-1)2.0 μL,ddH2O 8.5 μL。PCR反应程序:95℃预变性3 min;95℃变性30 s,65℃退火30 s,72℃延伸45 s,35个循环;最后72℃延伸10 min。PCR反应结束后,取6 μL PCR产物进行1%琼脂糖凝胶电泳检测。最终筛选出引物组合CC4F/CC4R和CC5F/CC5R可特异扩增多主棒孢ITS;CL1F/CL1R、CL2F/CL2R、CL3F/CL3R、CL3F/CL4R、CL3F/CL5R、CL3F/CL6R和CL3F/CL7R可特异扩增黄瓜炭疽病菌ITS;PS3F/PS4R和PS4F/PS4R可特异扩增丁香假单胞杆菌流泪致病变种16S rDNA。1.5 三重PCR反应体系建立及优化
1.5.1 引物组合的选择 引物组合CC5F/CC5R、CL3F/CL5R和PS3F/PS4R扩增片段的长度分别为370、275和698 bp,其混合产物可在3%琼脂糖凝胶上被有效分离,因此选择作为三重PCR引物。1.5.2 引物浓度优化 为了在同一三重PCR反应中使3个目的片段均得到有效扩增,需要对CC5F/ CC5R、CL3F/CL5R和PS3F/PS4R的浓度进行优化。在25 μL PCR反应体系中,设定CC5F/CC5R的3个浓度梯度为0.08、0.16和0.24 μmol∙L-1,CL3F/CL5R的3个浓度梯度为0.24、0.32和0.40 μmol∙L-1,PS3F/PS4R的3个梯度为0.16、0.24和0.32 μmol∙L-1。根据3对引物3个不同浓度梯度,设置18个引物用量组合(表3)。三重PCR反应体系为25.0 μL:2×HiffTM PCR plus Master Mix(With Dye)12.5 μL,CC5F/CC5R(10 μmol∙L-1) 0.2/0.4/0.6 μL,CL3F/CL5R(10 μmol∙L-1)0.6/0.8/1.0 μL,PS3F/PS4R(10 μmol∙L-1)0.4/0.6/0.8 μL,多主棒孢、黄瓜炭疽病菌和丁香假单胞杆菌流泪致病变种基因组DNA(2 ng∙μL-1)各2.0 μL,补加ddH2O至25.0 μL。三重PCR反应程序:95℃预变性3 min;95℃变性30 s,65℃退火30 s,72℃延伸2 min,35个循环;最后72℃延伸10 min。PCR反应结束后,取6 μL PCR产物进行3%琼脂糖凝胶电泳检测。
1.5.3 退火温度优化 设定65、66、67和68℃ 4个退火温度梯度。三重PCR反应体系为25.0 μL:2×HiffTM PCR plus Master Mix(With Dye)12.5 μL,CC5F/CC5R(10 μmol∙L-1)0.4 μL,CL3F/CL5R(10 μmol∙L-1)1.0 μL,PS3F/PS4R(10 μmol∙L-1)0.6 μL,多主棒孢、黄瓜炭疽病菌和丁香假单胞杆菌流泪致病变种基因组DNA(2 ng·μL-1)各2.0 μL,补加ddH2O至25.0 μL。三重PCR反应程序:95℃预变性3 min;95℃变性30 s,65/66/67/68℃退火30 s,72℃延伸2 min,35个循环;最后72℃延伸10 min。PCR反应结束后,取6 μL PCR产物进行3%琼脂糖凝胶电泳检测。
Table 3
表3
表3三重PCR反应体系中引物CC5F/CC5R、PS3F/PS4R和CL3F/CL5R的浓度
Table 3Concentration of CC5F/CC5R, PS3F/PS4R and CL3F/ CL5R used in triplex PCR
| 编号 Number | 引物浓度 Primer concentration(μmol∙L-1) | ||
|---|---|---|---|
| CC5F/CC5R | CL3F/CL5R | PS3F/PS4R | |
| 1 | 0.08 | 0.24 | 0.16 |
| 2 | 0.08 | 0.32 | 0.24 |
| 3 | 0.08 | 0.40 | 0.32 |
| 4 | 0.16 | 0.24 | 0.16 |
| 5 | 0.16 | 0.32 | 0.24 |
| 6 | 0.16 | 0.40 | 0.32 |
| 7 | 0.24 | 0.24 | 0.24 |
| 8 | 0.24 | 0.32 | 0.32 |
| 9 | 0.24 | 0.40 | 0.16 |
| 10 | 0.08 | 0.24 | 0.32 |
| 11 | 0.08 | 0.32 | 0.16 |
| 12 | 0.08 | 0.40 | 0.24 |
| 13 | 0.16 | 0.24 | 0.24 |
| 14 | 0.16 | 0.32 | 0.32 |
| 15 | 0.16 | 0.40 | 0.16 |
| 16 | 0.24 | 0.24 | 0.32 |
| 17 | 0.24 | 0.32 | 0.16 |
| 18 | 0.24 | 0.40 | 0.24 |
新窗口打开
1.5.4 延伸时间和循环次数优化 设定0.5、1、1.5和2 min 4个延伸时间;25、30、35、40和45次5个循环次数。最终确定最佳延伸时间为2 min,最佳循环次数为35次。
1.6 三重PCR特异性检测
根据多主棒孢、黄瓜炭疽病菌和丁香假单胞杆菌流泪致病变种基因组DNA的浓度,将3种病菌基因组DNA等量混匀。分别以多主棒孢、灰葡萄孢、古巴假霜霉菌、白粉菌、黄瓜炭疽病菌、丁香假单胞杆菌流泪致病变种和链格孢基因组DNA以及多主棒孢、黄瓜炭疽病菌和丁香假单胞杆菌流泪致病变种混合基因组DNA做模板,利用优化好的三重PCR反应体系和条件进行三重PCR,验证该三重PCR体系的特异性。1.7 三重PCR灵敏度分析
在25 μL反应体系中,将3种目标病菌基因组DNA模板浓度10倍梯度稀释至0.4 ng·μL-1、0.04 ng·μL-1、4 pg·μL-1、0.4 pg·μL-1、0.04 pg·μL-1、4 fg·μL-1、0.4 fg·μL-1和0.04 fg·μL-1。利用优化好的三重PCR体系和条件进行扩增,根据扩增产物的3%琼脂糖凝胶电泳结果确定三重PCR反应的灵敏度。1.8 黄瓜发病叶片DNA的特异检测
根据黄瓜靶斑病、黄瓜炭疽病和黄瓜细菌性角斑病发病叶片的基因组DNA浓度,将3种发病叶片基因组DNA等量混匀以及两两混匀,分别作为三重PCR特异检测体系的DNA模板,同时以健康叶片基因组DNA作为对照。利用优化好的三重PCR体系进行扩增,特异检测发病叶片中的黄瓜靶斑病菌、黄瓜炭疽病菌和黄瓜细菌性角斑病菌,验证该三重PCR特异检测体系。2 结果
2.1 引物组合CC5F/CC5R、CL3F/CL5R和PS3F/PS4R的特异性检测
CC5F/CC5R、CL3F/CL5R和PS3F/PS4R分别在多主棒孢、黄瓜炭疽病菌和丁香假单胞杆菌流泪致病变种基因组DNA中扩增出370、275和 698 bp的特异性目的片段,而在灰葡萄孢、古巴假霜霉菌、白粉菌、链格孢、嗜酸菌西瓜亚种、尖镰孢黄瓜专化型、新月弯孢、拟盘多毛孢、辣椒疫霉、串珠镰孢、胶孢炭疽等非目标病菌基因组DNA和阴性对照中没有扩增出条带(图3)。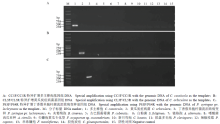 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3引物CC5F/CC5R、CL3F/CL5R和PS3F/PS4R的特异性检测
-->Fig. 3Specificity test of CC5F/CC5R, CL3F/CL5R and PS3F/PS4R primer pairs
-->
2.2 三重PCR反应体系及条件优化
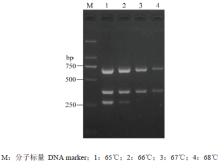
通过对三重PCR反应体系中引物CC5F/CC5R、CL3F/CL5R和PS3F/PS4R的浓度进行优化,发现25 μL反应体系中 CC5F/CC5R、CL3F/CL5R 和PS3F/PS4R的终浓度分别为0.16、0.4和0.16 μmol·L-1时能同时有效扩增3个目的片段(图4)。当三重PCR退火温度大于65℃时,部分目的片段不能有效扩增(图5)。最终优化的三重PCR反应体系:2×HiffTM PCR Plus Master Mix(With Dye)12.5 μL,CC5F/CC5R、CL3F/CL5R和PS3F/PS4R的终浓度分别是0.16、0.4和0.16 μmol·L-1,3种目标病菌基因组DNA模板(2 ng∙μL-1)各2.0 μL,补加ddH2O至25.0 μL;优化的三重PCR反应条件:95℃预变性3 min;95℃变性30 s,65℃退火30 s,72℃延伸2 min,35个循环;最后72℃延伸10 min。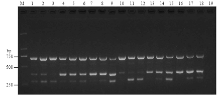 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4三重PCR引物浓度优化
M:分子标量DNA marker;1—18:引物CC5F/CC5R、CL3F/CL5R和PS3F/PS4R不同浓度组合,分别对应
-->Fig. 4Optimization for the concentration of primers used in triplex PCR
The combination of CC5F/CC5R, CL3F/CL5R and PS3F/PS4R with different concentrations corresponding to the number in
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5三重PCR退火温度优化
-->Fig. 5Optimization for the annealing temperature of triplex PCR
-->
2.3 三重PCR特异性检测
利用优化的三重PCR,同时扩增目标和非目标病菌基因组DNA,以检测该三重PCR扩增目标病菌基因组DNA的特异性。结果表明,该三重PCR可在目标菌株的混合或非混合基因组DNA中扩增出清晰的特异性目的条带,即在多主棒孢、黄瓜炭疽病菌和丁香假单胞杆菌流泪致病变种基因组DNA中分别扩增出长度为370、275和698 bp的特异条带,而在灰葡萄孢、古巴假霜霉菌、白粉菌、链格孢、嗜酸菌西瓜亚种、尖镰孢黄瓜专化型、新月弯孢、拟盘多毛孢、辣椒疫霉、串珠镰孢、胶孢炭疽等非目标病菌基因组DNA和阴性对照中没有扩增出条带(图6)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6三重PCR特异检测病菌
-->Fig. 6Specific detection of triplex PCR for pathogens
-->
2.4 三重PCR检测体系灵敏度分析
为了确定优化后三重PCR的灵敏度,将25 μL反应体系中多主棒孢、黄瓜炭疽病菌和丁香假单胞杆菌流泪致病变种基因组DNA的浓度从0.4 ng∙μL-1依次10倍梯度稀释至0.04 fg∙μL-1,并用优化的反应体系及条件进行扩增。结果表明,三重PCR同时扩增3个模板时,能够检测到0.4 pg∙μL-1的基因组DNA(图7)。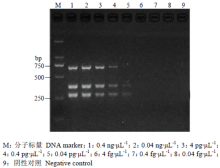 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7三重PCR灵敏度分析
-->Fig. 7Sensitivity assay of triplex PCR
-->
2.5 黄瓜发病叶片的三重PCR快速检测
在25 μL PCR反应体系中,分别以发病黄瓜叶片基因组DNA做模板,同时以多主棒孢、黄瓜炭疽病菌和丁香假单胞杆菌流泪致病变种等量混合基因组DNA做阳性对照,利用三重PCR特异检测这3种病菌。结果显示,在黄瓜靶斑病、黄瓜炭疽和黄瓜细菌性角斑病的黄瓜发病叶片基因组DNA中分别能扩增出长度为370、275和698 bp的特异片段,其长度与阳性对照一致,而在健康黄瓜叶片DNA和阴性对照中没有扩增出条带(图8),说明该三重PCR检测体系可以对发病叶片中的目标病菌进行特异检测,可以同时对黄瓜靶斑病、黄瓜炭疽病和黄瓜细菌性角斑病进行早期快速分子诊断。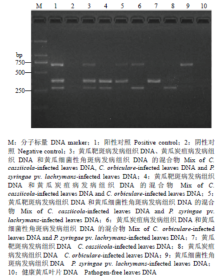 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8三重PCR特异扩增病菌侵染的黄瓜叶片DNA
-->Fig. 8Specific amplification for the mix of pathogen-infected cucumber tissues DNA by triplex PCR
-->
3 讨论
多重PCR主要应用于多种病原微生物的同时检测,具有省时、成本低、效率高的优点[24]。黄瓜靶斑病、炭疽病和细菌性角斑病在症状上存在相似之处,在病害诊断上容易将这3种病害混淆。此外,针对单一病害的分子检测不能快速、准确对病害进行甄别,往往错用防治药剂或耽搁病害的最佳防治时期。因此,亟需开发一种同时检测这3种病害的多重PCR检测技术。目前,针对瓜类黑星病菌、枯萎病菌和蔓枯病菌以及黄瓜炭疽病菌、菌核病菌和细菌性萎蔫病菌的三重PCR检测已经有报道[17,25],但针对黄瓜靶斑病菌、炭疽病菌和细菌性角斑病菌的三重PCR检测方法未见相关报道,只是对单一病菌进行特异分子检测[6,16]。多重PCR体系中存在两对以上引物,因此必须保证多对引物之间不形成引物二聚体;同时又要确保扩增产物的片段长度不能太接近,否则难以在琼脂糖凝胶上得到充分的分离;由于在扩增时不同引物对之间竞争其他反应组分,必须对反应体系中不同引物对的浓度进行优化 [26]。除了引物之外,Taq DNA聚合酶、dNTP、MgCl2、退火温度、延伸时间和循环次数等对多重PCR结果也均有影响[24,26]。为了简化多重PCR操作过程,本试验选用2×HiffTM PCR Plus Master Mix来替代Taq DNA聚合酶、dNTP和MgCl2,不需要对Taq DNA聚合酶、dNTP和MgCl2进行优化。因此本试验对引物浓度、退火温度、延伸时间和循环次数进行了优化,摸索出可同时检测黄瓜靶斑病菌、黄瓜炭疽病菌和黄瓜细菌性角斑病菌最优的三重PCR反应体系及条件。
该三重PCR检测体系的灵敏度可达0.4 pg·μL-1,与高永洋等(1 pg·μL-1)[25]和王楠等(0.4 pg·μL-1)[17,27]开发的三重PCR检测方法接近,处于同一数量级上;比陈璐等(4 pg·μL-1)[6]的黄瓜靶斑病菌PCR检测方法高1个数量级,但比王伟青等(50—100 fg·μL-1)[11]的黄瓜靶斑病种子带菌PCR分子检测低约1个数量级,可能是由于引物扩增效率和引物扩增序列的拷贝数不同导致这种差异[28]。
4 结论
三重PCR反应体系25 μL:12.5 μL 2×HiffTM PCR Plus Master Mix(With Dye),0.16 μmol∙L-1 CC5F/ CC5R、0.4 μmol∙L-1 CL3F/CL5R和0.16 μmol∙L-1 PS3F/ PS4R;三重PCR反应程序:95℃预变性3 min,35个循环(95℃变性30 s,65℃退火30 s,72℃延伸2 min),最后72℃延伸10 min。该检测体系可在4 h内从田间病株叶片中检测出黄瓜靶斑病菌、炭疽病菌和细菌性角斑病菌,其灵敏度可达0.4 pg·μL-1。The authors have declared that no competing interests exist.
