0 引言
【研究意义】低温胁迫是严重影响植物生长和存活的主要逆境之一[1]。棉花的整个生育期均对低温比较敏感,特别是苗期更容易遭受低温冷害,低温对棉花生长的影响远大于其他作物[2]。因此,挖掘棉花抗冷相关功能基因,对开展棉花抗冷分子育种具有重要意义。【前人研究进展】植物具有很高的能力适应外界环境条件的变化,在面临低温胁迫时会产生一系列的生理生化和基因表达变化,植物响应低温胁迫的最初反应是细胞质中钙离子的释放[3];其次是伴随着大量基因的表达,细胞内会诱导合成一系列的功能蛋白,以保护其免受胁迫的伤害[4],植物应对细胞脱水的一条主要途径是积累亲水性蛋白。LEA(late embryogenesis abundant proteins)蛋白,即胚胎发育后期丰富蛋白[5],是一类重要的植物细胞脱水保护蛋白。大量研究表明,LEA蛋白在植物响应各种逆境胁迫中起着重要作用,其首先在棉花子叶中被发现[6],根据其氨基酸序列及其保守域特征,将LEA蛋白分为6类(Ⅰ—Ⅵ),其中,脱水素(dehydrin,Dhn)属于第Ⅱ类,又名LEAⅡ蛋白,研究表明脱水素具有很强的热稳定性,在非生物逆境胁迫条件下对维持植物细胞的正常代谢和细胞膜结构稳定性具有重要的保护功能[7]。脱水素最基本的功能是清除细胞内自由基,保护细胞能正常行使功能[8],甚至对植株整个蛋白质组进行保护[9]。近年来,研究人员对植物响应低温胁迫过程中脱水素的功能开展了一系列的研究,KOSOVÁ等[10]研究表明经过低温胁迫后,10个大麦品种中Dhn5的积累量与其抗冻能力成正相关;郭鹏等[11]利用Northern杂交分析表明,番茄脱水素基因SlDHN2b受冷胁迫处理后在番茄根、茎、花蕾、果实、叶中的表达量均高于其常温(25℃)条件下在相应组织的表达量。在小麦的脱水素研究中发现,小麦脱水素基因TaDHN-1通过依赖ABA非生物胁迫响应路径发挥功能,参与了小麦对低温等逆境胁迫的调节过程[12];PUHAKAINEN等[13]在拟南芥中同时过量表达几个拟南芥脱水素基因后,在转基因植株中积累了大量的脱水素,与野生型对照相比,转基因植株在面对冻害胁迫时表现出较低的半致死温度和较高的存活率,同时证明了脱水素基因通过保护细胞膜来提高植物的抗冷性。高粱脱水素基因SbDhn2在高粱遇到低温胁迫时能够保护细胞内乳酸脱氢酶行使正常功能,增强其他蛋白酶的抗逆性[14]。在啤酒酵母(Saccharomyces cerevisiae)中过表达马铃薯Y2K型脱水素LEA4后,酵母的抗冻性大大增强[15]。SWIRE-CLARK等[16]在酵母中异源表达LEA/DHN后,发现LEA/DHN的主要功能是通过增强抗渗透胁迫能力来提高冷胁迫的能力。【本研究切入点】在笔者前期研究中,系统分析了棉花叶片低温转录组差异基因,获得了一批与抗冷性密切相关的候选基因,在这些候选基因中,有一个被注释为脱水素基因(CotAD_58358),关于该基因在棉花中对低温等非生物胁迫的响应及调控机制鲜见报道。【拟解决的关键问题】本研究分析棉花脱水素基因及其编码蛋白的结构特性,构建植物表达载体,研究其亚细胞定位,在转录组测序水平和实时荧光表达水平检测该基因受低温胁迫过程中在根、茎叶中的表达模式,为在棉花抗冷分子育种中进一步应用奠定基础。1 材料与方法
1.1 试验材料及其培养和低温处理
所用材料为陆地棉品种豫2067和衡棉3号,由中国农业科学院棉花研究所提供。于2015年9月在中国农业科学院棉花研究所抗逆鉴定实验室恒温光照生长箱中进行育苗,采用沙培法育苗(28℃,14 h光照/10 h黑暗),正常水分条件(沙土相对含水量约23%)下进行棉花的培养,在三叶期进行4℃处理0 h(CK,即28℃)和24 h;对抗冷材料豫2067分别取根、茎、叶,其中根取样部位是须根,茎取样部位是下胚轴,叶片取样部位是真叶的倒一叶,对冷敏感品种衡棉3号只取叶片,取样部位为倒一叶,每部位均取若干重复,剪碎,迅速放入液氮中速冻,然后放入-80℃超低温冰箱中保存备用。衡棉3号的叶片用于实时荧光定量分析,豫2067的一部分根、茎、叶样品用于实时荧光定量分析,在棉花生物学重点实验室进行;另一部分的叶片和根用于转录组测序,由深圳华大基因公司完成。同时对豫2067三叶期进行低温不同时间(4℃,0、0.5、2、4、6、8、12和24 h)处理,其中0 h为对照,取样部位为倒一叶和根系,用于实时荧光定量分析。
1.2 RNA的提取和全长GhDHN1的CDS序列克隆
利用北京艾德莱生物科技有限公司生产的EASYspinPlus植物RNA快速提取试剂盒对以上所取样品进行RNA提取,利用Nanodrop2000核酸分析仪测定总RNA的浓度和纯度,A260/280=2.0,同时进行1%(m/v)琼脂糖凝胶电泳检测RNA的完整性。在棉花基因组Cotton Genome Project (CGP,http://cgp. genomics.org.cn/page/species/index.jsp)中搜索到的脱水素(dehydrin,Dhn)基因(CotAD_58358)的CDS序列,利用Primer5软件设计特异引物,上游引物为GhDHN1-F:5′-ATGGCCGAGGAGCATACCAGTA-3′,下游引物为GhDHN1-R:5′-TCAAGCCTTTTCTTTT TCTTCA-3′。利用PrimeScript RT Reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa,China)将豫2067叶片RNA反转录合成第一链cDNA,以反转录获得的棉花cDNA为模板,扩增GhDHN1全长cDNA序列。所用的PCR程序为94℃ 5 min;94℃ 40 s,54℃ 40 s,72℃ 40 s,30 cycle;72℃ 10 min。扩增产物采用1%琼脂糖凝胶电泳(m/v)进行检测。PCR产物采用Omega PCR产物纯化试剂盒进行纯化。然后将目的基因与PMD-19载体连接,转化至大肠杆菌感受态细胞DH5α,倒置培养过夜,挑取白色单克隆,进行PCR检测,并且测序进行验证。测序由苏州金唯智科技有限公司北京分公司完成。1.3 棉花GhDHN1的生物信息学分析
1.3.1 棉花GhDHN1蛋白质的等电点、分子量及结构域的预测 用Protparam(http://web.expasy.org/ protparam/)在线程序分析蛋白质的分子量和等电点,ProtScale(http://web.expasy.org/protscale/)预测亲疏水性,利用ScanProsit、SMART(http://smart.embl- heidelberg.de/)、CCD(http://www.ncbi.nlm.nih.gov/ Structure/cdd/wrpsb.cgi)、PROSITE(http://prosite. expasy.org/)网站对基因进行蛋白质结构域预测,确定该基因所属蛋白家族,SOPMA(https://npsa-prabi. ibcp.fr/cgi-bin/secpred_sopma.pl)分析蛋白的二级结构,NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/ NetPhos/)程序预测磷酸化位点。1.3.2 棉花GhDHN1与其他几个物种DHN1进化树分析 在NCBI上查找葡萄(Vitis vinifera,NP_001268221.1)、可可(Theobroma cacao,XP_007017965.1)、拟南芥(Arabidopsis thaliana,CAA62449.1)、柑橘(Citrus sinensis,NP_001275806.1)、高粱(Sorghum bicolor,AGS16688.1)、苹果(Malus domestica,AFG33211.1)、玉米(Zea mays,NP_001105419.1)、山杨(Populus davidiana,ABS12334.1)、白骨壤(Avicennia marina,A8CVF3.1)、油茶(Camellia oleifera,ACF72673)、小麦(Triticum aestivum,AF453444_1)、葡萄柚(Citrus ×paradisi,AAN78125.1)等12个物种DHN1的蛋白序列,分别命名为VvDHN1、TcDHN1、AtDHN1、CsDHN1、SbDHN1、MdDHN1、ZmDHN1、PdDHN1、AmDHN1,CoDHN2、WZY1-1、CpDHN,利用在线工具ClustalW2和MEGA5.0对不同物种的DHN1全长蛋白质序列进行多序列比对,使用邻接(Neighbor- Joining,NJ)法建树,用MEGA软件生成系统进化树。
1.3.3 棉花GhDHN1染色体定位以及基因结构分析 分别在棉花基因组中获得GhDHN1(CotAD_58358)的CDS、cDNA全长序列和基因组序列,将cDNA序列作为查询序列与整个陆地棉AD基因组进行比对,获得GhDHN1在染色体中的位置;利用在线软件Gene Structure Display Server(GSDS2.0,http:// gsds.cbi.pku.edu.cn/)将GhDHN1的cDNA与其对应的基因组DNA序列进行比对,确定GhDHN1的外显子/内含子结构。
1.4 pBI121-GhDHN1::GFP荧光瞬时表达载体的构建及洋葱表皮细胞中的亚细胞定位分析
利用http://bioinfo.clontech.com/infusion在线设计In-Fusion引物(上游引物为InGhDHN1-F:5′-CACGG GGGACTCTAGAATGGCCGAGGAGCATACCAGTA-3′,下游引物为InGhDHN1-R:5′-AGGGACTGACCA CCCGGGTCAAGCCTTTTCTTTTTCTTCA-3′,下划线为酶切位点),以GhDHN1质粒为模板进行扩增。选择的酶切位点为XbaⅠ和SmaⅠ,对植物表达载体pBI121::GFP进行双酶切,采用In-Fusion连接技术构建融合蛋白瞬时表达载体pBI121-GhDHN1::GFP,转化至大肠杆菌DH5α感受态细胞,挑选阳性克隆进行测序,同时选用限制性内切酶BglⅡ和XhoⅠ验证插入位点后提取质粒。将洋葱切成1—2 cm的小块,用基因枪GDS-80(购自美国Wealtec Corp)活体转化技术将pBI121::GFP质粒和pBI121-GhDHN1::GFP质粒分别轰入洋葱内表皮细胞,把转化后的洋葱贴在MS培养基上,暗处室温过夜培养。用镊子轻轻撕下转化后的洋葱内表皮放在载玻片上,在激光共聚焦显微镜FV1000(日本Olympus)下观察。
1.5 基于转录组测序的GhDHN1表达分析
GhDHN1受低温胁迫后的转录表达分析在陆地棉豫2067三叶期的真叶和根中进行,低温处理为4℃,24 h,对照为4℃处理0 h(28℃),取样部位是倒一叶和根系。为了评价基因表达水平,将获得的GhDHN1序列上的序列读数转换为RPKM[17],公式如下:RPKM=106C/(NL/103)
式中,C指的是唯一比对到转录组的读长的数量,N是指唯一比对到一个特定样品上的读长的总数,L是指转录本中的碱基数。
1.6 三叶期棉花幼苗低温胁迫后GhDHN1的实时荧光定量分析
利用PrimerPremier5.0设计GhDHN1的荧光定量引物(上游引物为GhDHN1-F:5′- GTTAGCGGTGAA GGAGCAGT-3′,下游引物为GhDHN1-R:5′- ACTCGG TTACGATCACCTCC-3′),以Gossypium hirsutum Histone-3(Accession No.:AF024716)作为反应中的内参基因进行实时荧光定量PCR,PCR程序设定为94℃ 30 s;94℃ 5 s,55℃ 34 s,72℃ 34 s,共40个循环,所用仪器为7500 Real Time PCR System。实时荧光定量PCR结果分析参考AFRIN等[18]所报道2-ΔΔCt方法,每处理3个生物学重复,3个技术重复,结果用于平均数统计和方差分析。2 结果
2.1 GhDHN1的克隆
在前期的转录组试验中,发现一个注释为脱水素的基因受4℃低温胁迫后在棉花叶片和根中均上调表达,推测其与棉花的抗冷性有一定的相关性。根据棉花基因组Cotton Genome Project(CGP,http://cgp.genomics. org.cn/page/species/index.jsp)序列中搜索到的脱水素(dehydrin,Dhn)基因的CDS全长序列,在其两端设计引物,以棉花豫2067叶片的cDNA为模板,扩增出GhDHN1的完整CDS序列(图1)。得到的阅读框长度为636 bp,测序结果正确。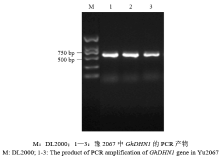 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1GhDHN1的扩增PCR产物
-->Fig. 1The product of PCR amplification of GhDHN1 gene
-->
2.2 棉花GhDHN1蛋白质的等电点、分子量及二级结构域的预测
GhDHN1蛋白质编码211个氨基酸,预测分子量为23.79 kD,等电点为5.04,富含谷氨酸(26.10%)和赖氨酸(19.40%),不含色氨酸,符合植物脱水素的一般特性(图2-A)[19]。带负电荷的酸性氨基酸(Asp+Glu)有61个,带正电荷的碱性氨基酸(Arg+Lys)有43个,该蛋白呈酸性且带负带荷,半衰期约为30 h,不稳定指数为70.27。分析GhDHN1蛋白的亲疏水性发现,蛋白中亲水性氨基酸明显多于疏水性氨基酸(图2-B),亲水性平均系数(GRAVY,Grand average of hydropathicity)为-1.53,属亲水性蛋白。SOPMA分析结果(图2-C)表明,α螺旋(alpha helix)包含116个氨基酸残基,占54.98%,组成该蛋白的主体结构;无规则卷曲(random coil)的氨基酸残基有87个,占41.23%;β片层(β-sheet)包含氨基酸残基5个,占2.37%;β-转角(beta turn)包含3个氨基酸,占1.42%,推测该蛋白的结构功能域可能主要由α螺旋构成。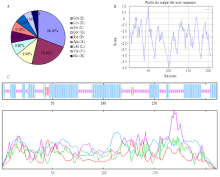 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2GhDHN1蛋白结构分析
A:氨基酸组成;B:亲疏水特性分析;C:二级结构预测
-->Fig. 2Protein stucture analysis of GhDHN1 protein
A: Compositions of amino acids; B: Hydrophobicity and hydrophilicity analysis; C: Secondary structure prediction
-->
2.3 棉花GhDHN1的染色体定位、基因结构分析和功能结构域分析
在棉花基因组Cotton Genome Project (CGP,http://cgp.genomics.org.cn/page/species/index.jsp)中对陆地棉AD基因组信息分析,结果表明,GhDHN1位于陆地棉D亚组第9染色体(Dt_chr9)上的54183731—54184456(+),全长726 bp;基因结构分析表明,GhDHN1在cDNA的259—348位置上含有一个长度为90 bp的内含子,2个外显子长度分别为258 bp和378 bp(图3)。利用SMART(http://smart.embl-heidelberg.de/)、CCD(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb. cgi)、PROSITE(http://prosite.expasy.org/)对棉花GhDHN1进行功能结构域分析可知,该氨基酸序列在C端含有2个保守的富含赖氨酸片段PS00823(KIKEKLPG,位于151—158;KIKEKLPG,位于192—199),在N端一个保守的富含丝氨酸片段PS00315(SSSSSDEEEGEGEEKKKKKK,位于84—103),具有亲水素蛋白结构域pfam00257(位于14—160和143—201),属于K2S型脱水素蛋白的典型结构。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3棉花GhDHN1内含子-外显子结构分析
-->Fig. 3The intron-exon organization of cotton GhDHN1 gene
-->
2.4 棉花GhDHN1编码蛋白的磷酸化位点预测
利用在线软件NetPhos 2.0 Server预测GhDHN1编码蛋白的磷酸化位点(图4)。结果表明,GhDHN1蛋白主要含有16个丝氨酸(Serine)磷酸化位点(分别在第7、14、17、24、79—88、127、167、183、202、204位点)、5个苏氨酸(Threonine)磷酸化位点(第6、48、48、126、142位点)、1个酪氨酸(Tyrosine)磷酸化位点(第207位点)。由此推测GhDHN1蛋白的活性可能与其磷酸化调控有关。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4棉花GhDHN1蛋白的磷酸化位点预测
-->Fig. 4Protein phosphorylation sites prediction of GhDHN1 protein
-->
2.5 棉花GhDHN1编码蛋白与其他植物亲水素蛋白的进化分析
在NCBI上查找到12种植物的亲水素蛋白序列(详见方法1.3.2),采用MEGA5.0邻接法与陆地棉GhDHN1蛋白序列对比并建立无根系统进化树,结果表明,陆地棉GhDHN1蛋白序列与可可亲缘关系最近,其序列一致性为78.70%,其次与柑橘、葡萄柚、山杨的脱水素蛋白亲缘关系也比较近,一致性分别为61.10%、61.40%和63.40%;与拟南芥、玉米、高粱、葡萄、苹果、小麦、油茶、白骨壤等物种的亲水素蛋白的亲缘关系较远(图5),推测棉花脱水素基因的功能可能与木本植物中脱水素基因功能相似。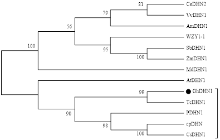 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5棉花GhDHN1蛋白与12个植物DHN1蛋白的进化树分析
-->Fig. 5Phylogenetic tree analysis of GhDHN1protein and 12 plant DHN1 proteins
-->
2.6 pBI121-GhDHN1::GFP荧光表达载体的酶切验证
利用pBI121作为瞬时表达载体,利用限制内切酶XbaⅠ和SmaⅠ,将GhDHN1插入植物表达载体pBI121::GFP中,构建融合蛋白瞬时表达载体,转化至大肠杆菌DH5α感受态细胞,挑选阳性克隆进行测序,序列比对结果正确。选用限制性内切酶BglⅡ和XhoⅠ酶切验证插入正确(图6),表明表达载体构建成功,命名为pBI121-GhDHN1::GFP。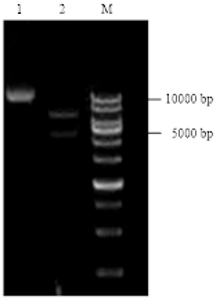 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6pBI121-GhDHN1::GFP表达载体酶切验证
1:载体质粒;2:BglⅡ和XhoⅠ酶切载体;M:1kB ladder
-->Fig. 6Enzyme digestion of expression vector pBI121- GhDHN1::GFP
1: Vector plasmid; 2: Digested with BglⅡ and XhoⅠ; M: 1kB ladder
-->
2.7 棉花GhDHN1蛋白的亚细胞定位分析
通过瞬时表达系统分析GhDHN1蛋白亚细胞定位,对照PBI121::GFP的绿色荧光分布在整个细胞中(图7-A—图7-C),而PBI121-GhDHN1::GFP融合蛋白的绿色荧光信号主要集中在细胞膜附近(图7-D—图7-F),推测GhDHN1蛋白主要在细胞膜附近发挥作用。该基因所编码的蛋白质在洋葱表皮中得到了表达,证明了该基因能够正常表达功能蛋白,为下一步使用基因枪活体转化技术获得转基因拟南芥和转基因棉花材料提供理论依据。2.8 低温胁迫条件下GhDHN1的转录表达分析
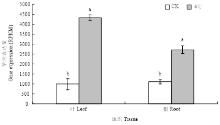
基于棉花转录组测序分析表明(图8),棉花三叶期在受4℃低温处理24 h后,与对照相比,GhDHN1在叶中和根中表达均差异显著,且上调表达,上调倍数分别为2.57和1.29倍,说明GhDHN1棉花响应低温胁迫中起正调控作用。2.9 低温胁迫条件下GhDHN1实时灾光定量分析
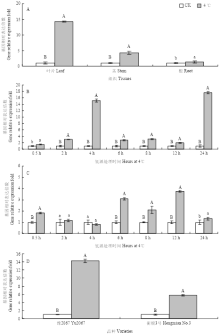
实时荧光定量分析表明(图9-A)可知,GhDHN1在受4℃低温处理24 h后,与对照相比,在叶、茎均上调表达,且差异达到极显著,表达倍数分别为14.28和4.30,在根中也上调表达,且与对照差异显著,上调倍数为1.33,说明GhDHN1在响应低温胁迫过程中,在叶中的作用最大,其次是在茎中和根中,这与转录组测序结果是一致的;4℃低温处理不同时间后,与对照相比,GhDHN1在在叶片中基因表达,除了在0.5 h处理时差异显著外,在其他时间均差异达极显著水平,在4 h和24 h时有2个表达高峰(图9-B);在根中受不同时间低温处理后,与对照相比,在0.5、6、8和12 h上调表达且差异达极显著,同时在6 h和12 h有2个表达高峰(图9-C);GhDHN1在受4℃低温处理24 h后,与对照相比,抗冷材料豫2067和衡棉3号的叶片均上调表达,且与对照间达差异极显著,表达倍数分别为14.28和5.77,在抗冷材料中的表达量远大于冷敏感材料,其表达量是冷敏感材料的2.47倍,二者表达倍数差异极显著(图9-D)。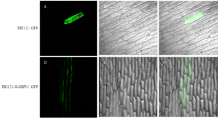 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7棉花GhDHN1蛋白的亚细胞定位
蓝光下的照片(A,D);明场下的照片(B,E);蓝光和明场下叠加的照片(C,F);A—C:PBI121::GFP;D—F:PBI121-GhDHN1::GFP
-->Fig. 7Sub-cellular localization of GhDHN1 protein
The photographs were taken in a dark field for green fluorescence (A, D); Under bright light for the morphology of the cell (B, E) and in combination (C, F); A-C: PBI121::GFP; D-F: PBI121-GhDHN1::GFP
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8 GhDHN1在豫2067三叶期叶片和根系经低温胁迫后的转录丰度
不同字母表示差异显著(P<0.05),n=3
-->Fig. 8Transcript abundance analysis of GhDHN1 gene in leaves and roots of Yu2067 after treatment at 4℃ low temperature for 24 h
Bars with different superscripts differ significantly (P<0.05), n=3
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9低温胁迫条件下GhDHN1实时荧光定量分析
A:4℃处理豫2067 24 h叶、茎、根的相对表达;B:4℃处理豫2067不同时间叶中相对表达;C:4℃处理豫2067不同时间根中相对表达;D:抗冷材料豫2067和冷敏感材料衡棉3号在受4℃处理24 h后叶片的相对表达。不同大写字母表示差异极显著(P<0.01),n=3;不同小写字母表示差异显著(P<0.05),n=3
-->Fig.9Expression of GhDHN1 gene in cotton under low temperature stress treatment with qRT-PCR method
A: The relative expression of GhDHN1 gene in true leaves, stems, roots of cotton variety Yu2067 after 4℃24 h treatment; B: The relative expression of GhDHN1 gene in true leaves of cotton variety Yu2067 after 4℃ different time treatments; C: The relative expression of GhDHN1 gene in roots of cotton variety Yu2067 after 4℃ different time treatments; D, The relative expression of GhDHN1 gene in true leaves of chilling-resistant variety Yu2067 and chilling sensitive variety Hengmian No.3 after 4℃24 h treatment; Different capital letters showed extremely significant difference (P<0.01); n=3; Different small letters mean significant difference (P<0.05), n=3
-->
3 讨论
植物在生长发育发过程中面临大量的环境威胁,如生物的和非生物的逆境,面对这些环境的不断变化,它们必须进化出相应的适应机制,才能度过这些不利环境,继续生存下去。合成一系列逆境响应蛋白,小分子代谢物和一些渗透保护物质等可以有助于植物在不同的逆境胁迫条件下存活。积累脱水素是植物在应对逆境胁迫过程的一条主要途径,在植物耐受干旱和盐胁迫过程中发挥重要的保护功能[20]。脱水素是一类重要LEA蛋白,通常包含有Y片段、S片段和K片段保守域,其中K片段是所有脱水素均具备的特征结构域[21]。研究表明,富含赖氨酸K片段一般位于蛋白序列的C端,可以形成双亲α螺旋,α螺旋能够和其他蛋白的脱水表面或生物膜表面发生互作,这种互作能保护其他蛋白水分的丢失,在细胞脱水保护过程中发挥重要功能[22]。在本研究中发现,GhDHN1蛋白在C端具有2个K片段保守域,二级结构分析显示该蛋白的α螺旋(alpha helix)占到整个蛋白54.98%,无规则卷曲(random coil)占到整个蛋白的41.23%,FAN等[23]研究表明这种无规则卷曲结构对于增加细胞中束缚水含量,保护细胞脱水功能非常有利。S片段是由一系列丝氨酸残基组成,ALSHEIKH等[24]研究表明S片段的磷酸化可以使脱水素在信号肽的引导下进入细胞核,GhDHN1在N端具有一个S片段,共含有16个丝氨酸(Serine)磷酸化位点,5个苏氨酸(Threonine)磷酸化位点,1个酪氨酸(Tyrosine)磷酸化位点,推测这些磷酸化位点在棉花脱水素的功能行使过程中发挥重要作用,这一功能还有待于进一步的验证。研究表明,GhDHN1蛋白呈酸性且带负带荷,亚细胞定位于细胞质膜附近,DANYLUK等[25]报道,小麦冷诱导脱水素基因也呈酸性,在细胞质膜上被检测到,因此,2个物种的脱水素蛋白有相似的性质和亚细胞定位,推测可能具有相似的功能。
大量研究表明在非生物逆境胁迫下,植物脱水素的表达和积累与植物抗逆性之间存在着正相关关系[26-28]。本研究转录组测序结果表明,GhDHN1受低温胁迫棉花叶片和根中均上调表达;实时荧光定量分析表明,GhDHN1在受低温胁迫的根、茎、叶中均上调表达,特别是在叶中上调表达的更为明显,这些结果充分说明GhDHN1受低温的诱导,这跟GhDHN1蛋白的性质有一定相关性,据报道,酸性或中性的SKn、Kn、Y2Kn型脱水素蛋白优先可被低温诱导,如小麦WCO410属于酸性的K3S型脱水素,可在维管组织中受低温诱导[25];另据报道,脱水素在抵御低温等非生物胁迫过程发挥着重要作用[29],有研究表明过量表达脱水素基因可增强拟南芥的低温抗性,提高其抗寒力[30];GhDHN1在低温胁4 h和24 h在棉花的叶片中上调倍数2次达到高峰,这与徐丽等[31]在核桃中的研究结果相似,徐丽等研究表明,JrDHN在4℃胁迫下核桃叶片中表达增加,4℃处理4 h后达到最大值;这些结果与花生中K2S型脱水素基因AhDHN1的功能不完全一样,AhDHN1对高盐和干旱胁迫则有明显响应,对低温胁迫无响应[32],推测可能是因为花生中该脱水素基因序列与棉花中该基因序列差异较大造成的;GhDHN1在抗冷材料和冷敏感材料中表达差异显著,其表达量与棉花的抗冷性呈正相关,这与小麦脱水素有相似的功能,研究表明,在适合生长的温度条件下,小麦脱水素在转录水平和蛋白水平在抗冻性强的小麦品种中的积累远多于不抗冻品种,所以在温度降低过程中具有更高的适应性,具有更强的抗冷性,因此,脱水素可以作为不同材料间的抗冷性筛选鉴定标记[33]。以上结果表明,脱水素蛋白在棉花响应低温胁迫过程中可能具有复杂的响应模式。
4 结论
陆地棉GhDHN1属于典型的K2S型脱水素,与可可亲缘关系最近,在响应低温胁迫中起正调控作用,在抗冷材料和冷敏感材料中表达差异极显著,其表达量与棉花的抗冷性呈正相关,可以作为筛选不同抗冷材料的分子标记,同时可以作为培育棉花抗冷材料的候选基因。The authors have declared that no competing interests exist.
