 ,1,2, 岳晓凤
,1,2, 岳晓凤 ,1,2,3,4, 白艺珍1,2,3, 郭灿1,2, 丁小霞1,2,3, 李培武
,1,2,3,4, 白艺珍1,2,3, 郭灿1,2, 丁小霞1,2,3, 李培武 ,1,2,3,4, 张奇1,2,3,4
,1,2,3,4, 张奇1,2,3,4The Infectivity of Aspergillus flavus in Peanut
JING Dan ,1,2, YUE XiaoFeng
,1,2, YUE XiaoFeng ,1,2,3,4, BAI YiZhen1,2,3, GUO Can1,2, DING XiaoXia1,2,3, LI PeiWu
,1,2,3,4, BAI YiZhen1,2,3, GUO Can1,2, DING XiaoXia1,2,3, LI PeiWu ,1,2,3,4, ZHANG Qi1,2,3,4
,1,2,3,4, ZHANG Qi1,2,3,4通讯作者:
责任编辑: 岳梅
收稿日期:2021-03-19接受日期:2021-04-24
| 基金资助: |
Received:2021-03-19Accepted:2021-04-24
作者简介 About authors
荆丹,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (2182KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
荆丹, 岳晓凤, 白艺珍, 郭灿, 丁小霞, 李培武, 张奇. 花生黄曲霉侵染力. 中国农业科学, 2021, 54(23): 5008-5020 doi:10.3864/j.issn.0578-1752.2021.23.007
JING Dan, YUE XiaoFeng, BAI YiZhen, GUO Can, DING XiaoXia, LI PeiWu, ZHANG Qi.
开放科学(资源服务)标识码(OSID):

0 引言
【研究意义】黄曲霉(Aspergillus flavus)是一种常见的腐生真菌,在世界范围内广泛分布,极易侵染花生等农产品。黄曲霉侵染寄主后产生的次级代谢产物——黄曲霉毒素(aflatoxin)具有剧毒、致畸和致癌性,是迄今发现的污染农产品和食品毒性最大、致癌力最强的真菌毒素,严重威胁消费安全和人畜生命健康,造成巨大的农业经济损失[1,2]。据报道,发展中国家,特别是亚洲和非洲国家,有45亿人民的日常饮食长期暴露于受黄曲霉毒素污染的粮食之中[2]。我国是世界最大的花生生产和消费国,也是受黄曲霉毒素污染较严重的国家之一,特别是长江流域和南方花生产区气候适宜黄曲霉侵染和产毒,花生黄曲霉毒素污染呈加重趋势[3,4]。黄曲霉侵染和黄曲霉毒素污染不仅发生在田间生长环节,也会发生在收获、干燥、储运等过程。目前,培育抗侵染和抗产毒花生品种,以及利用不产毒黄曲霉等生防菌进行田间生物防控是源头控制毒素污染最为经济有效的途径[5,6,7,8]。研究发现我国不同生态区黄曲霉分布及菌株产毒力存在显著差异[9],但不同产毒力黄曲霉侵染特征尚不明确,一定程度上影响了黄曲霉毒素污染的精准防控,因此,研究不同产毒力、不同地理来源黄曲霉对花生侵染差异,明确其相互关系,对抗黄曲霉花生品种选育以及源头控制黄曲霉侵染和产毒,从而降低花生黄曲霉毒素污染风险具有重要意义。【前人研究进展】黄曲霉属子囊菌门(Ascomycota),发菌科(Trichocomaceae),曲霉属(Aspergillus)[10]。在花生田间生长阶段,土壤中的黄曲霉穿透花生果壳、种皮,最终在花生子叶中定殖,从子叶汲取营养,满足生长繁殖需求并产生黄曲霉毒素[5,11]。花生对黄曲霉毒素污染的抗性存在两种类型:一种是对黄曲霉侵染的抗性(称为抗侵染);另一种是对黄曲霉产毒的抗性(称为抗产毒),即在黄曲霉侵染后花生启动多种防御机制抑制黄曲霉产毒[12]。我国花生黄曲霉分布范围广,菌株间产毒能力存在显著差异[9,13]。ZHANG等[9]研究表明,黄曲霉分布存在明显的地域特征,数量最多、分布最广的为长江流域,其次是东南沿海地区,再次是黄河流域,最少的为东北地区,不产毒、中低产毒、高产毒菌株在不同生态区分布存在显著差异;余仲东等[14]研究表明,产毒和不产毒黄曲霉菌株普遍分布,产毒特性具有菌株特异性,且与地理分布或农作物类型间存在一定关系。在黄曲霉侵染研究方面,ASIS等[15]研究表明,黄曲霉在侵染花生过程中产生的蛋白酶(金属蛋白酶和丝氨酸蛋白酶)参与花生种子侵染,导致种子组织损伤、活力下降,进而促进黄曲霉通过种皮侵入花生种子。李春娟等[8]基于iTRAQ技术研究发现,黄曲霉侵染主要影响花生的代谢通路,且诱导植株抗性机制的运行。目前,在不同产毒力黄曲霉的侵染研究方面报道较少。唐兆秀等[16]对我国福建省分离出的黄曲霉菌株侵染力进行研究,初步发现黄曲霉菌株的致病性存在分化现象,产毒力×致病性×品种互作极为显著;李毓等[17]对福建省10个花生产区分离的黄曲霉研究表明,不同产地的黄曲霉不仅形态、生长速率有差异,而且产毒力、侵染力、侵染指数之间有显著差异。【本研究切入点】目前,我国不同产毒力花生黄曲霉的侵染特征尚不明确,本研究以分离自不同地理区域和具有不同产毒能力的黄曲霉为研究对象,鉴定菌株对不同花生品种的侵染力,分析黄曲霉菌株间的侵染差异及其与菌株产毒力、来源的关系。【拟解决的关键问题】明确黄曲霉菌株侵染等级、分布范围,及其与菌株产毒力、菌株地理来源的相关性,为抗黄曲霉花生品种选育以及我国花生黄曲霉毒素污染风险预警与精准防控提供理论依据。1 材料与方法
试验于2019年6月至2020年10月在中国农业科学院油料作物研究所完成。1.1 供试菌株
黄曲霉标准菌株CGMCC 3.4408购于中国微生物菌种保藏中心,其他供试菌株均为本实验室前期从我国花生主产地分离鉴定所得。本研究选取的102株不同产毒力黄曲霉菌株主要分离自辽宁、河南、山东、河北、江西、江苏、湖北、四川、广东等12个花生产地的土壤或花生中(表1)。Table 1
表1
表1不同产毒力黄曲霉菌株来源
Table 1
| 来源 Source | 不产毒菌株数 Number of non-toxigenicity strains | 中低产毒菌株数 Number of medium-low toxigenicity strains (0-1500 μg·kg-1) | 高产毒菌株数 Number of high toxigenicity strains (>1500 μg·kg-1) | 合计 Total |
|---|---|---|---|---|
| 辽宁Liaoning | 3 | 5 | 5 | 13 |
| 山东Shandong | 5 | 3 | 2 | 10 |
| 河南Henan | 4 | 3 | 3 | 10 |
| 河北Hebei | 2 | 3 | 3 | 8 |
| 山西Shanxi | 2 | 1 | 0 | 3 |
| 江苏Jiangsu | 0 | 1 | 1 | 2 |
| 江西Jiangxi | 5 | 4 | 5 | 14 |
| 湖北Hubei | 5 | 3 | 3 | 11 |
| 四川Sichuan | 1 | 4 | 4 | 9 |
| 广东Guangdong | 2 | 6 | 4 | 12 |
| 西藏Tibet | 1 | 3 | 4 | 8 |
| 云南Yunnan | 0 | 0 | 2 | 2 |
| 合计Total | 30 | 36 | 36 | 102 |
新窗口打开|下载CSV
1.2 供试花生品种
供试花生为市售粤油256、中花6号和豫花37花生种子(含水量约10%)。其中粤油256为南方红壤旱地花生主栽品种、中花6号为抗产毒花生品种、豫花37为高油酸花生品种。1.3 菌株产毒力测定
将待测菌株接种于DG-18培养基上进行活化,用已灭菌的0.1%吐温80洗取黄曲霉菌株的分生孢子,得到孢子悬浮液。在显微镜下使用血球计数板确定孢子悬浮液浓度,移取一定量孢子悬浮液于装有已灭菌的30 mL液体沙氏培养基的锥形瓶中,使其终浓度为4×105 cfu/mL,将锥形瓶置于摇床中,在(28±1)℃,200 r/min黑暗条件下培养5 d。取500 μL培养液于离心管中,加入500 μL甲醇,涡旋,20 000 r/min离心10 min,过0.22 μm有机滤膜,装入进样瓶,采用高效液相色谱法测定黄曲霉毒素含量[18]。1.4 黄曲霉对花生侵染研究
1.4.1 菌株活化及孢子悬浮液制备 将黄曲霉菌株接种于DG-18固体培养基活化(DG-18培养基购于青岛高科技工业园海博生物技术有限公司)。(28±1)℃黑暗条件下培养5 d后,用已灭菌的0.1%吐温80洗取获得平板上的黄曲霉分生孢子于10 mL离心管中,得到孢子悬浮液。在显微镜下用血球计数板确定孢子悬浮液浓度,无菌水稀释孢子浓度至106 cfu/mL待用。1.4.2 黄曲霉孢子接种 选取成熟、饱满、健康、种皮完整且大小均匀、颜色正常的花生种子。用70%酒精对花生种子消毒1 min,用无菌水冲洗3次,13.0 min以内完成(一是保证充分清洗、除去种子表面的酒精,二是保证种子的含水量达到20%左右)[16,19]。
将消毒后的花生种子浸没于浓度为106 cfu/mL的25 mL黄曲霉分生孢子悬浮液中5 min,并以黄曲霉CGMCC 3.4408为阳性对照,以不含分生孢子的无菌水溶液为阴性对照。然后用无菌镊子夹至9 cm无菌培养皿中,每组10粒,每组设3个重复试验。在恒温培养箱中(28±1)℃,相对湿度90%、黑暗条件下连续培养7 d。
1.4.3 黄曲霉侵染情况调查 培养7 d后观察培养皿中每粒花生种子表面黄曲霉生长情况,根据分生孢子覆盖率调查侵染级别,并计算侵染指数。0级(花生表面无黄曲霉孢子产生),1级(孢子覆盖率0—15%),2级(孢子覆盖率16%—30%),3级(孢子覆盖率31%—50%),4级(孢子覆盖率>50%,能看见少部分或看不见花生种皮)。花生黄曲霉侵染指数计算方法如下[20]:侵染指数=(0×N0+1×N1+2×N2+3×N3+4×N4)/(4×N),N0、N1、N2、N3、N4分别为0、1、2、3、4级抗性的花生种子数目,N代表花生种子总数目。
1.5 数据分析
使用IMB SPSS Statistics 20软件对试验数据进行统计及差异显著性分析,Origin 9.1作图,@Risk 5.7软件进行黄曲霉侵染指数分布曲线模拟,利用R 4.0软件进行菌株产毒力与侵染力的系统聚类分析。2 结果
2.1 花生黄曲霉产毒力与侵染力鉴定
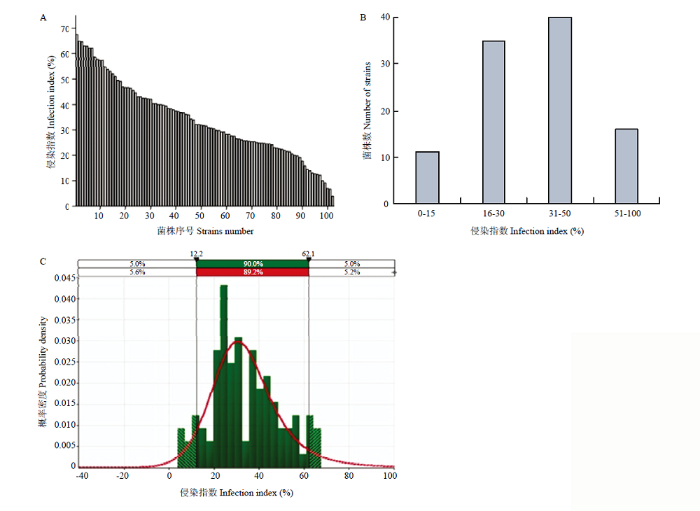
采用高效液相色谱法对分离自我国花生产地的黄曲霉进行产毒力测定,102株黄曲霉产毒含量范围为0—18 038.50 μg·kg-1,其中不产毒菌30株,中低产毒菌36株,高产毒菌36株(表1、表2)。为进一步明确菌株间侵染差异,将不同产毒力的黄曲霉分别接种到不同品种花生种子上,调查分生孢子在花生种子表面的覆盖率,并将侵染情况划分为5个等级(图1-A)。根据侵染级别计算侵染指数,结果表明102株黄曲霉对中花6号、粤油256和豫花37这3个品种花生的平均侵染指数分布范围为3.89%—67.50%(表2、图2-A)。其中,辽宁阜新的LNFX-90-1菌株侵染力最低,湖北红安的HBHA-130-2菌株侵染力最高。中高侵染力(侵染指数为3级、4级)且高产毒菌株有19株(占比18.63%),主要来自江西樟树、广东湛江等南方及长江流域产区。由此可见,来自12个不同花生产地的102株黄曲霉均具有侵染能力,且菌株间存在致病力分化现象。Table 2
表2
表2黄曲霉不同菌株侵染力鉴定结果
Table 2
| 产毒力水平 Toxigenicity level | 菌株编号 Strain number | 产毒力 Toxigenicity (μg·kg-1) | 侵染指数 Infection index (%) | 菌株编号 Strain number | 产毒力 Toxigenicity (μg·kg-1) | 侵染指数 Infection index (%) | 菌株编号 Strain number | 产毒力 Toxigenicity (μg·kg-1) | 侵染指数 Infection index (%) | 菌株编号 Strain number | 产毒力 Toxigenicity (μg·kg-1) | 侵染指数 Infection index (%) | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 不产毒 Non-toxigenicity | LNFX-28-2 | ND | 12.22 | SCPA-25-6 | ND | 64.86 | JXZS-116-1 | ND | 30.56 | SX-1-4 | ND | 39.44 | |||
| LNFX-26-2 | ND | 9.17 | SDXT-3 | ND | 38.33 | JXZS-103-14 | ND | 35.97 | SX-1-5 | ND | 30.83 | ||||
| LNFXS-7 | ND | 6.67 | SDPY-1 | ND | 20.56 | JXZS-89-1 | ND | 25.42 | HeNSQ-4 | ND | 24.72 | ||||
| HBHA-80-1 | ND | 38.47 | SDPY-3 | ND | 26.53 | GDYD-1 | ND | 46.67 | HNZY-17 | ND | 23.06 | ||||
| HBYL-5-2 | ND | 32.08 | SDPY-2 | ND | 20.00 | GDMM-2 | ND | 58.61 | HeNQF-3 | ND | 37.92 | ||||
| HBHA-116-8 | ND | 44.58 | SDXT-2 | ND | 12.78 | HeBBD-2 | ND | 15.83 | HNZY-3 | ND | 25.42 | ||||
| HBHA-69-1 | ND | 29.86 | JXZS-121-6 | ND | 54.86 | HeBBD-5 | ND | 24.44 | XZCY-18-5 | ND | 29.17 | ||||
| HuBXY-33 | ND | 29.72 | JXZS-104-9 | ND | 34.17 | ||||||||||
| 中低产毒 Medium-low toxigenicity (0-1500 μg·kg-1) | HBTS-127-1 | 2.28 | 46.81 | GDZJ-126-2 | 51.36 | 62.08 | GDZJ-105-9 | 420.39 | 57.36 | XZCY-16-2 | 900.83 | 24.83 | |||
| XZCY-18-1 | 5.14 | 27.50 | HBTS-147-3 | 221.37 | 28.33 | GDZJ-103-3 | 502.53 | 57.78 | HNZY-15 | 928.95 | 21.53 | ||||
| SX-1-7 | 5.18 | 25.69 | LNFX-90-1 | 262.98 | 3.89 | JXZS-118-6 | 518.35 | 36.11 | LNFX-73-1 | 932.38 | 12.50 | ||||
| XZCY-18-4 | 5.74 | 32.08 | JXZS-114-6 | 284.25 | 40.00 | JXZS-117-1 | 575.56 | 46.67 | HNZY-8 | 1112.40 | 19.17 | ||||
| HBTS-125-1 | 12.92 | 43.06 | HBHA-130-2 | 293.48 | 67.50 | JXZS-117-3 | 629.58 | 33.89 | HBHA-137-1 | 1175.05 | 31.67 | ||||
| SCPA-20-3 | 43.00 | 40.42 | SCPA-22-5 | 303.64 | 62.08 | GDZJ-101-1 | 680.98 | 51.11 | SDJY-104-1 | 1191.30 | 6.94 | ||||
| SCPA-23-4 | 43.28 | 42.42 | GDZJ-101-2 | 346.15 | 57.36 | HBHA-131-1 | 730.08 | 62.92 | LNFX-26-1 | 1222.25 | 10.00 | ||||
| LNFX-4-5 | 43.99 | 13.06 | GDZJ-106-1 | 356.06 | 53.06 | SDJY-42-1 | 824.38 | 24.17 | HeNQF-2 | 1227.90 | 42.50 | ||||
| LNFX-25-3 | 44.86 | 36.81 | JSRS-17-2 | 369.88 | 19.86 | SDJY-135-1 | 880.53 | 29.17 | SCPA-32-12 | 1490.49 | 63.06 | ||||
| 高产毒 High toxigenicity (>1500 μg·kg-1) | GDZJ-110-4 | 1531.99 | 42.08 | HeNSQ-18 | 2660.25 | 24.44 | LNFX-25-1 | 3545.22 | 25.56 | JXZS-69-3 | 6087.31 | 43.06 | |||
| HeNQF-1 | 1705.95 | 39.72 | YNGN-20-6 | 2698.18 | 21.39 | XZCY-30-1 | 3570.74 | 40.42 | HBTS-28-2 | 6348.68 | 37.22 | ||||
| JXZS-119-1 | 2049.86 | 26.39 | XZCY-21-5 | 2703.36 | 42.22 | HBTS-94-2 | 3903.05 | 27.64 | SDJY-50-1 | 6495.97 | 36.67 | ||||
| XZCY-16-4 | 2147.79 | 24.86 | JXZS-126-9 | 2762.77 | 49.17 | XZCY-21-2 | 3908.80 | 22.50 | GDZJ-105-2 | 9354.93 | 22.92 | ||||
| LNFX-103-2 | 2155.32 | 28.33 | YNGN-15-2 | 2844.27 | 40.00 | SCPA-14-3 | 3957.07 | 25.69 | LNFX-103-1 | 9469.96 | 13.89 | ||||
| GDZJ-119-4 | 2247.91 | 46.39 | GDZJ-108-15 | 3085.41 | 53.89 | LNFX-45-3 | 4436.47 | 14.44 | HBHA-125-1 | 10643.80 | 21.94 | ||||
| JXZS-117-2 | 2314.62 | 31.94 | HBHA-147-1 | 3197.12 | 45.56 | SCPA-40-4 | 4913.89 | 22.36 | JSRG-18-1 | 13272.40 | 31.53 | ||||
| JXZS-132-9 | 2362.42 | 49.44 | LNFX-77-1 | 3245.92 | 17.78 | HBTS-26-7 | 4976.00 | 25.00 | SCPA-14-6 | 13456.28 | 64.58 | ||||
| HBHA-131-2 | 2480.35 | 52.08 | HeNSQ-19 | 3389.85 | 26.11 | SCPA-27-5 | 5486.87 | 37.50 | SDJY-60-1 | 18038.50 | 30.69 | ||||
| CGMCC 3.4408 | 2296.53 | 45.00 |
新窗口打开|下载CSV
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1黄曲霉侵染指数等级的划分(A)及不同菌株对花生的侵染差异(B)
Fig. 1The levels of infection index (A) and the infection difference of different A. flavus strains to peanut (B)
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2黄曲霉不同菌株侵染指数分布
A:102株黄曲霉侵染指数的分布范围Infection index distribution range of 102 A. flavus strains;B:黄曲霉在不同侵染指数范围分布情况The number of A. flavus strains in different infection index ranges;C:黄曲霉侵染指数拟合分布 Fitting curve of A. flavus infection index
Fig. 2The infection index distribution of different A. flavus strains
102株黄曲霉侵染指数在不同区段的分布结果见图2-B,侵染指数在0—15%的菌株数为11株,占比最低,为总菌株数的10.78%;16%—30%的菌株数为35株(占比34.31%);31%—50%的菌株数为40株,占比最高,达总菌株数的39.22%;侵染指数在50%以上的菌株有16株(占比15.69%)。黄曲霉侵染指数在16%—50%范围分布最多,占比73.53%,中高侵染力菌株(侵染指数为3级、4级)占总菌株数的54.90%。使用@Risk 5.7软件模拟了黄曲霉侵染指数分布,通过模拟的分布曲线进行概率计算,频率分布结果及拟合曲线见图2-C,发现菌株侵染指数在12.2%—62.1%的分布概率为89.2%,低于12.2%、高于62.1%的概率分别为5.6%、5.2%。
2.2 不同产毒力黄曲霉菌株侵染差异
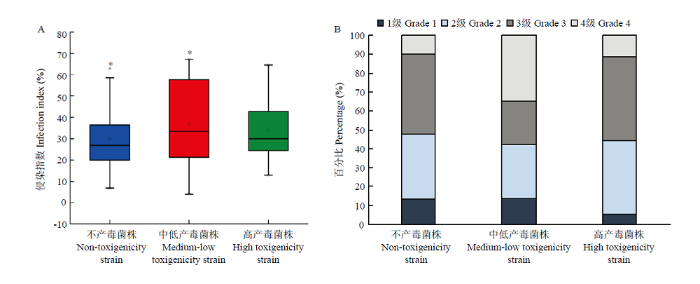
对不同产毒力黄曲霉菌株侵染差异研究发现,不产毒、中低产毒、高产毒菌株对不同品种的侵染指数在0—15%、16%—30%、31%—50%和51%—100% 4个区段内均有分布。中低产毒菌株的平均侵染指数显著高于不产毒菌株。不产毒菌株的侵染指数为6.67%— 64.86%,对不同品种的平均侵染指数最低,为30.76%;中低产毒菌的侵染指数为3.89%—67.50%,平均侵染指数最高,为37.04%;高产毒菌的侵染指数范围为13.89%—64.58%,平均侵染指数为33.48%(图3-A、表3)。结果表明,同一产毒力等级菌株间侵染力存在差异,总体上中低产毒和高产毒菌株的侵染指数高于不产毒菌株,产毒菌株的侵染力较不产毒菌株强。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同产毒力等级黄曲霉菌株侵染指数分布(A)及不同侵染指数范围等级占比(B)
Fig. 3The distribution of infection index of A. flavus strains with different toxigenicity grades (A) and the proportion in different infection index grades (B)
Table 3
表3
表3不同产毒力等级的黄曲霉菌株侵染指数
Table 3
| 产毒力水平 Toxigenicity level | 侵染指数范围 Infection index range (%) | 平均侵染指数Average of infection index (%) | |||
|---|---|---|---|---|---|
| 中花6号 Zhonghua 6 | 粤油256 Yueyou 256 | 豫花37 Yuhua 37 | 均值 Average | ||
| 不产毒Non-toxigenicity | 6.67-64.86 | 47.19b | 13.36b | 31.74b | 30.76b |
| 中低产毒Medium-low toxigenicity | 3.89-67.50 | 53.07a | 17.63a | 40.41a | 37.04a |
| 高产毒High toxigenicity | 13.89-64.58 | 50.20ab | 15.96ab | 34.29ab | 33.48ab |
新窗口打开|下载CSV
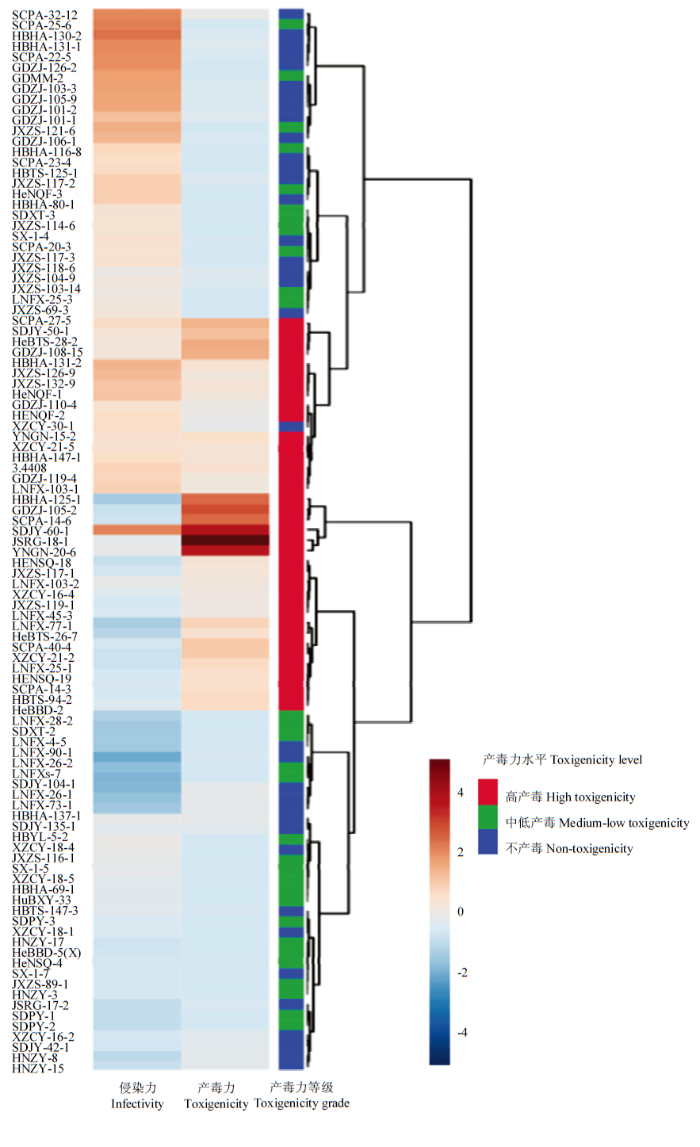
根据菌株侵染和产毒能力不同,采用R 4.0软件对高产毒、中低产毒、不产毒菌株进行侵染指数和产毒力聚类分析(图4),结果表明不同产毒力等级菌株可较明显地归聚为强、弱两种侵染力类型,但菌株产毒含量与侵染指数聚类无明显对应关系。Pearson相关性及MIC非线性相关性分析进一步表明,菌株产毒力与侵染力无显著相关性,相关系数分别为-0.11、0.35。进一步分析不同产毒力黄曲霉菌株在各侵染指数等级的分布情况,结果见图3-B,16株高侵染力菌株(侵染指数为4级)中的不产毒、中低产毒、高产毒菌株数占比分别为10.00%、34.60%、11.40%;39株侵染指数为3级的菌株中不产毒、中低产毒和高产毒菌株占比分别为42.00%、23.10%、44.40%;11株侵染指数为1级的菌株中不产毒、中低产毒、高产毒菌株占比分别为13.30%、13.90%、5.60%,表明高产毒、中低产毒菌株的侵染指数分别在3级和4级的占比最高,侵染力更强,高产毒菌侵染指数在1级的占比最低。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4黄曲霉侵染指数和产毒力的聚类分析
Fig. 4The cluster analysis of infection index and toxigenicity of A. flavus
2.3 不同生态区黄曲霉菌株侵染差异
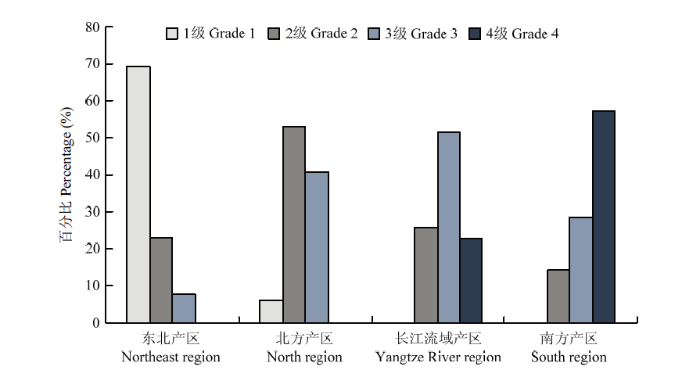
对分离自不同花生产地的黄曲霉侵染力进行分析,结果表明黄曲霉菌株间存在显著的地域差异(P<0.05),例如广东、辽宁分离的菌株侵染力与其他省份存在显著差异(表4)。东北、北方、长江流域、南方花生主产区以及西藏高原花生黄曲霉平均侵染指数分别为15.72%、27.52%、36.12%、46.59%和30.50%。对不同地区菌株侵染力分析结果发现,16株高侵染力(侵染指数为4级)菌株主要来自广东湛江(占比43.75%)、四川蓬安(占比25.00%)、湖北红安(占比18.75%),11株低侵染力(侵染指数为1级)菌株主要来自辽宁阜新(占比81.82%)、山东济阳(占比9.09%)、山东新泰(占比9.09%)。总体上,长江流域产区和南方产区的侵染指数分别在3级和4级的占比最高,为51.43%、57.14%,东北产区和北方产区的侵染指数分别在1级和2级占比最高,为69.23%、53.13%(图5)。南方产区广东茂名、湛江分离出的黄曲霉平均侵染指数最高,分别为58.61%、50.40%。长江流域产区四川蓬安、湖北红安、江西樟树平均侵染指数分别为47.00%、43.84%、38.40%(表5)。南方和长江流域产区的高侵染力黄曲霉比例高于东北和北方产区。Table 4
表4
表4不同省(自治区)黄曲霉菌株侵染差异显著性分析
Table 4
| 省(自治区) Province (Autonomous Region) | 平均侵染指数 Average of infection index (%) | 广东 Guandong | 河北 Hebei | 河南 Henan | 湖北 Hubei | 江苏 Jiangsu | 江西 Jiangxi | 辽宁 Liaoning | 山东 Shandong | 山西 Shanxi | 四川 Sichuan | 西藏 Tibet | 云南 Yunnan |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 广东Guangdong | 51.89 | ||||||||||||
| 河北Hebei | 27.41 | 19.57* | |||||||||||
| 河南Henan | 29.14 | 25.07* | 5.50 | ||||||||||
| 湖北Hubei | 35.21 | 13.65* | 5.92 | 11.41* | |||||||||
| 江苏Jiangsu | 25.69 | 27.04* | 7.47 | 1.97 | 13.38* | ||||||||
| 江西Jiangxi | 38.40 | 15.77* | 3.81 | 9.30* | 2.11 | 11.27 | |||||||
| 辽宁Liaoning | 15.72 | 36.65* | 17.08* | 11.59* | 22.99* | 9.60 | 20.89* | ||||||
| 山东Shandong | 24.48 | 29.95* | 10.38* | 4.89 | 16.30* | 2.92 | 14.19* | 6.70 | |||||
| 山西Shanxi | 31.99 | 18.61* | 0.96 | 6.45 | 4.96 | 8.43 | 2.84 | 18.04* | 11.34* | ||||
| 四川Sichuan | 47.00 | 9.25* | 10.32* | 15.81* | 4.40 | 17.78* | 6.51 | 27.40* | 20.70* | 9.36 | |||
| 西藏Tibet | 30.50 | 20.81* | 1.24 | 4.26 | 7.16 | 6.23 | 5.04 | 15.85* | 9.15* | 2.20 | 11.56* | ||
| 云南Yunnan | 30.69 | 24.40* | 4.83 | 0.67 | 10.75 | 2.64 | 8.63 | 12.25 | 5.56 | 5.79 | 15.15* | 3.59 |
新窗口打开|下载CSV
Table 5
表5
表5不同产区黄曲霉菌株侵染差异
Table 5
| 菌株来源 Source | 侵染指数范围 Infection index range (%) | 平均侵染指数 Average of infection index (%) | |
|---|---|---|---|
| 东北产区Northeast region | 辽宁阜新Fuxin, Liaoning | 3.89-36.81 | 15.72 |
| 北方产区North region | 河北保定Baoding, Hebei | 15.83-24.44 | 20.14 |
| 河北唐山Tangshan, Hebei | 25.00-46.81 | 34.68 | |
| 河南正阳Zhengyang, Henan | 19.17-25.42 | 22.29 | |
| 河南商丘Shangqiu, Henan | 22.44-26.11 | 25.09 | |
| 河南清风Qingfeng, Henan | 37.92-42.50 | 40.05 | |
| 山东平邑Pingyi, Shandong | 20.00-26.56 | 22.36 | |
| 山东新泰Xintai, Shandong | 12.78-38.33 | 25.56 | |
| 山东济阳Jiyang, Shandong | 6.94-36.67 | 25.53 | |
| 山西襄汾Linfen, Shanxi | 25.69-39.44 | 31.99 | |
| 长江流域产区Yangtze River region | 江苏如皋Rugao, Jiangsu | 19.86-31.53 | 25.69 |
| 湖北红安Hongan, Hubei | 21.94-67.50 | 43.84 | |
| 湖北襄阳Xiangyang, Hubei | 29.72 | 29.72 | |
| 湖北阳逻Yangluo, Hubei | 32.08 | 32.08 | |
| 四川蓬安Peng’an, Sichuan | 22.36-64.86 | 47.00 | |
| 江西樟树Zhangshu, Jiangxi | 25.42-54.86 | 38.40 | |
| 南方产区South region | 云南广南Guangnan, Yunnan | 21.39-40.00 | 30.69 |
| 广东英德Yingde, Guangdong | 46.67 | 46.67 | |
| 广东茂名Maoming, Guangdong | 58.61 | 58.61 | |
| 广东湛江Zhanjiang, Guangdong | 22.92-62.08 | 50.40 | |
| 西藏高原Tibetan Plateau region | 西藏察隅Chayu, Tibet | 22.50-42.22 | 30.50 |
新窗口打开|下载CSV
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5花生主产区黄曲霉菌株在各级侵染指数范围内占比
Fig. 5The proportion of A. flavus strains from the main peanut producing regions within different infection index ranges
3 讨论
花生是我国重要的油料作物和经济作物,也是我国为数不多的具出口创汇优势的农产品[21]。然而由黄曲霉侵染和产毒引起的黄曲霉毒素污染问题严重威胁花生消费安全和出口贸易。花生黄曲霉毒素污染是产毒菌株侵入、次级代谢产物积累的结果,黄曲霉的侵染率与产毒水平直接影响花生黄曲霉毒素污染程度[16]。我国地处黄曲霉毒素污染较严重区,由于自然地理条件和农业生态差异,我国花生黄曲霉毒素污染水平、菌株分布与产毒力呈现明显的地域差异[9,18,22-23]。因此,探明我国不同地区花生黄曲霉菌株侵染特征及其与产毒、地理来源的关系,对抗黄曲霉花生品种选育以及针对性的毒素污染防控具有重要意义。目前,对花生抗侵染、抗产毒种质筛选,以及黄曲霉菌株产毒力研究已有较多报道[6,24-26],但对菌株侵染力研究报道较少。本研究对分离自我国花生主产省的102株不产毒、中低产毒以及高产毒黄曲霉菌株进行侵染力鉴定和侵染特征分析,结果表明供试的黄曲霉(产毒力范围为0—18 038.50 μg·kg-1)均具有侵染能力,侵染指数范围为3.89%—67.50%,不同产毒力菌株的侵染指数在1—4级均有分布,说明同一产毒力等级菌株间侵染力也存在强弱的差异。进一步对菌株产毒力与侵染力进行聚类及相关性分析,结果表明菌株产毒量与侵染指数无显著相关性。但总体上中低产毒菌株和高产毒菌株的平均侵染指数高于不产毒菌株,中低产毒、高产毒菌株的侵染指数分别在4级和3级的占比最高,侵染力更强,引起花生黄曲霉毒素污染风险更高,是防控的重点,该结果与唐兆秀等[16]对福建省菌株侵染力研究结果一致。对不同地理来源黄曲霉侵染力研究表明,黄曲霉菌株间存在显著的地域差异,例如广东、辽宁分离的菌株侵染力与其他省份存在显著差异(表4),但同一省份内仅湖北襄阳与湖北阳逻的黄曲霉侵染指数差异显著(数据未发表)。总体上南方和长江流域产区的花生黄曲霉侵染指数在3级和4级的占比最高,东北和北方产区黄曲霉侵染指数主要分布在1级和2级。我国花生黄曲霉毒素污染风险在长江流域及南方花生产区最高,北方次之,东北产区污染风险最低[9,26]。本研究不同产区菌株平均侵染力水平及高侵染力菌株分布区域与产后花生黄曲霉毒素污染程度基本一致,表明长江流域和南方花生产区土壤中黄曲霉菌株侵染力强是毒素污染风险高的原因之一。
我国在花生种子抗黄曲霉侵染或产毒以及荚壳抗侵染种质筛选鉴定方面取得了较大进展。如邱西克等[6]对276份花生种质材料进行了荚壳侵染抗性鉴定,发现不同种质资源对黄曲霉的侵染抗性存在显著差异,筛选出荚壳抗侵染的花生种质。但对侵染和产毒抗性综合进行筛选的相关报道较少。近期,蒋艺飞等[27]鉴定获得了一份兼抗侵染和产毒的大果新种质,发现一般情况下抗侵染的材料也具有产毒抗性,抗侵染和抗产毒的花生种子材料较小。本研究通过对黄曲霉菌株侵染力鉴定表明黄曲霉对花生的侵染力与菌株、品种及环境存在一定互作关系,不同产毒力、不同地理来源菌株侵染力存在显著差异,因此建议在抗侵染和抗产毒花生种质选育过程中,要选择高产毒、高侵染力的菌株作为抗性鉴定的菌源,同时也要对不同产毒力、不同侵染力菌株进行抗性测定和综合分析,以便获得具有广谱抗性、适应性强的花生种质材料。
黄曲霉毒素是一类聚酮衍生物,调控其合成的是第54号次级代谢基因簇,由于黄曲霉毒素基因簇存在大片段缺失、插入、基因簇重排和点突变等多种变异形式[28,29],导致黄曲霉菌株间产毒力存在差异。本研究发现,不同产毒力黄曲霉菌株间存在致病分化现象,总体上产毒菌株的侵染力比不产毒菌株的侵染力更强,且菌株间侵染力存在显著的地域差异。但对于产生这种差异的原因尚未做深入研究,因此下一步一方面需加大黄曲霉菌株侵染力鉴定的菌株量,获取更多的侵染力差异的菌株资源,另一方面基于基因组、代谢组等多组学关联分析,研究黄曲霉群体结构及其与产毒力、侵染力的关系,探明黄曲霉菌株侵染力差异机制、演化规律及其与地理、气候、品种等互作关系,为抗黄曲霉花生育种、基因资源筛选以及黄曲霉毒素污染精准防控提供理论依据。
4 结论
黄曲霉菌株间存在致病力分化现象,不同产毒力等级、不同地区菌株侵染力差异显著,中低产毒和高产毒菌株的侵染指数分别在4级和3级的占比最高,产毒黄曲霉比不产毒黄曲霉侵染力更强。长江流域和南方产区黄曲霉侵染指数分别在3级和4级的占比最高,东北和北方产区黄曲霉侵染指数主要分布在1级和2级,且其平均侵染指数以及高侵染力菌株比例均低于长江流域和南方产区。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1146/phyto.2011.49.issue-1URL [本文引用: 1]
DOI:10.1093/ajcn/80.5.1106URL [本文引用: 2]
DOI:10.3390/toxins7104157URL [本文引用: 1]
DOI:10.1016/j.foodcont.2015.06.029URL [本文引用: 1]
DOI:10.3146/AT07-008.1URL [本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.3390/toxins9010040URL [本文引用: 5]
DOI:10.1111/mpp.2007.8.issue-6URL [本文引用: 1]
[本文引用: 1]
DOI:10.3146/AT07-009.1URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.17520/biods.2019034 [本文引用: 1]

黄曲霉(Aspergillus flavus)是一种广泛分布的腐生真菌, 是黄曲霉毒素B (aflatoxin B, AFB)和圆弧偶氮酸(cyclopiazonic acid, CPA)的主要产生菌, 也是动植物的条件致病菌。全球的玉米、花生和棉籽均不同程度地遭到黄曲霉及其毒素的污染。黄曲霉菌株间在形态学、遗传学和产毒特性上变异较大, 且其居群遗传结构也尚不明确。为了揭示黄曲霉居群遗传结构及其产毒素特性的规律, 本研究选取了从我国26省区(包括大小兴安岭)不同环境中分离的黄曲霉88株, 结合模式菌株和国际权威菌株9株, 基于钙调蛋白基因(CaM)和β-微管蛋白基因(benA)进行多基因序列分型(multi-locus sequence typing, MLST), 使用MEGA 6.0和Structure 2.3.4软件进行系统发育学分析和居群结构推导, 并结合菌株的产毒特性(AFB和CPA)进行比较分析。结果显示本研究的97株黄曲霉可分为3个居群, 即黄曲霉居群I、黄曲霉居群II和米曲霉居群, 该97株黄曲霉共有17个序列型(sequence type, ST), 其中我国的88株菌分布于15个序列型。米曲霉居群均不产AFB, 黄曲霉居群I和II的菌株绝大多数都产AFB和CPA, 其产毒特性只具有菌株特异性, 与居群和序列型无关。黄曲霉菌株产毒特性与地理分布或农作物类型间存在一定关系。我国东北玉米产区、西北干旱棉花产区和南方花生产区的黄曲霉居群I和II菌株均产AFB和CPA, 我国青海可可西里和四川阿坝地区的黄曲霉仅产CPA而不产AFB, 不产AFB的米曲霉居群大部分来自我国气候和地理环境多样的华北地区, 该地区也是我国农村传统酿造黄豆酱的地区。
DOI:10.17520/biods.2019034 [本文引用: 1]

黄曲霉(Aspergillus flavus)是一种广泛分布的腐生真菌, 是黄曲霉毒素B (aflatoxin B, AFB)和圆弧偶氮酸(cyclopiazonic acid, CPA)的主要产生菌, 也是动植物的条件致病菌。全球的玉米、花生和棉籽均不同程度地遭到黄曲霉及其毒素的污染。黄曲霉菌株间在形态学、遗传学和产毒特性上变异较大, 且其居群遗传结构也尚不明确。为了揭示黄曲霉居群遗传结构及其产毒素特性的规律, 本研究选取了从我国26省区(包括大小兴安岭)不同环境中分离的黄曲霉88株, 结合模式菌株和国际权威菌株9株, 基于钙调蛋白基因(CaM)和β-微管蛋白基因(benA)进行多基因序列分型(multi-locus sequence typing, MLST), 使用MEGA 6.0和Structure 2.3.4软件进行系统发育学分析和居群结构推导, 并结合菌株的产毒特性(AFB和CPA)进行比较分析。结果显示本研究的97株黄曲霉可分为3个居群, 即黄曲霉居群I、黄曲霉居群II和米曲霉居群, 该97株黄曲霉共有17个序列型(sequence type, ST), 其中我国的88株菌分布于15个序列型。米曲霉居群均不产AFB, 黄曲霉居群I和II的菌株绝大多数都产AFB和CPA, 其产毒特性只具有菌株特异性, 与居群和序列型无关。黄曲霉菌株产毒特性与地理分布或农作物类型间存在一定关系。我国东北玉米产区、西北干旱棉花产区和南方花生产区的黄曲霉居群I和II菌株均产AFB和CPA, 我国青海可可西里和四川阿坝地区的黄曲霉仅产CPA而不产AFB, 不产AFB的米曲霉居群大部分来自我国气候和地理环境多样的华北地区, 该地区也是我国农村传统酿造黄豆酱的地区。
DOI:10.1007/s10658-008-9426-7URL [本文引用: 1]
[本文引用: 4]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1021/jf001333iURL [本文引用: 1]
DOI:10.3146/AT07-004.1URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/s12298-018-0522-7URL
DOI:10.3390/toxins8020046URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1128/AEM.70.3.1253-1262.2004URL [本文引用: 1]
