 ,1,2, 冯波
,1,2, 冯波 ,1, 曹芳1, 李升东1, 王宗帅1, 张宾1, 王峥1, 孔令安1, 王法宏1
,1, 曹芳1, 李升东1, 王宗帅1, 张宾1, 王峥1, 孔令安1, 王法宏1Effects of Nitrogen Application Rate on Assimilate Accumulation, Transportation and Grain Yield in Wheat Under High Temperature Stress After Anthesis
GAO ChunHua ,1,2, FENG Bo
,1,2, FENG Bo ,1, CAO Fang1, LI ShengDong1, WANG ZongShuai1, ZHANG Bin1, WANG Zheng1, KONG LingAn1, WANG FaHong1
,1, CAO Fang1, LI ShengDong1, WANG ZongShuai1, ZHANG Bin1, WANG Zheng1, KONG LingAn1, WANG FaHong1通讯作者:
责任编辑: 杨鑫浩
收稿日期:2020-05-11接受日期:2020-07-29网络出版日期:2020-11-01
| 基金资助: |
Received:2020-05-11Accepted:2020-07-29Online:2020-11-01
作者简介 About authors
高春华,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (519KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
高春华, 冯波, 曹芳, 李升东, 王宗帅, 张宾, 王峥, 孔令安, 王法宏. 施氮量对花后高温胁迫后小麦同化物积累、转运及产量的影响[J]. 中国农业科学, 2020, 53(21): 4365-4375 doi:10.3864/j.issn.0578-1752.2020.21.006
GAO ChunHua, FENG Bo, CAO Fang, LI ShengDong, WANG ZongShuai, ZHANG Bin, WANG Zheng, KONG LingAn, WANG FaHong.
0 引言
【研究意义】近年来全球平均温度升高,地域性高温经常发生[1,2,3,4],高温胁迫已经成为小麦产量形成过程的主要非生物限制因素之一。山东省位于黄淮海冬小麦主产区的东部,小麦在灌浆期经常遭遇3—5 d的高温天气,超过30℃的短时高温会引起旗叶光合速率降低、灌浆时间缩短,千粒重降低,籽粒中淀粉合成受阻,严重的地区和年份减产幅度可达30%以上[5,6,7]。开展不同施氮量对花后高温胁迫下小麦籽粒产量的影响及其形成生理基础的研究,为小麦抗逆稳产栽培提供技术支持,对保证粮食安全具有重大意义。【前人研究进展】小麦属喜凉作物,小麦籽粒灌浆的适宜温度是20℃—30℃[8],当温度超过35℃时,小麦籽粒产量显著降低[9]。高温胁迫后,叶片叶素绿含量降低,加速叶片衰老,缩短了叶片中光合产物向籽粒中的运输时间[10]。籽粒灌浆终止早于叶片完全衰老,导致叶片光合产物被分配到其他营养器官中[11],从而降低了叶片中同化物质向籽粒中的转运[12],抑制了籽粒中光合产物的累积,最终影响粒重和产量。氮的供应改变热胁迫对小麦籽粒重量影响程度[13,14],小麦在高施氮量下灌浆期高温胁迫效应更为显著,籽粒产量减产幅度增大[15,16]。低施氮量的粒重在高温胁迫后降低幅度小于高施氮量[17],高土壤有效氮供给下,高温胁迫对籽粒产量和产量构成因素损害更大[16]。高温胁迫下,灌浆期缩短,淀粉积累进程提前结束[7]。蔗糖合成酶是蔗糖向淀粉转化过程中的第1个限速酶,其活性高低和活性持续期长短决定着籽粒灌浆速率的大小和持续时间的长短,并与籽粒的体积和重量密切相关[18]。高温胁迫显著降低了小麦籽粒蔗糖合成酶活性[19,20],而施氮量不足或过量降低玉米穗位叶蔗糖合成酶活性[21,22]。前人通过增施穗肥、叶面施镁、选择品种和调整播期等措施减小高温胁迫伤害[23,24,25,26],为降低高温胁迫危害提供了理论依据。然而,由于小麦生育后期高温胁迫的突发性,胁迫发生程度、发生时间、持续时间等的不确定性,生产上调控高温胁迫的栽培技术大都具有一定的局限性。【本研究切入点】考虑到高温胁迫的频发性以及氮肥管理的普遍性,在前人研究基础上,研究不同施氮量对小麦花后高温胁迫的影响。前人关于高温胁迫研究多在温室、生长箱和盆栽条件下进行,在大田条件下,不同施氮量对花后高温胁迫后小麦产量影响的报道较少。【拟解决的关键问题】本研究以济麦44为材料,在大田条件下,通过搭建增温棚进行高温胁迫处理,探讨不同施氮量下小麦同化物积累分配转运及相关酶活性对花后高温胁迫的响应,明确高温胁迫对冬小麦产量影响以及不同施氮量对花后高温胁迫后小麦籽粒产量形成影响的生理基础,为冬小麦抗逆和调优栽培提供技术和理论支撑。1 材料与方法
1.1 试验地概况
试验于2018—2019年小麦生长季,在山东省农业科学院济南试验基地(117.07°E,36.68°N)和山东省农业科学院济阳试验基地(117.22°E,36.98 °N)两地进行。济南试验地为褐土,有机质含量15.1 g·kg-1,全氮1.29 g·kg-1,速效氮60.9 mg·kg-1,速效磷34.6 mg·kg-1,速效钾146.7 mg·kg-1;济阳试验地为潮土,有机质含量10.3 g·kg-1,全氮1.20 g·kg-1,速效氮59.9 mg·kg-1,速效磷32.7 mg·kg-1,速效钾129.8 mg·kg-1。1.2 试验设计
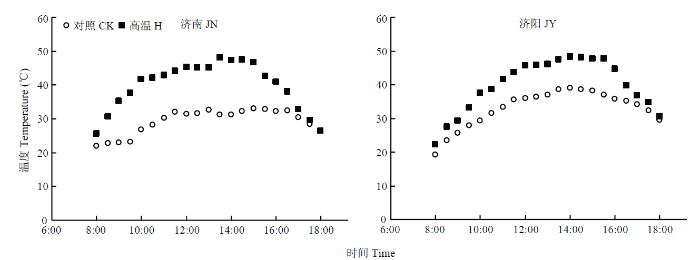
田间搭建高温棚,于花后10 d至花后17 d进行高温胁迫(H),搭建高温棚期间,无有效降雨。高温棚采用0.07 mm无色透明的聚乙烯塑料膜做成,透光率为92.3%,棚高1.5 m,棚底距地面30 cm,保证棚内通风条件良好,底面积与小区面积相同。每日8:00—18:00进行高温处理,在试验小区冠层位置悬挂温湿度计,每30 min自动记录温湿度,以此计算两地试验各处理增温阶段日均温度(图1)。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1对照和花后高温胁迫处理下的小麦冠层温度
Fig. 1The wheat canopy temperature of control and heat stress
试验材料选用山东省地区推广的小麦品种济麦44(JM44),采用二因素随机区组设计,设2个温度处理(CK:未胁迫,H:高温胁迫),3个氮肥水平(低氮N1:180 kg·hm-2,常规N2:240 kg·hm-2,高氮N3:300 kg·hm-2),小区面积12 m2,重复3次。所用肥料为尿素(N 46.4%),磷酸二铵(P2O5 46%,N 18%),氯化钾(K2O 52%),50%氮肥作为基施,播种时同时施入,50%于拔节期追施。磷钾肥用量为P2O5 112.5 kg·hm-2、K2O 112.5 kg·hm-2,全部基施。2018年10月15日播种,基本苗为180株/m2,其他田间管理同正常大田。
1.3 测定项目与方法
1.3.1 取样 济南试验地开花期为5月2日,成熟期为6月4日;济阳试验地开花期为5月7日,成熟期为6月12日。开花期对长势一致的单茎挂牌标记,开花期和成熟期取标记的单茎,分为穗、旗叶、其余叶、茎+叶鞘,105℃杀青30 min,80℃烘至恒重,测干物质重。于高温胁迫第3天,取标记植株的穗和旗叶,液氮速冻,置-80℃冰箱保存,用于测定蔗糖合成酶活性。成熟后每小区收获2 m2计产。1.3.2 干物质积累与分配的测定 开花期和成熟期数分蘖成穗数,成熟期按叶、茎+叶鞘、穗轴+颖壳和籽粒4部分分样,称重后用于计算各器官分配比例。同化物质的转运和积累计算公式如下[27]:
营养器官开花前贮藏干物质转运量=开花期营养器官干重-成熟期营养器官干重;
营养器官开花前贮藏干物质转运率(%)=(开花期营养器官干重-成熟期营养器官干重)/开花期营养器官干重×100;
开花后干物质输入籽粒量=成熟期籽粒干重-营养器官花前贮藏干物质转运量;
营养器官花前贮藏干物质对籽粒产量的贡献率(%)=开花前营养器官贮藏干物质转运量/成熟期籽粒干重×100;
开花至成熟期的干物质积累速率=(成熟期的干物质积累量-开花期的干物质积累量)/开花至成熟的天数。
1.3.3 旗叶SPAD值测定 于胁迫后第3天,采用SPAD-502PLUS便携式叶绿素仪(日本托普),选取10个标记的单茎旗叶和顶二叶进行测量,取平均值。
1.3.4 酶活性测定方法 蔗糖合成酶合成方向活性测定参考RUFTY等[28]的方法,并加以改进。200 μL酶液加50 μL pH7.5的 HEPES-NaOH缓冲液、50 μL 10 mmol·L-1 MgCl2、100 μL 50 mmol·L-1 UDPG、100 μL 50 mmol·L-1 6-磷酸果糖,30℃反应30 min后,100℃水浴杀死酶活性,加200 μL 40% NaOH溶液混匀,100℃保温10 min,加 2.0 mL30%盐酸混匀,80℃保温10 min,再加1 mL 1%间苯二酚,混匀后 80℃保温10 min,冷却后于480 nm下比色测生成磷酸蔗糖含量。用蔗糖生成量表示酶活性。
蔗糖合成酶分解方向活性测定参考SEBKOVA等[29]的方法,取4个1.5 mL的离心管,分别标记对照管、测定管、标准管和空白管。对照管:10 μL酶提取液加40 μL pH7.5的HEPES-NaOH缓冲液;测定管:10 μL酶提取液加40 μL HEPES-NaOH缓冲液(含蔗糖和MgAc2·4H2O),将对照管和测定管30℃水浴30 min后,95℃水浴10 min(盖紧,防止水分散失)。标准管:10 μL的20 mg·mL-1果糖标准液加40 μL pH 7.5的HEPES-NaOH缓冲液;空白管:10 μL的蒸馏水加40 μL pH7.5的HEPES-NaOH缓冲液。在4个离心管中加50 μL DNS试剂终止反应,混匀,沸水浴5 min,冷却后加400 μL蒸馏水,混匀后测定540 nm处的吸光值。对照反应体系中不含UDPG。
1.4 数据分析与方法
用Excel 2010进行数据处理,籽粒产量、同化物的积累、转运、分配及相关酶活性等指标均进行3次重复检测,所有指标进行二因素随机区组的方差分析(DPS18.5数据处理系统),并采用多重比较法中的最小显著性差异法(LSD)进行高温、氮肥及两者交互作用的方差检测(P<0.05),用Sigmaplot10.0软件作图。2 结果
2.1 不同处理籽粒产量及减产率
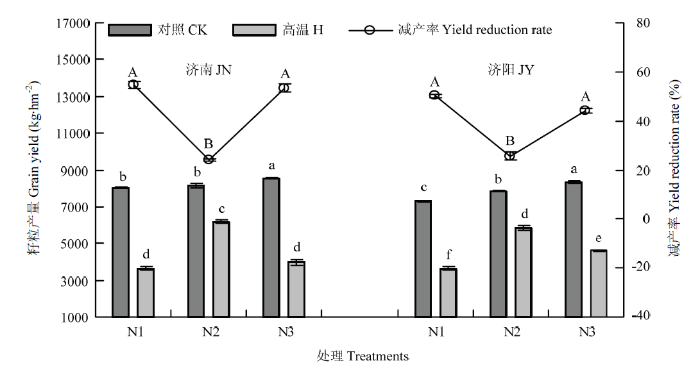
与对照相比,高温胁迫显著降低2个试验点小麦籽粒产量,但不同施氮量处理减产率不同(图2),N1、N2、N3处理的减产率分别为54.78%、24.05%、54.49%(济南)和50.19%、25.29%、44.13%(济阳)。2个试验地均是N2处理减产率最低,显著低于N1和N3处理。表明N2处理可以缓解花后高温胁迫对小麦籽粒产量的抑制。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2高温胁迫和施氮量对小麦籽粒产量和减产率的影响
不同小写字母代表示产量处理间差异达5%显著水平,不同的大写字母表示减产率处理间差异达5%显著水平
Fig. 2Effects of high temperature stress and nitrogen application rate on grain yield and yield reduction rate
Different small letters indicate significant difference among treatments at 0.05 level on grain yield, and different capital letters indicate significant difference among treatments at 0.05 level on yield reduction rate
2.2 不同处理产量构成因素及同化物积累
高温、施氮量及两者间的交互作用对各性状均有极显著的影响,与对照相比,高温胁迫使单穗重、穗粒数、千粒重、成熟期同化物积累量、积累速率和籽粒收获指数均显著降低,但不同氮处理降低的幅度不同(表1)。Table 1
表1
表1高温胁迫和施氮量对小麦产量构成因素及同化物积累的影响
Table 1
| 处理 Treatment | 单穗重 WPP (g) | 穗粒数 GWPP | 千粒重 TKW (g) | 成熟期同化物积累量 AAAM (kg·hm-2) | 花后同化物积累速率AARAA (kg·hm-2·d-1) | 收获指数 HI (%) |
|---|---|---|---|---|---|---|
| 济南JN | ||||||
| CKN1 | 1.29±0.03b | 34.50±0.5c | 47.30±0.30a | 15785.52±114.40b | 157.16±1.03b | 50.92±0.63a |
| CKN2 | 1.46±0.008a | 35.50±0.1b | 45.03±0.66b | 16967.30±283.20a | 182.83±1.35a | 47.96±1.65a |
| CKN3 | 1.56±0.02a | 36.80±0.1a | 43.83±0.04c | 17716.02±607.11a | 180.31±12.75a | 48.24±1.53a |
| HN1 | 0.87±0.06c | 29.75±0.25e | 19.56±0.24d | 13697.32±155.75c | 93.07±2.73c | 26.53±0.39c |
| HN2 | 1.24±0.05b | 32.05±0.35d | 37.14±0.27c | 15671.66±173.46b | 138.45±1.64b | 39.41±0.09b |
| HN3 | 0.94±0.02c | 30.45±0.05e | 17.12±0.54e | 14399.02±143.37c | 107.02±5.20c | 27.57±0.79c |
| 济阳JY | ||||||
| CKN1 | 1.30±0.003c | 34.00±0.8b | 49.15±0.23a | 16190.53±79.64c | 153.17±0.002c | 45.00±0.50ab |
| CKN2 | 1.40±0.003b | 36.60±0.2a | 45.32±0.03a | 16883.76±50.68b | 166.55±3.67b | 46.48±0.01a |
| CKN3 | 1.66±0.004a | 37.75±0.05a | 44.05±0.36a | 18902.49±8.95a | 203.00±1.30a | 43.99±0.40b |
| HN1 | 1.00±0.004e | 30.50±0.50c | 21.41±3.53b | 14331.65±52.49f | 103.47±1.36e | 25.33±0.69e |
| HN2 | 1.13±0.14d | 32.95±0.15b | 38.71±1.25c | 15392.29±69.81d | 116.66±2.48d | 37.94±1.13c |
| HN3 | 1.01±0.01e | 30.80±0.9c | 24.54±0.29c | 14565.30±94.87e | 88.96±0.56f | 31.89±0.41d |
| FH | 691.42** | 369.32** | 885.17** | 368.11** | 691.45** | 1028.87** |
| FN | 47.68** | 27.25** | 73.18** | 49.49** | 34.07** | 58.12** |
| FH×N | 48.21** | 14.68** | 90.81** | 34.47** | 31.95** | 64.22** |
新窗口打开|下载CSV
高温胁迫后,千粒重和花后同化物积累速率下降,差异极显著,N1和N3处理千粒重2个试验地降幅为44.28%—60.94%,N2处理为17.53%(济南)和14.59%(济阳),N1和N3处理花后同化物积累速率降幅为32.45%—56.18%,N2处理为24.27%(济南)和29.96%(济阳),说明粒重降低和花后同化物积累速率减缓是花后高温胁迫导致产量降低的主要原因,N2处理在花后高温胁迫后能保持较高的粒重和花后同化物积累速率,从而获得相对较高的籽粒产量。
2.3 成熟期同化物在各器官的分配量及比例
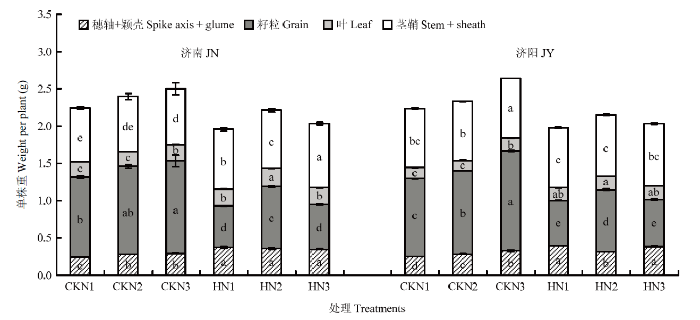
高温胁迫后穗轴+颖壳、叶片和茎鞘的同化物积累量显著升高,粒重显著降低,最终单茎重显著降低(图3)。不同施氮量处理中,N2处理籽粒重最高。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3成熟期同化物在不同器官中的积累量
不同小写字母表示相同器官处理间差异达5%显著水平。下同
Fig. 3Assimilate accumulation in different organs at maturity
Different small letters indicate significant difference among treatments at 0.05 level on the same organs. The same as below
高温胁迫使成熟期同化物在穗轴+颖壳、叶片、茎鞘中的百分比较对照显著增加,籽粒中的百分比显著降低(图4)。高温胁迫使N2处理籽粒中百分比下降30.30%(济南)和24.60%(济阳),显著小于N1(济南67.92%,济阳66.91%)和N3处理(济南52.33%,济阳62.93%)。高温胁迫后N1和N3处理同化物在穗轴+颖壳中分配比例的增幅(31%—42.38%)显著高于叶片(12.38%—27.72%)和茎鞘(12.42%—28.44%)。
图4
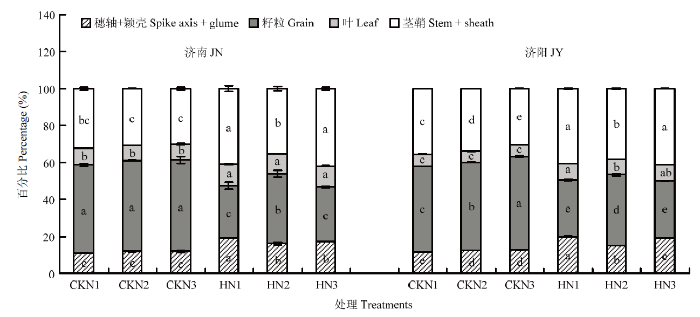 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4成熟期同化物在不同器官中的分配比例
Fig. 4Assimilate allocation ratio in different organs at maturity
2.4 开花后营养器官中同化物向籽粒中的转运
花前营养器官同化物转运量、转运率和对籽粒的贡献率、花后同化物积累量和对籽粒的贡献率在高温、施氮量及两者间的交互作用下均存在显著性差异(表2)。高温胁迫显著降低了不同氮处理花前同化物的转运量、转运率、对籽粒的贡献率以及花后同化物积累量,而花后同化物积累量对籽粒的贡献率升高。高温胁迫后N2处理花前同化物的转运量、转运率以及花后同化物积累量均显著高于N1和N3处理,降幅小于N1和N3处理。高温胁迫下,济南试验地的花前同化物对籽粒的贡献率N1和N2处理间无显著差异,但显著高于N3处理;济阳试验地的N2和N3处理间无显著差异,但是显著高于N1处理;济南试验地的花后同化物对籽粒的贡献率N1和N2处理间无显著差异,但显著低于N3处理,济阳试验地的N2和N3处理间无显著差异,但是显著低于N1处理。说明N2处理在高温胁迫下保持较高的同化物向籽粒中转运的能力。Table 2
表2
表2花前同化物向籽粒的转运量及花后同化物积累量对高温胁迫和施氮量的响应
Table 2
| 处理 Treatment | 花前同化物AABA | 花后同化物AAAA | ||||
|---|---|---|---|---|---|---|
| 转运量 TA (kg·hm-2) | 转运率 TR (%) | 籽粒贡献率 CR (%) | 积累量 AA (kg·hm-2) | 籽粒贡献率 CR (%) | ||
| 济南JN | ||||||
| CKN1 | 2213.18±143.97b | 21.18±1.08a | 27.55±0.07b | 5343.56±35.02b | 72.45±0.07cd | |
| CKN2 | 2144.03±116.87b | 19.93±0.65a | 26.39±0.10b | 6216.09±45.84a | 73.61±0.10c | |
| CKN3 | 2655.26±128.60a | 22.91±0.77a | 31.10±1.43a | 6130.58±433.58a | 68.90±1.43d | |
| HN1 | 746.73±106.73d | 7.07±0.85c | 20.49±0.40c | 3164.33±92.76c | 79.51±1.40b | |
| HN2 | 1224.37±113.86c | 11.15±0.81b | 19.30±1.08c | 4707.26±55.68b | 80.20±1.58b | |
| HN3 | 635.84±133.17d | 5.88±1.06c | 15.90±0.74d | 3638.70±176.82c | 84.10±0.74a | |
| 济阳JY | ||||||
| CKN1 | 2020.81±16.37b | 18.93±0.14a | 27.74±0.40a | 5514.26±0.08c | 72.26±0.40b | |
| CKN2 | 2145.54±48.82a | 19.26±0.64a | 27.34±0.71a | 5995.88±132.08b | 72.66±0.71b | |
| CKN3 | 2255.84±37.18a | 19.43±0.39a | 27.14±0.68a | 7308.18±46.95a | 72.86±0.68b | |
| HN1 | 653.49±28.92e | 6.16±0.27d | 18.00±0.37d | 3724.92±48.83e | 82.00±0.37a | |
| HN2 | 1696.53±3.97c | 15.17±0.11b | 29.07±0.80a | 4199.76±89.11d | 70.93±0.80b | |
| HN3 | 1320.79±35.39d | 11.63±0.35c | 28.44±0.94a | 3202.57±20.10f | 71.56±0.94b | |
| FH | 516.60** | 765.81** | 193.99** | 726.97** | 128.53** | |
| FN | 20.79** | 20.43** | 11.00** | 34.93** | 7.92** | |
| FH×N | 23.5794** | 31.54** | 15.83** | 34.37** | 11.83** | |
新窗口打开|下载CSV
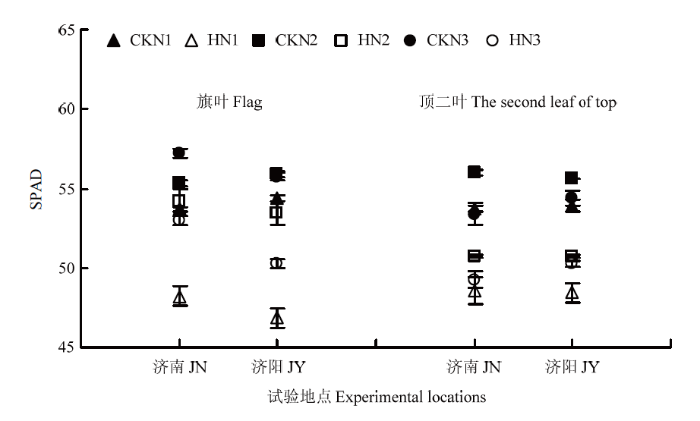
2.5 不同叶位叶片的SPAD值
与对照相比,高温胁迫显著降低了旗叶和顶二叶的SPAD值,且不同施氮量处理间存在显著差异(图5)。高温胁迫后N1、N2和N3处理旗叶SPAD值的降幅分别为10.24%、1.99%、7.40%(济南)和13.91%、4.36%、9.87%(济阳)。N2处理旗叶SPAD值降幅最低,在高温胁迫后仍具有较高的叶绿素含量。高温胁迫N1、N2和N3处理后顶二叶SPAD值的降幅分别为9.62%、9.29%、7.74%(济南)和10.14%、8.69%、7.60%(济阳),降幅在不同氮肥水平间差异不显著。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5高温胁迫和施氮量对不同叶位叶片SPAD值的影响
Fig. 5Effects of high temperature stress and nitrogen application rate on SPAD value of leaves at different positions
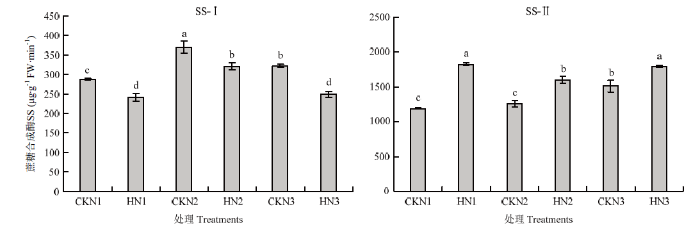
2.6 籽粒和旗叶中蔗糖合成酶活性
由图6可知,与对照相比,高温胁迫后籽粒中蔗糖合成酶分解方向(SS-Ⅰ)酶活显著降低,N1处理降幅为16.36%,N2降幅为13.43%,N3降幅为22.69%。籽粒中蔗糖合成酶合成方向(SS-Ⅱ)的酶活显著升高,N1处理升幅为34.85%,N2处理升幅为21.31%,N3处理升幅15.94%。说明籽粒中合成淀粉的底物减少,淀粉的合成量减少,最终影响粒重。图6
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6不同处理籽粒中蔗糖合成酶活性(济南)
SS-Ⅰ:蔗糖合成酶分解方向,SS-Ⅱ:蔗糖合成酶合成方向。不同小写字母表示处理间差异达5%的显著水平。下同
Fig. 6Sucrose synthase activity under different treatments in wheat grain (JN)
SS-Ⅰ: Sucrose synthetase-I activity points to synthetic, SS-Ⅱ: Sucrose synthetase-Ⅱactivity points to decomposition. Different small letters indicate significant difference among treatments at 0.05 level. The same as below
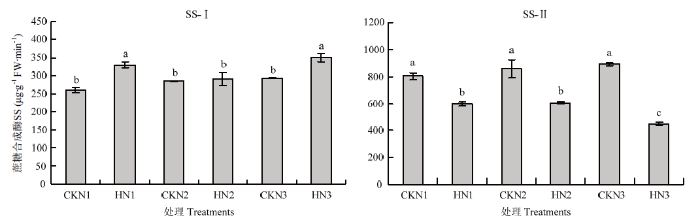
高温胁迫后旗叶在下蔗糖合成酶分解方向活性升高,其中N1和N3处理较对照差异显著,N2处理与对照无显著差异(图7)。各施氮量处理旗叶蔗糖合成酶合成方向活性显著降低,N3处理显著低于N1和N2处理。说明高温胁迫导致旗叶蔗糖分解能力升高,合成蔗糖能力降低,输出物质减少。
图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7不同处理旗叶中蔗糖合成酶活性(济南)
Fig. 7Sucrose synthase activity under different treatments in flag of wheat (JN)
3 讨论
3.1 施氮量对高温胁迫后小麦籽粒产量及产量构成因素的影响
LIU等[30]通过冬季增温和氮肥试验表明,施氮处理在增温条件下籽粒产量显著低于未施氮处理。对玉米和春小麦的高温肥料试验表明,随着氮肥供给的增加,籽粒减产率增加[30,31],MóNICA等[17]通过在不同地力条件下进行高温胁迫试验发现,土壤供氮量越高籽粒减产率越大。本试验在基础地力相当的济南、济阳两地进行,通过不同的施氮量改变土壤供氮量,籽粒产量和减产率均表现显著差异,施氮量从180 kg·hm-2(N1)增加到240 kg·hm-2(N2),花后高温胁迫对籽粒产量影响降低,施氮量增加到300 kg·hm-2(N3),高温胁迫对籽粒产量的影响显著增加,在对照条件下,N3的籽粒产量高,高温胁迫后籽粒产量减产的绝对值也大。说明低施氮量和过高施氮量均加剧高温胁迫对产量的抑制作用,合理施氮量可以相对减小花后高温胁迫的危害,获得较高籽粒产量。在本试验条件下,240 kg·hm-2为合理的施氮量。灌浆期高温胁迫使穗粒数和粒重均显著降低,但降低量随着氮供应量升高而升高[17]。也有盆栽试验发现,花后高温胁迫后,适量氮肥增加穗粒数及籽粒千粒重,提高籽粒产量[31]。本试验高温胁迫后,各处理单穗重、穗粒数、千粒重、成熟期同化物积累量、花后同化物积累速率和收获指数均显著降低。其中,N2处理单穗重、穗粒数、千粒重、成熟期同化物积累量、花后同化物积累速率和收获指数显著高于N1和N3处理,说明N2处理能降低同化物积累和花后同化物积累速率降幅,降低高温胁迫对单穗重、穗粒数、千粒重的损害程度,减轻产量损失。
3.2 施氮量对高温胁迫后小麦同化物积累转运的影响
小麦籽粒产量的影响因素是同化物的合成能力和同化物向籽粒中转运能力,转运能力与库对同化物的竞争能力有关。籽粒产量的1/3来自花前贮藏同化物的转运,2/3来自花后叶片光合同化物的积累[32]。研究表明,高温处理使同化物向库器官的分配受到阻碍,输出时间缩短,输出速率下降,产量降低[11,12]。适量氮肥处理能够促进高温胁迫下春小麦花前营养器官贮藏同化物向籽粒中转运,增加花后积累同化物对籽粒贡献率[31]。本研究结果表明,高温胁迫降低了花前贮藏同化物向籽粒中转移量和花后同化物的积累量,从而降低了成熟期同化物积累总量。成熟期籽粒中同化物的分配量及比例减少,而穗轴+颖壳和茎鞘的分配量和比例显著增加,这与前人的研究结果一致[10,11,12]。两地试验中,N2处理的花前营养器官同化物转运量和花后同化物的积累量均显著高于N1和N3处理,N2处理籽粒中同化物积累量和分配比例降幅低于N1和N3处理,在穗轴+颖壳和茎鞘中的分配量及比例的升幅显著高于N1和N3处理。济南试验地,N3处理的花后同化物的转运量低于N1和N2处理,花后同化物的积累量低于N2处理。济阳试验地,N3处理的花后同化物的转运量低于N2处理,高于N1处理,花后同化物的积累量低于N1和N2处理,表明在N3处理条件下不利于同化物的积累和转运。以上结果说明,N2处理较N1和N3处理能优化花后高温胁迫后同化物向籽粒中转运和分配,具有较高的同化物转运能力。3.3 施氮量对高温胁迫后叶片衰老和籽粒中酶活的影响
小麦开花后,旗叶作为功能叶其活力持续时间对于产量形成具有重要作用。MóNICA等[17]研究表明,高温对衰老模式的影响微乎其微,叶片SPAD读数无显著差异。而TALUKDER等[33]和WANG等[34]研究认为,高温胁迫加速了旗叶叶绿素含量的损失,促进旗叶衰老。本试验结果表明,高温胁迫显著降低了旗叶和顶二叶的SPAD值,N2处理较N1和N3处理能有效减缓旗叶叶绿素下降,延缓旗叶衰老。高温胁迫后,N2处理顶二叶SPAD值与N1、N3处理间差异不显著,这可能与顶二叶中衰老酶活性有关,尚需进一步研究。蔗糖是光合作用过程中最主要的产物,蔗糖合成酶是催化蔗糖进入其他新陈代谢途径的关键酶,具有双向催化作用。小麦籽粒中蔗糖合成酶SS-Ⅰ分解方向活性高低反映了籽粒降解蔗糖的能力,较高的活性可提供充足的淀粉合成底物。温度和施氮量影响蔗糖合成酶活性。小麦花前夜间增温下,蔗糖合成酶活性随施氮量的增加而增加[21]。刘霞等[35]研究认为,高温降低了籽粒中蔗糖合成酶活性。陈洋等[22]和赵宏伟等[23]发现施氮量不足或过量均导致玉米穗位叶蔗糖合成酶活性下降。本试验在济南和济阳结果表现一致,以济南试验点为代表检测酶活性,发现灌浆期高温胁迫后籽粒中蔗糖合成酶分解方向活性降低,合成方向活性升高;旗叶中蔗糖合成酶分解方向活性升高,合成方向活性降低。N2处理籽粒中蔗糖合成酶分解方向活性和旗叶中蔗糖合成酶合成方向活性高于N1和N3处理;高温胁迫后,N3处理籽粒中蔗糖合成酶分解方向活性最低,而旗叶中蔗糖合成酶合成方向的活性最高,表明N3处理籽粒中合成淀粉的底物少,降低了籽粒的粒重。说明N2处理籽粒中淀粉合成底物较多,旗叶具有较强的蔗糖合成能力,这是N2处理获得较高干物质积累量和粒重的基础。
4 结论
高温胁迫降低小麦成熟期干物质的积累量、向籽粒中的转运量及转运率,从而降低产量。N2(240 kg·hm-2)处理较N1(180 kg·hm-2)和N3(300 kg·hm-2)处理能够延缓花后高温胁迫后的旗叶衰老,使旗叶保持较高的蔗糖合成能力,籽粒保持较高的蔗糖分解能力,同化物积累和同化物向籽粒转运能力受损较低,获得较高籽粒产量。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 3]
[本文引用: 3]
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 4]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLPMID:16663233 [本文引用: 1]
DOI:10.1104/pp.108.1.75URLPMID:7784526 [本文引用: 1]

Sucrose synthase (EC 2.4.1.13) from carrot (Daucus carota) is a tetramer with a molecular mass of 320 kD and subunits of 80 kD. The enzyme has a pH optimum of 7.0 (cleavage direction). Maximal activities were measured at 55 degrees C. The Km for Suc was estimated as 87 mM and for UDP as 0.39 mM. Fructose acts as a noncompetitive inhibitor with an inhibition constant of 17.2 mM. In contrast, glucose inhibits carrot sucrose synthase uncompetitively with an inhibition constant of 4.3 mM. cDNA clones encoding a single class of sucrose synthase polypeptide were isolated and sequenced. DNA gel blot analysis also indicated the occurrence of only one to two genes. The deduced amino acid sequence of the carrot enzyme is highly homologous to the sucrose synthase sequences of tomato, potato, and bean. A comparison of the cDNA-derived amino acid sequence with the SS1- and SS2-type sucrose synthase sequences of the monocot plants maize, rice, and barley showed that the carrot enzyme is neither of the SS1 nor of the SS2 type. High enzyme activity was found in roots and petioles of developing carrot plants, with maximal activity in roots at the transition of primary roots to tap roots. Enzyme activity was highly correlated with both polypeptide and transcript levels, indicating that gene expression is regulated mainly at the mRNA level in the different tissues and organs of developing carrot plants.
DOI:10.1016/j.fcr.2013.07.006URL [本文引用: 2]
[D].
[本文引用: 3]
[D].
[本文引用: 3]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.fcr.2014.01.013URL [本文引用: 1]
DOI:10.1016/j.jplph.2010.09.016URLPMID:21247658 [本文引用: 1]

The objective of this study was to investigate the effect of pre-anthesis high-temperature acclimation on leaf physiology of winter wheat in response to post-anthesis heat stress. The results showed that both pre- and post-anthesis heat stresses significantly depressed flag leaf photosynthesis and enhanced cell membrane peroxidation, as exemplified by increased O(2)(-)(.) production rate and reduction in activities of antioxiditave enzymes. However, under post-anthesis heat stress, plants with pre-anthesis high-temperature acclimation (HH) showed much higher photosynthetic rates than those without pre-anthesis high-temperature acclimation (CH). Leaves of HH plants exhibited a higher Chl a/b ratio and lower chlorophyll/carotenoid ratio and superoxide anion radical release rate compared with those of the CH plants. In addition, antioxidant enzyme activities in HH plants were significantly higher than in CH. Coincidently, expressions of photosythesis-responsive gene encoding Rubisco activase B (RcaB) and antioxidant enzyme-related genes encoding mitochondrial manganese superoxide dismutase (Mn-SOD), chloroplastic Cu/Zn superoxide dismutase (Cu/Zn-SOD), catalase (CAT) and cytosolic glutathione reductase (GR) were all up-regulated under HH, whereas a gene encoding a major chlorophyll a/b-binding protein (Cab) was up-regulated by post-anthesis heat stress at 10 DAA, but was down-regulated at 13 DAA. The changes in the expression levels of the HH plants were more pronounced than those for the CH. Collectively, the results indicated that pre-anthesis high-temperature acclimation could effectively alleviate the photosynthetic and oxidative damage caused by post-anthesis heat stress in wheat flag leaves, which was partially attributable to modifications in the expression of the photosythesis-responsive and antioxidant enzymes-related genes.
[D].
[本文引用: 1]
[D].
[本文引用: 1]
