 ,, 朱永静, 张舒婷, 吕煜梦, 李晓斐, 宋雨洋, 赖钟雄, 林玉玲
,, 朱永静, 张舒婷, 吕煜梦, 李晓斐, 宋雨洋, 赖钟雄, 林玉玲 ,福建农林大学园艺植物生物工程研究所,福州 350002
,福建农林大学园艺植物生物工程研究所,福州 350002Whole-Genome Identification and Expression Analysis of SPL Gene Family in Dimocarpus Longan
LU BaoShun ,, ZHU YongJing, ZHANG ShuTing, Lü YuMeng, LI XiaoFei, SONG YuYang, LAI ZhongXiong, LIN YuLing
,, ZHU YongJing, ZHANG ShuTing, Lü YuMeng, LI XiaoFei, SONG YuYang, LAI ZhongXiong, LIN YuLing ,Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou 350002
,Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou 350002通讯作者:
责任编辑: 赵伶俐
收稿日期:2020-03-9接受日期:2020-05-9网络出版日期:2020-10-16
| 基金资助: |
Received:2020-03-9Accepted:2020-05-9Online:2020-10-16
作者简介 About authors
路保顺,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (1892KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
路保顺, 朱永静, 张舒婷, 吕煜梦, 李晓斐, 宋雨洋, 赖钟雄, 林玉玲. 龙眼SPL基因家族全基因组鉴定及表达分析[J]. 中国农业科学, 2020, 53(20): 4259-4270 doi:10.3864/j.issn.0578-1752.2020.20.014
LU BaoShun, ZHU YongJing, ZHANG ShuTing, Lü YuMeng, LI XiaoFei, SONG YuYang, LAI ZhongXiong, LIN YuLing.
0 引言
【研究意义】SPL(squamosa promoter binding- like)蛋白是一类参与植物众多生长发育过程的转录因子。龙眼(Dimocarpus longan Lour)富含丰富的磷质和维生素,对人的大脑和脾脏具有良好的调节作用[1]。龙眼果实的产量和质量取决于胚胎的发育状况,因此,鉴定SPL家族基因并研究其在龙眼胚胎发育阶段的表达,对龙眼果实质量、产量的改善具有重要意义[2]。【前人研究进展】SPL家族成员均含有一个SBP结构域,其家族成员最先在金鱼草(Antirrhinum majus)中被KLEIN等[3]鉴定出来,并命名为SBP1和SBP2。SPL家族成员广泛参与植物胚胎发育、叶片发育、发育阶段转变、花和果实发育、花青素积累等过程[4]。拟南芥中共有17个AtSPL成员[5],AtSPL1参与调控拟南芥低磷胁迫反应以及诱导有关磷饥饿基因在根际酸化反应的表达[6];AtSPL1与AtSPL12双突变体的花絮对热胁迫有很高的敏感度,AtSPL1和AtSPL12过表达时明显增强拟南芥的耐热性;AtSPL8的突变体会造成花药变小,花粉囊和花粉数目减少,从而导致不育,主要原因是AtSPL8突变体中花药某些角隅处孢原细胞无法正常形成造孢细胞和花药壁层细胞[7]。水稻中共有19个SPL家族成员[8],OsSPL21的突变导致叶绿素含量显著下降以及叶片的净光合速率远低于野生型,而过表达OsSPL16D可以促进水稻的细胞分裂,改变籽粒的大小和形状等[9]。前期研究发现SPL蛋白通过与MADS-box的squamosa启动子结合,对植物花的早期发育进行调控[10]。SPL基因家族在其他物种也有许多研究报道,例如葡萄VvSPL9和VvSPL10在不同组织中均有表达,尤其在营养器官和生殖器官的表达显著[11];牡丹PsSPL3在根中转录水平较高且响应赤霉素诱导,低温结合外施赤霉素可以解除花芽内休眠[12];白桦BpSPL在营养生长和生殖发育生长过程表达有显著变化,尤其是在顶芽雄花序的生长发育过程中的作用尤为明显[13];陆地棉GhSPL10表达趋势在脱分化前期与胚性再分化过程中完全相反,陆地棉胚性再分化提前发生是因为过表达GhSPL10能提高愈伤的增殖速率[14]。上述研究表明,SPL广泛参与植物的生长发育等各个进程。【本研究切入点】目前关于龙眼SPL(DlSPL)基因家族系统的分析尚未见报道。【拟解决的关键问题】本研究拟通过生物信息学方法鉴定出龙眼DlSPL所有成员,分析其基本结构特点,并通过qRT-PCR分析DlSPL成员在龙眼胚性培养物及非胚性培养物和不同激素处理下的胚性愈伤组织中的表达情况,为将来进一步研究龙眼DlSPL基因家族成员的生物学功能提供依据。1 材料与方法
试验于2019年4—12月在福建农林大学园艺植物生物工程研究所进行。1.1 材料
试验材料龙眼非胚性愈伤组织(nonembryonic callus,NEC)、胚性愈伤组织(embryoniccallus,EC)、不完全胚性紧实结构(incomplete embryonic compact structure,ICpEC)、球形胚(globularembryo,GE),脱落酸(ABA,100 μmol·L-1)和茉莉酸甲酯(MeJA,100 μmol·L-1)处理的龙眼EC[15,16]均由福建农林大学园艺植物生物工程研究所提供,3次生物学重复。1.2 方法
1.2.1 龙眼DlSPL家族成员的鉴定 从GIGADB(http://gigadb.org)中获取龙眼基因组[17]全长核苷酸序列及氨基酸序列。利用Pfam从龙眼基因组数据库中提取所有的SPL家族成员。采用HMMER在线软件(https://www.ebi.ac.uk/ Tools/hmmer/search/phmmer)对候选序列进行鉴定,筛选获得具有完整保守结构域的成员。初步鉴定出龙眼DlSPL家族16个候选成员。其中Dlo-026073.2具有重复的保守结构域,另外发现有两条序列的CDS序列完全相同,因此删除冗余序列,最终确定14个龙眼DlSPL家族成员。把14个DlSPL成员注释到拟南芥中,并对其命名。1.2.2 龙眼DlSPL家族系统进化树的构建 从NCBI(https://www.ncbi.nlm.nih.gov/geo/)下载拟南芥的氨基酸序列,采用MEGA5.0软件,基于邻近法(Neighbor-joining method)构建龙眼、拟南芥2个物种SPL家族系统发育进化树,并用自展法(Bootstrap)重复1 000次进行检验。
1.2.3 龙眼DlSPL家族基因结构、蛋白质理化性质及保守基序分析 利用GSDS2.0(http://gsds.cbi.pku.edu. cn/)在线软件对龙眼14条SPL基因家族成员进行基因结构分析并绘图。利用ExPASy和SignalP检测14条DlSPL氨基酸序列的蛋白的等电点(PI)、分子量(MW)和氨基酸数目(aa)。采用MEME(http://meme. nbcr.net/meme/cgi-bin/meme.cgi)对DlSPL家族成员进行保守基序分析。
1.2.4 龙眼DlSPL家族成员启动子序列的获得和分析 利用TBtools软件,从龙眼基因组数据库中提取DlSPL起始密码子ATG上游2 000 bp序列作为龙眼DlSPL的启动子,利用在线软件PlantCARE(http:// bioinformatics.psb.ugent.be/webtools/plantcare/html)分析其启动子顺式元件的种类和数量。
1.2.5 基于转录组的DlSPL家族FPKM值分析 从龙眼非胚性及胚性培养物各阶段(NEC、EC、ICpEC、GE)转录组、胚性愈伤组织不同激素处理(D:加2,4-D 1.0 mg·L-1的MS培养基;D_KT:加2,4-D 1.0 mg·L-1和KT 0.5 mg·L-1的MS培养基;KT:加KT 0.5 mg·L-1的MS培养基;MS:MS培养基,琼脂浓度7 g·L-1,蔗糖浓度20 g·L-1,MS作对照)转录组及不同光质(蓝光、白光,暗处理作对照)处理下转录组数据库[18]中提取DlSPL的基因表达水平(FPKM值),并利用TBtools软件绘制热图。
1.2.6 DlSPL家族的qRT-PCR分析 采用TransZol Up试剂盒(http://www.transgen.com.cn/)提取龙眼非胚性培养物、胚性培养物及不同激素处理下胚性愈伤组的总RNA,参照PrimeScriptTM IV 1st Strand cDNA Synthesis Mix试剂盒(https://www.takarabiomed.com. cn/)进行cDNA合成。DlSPL家族成员的qRT-PCR引物序列通过DNAMAN6进行设计(表1)。qRT-PCR反应体系(20 μL)包含:10 μL SYBR Premix Ex TaqTM II(TaKaRa)、7.4 μL ddH2O、上下游特异性引物各0.8 μL和1 μL cDNA模板。反应程序为94℃预变性30 s;94℃变性5 s,退火时间30 s,72℃延伸10 s,40个循环。以Eukaryotic elongation factor 1-alpha (EF-1α)作为内参基因。
Table 1
表1
表1qRT-PCR引物序列信息
Table 1
| 基因名称 Gene name | 引物序列 Primer sequence | 退火温度 Annealing temperature (℃) | 产物大小 Product size (bp) |
|---|---|---|---|
| DlSPL1 DlSPL5 DlSPL7 DlSPL8 DlSPL13 DlSPL14 EF-1α | CCCACGTGTGTTTACCGAG GGAGACAGATCCTTGATTGGTT GGTACCCATCCCTTTACGG TCGGAGTTTGATGAGGCC TGGTCAAACACAACAGAGCC AGGCCCCAAAGCTTCACTAT GAGGAGTGGTCTTCGAAGGAT TGTTGGAGTACGAGTGGGC GCAGCTTCTCTTTCCCTCATC AGTCCCTTCTTGCTTGGTTG GCTTCTCTTTCCCTCGTCAA ACCGCCGTCATAAAGTGTGT GATGATTCCCACCAAGCCCAT GGGTCCTTCTTCTCAACACTCT | 60.0 59.4 59.1 59.7 59.7 60.1 59.7 59.7 60.5 59.3 59.6 60.4 61.3 58.9 | 113 122 196 144 175 133 129 |
新窗口打开|下载CSV
2 结果
2.1 龙眼DlSPL家族成员鉴定及基本理化性质分析
利用Pfam软件分析其结构域,筛选出14个只含有一个SBP结构域的DlSPL家族成员。在NCBI与TAIR在线网站通过Blast比对,通过注释到拟南芥和水稻SPL家族,对14个DlSPL成员进行系统命名。ExPASy和SignalP对DlSPL家族成员基本理化性质鉴定结果显示(表2),该家族的氨基酸长度在138—1 062 aa,只有DlSPL1和DlSPL14的氨基酸数大于1 000 aa。蛋白分子量在15.61—118.42 kD,其中DlSPL1、DlSPL12和 DlSPL14的分子量超过100 kD。等电点(pI)在5.81—9.22。
Table 2
表2
表2DlSPL家族基本理化性质分析
Table 2
| 基因 ID Gene ID | 注释 Annotated | 氨基酸数 Number of amino acids | 分子量 Molecular weight (kD) | 等电点 pI |
|---|---|---|---|---|
| Dlo_001733.2SPL1 Dlo_031916.2SPL2 Dlo_022368.1SPL3 Dlo_006549.2SPL4 Dlo_010830.1SPL5 Dlo_003532.1SPL6 Dlo_032239.1SPL7 Dlo_028807.2SPL8 Dlo_028808.2SPL9 Dlo_031932.1SPL10 Dlo_003987.1SPL12 Dlo_031932.1SPL13 Dlo_028254.1SPL14 Dlo_009019.1SPL15 | AtSPL1 AtSPL2 AtSPL3 AtSPL4 AtSPL5 AtSPL6 AtSPL7 AtSPL8 AtSPL9 AtSPL10 AtSPL12 AtSPL13 AtSPL14 AtSPL15 | 1030 480 138 191 183 535 798 341 271 450 987 312 1062 383 | 114.71 52.61 15.61 21.82 20.48 58.38 89.32 38.20 29.80 49.42 109.25 33.74 118.42 40.56 | 6.94 8.75 7.65 8.83 9.13 7.00 6.07 8.83 9.12 7.28 5.81 8.86 8.24 9.22 |
新窗口打开|下载CSV
2.2 DlSPL基因家族的系统进化树分析
利用MEGA5.0对17个拟南芥SPL家族成员和14个龙眼DlSPL家族成员的氨基酸序列构建进化树。参考拟南芥SPL的分类,根据DlSPL同源性分析,可将龙眼DlSPL家族成员分成6大类:第一类:DlSPL2、DlSPL9、DlSPL15;第二类:DlSPL6、DlSPL10、DlSPL13;第三类:DlSPL3、DlSPL4、DlSPL5;第四类:DlSPL1、DlSPL12、DlSPL14;第五类DlSPL8;第六类:DlSPL7(图1)。图1
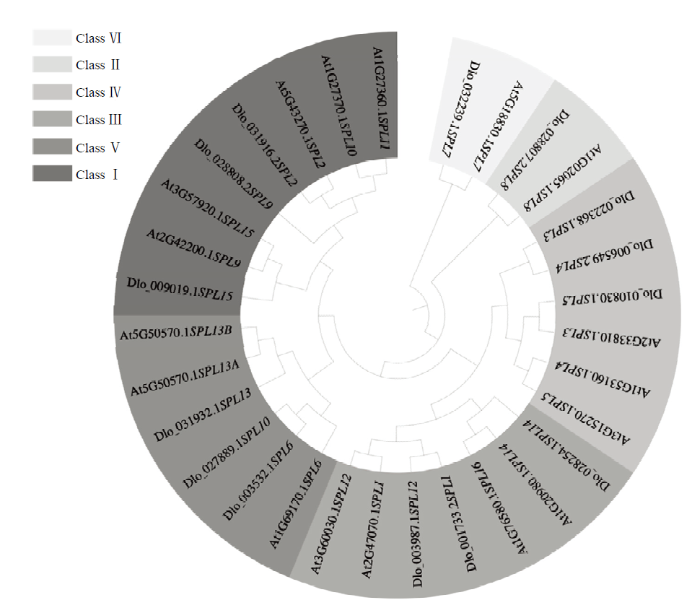 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1拟南芥、龙眼SPL 家族成员系统进化树
Fig. 1Phylogenic tree of Arabidopsis thaliana and Dimocarpus longan SPL family members
2.3 DlSPL家族基因结构及保守基序分析
龙眼DlSPL外显子数目在2—10个。进化树聚集的成员外显子数目大致相同,例如DlSPL3、DlSPL4、DlSPL5均含有2个外显子;DlSPL6、DlSPL10、DlSPL13均含有3个外显子;DlSPL1、DlSPL12和DlSPL14含有10个外显子;另外,没有同源聚集的成员中DlSPL8含有3个外显子,DlSPL7含有10个外显子(图2)。图2
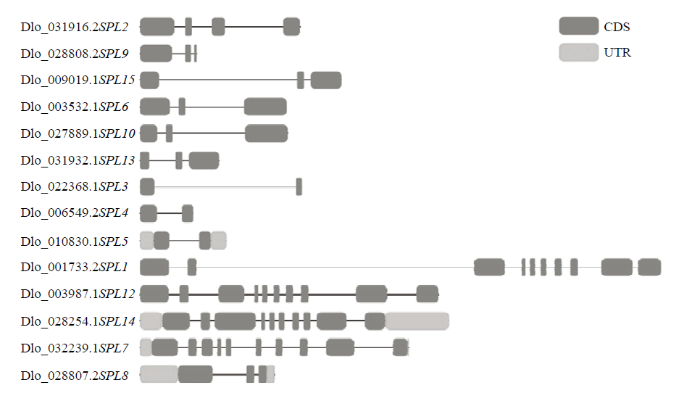 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2DlSPL家族基因结构分布图
Fig. 2Gene structural distribution map of DlSPL family
DlSPL共含有10个motif,14个龙眼DlSPL蛋白均有Motif1、Motif2和Motif3(图3)。Motif5、Motif6、Motif8、Motif9只存在于DlSPL6和DlSPL10;Motif7和Motif10只存在于DlSPL1、DlSPL12和DlSPL14。另外,在进化树聚集的成员Motif大多相同,例如DlSPL2、DlSPL9、DlSPL15的Motif完全相同;DlSPL3、DlSPL4、DlSPL5的Motif完全相同;DlSPL6、DlSPL10的Motif完全相同。
图3
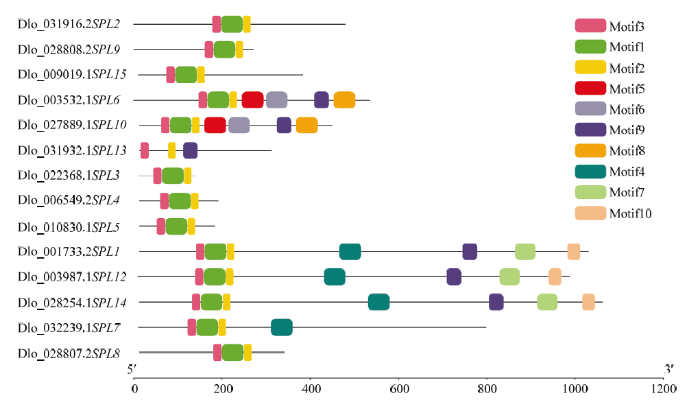 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3DlSPL家族蛋白motif分布图
Fig. 3Protein motif distribution map of DlSPL family
2.4 龙眼DlSPL基因家族启动子元件分析
DlSPL启动子中含有大量激素应答元件、胁迫响应元件、光反应元件、组织特异性调控元件等(图4)。对DlSPL所有顺式元件及其位点数进行分类和统计发现,DlSPL9是含有启动子顺式作用元件最多的成员;另外,DlSPL10只含有一个anaerobic元件,也是唯一一个不含有光响应元件的成员,提示不同DlSPL成员对光的响应程度可能有差别。图4
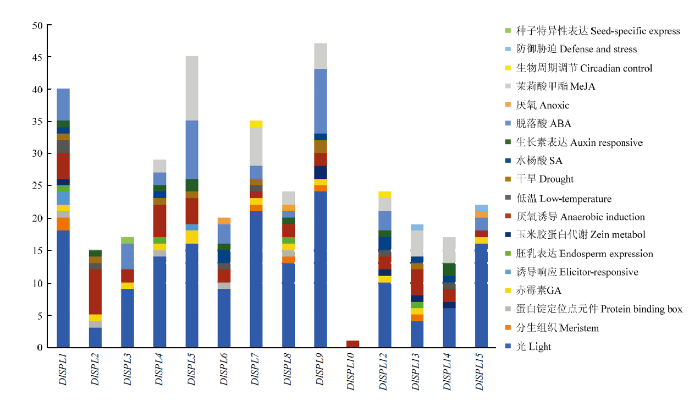 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4龙眼DlSPL家族启动子序列顺式作用元件分布
Fig. 4Distribution of cis-acting elements in promoter sequence of longan SPL family
DlSPLs启动子序列预测到了多个激素响应元件,包括赤霉素、水杨酸、ABA、生长素和MeJA。含有赤霉素响应元件的有DlSPL1、DlSPL2、DlSPL3、DlSPL4、DlSPL5、DlSPL7、DlSPL8、DlSPL9、DlSPL12、DlSPL13、DlSPL15;含有水杨酸响应元件的有DlSPL1、DlSPL4、DlSPL6、DlSPL9、DlSPL12、DlSPL13、DlSPL14;含有ABA响应元件的有DlSPL1、DlSPL3、DlSPL4、DlSPL5、DlSPL6、DlSPL7、DlSPL8、DlSPL9、DlSPL12、DlSPL15;含有生长素响应元件的有DlSPL1、DlSPL2、DlSPL3、DlSPL4、DlSPL5、DlSPL6、DlSPL8、DlSPL12、DlSPL14;含有MeJA响应元件的有DlSPL4、DlSPL5、DlSPL7、DlSPL8、DlSPL9、DlSPL12、DlSPL13、DlSPL14。可见,多种激素参与调控DlSPL的表达,不同成员之间可能存在协同或拮抗作用。
DlSPLs启动子序列同时也预测到了厌氧诱导响应元件ARE、低温胁迫相关的应答元件LTR、干旱相关的应答元件MBS等响应逆境胁迫的元件。此外还检测到了许多与植物生长有关的元件例如分生组织表达相关的调控元件CAT-box、参与胚乳表达的Endosperm、以及参与茎特异表达元件Meristem等。上述结果表明,不同响应元件共同调控DlSPL在龙眼中的作用。
2.5 DlSPL家族在不同光质下、不同激素处理以及非胚性及胚性培养物的RNA-Seq表达分析
在不同光质处理的胚性愈伤组织中,除了DlSPL4、DlSPL6、DlSPL10不表达外,其余的11个DlSPLs家族成员均检测到表达。与黑暗处理对照组相比,11个DlSPL存在3种表达模式(图5-A):第一类在蓝光和白光处理下呈上调表达趋势的有DlSPL1、DlSPL2、DlSPL5、DlSPL7、DlSPL12、DlSPL13、DlSPL14;第二类在蓝光、白光处理下呈下调表达趋势的有DlSPL8;第三类在蓝光、白光处理后表达程度与黑暗组相同的有DlSPL3、DlSPL9、DlSPL15。可见,一部分龙眼DlSPL基因家族成员在不同光质处理下表达呈现上调趋势,极少部分呈现下调表达趋势。图5
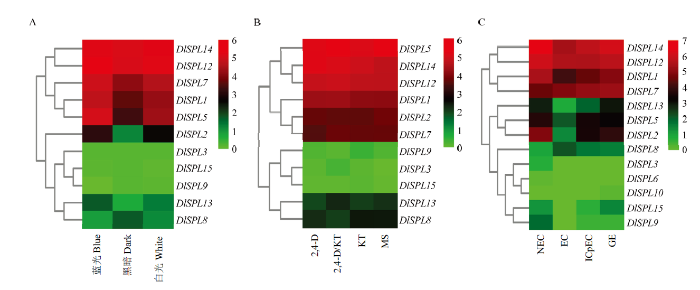 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5龙眼DlSPL家族在光质(A)、激素(B)及非胚性培养物和胚性培养物(C)的表达分析
NEC:非胚性愈伤组织 Nonembryonic callus;EC:胚性愈伤组织 Embryonic callus;ICpEC:不完全胚性紧实结构 Incomplete embryonic compact structure;GE:球形胚 Globularembryo。下同 The same as below
Fig. 5The specific expression of the DlSPL family in light quality (A), hormone (B) and non-embryogenic and embryogenic cultures (C) of longan
在不同激素处理的胚性愈伤组织中,同样除了DlSPL4、DlSPL6、DlSPL10不表达外,其余的11个DlSPL家族成员均检测到表达。与对照组相比,11个DlSPL存在3种表达模式(图5-B):第一类在2,4-D处理下呈上调表达的有DlSPL12、DlSPL14。第二类在KT处理下呈上调表达的有DlSPL1、DlSPL9和DlSPL14。第三类在4种处理下表达趋势相同的有DlSPL5和DlSPL15。由此可见,少部分DlSPL家族成员在激素处理下呈现上调表达趋势。龙眼DlSPL家族成员在参与激素表达的情况下,对2,4-D和KT两种激素处理中的一种呈现上调或下调或不表达的情况下,大多数对另一种激素处理呈现出相同的表达结果。
在非胚性及胚性培养物中,有13个DlSPL家族成员均检测到表达,存在4种模式(图5-C):第一类有7个成员在NEC阶段表达量最高,其中DlSPL1、DlSPL2、DlSPL5、DlSPL12、DlSPL14在NEC到GE阶段表达量先下调后上调;DlSPL3、DlSPL9、在NEC到GE阶段表达量逐渐下调。第二类有3个成员在GE阶段表达量最高,其中DlSPL7在NEC到GE阶段表达量逐渐上调;DlSPL13、DlSPL15在NEC到GE阶段表达量先下调后上调。第三类在EC阶段表达量最高的只有DlSPL8,并且在NEC到GE阶段表达量先下调后上调。第四类DlSPL6和DlSPL10两个成员在4个阶段表达程度几乎相同。可见,龙眼DlSPL家族成员大部分在体胚发生过程呈下调表达趋势。
2.6 龙眼DlSPL基因家族成员在非胚性及胚性培养物的中的qRT-PCR分析
除了DlSPL7表达趋势与转录组相同外,其余4个成员与转录组表达趋势有较所差别(图6)。其中,DlSPL7呈上升表达趋势,DlSPL1、DlSPL5、DlSPL13呈先下降后上升趋势。整体分两种表现:一是ICpEC阶段表达量最高,如DlSPL5、DlSPL7和DlSPL13。第二种是EC阶段表达量最高,如DlSPL1和DlSPL14。图6
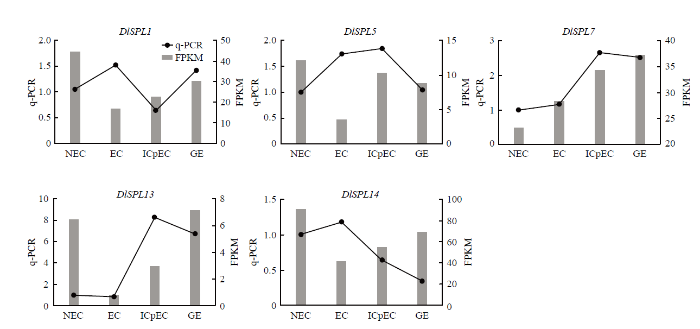 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6DlSPL 在龙眼非胚性和胚性培养物中的表达分析
Fig. 6Expression analysis of DlSPL in non-embryonic and embryogenic cultures of Dimocarpus longan
2.7 龙眼DlSPL家族成员在ABA和MeJA处理下的qRT-PCR分析
因DlSPL1、DlSPL5、DlSPL13、DlSPL14 4个成员含有至少响应ABA或MeJA其中一种应答元件。因此选用上述4个DlSPL成员探索ABA、MeJA处理0、4、12和24 h的胚性愈伤组织表达情况。qRT-PCR分析结果表明,与0 h对照相比,经ABA处理4、12和24 h处理后,DlSPL1、DlSPL5、DlSPL7和DlSPL13均显著下调表达,可能DlSPL家族在响应ABA元件应答的过程表现出拮抗作用;经MeJA处理4、12和24 h后,DlSPL1、DlSPL7和DlSPL13呈下调表达,其中DlSPL7各时间表达均显著下调,只有DlSPL5经MeJA 4 h和24 h处理后呈上调表达趋势,猜测MeJA对DlSPL5在龙眼中的表达有促进作用,并且抑制DlSPL1、DlSPL7、DlSPL13在龙眼中的表达(图7)。图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7DlSPL家族成员在ABA和MeJA不同时长处理下的胚性愈伤组织中的表达情况
不同小写字母表示处理间差异显著(P<0.05)
Fig. 7Expression of DlSPL family members in longan EC treated with abscisic acid and jamonic acid methyl ester for different durations
Different lowercase letters indicate significant differences (P<0.05)
3 讨论
3.1 龙眼DLSPL基因家族成员的分子特性
SPL家族成员参与调控许多植物的胚胎发育、叶片发育、发育转变阶段、花和果实发育、花青素积累等生长发育过程[19]。SPL家族成员的鉴定分析在多种植物中已有报道,但在龙眼中尚未进行详尽的研究。本研究从龙眼全基因组中鉴定得到14个具有完整SBP结构域的DlSPL,少于拟南芥(17个)[5]、水稻(19个)[8]、番茄(15个)[20]、银杏(15个)[21]等物种中SPL基因家族成员数目。DlSPL家族成员的外显子数目为2—10个,多于三叶裂薯ItSPL成员的2—4个[22],和菠萝AcSPL外显子数目相同(2—10个)[23]。系统进化树结果表明,龙眼DlSPL家族分成6组。同一组成员的基因结构和蛋白保守基序大体相同,具体表现在每一组成员的外显子数目以及所含Motif种类大致一样。但也有特殊,例如DlSPL2含有4个外显子,同组DlSPL9、DlSPL15只有3个外显子;DlSPL13只含有Motif2、Motif3、Motif9,同组DlSPL6、DlSPL10还含有Motif1、Motif5、Motif6、Motif8。在进化树中关系亲近的成员在功能上可能具有相似性,例如,AtSPL8参与植物开花的过程[5],可以猜测同源性最近的DlSPL8很大可能调控龙眼开花的过程;AtSPL9调控拟南芥由营养生长向生殖生长的转变,过表达AtSPL9 的转基因拟南芥植株叶片数量减少和叶片远轴面表皮毛增加[24,25,26,27];在茶树CsSPL9的研究中发现其可增加茶树的耐高温性[28],这与AtSPL9减少表皮毛数量的作用相似,再根据同源性推断DlSPL9可能提高龙眼的耐高温性。
3.2 DLSPL家族成员可能参与龙眼体胚发生过程
SPL在植物组织特异性表达尤为显著,8个菠萝AcSPL成员在花芽、雄蕊、萼片中检测到表达[15];小麦TaSPL20不同成员在小麦穗部侧芽、雌蕊[29]等部位大量表达,在小麦穗部的发育中起重要作用。SPL家族成员参与调控植物的胚胎发育。在前人的研究中发现柑橘CsSPL14与CsAKIN10互作增强了CsSPL14在柑橘愈伤组织系的体胚发生能力[30]。在银杏胚胎休眠的3个阶段中,少部分GbSPL成员全部呈下调表达模式;另一类GbSPL成员全部呈上调表达模式,总体来说,GbSPL家族在银杏胚胎发育中的表达水平较高[31]。本研究发现5个DLSPL家族成员可能因为个别基因功能的差异导致其在龙眼NEC、EC、ICpEC、GE 4个阶段的表达模式存在很大差别。大部分DLSPL在EC、ICpEC阶段显著高表达,在NEC和GE阶段都有下调表达趋势。不同DLSPL成员在龙眼体胚发育不同阶段表达量的明显差异表现出DLSPL在体胚发育的表达中存在时空特异性。值得注意的是,SPL家族转录组测序结果与qRT-PCR结果的表达趋势并不完全相同,且部分基因存在差异,这可能是由于转录组测序时间较早,转录组测序所使用的4个阶段材料与qRT-PCR试验的材料为不同批次培养所得,非胚性及胚性培养物状态可能由于批次效应存在一定的差异,导致表达结果存在差异。今后将通过转基因验证试验来进一步鉴定SPL家族在龙眼体胚发育过程中的功能。
3.3 龙眼DlSPL家族响应ABA和MeJA激素应答
ABA调控许多植物生长的过程。例如ABA能够缓解盐分过多对植物造成的渗透斜坡,达到保持水分平衡的目的[32],脱落酸对水稻产生诱抗效应,显著提高水稻对碱胁迫的抗性和苏打盐碱水田中水稻的产量[33];胡萝卜体细胞胚的研究中,适宜浓度的 ABA能使体胚发生提前一周,对其体胚的进一步发育有调节作用[34]。本研究中,4个DlSPL成员的表达经ABA处理后均呈下调表达,而DlSPL1、DlSPL5和DlSPL7均含有ABA的应答元件,进一步说明DlSPL能够应答ABA的处理;值得注意的是DlSP13虽不含ABA的应答元件,但qRT-PCR结果显示其也能响应ABA处理并呈下调趋势,提示其他SPL成员也有可能受ABA调控。前人对SPL的研究发现SPL与植物的开花过程密切相关[35],ABA可以加快番茄结实[36]的过程,结合qRT-PCR结果,DlSPL成员可能更多参与龙眼结实前的发育。MeJA与植物的抗逆能力有着密切联系,例如干旱胁迫下,外源MeJA可以增强玉米幼苗根系水通道蛋白的表达,提高根系的吸水能力[37]。另外,发现MeJA可以提高紫苏种子SOD等保护酶的活性,有效降低高温高湿等逆境对种子造成的氧化和损伤,保证紫苏种子在高温高湿胁迫下的正常萌发[38]。最新研究发现浓度1 μmol?L-1左右的MeJA能提高杂交鹅掌楸体胚发生率和体胚成熟率[39]。在橡胶树的研究中发现MeJA是诱导橡胶树体胚花青素积累的有效诱导剂[40]。qRT-PCR结果显示只有DlSPL5在MeJA处理后呈上调表达,DlSPL1、DlSPL7和 DlSPL13呈下调表达。DlSPL5、DlSPL7和 DlSPL13均含MeJA元件,但DlSPL1不含该元件,却也能响应MeJA处理呈下调表达,提示SPL可能具有复杂的调控关系。
4 结论
本研究共鉴定出DlSPL成员14个,只含有一个高度保守的SBP结构域成员;根据拟南芥AtSPL家族分类标准可把龙眼DlSPL成员分成6大类;多数DlSPL成员在非胚性愈伤组织和胚性愈伤组织阶段高表达;龙眼DlSPL响应ABA和MeJA的应答。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1007/BF02191820URLPMID:8569690 [本文引用: 1]

Several sites of nuclear protein interaction within the promoter region of the Antirrhinum majus floral meristem identity gene SQUAMOSA were detected using an electrophoretic mobility shift assay. One of these sites displayed a particularly clear interaction with nuclear protein extracted from inflorescences but not with nuclear protein extracted from young, nonflowering plants. This site could thus represent a binding motif for a transcriptional activator. A South-western screen of an inflorescence cDNA expression library resulted in the isolation of several cDNAs representing two different genes named SBP1 and SBP2 (for SQUAMOSA-pROMOTER BINDING PROTEIN gene 1 and 2). Both genes encode highly similar protein domains which were found to be necessary and sufficient for binding DNA in a sequence-specific manner. This DNA-binding domain showed no similarity to known proteins in the databases. However, it is characteristic for a small family of gene products in A. majus and other plant species. Expression of SBP1 and 2 is developmentally regulated and their transcriptional activation precedes that of SQUAMOSA. The data presented support the idea that members of the newly identified SBP gene family function as transcription factors involved in the control of early flower development.
[本文引用: 1]
[本文引用: 1]
URLPMID:12202040 [本文引用: 3]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1002/jsfa.10885URLPMID:33058186 [本文引用: 1]

BACKGROUND: The terrain slope and field altitude where the plant is cultivated influence the composition of coffee cherries. The aim of this study was to analyze the effects of different levels of altitude and terrain slope on the Coffea canephora cherries as well as on the quality of the final beverage. Coffea canephora harvested in fields with 300 and 600 m altitude and with southeast-facing slopes (SEFS) and northwest-facing slopes (NWFS) was evaluated. RESULTS: Lower pH values were observed for cherries cultivated at higher altitudes. The highest percentage of soluble solids (525.00 g kg(-1) ) was found on NWFS at 300 m. The highest values of phenolic compounds were observed at 600 m. Significant differences were found in the moisture of coffee cherries grown in different terrain slope and in the fiber content at different altitudes. The results do not enable to conclude how the altitude and terrain slope influence the mineral content of cherries. Acidity, proteins, lipids, and carbohydrates were not influenced by altitude or terrain slope. The scores of cup quality were significantly affected by the altitude but not by the terrain slope. Coffees from cherries harvested in fields with 600 m altitude obtained the higher scores. CONCLUSION: Results show that altitude and terrain slope influence some compounds of coffee fruits, while others remain unaffected. The findings are important because during coffee fruits processing, these compounds are used to produce others that will influence on the bean and coffee beverage quality. This article is protected by copyright.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URLPMID:25578275 [本文引用: 1]
URLPMID:20622149 [本文引用: 1]
URLPMID:22942378 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
