 ,1, 何鲁南1, 易超1, 刘学艳1, 黄雯1, 陈加敏1
,1, 何鲁南1, 易超1, 刘学艳1, 黄雯1, 陈加敏1Metabolic Changes in the Processing of Yunkang 10 Sun-Dried Green Tea based on Metabolomics
DAI YuQiao1,2, Lü CaiYou ,1, HE LuNan1, YI Chao1, LIU XueYan1, HUANG Wen1, CHEN JiaMin1
,1, HE LuNan1, YI Chao1, LIU XueYan1, HUANG Wen1, CHEN JiaMin1通讯作者:
责任编辑: 赵伶俐
收稿日期:2019-04-18接受日期:2019-10-9网络出版日期:2020-01-16
| 基金资助: |
Received:2019-04-18Accepted:2019-10-9Online:2020-01-16
作者简介 About authors
戴宇樵,18985575397;E-mail:827927867@qq.com。

摘要
关键词:
Abstract
Keywords:
PDF (3096KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
戴宇樵, 吕才有, 何鲁南, 易超, 刘学艳, 黄雯, 陈加敏. 基于代谢组学的‘云抗10号’晒青茶加工过程代谢物变化[J]. 中国农业科学, 2020, 53(2): 357-370 doi:10.3864/j.issn.0578-1752.2020.02.010
DAI YuQiao, Lü CaiYou, HE LuNan, YI Chao, LIU XueYan, HUANG Wen, CHEN JiaMin.
0 引言
【研究意义】普洱茶的原料是云南大叶种晒青茶[1]。晒青毛茶是将云南大叶种茶树鲜叶经过摊放、杀青、揉捻、日晒干燥制成的初加工茶,其中“日晒”这一过程对晒青茶独特品质特征的形成至关重要。传统工艺的重要性不能只是体现在普洱茶成品的风味上,还需要从更深度的机理方面去探究,了解云南大叶种晒青毛茶在晒青过程中内含物质的变化,是探索晒青茶品质形成的重要途径。【前人研究进展】随着饮茶的生活习惯在人们日常生活中越来越普及,消费者对茶叶的食品安全与品质要求逐渐提高。随着科学检测技术的进步,检测茶叶各方面指标的方法也开始增多,从而能更好地提高茶叶品质。植物代谢组学指在特定的生理时间内,对某一植物组织或细胞的所有低分子量的代谢产物进行定性定量分析[2]。目前已有的代谢组学分析技术主要为气相色谱质谱联用、高效液相色谱质谱联用、核磁共振、毛细血管电泳技术等。代谢组学技术已被广泛应用于茶产业的多个环节中,可以用来更全面地了解茶叶从种植、加工、饮用过程中内含物质的变化规律,从而揭示茶叶特殊风味的形成原理。茶叶加工对茶叶品质形成来说是一项重要环节,但要探索茶叶生产工艺与品质的关系,常规检测还不够全面与深入。利用代谢组学技术可以进一步探索茶叶加工过程中的物质变化。研究证明,运用近红外光谱分析方法对武夷岩茶生产过程中的实际在线检测应用是可行的[3]。并且代谢组学技术能较全面地探究茶叶中特殊内含物变化规律,如花青素、生物胺的变化规律[4,5,6,7]。运用LC-MS可对普洱茶的风味化合物、抗氧化活性以及储存年份进行鉴定[8,9,10],也可通过对白茶内含物的鉴定对白茶品质进行分级[11,12]。通过研究不同山头普洱生茶的差异代谢物,运用1H-NMR方法为普洱茶的品质评价找到新思路[13]。目前,HPLC、NMR等方法都能进行快速准确且具有深度的茶叶内含物质测定[14,15,16,17]。GC-MS是目前最准确、最全面的茶叶香气检测方法。试验证明HS-SPME/GC-MS技术能较好地鉴定茶叶中的挥发性风味物质[18]。【本研究切入点】云南大叶种‘云抗10号’是云南省农业科学院茶叶研究所用单株育种法得到的品种,属于乔木型茶树[19],具有产量高、品质优、抗逆性强、适应性广的特点,是云南省茶产业的主力军[20],常用来制作云南绿毛茶、红茶等,用该品种制作成的晒青毛茶品质具有一定的代表性。目前,关于普洱茶原料云南大叶种晒青茶的各方面研究都相对较少,探究晒青茶品质形成原因的研究更加薄弱。【拟解决的关键问题】以LC-MS为研究手段,选取具有代表性的云南大叶种‘云抗10号’作为原料,探究从鲜叶采摘到晒青茶制成过程中内含成分的变化规律,为晒青茶的品质形成机理与优化普洱茶加工工艺与品质提供参考。1 材料与方法
试验于2018年11—12月在云南农业大学龙润普洱茶学院加工实验室进行。1.1 试验材料与仪器
试剂:乙醇、甲醇、乙腈(Mecrk)标准品:二甲基亚砜(DMSO)或甲醇作为溶剂溶解后,-20℃保存,质谱分析前用70%甲醇稀释成合适浓度(BioBioPha,Sigma-Aldrich),均为色谱纯。仪器:离心机(5424R 2 Eppendorf)(艾本德中国有限公司),真空冷冻干燥机(Labconco Freezone 2.5L-84),研磨机(MM 400,Retsch(德国RETSCH)),电炒锅(6CCH-63型,富阳市叶峰茶叶机械设备),超高效液相色谱(UPLC)(Shim-pack UFLC SHIMADZU CBM30A)和串联质谱(MS/MS)(Applied Biosystems 6500 QTRAP)。
1.2 试验方法
1.2.1 样品的制作 地点:云南普洱茶树良种场流程:鲜叶(一芽二叶(55%)、一芽三叶(45%))摊青、杀青、手工揉捻、日光干燥。
1.2.2 样品预处理 选取‘云抗10号’加工过程中鲜叶(YK10-1)、揉捻叶(YK10-2)、晒青叶(YK10-3)各3份;样品真空冷冻干燥;研磨仪(MM 400,Retsch)研磨(30 Hz,1.5 min)至粉末状;称100 mg粉末溶于1.0 mL的提取液中;保存于4℃冰箱,过夜,涡旋3次提高提取率;离心(转速10 000×g,10 min)后,取上清液,微孔滤膜(0.22 μm)过滤,然后进行LC-MS/MS分析。
1.2.3 LC-MS分析条件 超高效液相色谱(UPLC)和串联质谱(MS/MS)。
液相条件:色谱柱:Waters ACQUITY UPLC HSS T3 C18;流动相:水相,超纯水(加入0.04%乙酸),有机相,乙腈(加入0.04%乙酸);洗脱梯度:0 min为水/乙腈(95﹕5(V/V)),11.0 min为5﹕95(V/V),12.0 min为5﹕95 V/V,12.1 min为95﹕5 V/V,15.0 min为95﹕5 V/V;流速0.4 mL∙min-1;柱温40℃;进样量2 μL。
质谱条件主要包括:电喷雾离子源,温度500℃,质谱电压5 500 V,帘气25 psi,碰撞诱导电离,参数设置为高。在三重四级杆中,每个离子对根据优化的去簇电压(DP)和碰撞能(CE)进行扫描检测[21]。
1.2.4 数据分析 采用多元统计分析,基于OPLS-DA结果,从多变量分析OPLS-DA模型的变量重要性投影(variable importance in project,VIP)中初步筛选出不同样品间差异代谢物,再通过组合单变量分析的P值或差异倍数值来进一步筛选差异代谢物。本试验中存在生物学重复,通过fold change和OPLS-DA模型的VIP值相结合的方法来筛选差异代谢物。筛选标准:选取fold change≥2(上调)和fold change≤0.5(下调)的代谢物。在上述基础上,选取VIP≥1的代谢物,VIP值表示对应代谢物的组间差异在模型中各组样本分类判别中的影响强度,一般认为VIP≥1的代谢物为差异显著。基于商业数据库MWDB(metware database)及代谢物信息公共数据库,利用三重四级杆质谱的多反应监测模式(MRM)分析完成代谢物定性。在获得不同样品的代谢物质谱数据后,对所有物质的质谱峰进行峰面积积分,并对不同样品的相同代谢物质谱进行积分校正[22]。
2 结果
2.1 主成分分析
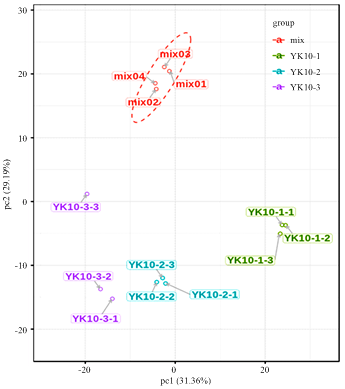
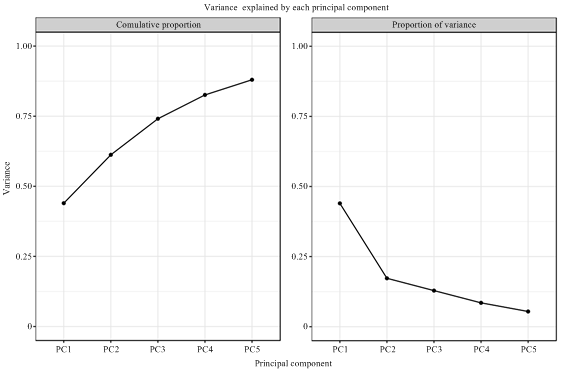
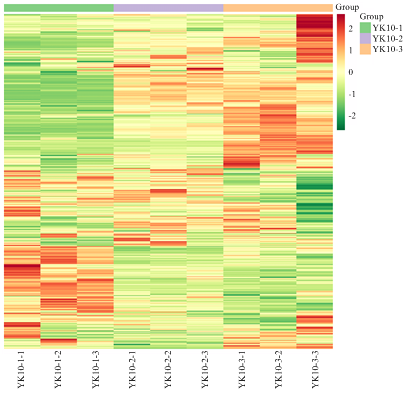
通过对样本(包括质控样品)的主成分分析,初步了解各组样本之间的总体代谢差异和组内样本之间的变异度大小[23]。其中MIX即上方提到的质控样本,PCA得分图如下(图1)。在PCA图中,图上任意一点表示一个对应样本。从图中可以看出LC-MS分析所得原始数据在PC1、PC2两种主成分中得到良好地呈现。在图中,第一主成分的贡献率为31.36%,第二主成分的贡献率为29.19%,两种主成分的贡献率和为60.55%,代表两个主成分能够基本反映茶样的主要特征信息。同时各组样品与质控样品质谱数据的PCA得分图在图上可见(图2),左图为不同主成分累计比例图,右图为不同主成分方差比例,每一点代表PC1至PC5,在左图中,PC1对应点与右图PC1对应点一致,PC2对应点纵坐标值为右图中PC1贡献率与PC2贡献率之和,PC3对应点纵坐标值为右图中PC1、PC2、PC3贡献率之和,以此类推,左图中PC5对应纵坐标值越接近于1,表示该PCA模型越具有可靠性,右图中可看出主成分贡献率比较为PC1>PC2>PC3>PC4>PC5,由此也说明选取PC1、PC2来分析样本具有较好可靠性。从3组样品的聚类热图分析(图3)上看出,3组样本区别明显,组内平行样本成分接近,证明样本的可靠性。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1各组样品与质控样品质谱数据的PCA得分图
Fig. 1PCA score map of mass spectrometry data of each group of samples and quality control samples
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2分组主成分分析可解释变异图
Fig. 2Variation map based on group principal component analysis
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3样品总体聚类图
Fig. 3Sample overall clustering map
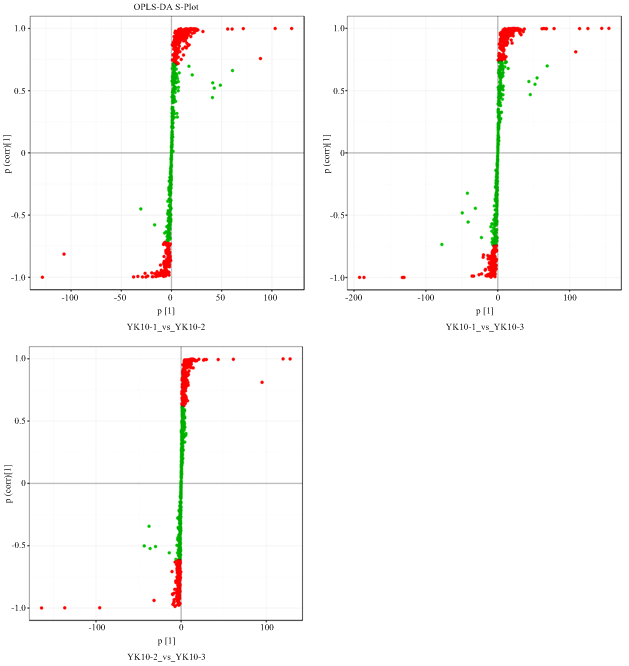
为了鉴别出具体有哪些差异代谢物造成了分离现象,建立‘云抗10号’鲜叶与揉捻叶之间、鲜叶与晒青叶之间、揉捻叶与晒青叶之间的3组PLS-DA模型。模型S图如图4所示,S图能表示每个代谢物对于分组的贡献率。横坐标为可变量,数据离原点越远,该点对样品的组间分离贡献越大;纵坐标为样本之间的相关性,数据离原点越远,样本间的相关性越好。表1为模型评价参数,在这3组模型中,其中两组R2Y和Q2的值均大于0.9(表1),其余一组R2Y与Q2值均大于0.3,说明这3组模型构建良好,预测性可靠。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4组间OPLS-DA S点图
图中红色表示VIP≥1的代谢物,绿色表示VIP<1的代谢物 Red represents the metabolites with VIP≥1, and green represents the metabolites with VIP<1
Fig. 4OPLS-DAS-plot between two groups
Table 1
表1
表1PLS分析的参数
Table 1
| 样品 Tea sample | R2X | R2Y | Q2 |
|---|---|---|---|
| YK10-1_vs_YK10-2 | 0.514 | 0.996 | 0.923 |
| YK10-1_vs_YK10-3 | 0.547 | 0.997 | 0.937 |
| YK10-2_vs_YK10-3 | 0.377 | 0.986 | 0.778 |
新窗口打开|下载CSV
2.2 差异代谢物筛选
通过PLS-DA分析后,根据VIP值>1与上调代谢物fold change≥2和下调代谢物fold change≤0.5以及T检验的相对变量分析结果筛选出显著差异代谢物。在‘云抗10号’晒青茶的加工中,将其鲜叶、揉捻叶、晒青叶进行分组,由图5—7可看出鲜叶与揉捻叶差异代谢物116种、鲜叶与晒青叶差异代谢物158种,揉捻叶与晒青叶差异代谢物42种。统计出这3组对比的总差异代谢物180种,对总差异代谢物差异倍数值(FC)进行归一化处理,从图8中可以看出3组对比FC值部分区分良好,差异代谢物种类区别明显。从表2可看出,总差异代谢物的物质种类与相对含量变化情况。在3组对比中均为差异代谢物的物质有8种,分别有上调差异代谢物异樱花亭,5-尿嘧啶核苷酸(5-UMP),6-C-己糖基-金圣草黄素O-己糖苷、7-甲基鸟嘌呤、白杨素C-己糖苷,磷脂酰胆碱 酰基16﹕1/14﹕1,咖啡醛在揉捻过程中相对含量下降,可在晒青过程中显著上升,最终的变化趋势表现为上升,下调差异显著代谢物有萜类物质植保素D,黄酮碳糖苷物质C-己糖苷-异鼠李素O-己糖苷。图5
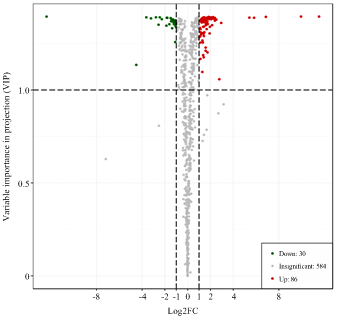 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5YK10-1_vs_YK10-2 差异代谢物火山图
图中一个点表示一种代谢物,横坐标为代谢物在两样品中定量差异倍数对数值,纵坐标为VIP值。绿点为下调差异表达代谢物,红点为上调差异表达代谢物,灰色部分为检测到但差异不显著的代谢物。下同
Fig. 5YK10-1_vs_YK10-2 differential metabolite volcano map
A point in the figure represents a metabolite, the abscissa is the value of the multiple logarithm of the quantitative difference between the two samples, and the ordinate is the VIP value. The green dot is the down-regulated differential expression metabolite, the red dot is the up-regulated differential expression metabolite, and the gray part is the detected but the difference is not significant. The same as below
图6
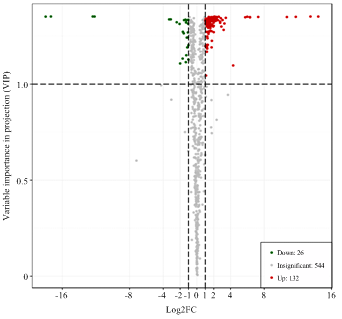 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6YK10-1_vs_YK10-3差异代谢物火山图
Fig. 6YK10-1_vs_YK10-3 differential metabolite volcano map
图7
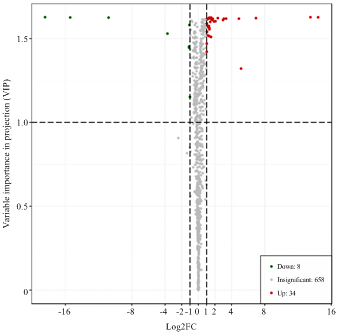 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7YK10-2_vs_YK10-3差异代谢物火山图
Fig. 7YK10-2_vs_YK10-3 differential metabolite volcano map
图8
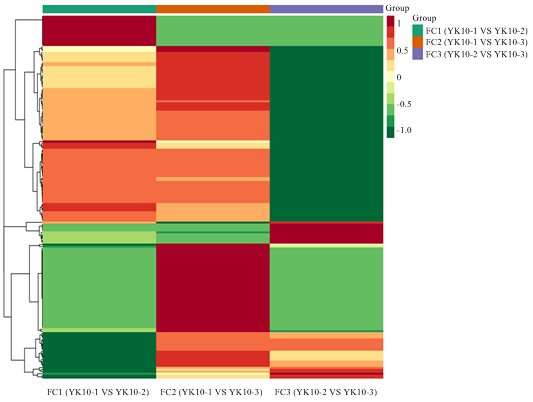 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图83组处理对比FC值聚类热图
Fig. 8Comparison of FC value clustering heat map between the three groups
Table 2
表2
表2差异代谢物种类与变化情况
Table 2
| 序号 No. | 代谢物种类 Species of metabolites | 总数 Amount | 上调数量 Increase the number | 下调数量 Reduce the number |
|---|---|---|---|---|
| 1 | 脂质类Lipids | 44 | 37 | 7 |
| 2 | 氨基酸及其衍生物Amino acid and its derivatives | 27 | 23 | 4 |
| 3 | 黄酮类Flavone | 25 | 19 | 6 |
| 4 | 核苷酸及其衍生物Nucleotide and its derivates | 18 | 18 | 0 |
| 5 | 苯甲酸及其衍生物Benzoic acid and its derivatives | 6 | 5 | 1 |
| 6 | 羟基肉桂酰衍生物Hydroxycinnamoyl derivatives | 11 | 8 | 3 |
| 7 | 有机酸及其衍生物Organic acids | 15 | 10 | 5 |
| 8 | 维生素Vitamins | 4 | 2 | 2 |
| 9 | 儿茶素及其衍生物Catechin and its derivatives | 1 | 1 | 0 |
| 10 | 花青素Anthocyanins | 2 | 0 | 2 |
| 11 | 生物碱Alkaloids | 1 | 1 | 0 |
| 12 | 胆碱类Cholines | 3 | 2 | 1 |
| 13 | 酚胺Phenolamides | 3 | 3 | 0 |
| 14 | 糖类Carbohydrates | 2 | 2 | 0 |
| 15 | 萜类Terpenoids | 1 | 0 | 1 |
| 16 | 吡啶Pyridine derivatives | 1 | 1 | 0 |
| 17 | 奎宁酸及其衍生物Quinate and its derivatives | 2 | 1 | 1 |
| 18 | 香豆素及其衍生物Coumarins | 3 | 3 | 0 |
| 19 | 色胺及其衍生物Tryptamine derivatives | 1 | 0 | 1 |
新窗口打开|下载CSV
2.3 茶叶中特殊成分的变化规律
茶叶中有效活性成分种类丰富,本研究主要探讨儿茶素类、黄酮类、氨基酸、生物碱类物质的相对含量变化规律。儿茶素类是茶叶中重要的活性物质,在本次检测中,所有的儿茶素类物质从鲜叶到晒青叶的变化规律如表3所示,共检测到儿茶素类14种,其中有71%呈下调趋势,其余呈上调趋势。且酯型儿茶素含量都呈显著下降的。Table 3
表3
表3鲜叶、揉捻叶和晒青叶组间儿茶素类代谢物差异
Table 3
| 序号 No. | 保留时间 Retention time (min) | 代谢物 Metabolites | YK10-1 | YK10-2 | YK10-3 | 类型 Type |
|---|---|---|---|---|---|---|
| 1 | 2.53 | 咖啡酰原儿茶酸 Protocatechuic acid O-glucoside | 1050333.33±217647.27 | 6006666.67±575528.74 | 9486666.67±5827661.05 | 上调 Up |
| 2 | 3.05 | 原儿茶醛Protocatechuic aldehyde | 55100±7100 | 72833.33±3499.05 | 101300±7291.78 | 上调 Up |
| 3 | 4.02 | 4-甲基儿茶酚4-Methylcatechol | 15433.33±1767.30 | 24200±3143.25 | 24633.33±1703.92 | 上调 Up |
| 4 | 2.38 | 二没食子儿茶素 Gallocatechin-gallocatechin | 529666.67±85242.79 | 590000±43347.43 | 582000±71021.12 | 上调 Up |
| 5 | 3.49 | 没食子儿茶素-儿茶素 Gallocatechin-catechin | 6836.67±1506.40 | 4870±1384.59 | 2560±2470.49 | 下调 Down |
| 6 | 2.3 | 原儿茶酸Protocatechuic acid | 194000±15394.80 | 196666.67±26764.40 | 123900±41179.24 | 下调 Down |
| 7 | 3.51 | 三儿茶素Catechin-catechin-catechin | 3713333.33±385010.82 | 3863333.33±346458.27 | 3073333.33±213853.53 | 下调 Down |
| 8 | 3.45 | 表儿茶素表阿夫儿茶精 Epicatechin-epiafzelechin | 281000±22869.19 | 281666.67±54811.80 | 253000±26000 | 下调 Down |
| 9 | 2.99 | 儿茶素Catechin | 3960000±240208.24 | 3890000±208086.52 | 3650000±715821.21 | 下调 Down |
| 10 | 2.44 | 没食子儿茶素(+)-Gallocatechin (GC) | 1576666.67±63508.53 | 1376666.67±56862.41 | 1470000±78102.50 | 下调 Down |
| 11 | 2.53 | 表没食子酸儿茶素 Epigallocatechin (EGC) | 1500000±80000 | 1313333.33±50332.23 | 1400000±52915.03 | 下调 Down |
| 12 | 3.18 | 表儿茶素L-Epicatechin | 3306666.67±117189.31 | 3316666.67±138684.29 | 3146666.67±565803.26 | 下调 Down |
| 13 | 3.28 | 表没食子酸儿茶素没食子酸酯Epigallate catechin gallate (EGCG) | 3886666.67±210792.16 | 4140000±186815.42 | 3766666.67±213853.53 | 下调 Down |
| 14 | 3.83 | 表儿茶素没食子酸 Epicatechin gallate (ECG) | 15666666.67±808290.38 | 15900000±529150.26 | 15300000±608276.25 | 下调 Down |
新窗口打开|下载CSV
对于黄酮与黄酮醇物质,选取其中晒青叶与鲜叶相对比VIP≥1的黄酮类差异代谢物,列出3组样品中含量变化。从表4可以看出,槲皮素,山奈酚、丁香亭、白杨素等物质的含量整体上呈大幅度增加趋势,在差异显著的黄酮类代谢物中仅有异鼠李素-3-O-新橙皮糖苷与芹菜素7-O-新橘皮糖苷(野漆树苷)呈下调模式。
Table 4
表4
表4鲜叶、揉捻叶和晒青叶组间黄酮与黄酮醇类代谢物差异
Table 4
| 序号 No. | 保留时间 Retention time (min) | 物质 Metabolites | YK10-1 | YK10-2 | YK10-3 | 类型 Type |
|---|---|---|---|---|---|---|
| 1 | 6.73 | 白杨素Chrysin | 0±0.00 | 8880±782.37 | 14883.33±5566.49 | 上调 Up |
| 2 | 330.2 | 丁香亭Syringetin | 4490±1406.84 | 17366.67±782.37 | 33666.67±12483.72 | 上调 Up |
| 3 | 5.08 | 槲皮素Quercetin | 3046666.67±336501.61 | 10096666.67±505008.25 | 13400000±1907878.40 | 上调 Up |
| 4 | 5.08 | 桑色素水合物Morin | 2883333.33±361155.55 | 9653333.33±609289.20 | 12400000±1708800.75 | 上调 Up |
| 5 | 4.58 | 二氢山奈酚Aromadedrin (Dihydrokaempferol) | 978666.67±132673.79 | 3026666.67±206478.41 | 3600000±170880.07 | 上调 Up |
| 6 | 5.69 | 山奈酚Kaempferol | 3753333.33±480555.23 | 10603333.33±1347973.79 | 12543333.33±3894051.02 | 上调 Up |
| 7 | 5.73 | 金圣草(黄)素Chrysoeriol | 369666.67±37581.02 | 939666.67±42770.71 | 1196666.67±90737.72 | 上调 Up |
| 8 | 5.81 | 异鼠李素Isorhamnetin | 12453.33±3177.19 | 14000000±1708800.75 | 37733.33±5131.60 | 上调 Up |
| 9 | 5.86 | 3,7-二氧-甲基槲皮素 Di-O-methylquercetin | 136666.67±30022.21 | 249666.67±19655.36 | 353000±17435.60 | 上调 Up |
| 10 | 6.98 | 金合欢素Acacetin | 12046.67±2802.59 | 240000±20297.78 | 29700±2600 | 上调 Up |
| 11 | 5.62 | 芹菜素Apigenin | 504666.67±72507.47 | 829333.33±64002.60 | 1234666.67±390800.89 | 上调 Up |
| 12 | 7.23 | 毡毛美洲茶素Velutin | 1983.33±221.89 | 5923.33±2653.72 | 4543.33±320.36 | 上调 Up |
| 13 | 7.17 | 华良姜素Kumatakenin | 13866.67±1193.04 | 46366.67±27164.38 | 30333.33±1858.31 | 上调 Up |
| 14 | 3.54 | 异鼠李素-3-O-新橙皮糖苷 Isorhamnetin 3-O-neohesperidoside | 519666.67±198807.28 | 303333.33±51964.73 | 216333.33±62043.00 | 下调 Down |
| 15 | 4.02 | 芹菜素 7-O-新橘皮糖苷 (野漆树苷) Apigenin 7-O-neohesperidoside (Rhoifolin) | 15966666.67±3807011.08 | 10786666.67±920072.46 | 6953333.33±1276727.59 | 下调 Down |
新窗口打开|下载CSV
对于氨基酸及其衍生物类,选取其中晒青叶与鲜叶相对比VIP≥1的氨基酸类差异代谢物,列出3组样品中的含量变化,从表5中可以看出茶叶中含有多种氨基酸,其中鲜叶中含量最多的是茶氨酸,本研究中检测到茶氨酸随着加工过程的进行其含量显著下降。本研究共检测到8种生物碱物质,且影响茶叶风味的关键代谢物咖啡碱相对含量呈下调趋势(表6)。
Table 5
表5
表5鲜叶、揉捻叶和晒青叶组间氨基酸及其衍生物类代谢物差异
Table 5
| 序号 No. | 保留时间 Retention time (min) | 物质 Metabolites | YK10-1 | YK10-2 | YK10-3 | 类型 Type |
|---|---|---|---|---|---|---|
| 1 | 0.79 | 天门冬氨酸 二葡糖苷 Aspartic acid di-O-glucoside | 567000±31000 | 2093333.33±218250.62 | 2993333.33±685298.00 | 上调 Up |
| 2 | 1.24 | L-亮氨酸 Aspartic acid di-O-glucoside | 192000±27874.72 | 1002666.67±33842.77 | 990333.33±37287.17 | 上调 Up |
| 3 | 1.14 | L-(-)-酪氨酸L-(-)-Tyrosine | 867000±70149.84 | 3750000±193132.078 | 4370000±167032.93 | 上调 Up |
| 4 | 1.23 | L-异亮氨酸L-Isoleucine | 103766.67±17417.33 | 499333.33±21501.94 | 500000±15394.80 | up |
| 5 | 1.97 | L-苯丙氨酸L-Phenylalanine | 528000±39949.97 | 2470000±115325.63 | 2420000±115325.63 | 上调 Up |
| 6 | 0.8 | 2-氨基己二酸 (L-高谷氨酸) 2-Aminoadipic acid (L-Homoglutamic acid) | 330000±11357.82 | 1270000±155241.75 | 1420000±36055.51 | 上调 Up |
| 7 | 0.84 | 缬氨酸Dl-Norvaline | 8706666.67±428524.60 | 35466666.67±3720663.02 | 34933333.33±1871719.35 | 上调 Up |
| 8 | 0.84 | L-缬氨酸L-Valine | 1953333.33±132035.35 | 7136666.67±828573.07 | 7423333.33±460470.77 | 上调 Up |
| 9 | 0.71 | L-酵母氨酸L-Saccharopine | 181000±16522.71 | 773333.33±61174.61 | 667333.33±122964.76 | 上调 Up |
| 10 | 0.68 | L-(+)-赖氨酸L-(+)-Lysine | 8870000±478852.80 | 31666666.67±642910.05 | 31300000±3122499.00 | 上调 Up |
| 11 | 0.81 | DL-高半胱氨酸DL-homocysteine | 139333.33±11015.14 | 461333.33±47077.95 | 479333.33±25696.95 | 上调 Up |
| 12 | 1.21 | DL-多巴 3,4-Dihydroxy-DL-phenylalanine | 4706.67±2740.55 | 14033.33±3362.04 | 15800±4253.23 | 上调 Up |
| 13 | 0.65 | 蛋氨酸亚砜Methionine sulfoxide | 152333.33±25658.01 | 639000±11135.53 | 507000±37643.06 | 上调 Up |
| 14 | 0.72 | L-谷氨酸 O-己糖苷 L-Glutamic acid O-glucoside | 43066.67±3027.10 | 62033.33±13041.60 | 140333.33±5131.60 | 上调 Up |
| 15 | 0.73 | L-天冬酰胺L-Asparagine | 126666.67±16258.33 | 420333.33±73493.76 | 407666.67±48675.80 | 上调 Up |
| 16 | 1.24 | S-甲基谷胱甘肽 S-(methyl) glutathione | 6613.33±2116.63 | 8910±2098.36 | 19900±2128.38 | 上调 Up |
| 17 | 0.74 | 同型丝氨酸L-Homoserine | 12933.33±2967.04 | 26400±3751.00 | 38800±5350.70 | 上调 Up |
| 18 | 0.68 | L-组氨酸L-Histidine | 1153333.33±76376.26 | 3736666.67±265015.72 | 3280000±360555.13 | 上调 Up |
| 19 | 3.52 | L-苯丙氨酸-L-苯丙氨酸Phe-Phe | 42533.33±7850.05 | 144333.33± | 109433.33±25162.74 | 上调 Up |
| 20 | 0.77 | L-(-)-胱氨酸L-(-)-Cystine | 30866.67±11184.07 | 24200±7937.88 | 69866.67±14216.31 | 上调 Up |
| 21 | 2.05 | N′-甲酰基犬尿氨酸 N′-Formylkynurenine | 705333.33±111540.73 | 612333.33±25890.80 | 1593333.33±56862.41 | 上调 Up |
| 22 | 0.81 | 高胱氨酸L-Homocystine | 1593333.33±3646.00 | 51466.67±17333.88 | 61366.67±9022.38 | 上调 Up |
| 23 | 1.93 | N-甘氨酰-L-亮氨酸 N-Glycyl-L-leucine | 32666.67±2668.96 | 78633.33±5641.22 | 67333.33±6493.33 | 上调 Up |
| 24 | 1.14 | 谷胱甘肽还原型 Glutathione reduced form | 135733.33±92073.96 | 447000±303605.01 | 34066.67±12702.10 | 下调 Down |
| 25 | 0.74 | 2-氨基异丁酸 2-Aminoisobutyric acid | 64700000±4853864.44 | 23033333.33±1331665.62 | 25333333.33±2683902.63 | 下调 Down |
| 26 | 2.43 | N-乙酰基蛋氨酸 N-Acetylmethionine | 147233.33±46476.48 | 111666.67±9712.53 | 66400±2066.40 | 下调 Down |
| 27 | 0.99 | L-茶氨酸L-Theanine | 3820000±137356 | 4600000±558748.60 | 4490000±331763 | 上调 Up |
| 28 | 0.77 | γ-氨基丁酸γ-aminobutyric acid | 1903333.33±295014.13 | 5510000±508625.60 | 5783333.33±508625.60 | 下调 Down |
新窗口打开|下载CSV
Table 6
表6
表6鲜叶、揉捻叶和晒青叶组间生物碱代谢物差异
Table 6
| 序号 No. | 保留时间 Retention time (min) | 物质 Metabolite | YK10-1 | YK10-2 | YK10-3 | 类型 Type |
|---|---|---|---|---|---|---|
| 1 | 1.16 | 哌啶Piperidine | 5443333.33±494098.51 | 19800000±1873499.4 | 18500000±781024.97 | 上调 Up |
| 2 | 0.79 | 葫芦巴碱Trigonelline | 164666.67±54993.94 | 318000±125391.39 | 308666.67±112669.13 | 上调 Up |
| 3 | 0.78 | 甜菜碱Betaine | 13733333.33±929157.32 | 17566666.67±1833939.29 | 24300000±12931743.89 | 上调 Up |
| 4 | 2.64 | 茶碱Theophylline | 6455066.67±578935.03 | 7286366.67±194360.4 | 6545566.67±1001309.43 | 上调 Up |
| 5 | 1.45 | 大麦芽碱Hordenine | 417333.33±33246.55 | 472333.33±66905.41 | 391000±34655.45 | 下调 Down |
| 6 | 3.14 | 咖啡碱Caffeine | 6883000±232758.27 | 6826466.67±97485.61 | 6241100±380824.22 | 下调 Down |
| 7 | 4.64 | 异喹啉Isoquinoline | 112366.67±24056.25 | 119466.67±28075.85 | 88566.67±3442.87 | 下调 Down |
| 8 | 2.38 | 可可碱Theobromine | 7260000±401497.2 | 6323333.33±230289.67 | 5460000±326955.65 | 下调 Down |
新窗口打开|下载CSV
3 讨论
本研究中,儿茶素类从鲜叶到晒青叶明显下降,可能是因为儿茶素性质不稳定,容易被多酚氧化酶氧化。当鲜叶经过摊青后,在失水与杀青的高温作用下,其中的儿茶素可转变为它对应的旋光异构体或顺反异构体[24]。儿茶素还可以发生聚合反应形成原花青素与花青素,这两种物质在本次反应中也被检测到。同时,儿茶素类物质还可以与其他活泼的化合物(如多酚类物质、维生素、茶氨酸等)发生聚合反应。茶氨酸含量也发生了显著下降,原因也可能是参与上述聚合反应形成的。而咖啡酰原儿茶酸、原儿茶醛、4-甲基儿茶酚、二没食子儿茶素这4种上调物质,有可能是由于儿茶素内部发生了聚合反应,导致其中的咖啡酰原儿茶酸的含量明显提升。也可能是与最终晒青过程中日光催化茶叶中的活性成分发生了反应,并且下调代谢物(ECG、EGCG与三儿茶素)含量在揉捻叶中含量最多,在晒青叶中含量又降低,表明这些物质在从鲜叶到揉捻叶的过程中遭到高温的破坏,又在揉捻过程中反应增多,最后在日光催化下转变为其他物质。本研究中部分黄酮类物质在‘云抗10号’鲜叶中含量相对较低,然而经过高温杀青后,黄酮苷遇热发生水解,苷类配基脱去,转化黄酮或黄酮醇,可使苷类物质的苦味降低[24],这可能也是部分黄酮类物质上调的原因。然而在光的作用下黄酮也会分解,也就造成了部分黄酮含量的下降。
茶氨酸从鲜叶到揉捻叶表现为上升,然而从揉捻叶到晒青叶其含量表现为下降,总趋势为上调,但其中下降这一表现与前人研究的氨基酸变化规律相符[25]。在杀青过程中,大量叶绿素遇热导致大量叶绿素蛋白降解,形成大量游离氨基酸[26]。在晒青过程中,茶氨酸含量显著降低可能是因为茶氨酸在日晒作用下易降解为谷氨酸和乙酰胺,同时茶氨酸被酶氧化,与儿茶素形成茶色素,但总体趋势的上升或许是因为茶氨酸的耐热耐酸性,使其在高温杀青与机械作用中未被破坏。对于递减的氨基酸或许是因为在高温杀青的过程中,氨基酸类与碳水化合物发生美拉德反应生成黑色素并产生特殊的香味。其余大部分氨基酸相对含量均表现出递增,包括γ-氨基丁酸。由此可见,在晒青茶中,茶叶中氨基酸类物质大部分被很好的保留下来,使晒青茶具有独特鲜爽的滋味与良好的保健功效。
本研究共检测到8种生物碱物质,其中甜菜碱相对含量最高,甜菜碱的学名为三甲基甘氨酸,参与渗透调节,与植物抗逆性相关,且外用具有护肤功效[27]。前人研究主要关注的咖啡碱、茶叶碱、可可碱也被检测出,咖啡碱相对含量在鲜叶到揉捻叶再到晒青叶的加工过程中相对含量均下降,这与前人的研究结果相符[28]。咖啡碱具有苦味,且在后期加工过程中可与茶黄素以氢键缔合形成具有鲜爽味的复合物[24],可可碱相对含量在两个品种中也均表现为下降,茶叶碱相对含量却在晒青过程中增多并高于鲜叶中的含量。在今后的研究工作中,将进一步找到多种关键物质的变化途径,研究其他品种晒青茶加工过程中的成分变化,与工艺相结合,探讨加工过程中部分重要成分的转化产物,更加深入地掌握晒青毛茶品质形成的机理。
4 结论
本研究运用超高效液相色谱和质谱联用的方法,对云南大叶种‘云抗10号’晒青毛茶及其制茶过程中的代谢物进行了分析,发现此品种晒青茶在制作过程中内含成分产生显著变化,且检测到在平时茶叶研究中关注较少的物质相对含量变化十分显著,如核苷酸及其衍生物、维生素、脂质、苯甲酸衍生物等多种代谢物。这表明在晒青毛茶加工中的摊青、杀青、揉捻、日光干燥过程中,除了儿茶素、黄酮类与氨基酸以及衍生物与生物碱发生较大变化外,许多其他代谢物也受到高温、氧化、物理机械等作用而发生反应。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[S],
[本文引用: 1]
[S],
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 3]
[D].
[本文引用: 3]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
