 ,2, 梁剑平
,2, 梁剑平 ,1
,1Mutagenesis and Screening of Endophytic Fungus Alternaria Section Undifilum oxytropis Producing Swainsonine from Locoweed
HAO BaoCheng1, SONG XiangDong1,2, GAO Yan1,2, WANG XueHong1, LIU Yu1, LI YuanXi1,2, LIANG Yan1, CHEN KeYuan1, HU YuYao1, XING XiaoYong2, HU YongHao ,2, LIANG JianPing
,2, LIANG JianPing ,1
,1通讯作者:
收稿日期:2018-06-14接受日期:2019-05-19网络出版日期:2019-08-01
| 基金资助: |
Received:2018-06-14Accepted:2019-05-19Online:2019-08-01
作者简介 About authors
郝宝成,E-mail:
宋向东,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (3321KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
郝宝成, 宋向东, 高艳, 王学红, 刘宇, 李元曦, 梁妍, 陈柯源, 胡毓瑶, 邢小勇, 胡永浩, 梁剑平. 产苦马豆素疯草内生真菌Alternaria Section Undifilum oxytropis的诱变筛选[J]. 中国农业科学, 2019, 52(15): 2716-2728 doi:10.3864/j.issn.0578-1752.2019.15.015
HAO BaoCheng, SONG XiangDong, GAO Yan, WANG XueHong, LIU Yu, LI YuanXi, LIANG Yan, CHEN KeYuan, HU YuYao, XING XiaoYong, HU YongHao, LIANG JianPing.
0 引言
【研究意义】疯草广泛分布于世界范围内,已成为危害草地畜牧业最严重的毒草,其毒害已被列入世界性“生态经济病”之一。据统计,截至2013年中国疯草面积约1 100万hm2[1],疯草在天然草地的迅速蔓延与扩散,引起疯草灾害的多发和频发,造成大批牲畜中毒、死亡。近年来,中国西部天然草地动物因疯草中毒死亡所造成的经济损失仍在不断剧增[2,3]。现已确证引起疯草中毒的主要毒性物质是苦马豆素(swainsonine,SW)[4,5]。另有研究表明SW具有抑制肿瘤细胞生长[6]、抑制肿瘤细胞浸润和转移、抗病毒感染[7]、增强免疫及潜在的抗艾滋病病毒等多种药用活性[8,9]。目前国外二期抗肿瘤临床试验已经完成[10]。疯草内生真菌是从疯草中分离获得的,具有产苦马豆素能力的一类真菌[11]。研究表明疯草中普通存在能够产生SW的内生真菌Alternaria Section Undifilum oxytropis,如从疯草中分离出能产生SW的内生真菌[12,13,14],研究结果表明疯草中SW含量与疯草内生真菌密切关联,且疯草内生真菌的分离率越高,疯草及疯草内生真菌中SW的产量越高[15,16,17,18]。虽然中国疯草面积超过1 100万hm2,为SW的研究和开发提供了充足的来源,但由于疯草中SW含量较低,提取技术有限,而且面临植物资源消耗造成草地沙漠化等严重生态问题,直接从疯草中提取SW已不是一种理想的方法[19]。因此,通过生物发酵获取内生真菌次生代谢产物,扩大SW来源以及进行批量生产,已成为获取SW 的新途径。但目前对SW在疯草内生真菌中的生物合成通路还未完全阐释清楚。如果能明确疯草内生真菌产苦马豆素的生物合成途径和分子机理,则可利用基因工程手段对内生真菌进行改造,一方面抑制Alternaria Section Undifilum oxytropis的生长,阻断SW在内生真菌中的合成路径,降低或消除疯草的毒性。另一方面通过真菌发酵培养、提取,获得大量SW将为抗肿瘤临床应用和科学研究提供有力的技术支撑,达到改良和利用的双赢。【前人研究进展】由于疯草内生真菌产SW的生物合成通路还未完全阐释清楚,目前推测其代谢合成的通路类似于豆类丝核菌和金龟子绿僵菌,哌啶酸和酵母氨酸脱氢酶为SW合成的主要中间物。HARRIS等曾对疯草(A. oxyphysus)中SW的合成机理进行了研究,发现A. oxyphysus含有反式-1-羟基吲哚里西啶和1,2-二羟基吲哚里西啶和SW,推测疯草感染了豆类丝核菌或类似的微生物而导致疯草合成SW[20]。此后,MUKHERJEE等通过简并引物,(RACE)-PCR、反向PCR技术研究酵母氨酸脱氢酶基因序列;并研究酵母氨酸脱氧酶在SW合成中的作用,研究结果显示,敲除酵母氨酸脱氢酶基因后,赖氨酸和SW产量下降,推断酵母氨酸脱氢酶在SW中起着尤为重要的作用[21]。杨国栋等研究发现L-赖氨酸中被标记的碳氮原子可以掺入到哌可酸和苦马豆素中,推测L-赖氨酸、哌可酸在U. oxytropis真菌合成SW的通路中扮演重要的角色[22]。近年来,国内外****研究发现疯草内普遍存在能合成SW的内生真菌;酵母氨酸脱氢酶是疯草内生真菌SW合成的关键酶之一,推测疯草内生真菌中SW合成通路可能类似于豆类丝核菌和金龟子绿僵菌[23]。李海利等对疯草内生真菌(Undifllum oxytropis,Astragalus cinereum)的蛋白组学进行了初步的研究,采用已构建的双向电泳条件、酶解方法及一维固相等电聚焦与质谱结合对Astragalus cinereum真菌蛋白质进行了鉴定,试验共鉴定出应激蛋白、盐胁迫蛋白、真菌过敏原蛋白、参与赖氨酸的生物合成代谢蛋白等49个功能蛋白;其中鉴定出与苦马豆素生物合成路径相关的酶:酵母氨酸氧化酶、酵母氨酸脱氢酶、呢可酸氧化酶、与赖氨酸生物合成相关的酶及一些未知的与苦马豆素生物合成相关的蛋白,这些蛋白的鉴定为进一步开展苦马豆素生物合成关键酶研究奠定了基础[24,25]。LU等对波状芽管蠕孢菌进行了全基因测序,研究结果表明波状芽管蠕孢菌是由70.05 Mb基因组成,并推测其中有164个基因位点所对应的氨基酸或酶可能参与苦马豆素的合成途径,并进一步推测有P6C途径和P2C途径[26,27],但仍需要进一步的研究进行验证确认。【本研究切入点】随着科学技术的发展,利用微生物诱变选育技术也逐渐成熟起来。通过物理或化学手段,以人工干预的方式,诱导促使微生物中某些基因进行重组或缺失来优化基因性状[28],使微生物的代谢产物及生长情况向人们的期望所发展,已成为大多数****的共识。本研究拟采用紫外辐照诱变、亚硝基胍化学诱变和紫外辐照与亚硝基胍的复合诱变方法,以期筛选获得高产、低产或不产SW的诱变新菌株,为后续利用高通量测序等分子生物学手段,在分子水平上阐释疯草内生真菌Alternaria Section Undifilum oxytropis关键基因、关键酶在其生物合成SW机制关系方面奠定研究基础。【拟解决的关键问题】研究结果将为阐明疯草内生真菌Alternaria Section Undifilum oxytropis产苦马豆素分子作用机理研究提供物质基础保障和理论依据,并对后期疯草进行脱毒改良或人工育种,在一定程度上有效降低由于疯草中毒引起的经济损失,发挥其潜在的牧草价值,保护草地生态健康发展提供技术参考。1 材料与方法
试验于2016 年11 月至2018 年1月份在中国农业科学院兰州畜牧与兽药研究所兽用天然药物研究室完成。1.1 菌株
Alternaria Section Undifilum oxytropis(编号:CICC2493)购自中国工业微生物菌株保藏中心。1.2 试剂与仪器
亚硝基胍购自上海叶源生物科技公司;PDA、改良察氏培养基购自索莱宝生物公司;组织研磨器、除菌滤膜购自博乐知生物科技有限公司;氯化锂、PBS、丙酮购自天津大茂化学试剂厂;α-甘露糖苷酶、对硝基苯基-α-D甘露糖苷、柠檬酸缓冲液(pH =4.5)、硼酸-氢氧化钠(pH =9.5),α-D甘露糖苷、双(三甲基硅烷基)三氟乙酰胺BSTFA+(三甲基氯硅烷)TMCS,SW标准品(98.4%,西安杨凌天力生物科技有限公司),无水乙醇、甲醇等化学试剂。高速台式冷冻离心机(YiH-2050R-1)购自湖南湘仪;立式单门双层加热制冷振荡器、生物安全柜(fsafe-1500)购自上海力申科学仪器有限公司;微孔板酶标版振荡器混匀(B100-2A)购自杭州卓尔科学仪器有限公司;恒温培养箱(NP-9272A)购自上海鸿都电子科技有限公司;紫外灯(ZW5D15W-Z150)购自沈阳普力德商贸有限公司。1.3 Alternaria Section Undifilum oxytropis菌种原液的制备
以Alternaria Section Undifilum oxytropis为出发菌株,选择挑取生长良好的菌落置于菌丝研磨器中加磷酸盐缓冲液(除菌)10 mL研磨,三层搽镜纸过滤除去菌丝,将过滤所得的菌液移入10 mL EP管中备用。1.4 α-甘露糖苷酶活性分析法测定菌丝及发酵中SW含量标准曲线的制定
将1 mg·mL-1浓度的SW标准品溶液稀释配制为10、8、7、6、5、4、3、2、1、0.5、0.25、0.125、0.0625、0.03125 μg·mL-1。分别加10 μL置于96孔板中,并加入20 μL α-甘露糖苷酶(浓度:1 U·mL-1)和50 μL柠檬酸盐缓冲液于37℃下水浴15 min,然后加入20 μL对硝基苯基-α-D-甘露糖苷作为底物,37℃水浴1.5 h,反应完全后,采用分光光度法在405 nm测定产物的吸光值,绘制SW对α-甘露糖苷酶活性百分比影响折线图及标准曲线,并对样品进行测定。1.5 紫外辐照诱变
1.5.1 诱变处理 将编号1、2、3……7的7个6孔细胞培养板中,每孔分别加入1 mL磷酸盐缓冲液(pH=7),再依次加入0.5 mL菌液,置于振荡器混匀仪上,低速运行,将1—6号板放置于波长为253.7 nm的卡瑞尔紫外灯下15 cm处,分别辐照20、40、80、160、320、640 s时取出。7号板不做紫外辐照处理作为空白对照,紫外诱变所有的操作均在黑暗避光环境下操作,待紫外诱变结束后,将诱变后菌液吸取200 μL涂于接种于PDA培养基平板上,置于避光的恒温箱中连续培养24 d,记录菌落数,以上细胞培养板分别设6个平行重复,并计算平均致死率(致死率按以下公式计算):致死率(%)=$\frac{空白对照组菌落-诱变处理组菌落}{空白对照组菌落}$×100%
1.5.2 紫外辐照诱变菌株筛选 选取经紫外诱变处理生长良好的菌株,利用无菌接种针挑取单个菌落,划线接种于PDA培养基平板上,28℃、180 r/min恒温培养箱24 d,收集菌丝提取SW,利用α-甘露糖苷酶活性分析法,计算菌丝中SW含量,并在改良察式液体培养基中连续传代5次,每一代培养结束后,检测菌丝中SW含量,评价其产SW稳定性。
1.6 亚硝基胍化学诱变
1.6.1 诱变处理 分别取浓度0.5 mg·mL-1亚硝基胍2、4、6、8、10、12 μL,于6个2 mL EP管中,加磷酸盐缓冲液(pH=7.0)1 mL,依次加入0.5 mL菌液,28℃,120 r/min恒温培养箱中反应5、10、15、20、25、30 min,加入浓度为0.9%的无菌生理盐水5 mL稀释终止反应,11 000 r/min离心10 min,弃上清,再加入浓度为0.9%无菌生理盐水5 mL,震荡,1 000 r/min离心10 min,弃上清,再加入0.9%生理盐水5 mL,震荡后吸取200 μL涂布接种于PDA培养基中平板中培养,立刻置恒温箱中连续培养24 d,记录菌落数,每个剂量组设6个平行重复,计算平均致死率。1.6.2 亚硝基胍化学诱变菌株筛选 选取亚硝基胍处理生长良好的菌株,利用无菌接种针挑取单个菌落,划线接种于PDA培养基平板上,28℃、180 r/min恒温培养箱24 d,收集菌丝,提取SW,利用α-甘露糖苷酶活性分析法,计算菌丝中SW含量,将SW含量变化差异较大的菌株在改良察式培养基中连续传代5代,每一代培养24 d,培养结束后检测菌丝中SW含量,评价其产SW稳定性。
1.7 紫外辐照与亚硝基胍复合诱变
1.7.1 诱变处理 将编号1、2、3……7的7个6孔细胞培养板,每孔分别加入1 mL磷酸盐缓冲液(pH=7),再依次加入0.5 mL菌液,置于振荡器混匀仪上,低速运行,将1—6号板放置于紫外灯下15 cm处,分别辐照20、40、80、160、320、640 s时取出,依次加入亚硝基胍2 μL,28℃,120 r/min诱变处理5 min,7号板不做任何诱变处理作为空白对照,诱变后立即加入浓度为0.9%的无菌生理盐水5 mL稀释终止反应,11 000 r/min离心10 min,弃上清,再加入浓度为0.9%无菌生理盐水5 mL,震荡,1 000 r/min离心10 min,弃上清,再加入0.9%生理盐水5 mL,震荡后吸取200 μL涂布接种于PDA培养基平板中培养,置于避光的恒温箱中连续培养24 d,记录菌落数,以上细胞培养板分别设6个平行重复,并计算平均致死率。1.7.2 紫外辐照与亚硝基胍复合诱变菌株筛选 选取经紫外辐照和亚硝基胍复合诱变处理生长良好的菌株,采用无菌接种针挑取单个菌落,划线接种于PDA培养基平板上,28℃恒温培养箱24 d,收集菌丝,提取SW,利用α-甘露糖苷酶活性分析法,计算菌丝中SW含量,将SW含量变化差异较大的菌株在改良察式液体培养基中连续传5代,每一代培养24 d,培养结束后检测菌丝中SW含量,评价其产SW稳定性。
1.8 诱变菌株生长曲线的测定
选取诱变筛选获得的SW产量变化显著的新菌株,接种于PDA、改良察式液体培养基中置于28℃,180 r/min恒温摇床发酵培养以及恒温培养箱32 d,每隔4 d取样1次,每日观察记录诱变菌生长情况,并利用α-甘露糖苷酶活性分析法检测突变菌株产SW含量,绘制其生长曲线。1.9 数据分析
采用SPSS19.0统计分析软件采用单因素方差法对试验结果进行统计,结果均以(平均值±标准差)统计显示。*表示差异显著(P<0.05),**表示差异显著(P<0.05)。2 结果
2.1 α-甘露糖苷酶活性分析法标准曲线的绘制
从图1结果表明,SW浓度在1×10-3—5×10-3 mg·mL-1范围内线性关系良好,并以5个梯度的苦马豆素浓度为横坐标,以苦马豆素对α-甘露糖苷酶活性百分比为纵坐标,利用EXCEL制作标准曲线,回归方程为y=-0.0753x+0.4532(R2=0.9993)(图2)。图1
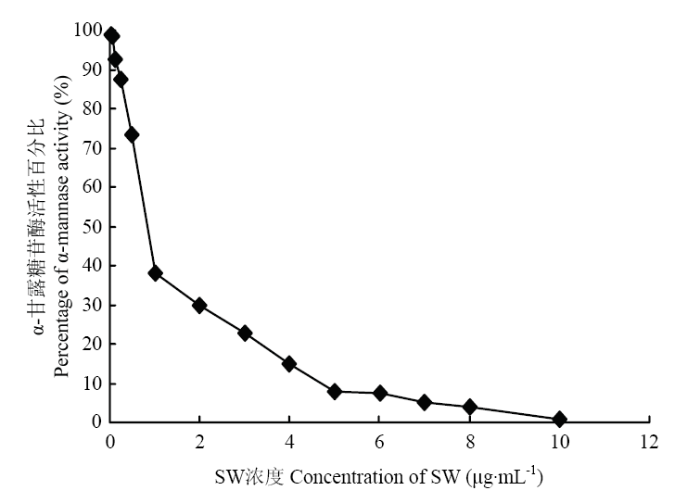 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1不同浓度SW对α-甘露糖苷酶活性百分比的影响
Fig. 1Line chart of percentage of alpha-mannosidase activity in different concentrations of swainsonine
图2
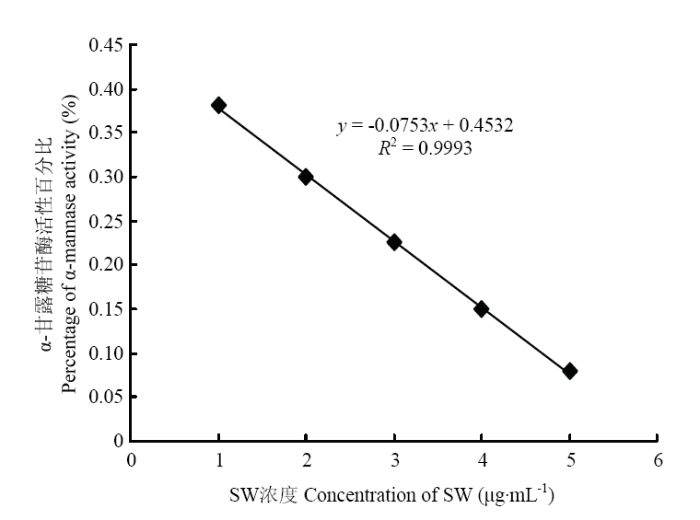 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2SW抑制α-甘露糖苷酶活性百分比标准曲线
Fig. 2The standard curve of inhibition percentage of alpha- mannosidase activity by swainsonine
2.2 紫外辐照对诱变菌株平均致死率的影响
从表1、图3可以看出紫外辐照20 s,菌株开始死亡,死亡率为11.54%,但随着时间的增加为40 s时,致死率为40.28%,当紫外辐照80 s时致死率增加至83.33%,辐照160 s时致死率为94.87%,辐照320 s时致死率达到100%。结果表明紫外辐照20 s到80 s此间致死率变化较大,并随时间增加致死率不断上升。Table 1
表1
表1紫外辐照对Alternaria Section Undifilum oxytropis菌株的致死率
Table 1
| 辐照时间 Ultraviolet irradiation time (s) | 辐照后菌株生长数 Number of strains after ultraviolet irradiation | 对照组生长数 Number of strains in control group | 平均致死率 Average mortality rate(%) | |||||
|---|---|---|---|---|---|---|---|---|
| 20 | 12 | 11 | 13 | 10 | 12 | 11 | 13 | 11.54±8.07 |
| 40 | 6 | 8 | 6 | 7 | 8 | 8 | 12 | 40.28±8.20 |
| 80 | 2 | 3 | 1 | 1 | 3 | 2 | 12 | 83.33±7.46 |
| 160 | 1 | 0 | 0 | 1 | 1 | 1 | 13 | 94.87±3.97 |
| 320 | 0 | 0 | 0 | 0 | 0 | 0 | 11 | 100.00±0.00 |
| 640 | 0 | 0 | 0 | 0 | 0 | 0 | 13 | 100.00±0.00 |
新窗口打开|下载CSV
图3
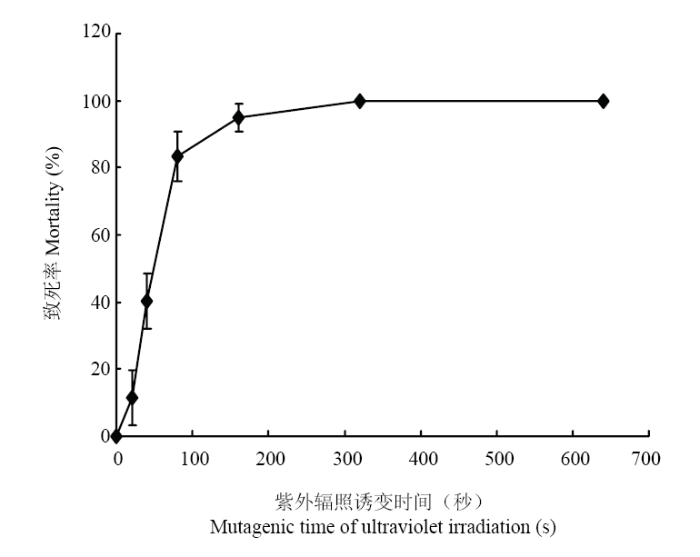 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3紫外辐照对Alternaria Section Undifilum oxytropis菌株的致死率
Fig. 3The lethality curve of Alternaria Section Undifilum oxytropis exposed to ultraviolet irradiation
2.3 诱变菌株紫外辐照最佳诱变条件的确定
分别从紫外辐照20、40、80、160 s中选取1株生长良好的诱变菌株,依次命名为U1、U2、U3、U4进行发酵培养,经α-甘露糖苷酶活性分析法检测菌丝中SW含量(表2,图4),并经过连续传代5代培养,最终确定U4诱变株为生长良好且SW含量传代稳定的菌株,因此,紫外辐照处理160 s为紫外辐照诱变最佳条件。与原始菌株相比U4菌株菌落形态较小,且菌落呈白色微粉,菌落底色也偏粉(图5)。Table 2
表2
表2突变菌株产SW含量
Table 2
| 组别 Group | 吸光值 Absorbance ($\bar{x}\pm s$) | SW含量 SW content (μg·mL-1) | SW含量变化 Change of SW content (%) |
|---|---|---|---|
| Alternaria Section Undifilum oxytropis | 0.6116±0.08621 | 2.6445±0.1416 | — |
| U1 | 0.6110±0.00664 | 2.636±0.1075 | -0.31% |
| U2 | 0.6431±0.00094 | 2.4600±0.1883 | -6.98%* |
| U3 | 0.6265±0.03167 | 2.5520±0.0437 | -3.50% |
| U4 | 0.5330±0.00175 | 3.0683±0.1604 | +16.02%** |
新窗口打开|下载CSV
图4
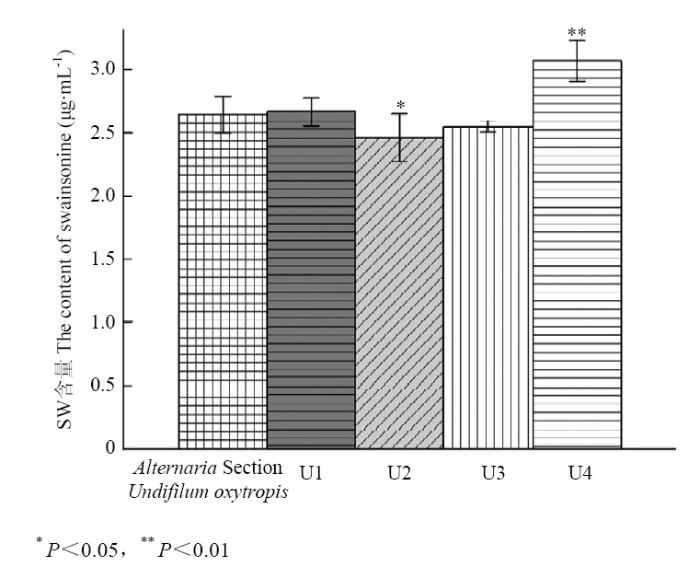 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4紫外辐照诱变菌株产SW含量柱状图
Fig. 4Cylindrical chart of the swainsonine content of swainsonine- producing mutants by ultraviolet irradiation
图5
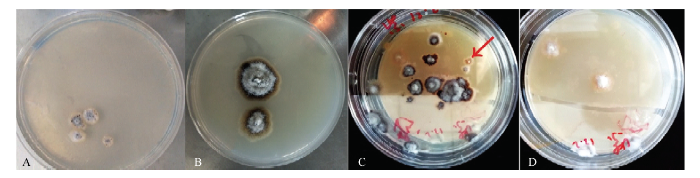 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5紫外辐照诱变筛选前后菌落形态
A、B为原始菌株生长菌落形态,C为紫外诱变后初筛的U4突变株菌落形态,D为U4传代培养后的菌落形态
Fig. 5Colony morphology before and after ultraviolet irradiation mutagenesis
A and B are the morphology of the colony of the original strain. C is the colony morphology of the U4 mutant strain screened after ultraviolet irradiation mutation, and D is U4 colony morphology after subculture
2.4 亚硝基胍对诱变菌株平均致死率的影响
由表3结果看出,当亚硝基胍剂量为6 μL,与出发菌株诱变处理5 min时,平均致死率达58.33%,当亚硝基胍剂量为12 μL,与出发菌株诱变处理5 min时,平均致死率达到100%。结果表明,随亚硝基胍诱变剂量、诱变处理时间的增加,诱变菌株平均致死率也快速上升。Table 3
表3
表3亚硝基胍诱变对Alternaria Section Undifilum oxytropis菌株致死率
Table 3
| 诱变处理时间 Mutagenesis time(min) | 亚硝基胍剂量 Nitroguanidine dose (μL) | 空白对照 Blank control | |||||
|---|---|---|---|---|---|---|---|
| 2 | 4 | 6 | 8 | 10 | 12 | ||
| 5 | 8.33±5.38 | 33.33±14.05 | 58.33±4.59 | 75.00±3.72 | 91.67±13.29 | 100.00±0.00 | 0 |
| 10 | 33.33±7.38 | 66.67±13.66 | 75.0±22.36 | 91.67±7.52 | 91.67±3.50 | 100.00±0.00 | 0 |
| 15 | 58.33±7.46 | 75.00±6.85 | 91.67±6.05 | 100.0±0.00 | 100.0±0.00 | 100.00±0.00 | 0 |
| 20 | 75.00±3.95 | 91.67±7.45 | 100.0±0.00 | 100.0±0.00 | 100.00±0.00 | 100.00±0.00 | 0 |
| 25 | 83.33±12.11 | 100.00±0.00 | 100.0±0.00 | 100.00±0.00 | 100.00±0.00 | 100.00±0.00 | 0 |
| 30 | 91.67±5.31 | 100.0±0.00 | 100.0±0.00 | 100.00±0.00 | 100.00±0.00 | 100.00±0.00 | 0 |
新窗口打开|下载CSV
2.5 亚硝基胍诱变最佳条件的确定
根据一般优选半数致死率附近的诱变剂量和诱变处理时间作为最佳诱变条件的原则,选取亚硝基胍诱变剂量2 μL、诱变处理时间15 min;亚硝基胍诱变剂量6 μL、诱变处理时间5 min,两组各3株诱变菌株,将其依次编号为D1、D2、D3、D4、D5、D6,采用无菌接种针挑取单个菌落,划线接种于PDA培养基平板上,传代培养5代,经α-甘露糖苷酶活性分析法检测菌丝中SW含量,诱变菌株产SW含量见表4和图6。图7-E为D4诱变后培养菌落形态,7-F为D4传代后生长24 d后菌落形态,可见菌落形态为中间凸起,呈不规则形状,菌落颜色发白略微偏粉。图7- G为诱变后D1培养生长菌落形态,7-H为D1连续传代5代后培养生长24 d后菌落形态,可见菌落形态偏小,且菌落颜色发白,生长相对于原始菌株缓慢。Table 4
表4
表4突变菌株产SW含量
Table 4
| 组别 Group | 吸光值 Absorbance ($\bar{x}$±s) | SW含量 SW content (μg·mL-1) | SW含量变化 Change of SW content(%) |
|---|---|---|---|
| Alternaria Section Undifilum oxytropis | 0.5916±0.0353 | 2.7890±0.1870 | - |
| D1 | 0.5714±0.0029 | 2.8597±0.0082 | +2.53% |
| D2 | 0.5213±0.0088 | 3.1364±0.0385 | +12.46%** |
| D3 | 0.5876±0.0413 | 2.7662±0.2250 | -1.18% |
| D4 | 0.7031±0.0033 | 2.1314±0.0180 | -23.58%** |
| D5 | 0.5634±0.0029 | 2.9038±0.0180 | +4.11% |
| D6 | 0.5811±0.0085 | 2.8062±0.0473 | +0.61% |
新窗口打开|下载CSV
图6
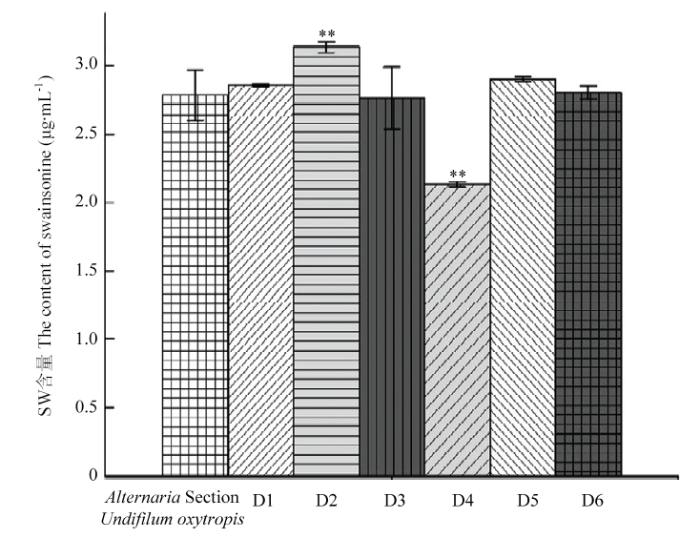 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6亚硝基胍诱变菌株产SW含量柱状图
Fig. 6Cylindrical chart of the swainsonine content of swainsonine- producing mutants by nitrosoguanidine mutagenesis
**P<0.01
图7
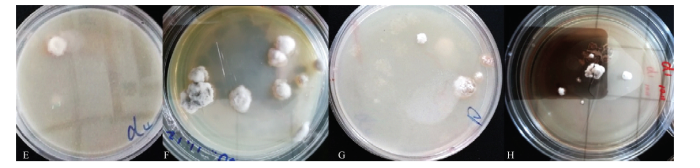 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7诱变后突变菌株菌落的形态观察
E诱变后D4培养菌落形态,F为D4传代培养后的菌落形态,G为诱变后D1培养菌落形态,H为D1传代培养后的菌落形态
Fig. 7Colony morphology of mutant strain before and after mutagenesis by nitrosoguanidine
E was the colony morphology of D4 was cultured after mutagenesis, F was the colony form of D4 after subculture, G was the colony morphology of D1 culture after mutagenesis, and H was the colony form after the passage of D1
2.6 紫外辐照与亚硝基胍复合诱变对诱变菌株平均致死率的影响
由表5、图8可以看出,在复合诱变时菌株在紫外辐照20 s、亚硝基胍诱变剂量2 μL,诱变处理时间5 min时,诱变菌株致死率达到58.98%,当复合诱变时间达到160 s时,致死率达到96.15%,当复合诱变时菌株在320 s,致死率达到100%。结果表明,在亚硝基胍诱变剂量为2 μL,诱变处理5 min时,随紫外辐照时间增加致死率也随之上升。Table 5
表5
表5紫外辐照与亚硝基胍复合诱变对菌株的致死率
Table 5
| 紫外辐照时间 Ultraviolet irradiation time (s) | 亚硝基胍剂量 Nitroguanidine dose (μL) | 诱变时间 Mutagenesis time (min) | 诱变后菌株生长数 Number of strains after mutagenesis | 对照组 Control group | 致死率 Lethal rate (%) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 20 | 2 | 5 | 6 | 5 | 6 | 6 | 4 | 5 | 13 | 58.98±6.28 |
| 40 | 2 | 5 | 3 | 2 | 2 | 4 | 3 | 3 | 12 | 76.39±6.27 |
| 80 | 2 | 5 | 1 | 0 | 1 | 0 | 0 | 2 | 12 | 94.45±6.80 |
| 160 | 2 | 5 | 0 | 0 | 2 | 0 | 0 | 1 | 13 | 96.15±6.43 |
| 320 | 2 | 5 | 0 | 0 | 0 | 0 | 0 | 0 | 11 | 100.00±0.00 |
| 640 | 2 | 5 | 0 | 0 | 0 | 0 | 0 | 0 | 13 | 100.00±0.00 |
新窗口打开|下载CSV
图8
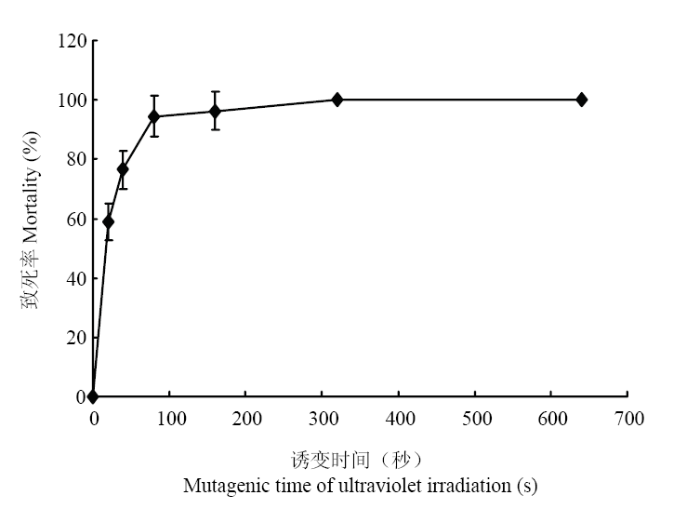 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图8紫外辐照与亚硝基胍复合诱变对菌株的致死率
Fig. 8The lethality curve of Alternaria Section Undifilum oxytropis strain by ultraviolet irradiation-NTG mutagenesis
2.7 复合诱变最佳条件的确定
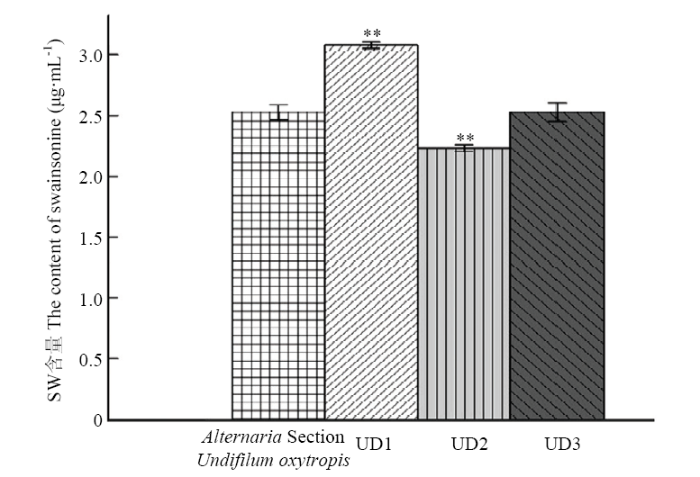
选取紫外辐照20 s,亚硝基胍作用剂量2 μL,作用5 min时,菌株中菌落形态较原始菌落差异较大、长势良好菌株6株诱变菌接种于PDA培养基上,传代5代,经α-甘露糖苷酶活性分析法检测菌丝及发酵中SW含量,共获得3株产SW稳定诱变新菌株,将其依次编号为UD1、UD2、UD3,结果见表6和图9。图10-I为UD1株诱变后的培养24 d菌落生长形态,图10-J为UD1连续传代5代后生长24d后菌落生长形态,可见菌落偏圆且中间凸起,且菌落颜色发白。Table 6
表6
表6突变菌株产SW含量
Table 6
| 组别 Group | 吸光值 Absorbance($\bar{x}$±s) | SW含量 SW content (μg·mL-1) | SW含量变化 Change of SW content (%) |
|---|---|---|---|
| Alternaria Section Undifilum oxytropis | 0.6313±0.0116 | 2.5806±0.06237 | — |
| UD1 | 0.2321±0.0203 | 3.0774±0.02356 | +21.87%** |
| UD2 | 0.6848±0.0354 | 2.2293±0.02997 | -11.72%** |
| UD3 | 0.6311±0.0639 | 2.5256±0.07710 | -0.01% |
新窗口打开|下载CSV
图9
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图9复合诱变菌株产SW含量柱状图
Fig. 9Cylindrical chart of the swainsonine content of swainsonine- producing mutant by ultraviolet irradiation-NTG mutagenesis
**P<0.01
图10
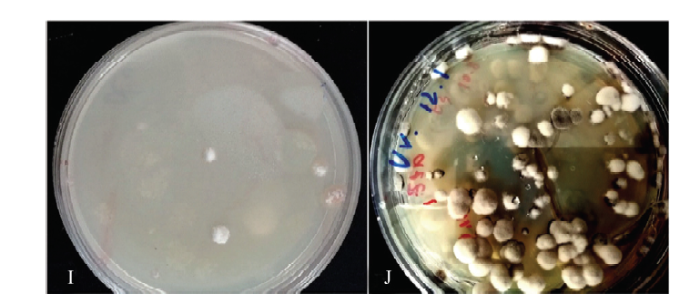 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图10诱变后突变菌株菌落的形态观察
I为诱变后UD1菌落生长形态;J为UD1传代培养后的菌落生长形态
Fig. 10Colony morphology of mutant strain after mutagenesis
I is the growth pattern of UD1 colony after mutation, and J is UD1 colony growth pattern after passage culture
2.8 诱变菌株D4、UD1生长周期的测定
从表7可以看出,诱变菌株D4和UD1在培养至24 d时菌丝干重达到最大值,且菌丝中SW含量同时达到最大值,24 d后趋于稳定不再增加,但菌丝干重有所下降(图11)。结果表明,诱变菌株D4和UD1的生长周期为24 d,与原始菌株的生长周期相同(图12)。Table 7
表7
表7突变菌株与Alternaria Section Undifilum oxytropis菌株菌丝干重及SW产量检测
Table 7
| 时间 Time (d) | 菌丝干重 The dry mycelial weight (g) | SW含量 The content of SW (μg·mL-1) | ||||
|---|---|---|---|---|---|---|
| D4 | UD1 | Alternaria Section Undifilum oxytropis | D4 | UD1 | Alternaria Section Undifilum oxytropis | |
| 4 | 0.231±0.003 | 0.361±0.003 | 0.341±0.003 | 0.2660±0.034 | 0.2671±0.041 | 0.2743±0.003 |
| 8 | 0.503±0.023 | 0.613±0.002 | 0.491±0.061 | 1.2776±0.019 | 1.2775±0.016 | 1.7201±0.052 |
| 12 | 0.800±0.011 | 0.770±0.012 | 0.792±0.026 | 2.1141±0.011 | 1.8384±0.009 | 2.4970±0.038 |
| 16 | 1.015±0.05 | 1.103±0.047 | 1.033±0.049 | 3.0571±0.010 | 3.2219±0.019 | 3.0724±0.052 |
| 20 | 1.793±0.084 | 1.691±0.082 | 1.693±0.081 | 3.7713±0.019 | 5.4179±0.044 | 4.7585±0.011 |
| 24 | 1.986±0.018 | 2.105±0.025 | 2.100±0.033 | 4.1852±0.053 | 5.8580±0.005 | 5.1561±0.011 |
| 28 | 1.836±0.049 | 1.976±0.041 | 1.963±0.083 | 3.9043±0.009 | 5.8357±0.003 | 5.0102±0.010 |
| 32 | 1.021±0.031 | 1.433±0.027 | 1.230±0.026 | 2.2371±0.016 | 3.1252±0.045 | 3.2580±0.004 |
新窗口打开|下载CSV
图11
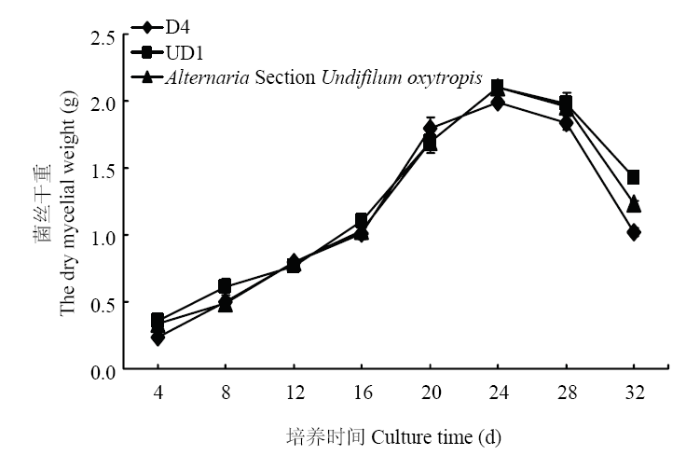 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图11突变菌株与Alternaria Section Undifilum oxytropis菌株菌丝干重
Fig. 11Line chart of the dry mycelial weight among the two mutants and Alternaria Section Undifilum oxytropis
图12
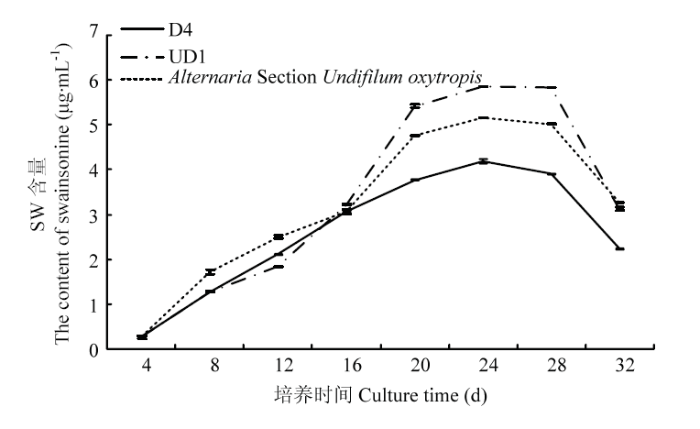 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图12突变菌株与Alternaria Section Undifilum oxytropis菌株产SW含量
Fig. 12The curve of swainsonine content of swainsonine- producing strains among the two mutants and Alternaria Section Undifilum oxytropis
3 讨论
微生物诱变筛选的主要目的是通过人工干预的方式使微生物的代谢产物及生长情况向人们的期望所发展。随着科学技术的不断进步,诱变育种技术也逐渐成熟起来,诱变育种的原理是通过物理或化学的诱导使微生物中某些基因进行重组或缺失来优化基因性状[29,30]。本试验中采用紫外辐照诱变、亚硝基胍诱变及紫外辐照和亚硝基胍诱变相结合的复合诱变方法。其中,紫外辐照诱变具有操作相对简单易行,育种效率高且安全等特点,原理是DNA或RNA能够吸收256 nm紫外波长而影响DNA的正常复制和转录来引起基因突变[31]。化学诱变是一种具有低成本、方便使用、专一性强等特点的诱变常用方法,其中亚硝基胍因其诱变效果稳定良好,被认为是化学诱变方式中的第一选择性化学诱变剂。亚硝基胍诱变主要是使微生物基因产生“GC-AT”转化,诱导DNA复制叉附近的突变,随时间的变化亚硝基胍诱变效果是不相同的,一般优选引起半数致死率附近的诱变剂浓度及作用时间作为最佳诱变选育时间[32,33,34,35]。例如,SANDESH[36]分别利用紫外线、乙基磺酸甲酯(EMS)和亚硝基胍(MNNG)对雨生红球藻进行诱变,获得的诱变新株中总类胡萝卜素和虾青素含量提高了23%—59%,从转录水平上分析发现类胡萝卜素合成途径相关基因的表达均明显高于野生型。采用复合诱变的方法是为了防止诱变选育菌株过程中,菌株对诱变剂、诱变作用时间产生耐受,从而导致致死率及突变率的下降[37]。本试验通过紫外辐照诱变、亚硝基胍化学诱变和复合诱变的方式筛选获得的3株新菌株U4、D4、UD1产苦马豆素含量分别为平均增加16.02%、平均降低23.58%,UD1平均增加21.87%,也验证了亚硝基胍化学诱变在常规诱变方法中具有很好的作用效果。
长期以来,虽然有****推测疯草内生真菌产苦马豆素的代谢合成的通路,可能与豆类丝核菌和金龟子绿僵菌类似,但其验证试验进展缓慢。如何选择合适、有效的研究方法来阐明Alternaria Section Undifilum oxytropis产苦马豆素的生物合成通路显得尤为关键。本试验选取常规的诱变手段,对原始菌株进行诱变筛选,以期从突变菌株产苦马豆素差异性入手,从分子水平上探究寻找调控苦马豆素合成的关键基因和关键酶,为后续研究提供参考依据和技术支撑。
4 结论
通过紫外辐照、亚硝基胍化学诱变、紫外辐照与亚硝基胍结合的复合诱变方法,成功筛选出产苦马豆素含量变化较原始菌株差异较大的3株突变菌株U4、D4、UD1,这为后续利用分子生物学手段在分子水平上阐释疯草内生真菌Alternaria Section Undifilum oxytropis关键基因、关键酶在合成苦马豆素机制关系方面研究奠定了基础。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.3864/j.issn.0578-1752.2013.06.023URLMagsci [本文引用: 1]

西部天然草地是中国草地畜牧业的重要生产基地,也是其重要的绿色生态屏障,对维护生态安全和食物安全,保护人类生存环境,实现草地永续利用,具有重要战略意义。长期以来,由于草地干旱、超载过牧、盲目开垦等自然和人为因素的影响,以及草地基础建设投入不足和管理滞后,导致草地大面积沙化和毒草化。特别是近几十年来,草地毒害草的迅速蔓延,造成草地植被群落和生物多样性减少,草地植被单一,沙漠化等生态学问题,严重影响了草地生态平衡以及牧区畜牧业的可持续发展。“疯草”已成为西部天然草地主要毒害草之首,每年给畜牧业造成直接经济损失超过几十亿元。本文就中国西部天然草地疯草研究历史、种类与生态分布、毒性灾害状况、毒性成分与毒性机理、灾害及综合防控技术进行综述,并提出今后疯草研究中应注意的问题,对认识疯草在天然草地中的生态作用和疯草灾害综合防控具有重要指导意义。
DOI:10.3864/j.issn.0578-1752.2013.06.023URLMagsci [本文引用: 1]

西部天然草地是中国草地畜牧业的重要生产基地,也是其重要的绿色生态屏障,对维护生态安全和食物安全,保护人类生存环境,实现草地永续利用,具有重要战略意义。长期以来,由于草地干旱、超载过牧、盲目开垦等自然和人为因素的影响,以及草地基础建设投入不足和管理滞后,导致草地大面积沙化和毒草化。特别是近几十年来,草地毒害草的迅速蔓延,造成草地植被群落和生物多样性减少,草地植被单一,沙漠化等生态学问题,严重影响了草地生态平衡以及牧区畜牧业的可持续发展。“疯草”已成为西部天然草地主要毒害草之首,每年给畜牧业造成直接经济损失超过几十亿元。本文就中国西部天然草地疯草研究历史、种类与生态分布、毒性灾害状况、毒性成分与毒性机理、灾害及综合防控技术进行综述,并提出今后疯草研究中应注意的问题,对认识疯草在天然草地中的生态作用和疯草灾害综合防控具有重要指导意义。
URLMagsci [本文引用: 1]

<FONT face=Verdana>西部草原是中国西部地区居民的主要生活生产资料来源。多年来,受超载过牧、滥垦、滥挖、人口增长等因素的影响,草场大面积沙化和毒草化,使西部地区的自然生态环境遭受严重破坏,制约了西部地区畜牧业生产的可持续发展。毒草的迅速蔓延是造成草地生态失衡的重要生态学问题之一,是草地退化的一个重要指标。笔者在对文献资料分析、归纳的基础上,就中国西部草地近几十年的毒草灾害状况,毒草种类与分布,毒草综合防治及合理利用做以综述。</FONT>
URLMagsci [本文引用: 1]

<FONT face=Verdana>西部草原是中国西部地区居民的主要生活生产资料来源。多年来,受超载过牧、滥垦、滥挖、人口增长等因素的影响,草场大面积沙化和毒草化,使西部地区的自然生态环境遭受严重破坏,制约了西部地区畜牧业生产的可持续发展。毒草的迅速蔓延是造成草地生态失衡的重要生态学问题之一,是草地退化的一个重要指标。笔者在对文献资料分析、归纳的基础上,就中国西部草地近几十年的毒草灾害状况,毒草种类与分布,毒草综合防治及合理利用做以综述。</FONT>
URL [本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2014.01.018URLMagsci [本文引用: 1]

【目的】疯草是中国西部影响草地生态和畜牧业健康发展的毒草之一。主要有豆科棘豆属和黄芪属有毒植物等,在冬季牧草严重缺乏的时节,牛羊等牲畜被迫采食后可引起中毒和生产性能下降,甚至死亡,每年给我国草地生态和畜牧业造成的直接经济损失达几十亿元,是危害最严重的毒草。目前,我国西部天然草地动物因疯草中毒死亡所造成的经济损失仍持续剧增。苦马豆素被认为是引起动物疯草中毒的主要毒性成分。由于疯草分布广泛,资源丰富,如何改善草地生态,合理开发利用疯草成为研究的课题和方向。近几十年来, 随着对疯草研究的深入和扩展,人们发现苦马豆素不仅具有良好的抗肿瘤效果,还可作为免疫调节剂、抗HIV及扩散抑制剂、抗病毒和细胞保护剂等药物使用。目前,国内在对苦马豆素抗肿瘤、调节机体免疫方面研究较热,但是,对苦马豆素在抗病毒活性、作用机理方面的研究尚无相关报道。为了探讨茎直黄芪中生物碱苦马豆素(swainsonine,SW)抗牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)的作用机制,明确其体外抗病毒作用效果,为抗BVDV的药物筛选提供参考依据。【方法】利用细胞培养技术,采用CPE观察法和MTT比色法相结合的方法测定不同浓度SW对牛肾原代细胞(madin-darby bovine kidney cells,MDBK)的毒性作用,确定药物的安全浓度和TD50,并分别采用先加药后感染病毒、先感染病毒后加药、药毒作用2 h后加入、感染病毒同时给药后再加药四种作用方式,检测不同浓度SW对BVDV入侵的阻断作用、复制的抑制作用、直接杀伤作用和综合作用,并计算不同作用方式下的治疗指数。【结果】结果显示:SW浓度小于0.256 μg•mL-1范围内对MBDK细胞无毒性作用,在大于0.512 μg•mL-1浓度下MBDK细胞表现出一定程度的病变,TD50为2.512 μg•mL-1,按Reed-Muench 氏法计算BVDV TCID50为10-4.7/0.1mL;在体外随苦马豆素质量浓度的增加,其抗BVDV作用具有很好的量效关系,且与作用方式有关,比较四种作用方式下的治疗指数1.05、2.47、2.08和3.21,说明SW对BVDV的综合作用(65.29%,P<0.01)和复制(65.05%,P<0.01)的抑制作用较好,亦有一定的直接杀伤作用,但对其入侵的阻断作用不佳。【结论】SW在体外有良好抗BVDV活性作用,并推测苦马豆素(SW)抗病毒的主要效应可能是SW能进入细胞内抑制BVDV的复制增殖以及直接灭活游离BVDV而发挥作用。
DOI:10.3864/j.issn.0578-1752.2014.01.018URLMagsci [本文引用: 1]

【目的】疯草是中国西部影响草地生态和畜牧业健康发展的毒草之一。主要有豆科棘豆属和黄芪属有毒植物等,在冬季牧草严重缺乏的时节,牛羊等牲畜被迫采食后可引起中毒和生产性能下降,甚至死亡,每年给我国草地生态和畜牧业造成的直接经济损失达几十亿元,是危害最严重的毒草。目前,我国西部天然草地动物因疯草中毒死亡所造成的经济损失仍持续剧增。苦马豆素被认为是引起动物疯草中毒的主要毒性成分。由于疯草分布广泛,资源丰富,如何改善草地生态,合理开发利用疯草成为研究的课题和方向。近几十年来, 随着对疯草研究的深入和扩展,人们发现苦马豆素不仅具有良好的抗肿瘤效果,还可作为免疫调节剂、抗HIV及扩散抑制剂、抗病毒和细胞保护剂等药物使用。目前,国内在对苦马豆素抗肿瘤、调节机体免疫方面研究较热,但是,对苦马豆素在抗病毒活性、作用机理方面的研究尚无相关报道。为了探讨茎直黄芪中生物碱苦马豆素(swainsonine,SW)抗牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)的作用机制,明确其体外抗病毒作用效果,为抗BVDV的药物筛选提供参考依据。【方法】利用细胞培养技术,采用CPE观察法和MTT比色法相结合的方法测定不同浓度SW对牛肾原代细胞(madin-darby bovine kidney cells,MDBK)的毒性作用,确定药物的安全浓度和TD50,并分别采用先加药后感染病毒、先感染病毒后加药、药毒作用2 h后加入、感染病毒同时给药后再加药四种作用方式,检测不同浓度SW对BVDV入侵的阻断作用、复制的抑制作用、直接杀伤作用和综合作用,并计算不同作用方式下的治疗指数。【结果】结果显示:SW浓度小于0.256 μg•mL-1范围内对MBDK细胞无毒性作用,在大于0.512 μg•mL-1浓度下MBDK细胞表现出一定程度的病变,TD50为2.512 μg•mL-1,按Reed-Muench 氏法计算BVDV TCID50为10-4.7/0.1mL;在体外随苦马豆素质量浓度的增加,其抗BVDV作用具有很好的量效关系,且与作用方式有关,比较四种作用方式下的治疗指数1.05、2.47、2.08和3.21,说明SW对BVDV的综合作用(65.29%,P<0.01)和复制(65.05%,P<0.01)的抑制作用较好,亦有一定的直接杀伤作用,但对其入侵的阻断作用不佳。【结论】SW在体外有良好抗BVDV活性作用,并推测苦马豆素(SW)抗病毒的主要效应可能是SW能进入细胞内抑制BVDV的复制增殖以及直接灭活游离BVDV而发挥作用。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLMagsci [本文引用: 1]

【目的】了解内蒙古阿拉善和宁夏天然草原的小花棘豆和变异黄芪不同组织中内生真菌Undifilum oxytropis的显微分布特点和含量分布规律。【方法】通过石蜡切片结合乳酸酚棉蓝染色法观察,采用实时荧光定量PCR(RT-qPCR) 进行定量研究,获得各组织(茎、叶、种子和根)中内生真菌分布和含量。【结果】种子中内生真菌主要定殖于种皮栅栏组织与薄壁组织两层的细胞间隙;叶片组织主要定殖于靠近气孔的表皮细胞层,茎髓中内生真菌围绕于茎髓质维管束纵轴边缘的薄壁细胞层中;RT-qPCR的检测限为0. 029 pg/ng总DNA,各采样点相应组织内生真菌含量不同,两采样点小花棘豆种子中U.oxytropis含量均为最高,叶和茎相反,两地变异黄芪为种子中最高,根最低,叶和茎相反。【结论】内生真菌寄生在植物组织时对宿主组织和细胞类型均有选择性,生境对疯草中内生真菌的定殖和分布也有影响。
URLMagsci [本文引用: 1]

【目的】了解内蒙古阿拉善和宁夏天然草原的小花棘豆和变异黄芪不同组织中内生真菌Undifilum oxytropis的显微分布特点和含量分布规律。【方法】通过石蜡切片结合乳酸酚棉蓝染色法观察,采用实时荧光定量PCR(RT-qPCR) 进行定量研究,获得各组织(茎、叶、种子和根)中内生真菌分布和含量。【结果】种子中内生真菌主要定殖于种皮栅栏组织与薄壁组织两层的细胞间隙;叶片组织主要定殖于靠近气孔的表皮细胞层,茎髓中内生真菌围绕于茎髓质维管束纵轴边缘的薄壁细胞层中;RT-qPCR的检测限为0. 029 pg/ng总DNA,各采样点相应组织内生真菌含量不同,两采样点小花棘豆种子中U.oxytropis含量均为最高,叶和茎相反,两地变异黄芪为种子中最高,根最低,叶和茎相反。【结论】内生真菌寄生在植物组织时对宿主组织和细胞类型均有选择性,生境对疯草中内生真菌的定殖和分布也有影响。
DOI:10.11843/j.issn.0366-6964.2016.06.001URLMagsci [本文引用: 1]

<p>吲哚里西啶类生物碱苦马豆素是疯草及其内寄生真菌的代谢产物,其有良好的抗病毒、抗肿瘤和提高机体免疫力的作用,具有巨大的药用潜力。作者简要阐述了苦马豆素的药理作用、检测方法、药用价值和研发潜力,并对其来源及疯草内生真菌合成苦马豆素的相关研究进展进行总结,以期丰富苦马豆素的来源,为其在科研和医疗上的广泛应用提供保障。</p>
DOI:10.11843/j.issn.0366-6964.2016.06.001URLMagsci [本文引用: 1]

<p>吲哚里西啶类生物碱苦马豆素是疯草及其内寄生真菌的代谢产物,其有良好的抗病毒、抗肿瘤和提高机体免疫力的作用,具有巨大的药用潜力。作者简要阐述了苦马豆素的药理作用、检测方法、药用价值和研发潜力,并对其来源及疯草内生真菌合成苦马豆素的相关研究进展进行总结,以期丰富苦马豆素的来源,为其在科研和医疗上的广泛应用提供保障。</p>
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLMagsci [本文引用: 1]

化学诱变是一种传统而经典的微生物育种技术,不仅在高产工业菌株选育中得到广泛应用,而且近来还用于改造野生菌株代谢功能,以发现新产活性产物。本文简要综述常用化学诱变剂及其作用机制,以及化学诱变技术在微生物育种领域中的新近应用研究进展。
URLMagsci [本文引用: 1]

化学诱变是一种传统而经典的微生物育种技术,不仅在高产工业菌株选育中得到广泛应用,而且近来还用于改造野生菌株代谢功能,以发现新产活性产物。本文简要综述常用化学诱变剂及其作用机制,以及化学诱变技术在微生物育种领域中的新近应用研究进展。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
