 ,1, 余婧
,1, 余婧 ,1
,1The Function of the Polyketide Synthase OsPKS1 and OsPKS2 in Regulating Pollen Wall Formation in Rice
ZHOU YuLu1, LIN Hong1, ZHANG DaBing1,2, WANG CanHua ,1, YU Jing
,1, YU Jing ,1
,1通讯作者:
收稿日期:2018-12-10接受日期:2019-01-24网络出版日期:2019-04-16
| 基金资助: |
Received:2018-12-10Accepted:2019-01-24Online:2019-04-16
作者简介 About authors
周雨露,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (6571KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
周雨露, 林泓, 张大兵, 王灿华, 余婧. 酮类物质合成酶OsPKS1和OsPKS2对水稻花粉外壁形成的作用[J]. 中国农业科学, 2019, 52(8): 1295-1307 doi:10.3864/j.issn.0578-1752.2019.08.001
ZHOU YuLu, LIN Hong, ZHANG DaBing, WANG CanHua, YU Jing.
0 引言
【研究意义】稻米是人类最主要的粮食来源,中国是世界上水稻种植和消费大国,不仅有着悠久的水稻栽培历史,还拥有先进水稻育种技术体系,特别是杂交水稻育种技术的应用和推广,大大缓解了中国乃至全世界的粮食安全问题。杂交水稻育种依赖于雄性不育作为母本获取F1代种子,因此,雄性不育系的鉴定和分析对于杂交水稻育种具有重要意义[1]。【前人研究进展】水稻雄性发育是在花药这个生殖器官中完成,花药原基经历一系列细胞分裂分化,形成自外向内分别是表皮、内皮层、中间层和绒毡层的四层壁细胞,四层壁细胞包裹的孢母细胞经过减数分裂形成小孢子。此时,绒毡层细胞合成孢粉素,运输到小孢子表面,形成花粉外壁[2]。花粉外壁可以保护花粉免受外界各种生物及非生物的伤害,例如紫外线、高温以及病虫害等[3,4,5],花粉外壁对于物种的识别也有着重要作用[6]。花粉外壁主要包括2部分结构,从里到外分别是花粉外壁内层和花粉外壁外层,外壁外层包括最外部的覆盖层和柱状体[7,8]。研究表明孢粉素是由脂类物质和酚类物质及其衍生物组成的高分子聚合物[9,10,11]。研究证实大量的脂类代谢相关基因参与孢粉素的形成,水稻中花药特异表达基因CYP704B2[12]和CYP703A3[13],其编码蛋白参与脂肪酸羟基化,形成ω-羟基脂肪酸和链内羟基脂肪酸。在拟南芥中,CYP704B1[14]与CYP704B2功能保守,CYP703A2[15]与CYP703A3功能保守。水稻DPW(DEFECTIVE POLLEN WALL)[16]和拟南芥MS2(MALE STERILE2)[17]编码一类脂肪酸还原酶,能够将棕榈酰基载体蛋白转化为1-十六烷醇,也可催化十八碳酰基载体蛋白,将其转化为十八烷醇。DPW2(DEFECTIVE POLLEN WALL2)[18]编码一个细胞质定位的酰基转移酶,能够将羟基肉桂酰辅酶A的酰基转移到ω-羟基脂肪酸上。OsNP1(No POLLEN1)[19]是一个葡萄糖-甲醇-胆碱氧化还原酶成员,主要在绒毡层中表达,该基因的缺失使得环氧衍生的比例明显下降,暗示OsNP1参与脂肪酸的环氧修饰。以上基因的缺失都会导致花粉外壁形成缺陷,从而影响育性。此外,研究发现一条在拟南芥、水稻、烟草、油菜等植物中保守的关于孢粉素酚类物质的代谢途径[20,21,22,23,24]。在拟南芥中,孢粉素合成所需的中长链脂肪酸由ACOS5(CoA Synthetase5)催化成中长链脂肪酰-CoA[25],中长链脂肪酰-CoA经PKS1/PKSA/LAP6(POLYKETIDE SYNTHASE 1/POLYKETIDE SYNTHASE A/LESS ADHESIVE POLLEN 6)和PKS2/PKSB/LAP5(POLYKETIDE SYNTHASE 2/ POLYKETIDE SYNTHASE B/LESS ADHESIVE POLLEN 5)催化与丙二酰辅酶A缩合形成三酮或四酮的α-吡喃酮[26,27],后可被DRL1/TKPR1(DIHYDROFLAVONOL 4-REDUCTASE-LIKE 1/ TETRAKETIDE α-PYRONE REDUCTASE1)和DRL2/TKPR2(DIHYDROFLAVONOL 4-REDUCTASE- LIKE 2/TETRAKETIDE α-PYRONE REDUCTASE2)所还原[28]。ACOS5的水稻同源基因OsACOS12(CoA Synthetase12)在水稻中也行使保守的功能,osacos12突变体也表现出与拟南芥相似的雄性不育的表型,并且会影响花药外壁、乌式体和花粉外壁的形成[21,25]。PKS1/PKSA/LAP6和PKS2/PKSB/LAP5的水稻同源基因OsPKS1/OsLAP6和OsPKS2/OsLAP5属于植物PKSⅢ超家族,该家族蛋白催化多种植物次生代谢产物的合成。在植物从水生走向陆生进化过程中起到非常重要的作用[26]。而花粉外壁的形成被认为是植物从水生走向陆生的重要原因[6]。研究表明这两个基因可能存在保守的生物学功能,参与吡喃酮相关的孢粉素合成[20,21,22,23,24]。体外生化试验表明OsPKS1和OsPKS2可将饱和或者不饱和的16C或者18C脂肪酰-CoA与丙二酰辅酶A缩合形成三酮或四酮的α-吡喃酮从而控制花粉发育[24,25,26,27,28,29]。此外,用拟南芥PKS1/PKSA/LAP6和PKS2/PKSB/LAP5启动子驱动水稻OsPKS1/OsLAP6和OsPKS2/OsLAP5 cDNA序列可以基本恢复pks1/pksa/ lap6和pks2/pksb/lap5的花粉外壁缺陷[29,30]。以上结果说明PKSs在水稻和拟南芥中功能保守,但细胞学研究及代谢分析研究发现PKSs在水稻和拟南芥功能存在差异。拟南芥pks1/pksa/lap6和pks2/pksb/lap5的花粉外壁花纹异常,但育性不受影响。代谢测定显示pks1/pksa/lap6或pks2/pksb/lap5突变体中代谢物总量变化不明显,而pksa pksb双突变体的代谢物大大下降[27,31],说明PKS1/PKSA/LAP6和PKS2/PKSB/ LAP5可能存在功能冗余,共同参与孢粉素合成。【本研究切入点】拟南芥pks1/pksa/lap6和pks2/pksb/lap5的花粉外壁形态异常[27,31],它们的花粉外壁与野生型相比更薄,柱状体更短,但花粉可育。水稻的同源突变体ospks1和ospks2均呈现雄性不育的表型,ospks2花粉外壁堆积了更多的孢粉素颗粒,脂类物质积累稍有上升[29-30,32]。以上结果说明PKS1/PKSA/LAP6和OsPKS1/OsLAP6以及PKS2/PKSB/LAP5和OsPKS2/ OsLAP5虽然具有保守的生化功能,其细胞学功能尚不清楚。【拟解决的关键问题】本研究利用CRISPR/ Cas9技术分别在野生型和ospks2突变体背景下敲除OsPKS1获得ospks1单突变体和ospks1 ospks2双突变体,通过半薄切片,扫描电镜和透射电镜等技术观察突变体表型,分析OsPKS1在水稻花药发育中的细胞学功能,研究OsPKS2和OsPKS1两者协同调控花粉外壁的机制。1 材料与方法
1.1 植物材料
野生型水稻品种为武运粳7号(9522),该品种于2018年夏季种植在上海交通大学转基因科普教育基地,春季种植于海南三亚上海南繁站试验田。1.2 菌株和载体
Escherichia coli(E.coli)DH5α大肠杆菌感受态、EHA105农杆菌感受态购自天根生物技术(北京)有限公司。载体pRGEB32和pGTR来自谢卡斌实验室[33]。1.3 主要试剂
限制性内切酶FokⅠ、BsaⅠ均购自NEB公司,T7连接酶购自TaKaRa公司,Taq DNA聚合酶购自上海申能博彩有限公司;质粒提取试剂盒购自上海捷瑞生物工程有限公司;琼脂糖凝胶回收试剂盒购自Axygen;卡那霉素(Kanamycin)和氨苄青霉素(Ampicillin)购自上海先锋药业有限公司;DNA测序服务由上海华大基因公司提供;乙醇、甲醛、戊二醛、异丙醇等常规试剂均购自国药集团(上海)有限公司。引物均由上海捷瑞生物工程有限公司合成提供。1.4 CRISPR-Cas9重组载体构建、水稻转化及突变体鉴定
通过基因分析网站(http://gramene.org)确定基因外显子,使用蛋白分析网站(http://smart.embl-heidelberg. de)预测基因保守区域,在CRISPR-P 2.0(http:// crsripr.hzau.cn/CRISPR2)网站输入保守区域序列信息来寻找符合条件的靶标,根据CRISPR-Cas9原理在PAM序列(protospacer adjacent motif-NGG)上游20个碱基处设计靶点,正向引物选取第9—20位碱基作为主体并在两端加上接头,反向引物选取第1—12位碱基作为主体,在两端加上接头。选取2个靶点来设计引物,具体引物序列(表1)。通过文献[33]中描述方法,利用通用引物和设计引物OsPKS1-T1和OsPKS1-T2构建CRISPR/Cas9质粒,将质粒转入到EHA105农杆菌感受态中,再将农杆菌转入到野生型水稻愈伤组织来获得ospks1单突变体;转入ospks2愈伤组织获得ospks1 ospks2双突变体。转基因植株通过PCR产物测序方法鉴定基因型,引物信息见表1。Table 1
表1
表1OsPKS1 CRISPR构建引物及鉴定引物
Table 1
| 引物名称 Primer name | 正向引物 Forward primer(5′-3′) | 反向引物 Reverse primer (5′-3′) |
|---|---|---|
| OsPKS1_Cri_T1 | TAGGTCTCCCAAGGAAGAGAAGTTTTAGAGCTAGAA | CGGGTCTCACTTGGCTGCTCCTGCACCAGCCGGG |
| OsPKS1_Cri_T2 | TAGGTCTCCACTACAAGGACGGTTTTAGAGCTAGAA | CGGGTCTCATAGTAGCCGCGGTGCACCAGCCGGG |
| OsPKS1_Cri_GT | CTAGACGAGCACCCAGAGCT | ACCTTGTCCGTCCCTGGTAG |
新窗口打开|下载CSV
1.5 ospks1和ospks1 ospks2突变体表型分析
用Nikon E995数码相机拍摄突变体整株和花器官表型。通过碘染剂测定花粉活力,野生型和突变体花粉用医用镊子轻夹使之释放到I2-KI溶液中(0.2%碘和2%碘化钾),显微镜(Leica DM2500)拍照并记录可育花粉比例。半薄切片观察花药表型采用李娜等[34]方法制备8b—12期的花药,根据张大兵等[35,36]方法确定花药发育时期。将野生型和突变体花药用4%戊二醛溶液固定,然后在0.2 mol·L-1,pH7.0的磷酸钠缓冲溶液中漂洗3次,然后在2%OsO4溶液中后固定4 h以上。经过酒精梯度脱水和环氧丙烷置换,样品最终被包埋进丙烯酸树脂中(London Resin Company, London, UK)。然后通过超薄切片(70 nm, using an Ultramicrotome Leica EM UC7),并用2%乙酸铀酰和2.6%柠檬酸铅双重染色,最后用120 kV TEM进行拍照和记录(FEI, Tecnai G2 Spirit Bio TWIN)。
将野生型和突变体13期花药用FAA溶液固定2 h以上。使用梯度酒精对材料进行脱水处理,依次加入70%、80%、95%和100%乙醇,脱水后使用临界点干燥器(Critical Point Drier, Leica EM CPD300, Germany)干燥花药样品。在铜台上贴上导电胶,将花药样品放置在导电胶上。将铜台放入镀膜机(Super Cool Sputter Coater, Leica SCD050, Germany)中进行喷金处理。扫描电镜(Scanning Electron Microscope, Hitachi S-4800, Japan)下观察样品的花药内外壁和花粉外壁的形态并拍照记录。
2 结果
2.1 利用CRISPR/Cas9系统获得ospks1单突变体和ospks1 ospks2双突变体
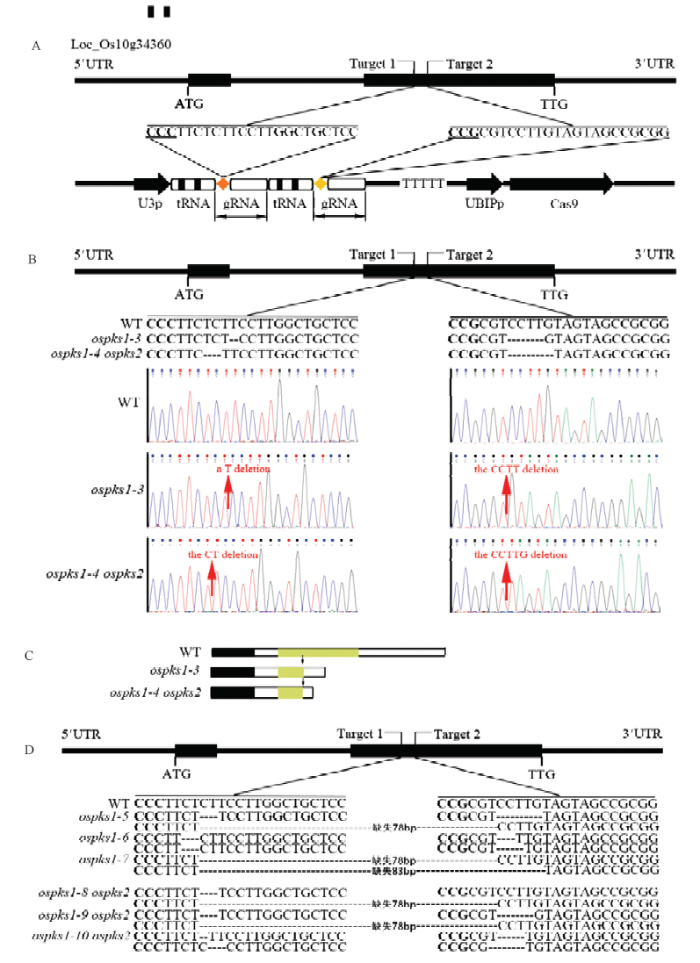
从水稻花药发育网络AntherNet[37]预测到一个可能参与孢粉素合成的基因OsPKS1,结果表明,该基因是一个在绒毡层中特异表达的基因[30,32]。为了验证OsPKS1对孢粉素合成的作用以及OsPKS1和OsPKS2在水稻花药发育过程中的作用,在OsPKS1的第二个外显子上设计了2个位点(图1-A),利用CRISPR/Cas9系统获得9522背景下的ospks1单突变体和ospks2背景下的ospks1 ospks2双突变体来验证其基因功能。从获得的大量转基因苗中,分别选取8棵材料进行鉴定,获得4个单突变体和4个双突变体(图1-B和图1-D),其中一个单突变体在+1 322 bp缺失一个碱基T,从 +1 398 bp开始缺失4 bp,命名为ospks1-3;一个双突变体在从+1 319 bp缺失2个碱基,从+1 398 bp开始缺失5 bp,命名为ospks1-4 ospks2(图1-B)。蛋白结构分析突变体的突变都发生在保守结构域上(图1-C),并且造成翻译提前终止。以上结果说明成功获得敲除OsPKS1的突变体。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1OsPKS1 gRNA靶位点及突变位点分析
A:2个靶点在OsPKS1中的位置及2个靶点gRNA表达盒与pRGEB32CRISPR/Cas9组装成的表达载体;B:ospks1-3和ospks1-4 ospks2突变体的突变位点测序结果;C:野生型与突变体表达蛋白分析,色框显示的是预测出的保守域,箭头表示突变位置。D:其他等位的基因型信息
Fig. 1Target sites of the gRNA in the OsPKS1 gene and mutation site analysis
A: Position of two targets in OsPKS1 gene locus, cloning of two gRNA cassettes into the pRGEB32CRISPR/Cas9 vector; B: Mutation site sequencing results of ospks1-3 and ospks1-4 ospks2; C: The protein prediction analysis of the wild type and the mutants, green boxes indicate putative conserved domain, the arrows indicate the mutation position. D: Mutation information in other alleles
2.2 突变体ospks1-3和ospks1-4 ospks2植株育性表型
通过对获得的突变体进行表型分析。与野生型相比,ospks1-3和ospks1-4 ospks2表现为正常的营养生长和花器官发育(图2-A—图2-E),ospks1-3和ospks1-4 ospks2的穗型与野生型相比也无明显差异(图2-B),但是ospks1-3单突变体和ospks1-4 ospks2双突变体的花药比野生型小(图2-F—图2-H),特别是ospks1-4 ospks2双突变体,它的花药颜色偏白。I2-KI染色结果显示ospks1-3单突变体的花粉失去活力,而ospks1-4 ospks2双突变体不能形成成熟的花粉(图2-F—图2-H),而ospks2与ospks1-3相似,也能形成失去活力的花粉[29]。根据以上结果以及之前的研究[29-30,32]表明OsPKS1和OsPKS2协同控制水稻花粉发育。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2野生型与ospks1-3、ospks1-4 ospks2突变体的表型比较
A:野生型植株(左)、ospks1-3突变体植株(中间)和ospks1-4 ospks2突变体植株(右);B:结实阶段野生型穗型(左)、ospks1-3突变体穗型(中间)和ospks1-4 ospks2突变体穗型(右);C—E:分别是去掉内外稃的13期野生型小花、ospks1-3小花和ospks1-4 ospks2小花;F:野生型黄色花药,13期被I2-KI溶液染色的花粉;G:ospks1-3花药,13期被I2-KI溶液染色的花粉;G:ospks1-4 ospks2花药,13期被I2-KI溶液染色的花粉。Pi:雌蕊;St:雄蕊。Bar:10 cm(A);5 cm(B);2 mm(C—E);1 mm(F—H);200 μm(F—H)内部
Fig. 2The phenotypic comparison among the wild type, ospks1-3 and ospks1-4 ospks2
A: Wild-type plant (left), ospks1-3 mutant plant (middle) and ospks1-4 ospks2 mutant plant (right); B: Part of a wild-type panicle (left), an ospks1-3 panicle (middle) and an ospks1-4 ospks2 panicle (right) at seed producing stage; C-E: Wild-type flower, ospks1-3 flower and ospks1-4 ospks2 flower at stage 13 all with lemma and palea removed; F: Wild-type yellow anther and pollen grains stained with I2-KI solution at stage 13; G: ospks1-3 mutant anther and pollen grains stained with I2-KI solution at stage 13; H: ospks1-4 ospks2 mutant anther and pollen grains stained with I2-KI solution at stage 13. Pi: Pistil; St: Stamen. Bars: 10 cm (A); 5 cm (B); 2 mm (C-E), 1 mm (F-H), 200 μm in insets (F-H)
2.3 半薄切片观察ospks1-3和ospks1-4 ospks2的花药发育过程
通过对突变体进行I2-KI溶液染色,结果表明,ospks1突变体产生的花粉缺乏活力,ospks1 ospks2不能产生花粉,需要进一步研究突变体与野生型花粉发育的形态差异过程。分别以ospks1-3突变体和ospks1-4 ospks2突变体作为研究材料,进行花药的横断面分析,比较突变体与野生型花粉发育的各个时期形态差异[34]。结果显示,ospks1-3突变体在花药发育8b期至11期(图3-F—图3-I)与野生型(图3-A—图3-D)相比无明显差异,表现出正常的小孢子发育和绒毡层降解。野生型在12期积累淀粉,形成圆形的成熟花粉(图3-E),而ospks1-3突变体在12期(图3-J)小孢子形态异常并皱缩。ospks1-4 ospks2突变体在花药发育8b期至9期(图3-K—图3-L)与野生型(图3-A—图3-B)相比无明显差异,表现出正常的四分体发育和绒毡层波浪状形态。10期野生型(图3-C)小孢子呈圆形并且空泡化,而ospks1-4 ospks2突变体在10期(图3-M)小孢子无法形成空泡化并在小孢子外围形成透明未知物质,绒毡层异常膨大无法正常降解。11期野生型(图3-D)绒毡层进一步降解,而ospks1-4 ospks2突变体在11期(图3-N)绒毡层依然呈现异常膨大状态,并且小孢子形态异常,被部分降解,并在12期(图3-O)小孢子被完全降解。结合ospks2[29]结果和花药发育的半薄切片结果,表明OsPKS1或OsPKS2的突变不影响小孢子在10期的空泡化,影响其后期发育,不影响绒毡层发育。而当OsPKS1和OsPKS2同时缺失时将导致小孢子外壁不能正常形成,10期小孢子无法进行空泡化并且提前降解;绒毡层异常膨大,无法正常降解。图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3野生型和ospks1-3、ospks1-4 ospks2突变体花药发育的半薄切片分析
A—E:野生型;F—J:ospks1-3突变体;K—O:ospks1-4 ospks2突变体。DMsp:退化的小孢子;E:表皮;En:内皮;Ml:中间层;Msp:小孢子;T:绒毡层;Tds:四分体;Mp:成熟的花粉;DMp:退化的成熟花粉。Bar:20 μm(A—O)
Fig. 3Transverse section analysis of anther development in the wild type, ospks1-3 and ospks1-4 ospks2
A-E: Wild type; F-J: ospks1-3; K-O: ospks1-4 ospks2. DMsp: Degenerated microspores; E: Epidermis; En: Endothecium; Ml: Middle layer; Msp: Microspore; T: Tapetum; Tds: Tetrads; Mp: Mature pollen; DMp: Degenerated mature pollen. Bar: 20 μm (A-O)
2.4 扫描电镜及透射电镜观察ospks1-3花药和花粉精细结构
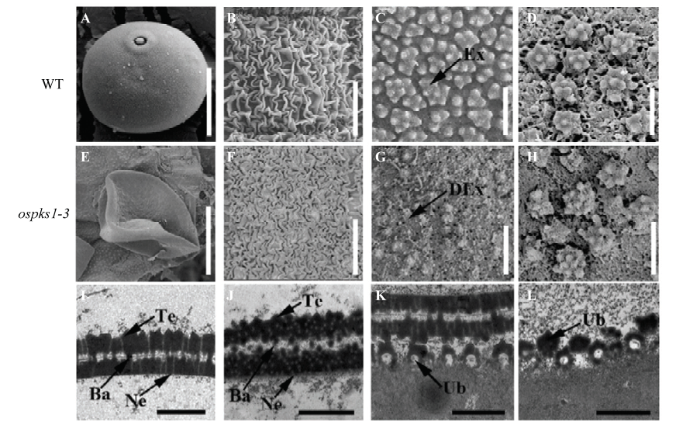
为了进一步研究ospks1-3突变体花粉发育缺陷,对13期野生型和突变体的花药和花粉利用扫描电镜和透射电镜进行观察。扫描电镜结果显示野生型花粉呈现圆形(图4-A),而ospks1-3突变体呈现扁形形态(图4-E)。野生型(图4-B)和ospks1-3突变体(图4-F)花药外壁无明显差异。13期野生型的花粉外壁呈现均匀分布的点簇状规则结构(图4-C),而ospks1-3突变体(图4-G)无法形成这一结构。野生型乌式体大小较均匀且大致呈现均匀分布(图4-D),ospks1-3突变体乌式体形态异常且分布较不规则(图4-H)。图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4野生型和ospks1-3突变体花粉及花药的扫描电镜和透射电镜分析
A—H:13期野生型和ospks1-3突变体花药和花粉表面的扫描电镜分析;I—L:10期野生型和ospks1-3突变体乌式体和花粉外壁的透射电镜分析。A:野生型花粉;B:野生型花药外壁;C:野生型花粉外壁;D:野生型花药内壁;E:ospks1-3突变体花粉;F:ospks1-3突变体花药外壁;G:ospks1-3突变体花粉外壁;H:ospks1-3突变体花药内壁;I:野生型花粉外壁;J:ospks1-3突变体花粉外壁;K:野生型乌式体;L:ospks1-3突变体乌式体。Ex:花粉外壁;DEx:畸形花粉外壁;Ne:外壁内层;Ub:乌式体;Ba:柱状体;Te:覆盖层。Bars:20 μm(A、E);10 μm(B、F);1 μm(C、D、G、H);0.5 μm (I—L)
Fig. 4SEM and TEM observation for anther and pollen in the wild type and ospks1-3
A-H: SEM analysis of the surface of anthers and pollen grains in the wild type and ospks1-3 at stage 13; I-L: TEM observation of pollen wall and Ubisch body in the wild type and ospks1-3 at stage 10. A: Pollens of the wild type; B: Anther epidermis of the wild type; C: Pollen wall of the wild type; D: The inner surface of the wild type; E: Pollens of ospks1-3; F: Anther epidermis of ospks1-3; G: Pollen wall of ospks1-3; H: The inner surface of ospks1-3; I: Ultra-thin sections of pollen wall in the wild type; J: Ultra-thin sections of pollen wall in ospks1-3; K: Ultra-thin sections of Ubisch body in the wild type; L: Ultra-thin sections of Ubisch body in ospks1-3. Ex: Exine; DEx: Deformed exine; Ne: Nexine; Ub: Ubisch body; Ba: Bacula; Te: Tectum. Bars: 20 μm (A, E); 10 μm (B, F); 1 μm (C, D, G, H); 0.5 μm (I-L)
透射电镜结果显示,在花粉发育10期,野生型(图4-I)形成规则的两层花粉外壁结构,圆锥形物质在顶盖上呈规律的间隔分布,虽然ospks1-3突变体(图4-J)也能形成两层的花粉外壁结构,但是花粉外壁内部可见大量微小的空洞,结构更为松散,柱状体变短,无法有效连接覆盖层和花粉外壁内层。这与ospks2花粉外壁增厚,孢粉素颗粒变大的表型不尽相同[29]。野生型乌式体在花药内壁上呈现均匀分布(图4-K),而ospks1-3突变体乌式体(图4-L)下部中部无染色的部分高度减小,而上层染色的部分更厚,并可见更多数目的尖锐突起,甚至有些乌式体缺乏下部结构,只有更厚的上层结构。这与ospks2乌氏体的下层结构高度增加,上层结构突起更圆润的表型正好相反[29]。以上结果暗示OsPKS1影响花粉外壁和乌式体正常结构的形成,这可能影响孢粉素在花粉表面的堆积,从而影响花粉的发育,并且OsPKS1与OsPKS2的功能存在差异。
2.5 扫描电镜及透射电镜观察ospks1-4 ospks2花药内外壁和花粉外壁精细结构
为进一步研究ospks1-4 ospks2突变体花粉发育缺陷,同样对13期野生型和突变体的花药和花粉利用扫描电镜进行观察。和半薄切片结果一致(图3-O),13期ospks1-4 ospks2突变体花药腔内无小孢子。野生型在花药发育13期形成正常的泡面状纵横交错的花药外壁(图5-A)以及分布均匀的乌式体(图5-B),而ospks1-4 ospks2突变体(图5-C)的花药外壁形态异常,与野生型相比表面较为光滑,纹路变少,并且在花药内壁无法形成乌式体(图5-D)。以上结果说明OsPKS1和OsPKS2功能保守,共同调控水稻花药外壁和乌式体的发育。图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5野生型和ospks1-4 ospks2突变体花粉及花药的扫描电镜分析
A:野生型花药外壁;B:野生型花药内壁;C:ospks1-4 ospks2突变体花药外壁;D:ospks1-4 ospks2突变体花药内壁。Ub:乌式体。Bars:10 μm(A、C);1 μm(B、D)
Fig. 5SEM observation for anther and pollen in the wild type and ospks1-4 ospks2
A: Anther epidermis of the wild type; B: The inner surface of the wild type; C: Anther epidermis of ospks1-4 ospks2; D: The inner surface of ospks1-4 ospks2. Ub: Ubisch body. Bars: 10 μm (A, C), 1 μm (B, D)
为了进一步研究ospks1-4 ospks2突变体花粉外壁和乌式体形成缺陷,利用透射电镜观察9—11期野生型和突变体花药的精细结构。在花药发育9期,野生型(图6-A)小孢子表面形成外壁内层和柱状体结构,且它的乌式体(图6-G)形态呈圆形透明状,但是ospks1-4 ospks2(图6-D)花粉外壁内层结构异常,柱状体前体变小,且ospks1-4 ospks2中乌式体(图6-J)形态异常并形成较多顶部物质;在花药发育10期,野生型(图6-B)形成典型的由外壁内层和外壁外层构成的花粉外壁结构,绒毡层表面(图6-H),乌式体呈底部透明近似圆状,顶部被染色较深,但是ospks1-4 ospks2(图6-E)在这个时期无法观察到明显的花粉外壁,孢粉素无法在小孢子表面进行堆积,且ospks1-4 ospks2(图6-K)乌式体形态异常,未黏附在绒毡层上;在花药发育11期,野生型(图6-C)呈现出典型的两层花粉外壁结构,野生型(图6-I)绒毡层表面,乌式体与10期形态相似(图6-H),但是ospks1-4 ospks2(图6-F)在这个时期无法观察到花粉外壁,并且小孢子细胞膜断裂(如白色箭头指示),这与横断面表型分析结果小孢子被降解一致(图3-N),这个时期ospks1-4 ospks2中的(图6-L)乌式体形态异常并且皱缩,且从绒毡层上脱离。综合上述结果和之前研究表明ospks1-4 ospks2最终无法形成乌式体和花粉外壁,而ospks1-3(图4-J,图4-L)和ospks2[29]单突变形成异常的花粉外壁和乌式体。
图6
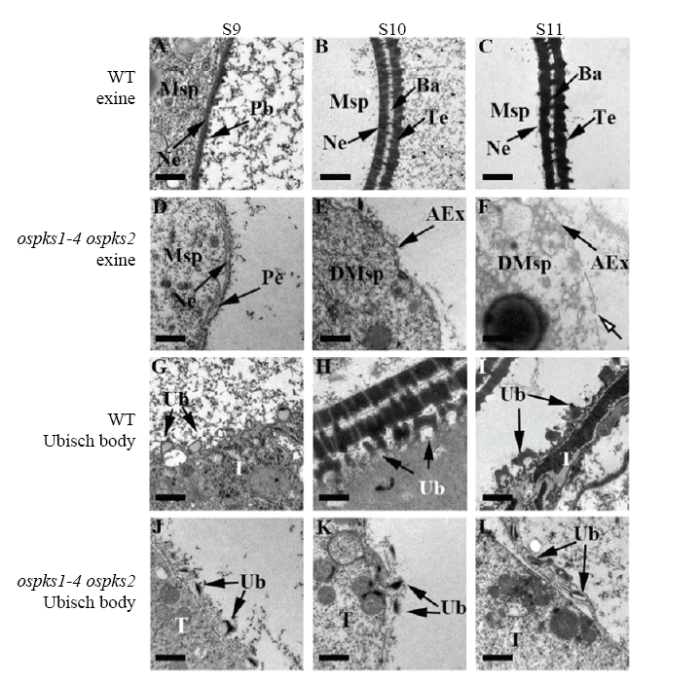 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6野生型和ospks1-4 ospks2花药透射电镜分析
A—C:野生型9—11期花粉外壁;D—F:ospks1-4 ospks2突变体9—11期花粉外壁;G—I:野生型9—11期乌式体;J—L:ospks1-4 ospks2突变体9—11期乌式体。Msp:小孢子;DMsp:退化的小孢子;AEx:异常的花粉外壁;Ne:外壁内层;Ub:乌式体;T:绒毡层;Ba:柱状体;Te:覆盖层;Pb:柱状体前体;Pe:外壁外层前体。Bars:0.5 μm
Fig. 6Transmission electron microscopy analysis of anthers in the wild type and ospks1- 4 ospks2
A-C: Pollen wall of the wild type from stage 9 to stage 11; D-F: Pollen wall of ospks1-4 ospks2 from stage 9 to stage 11; G-I: Ubisch body in the wild type from stage 9 to stage 11; J-L: Ubisch body in ospks1-4 ospks2 from stage 9 to stage 11. Msp: Microspore; DMsp: Degenerated microspore; AEx: Abnormal exine; Ne: Nexine; Ub: Ubisch body; T: Tapetum; Ba: Bacula; Te: Tectum; Pb: Probacula; Pe: Prim-exine. Bars: 0.5 μm
3 讨论
3.1 PKSs对水稻育性的影响
孢粉素作为花粉表面的主要成分,其正常的合成和堆积方式对于花粉活力,花粉育性以及物种识别都是至关重要的,孢粉素主要由脂 肪酸及其衍生物和酚类物质及其衍生物组成,因此,这两大类物质的体内合成途径对于孢粉素合成是至关重要的[24]。其中脂肪酸及其衍生物因易于测定以及获得了较多数目的合成酶编码基因,其合成途径已被研究得较为深入,然而对于酚类衍生物合成途径的研究还主要依赖于少数已知的酶的遗传学和体外的生化功能研究。目前,在拟南芥、水稻、烟草等多个物种中均鉴定了一条保守的生化途径,参与合成由羰基连接长链脂肪酸链和苯环的酚类物衍生物——α-吡喃酮[20,21,22,23,24]。本研究从水稻花药发育网络AntherNet[37]预测到一个参与孢粉素合成的关键基因OsPKS1,它和水稻中另一个PKS成员基因OsPKS2,编码的蛋白结构类似,具有相同的体外催化活性[24,29],本研究结果(图3-J)及前人研究[29-30,32]显示,水稻的ospks1和ospks2花粉外壁异常,无法正常形成花粉。本研究通过对ospks1-4 ospks2的半薄切片观察显示,双突变体无法形成花粉外壁,小孢子在11期即被降解(图3-O)。拟南芥的pks1/pksa/lap6和pks2/pksb/lap5花粉外壁异常,但均可形成可育花粉,双突变体几乎无花粉外壁堆积并且雄性不育[27]。而水稻的ospks1和ospks2单突变体均呈现雄性不育,说明OsPKS1和OsPKS2对于水稻花粉育性是更必要的,可能由于水稻的花粉外壁形态对其花粉育性较拟南芥具有更重要的作用,因此PKSs对水稻花药育性的影响较拟南芥更为强烈。3.2 PKSs在水稻和拟南芥中的保守性和差异性
在孢粉素合成过程中,脂肪酸经ACOS合成脂肪酰辅酶A,而后在PKSs聚酮合酶作用下合成聚酮化合物,随后在黄酮醇还原酶TKPRs作用下将羰基还原成羟基[24,27,29]。说明PKSs具有保守的酶活性。用拟南芥PKS1/PKSA/LAP6和PKS2/PKSB/LAP5启动水稻OsPKS1/OsLAP6和OsPKS2/OsLAP5序列可以基本恢复pks1/pksa/lap6和pks2/pksb/lap5的花粉外壁缺陷[29,30]。进一步说明PKSs在水稻和拟南芥中功能保守。在拟南芥中,pks1/pksa/lap6和pks2/pksb/lap5都会影响拟南芥花粉外壁的结构,代谢组学数据显示两者花药的代谢物含量与野生型相比差异较微弱,而双突变体则完全无法形成花粉外壁,花药代谢物大大下降,暗示两者可能功能互补,共同参与花粉外壁发育[27,31]。拟南芥pks2/pksb/lap5突变体缺乏网状结构,影响了覆盖层的形成;pks1/pksa/lap6突变体网状结构空隙减小,可能是下部的柱状体受到影响[27,31]。而在水稻中,ospks2覆盖层异常更为显著;而与前人的报道一致,ospks1-3花粉外壁的柱状体变短(图4-J),以上结果说明ospks1、ospks2的表型与pks1/pksa/lap6、pks2/pksb/lap5的表型相对比较保守,都是部分地影响了花粉外壁的结构,并且两者影响的结构互有差异,暗示OsPKS1和OsPKS2对花粉外壁花纹的调控作用略有差异,这与拟南芥的PKS1/PKSA/LAP6和PKS2/PKSB/LAP5功能保守。另外,通过扫描电镜和透射电镜均发现,ospks1-3的花粉外壁内部出现细小空洞(图4-J,图4-G),说明OsPKS1亦调节花粉外壁的内部结构,这在前人的研究中均未有报道[30,32]。另一方面,对水稻ospks1-3突变体乌式体的观察结果(图4-L)和前人的研究[29-30,32]表明,OsPKS1和OsPKS2都会影响乌式体的正常发育,ospks2的乌式体底部结构增大,表面的突起更为圆润,而ospks1-3的乌式体底部结构减小,表面的突起更为尖锐,暗示两者在调节乌式体形态上功能并不互补,更趋向于呈现相反的功能。而ospks1-4 ospks2双突变体(图6-J—图6-L)乌式体的底部结构和顶部结构都大大减小,乌式体形态异常明显,进一步支持OsPKS1和OsPKS2两者差异地调控乌式体的形态发育。本研究利用乌式体这一拟南芥没有的结构,更进一步阐释了OsPKS1和OsPKS2在控制孢粉素合成和沉积的功能差异。根据以上结果可以推测OsPKS1和OsPKS2共同参与到花粉外壁和乌式体的形成,但是两者的功能既保守又有差异。虽然这两个基因生化功能保守,其功能差异可能是因为两者对底物具有不同的偏好性。根据以上结果得出OsPKS1和OsPKS2在花药外壁和花粉外壁发育过程中作用的可能模式图(图7),OsPKS1和OsPKS2催化经由OsACOS12催化产生的底物脂肪酰辅酶形成带有不同类型的聚酮化合物,不同类型的聚酮化合物分别参与乌氏体和花粉外壁不同结构的形成,而聚酮化合物也参与花药外壁的发育。
图7
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图7OsPKS1和OsPKS2在花药外壁和花粉外壁发育过程中的作用
Polyketide:聚酮化合物;Cutin Monomers:角质单体;Sporopollenin Precursor:孢粉素前体;Anther Cuticle:花药角质层;Pollen wall:花粉外壁。OsACOS12催化不同的脂肪酸形成脂肪酰辅酶A,形成的脂肪酰辅酶A继续被OsPKS1或OsPKS2催化形成不同类型的聚酮化合物,不同类型的聚酮化合物分别参与角质单体和孢粉素前体的形成,继而参与乌氏体和花粉外壁不同结构的形成,聚酮化合物也参与花药角质层的发育
Fig. 7The proposed roles of OsPKS1 and OsPKS2 in anther cuticle and pollen wall development
OsACOS12 catalyzes diverse fatty acids to produce fatty acyl coenzyme A which is then condensed by OsPKS1 or OsPKS2 to form different types of polyketide. Different types of polyketide involved in the formation of cutin monomers and sporopollenin precursor are required for the different structures in Ubisch body and pollen wall formation and also participate in the development of anther cuticle
3.3 OsPKS1和OsPKS2对绒毡层程序化死亡的影响
很多研究显示脂类合成和修饰相关基因的缺失都会影响绒毡层的正常降解,比如缺失水稻中脂类相关基因OsGPAT3(Glycerol-3-phosphate Acyltransferase3)[38]、CYP704B2[12]、DPW[16]、OsNP1[19]以及OsACOS12[21]都会影响绒毡层降解。本研究观察到ospks1-4 ospks2绒毡层异常膨大不能正常降解的现象,而在ospks1-3(图4-F—图4-J)和ospks2[29]中绒毡层降解未见异常。osacos12绒毡层也异常膨大,最终花药腔的物质几乎完全被降解,但是osacos12缺陷更为严重,它无法形成花药外壁表面的花纹以及完成无法形成乌式体[21]。这从遗传学角度为OsACOS12、OsPKS1和OsPKS2参与同一代谢途径提供了证据,并可以推测OsACOS12可能通过其他基因参与花药外壁形成及乌式体形成。根据双突变体绒毡层异常而单突变体绒毡层降解正常的结果,以及ospks1和ospks2的乌式体和花粉外壁表型差异的结果推测,OsPKS1和OsPKS2可能催化类经由OsACOS12催化产生的底物脂肪酰辅酶A,但是两者可能对于不同类型的脂肪酰辅酶A偏好性略有差异。OsPKS1和OsPKS2两者协同作用,极大程度地催化了脂肪酰辅酶A,形成聚酮化合物。而脂肪酰辅酶A的过度积累或者聚酮化合物的降低,影响了绒毡层细胞内的脂类物质和/或酚类物质代谢,影响绒毡层降解。
对于OsPKS1和OsPKS2如何共同参与到乌式体形成和绒毡层降解需要进一步的试验研究,后续可以通过ospks1-4 ospks2、osacos12、ospks1-3和ospks2的代谢产物分析进行进一步研究。
4 结论
OsPKS1和OsPKS2均参与花粉外壁和花药外壁的发育,两者具有保守的生化功能但两者功能存在差异。OsPKS1对柱状体和乌氏体的底部结构影响更大,而OsPKS2对覆盖层和乌氏体的顶部结构影响更大;OsPKS1影响花粉外壁内部结构的组装,目前尚未发现OsPKS2的此功能。这可能是由于两者存在不同的底物偏好性,而其产物的差别决定了其生物学功能的差异。OsPKS1和OsPKS2两者共同调控花药外壁和绒毡层降解。致谢:李焕军给予超薄切片实验技术的指导;陈明姣师傅和陈晓菲给予愈伤组织培养以及水稻材料的种植的指导。在此表示感谢!
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
DOI:10.1104/pp.110.158865URL [本文引用: 1]
DOI:10.1146/annurev-arplant-042809-112312URL [本文引用: 1]
DOI:10.1111/plb.2013.15.issue-2URL [本文引用: 1]
DOI:10.1111/nph.2007.174.issue-3URL [本文引用: 1]
DOI:10.1105/tpc.017012URL [本文引用: 2]
DOI:10.1016/j.tplants.2015.07.010URL [本文引用: 1]
DOI:10.1105/tpc.5.10.1217URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1105/tpc.109.070326URL [本文引用: 2]
DOI:10.1111/jipb.v56.10URL [本文引用: 1]
[本文引用: 1]
DOI:10.1105/tpc.106.045948URL [本文引用: 1]
DOI:10.1105/tpc.111.087528URL [本文引用: 2]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/tpj.2017.91.issue-2URL [本文引用: 2]
DOI:10.1111/febs.2014.281.issue-17URL [本文引用: 3]
[本文引用: 6]
[本文引用: 3]
DOI:10.1007/s00425-017-2691-yURL [本文引用: 3]
DOI:10.1111/ppl.2013.149.issue-1URL [本文引用: 7]
[本文引用: 3]
[本文引用: 3]
[本文引用: 8]
[本文引用: 2]
DOI:10.1111/jipb.12574URL [本文引用: 15]
[本文引用: 8]
[本文引用: 4]
DOI:10.1186/s12284-017-0191-0URL [本文引用: 6]
DOI:10.1073/pnas.1420294112URL [本文引用: 2]
DOI:10.1105/tpc.106.044107URL [本文引用: 2]
DOI:10.1007/s11434-009-0348-3URL [本文引用: 1]
DOI:10.1016/j.jgg.2011.08.001URL [本文引用: 1]
DOI:10.1111/tpj.13744URL [本文引用: 2]
[本文引用: 1]
