Flavor Variation of Flammulina velutipes in Polyethylene Film Packaging During the Cold Storage
MA Ning1, WANG ChaoFan1, FANG DongLu2, DING MengTing1, YAO JiaLei1, YANG WenJian1, HU QiuHui1收稿日期:2018-10-18接受日期:2019-01-22网络出版日期:2019-04-16
| 基金资助: |
Received:2018-10-18Accepted:2019-01-22Online:2019-04-16
作者简介 About authors
马宁,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (687KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
马宁, 王超璠, 方东路, 丁梦婷, 姚嘉蕾, 杨文建, 胡秋辉. 聚乙烯膜包装金针菇冷藏期间的风味变化规律[J]. 中国农业科学, 2019, 52(8): 1435-1448 doi:10.3864/j.issn.0578-1752.2019.08.013
MA Ning, WANG ChaoFan, FANG DongLu, DING MengTing, YAO JiaLei, YANG WenJian, HU QiuHui.
0 引言
【研究意义】金针菇(Flammulina velutipes (Fr) Sing.)学名毛柄金钱菌,是一种大型食用真菌,富含维生素、必需氨基酸等营养物质[1]。金针菇不仅具有较高的营养价值,而且风味独特,深受消费者的喜爱。金针菇的风味物质主要是由含有8个碳的化合物及其衍生物以及醇、酮、醛等挥发性风味成分[2]和可溶性糖、呈味核苷酸、游离氨基酸等非挥发性风味成分[3]组成。但是,新鲜采收的金针菇在储运销售过程中极易失水,菇体后生长及遭受微生物侵袭,影响了金针菇的食用和风味品质。实际生产流通过程中,常用的保鲜方式是冷藏结合聚乙烯包装。在聚乙烯包装条件下,由于金针菇强烈的呼吸作用,使得包装内金针菇子实体极易出现缺氧状态,从而发酵酸败。然而,对于这种低温和低氧环境下诱导的金针菇风味品质劣变还缺乏系统研究和数据支撑。因此,本研究模拟实际物流贮藏条件,动态监测金针菇在低温和聚乙烯包装过程中风味成分的变化规律,对采取相应措施促进金针菇品质的控制和风味的保持具有重要意义。【前人研究进展】在金针菇保鲜方面,目前的研究大部分集中于金针菇贮藏品质指标和保鲜方法的研究。例如,孙亚男等[4]研究不同透性保鲜膜对金针菇保鲜效果的影响,确定中通透性保鲜膜(潘多拉PE保鲜膜)对金针菇的保鲜效果最佳。杨福馨等[5]研究不同包装材料对常温下金针菇的保鲜效果,以金针菇失重率和相关理化指标以及感官评定来研究贮藏期间金针菇新鲜度的变化,结果表明NSPE海纳保鲜膜(一种改性聚乙烯保鲜膜)的保鲜效果最佳。曾晓丹等[6]研究聚乙烯(C)、改性聚乙烯(M)、聚乳酸(P)保鲜膜对金针菇采后常温贮藏品质的影响,以此确定M保鲜膜对金针菇的常温保鲜效果最佳。在食用菌贮藏期间风味品质的研究方面,目前的研究多集中于对食用菌挥发性风味成分的研究。例如,阎瑞香等[7]对塑料箱式气调和塑料袋自发气调贮藏后期的香菇中的香气成分进行了分析鉴定,通过GC-MS分析能够客观反映不同贮藏方式的香菇成熟后期的主要特征香气,从而评价香菇的品质。李文等[8]分析不同生长阶段香菇子实体风味成分对香菇风味的影响,明确了影响香菇风味的关键风味物质、特征性风味物质的种类,解析了香菇生长阶段与香菇风味成分之间的关系。FANG等[2]通过SPME/GC-MS、电子鼻、电子舌、全自动氨基酸分析仪对纳米包装和普通聚乙烯包装金针菇在贮藏过程中挥发性风味成分、非挥发性成分进行测定,得出纳米包装能更好地维持金针菇原有的风味。【本研究切入点】模拟金针菇采后运输销售贮藏环境,解析金针菇的风味变化规律。目前,对于金针菇的研究多是不同包装金针菇采后贮藏品质的变化,而对聚乙烯膜包装金针菇贮藏过程中风味成分变化规律的研究有待加强。【拟解决的关键问题】研究聚乙烯膜包装金针菇贮藏过程中风味成分的变化规律,为金针菇贮藏保鲜提供理论依据。1 材料与方法
试验于2017年11月至2018年5月在南京财经大学食品科学与工程学院进行。1.1 试验材料
新鲜金针菇从如意情生物科技有限公司采购,1 h内低温运输抵达实验室。迅速挑选未开伞、菇体完整、无机械伤或病虫害、菇柄长在10—15 cm的金针菇,放入温度(4±1)℃、相对湿度(RH)(90±5)%的恒温恒湿箱中预冷12 h后进行包装处理。利用厚度为40 μm的聚乙烯膜,剪切制备25 cm×25 cm规格的包装袋。利用紫外杀菌后的聚乙烯膜对新鲜金针菇进行包装,随机挑选、称取200 g金针菇放入包装袋内并用热封口机进行密封,样品置于恒温恒湿箱(温度(4±1)℃,RH(90±5)%)中贮藏15 d,每隔3 d进行取样测定,每个处理组3个平行样品。1.2 仪器与试剂
GC(7890A)-MS(5975C)气质联用分析仪,美国安捷伦公司;50/30 μm DVB/CAR/PDMS固相萃取头,美国Supelco公司;FOX3000型电子鼻,法国Alpha MOS公司;Agilent1200高效液相色谱仪,美国Agilent公司;Alltech3300型蒸发光散射检测器,美国Agilent公司;ASTREEⅡ型电子舌,法国Alpha MOS公司;L-8900型全自动氨基酸分析仪,日本Hitaohi公司;AL104电子天平,Mettler Toledo上海有限公司;HH-2型数显恒温水浴锅,江苏国华电器有限公司;KQ-500E型数控超声波清洗器,昆山市超声仪器有限公司;Hei- VAP型旋转蒸发仪,德祥科技有限公司;DELTA320型pH计,Mettler Toledo公司;DL-I-15型电磁炉,天津市泰斯特仪器有限公司。正构烷烃(C7—C30)混标购于美国Sigma公司;果糖、海藻糖、甘露醇、酒石酸、富马酸、苹果酸、柠檬酸、冰乙酸、琥珀酸、5′-AMP、5′-CMP、5′-GMP、5′-IMP、5′-UMP均购于上海源叶生物科技有限公司;冰乙酸(色谱纯)、四丁基氢氧化铵、乙腈(色谱纯)、甲醇(色谱纯)、磷酸二氢钠均购于国药集团化学试剂有限公司。
1.3 试验方法
1.3.1 挥发性风味成分的测定 参考LAURIENZO等[9]的方法,精确称取2.0 g金针菇样品置于20 mL顶空瓶内,萃取头在250℃活化30 min后,置于60℃水浴锅内吸附40 min,将萃取头插至进样口,解离分析挥发性物质。色谱条件:DB-5MS毛细管色谱柱(30 m×250 μm,φ0.25 μm);升温程序条件设置为初始温度40℃,保持3 min,以5℃·min-1的速度升到150℃,保持3 min,再以10℃·min-1的速度升至230℃,保持2 min;载气为氦气,流速为0.8 mL·min-1,分流比为1﹕1。质谱条件:电离方式为电子轰击离子源(electron ionization,EI),离子源温度为230℃,四极杆温度为150℃,接口温度为250℃,电子能量为70 eV;质量扫描范围25—450 U。取正构烷烃混标(C7—C30)标准品按照上述实验条件分析,记录每个正构烷烃的保留时间,采用保留指数的线性升温公式:
RI=100n+100[(tx-tn)/(tn +1-tn)]
计算各挥发性组分的RI值,其中tx、tn和tn+1(tn<tx<tn+1)分别为被分析组分和碳原子处于n和n+1之间的正构烷烃的保留时间(min)。
参考YANG等[10]的方法,精确称取2.0 g金针菇样品放置于20 mL顶空瓶内,样品测量流速为150 mL·min-1,检测时间为120 s。该电子鼻装有12个不同的气体传感器:LY2/LG、LY2/G、LY2/AA、LY2/GH、LY2/gCTL、LY2/gCT、T30/1、P10/1、P10/2、P40/1、T70/2和PA/2,通过传感器阵列响应和模式识别技术对挥发性气体分子进行分析。
1.3.2 非挥发性风味成分的测定 可溶性糖(醇)的测定:参考TSAI等[11]的方法,精确称取5.0 g金针菇样品,加入80 mL体积分数50%的乙醇溶液,在50℃下水浴30 min,5 000 r/min离心15 min,倾出上清液,残渣用相同的方法再提取1次,合并上清液,转于旋转蒸发仪中浓缩蒸干,然后加入体积分数50%的乙腈溶液溶解,0.45 μm滤膜过滤后,取滤液待用。色谱条件:色谱柱Sugar-D(250 mm×4.6 mm,5 μm);柱温25℃;流速1.0 mL·min-1;流动相为V(水):V(乙腈)=25﹕75;进样量20 μL,检测器采用蒸发光散射检测器(ELSD),氮气流速2.5 L·min-1,漂移管温度为50℃。
呈味核苷酸的测定:参考TAYLOR等[12]的方法,精确称取5.0 g金针菇样品,加入20 mL超纯水,煮沸1 min,冷却,5 000 r/min离心15 min,残渣用相同的方法再提取1次,合并上清液旋转浓缩定容,经0.45 μm滤膜过滤后待测。色谱条件:色谱柱Zorbax-Eclipse XDB-C18(250 mm×4.6 mm,5 μm),流动相为V(水)﹕V(甲醇)﹕V(冰乙酸)﹕V(四丁基氢氧化铵)=893.5﹕100﹕6﹕0.5,流速0.5 mL·min-1,柱温25℃。采用紫外检测器,检测波长254 nm。
有机酸的测定:参考LI等[13]的方法,精确称取5.0 g金针菇样品,加入10 mL 0.01 mol·L-1的KH2PO4(pH =2.6),于45℃下超声30 min,5 000 r/min离心15 min,定容,经0.45 μm滤膜过滤后待测。色谱条件:色谱柱Zorbax-Eclipse XDB-C18(250 mm×4.6 mm,5 μm),流动相为V(KH2PO4的水溶液,pH 2.6,0.01 mol·L-1):V(甲醇)=95﹕5,柱温25℃,流速0.5 mL·min-1,进样量20 μL。检测器采用紫外检测器,检测波长210 nm。
参考BURATTI等[14]的方法,利用ASTREEⅡ型电子舌味觉传感系统对金针菇样品的非挥发性风味物质进行分析。准确称取5.0 g金针菇样品,加入100 mL去离子水研磨,6 000×g离心15 min,取上清液作为待测样品。电子舌经过活化和校准以后对待测样品进行检测,利用电子舌自带的数据处理软件对味觉数据进行采集分析。
游离氨基酸的测定:参考LIU等[15]的方法,准确称取0.2 g金针菇样品于水解管中,加入6 mol·L-1 HCl(20 mL)倒满整瓶,盖上保鲜膜,密封胶密封水解管,放入烘箱110℃下水解24 h。取出样品,滤纸过滤,定容至50 mL(6 mol·L-1 HCl)。取3 mL旋转蒸干,加入30 mL 0.02 mol·L-1 HCl,经0.22 μm滤膜过滤后待测。
1.4 数据处理
采用IBM SPSS Stastics 23软件对GC-MS数据进行聚类分析,采用Microsoft Office Excel 2010统计分析软件进行数据处理、分析与作图,采用JMP13(SW)分析软件进行差异显著性分析,差异显著性采用Student t检验法,显著差异选用P<0.05,每组试验重复3次,所得结果以平均值±标准差的形式表示。利用Origin 2018作雷达图。2 结果
2.1 挥发性风味物质
2.1.1 GC-MS检测结果 如表1所示,贮藏期间共鉴定出47种挥发性化合物,包括13种醛类,4种酮类,11种醇类,6种酯类,5种烃类化合物,8种其他化合物。新鲜的金针菇鉴定出了12种醛类和8种醇类,贮藏3 d的金针菇鉴定出7种醛类和8种醇类,贮藏6 d的金针菇鉴定出8种醛类和9种醇类,贮藏9 d的金针菇鉴定出8种醛类和7种醇类,贮藏12 d的金针菇鉴定出7种醛类和7种醇类,贮藏15 d的金针菇鉴定出10种醛类和8种醇类。在醛类中,反式-2-庚烯醛所占的比例最高,占醛类的25.8%。其次是辛醛和反式-2-辛烯醛,分别占13.4%和16.3%。从表中可以发现金针菇挥发性风味成分主要以含8个碳原子的不饱和醇、醛、酮、芳香醇等关键风味物质组成,在金针菇中共测出10种(青草味的己醛、杏仁味的苯甲醛、花香味的辛醛和苯乙醛、熟蘑菇味的反式-2-壬烯醛和3-辛酮、清香味的正己醇和1,2-二乙基己醇、果香味的正辛醇、蘑菇味的1-辛烯-3-醇),它们共同构成了金针菇的特殊香味。反式-2-壬烯醛在新鲜蘑菇中存在,在之后的贮藏过程中并没有检测出。1-辛烯-3-醇、3-辛酮的含量在贮藏过程中分别呈先下降后上升、先上升后下降的趋势,1-辛烯-3醇的含量在贮藏9 d时降至最低值,3-辛酮的含量在贮藏9 d后就没有检测出。Table 1
表1
表1聚乙烯膜包装金针菇贮藏过程中挥发性成分的相对含量
Table 1
| 分子式 Molecular formula | 保留时间 Retention time | RI | RI* | 化合物 Compound | 相对含量 Relative content | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 0 d | 3 d | 6 d | 9 d | 12 d | 15 d | |||||
| 醛类 Aldehydes (13) | 0.352 | 0.240 | 0.232 | 0.344 | 0.307 | 0.369 | ||||
| C6H12O | 6.358 | 803 | 己醛 Hexanal | 0.019 | 0.107 | 0.075 | 0.124 | 0.163 | 0.160 | |
| C7H12O | 11.438 | 953 | 956 | 反式-2-庚烯醛 2-Heptenal, (E)- | 0.091 | 0.027 | 0.022 | 0.019 | 0.027 | 0.036 |
| C7H6O | 11.600 | 962 | 961 | 苯甲醛 Benzaldehyde | 0.018 | 0.016 | 0.012 | 0.016 | 0.014 | 0.019 |
| C8H16O | 13.003 | 1005 | 1004 | 辛醛 Octanal | 0.047 | - | 0.023 | 0.027 | 0.017 | 0.019 |
| C7H10O | 13.249 | 1012 | 1011 | 反式-2,4-庚二烯醛 2,4-Heptadienal, (E,E)- | 0.039 | 0.008 | 0.009 | 0.014 | 0.011 | 0.015 |
| C8H8O | 14.327 | 1041 | 1045 | 苯乙醛 Benzeneacetaldehyde | - | - | - | - | - | 0.023 |
| C8H14O | 14.784 | 1063 | 1059 | 反式-2-辛烯醛 2-Octenal, (E)- | 0.057 | 0.018 | 0.016 | 0.013 | 0.016 | 0.020 |
| C9H18O | 16.271 | 1098 | 1105 | 壬醛 Nonanal | 0.019 | 0.052 | 0.060 | 0.119 | 0.059 | 0.064 |
| C9H16O | 17.969 | 1168 | 1161 | 反式-2-壬烯醛 2-Nonenal, (E)- | 0.011 | - | - | - | - | - |
| C9H10O | 18.087 | 1168 | 1165 | 3-乙基苯甲醛 Benzaldehyde, 3-ethyl- | 0.014 | - | - | - | - | - |
| C10H20O | 19.357 | 1223 | 1207 | 癸醛 Decanal | 0.012 | 0.012 | 0.015 | 0.012 | - | 0.008 |
| C9H14O | 19.643 | 1224 | 1217 | 反,反-2,4-壬二烯醛2,4-Nonadienal, (E,E)- | 0.011 | - | - | - | - | - |
| C10H16O | 22.557 | 1320 | 1313 | 反,反-2,4-癸二烯醛 2,4-Decadienal, (E,E)- | 0.014 | - | - | - | - | 0.005 |
| 酮类 Ketones (4) | 0.038 | 0.133 | 0.125 | 0.039 | 0.040 | 0.044 | ||||
| C7H14O | 9.164 | 885 | 886 | 2-庚酮 2-Heptanone | 0.006 | 0.010 | - | - | - | - |
| C8H16O | 12.393 | 988 | 985 | 3-辛酮 3-Octanone | 0.013 | 0.064 | 0.067 | - | - | - |
| C11H22O | 21.823 | 1290 | 1293 | 2-十一烷酮 2-Undecanone | 0.005 | 0.041 | 0.038 | 0.031 | 0.031 | 0.035 |
| C13H22O | 26.012 | 1435 | 1444 | 5,9-十一碳二烯-2-酮,6,10-二甲基 5,9-Undecadien-2-one, 6,10-dimethyl-, (E)- | 0.014 | 0.018 | 0.020 | 0.008 | 0.009 | 0.009 |
| 续表1 Continued table 1 | ||||||||||
| 分子式 Molecular formula | 保留时间 Retention time | RI | RI* | 化合物 Compound | 相对含量 Relative content | |||||
| 0 d | 3 d | 6 d | 9 d | 12 d | 15 d | |||||
| 醇类 Alcohols (11) | 0.458 | 0.444 | 0.425 | 0.344 | 0.337 | 0.367 | ||||
| C5H12O | 5.438 | 764 | l-正戊醇 1-Pentanol | 0.006 | 0.049 | 0.026 | 0.007 | 0.030 | 0.018 | |
| C4H10O2 | 5.846 | 2,3-丁二醇 2,3-Butanediol | - | 0.003 | 0.004 | 0.001 | 0.018 | 0.007 | ||
| C6H14O | 8.514 | 870 | 866 | 正己醇 Hexanol | 0.023 | 0.226 | 0.183 | 0.085 | 0.164 | 0.195 |
| C7H14O | 11.782 | 966 | 反式-2-庚烯-1-醇 2-Hepten-1-ol, (E)- | 0.027 | - | - | - | - | - | |
| C7H16O | 11.871 | 969 | 969 | 正庚醇 1-Heptanol | - | 0.018 | 0.017 | - | 0.014 | 0.013 |
| C8H16O | 12.210 | 992 | 979 | 1-辛烯-3-醇 1-Octen-3-ol | 0.028 | 0.015 | 0.014 | 0.011 | 0.021 | 0.025 |
| C8H18O | 13.800 | 1029 | 1028 | 1,2-二乙基己醇 Hexanol, 1,2-ethyl- | 0.012 | 0.016 | 0.013 | 0.008 | - | 0.005 |
| C8H18O | 15.174 | 1070 | 1071 | 正辛醇 1-Octanol | 0.154 | 0.052 | 0.067 | 0.097 | 0.043 | 0.046 |
| C9H18O | 17.753 | 1156 | 1154 | 顺-3-壬烯-1-醇 3-Nonen-1-ol, (Z)- | - | - | 0.011 | - | - | - |
| C9H20O | 18.299 | 1173 | 1172 | l-正壬醇 1-Nonanol | 0.195 | 0.065 | 0.090 | 0.135 | 0.047 | 0.058 |
| C10H22O | 21.233 | 1275 | 1273 | 正癸醇 1-Decanol | 0.013 | - | - | - | - | - |
| 酯类 Esters (6) | 0.039 | 0.044 | 0.029 | 0.013 | 0.003 | 0.022 | ||||
| C7H12O2 | 9.897 | 989 | 989 | 顺式2-戊烯醇乙酸酯 (Z)-pent-2-en-1-yl acetate | 0.004 | - | - | - | - | - |
| C7H14O2 | 9.981 | 912 | 912 | 乙酸戊酯 Acetic acid, pentyl ester | 0.035 | 0.008 | 0.008 | 0.009 | - | 0.009 |
| C8H14O2 | 13.017 | 1004 | 丙酸2-戊烯-1-酯 Propanoic acid, 2-penten-1-yl ester (Z)- | - | 0.032 | - | - | - | - | |
| C16H22O4 | 34.905 | 1868 | 1862 | 邻苯二甲酸二异丁酯 Phthalic acid, butyl isohexyl ester | - | 0.004 | 0.015 | - | 0.003 | 0.007 |
| C16H22O4 | 36.067 | 1954 | 1955 | 邻苯二甲酸二丁酯 Dibutyl phthalate | - | - | 0.007 | - | - | - |
| C18H36O2 | 36.510 | 1997 | 1993 | 十六烷酸乙酯 Hexadecanoic acid, ethyl ester | - | - | - | 0.004 | - | 0.006 |
| 烃类 Hydrocarbons (5) | 0.024 | 0.057 | 0.039 | 0.032 | 0.039 | 0.023 | ||||
| C10H16 | 13.854 | 1026 | 1031 | D-柠檬烯 D-Limonene | 0.011 | 0.026 | 0.014 | 0.007 | 0.024 | 0.004 |
| C14H30 | 24.732 | 1400 | 1401 | 十四烷 Tetradecane | 0.006 | 0.006 | 0.005 | 0.006 | - | 0.004 |
| C16H34 | 30.579 | 1600 | 1601 | 十六烷 Hexadecane | 0.007 | 0.010 | 0.009 | 0.007 | 0.008 | 0.011 |
| C17H36 | 32.548 | 1700 | 1701 | 十七烷 Heptadecane | - | 0.009 | 0.005 | 0.008 | 0.007 | - |
| C18H38 | 34.103 | 1800 | 1801 | 十八烷 Octadecane | - | 0.006 | 0.006 | 0.004 | - | 0.004 |
| 其他化合物 Other compounds (8) | 0.092 | 0.084 | 0.151 | 0.229 | 0.266 | 0.179 | ||||
| C6H12O | 5.005 | 2-甲基,异丙基环氧乙烷 Oxirane,2-methyl, isopropyl | 0.004 | 0.027 | 0.006 | 0.032 | 0.050 | 0.034 | ||
| C9H14O | 12.545 | 993 | 990 | 2-正戊基呋喃 Furan, 2-pentyl | 0.076 | - | 0.044 | 0.034 | 0.041 | 0.035 |
| C10H14 | 13.702 | 1023 | 1025 | 1-甲基-4-异丙基苯 Benzene, 1-methyl-4-isopropyl | 0.006 | 0.005 | 0.006 | 0.004 | 0.006 | 0.014 |
| C8H10O | 16.478 | 1112 | 1112 | 苯乙醇 Phenylethyl alcohol | - | - | - | - | - | 0.012 |
| C10H8 | 18.776 | 1178 | 1188 | 萘 Naphthalene | 0.006 | 0.036 | 0.043 | 0.039 | 0.034 | 0.036 |
| C11H16O | 20.021 | 1229 | 1230 | 2-异丙基-4-甲基茴香醚 4-methy anisole, 2-isopropyl | - | - | - | - | 0.002 | 0.014 |
| C10H14O | 21.725 | 1292 | 1290 | 百里酚 Thymol | - | - | - | - | - | 0.003 |
| C14H22O | 27.872 | 1502 | 1507 | 2,4-二异丙基苯酚 2,4-diisopropyl phenol | - | 0.016 | 0.052 | 0.120 | 0.133 | 0.031 |
新窗口打开|下载CSV
为了进一步分析聚乙烯膜包装的金针菇挥发性风味成分的影响,将气质数据进行聚类分析,结果如图1所示。从图1中可以看出,聚乙烯膜包装的金针菇挥发性风味成分聚类分析树状图显示出3个主要的类别。其中贮藏9 d、贮藏12 d和贮藏15 d的样品分在了一类,贮藏3 d和贮藏6 d的样品被分在一类,新鲜样品为另一类。在第一大类中,贮藏9 d和贮藏12 d的样品在最小距离水平上首先聚类,这说明贮藏9 d和贮藏12 d的样品挥发性成分相似度很高。随着欧式距离的增加,贮藏15 d的样品也并入到这一类中。而在第二大类中,贮藏3 d和贮藏6 d的样品在欧式距离为3时聚到一起,说明两个样品间挥发性成分相似度较高。在第三大类中,只有新鲜样品。当欧式距离增加至18时,新鲜样品与贮藏3 d和贮藏6 d的样品归为一类。随着欧式距离的继续增大,当增至25时,三大类才归为一类,说明新鲜样品与贮藏过程中的样品的相似度明显较低。因此,可以把贮藏期分为3个阶段:初期、中期、末期。
图1
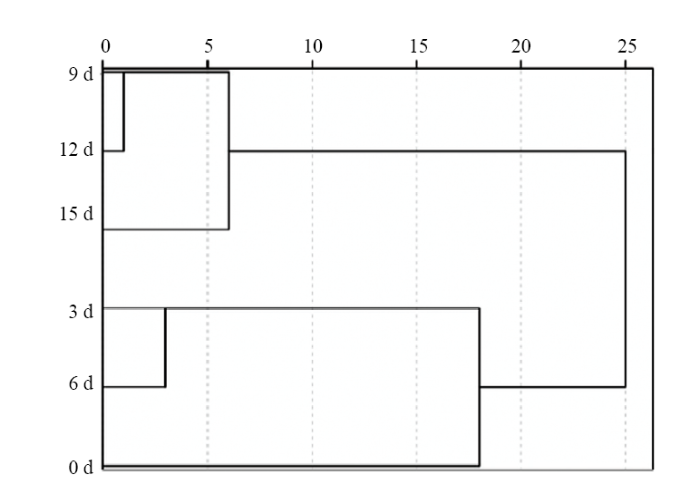 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1聚乙烯膜包装金针菇贮藏过程中挥发性成分数据聚类分析结果
Fig. 1Clustering results of flavor components data analysis during the storage of F. velutipes in polyethylene film packaging
2.1.2 电子鼻检测结果 如图2所示,12个传感器中的大部分对贮藏期间的3个样品给出了类似的信号。其中,LY2/G、LY2/AA、LY2/GH、LY2/gCTL和LY2/gCT传感器的响应值为负,其他传感器的响应值为正,但连接趋势较为一致,说明聚乙烯膜包装金针菇贮藏过程中挥发性风味物质较为相似。在贮藏过程中,LY2/G、LY2/AA、LY2/GH在3个样本间的响应距离最大,T70/2、PA/2、P10/1和T30/1也对聚乙烯膜包装金针菇挥发性风味鉴别作出了很大的贡献。传感器LY2/G对醇类和酮类物质较为敏感;传感器LY2/AA对酮类物质敏感;传感器LY2/GH对氨类和胺类物质较为敏感。传感器LY2/G和LY2/AA的响应距离较大,这说明聚乙烯包装的样品醇类和醛类物质的变化更为显著,这与GC-MS的检测结果相一致。
图2
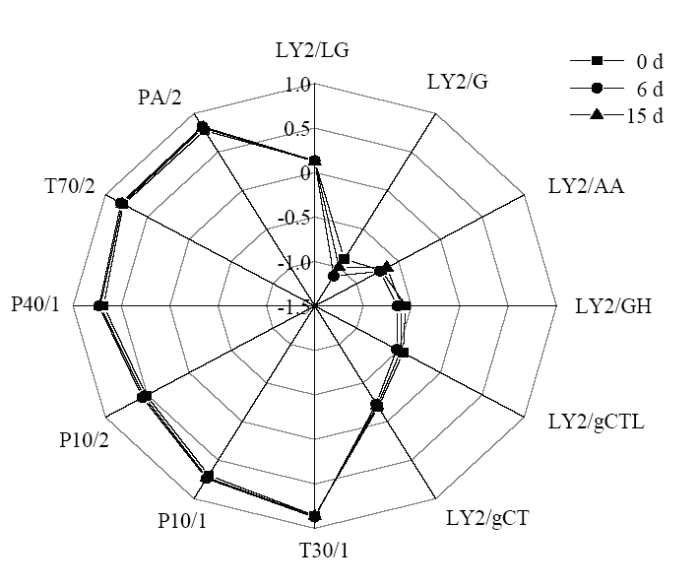 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2聚乙烯膜包装金针菇贮藏过程中电子鼻挥发性风味物质雷达图谱
Fig. 2Electronic nose radar map on volatile flavors during the storage of F. velutipes in polyethylene film packaging
对聚乙烯膜包装金针菇贮藏期间的挥发性风味的原始响应值进行主成分分析。如图3所示,聚乙烯膜包装样品提取的主成分累积贡献率为99.39%,几乎提取了原始数据的全部信息,极具代表性。聚乙烯膜包装处理的样品在贮藏0 d时,在PC1和PC2正的一侧;而贮藏3 d时,PC1负的一侧;在贮藏6 d时,在PC1和PC2负的一侧。贮藏3 d和贮藏6 d距离较近,说明两个样品之间的挥发性成分有相似性。贮藏0 d与贮藏3 d和6 d的样品距离较远,说明这3个样品间的挥发性成分存在一定的差别。而贮藏9 d、12 d和15 d是几乎都在PC1正的一侧和PC2负的一侧,且有一定的重叠区域,说明这3个样品之间的挥发性成分较为相似。与GC-MS的聚类分析结果一致。
图3
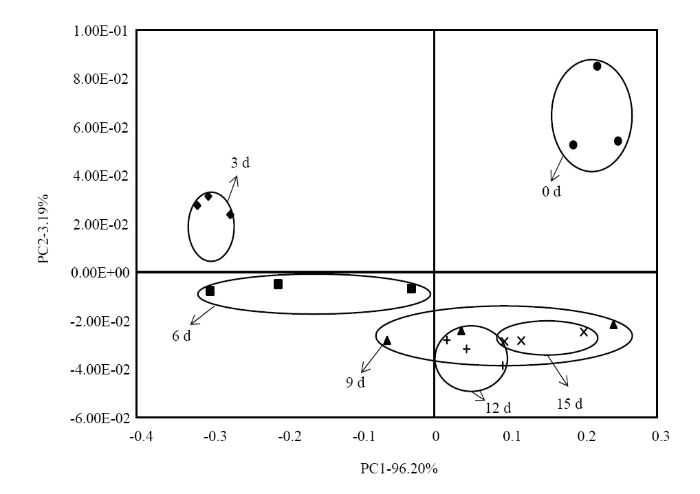 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3聚乙烯膜包装金针菇在贮藏过程中的电子鼻主成分分析
Fig. 3Principal component analysis of electronic nose during the storage of F. velutipes in polyethylene film packaging
2.2 非挥发性风味物质
2.2.1 可溶性糖含量 在贮藏过程中,可溶性糖(醇)总量和各种可溶性糖(醇)含量变化均显著(P<0.05)。在贮藏前期(3 d),聚乙烯膜包装金针菇的果糖含量增加,在贮藏中期(9 d),果糖含量下降至44.405 mg·g-1。在贮藏初期,聚乙烯膜包装金针菇的甘露醇含量增加,随后,甘露醇含量呈下降的趋势。在贮藏0—6 d,金针菇的海藻糖含量从13.235 mg·g-1增加至76.749 mg·g-1,随后,海藻糖含量下降至8.157 mg·g-1。随着贮藏时间的延长,可溶性糖(醇)总量呈先上升后下降的趋势。贮藏初期,可溶性糖(醇)总量从181.057 mg·g-1上升至248.803 mg·g-1,直至贮藏末期,可溶性糖(醇)总量呈下降的趋势。2.2.2 有机酸含量 金针菇中的富马酸含量在贮藏初期呈下降趋势,贮藏中期变化不大,贮藏后期有所下降。在贮藏初期,聚乙烯膜包装的金针菇富马酸含量下降至0.870 mg·g-1,在贮藏中期变化不大;在贮藏末期,富马酸含量呈下降的趋势。金针菇中琥珀酸含量在贮藏初期有所下降,在贮藏中期琥珀酸含量上升,贮藏末期呈下降的趋势。金针菇中的酒石酸含量在贮藏期间呈现上升趋势。聚乙烯膜包装的金针菇在贮藏12 d内酒石酸含量逐渐上升至6.593 mg·g-1,贮藏末期,酒石酸含量下降,下降至5.888 mg·g-1。金针菇中的苹果酸含量在贮藏期间呈下降趋势,贮藏后期略微上升。在贮藏前期,由3.778 mg·g-1下降到2.291 mg·g-1,在第6天上升,随后在第12 天缓慢下降为1.592 mg·g-1,第15 天又上升为2.036 mg·g-1。聚乙烯膜包装的金针菇柠檬酸含量在贮藏前期,由29.154 mg·g-1下降到22.945 mg·g-1,在贮藏中期有小幅度上升,贮藏末期呈下降的趋势。金针菇中的冰乙酸含量在贮藏期间呈先下降的趋势,贮藏0—12 d,金针菇中冰乙酸含量从0.078 mg·g-1下降至0.020 mg·g-1,贮藏15 d,冰乙酸含量又上升至0.039 mg·g-1。在金针菇的贮藏过程中,除了酒石酸、冰乙酸外,其余4种有机酸的变化趋势与总有机酸变化趋势类似,且6种有机酸中,柠檬酸的含量最高,其次为琥珀酸。
Table 2
表2
表2聚乙烯膜包装金针菇贮藏过程中可溶性糖(醇)含量的变化
Table 2
| 贮藏时间 Storage time (d) | 果糖 Fructose | 甘露醇 Mannitol | 海藻糖 Trehalose | 总量 Total content |
|---|---|---|---|---|
| 0 | 81.666±0.524b | 86.656±1.081b | 13.235±0.258d | 181.057±1.002c |
| 3 | 89.761±0.681a | 94.102±1.633a | 64.940±0.051b | 248.803±2.330a |
| 6 | 62.412±0.879c | 67.030±0.318c | 76.749±0.376a | 206.192±0.965b |
| 9 | 44.405±0.701d | 52.984±1.260d | 21.961±0.079c | 119.350±2.011d |
| 12 | 37.280±0.513e | 48.579±0.593e | 9.309±0.015e | 95.169±1.117e |
| 15 | 44.971±0.440d | 42.117±0.375f | 8.157±0.074f | 95.245±0.806e |
新窗口打开|下载CSV
2.2.3 呈味核苷酸含量 贮藏0—9 d,5′-AMP含量呈上升的趋势,贮藏末期,5′-AMP含量从1.842 mg·g-1下降至1.638 mg·g-1。食用菌中含有的5′-GMP具有肉的鲜味,表现出食用菌所特有的鲜味[16]。在贮藏期间,5′-GMP含量先上升后下降。贮藏0—9 d,5′-GMP含量呈上升的趋势,贮藏末期,5′-GMP含量从0.242 mg·g-1下降至0.050 mg·g-1。在贮藏过程中,5′-CMP含量先上升后下降。贮藏0—6 d,5′-CMP含量上升至3.611 mg·g-1,贮藏末期5′-CMP含量呈下降的趋势。贮藏期间5′-IMP的含量先上升后下降。贮藏初期,5′-IMP含量变化不明显,贮藏中期,5′-IMP含量从0.015 mg·g-1上升至0.068 mg·g-1,贮藏末期,5′-IMP含量下降至0.033 mg·g-1。5′-UMP含量在贮藏期间呈先上升后下降的趋势。贮藏0—9 d,5′-UMP含量从0.054 mg·g-1上升至0.144 mg·g-1,贮藏末期,5′-UMP含量下降至0.070 mg·g-1。呈味核苷酸的总量呈先升后降的趋势。5种呈味核苷酸中5′-CMP所占比重最高,其次为5′-AMP。
Table 3
表3
表3聚乙烯膜包装金针菇贮藏过程中有机酸含量的变化
Table 3
| 贮藏时间 Storage time (d) | 富马酸 Fumaric acid | 琥珀酸 Succinic acid | 酒石酸 Tartaric acid | 苹果酸 Malic acid | 柠檬酸 Citric acid | 冰乙酸 Glacial acetic acid | 总量 Total content |
|---|---|---|---|---|---|---|---|
| 0 | 1.148±0.191a | 21.074±0.102c | 3.280±0.182e | 3.778±0.057a | 29.151±0.236a | 0.078±0.002a | 58.508±0.180a |
| 3 | 0.870±0.018b | 18.981±0.217d | 4.880±0.134d | 2.291±0.104c | 22.945±0.808c | 0.058±0.001b | 50.025±0.767c |
| 6 | 0.883±0.015b | 22.358±0.787b | 5.114±0.093c | 2.963±0.102b | 22.369±0.626c | 0.056±0.001b | 53.743±0.022b |
| 9 | 0.912±0.010b | 24.853±0.136a | 5.970±0.010b | 2.027±0.067d | 24.161±0.591b | 0.022±0.000d | 57.946±0.612a |
| 12 | 0.712±0.076c | 16.363±0.168f | 6.593±0.081a | 1.592±0.043e | 18.087±0.559e | 0.020±0.001e | 43.366±0.594e |
| 15 | 0.819±0.042bc | 17.362±0.718e | 5.888±0.042b | 2.036±0.093d | 21.008±0.588d | 0.039±0.001c | 47.153±1.484d |
新窗口打开|下载CSV
Table 4
表4
表4聚乙烯膜包装金针菇贮藏过程中呈味核苷酸含量的变化
Table 4
| 贮藏时间 Storage time (d) | 5'-AMP | 5'-GMP | 5'-CMP | 5'-IMP | 5'-UMP | 总量 Total content |
|---|---|---|---|---|---|---|
| 0 | 1.103±0.079c | 0.110±0.010c | 1.629±0.035d | 0.024±0.009de | 0.054±0.001b | 2.920±0.106c |
| 3 | 1.603±0.018b | 0.127±0.010bc | 2.445±0.134c | 0.015±0.001e | 0.072±0.002b | 4.262±0.141b |
| 6 | 1.663±0.017b | 0.160±0.007b | 3.611±0.188a | 0.043±0.008bc | 0.084±0.007b | 5.561±0.200a |
| 9 | 1.842±0.043a | 0.242±0.050a | 3.136±0.229b | 0.068±0.013a | 0.144±0.033a | 5.431±0.196a |
| 12 | 1.699±0.088b | 0.130±0.018bc | 0.649±0.161f | 0.058±0.016ab | 0.135±0.039a | 2.671±0.218c |
| 15 | 1.638±0.125b | 0.050±0.014d | 0.969±0.207e | 0.033±0.008cd | 0.070±0.009b | 2.761±0.271c |
新窗口打开|下载CSV
2.2.4 游离氨基酸 表5显示了聚乙烯包装金针菇冷藏期间游离酸含量的变化。从氨基酸总量上看,聚乙烯包装金针菇贮藏期间呈现先下降后上升的趋势。新鲜金针菇富含Pro、Glu、Phe;新鲜金针菇与贮藏9 d金针菇的游离氨基酸总量和Glu含量接近,未出现显著下降;在贮藏15 d ,聚乙烯包装金针菇游离氨基酸总量显著增加,Phe含量变化不明显,Pro、Glu含量显著增加。
Table 5
表5
表5聚乙烯膜包装金针菇贮藏过程中游离氨基酸含量的变化
Table 5
| 类型 Type | 氨基酸 Amino acid | 氨基酸含量 Amino acid content (mg?g-1) | |||||
|---|---|---|---|---|---|---|---|
| 0 d | 3 d | 6 d | 9 d | 12 d | 15 d | ||
| 呈鲜味氨基酸 Umami amino acid | 天冬氨酸 Asp | 2.474±0.023c | 2.724±0.061b | 2.665±0.013b | 2.182±0.013d | 0.732±0.088e | 3.333±0.218a |
| 谷氨酸 Glu | 10.055±0.029bc | 7.701±0.007e | 9.793±0.356c | 10.291±0.002b | 8.510±0.085d | 12.025±0.454a | |
| 小计 Subtotal | 12.529±0.050b | 10.425±0.062c | 12.457±0.356b | 12.473±0.013b | 9.242±0.157d | 15.358±0.289a | |
| 呈甜味氨基酸 Sweet amino acid | 丙氨酸 Ala | 1.941±0.012c | 1.607±0.007e | 2.035±0.012b | 1.775±0.012d | 1.381±0.045f | 2.373±0.050a |
| 甘氨酸 Gly | 1.274±0.001b | 1.047±0.001e | 1.169±0.001c | 1.137±0.010d | 0.888±0.029f | 1.447±0.011a | |
| 丝氨酸 Ser | 2.084±0.014ab | 1.087±0.015d | 1.936±0.373b | 1.798±0.034b | 1.375±0.025c | 2.29±0.119a | |
| 苏氨酸 Thr | 1.758±0.002c | 1.126±0.017e | 1.883±0.159b | 1.623±0.001d | 1.08±0.014e | 2.019±0.058a | |
| 小计 Subtotal | 7.057±0.015b | 4.867±0.009d | 7.023±0.520b | 6.333±0.054c | 4.725±0.085d | 8.129±0.213a | |
| 呈苦味氨基酸 Bitter amino acid | 精氨酸 Arg | 1.123±0.013b | 0.894±0.001c | 1.113±0.024b | 1.097±0.024b | 0.508±0.025d | 1.288±0.013a |
| 组氨酸 His | 1.178±0.007a | 1.049±0.058b | 1.041±0.037b | 1.168±0.066a | 0.000±0.000c | 1.238±0.014a | |
| 异亮氨酸 Ile | 1.070±0.007b | 0.929±0.001c | 1.005±0.001bc | 1.077±0.018b | 0.798±0.132d | 1.278±0.013a | |
| 亮氨酸 Leu | 1.904±0.001b | 1.634±0.032cd | 1.778±0.051bc | 1.829±0.018b | 1.541±0.229d | 2.089±0.032a | |
| 甲硫氨酸 Met | 1.544±0.008a | 1.069±0.183bc | 0.972±0.057c | 0.987±0.115c | 0.522±0.001d | 1.155±0.028b | |
| 苯丙氨酸 Phe | 7.270±0.066a | 6.734±0.077b | 6.542±0.023b | 6.720±0.274b | 7.215±0.578a | 7.664±0.023a | |
| 酪氨酸 Tyr | 2.915±0.021b | 2.893±0.051b | 2.794±0.024bc | 2.744±0.050c | 1.434±0.146d | 3.512±0.039a | |
| 缬氨酸 Val | 2.214±0.003b | 2.023±0.044c | 2.142±0.090b | 2.184±0.056b | 1.873±0.050d | 2.622±0.044a | |
| 小计 Subtotal | 19.218±0.035b | 17.224±0.282d | 17.386±0.111d | 17.805±0.332c | 13.891±0.125e | 20.847±0.03a | |
| 无味氨基酸 Odorless amino acid | 半胱氨酸 Cys | 0.503±0.005ab | 0.503±0.051ab | 0.484±0.044b | 0.555±0.008a | 0.474±0.046b | 0.475±0.051b |
| 赖氨酸 Lys | 3.733±0.005b | 3.452±0.021c | 3.490±0.020c | 3.537±0.025c | 3.166±0.138d | 4.000±0.021a | |
| 脯氨酸 Pro | 22.540±0.466cd | 22.398±0.961cd | 23.199±0.336bc | 24.140±0.104b | 21.824±0.694d | 27.277±1.164a | |
| 小计 Subtotal | 26.777±0.473cd | 26.354±0.984cd | 27.172±0.367bc | 28.231±0.117b | 25.465±0.822d | 31.752±1.120a | |
| 总计 Total | 65.581±0.515b | 58.870±0.751c | 64.038±0.754b | 64.842±0.424b | 53.323±1.120d | 76.087±1.572a | |
新窗口打开|下载CSV
从图4可以看出金针菇所含的4类游离氨基酸中,无味氨基酸所占的比重最高,其次是呈苦味氨基酸和呈鲜味氨基酸,呈甜味氨基酸最低。在贮藏期间,呈鲜味氨基酸的含量变化较为明显,而其他3类游离氨基酸无明显变化。贮藏前期,游离氨基酸的含量有所下降,在贮藏中期,金针菇的游离氨基酸含量变化缓慢。在贮藏12 d时,游离氨基酸含量下降。贮藏15 d时,游离氨基酸的含量又上升,且明显高于0 d时的游离氨基酸含量。
图4
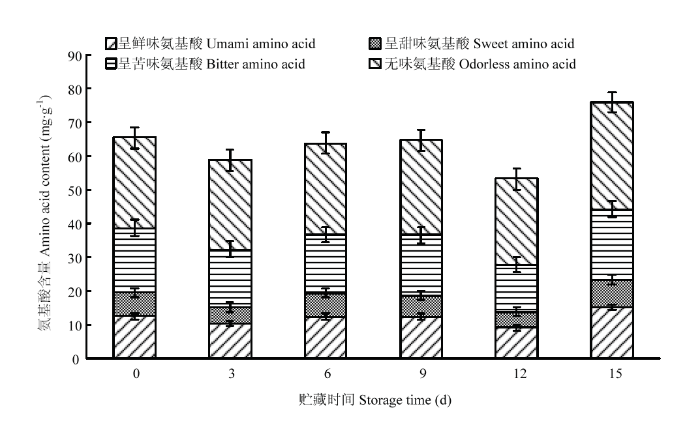 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4聚乙烯膜包装金针菇贮藏过程中四类游离氨基酸变化
Fig. 4Changes of four kinds of free amino acids during storage of F. velutipes in polyethylene film packaging
2.2.5 电子舌检测结果 对聚乙烯膜包装金针菇在贮藏期间的非挥发性风味的原始响应值进行主成分分析。如图5所示,聚乙烯膜包装样品提取的主成分累积贡献率为96.77%,几乎提取了原始数据的全部信息,极具代表性。聚乙烯膜包装处理的样品在贮藏0 d时,在PC1正的一侧;而贮藏3 d、贮藏6 d、贮藏9 d的样品在PC1负的一侧。贮藏0 d与贮藏3 d和6 d的样品距离较远,说明这3个样品之间的非挥发性成分存在一定的差别。而贮藏12 d和15 d的样品在PC2正的一侧,说明这两个样品之间具有一定的相似度。
图5
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5聚乙烯包装金针菇贮藏过程中电子舌主成分分析
Fig. 5Electronic tongue principal component analysis during storage of F. velutipes in polyethylene film packaging
3 讨论
金针菇的风味成分主要有挥发性成分和非挥发性成分两种。挥发性风味成分如八碳不饱和醇、醛或酮类,它们对食用菌风味的形成起着重要的作用;非挥发性成分如可溶性糖(醇)、有机酸、呈味核苷酸、游离氨基酸,它们对食用菌滋味的形成至关重要[17]。本研究对不同贮藏时间金针菇样品的风味成分进行检测。通过SPME-GC/MS技术可以对金针菇贮藏过程中的挥发性成分进行检测,采用RI和MS共同定性,可以提高准确性。SPME-GC/MS结果表明,在贮藏过程中,醛类、酮类和醇类物质的变化最为明显。在检测到的醇类物质中,正辛醇和正壬醇所占的比例最高。而在不饱和醇中,1-辛烯-3-醇的含量最高,是大多数食用菌的主要挥发性成分,这与大多数食用菌的挥发性成分研究结果一致[18]。挥发性成分中一些醇类、醛类、酮类化合物来自于脂类物质的氧化[19,20],如辛醛、壬醛是油酸氧化的产物,反,反-2,4-癸二烯醛是聚不饱和脂肪酸氧化的产物,1-辛烯-3-醇是亚油酸经脂肪氧化酶催化形成的,具有蘑菇的香气[21],对食用菌的风味影响较大。贮藏末期(15 d)金针菇酮类物质的含量呈上升的趋势,酮类物质的上升是金针菇风味劣变的一种表现[22]。贮藏末期(15 d)醛类物质的含量上升,这与前人的研究结果一致[2]。食用菌特征气味也离不开醛类化合物的作用,一般具有较高碳位数的醛类化合物有柑橘皮的香味[23]。醛类化合物气味阈值低,醛类在脂质氧化中生成速率很快,它与其他化合物可产生重叠效应,且效应较强。虽然长链的醛类表面上检测不到香味,但是却是一些杂环化合物的前体。雷达图结果表明,冷藏15 d的金针菇中积累了更多的醇类、醛类及其他不良气味的物质。通过电子鼻分析可以看出,新鲜样品与贮藏过程中样品的风味差异均十分显著。其风味类型的变化趋势与GC-MS所检测的挥发性成分变化结论一致。
试验发现,金针菇中的主要可溶性糖(醇)为甘露醇和果糖。其中,甘露醇是一种较强的自由基清除剂[24]。随着贮藏时间的延长,金针菇的甘露醇含量呈先上升后下降的趋势,这与梁艳丽等[25]研究的白灵菇贮藏过程中甘露醇含量的变化趋势基本一致。金针菇的甘露醇含量上升可能和菇体后熟作用维持渗透压有关,随后下降可能是菇体内甘露醇大量转运或后熟作用的减弱造成的[26,27]。金针菇的果糖含量在贮藏期间呈先上升后下降的趋势,这与前人的研究结果[28]基本一致。金针菇中的果糖含量增加,可能是由于蔗糖水解为果糖和葡萄糖引起的。随后,金针菇的果糖含量逐渐降低,可能是由于葡萄糖和果糖合成淀粉引起的[28]。在贮藏末期,果糖含量增加,可能是由于多糖水解造成的[29]。金针菇中主要的有机酸是琥珀酸和柠檬酸,占总有机酸的80%以上。金针菇的琥珀酸含量在冷藏过程中呈先升后降的趋势,这与安华明等[30]的研究结果基本一致。金针菇中琥珀酸含量的变化可能与琥珀酸脱氢酶(SDH)的活性有关,SDH活性的降低导致琥珀酸含量的累积[31]。在贮藏的过程中,柠檬酸含量总体呈下降的趋势,这与前人的研究结果[32]基本一致。金针菇中的柠檬酸含量的变化可能与柠檬酸合成酶(CS)、乌头酸酶(ACO)和异柠檬酸脱氢酶(NAD-IDH)在金针菇贮藏期间的活性变化有关。刘雅兰等[33]经研究发现果梅果实的柠檬酸含量与CS的活性呈极显著正相关,ACO和NAD-IDH参与柠檬酸的降解过程,其活性在果实成熟期间不断变化。在贮藏过程中,5′-AMP含量呈先上升后下降的趋势,这与张晓玉[34]研究的秀珍菇在贮藏过程中5′-AMP含量的变化趋势一致。呼吸提供了果蔬采后生命活动所需要的能量。呼吸作用释放的能量,一部分转化为呼吸热,一部分以ATP形式贮藏。琥珀酸脱氢酶是连接氧化磷酸化与电子传递的枢纽之一,以FAD作为其脱下电子的受体,将琥珀酸氧化为延胡索酸,产生FADH2,每个FADH2生成2个ATP[35],而ATP可以降解为AMP。5′-IMP含量呈先上升后下降的趋势,而5′-IMP主要由ATP降解所产生,具有显著地增鲜效果。据研究,5′-IMP的生成代谢主要与环境温度、pH以及各种酶活性有关,其中,肌苷酸降解酶是其贮藏过程中含量发生变化的主要因素[36]。食用菌中的游离氨基酸会提供给蘑菇特有的鲜味和甘甜味。虽然金针菇中的呈苦味氨基酸含量大于呈鲜味氨基酸,但是由于鲜味氨基酸的滋味活度值(taste active,TAV)较高,且又有可溶性糖甜味的遮盖,因此金针菇的呈苦味氨基酸并没有味觉活性[33]。在本研究中,随着贮藏时间的延长,游离氨基酸的含量呈现先降后升的趋势,这与张海军[37]研究杏鲍菇低温贮藏期间游离氨基酸的变化规律基本一致。贮藏前期,游离氨基酸的含量下降可能是由于低温和PE材料包装膜有一定的密封性,使得袋内形成了低氧、高二氧化碳的环境,导致金针菇的后熟作用逐渐受到抑制。金针菇的游离氨基酸含量变化缓慢,可能是因为金针菇失水过多,氨基酸合成和转运受到抑制或菇体活力不高,维持自身正常生理活动消耗的游离氨基酸与菇体后熟阶段合成的游离氨基酸处于动态平衡。随后,游离氨基酸含量下降,原因可能是金针菇为维持自身正常生理活动需要消耗或转化游离氨基酸以保证供给。贮藏15 d时,游离氨基酸含量上升可能是由于金针菇腐烂变质,蛋白质加速分解,使游离氨基酸不断积累[37]。
在食品工业中,产品风味的形成与微生物的菌群演替有着密不可分的联系。在储运过程中,腐败微生物的生长变化会使食品产生不良风味,影响其商品销售。因此,在后续的研究中,将进一步研究金针菇贮藏过程中微生物的动态变化规律,为金针菇的贮藏保鲜提供新的理论依据。
4 结论
不同贮藏期的金针菇挥发性风味物质的含量存在一定的差异。冷藏初期金针菇中的挥发性成分主要以醇类为主,醛类次之。贮藏末期醇类、醛类、酮类物质含量上升,醇类、醛类、酮类物质含量的升高对金针菇挥发性风味的变化产生一定的不利影响。不同贮藏期金针菇的非挥发性风味物质的变化规律具有相似性。因此,可以依据贮藏过程中风味物质的变化规律区分不同贮藏期的金针菇样品,从而为金针菇品质的控制和风味的保持提供理论依据。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 3]
DOI:10.1016/j.foodchem.2010.07.081URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.jfoodeng.2009.11.006URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/S0021-9673(00)80584-1URL [本文引用: 1]
[本文引用: 1]
DOI:10.4236/fns.2013.46078URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1021/jf073181yURL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
Magsci [本文引用: 1]

目的:探索黄鳍金枪鱼肉挥发性成分与加工温度的关系。方法:利用电子鼻分别检测不同温度(70、80、90、100、120、150℃)加热条件下的黄鳍金枪鱼肉及其生肉样品,并对所获数据进行主成分分析,在此基础上进一步采用顶空固相微萃取和气相色谱-质谱联用技术对新鲜和分别加热到95、150℃的黄鳍金枪鱼肉样品进行分析。结果:不同条件下的样品电子鼻信号表现出很强的聚类特性。经气相色谱-质谱联用技术测定3种样品,分别检出52、50、53种成分,主要为醛类、烃类、醇类、酮类、呋喃类,它们的协同作用构成了黄鳍金枪鱼肉特有的特征气味。结论:黄鳍金枪鱼生肉中含有较多的腥味成分——1-戊烯-3-醇、1,5-辛二烯-3-醇,通过加热处理后这两种成分的相对含量明显减少;加热处理后,具有特殊香气的长链醛以及呋喃类物质相对含量明显增多,2-乙基呋喃、2-戊基呋喃是烤制肉品重要的香味呈味物,是加热后黄鳍金枪鱼的特征气味。
Magsci [本文引用: 1]

目的:探索黄鳍金枪鱼肉挥发性成分与加工温度的关系。方法:利用电子鼻分别检测不同温度(70、80、90、100、120、150℃)加热条件下的黄鳍金枪鱼肉及其生肉样品,并对所获数据进行主成分分析,在此基础上进一步采用顶空固相微萃取和气相色谱-质谱联用技术对新鲜和分别加热到95、150℃的黄鳍金枪鱼肉样品进行分析。结果:不同条件下的样品电子鼻信号表现出很强的聚类特性。经气相色谱-质谱联用技术测定3种样品,分别检出52、50、53种成分,主要为醛类、烃类、醇类、酮类、呋喃类,它们的协同作用构成了黄鳍金枪鱼肉特有的特征气味。结论:黄鳍金枪鱼生肉中含有较多的腥味成分——1-戊烯-3-醇、1,5-辛二烯-3-醇,通过加热处理后这两种成分的相对含量明显减少;加热处理后,具有特殊香气的长链醛以及呋喃类物质相对含量明显增多,2-乙基呋喃、2-戊基呋喃是烤制肉品重要的香味呈味物,是加热后黄鳍金枪鱼的特征气味。
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/j.foodchem.2003.08.016URL [本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1006/fgbi.1997.0976URL [本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2011.10.014Magsci [本文引用: 1]

【目的】明确刺梨有机酸各组分及抗坏血酸含量。【方法】以‘贵农5号’为材料,采用HPLC方法分析刺梨有机酸组分以及不同器官内、果实发育和采后贮藏过程中主要有机酸各组分及抗坏血酸含量的变化。【结果】刺梨果实中主要含有苹果酸、乳酸、酒石酸、柠檬酸、草酸和琥珀酸6种有机酸组分和较高含量的抗坏血酸;不同器官有机酸含量分析发现,根主要含乳酸和酒石酸,茎和叶中乳酸含量较高,而花中主要积累琥珀酸。果实发育过程中各有机酸组分均不同程度表现出先升高后降低趋势,而抗坏血酸含量则一直呈增加态势;成熟果实内,抗坏血酸含量显著高于任一种有机酸组分,约占总酸量的67%;6种有机酸组分中,苹果酸含量最高(约占有机酸总量的53%)。研究还发现,不同贮藏温度对刺梨果实有机酸含量有较大影响。【结论】从有机酸组分分析,刺梨是一种以苹果酸为主要有机酸的果实类型,但抗坏血酸的含量高于所有有机酸组分的总量。这种高抗坏血酸含量特点是刺梨果实独特的营养标志。
DOI:10.3864/j.issn.0578-1752.2011.10.014Magsci [本文引用: 1]

【目的】明确刺梨有机酸各组分及抗坏血酸含量。【方法】以‘贵农5号’为材料,采用HPLC方法分析刺梨有机酸组分以及不同器官内、果实发育和采后贮藏过程中主要有机酸各组分及抗坏血酸含量的变化。【结果】刺梨果实中主要含有苹果酸、乳酸、酒石酸、柠檬酸、草酸和琥珀酸6种有机酸组分和较高含量的抗坏血酸;不同器官有机酸含量分析发现,根主要含乳酸和酒石酸,茎和叶中乳酸含量较高,而花中主要积累琥珀酸。果实发育过程中各有机酸组分均不同程度表现出先升高后降低趋势,而抗坏血酸含量则一直呈增加态势;成熟果实内,抗坏血酸含量显著高于任一种有机酸组分,约占总酸量的67%;6种有机酸组分中,苹果酸含量最高(约占有机酸总量的53%)。研究还发现,不同贮藏温度对刺梨果实有机酸含量有较大影响。【结论】从有机酸组分分析,刺梨是一种以苹果酸为主要有机酸的果实类型,但抗坏血酸的含量高于所有有机酸组分的总量。这种高抗坏血酸含量特点是刺梨果实独特的营养标志。
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 2]
[D].
[本文引用: 2]
