 ,1, 王金社1, 魏荷1, 李金英1, 弓贵明2, 王树峰1, 张晶鹏1, 李茂林1, 郭建秋3, 卢为国
,1, 王金社1, 魏荷1, 李金英1, 弓贵明2, 王树峰1, 张晶鹏1, 李茂林1, 郭建秋3, 卢为国 ,1,*
,1,*Distribution survey of soybean cyst nematode of new race X12 in Gujiao city, Shanxi province
LIAN Yun ,1, WANG Jin-She1, WEI He1, LI Jin-Ying1, GONG Gui-Ming2, WANG Shu-Feng1, ZHANG Jing-Peng1, LI Mao-Lin1, GUO Jian-Qiu3, LU Wei-Quo
,1, WANG Jin-She1, WEI He1, LI Jin-Ying1, GONG Gui-Ming2, WANG Shu-Feng1, ZHANG Jing-Peng1, LI Mao-Lin1, GUO Jian-Qiu3, LU Wei-Quo ,1,*
,1,*通讯作者:
收稿日期:2020-05-18接受日期:2020-09-13网络出版日期:2020-09-22
| 基金资助: |
Received:2020-05-18Accepted:2020-09-13Online:2020-09-22
| Fund supported: |
作者简介 About authors
E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (277KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
练云, 王金社, 魏荷, 李金英, 弓贵明, 王树峰, 张晶鹏, 李茂林, 郭建秋, 卢为国. 山西省古交市大豆胞囊线虫新小种X12分布调查[J]. 作物学报, 2021, 47(2): 237-244. doi:10.3724/SP.J.1006.2021.04111
LIAN Yun, WANG Jin-She, WEI He, LI Jin-Ying, GONG Gui-Ming, WANG Shu-Feng, ZHANG Jing-Peng, LI Mao-Lin, GUO Jian-Qiu, LU Wei-Quo.
大豆胞囊线虫(soybean cyst nematode, SCN)病是一种世界性大豆病害, 常年给全球大豆生产造成数十亿美元的经济损失[1,2]。在前期调查研究中, 我们发现了具有超强致病力的大豆胞囊线虫新生理小种X12[3] (生理小种, 以下简称小种), 该小种的出现给大豆生产造成巨大威胁。调查X12小种分布及周围生理小种类型, 是有目的地采取策略控制该病害发展的先决条件。
在中国两大大豆主产区——东北大豆产区和黄淮海大豆产区均有大豆胞囊线虫分布。前期调查研究发现, 在黄淮海大豆产区, 约有70%的地区分布有大豆胞囊线虫, 4号生理小种主要集中分布在山西省; 据2012—2015年调查结果发现, 山西省主要分布有2号和4号生理小种, 该小种在山西省的检出频率分别为38.5%和38.5% [4]。
对大豆胞囊线虫生理小种分类目前常采用的方法有2种: Riggs和Schmitt[5]于1988年建立的将大豆胞囊线虫划分为16个小种模式, 以及Niblack等[6]在2002年建立的将大豆胞囊线虫划分为128个小种的“HG类型”模式, 其目的均是通过鉴别寄主区分致病力不同的线虫群体。2种划分方法各有其适宜的使用范畴, 而从抗病育种目标出发, 大豆抗病育种专家认为划分过细很容易给育种带来困惑, 同时, 为了便于同前期调查结果进行对比, 在中国, 相关研究专家仍采用Riggs鉴别模式。因此, 本研究也主要采用Riggs鉴别模式对采取的土样进行生理小种鉴定。而随着致病性超强的X12小种出现, 以上2种鉴别模式所采用的寄主已不能有效将新生理小种从目前小种中区分开, 因此在生理小种鉴定中, 我们增加了一个鉴别寄主——兴县灰皮支, 用于从4号小种中区分X12小种。
国内外目前所用主要抗源对大豆胞囊线虫新小种X12均表现感病或高感[3]。这些抗源包括Riggs鉴别模式中的4个鉴别寄主[5], HG鉴别模式中的7个鉴别寄主[6], 中国的优异抗源兴县灰皮支(ZDD2315)[7,8]和美国目前在用的重要抗源PI437654以及用这2个抗源培育的抗病品种中黄57[3], 抗LY1线虫群体的PI567516C[9]。在抵御由SCN给大豆生产带来严重经济损失的策略中, 培育抗病品种最经济、有效, 然而目前缺乏抗源, 暂时限制了抗X12小种的抗病品种培育。因此, 采取轮作、化学杀虫剂等手段对该地区SCN进行防控尤为重要。
纵观SCN在全球范围大豆产区的危害趋势, 越来越多调查数据表明, SCN致病力正在升级且SCN扩散范围仍在增大。SCN 1号小种仅能够侵染Riggs鉴别模式中的寄主PI88788, 2号小种能够侵染Peking、Pickett和PI88788共3个寄主, 已有研究表明, 在中国黄淮海大豆产区及美国密苏里州大豆产区, 优势生理小种均由1号小种[10,11]演变为2号小种[4,12], 说明在以上2个大豆产区分布的生理小种, 其致病性已经增强。2005年调查发现, 在美国伊利诺伊州, 83%大豆田感染了大豆胞囊线虫病, 其中70%感染田块的线虫能够寄生于PI88788, 导致在该州使用现有抗性品种作为防治SCN手段的有效性显著降低[13]。随后, 在其他产区也逐渐发现线虫群体克服PI88788抗性, 导致在PI88788上的胞囊指数(female index, FI)升高[14,15]。在中国, SCN已经扩散到新疆、广西、贵州等以前未受SCN侵染的大豆种植区[16,17]; 而在美国, SCN几乎遍及所有种植大豆产区[14]。
SCN是一种土传病害, 一旦大豆种植区受到侵染, 极难根除。尽管目前国内尚未有官方数据统计每年SCN给中国大豆生产带来的经济损失, 但在前期调查过程中已经发现, 在受到严重感染大豆产区, 有“火烧苗”现象, 比如此次调查的古交市。建议采取主动措施对SCN进行防治, 避免发展到大豆大面积绝产、损失不可挽回时, 再考虑防治或重视抗病品种培育或进行抗病品种的推广应用。
据2012—2015年调查研究结果[4]发现, 山西省是国内大豆胞囊线虫感染最严重的地区, 因为致病力最强的4号小种主要分布在山西省, X12就是在此次调查研究过程中于山西省古交市邢家社乡采集的。2012—2015年在古交市仅取此1份土样, 难以反映X12小种发现地点周围生理小种分布情况; 其次, X12小种在该市其他田块是否也有分布以及是否有扩散现象, 是本研究关注的另一问题。本研究拟在前期调查研究的基础上, 以邢家社为中心, 在古交市大豆种植区域密集采取土样, 调查X12小种周围生理小种分布规律, 明确优势小种和X12小种的分布, 以期为防治X12小种扩散提供依据。
1 材料与方法
1.1 供试材料
Riggs模式鉴别寄主[5] (Lee、Peking、Pickett、PI88788和PI90763)和兴县灰皮支由河南省农业科学院经济作物研究所大豆课题组保存。1.2 土样采集
于2019年大豆生长期, 在山西省古交市调查大豆胞囊线虫分布情况, 在有大豆胞囊线虫感染地块取土样33份, 覆盖7个乡镇, 共33个村庄, 面积810 km2。取土依据是在根系上能看到胞囊或地上部分植株出现明显矮化和失绿, 采集病株周围3~8 cm深的土层, 每份土样20~30 kg。采集路线沿山内屯兰川、原平川、大川和北梁4条主干道开展。采集的样本用塑料袋封住后, 物流到河南省农业科学院, 保存在16℃病土储存室, 直至需要检测时取出。1.3 生理小种鉴定
参考练云等[4]方法, 略有改动, 简述之: (1)鉴定方式。所有采集的土样, 直接在温室利用Riggs模式鉴定。对于在Lee上胞囊数目少于100个胞囊/株的土样, 种植混合的Lee、Essex和郑1307扩繁1~2代胞囊后再通过接种进行生理小种鉴定。(2)胞囊繁殖。将子叶出土期的感病幼苗移栽至病土中, 每杯1株, 温室培养, 约25 d后, 采用淘洗-过筛法将胞囊从根系上分离, 用橡皮擦轻轻研磨, 破碎胞囊, 然后将释放出来的卵用清水悬浮, 取10 μL在显微镜下计数虫卵密度, 备用于接种鉴定。(3)接种方法。将壤土在150℃烘干1.5 h, 分装在塑料杯中, 移栽子叶出土期且生长一致的4个鉴别寄主及Lee、兴县灰皮支, 每杯1株, 5个重复, 待长出新根后, 每杯接含2500个卵的悬浮液。25 d左右、胞囊处于显囊盛期时, 计数根部胞囊数目。1.4 胞囊计数
将胞囊通过淘洗-过筛法从根系中分离, 利用荧光显微镜拍照, 结合本课题自主研发的PDS软件, 通过计算机扫描自动计数大豆胞囊数目, 具体方法见专利2014SR060158[18]。1.5 数据分析及小种分布图绘制
Lee上平均胞囊数目大于100, 认定此次试验数据有效, 否则扩繁该土样中的胞囊, 进行接种鉴定, 如果Lee上平均胞囊数目仍然达不到要求, 舍弃该样本, 根据Riggs模式判别生理小种类型。FI = (待鉴定植株根系上平均胞囊数目×100/Lee根系上平均胞囊数目)。检出频率 = (属某一种生理小种的样本数目/鉴定出生理小种类型的所有样本数目)×100%将各采样点鉴定出的小种类型, 利用统计分析软件R的Maptools包[19]绘制生理小种分布图。
2 结果与分析
在采集的33份病土中, 共有26份鉴定出生理小种类型, 其中15份直接利用采集的病土鉴定出生理小种类型, 另18份经繁殖1~2代后, 通过接种进行鉴定, 其中11份鉴定出生理小种类型, 7份由于未繁殖出足够用于鉴定的胞囊, 故舍弃。古交市生理小种分布见图1。图1
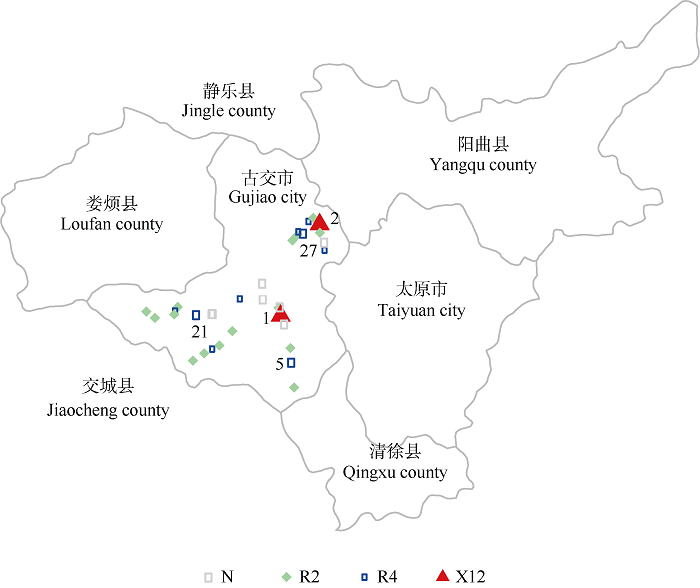 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1古交市大豆胞囊线虫新小种X12分布图(2019-2020年调查)
N: 受大豆胞囊线虫感染但未鉴定出结果的样本; R2: 2号生理小种; R4: 4号生理小种; X12: X12 新小种。红实心三角形1代表最初发现X12小种的地点; 红实心三角形2代表本次调查新发现X12小种的地点; 较大的蓝实心圆形代表有可能会优先由4号小种进化为X12小种的地点。
Fig. 1Race distribution of soybean cyst nematode of new race X12 in Gujiao city (surveyed in 2019 and 2020)
N: samples infected with SCN but without identification results; R2: race 2; R4: race 4; X12: race X12. Red solid triangle 1 stands for the original race X12 discovery location; red solid triangle 2 stands for determined as race X12 location according to this survey; the bigger blue solid circle stands for race 4 with potential prior determined as race X12 in the future.
图中所有彩色符号及灰色空心圆圈反映了受SCN感染的地块。15份样本鉴定为2号小种, 检出频率是57.7%; 11份样本鉴定为4号生理小种, 检出频率是42.3% (表1); 2号和4号小种交叉分布。在鉴定为4号生理小种的样本中, 有2个样本进一步鉴定为X12小种, 其中一份来自最初发现X12的采集地点——古交市邢家社, 在图中用红色实心三角形1表示, 另一份样本来自古交市河口镇, 在图中用红色实心三角形2表示, 这2个被检测为X12的样本, 在空间上有一定距离, 而且中间交叉分布有2号和4号小种, 可以排除古交市河口镇的X12小种由古交市邢家社样本感染所致; 在鉴定为4号生理小种的样本中, 有3份在兴县灰皮支上的胞囊数分别为20 (FI=7.6)、46 (FI=9.6)和16 (FI=6.4), 在黄淮海生理小种鉴定中, 在兴县灰皮支上生长的胞囊数目一般在0~6个 株-1, 而且0个 株-1的占多数。这3份土样有可能会优先发展为X12小种。
Table 1
表1
表1采集自古交市26份样本的生理小种类型鉴定(2019-2020年)
Table 1
| 小种类型a Race a (%) | 编号 Number | Lee上胞囊b Cysts on Lee b | 胞囊指数Female index | |||||
|---|---|---|---|---|---|---|---|---|
| Pickett | Peking | PI88788 (MU) | PI90763 | ZDD2315 | ||||
| 2号小种(57.7) Race 2 (57.7) | 1 | 95 | 98.9 | 270.7 | 85.1 | 1.9 | 1.1 | |
| 4 | 698 | 94.8 | 83.3 | 26.1 | 0.5 | 4.1 | ||
| 6 | 543 | 38.9 | 30.6 | 33.4 | 6.4 | 0.1 | ||
| 8 | 170 | 39.6 | 80.3 | 91.2 | 1.4 | 0.4 | ||
| 9 | 217 | 48.0 | 22.8 | 26.1 | 5.1 | 1.2 | ||
| 11 | 129 | 37.7 | 28.0 | 84.6 | 2.7 | 1.8 | ||
| 12 | 284 | 61.7 | 100.4 | 58.9 | 0.5 | 1.3 | ||
| 16 | 242 | 81.1 | 59.9 | 60.6 | 0.2 | 0.1 | ||
| 18 | 379 | 80.9 | 75.5 | 31.2 | 2.6 | 1.2 | ||
| 19 | 80 | 102.4 | 83.9 | 63.6 | 4.2 | 1.8 | ||
| 20 | 64 | 66.7 | 42.3 | 40.4 | 1.3 | 0.4 | ||
| 24 | 509 | 86.4 | 63.8 | 98.1 | 0.4 | 0.2 | ||
| 25 | 404 | 100.7 | 87.3 | 69.0 | 4.5 | 0.2 | ||
| 29 | 336 | 58.7 | 102.5 | 32.6 | 1.0 | 0.2 | ||
| 31 | 547 | 68.3 | 77.8 | 87.4 | 3.7 | 0.1 | ||
| X12小种c (7.7) Race X12 c (7.7) | 1 | 438 | 67.6 | 73.7 | 36.0 | 38.0 | 32.4 | |
| 2 | 520 | 93.3 | 79.8 | 84.7 | 94.1 | 10.7 | ||
| 小种类型a Race a (%) | 编号 Number | Lee上胞囊b Cysts on Lee b | 胞囊指数Female index | |||||
| Pickett | Peking | PI88788 (MU) | PI90763 | ZDD2315 | ||||
| 潜在的X12小种(11.5) Potential race X12 (11.5) | 5 | 258.6 | 173.9 | 86.1 | 69.8 | 39.0 | 7.6 | |
| 21 | 479 | 102.7 | 80.5 | 61.0 | 13.6 | 9.6 | ||
| 27 | 249 | 69.3 | 62.9 | 32.3 | 12.2 | 6.4 | ||
| 4号小种(23.1) Race 4 (23.1) | 10 | 298 | 91.6 | 61.5 | 55.6 | 15.2 | 1.1 | |
| 14 | 550 | 37.2 | 69.5 | 73.3 | 17.7 | 0.4 | ||
| 17 | 706 | 86.2 | 77.2 | 82.1 | 72.7 | 0.8 | ||
| 26 | 815 | 84.7 | 82.9 | 55.2 | 12.2 | 0.1 | ||
| 28 | 251 | 53.3 | 147.5 | 75.6 | 16.0 | 1.8 | ||
| 33 | 633 | 91.5 | 90.8 | 73.5 | 34.7 | 0.4 | ||
新窗口打开|下载CSV
鉴定出生理小种类型的所有26份SCN群体, 均能够侵染PI88788。PI88788的抗性基因是目前SCN抗性大豆品种的主要抗性来源, 说明SCN群体在PI88788上的致病力已经增强, 这种现象在美国中北部和中国东北也有报道: 据2005年调查结果发现, 在美国伊利诺伊州, 83%大豆田感染了大豆胞囊线虫病, 其中70%感染田块的线虫能够寄生在PI88788的根系上, 导致在该州使用现有抗性品种作为防治SCN手段的有效性显著降低[20]; 随后, 在美国其他大豆产区如密苏里州也逐渐发现有部分线虫群体克服PI88788抗性, 导致在PI88788上寄生的SCN胞囊指数升高[11]; 在中国东北大豆产区, 利用单胞囊繁殖法, 从HG type 0的SCN群体种分离出HG type 1.2.3.5.6.7、HG type 2.5.7及HG type 1.3 [21]。另外, 在本研究中, 所有这26份SCN群体均能够侵染Peking和Pickett, 34.6%的SCN群体能够侵染寄主PI90763, 表明需要慎重连续多年在同一田块使用抗性基因来自这些抗源的大豆品种, 建议注重同非寄主作物轮作并且重视使用来自其他抗源的抗性品种。
依据以上鉴定结果, 每种类型群体各选择1个生理小种群体, 利用HG type做进一步鉴定表明, 古交市存在1.2.5.6.7 (2号小种)、1.2.3.5.6.7 (4号和潜在优先发展为X12的小种)及1.2.3.4.5.6.7 (X12小种), 见表2。本研究结果也反映了现有的HG tpye不能区分开4号小种和潜在优先发展为X12小种群体。依据现有SCN群体, 尤其是X12小种的出现, 需要形成新的大豆胞囊线虫生理小种鉴定模式。
Table 2
表2
表2利用HG type模式鉴定采集自古交市不同生理小种类型的样本(2019-2020年)
Table 2
| 项目 Item | 寄主 Host | 编号 Number | |||
|---|---|---|---|---|---|
| 16 | 14 | 21 | 30 | ||
| Lee上胞囊数 Number of cysts on Lee | 482.7 | 156.0 | 787.0 | 340.7 | |
| 胞囊指数 Female index | Peking | 45.5 | 69.7 | 65.9 | 79.8 |
| PI88788 | 53.0 | 105.6 | 61.2 | 76.1 | |
| PI90763 | 3.5 | 18.2 | 14.4 | 12.7 | |
| PI437654 | 2.3 | 3.6 | 0.8 | 105.0 | |
| PI209332 | 15.8 | 50.3 | 14.4 | 87.4 | |
| PI89772 | 44.7 | 102.4 | 21.3 | 141.1 | |
| PI548316 | 70.0 | 81.8 | 12.5 | 161.7 | |
| 小种类型 Race | Race model | Race 2 | Race 4 | Potential X12 | Race X12 |
| HG type | 1.2.5.6.7 | 1.2.3.5.6.7 | 1.2.3.5.6.7 | 1.2.3.4.5.6.7 | |
新窗口打开|下载CSV
3 讨论
3.1 大豆胞囊线虫生理小种鉴别模式选择
目前对大豆胞囊线虫生理小种类型鉴别, 是利用不同鉴别寄主以区分致病力不同的线虫群体, 常用的方法有2个, 分别为Riggs和Schmitt[5]采用4个鉴别寄主建立的16个小种模式(Race模式), Niblack等[6]采用7个鉴别寄主建立的128个小种模式(HG type模式)。后一种方法将小种划分得更细。基于2种划分方法适宜的使用范畴, 本研究是从抗病育种目标出发, 同2012—2015年调查时一样, 仍认为小种不宜划分过细, 据已有研究结果表明, 线虫分布较为复杂, 划分过细容易给抗病品种选育及采取防御措施带来困惑。同时, 为了便于同国内已有研究结果进行对比分析, 本研究仍然选择使用Riggs鉴别模式对大豆胞囊线虫新小种X12分布进行研究。为了进一步从4号小种中鉴定出X12小种, 在鉴别模式中, 本研究增加了国内优异抗源兴县灰皮支。3.2 大豆胞囊线虫新小种X12分布及最初发现地点周围的生理小种分布概况
本研究是在前期调查研究的基础上, 对大豆胞囊线虫X12首次发现地点——古交市邢家社周围生理小种分布做进一步调查研究。在调查中, 途经每一个村庄的大豆或其他豆科作物田块, 均能在植物根系上看到胞囊, 表明古交市田间受大豆胞囊线虫侵染严重, 这与2012—2015年调查显示山西省感染SCN严重的结果相符。此次共采集病土33份, 其中26份鉴定出生理小种类型。由于X12是我们首次发现的具有超强致病力新小种, 因此, 为了进一步了解X12小种的分布, 本次调查以邢家社为中心, 开展了更为密集的取样, 研究结果比较系统地反映了X12首次发现地点周围生理小种分布的概况, 每份土样附有精确的经纬度记录, 这为今后进行周期监控研究奠定了基础。从本次调查结果来看, 古交市大豆胞囊线虫发生普遍, 2号和4号小种分别占57.7%和42.3%, 除2份4号小种被进一步鉴定为X12外, 未检测到其他类型的生理小种。在邢家社采集的样本本次鉴定结果仍是X12, 在生理小种分布图中标为1; 另一个鉴定为X12的是在古交市河口镇采集的样本, 在生理小种分布图中标记为2 (图1); 另外有3个样本, 其线虫群体可以在兴县灰皮支上寄生, 但尚未使兴县灰皮支达到感病水平, 这3个样本的采集地点在生理小种分布图中分别标记为5、21、27, 推测这3个采集地点SCN群体有可能会优先发展为X12小种。以上研究结果表明, 在不同地点发现了X12群体; 在X12周围仅存在2号、4号小种; 发现3份能在兴县灰皮支上寄生的4号SCN群体, 但是尚未达到感病水平。在这26份鉴定出生理小种类型的样本中, 其SCN群体均能在Peking、Pickett和PI88788上成功寄生。而且在Peking和 PI88788寄生的FI大于50的SCN群体分别占73.1%和57.7%, Peking和PI88788是目前被美国广泛利用的抗源[22]。另外, 在PI88788上的FI高的样本并不局限于土壤中胞囊虫卵浓度大的样本, 在11份通过扩繁胞囊并接种鉴定出生理小种类型的样本中, 其SCN群体在PI88788上的FI范围为26~85。据分析, 田间SCN群体在PI88788和Peking上寄生指数的增高, 是由于抗性来自PI88788的有限抗性品种的重复利用[12,23-24]。但就我们所知, 目前利用PI88788抗源培育的抗病品种尚未在山西推广应用。
3.3 在山西省出现超强致病力大豆胞囊线虫新小种X12的原因分析
多年来, 山西省一直是感染大豆胞囊线虫最严重的省份, 所以, 目前国内很多优异抗源也来自山西省。但是致病性较强的4号小种集中分布在山西省[4]以及X12小种在古交市被发现的原因, 尚不明晰。本研究做如下推测: 首先, 土质适宜。2012—2015年调查研究结果表明, 能鉴定出生理小种的土样集中分布在山西省、河北省和河南黄河沿岸, 这些属于沙性土壤的地区, 推测是沙性土质适宜大豆胞囊线虫滋生。其次, 气候适宜。山西省的气候适宜线虫繁殖, 古交市属于山区, 常年在7月份均温23℃, 平均年降水量428.60 mm, 这正是胞囊繁殖的季节。因而线虫群体通过内部多代杂交, 从而提高了其致病能力。第三, 在山西省, 目前尚缺乏抗病品种的推广应用, 是生理小种致病性增强的另一个原因。3.4 古交市大豆胞囊线虫生理小种分布特点及其对育种工作的启示
本研究结果表明, 在古交市仅检测到了2号、4号和X12生理小种, 再次表明大豆胞囊线虫分布有一定的区域性[4,10]。鉴于X12小种的超强致病能力, 目前又没有相应的抗源, 暂时限制了针对X12小种大豆抗病品种培育工作的开展。为缓解由X12小种扩散带来的经济损失, 建议从以下4个方面开展防御工作: (1)培育多抗品种。鉴于生理小种的交叉分布特点, 培育兼抗2个或2个以上生理小种的大豆品种, 在古交市推广应用; (2)加速抗源筛选。可通过扩大抗源筛选范围, 比如从大豆资源之外的其他豆科作物、野生豆中进行抗源筛选, 克隆抗病基因, 为培育抵御X12小种的大豆抗病品种提供资源; (3)依据当地政府力量, 引导农户采取与非豆科作物轮作, 适当采用化学剂杀虫对线虫进行毒杀, 即便付出更高的经济代价, 也要对已经发展为X12或会优先发展为X12的群体的田块进行防治, 以限制X12群体致病性的进一步升级和扩散; (4)定期调查古交市SCN生理小种分布。4 结论
古交市大豆胞囊线虫分布广泛、田间受害严重。经调查所有田块均有大豆胞囊线虫分布; 本次调查研究发现, 在X12首次发现地点邢家社周围集中分布有2号和4号小种, 此次调查在河口镇也发现了X12小种群体, 且有3个地点的SCN群体有可能会优先发展为X12小种; 当前应采取强有力的轮作措施或使用化学杀虫剂方案, 限制X12小种的扩散。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
URLPMID:10275108 [本文引用: 1]

Such factors as declining utilization, aging plant, and competition may contribute to a hospital's closing, but the ultimate cause of hospital failure can usually be found in the institution's financial books. Perhaps as many as 20 percent of the nation's hospitals will close in the next decade, usually because of insolvency. Ten specific principles of financial performance can help hospitals survive. Among these are the principles that operating profits should cover replacement cost of assets, that nonoperating sources of income are critical to product-line enhancement, and that growth of equity capital is the bottom line of survival. Careful attention should be given to Catholic hospitals' performance relative to the national norms. Financial Analysis Service data indicate a mixed showing in this regard, and in several areas both Catholic hospitals and hospitals in general need to improve.
[本文引用: 3]
[本文引用: 6]
[本文引用: 6]
URLPMID:19290228 [本文引用: 4]

One hundred thirty-eight isolates of Heterodera glycines from nine states in the United States, People's Republic of China, and Indonesia were tested on the four standard soybean race differentials. A total of 12 variants were found, including the five races described previously. The seven variants that did not correspond to one of the described races and reports from other areas of populations that could not be classified are evidence that the present race classification system needs to be fully characterized. Eleven additional races are described; this expands the total to 16 races, the maximum possible using the four prescribed differentials and a + or - rating for each. The seven new races are designated as 6, 9, 10, 13, 14, 15, and 16. This complete characterization of the race scheme will allow for immediate communication of the discovery of the remaining four races plus the identification of previous undescribed races.
URLPMID:19265945 [本文引用: 3]

Heterodera glycines, the soybean cyst nematode, is a major yield-limiting pathogen in most soybean production areas worldwide. Field populations of H. glycines exhibit diversity in their ability to develop on resistant soybean cultivars. Since 1970, this diversity has been characterized by a bioassay used to assign a race classification to a population. The value of the race scheme is reflected in the number and quality of resistant soybean cultivars that have been developed and released by soybean breeders and nematologists working in concert. However, the race scheme also has been misapplied as a means of studying H. glycines genotypes, in part due to the use of the term
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLPMID:26566850 [本文引用: 1]
[本文引用: 2]
[本文引用: 2]
DOI:10.1094/PDIS-91-11-1473URLPMID:30780744 [本文引用: 2]

The soybean cyst nematode, Heterodera glycines, is a serious economic threat to soybean producers in Missouri. Periodic monitoring for the presence, population densities, and virulence phenotypes of H. glycines is essential for determining crop losses and devising management strategies implementing the use of resistant cultivars. A survey using area-frame sampling was conducted to determine the distribution and virulence phenotypes of H. glycines in Missouri during 2005. Two samples from each of 125 fields representing eight geographical regions of Missouri were collected; 243 samples were processed for extraction of cysts and eggs. In all, 49% of samples had detectable cyst nematode populations, which ranged from 138 to 85,250 eggs per 250 cm(3) of soil. Race and H. glycines type tests were conducted on populations from 45 samples. Nearly 80% of the populations that were tested, irrespective of the region, were virulent on the indicator line plant introduction (PI) 88788, which is the source of resistance for most H. glycines-resistant cultivars. More than 70% of populations could reproduce on the indicator lines PI 88788, PI 209332, and PI 548316 (Cloud), indicating that soybean cultivars with resistance derived from these sources need to be carefully monitored and used only in rotation with nonhost crops and soybean cultivars with resistance from other sources. Approximately one-third of the populations, primarily in the southern regions of Missouri, could reproduce on PI 548402 (Peking), another common source of resistance. Fewer than 10% of the populations could reproduce on PI 90763, PI 437654, PI 89772, or PI 438489B, suggesting that these sources of resistance should be used in soybean breeding programs to develop H. glycines-resistant soybean cultivars.
[本文引用: 2]
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
[本文引用: 1]
URLPMID:30335911 [本文引用: 1]
DOI:10.2135/cropsci2004.1121URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
