 ,1,**, 靳晴2,**, 李召虎2, 王晔1, 彭真1, 段留生
,1,**, 靳晴2,**, 李召虎2, 王晔1, 彭真1, 段留生 ,1,2,*
,1,2,*Salicylic acid improved salinity tolerance of Glycyrrhiza uralensis Fisch during seed germination and seedling growth stages
LI Run-Zhi ,1,**, JIN Qing2,**, LI Zhao-Hu2, WANG Ye1, PENG Zhen1, DUAN Liu-Sheng
,1,**, JIN Qing2,**, LI Zhao-Hu2, WANG Ye1, PENG Zhen1, DUAN Liu-Sheng ,1,2,*
,1,2,*通讯作者:
收稿日期:2020-03-29接受日期:2020-07-2网络出版日期:2020-11-12
Received:2020-03-29Accepted:2020-07-2Online:2020-11-12
作者简介 About authors
李润枝, E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (501KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李润枝, 靳晴, 李召虎, 王晔, 彭真, 段留生. 水杨酸提高甘草种子萌发和幼苗生长对盐胁迫耐性的效应[J]. 作物学报, 2020, 46(11): 1810-1816. doi:10.3724/SP.J.1006.2020.04080
LI Run-Zhi, JIN Qing, LI Zhao-Hu, WANG Ye, PENG Zhen, DUAN Liu-Sheng.
近年来, 随着城市环境的治理, 人们对居住环境的要求越来越高, 建设生态型园林城市迫在眉睫。地被植物具有株型低矮、生长繁殖迅速、易于作覆盖裸露地表等特点, 对于提高绿地景观效果、维护生态平衡和保护环境具有十分重要的用。甘草(Glycyrrhiza uralensis Fisch)是原生沙漠旱区的豆科多年生草本植物[1], 其根可作为上品中草药, 同时其地下根系发达, 具有耐寒、耐旱和耐盐碱等优良特性, 是我国西北干旱与半干旱地区进行盐碱地改良和防风固沙的重要植物资源之一[2]。甘草具有生长期长、地面覆盖度高、地上茎叶养分含量高、养护成本低以及兼具观赏、生态和经济价值等特点, 是一种应用潜力较大的地被植物。
滨河湖海以及滩涂等边际性土地含盐量高的问题普遍存在, 城市园林绿地的土壤次生盐渍化也逐年加重[3]。尽管可以通过施用土壤改良剂、平整土地以及埋设地下渗管等方法对盐碱地进行改造, 但是上述方法耗资大、见效慢、效果持续时间短, 因此难以推广。而通过选用耐盐植物并集成配套栽培管理措施是加快盐渍化土壤应用的有效技术路径。
水杨酸(salicylic acid, SA)是一种天然植物激素信号分子, 在调节植物对生物和非生物胁迫的反应中发挥着重要作用, 且具有高效、低成本、无毒、无残留等特点[4,5]。大量研究表明, 一定浓度的外源SA可减轻盐胁迫对植物造成的危害, 在玉米[6]、水稻[7]、大豆[8]、马铃薯[9]、小麦[10]等作物的耐盐研究中均有报道。SA对植物耐盐性生理调控机制主要有诱导抗氧化防御系统并缓解膜脂过氧化、促进光合和呼吸作用、调控离子吸收与分布以降低离子毒害、调控物质代谢以改善营养状况与其他激素或信号物质间交叉作用。作物对外源SA吸收利用以及胁迫耐受能力因作物种类、基因型、发育阶段以及胁迫强度而存在较大差异[11]。前人研究表明, 盐胁迫对甘草种子萌发和幼苗生长有显著的影响[12,13], 而施用水杨酸是否能提高甘草耐盐性, 其调控效应与机制鲜有报道。基于上述原因, 本试验通过研究水杨酸对甘草种子在盐胁迫下萌发和幼苗生长相关形态、生理指标和甘草酸含量的影响, 探讨SA调控甘草种子萌发和幼苗耐盐性的生理机制, 以期为利用SA作为化学调控措施来缓解其盐害提供一种可行的途径, 同时也为甘草作为地被植物在城市盐渍化土壤中人工栽培提供理论依据。
1 材料与方法
1.1 试验材料
将供试乌拉尔甘草(Glycyrrhiza uralensis Fisch)种子用80%浓硫酸处理5 h, 再用蒸馏水将种子冲洗5遍, 去除所有残余浓硫酸, 并晾干备用。试验前, 选取均匀饱满、大小一致的甘草种子, 用1%的NaClO进行消毒处理10 min, 再用蒸馏水冲洗3遍, 去除残余NaClO, 用滤纸吸去多余水分, 室温下晾干。1.2 试验设计
1.2.1 种子萌发期盐胁迫试验 将种子均匀摆入铺有2层无菌滤纸的培养盒中, 每盒200粒左右, 加入无菌水7 mL, 培养54 h后, 更换滤纸, 加入SA溶液7 mL, 处理浓度为0 mmol L-1和0.5 mmol L-1(对照0以水代替), 培养12 h。12 h后, 分别选取2种处理下生长一致甘草种子。将从2种处理浓度中选取的种子分别均匀摆入铺有2层无菌滤纸的培养皿中, 每个培养皿放置50粒, 加入NaCl溶液3.5 mL, 处理浓度为0 mmol L-1和200 mmol L-1 (对照0以水代替), 即所有处理分别为CK0 (无盐胁迫+无SA处理)、SA0 (SA处理+无盐胁迫)、CK200 (无SA处理+200 mmol L-1 NaCl溶液胁迫)、SA200 (SA处理+200 mmol L-1 NaCl溶液胁迫)。SA处理浓度(0 mmol L-1和0.5 mmol L-1)和盐处理浓度(0 mmol L-1和200 mmol L-1)均由前期筛选试验分析得出。为保证盐浓度一致, 每3 d换2次滤纸。将所有培养盒和培养皿放入25℃的人工气候培养箱中培养。分别在盐胁迫1、6、12、24和72 h测定苗鲜重和胚根中甘草酸含量, 在72 h测定胚根长度和各项生理指标。每个处理设置4次重复, 每个重复选取3棵植株幼苗进行测定。1.2.2 幼苗生长盐胁迫试验 种子播种于装有沙子和草炭土(1﹕1)的培养钵(20 cm × 20 cm)中, 1个月后选取整齐一致的植株, 每盆定苗20株。在甘草幼苗苗龄2个月后喷施水杨酸, 处理浓度为0 mmol L-1和0.5 mmol L-1, 分别在处理开始时、处理第4天和第7天叶面喷施一次。其中, 处理浓度0 mmol L-1设为对照CK, 水杨酸处理记为SA。在SA处理开始后第4天进行NaCl处理, 处理浓度为0、100和200 mmol L-1, 每盆浇600 mL溶液, 当天为盐胁迫第1天; SA处理第7天(即盐胁迫第4天)再浇1次NaCl溶液, 最终形成6个不同处理, 分别为CK0 (无盐胁迫+无SA处理)、CK100 (无SA处理+100 mmol L-1 NaCl溶液胁迫)、CK200 (无SA处理+200 mmol L-1 NaCl溶液胁迫)、SA0 (SA处理+无盐胁迫)、SA100 (SA处理+100 mmol L-1NaCl溶液胁迫)、SA200 (SA处理+200 mmol L-1 NaCl溶液胁迫)。取在第1次喷施水杨酸后第10天(即盐胁迫第7天), 取生长一致的植株测定各项生理指标和甘草酸含量。每个处理设5盆重复, 每重复取5棵植株幼苗进行测定。
1.3 测定项目与方法
1.3.1 萌发指标的测定 利用千分之一天平(METTLER, ME203E)测定苗鲜重, 利用根系扫描系统(Win RHIZO, version 4.0b, Regent Instruments Inc., Quebec, Canada 2000)测定胚根长度。1.3.2 生理指标的测定 根据Dhindsa等[14]的方法测定超氧化物歧化酶(superoxide dismutase, SOD)活性, 参考Kar等[15]的方法测定过氧化物酶(peroxidase, POD)活性, 采用紫外吸收法[16]测定过氧化氢酶(catalase, CAT)活性; 采用Li等[17]的方法测定丙二醛(malondialdehyde, MDA)含量; 采用酸性茚三酮法[18]测定脯氨酸(proline)含量。每次测定重复3次。
1.3.3 甘草酸含量的测定 采用酶联免疫法[19]测定甘草酸含量。每次测定重复3次。
1.4 数据处理
用Microsoft Excel 2016整理试验数据并作图, 利用SPSS软件进行数据分析, 采用最小显著性差异法(least significant difference, LSD)分析各处理间差异。2 结果与分析
2.1 盐胁迫下水杨酸对甘草种子苗鲜重和胚根长度的影响
从表1可以看出, CK200和SA200的苗鲜重分别显著小于CK0和SA0 (P < 0.05), 表明200 mmol L-1 NaCl胁迫对萌发过程有显著的抑制作用。在无盐胁迫下, SA0的苗鲜重均大于CK0, 但差异不显著。在盐胁迫下, SA200的苗鲜重显著大于CK200, 且随着盐胁迫时间延长, 差异逐渐增大。表明水杨酸处理可以减小盐胁迫对苗鲜重的影响。水杨酸处理对盐胁迫下种子胚根的影响与以上结果一致(图1), 无盐胁迫下, 水杨酸处理对种子胚根的伸长无显著影响, 但在盐胁迫下, 水杨酸处理能显著减小盐胁迫对胚根的影响。Table 1
表1
表1水杨酸处理对盐胁迫下甘草苗鲜重的影响
Table 1
| 处理 Treatment | 处理时间 Treatment time | ||||
|---|---|---|---|---|---|
| 1 h | 6 h | 12 h | 24 h | 72 h | |
| CK0 | 35.3±1.0 ab | 43.6±2.3 a | 44.5±2.4 a | 48.5±2.6 a | 62.4±3.6 a |
| SA0 | 36.4±1.5 a | 44.7±1.7 a | 45.2±2.5 a | 49.1±1.9 a | 64.1±2.1 a |
| CK200 | 32.3±1.6 c | 33.2±0.9 c | 34.8±2.1 c | 37.4±1.0 c | 46.8±2.0 c |
| SA200 | 34.0±1.4 bc | 35.3±1.0 b | 38.6±0.5 b | 40.3±1.6 b | 52.9±1.9 b |
新窗口打开|下载CSV
图 1
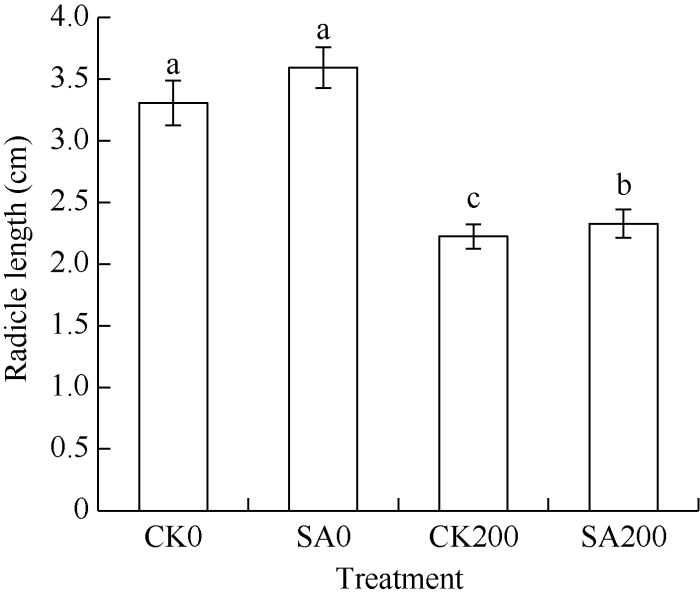 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图 1水杨酸处理对盐胁迫下甘草种子胚根长度的影响
处理同
Fig. 1Effect of salicylic acid on the radicle length of G. uralensis seeds under salt stress
Treatments are the same as those given in
2.2 盐胁迫下水杨酸对甘草种子和幼苗渗透调节物质含量和膜脂过氧化的影响
丙二醛(malondialdehyde, MDA)是膜脂过氧化的主要产物, 可以间接表示细胞膜的受伤程度。脯氨酸(proline)是植物体内重要的渗透调节物质。由图2可知, CK200和SA200的MDA含量和脯氨酸含量均显著高于CK0和SA0, 说明200 mmol L-1 NaCl胁迫对甘草种子膜系统的稳定性造成了影响。与CK0相比, SA0的MDA含量和脯氨酸含量差异不显著, 而SA200的MDA含量和脯氨酸含量显著小于CK200, 表明水杨酸处理可以缓解盐胁迫下MDA和脯氨酸的积累, 从而减轻盐胁迫对甘草种子的伤害。图 2
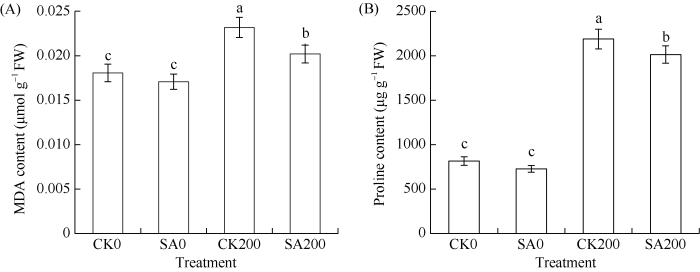 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图 2水杨酸处理对盐胁迫下甘草种子MDA(A)和脯氨酸(B)含量的影响
处理同
Fig. 2Effects of salicylic acid on the MDA content (A) and proline content (B) in G. uralensis seeds under salt stress
Treatments are the same as those given in
甘草幼苗的试验结果(图3)表明, 随着盐胁迫浓度的增加, MDA含量升高。在无盐胁迫条件下, CK0与SA0处理差异不显著。在100 mmol L-1 NaCl和200 mmol L-1 NaCl胁迫下, CA100和CA200处理下的MDA含量均显著低于CK100和CK200处理。由图4可知, 随着盐胁迫浓度的增加, 脯氨酸含量显著增加, 与CK0相比, CK100和CK200的脯氨酸含量分别增加了4.3倍和6.5倍。在100 mmol L-1 NaCl和200 mmol L-1 NaCl胁迫下, CA100和CA200的脯氨酸含量显著低于CK100和CK200。表明外源SA处理可以减少盐胁迫条件下渗透调节物质的积累和对膜的伤害, 减轻盐胁迫对甘草幼苗的伤害。
图 3
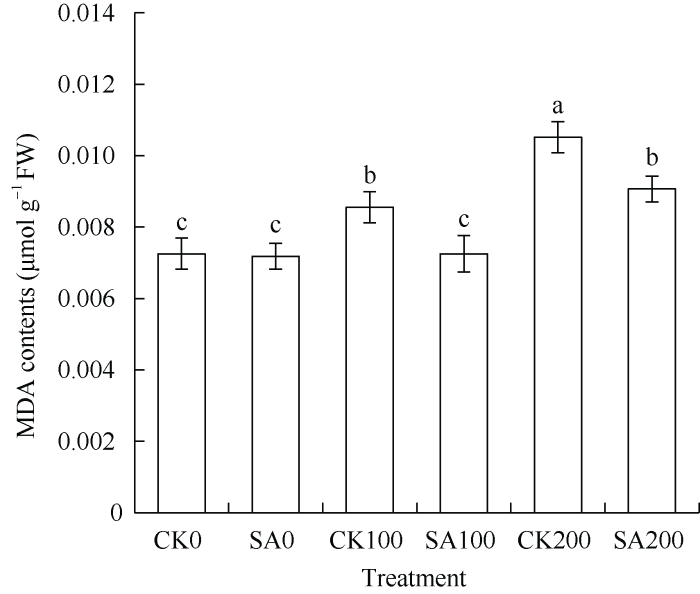 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图 3水杨酸处理对盐胁迫下甘草幼苗叶片中MDA含量的影响
CK0: 无SA处理+无盐胁迫; SA0: SA处理+无盐胁迫; CK100: 无SA处理+100 mmol L-1 NaCl溶液胁迫; SA100: SA处理+100 mmol L-1 NaCl溶液胁迫; CK200: 无SA处理+200 mmol L-1 NaCl溶液胁迫; SA200: SA处理+200 mmol L-1 NaCl溶液胁迫。MDA: 丙二醛。柱上不同小写字母表示在0.05水平上有显著性差异。
Fig. 3Effect of salicylic acid on the MDA contents in G. uralensis seedling leaves under salt stress
CK0: no SA treatment + no salt stress; SA0: SA treatment + no salt stress; CK100: no SA treatment +100 mmol L-1 NaCl stress; SA100: SA treatment +100 mmol L-1 NaCl stress; CK200: no SA treatment +200 mmol L-1 NaCl stress; SA200: SA treatment +200 mmol L-1 NaCl stress. MDA: malondialdehyde. Different letters above the bar mean significant difference at the 0.05 probability level.
图4
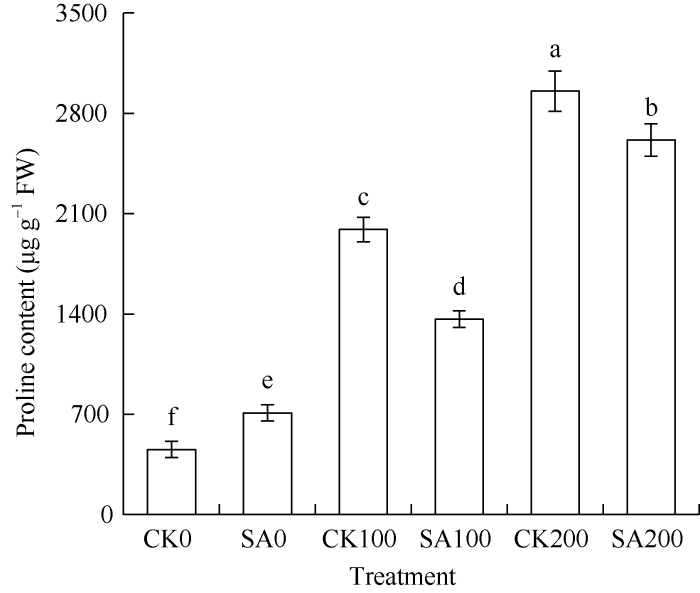 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4水杨酸处理对盐胁迫下甘草幼苗叶片中脯氨酸含量的影响
处理同
Fig. 4Effect of salicylic acid on the proline in G. uralensis seedling leaves under salt stress
Treatments are the same as those given in
2.3 盐胁迫下水杨酸对甘草种子和幼苗活性氧清除酶系统的影响
超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase, CAT)都是植物体内的自由基清除剂, 属于保护酶系统。由表2可知, CK200和SA200的SOD、POD、CAT活性均显著高于CK0和SA0, 说明在盐胁迫下甘草种子中氧化酶活性显著提高; SA0的SOD和CAT活性与CK0相比未达到显著水平, 而POD活性显著降低。与CK200相比, SA200的SOD和CAT活性显著下降, 而POD活性显著增高, 即无盐胁迫下, 水杨酸处理降低了甘草种子POD活性, 而盐胁迫下, 水杨酸处理提高了POD活性, 降低了SOD和CAT的活性。Table 2
表2
表2水杨酸处理对盐胁迫下甘草种子氧化酶活性的影响
Table 2
| 处理 Treatment | SOD活性 SOD activity (U g-1 FW) | POD活性 POD activity (OD470 g-1 FW min-1) | CAT活性 CAT activity (U g-1 FW min-1) |
|---|---|---|---|
| CK0 | 14±1.3 c | 33±1.8 c | 2.3±0.2 c |
| SA0 | 16±1.2 c | 25±1.7 d | 2.5±0.2 c |
| CK200 | 58±3.6 a | 56±2.7 b | 4.1±0.3 a |
| SA200 | 35±2.0 b | 67±3.7 a | 3.2±0.2 b |
新窗口打开|下载CSV
由表3可知, 在无盐胁迫条件下, 与CK0相比, SA0的SOD和POD活性无显著变化。SOD和POD活性均随着盐胁迫浓度增加而提高, 在100 mmol L-1 NaCl胁迫下, SA100的SOD活性显著高于CK100, 而POD活性的变化不显著。在200 mmol L-1 NaCl胁迫下, SA200的POD活性显著高于CK200, 而SOD活性的变化不显著。在无盐胁迫、100 mmol L-1 NaCl和200 mmol L-1 NaCl胁迫下, 0.5 mmol L-1 水杨酸处理后, 甘草幼苗中CAT的活性均显著高于对照。
Table 3
表3
表3水杨酸处理对盐胁迫下甘草幼苗叶片中氧化酶活性的影响
Table 3
| 处理 Treatment | SOD活性 SOD activity (U g-1 FW) | POD活性 POD activity (OD470 g-1 FW min-1) | CAT活性 CAT activity (U g-1 FW min-1) |
|---|---|---|---|
| CK0 | 64.4±4.3 a | 9.0±1.1 a | 27.3±1.6 b |
| SA0 | 64.4±3.6 a | 10.6±0.7 a | 39.5±1.2 a |
| CK100 | 108.2±8.1 a | 13.3±0.8 a | 27.6±1.2 b |
| SA100 | 80.5±5.6 b | 11.1±1.3 a | 39.9±0.9 a |
| CK200 | 130.9±7.6 a | 12.3±1.0 b | 27.2±2.0 a |
| SA200 | 144.3±9.2 a | 16.8±0.9 a | 32.6±1.5 b |
新窗口打开|下载CSV
2.4 盐胁迫下水杨酸对甘草种子和幼苗甘草酸含量的影响
由表4可知, CK200和SA200的甘草酸含量分别小于CK0和SA0, 说明盐胁迫抑制了甘草种子胚根中甘草酸的积累。SA200的甘草酸含量均高于CK200, 而且随着萌发时间的延长差异增大, 在胁迫24 h和72 h时差异达到显著, 说明水杨酸处理可以提高盐胁迫下甘草种子萌发过程中甘草酸的含量。Table 4
表4
表4水杨酸处理对盐胁迫下甘草种子甘草酸含量的影响
Table 4
| 处理 Treatment | 1 h | 6 h | 12 h | 24 h | 72 h |
|---|---|---|---|---|---|
| CK0 | 0.35±0.02 b | 0.45±0.12 ab | 0.73±0.09 ab | 1.69±0.29 ab | 4.62±0.52 b |
| SA0 | 0.45±0.03 a | 0.65±0.12 a | 0.95±0.10 a | 1.89±0.36 a | 5.81±0.32 a |
| CK200 | 0.19±0.01 c | 0.25±0.07 b | 0.38±0.15 b | 0.79±0.04 c | 2.64±0.21 c |
| SA200 | 0.33±0.03 b | 0.43±0.11 ab | 0.71±0.19 ab | 1.18±0.09 b | 3.86±0.45 b |
新窗口打开|下载CSV
由图5可知, SA0、SA100和SA200的甘草酸含量均显著高于CK0、CK100和CK200, 说明水杨酸处理甘草幼苗, 可以显著提高根中甘草酸的积累。CK100显著大于CK0和CK200, SA100显著大于SA0和SA200, 说明轻度盐胁迫(100 mmol L-1 NaCl)会提高甘草酸含量。
图5
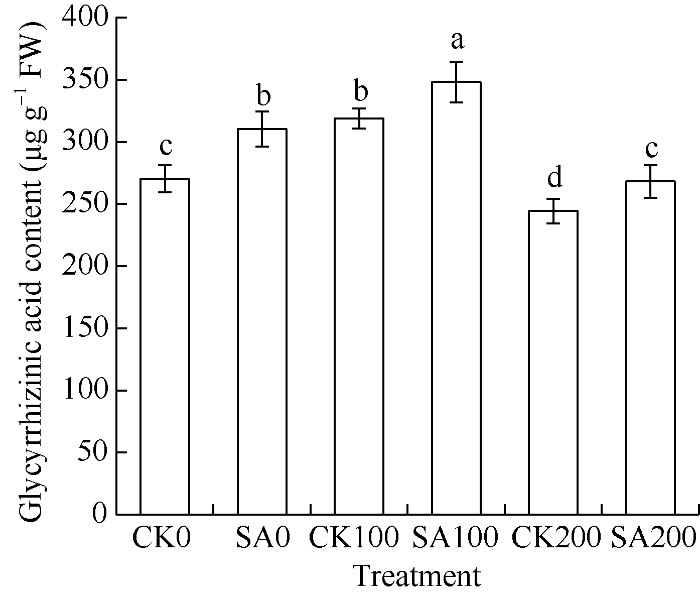 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5水杨酸处理对盐胁迫下甘草幼苗根中甘草酸含量的影响
处理同
Fig. 5Effect of salicylic acid on the glycyrrhizinic acid content in G. uralensis seedling roots under salt stress
Treatments are the same as those given in
3 讨论
对于大多数植物来说, 种子萌发和初期生长阶段对环境胁迫最为敏感, 所以常用种子萌发及其初期生长状况来评价植物的抗逆性[20]。生长特性是植物对盐胁迫的综合反应, 也是植物抗盐性的最优评价指标。本研究结果表明, 在无盐胁迫下, SA处理后幼苗鲜重和胚根长度均增加, 但差异不显著。在盐胁迫下, SA处理后幼苗鲜重和胚根长度比对照显著增加, 且随着盐胁迫时间的延长, 差异逐渐增大。这与朱伟等[11]的研究结果一致, 即SA处理可以减小盐胁迫对幼苗鲜重和胚根的影响。丙二醛含量是植物膜系统稳定与否的重要指标, 而膜系统稳定性的大小与植物抗盐能力密切相关。本研究结果显示, 盐胁迫条件下, 不论是SA浸种还是在苗期外施SA均抑制了甘草种子胚根和幼苗叶片中MDA积累引起的膜脂过氧化, 提高了甘草种子的抗盐能力, 这与SA对小麦盐害及水分胁迫的缓解作用机制相似[21]。
脯氨酸是植物重要的抗逆生理指标之一, 在遭受非生物胁迫时具有维持渗透调节平衡的作用。本试验结果表明, 盐胁迫条件下, 浸种和外施SA可显著降低脯氨酸的含量, 这与杨秀红等[22]的研究结果一致。有关脯氨酸在逆境中的作用有许多结论不同的报道, Flores等[23]认为, 胁迫植物中的高含量脯氨酸可作为抗逆性的重要因素, 相反, Upadhyaya等[24]认为, 脯氨酸的积累可以被看作是一种植物组织受到胁迫伤害的标志。根据以上结论, 我们可以推断内源游离脯氨酸含量与甘草种子的抗盐性密切相关。本试验中, 盐胁迫条件下, 外施水杨酸后脯氨酸的含量降低, 可能是由于盐胁迫积累的脯氨酸经脯氨酸氧化酶作用转化为氨基酸, 这些氨基酸合成了更多的蛋白质以缓解细胞的代谢紊乱, 降低了盐胁迫对甘草种子的伤害, 提高了抗盐性, 这一结果与TDM (triadimefon)改善黄瓜幼苗冷害的作用相似[25]。
SOD、POD和CAT是植物体内酶促防御系统的3个重要保护酶, SOD是抵御活性氧自由基介导的氧化损伤的第一道防线, 是保护酶体系中的关键酶, CAT和POD可清除H2O2[26]。本研究结果表明, 在无盐胁迫条件下, 水杨酸处理会显著降低胚根的POD活性, 但对SOD和CAT活性影响不显著。在盐胁迫条件下, 水杨酸处理可显著提高胚根POD活性, 但同时也显著降低了SOD和CAT活性。而水杨酸处理的甘草幼苗在不同盐浓度胁迫下, SOD、POD和CAT活性的变化是不一致的。在100 mmol L-1 NaCl胁迫下, SOD活性显著提高, 而POD活性变化不显著。在200 mmol L-1 NaCl胁迫下, POD活性显著提高, 而SOD活性变化不显著。Chen等[27]报道, 在胁迫下植物体内SA结合蛋白(SA-binding protein, SABP)基因与CAT基因高度同源, SA阻遏SABP的活性, 并抑制植物体内CAT活性, 以激活与抗逆有关基因的表达来提高植物的抗逆性。Tasgin等[28]对外源水杨酸在盐胁迫下对冬小麦抗氧化酶活性的影响, 以及刘爱荣等[29]对外源水杨酸在盐胁迫下对大豆抗氧化能力影响的结果是一致的。而SOD活性的降低, 可能是由于水杨酸抑制了膜脂过氧化, 增强了甘草种子自身的SOD活性, 降低了盐胁迫对种子的伤害, 因此在盐胁迫下无需过多的增加SOD活性就可以抵抗氧化伤害。同时POD活性的提高, 有效地控制了植物细胞内活性氧产生和清除失衡, 这一结果与佘小平等[30]对黄瓜幼苗的研究相符。这些研究结果说明, 在盐胁迫下3种酶协同作用, 保证了对超氧自由基的清除能力, 使细胞免受毒害, 提高对盐胁迫的抗性, 也揭示了外施水杨酸调节甘草种子中保护酶系统活性水平的复杂性。
甘草抗逆性与甘草酸含量的关系尚不明确。本研究结果表明, 低盐胁迫(100 mmol L-1 NaCl)可以提高甘草酸含量, 这与廖建雄等[31]的研究结果一致。杨秀红等[22]的研究表明, 外源甘草酸可削弱盐胁迫对甘草幼苗生长的抑制。在本试验中, 0.5 mmol L-1 SA处理甘草种子和幼苗, 可以显著提高盐胁迫下甘草酸含量。因此, 我们推测水杨酸处理提高甘草耐盐性可能与甘草酸含量的增加有关。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLPMID:16519911 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1002/jsfa.7989URLPMID:27507604 [本文引用: 1]

BACKGROUND: Potato is an important vegetable; however, salt stress drastically affects its growth and yield. A pot experiment was therefore conducted to assess salicylic acid efficacy in improving performance of potato cultivars, grown under salt stress (50 mmol L(-1) ). Salicylic acid at 0.5 mmol L(-1) was sprayed on to potato plants after 1 week of salinity application. RESULTS: Salt stress effects were ameliorated by salicylic acid effectively in both the studied cultivars. N-Y LARA proved more responsive to salicylic acid application than 720-110 NARC, which confirmed genetic variation between cultivars. Salicylic acid scavenged reactive oxygen species by improving antioxidant enzyme activities (superoxide dismutase, catalase, peroxidases) and regulating osmotic adjustment (proline, phenolic contents), which led to enhanced water relation and gaseous exchange attributes, and thereby increased potassium availability and reduced sodium content in potato leaves. Moreover, potato tuber yield showed a positive correlation with potassium content, photosynthesis and antioxidant enzyme activities. CONCLUSION: Salt tolerance efficacy of salicylic acid is authenticated in improving potato crop performance under salt stress. Salicylic acid effect was more pronounced in N-Y LARA, reflecting greater tolerance than 720-110 NARC, which was confirmed as a susceptible cultivar. Hence salicylic acid at 0.5 mmol L(-1) and cultivation of N-Y LARA may be recommended in saline soil. (c) 2016 Society of Chemical Industry.
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/s0076-6879(84)05016-3URLPMID:6727660 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLPMID:17006677 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLPMID:8415736 [本文引用: 1]
URLPMID:16519911 [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
