
*通讯作者(Corresponding author): 杨建平, E-mail: yangjianping02@caas.cn, Tel/Fax: 010-82105859 第一作者联系方式: E-mail: xiaoyang@caas.cn, Tel: 010-82109683
收稿日期:2015-12-16 接受日期:2015-12-22网络出版日期:2016-01-04基金:
摘要
关键词:作图技巧; 分子生物学文章; Excel; Photoshop
How to Prepare Figures in Articles of Molecular Biology?
XIAO Yang

Fund:
Abstract
Keyword:Figure preparation; Article of molecular biology;; Excel; Photoshop
Show Figures
Show Figures






















科技论文的文字写作和图版制作应为一个整体、相得益彰, 本文结合自己的工作和整理文章的经验, 介绍Microsoft Excel (简称Excel)和Adobe Photoshop (简称Photoshop)软件在处理免疫印迹、GFP荧光与GUS染色等分子生物学论文图版的一些基本原则与技巧。
1 Excel柱状图技巧Excel是一种非常有效的软件, 特别是柱状图, 不但能有效地展示实验结果, 而且可以利用不同颜色、填充、纹理等, 来强化视觉效果, 对展示结果和印证结论, 起到画龙点睛的作用。
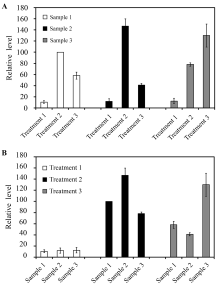
1.1 选择合适的横坐标和纵坐标Excel中隐藏着许多自动功能, 在作图时比较方便操作。初****应该了解Excel的自动功能, 学会选择合适的横坐标和纵坐标, 让图表充分体现自己的意图。以样品间分组的图1-A可用于比较样品1 (Sample 1)在处理1、2、3 (Treatments 1, 2, 3)间表现的差异, 通常情况下, 这样的比较没有太大实际意义。以处理间分组的图1-B主要体现在不同的处理(Treatments 1, 2, 3)中, 比较样品(Samples 1, 2, 3)间的差异。显然多数情况图1-B能更好地体现我们的实验意图。我们注意到很多学生在没有明确自己的作图目的, 用Excel的自动功能作了一张图, 结果图不达意。所以首先要明确自己作图之目的; 然后在Excel反复调整数据的排列组合, 直到得到一个体现自己实验设计的好图。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 Excel柱状图不同样品或处理间分组的比较Fig. 1 Comparison of histograms with different groups according to samples or treatments using Excel software |
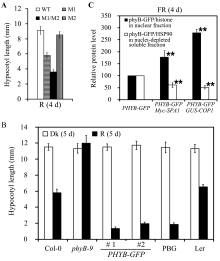
1.2 Excel中黑白柱状图用深色填充代表需要强调的项目图2-A中野生型(WT)用了空白柱状, Mutant 1 (M1)和Mutant 2 (M2)分别用了横线和竖线柱状, 而Double mutant (双突变体, M1/M2)用了全黑柱状, 从而突出了Double mutant显著低于WT和双亲(M1和M2)的效果。图2-B中黑暗条件下的下胚轴长度用了空白柱状, 而红光条件下的下胚轴长度用了全黑柱状, 黑暗条件下各株系没有差异, 用空白柱状在视觉上易被忽视, 即保持了数据的完整性, 又突显在红光条件下phyB-GFP的表现(显著抑制下胚轴伸长)。图2-C中细胞质中phyB-GFP蛋白的相对量用了空白柱状, 而细胞核中phyB-GFP蛋白的相对量用了全黑柱状, 突显了在远红光条件下Myc-SPA1和GUS-COP1能够促进phyB- GFP由细胞质到细胞核的转运(* * 表示Myc-SPA1和GUS- COP1背景下的phyB-GFP的含量与野生型背景下亲本有极显著的差异)。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 Excel柱状图用深色填充代表需要强调的项目Fig. 2 Dark color in histogram indicating the emphatic items when using Excel software |
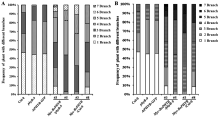
1.3 Excel中黑白柱状图用逐渐加重填充色代表需要强调项目的重要性图3为了显示Myc-BoPHYB的转基因在拟南芥中引起分枝增加, 图中纵坐标表示具有1~7个分枝的转基因植株占各自总株数的百分比; 在图3-B中, 我们将1个到7个分枝依此选用逐渐加深的填充图案, 视觉上能起到辅助突出结论效果: Myc-BoPHYB的转基因比起转基因的背景(Col-0或phyB-9)分枝显著增加。
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 Excel柱状图用逐渐加重填充色代表需要强调项目的重要性Fig. 3 Increasingly deepen color in histogram showing item importance when using Excel software |
1.4 彩色柱状图中尽量用同一种颜色代表同一个样品在同一篇文章, 尤其是同一张图版中, 尽量用同一种颜色代表同一个样品, 如图4-A、B和C中均用蓝色代表转基因株系PHYB-GFP, 用红色代表双突变体phyA-211/PHYB-GFP, 这样作者的思路很容易让读者把握。另外, 尽量在同一篇文章中图版、所有标注字体、字号和格式尽量一致; 柱状图的粗细、间隔尽量一致; 并且尽量采用普通常见的颜色。
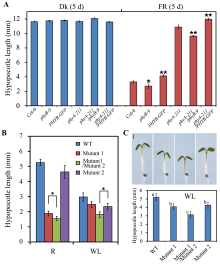
1.5 如何标注差异的显著性图5-A中, 根据学生t检验(Student’ s t-test)结果, 用星号表示phyB-9或PHYB-GFP与野生型(Col-0); 或者phyA-211/phyB-9或phyA-211/PHYB-GFP与phyA-211之间达到显著差异水平(P< 0.05* , P< 0.01* * ); 如果需要在图中指明哪两者有显著的差异, 可以参考下图5-B中的方式, 分别标出了在红光(R)或白光(WL)条件下, 双突变体(Mutant 1/Mutant 2)与Mutant 1或Mutant 2之间下胚轴长度达到显著差异; 在多个样品之间的同质性, 我们根据F检验结果, 采用下图4-C中的方法: 相同的字母表示相互之间差异不显著, 不同的字母表示差异达到显著水平。t检验和F检验具体计算参考统计学资料。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 Excel柱状图用同一种填充色代表同一个样品Fig. 4 The same color in histogram indicating the same item when using Excel software |
为了配合学生t检验在数据的测量时, 要把测量数据分成3个以上的组, 求每组平均数及组间的方差, 这样就可以进行学生t检验。举例说明: 把在3行中测量60株株高, 分成每行1组, 每组20株; 如果仅是单行需要测量60株, 可以把单行平分成3截, 每截测量20株。其他分组策略类推。
图5
Fig. 5
| Figure OptionViewDownloadNew Window | |
 | 图5 柱状图中标注差异显著性的常见3种方法Fig. 5 Three methods for marking significant differences in histogram |
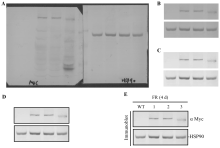
2 免疫印迹利用Photoshop的作图技巧2.1 免疫印迹图版处理的一般原则免疫印迹(Immunoblot)显色后, 将膜扫描入电脑(注意用NBT/BCIP显色时, 有时湿膜的扫描效果更好, 湿膜扫描时应注意保护扫描仪), 尽量使用较高的像素以确保图片的质量; 在Photoshop中新建一个文件, 大约20 cm × 20 cm (一般为灰色), 将扫描图像拖入新建文件中, 文件命名保存, 见图6-A; 然后在“ 显示额外” 的方格中, 把图片旋转、缩放到合适大小, 切去不需要的部分, 见图6-B; 主要通过对比度并结合亮度的调整, 使得条带清晰、背景较浅, 见图6-C; 对比度和亮度会影响对条带的差异程度产生一定的影响, 一定要适当; 积极实践、摸索、总结、提高; 由于免疫印迹图版边界较浅, 多数文章喜欢在图版的边缘加上线条, 起到突出图版的效果, 见图6-D; 给图版加上必要的信息和注释, 大功告成, 见图6-E。
图6
Fig. 6
| Figure OptionViewDownloadNew Window | |
 | 图6 免疫印迹图版对比度和亮度的调节Fig. 6 Adjustment of contrast and brightness on immunoblot membrane |
2.2 免疫印迹条带过淡反差较小时的作图技巧免疫印迹得到清晰反差大条带的方法: (1)用较好的凝胶系统; (2)适当增加上样量; (3)转膜低电压, 延长转膜时间; (4)一抗4℃过夜; (5)显色前用底物buffer洗膜; (6)用较低浓度的显色buffer显色(1/3~1/5); (7)显色过程中更换新的显色buffer。一旦上述措施不奏效, 不得不使用条带过淡反差较小的免疫印迹结果时, 如图7-A, 我们采用以下的措施作图: (1)将图A拖入Photoshop中; (2)将图7-A的亮度调到-50, 得到图7-B; (3)将图7-B的对比度调到+100, 得到图7-C; (4)重复步骤(2)~(3), 即将图7-C的亮度调到-50, 再将对比度调到+100, 得到图7-D; (5)将图7-D对比度调到+20, 得到图7-E; (6)可将图E转成黑白图版, 再按照上述2.1 (图6)的步骤, 完成图版, 见图7-F。想要发表高水平的文章, 尽量考虑重复实验。RT-PCR以及分子标记银染的图版处理, 也可以参考该部分免疫印迹的作图技巧。
图7
Fig. 7
| Figure OptionViewDownloadNew Window | |
 | 图7 免疫印迹条带过淡反差较小图版对比度和亮度的调节Fig. 7 Adjustment of contrast and brightness on immunoblot membrane with weak bands |
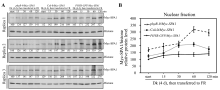
2.3 如何对免疫印迹结果量化对免疫印迹条带进行量化, 可以用具体数字代替文字描述, 会使结果更具说服力。由免疫印迹膜(如图8-A)变成具体的图表(如图8-B), 多数杂志会要求有3次独立的生物学重复。大家先看例子: 我们试图证明在远红光(FR)条件下拟南芥光敏色素B (phyB)能促进SPA1的核聚集, 我们在3种phyB水平的背景(缺失突变体phyB-9、野生型Col-0和过量表达PHYB-GFP)下比较了转基因Myc-SPA1在细胞核中的积累。图8-A是3次重复免疫印迹的结果, 将Myc-SPA1和核蛋白对照Histone条带量化, 二者比值的相对值做成图8-B。在图8-B中我们清晰可见, 随着phyB的增加, 从phyB-9、野生型Col-0和过量表达PHYB-GFP三种背景下, Myc-SPA1的核聚集逐级增强。可见, 图8-B比图8-A的效果会好很多, 并且文章中更容易叙述。Myc-SPA1和Histone条带的灰度值用ImageJ (http://rsb.info.nih.gov/ij/)量化, 黑暗中(Dk)二者的比值设为100, 其他条带的量化值通过与黑暗中的比例计算而来。请按照相关软件和文献[1]和[4]操作。
图8
Fig. 8
| Figure OptionViewDownloadNew Window | |
 | 图8 免疫印迹条带的量化Fig. 8 Band quantification of immunoblot results |
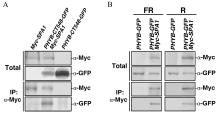
2.4 Co-IP免疫印迹应注意的事项:Co-IP是证明蛋白间互作, 并形成复合体的经典方法。Co-IP可以用下列样品: 烟草叶片混合注射样品, 如图9-A; 双转基因株系样品, 如图9-B; 也可以用2个单转基因株系的混合液。Co-IP免疫印迹应注意的事项: (1)认真配制Co-IP反应样品提取液, 有时需要加上一些蛋白降解的抑制剂; (2)反应样品液(称为Total或Input)和沉淀(IP)分别需要做两种蛋白的免疫印迹, 如图9的α -Myc和α -GFP; (3) Co-IP要设置合理的阴性对照, 如图9-A中Myc-SPA1和PHYB-CT548-GFP的烟草叶单个载体注射样品为阴性对照, 如图9-B中单转基因株系PHYB-GFP为阴性对照。
图9
Fig. 9
| Figure OptionViewDownloadNew Window | |
 | 图9 Co-IP免疫印迹图版的处理Fig. 9 Adjustment of immunoblot results on Co-IP results |
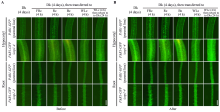
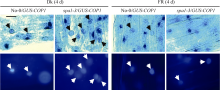
3 蛋白荧光与GUS染色图版处理技巧3.1 调整GFP图版明暗和对比度的原则: 在两种背景下比较GFP荧光强度时, 必须拼合为一个整体, 一起调整图10中, 在使用GFP荧光, 来比较转基因PAR1- GFP在野生型和cop1-4突变体两种背景下的PAR1- GFP蛋白积累的差异时: 可以先将相同条件拍照的图版按图10-A的形式整理好; 如果图版确实有些暗, 可以将图版在Photoshop中拼合成一个整体, 然后调整明暗和对比度到合适的程度; 图10-B显示, 无论是黑暗或由黑暗转入不同的光照条件下, 在cop1-4突变体比在野生型背景下均能积累更多的PAR1-GFP蛋白, 间接证明COP1介导PAR1的降解。
图10
Fig. 10
| Figure OptionViewDownloadNew Window | |
 | 图10 需要比较GFP荧光强度图版的处理Fig. 10 Adjustment of GFP images when strengthening fluorescence intensity |
3.2 蛋白荧光互作作图技巧蛋白荧光证明2个蛋白互作和是否形成复合体的经典方法, 包括GFP、YFP和RFP; BIFC和Luferase双分子互补; 免疫荧光等。可以用下列样品: 烟草叶片注射(快速); 双转基因株系(材料丰富); 原生质体(真实); 洋葱表皮细胞(效果好)。蛋白荧光应注意的事项: (1)DAPI细胞核染色; (2)每一种荧光单独的对照, 例如Myc-SPA1和PHYB-GFP; (3)有时需要空载体的对照(图11)。
图11
Fig. 11
| Figure OptionViewDownloadNew Window | |
 | 图11 蛋白荧光互作图版的处理Fig. 11 Adjustment of fluorescence images showing protein-protein interaction |
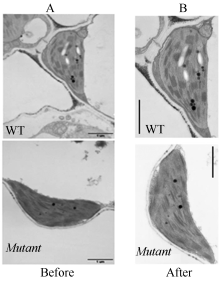
3.3 GUS染色作图技巧GUS染色是启动子表达部位分析和蛋白定位的常用方法。GUS染色应注意的事项: (1)蛋白需要核聚集的应采用DAPI细胞核染色, 如图12; (2)需要在两种不同的遗传背景下比较某一蛋白核聚集的差异, 应选用相同的部位, 并且染色、脱色应该尽可能一致; (3)照片拍摄的参数、图版处理的方法应该一致。
图12
Fig. 12
| Figure OptionViewDownloadNew Window | |
 | 图12 GUS染色图版的处理Fig. 12 Adjustment of GUS staining images |
4 其他图版处理4.1 如何画拟南芥插入T-DNA突变体基因图以SPA2(SPA1-RELATED 2)基因为例: 进入The Arabidopsis Information Resource (https://www.arabidopsis.org/)网站。在Search栏中, 填入基因号, 如SPA2: AT4g11110, 双击Locus中下方的基因号: AT4g11110, 即进入SPA2详细描述网页。下载Map Detail Image中的Protein Coding Gene Models图, 如下图13-A。在PPT中拖入下载图片, 调整到理想大小, 在下方用黑框或者下调画出基因模式图, 以及T-DNA插入位置, 如下图13-B。也可以从PPT中拷到Photoshop软件中进一步处理。
图13
Fig. 13
| Figure OptionViewDownloadNew Window | |
 | 图13 拟南芥SPA2基因插入T-DNA突变体基因图Fig. 13 Diagram of the genomic structure of SPA2 gene and the T-DNA insertion |
4.2 为了突显双突变体, 将其置于2个亲本中间基因功能研究中, 往往需要构建双突变体, 其用途是比较一个突变体或者转基因株系在不同突变体背景下的遗传表型和分子、生化鉴定。在作图中, 把双突变体放在2个亲本中间, 有助于突出双突变体与亲本的差异。例如: 下图14-A, Col和RLD分别是单突变体cop1-6和spa1-3对应的野生型, 双突变体spa1-3/cop1-6比双亲(cop1-6和spa1-3)更矮、花青素积累更多(颜色更深)。图14-B中, COP1-OE/ SPA1-OE极其显著的高于COP1-OE和SPA1-OE。(双突变体有的文章中要求有一个空格, 而不是斜线, 如spa1-3/cop1-6, 但是需要用斜体)。如果有2个以上的双突变体一同展示, 其中共用一个亲本(GFP-HFR1, B4)的话, 这个亲本放在前面, 如下图14-C。当然对应的野生型(WT)和GFP-HFR1转基因的突变体背景(hfr1-201), 需要放在恰当的位置上。同一种处理, 尽量在同一种放大倍数拍摄, 这样给定一个标尺(scale bar)即可, 如下图10-B和C中的FR、R、B; 如果不能, 每张照片需要放上一个标尺, 如下图14-A。
图14
Fig. 14
| Figure OptionViewDownloadNew Window | |
 | 图14 突显双突变体的位置是置于2个亲本中间Fig. 14 Double mutants located between two parental lines for strengthening their importances |
4.3 图版通过切除、放大、对比与明暗度调节突出主题每次实验尽量选用相似的背景、明暗和对比度, 准备一批图版, 反复对比挑选理想的图版; 原图一般在大小、角度和细节上不一定十全十美(图15-A), 通过切除、旋转、放大/缩小、对比度、明暗度的调节, 达到去除多余、杂乱的背景和突出主题的效果(图15-B)。科技文献要求真实反映客观事实, 而非提供漂亮的照片, 任何图片必须清晰、自然、客观和为主题服务, 除以上提到的方法以外, 其余的方法应严格禁止: 如喷涂、拼接。
图15
Fig. 15
| Figure OptionViewDownloadNew Window | |
 | 图15 图版通过切除、放大、对比与明暗度调节突出主题Fig. 15 Image adjustment through excision, magnification, contrast and brightness for strengthening its importance |
4.4 酵母双杂液体测试结果的作图技巧酵母双杂是证明2个蛋白互作的经典方法之一, 可以做平板测试(plate assay)和液体测试(liquid assay), 前者通过显色的深浅来表示2个蛋白互作的强弱, 后者是通过测定多个单克隆酶活来计算2个蛋白互作强度的相对值。酵母双杂不但能证明2个蛋白间互作, 还能进一步明确2个蛋白间的互作区段。下面我们通过具体事例来说明(图16): (1)为了证明拟南芥光敏色素B (phyB)与SPA1的互作, 将phyB-CT548构建到DNA结合区段的载体LEX中, 而SPA1的不同功能区段连接到DNA激活区段载体GAL4中; (2)载体LEX与GAL4-SPA1的不同功能区
段作为阴性对照, 进行液体测试; 我们将SPA1的不同功能区段放在左边, 而液体测试的β -半乳糖苷酶(β -galactocidase)相对酶活性放在右边, 并且左右图间通过调整大小形成对应, 这样很容易得出结论phyB的C端主要与SPA1的C端互作。
图16
Fig. 16
| Figure OptionViewDownloadNew Window | |
 | 图16 酵母双杂液体测试结果的图版处理Fig. 16 How to display the results of liquid assay of yeast two-hybrid |
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| 3 | |
| [3] | |
| [4] | |
| [5] | |
| [6] |
