
 , 彭宇, 孙树臣, 涂赣峰
, 彭宇, 孙树臣, 涂赣峰 东北大学 冶金学院, 辽宁 沈阳 110819
收稿日期:2020-11-13
基金项目:国家重点研发计划项目(2020YFC1909003)。
作者简介:肖发新(1980-), 男, 江西吉安人, 东北大学副教授;
涂赣峰(1964-), 男, 江西萍乡人, 东北大学教授, 博士生导师。
摘要:以高碱性脉石低品位氧化铜矿为研究对象, 针对该矿样钙镁含量高的特点, 采用氨水-硫酸铵浸出体系进行了常温常压浸出实验.针对该矿样的主要含铜矿物孔雀石(Cu2(OH)2CO3), 基于质量和电荷的双守恒的条件下构建的浸出体系中建立Cu2(OH)2CO3-(NH4)2SO4-NH3-H2O的热力学模型, 采用Matlab的拟合功能与diff和solve函数算出不同硫酸铵浓度时氨浸出孔雀石的最佳氨浓度和总铜离子浓度.实验考察了浸出氨水浓度、氨铵比、液固比对铜浸出率的影响.实验结果表明, 高碱性脉石氧化铜矿石适宜浸出条件为氨水浓度1.2 mol/L, 氨铵比2∶1, 液固比3∶1, 该条件下铜浸出率较高, 达到约70%.实验结果与热力学计算结果基本吻合.
关键词:氨浸氨铵比热力学(NH4)2SO4-NH3-H2O体系高碱性脉石低品位氧化铜矿
Leaching of High-Alkaline Gangue Low-Grade Copper Oxide Ore in (NH4)2SO4-NH3-H2O Solution
XIAO Fa-xin

 , PENG Yu, SUN Shu-chen, TU Gan-feng
, PENG Yu, SUN Shu-chen, TU Gan-feng School of Metallurgy, Northeastern University, Shenyang 110819, China
Corresponding author: XIAO Fa-xin, E-mail: xiaofx@smm.neu.edu.cn.
Abstract: A low-grade copper oxide ore with highly alkaline was treated. According to the characteristics of the solution with the high content of calcium and magnesium, ammonia-ammonium sulfate leaching system was adopted to conduct leaching experiment for recovering copper from a low-grade oxidized copper ore. The thermodynamic model of Cu2(OH)2CO3-(NH4)2SO4-NH3-H2O was established in the leaching system of malachite (Cu2(OH)2CO3) under the condition of double conservation of mass and charge. The fitting function of the Matlab software and the diff and solve functions were used to calculate the optimal ammonia concentration and total copper ion concentration of malachite under different ammonium sulfate concentrations, respectively. Parameters, such as ammonia concentration, ammonia-ammonium ratio and liquid-solid ratio were optimized. The results indicate that the appropriate conditions include an ammonia concentration of 1.2 mol/L, an ammonia-ammonium ratio of 2∶1 and a liquid-solid ratio of 3∶1. Under these conditions, the copper leaching rate reaches ~70%. The calculated results are basically consistent with the experimental measurements.
Key words: ammonia leachingammonia ammonium ratiothermodynamic(NH4)2SO4-NH3-H2O systemhigh-alkaline gangue low grade copper oxide
铜是一种重要的金属资源, 由于其机械性能、导电及导热方面的优势, 广泛用于电子电气、机械制造、国防军工等领域.我国铜矿资源已查明储量的基数大, 但由于贫矿多、富矿少的铜矿床特点, 经济可采储量相对偏少[1-2], 随着高品位硫化铜矿不断消耗, 对于低品位氧化铜矿的利用势在必行[3-4], 其中高碱性脉石型低品位氧化铜矿是典型的氧化铜矿, 国外主要分布在刚果(金)、赞比亚[5]; 国内主要分布在我国的新疆、云南、四川和内蒙古地区, 如:云南东川氧化铜矿、四川乐山氧化铜矿和新疆的砂岩氧化铜矿[6].高碱性脉石型低品位氧化铜矿具有碱性脉石含量高、氧化率高、含泥量高、品位低的“三高一低”特征, 矿石中多金属混杂, 如:钙、镁、铝等杂质金属, 其中钙、镁所形成的碱性脉石约占矿石中总矿物的20%~40%, 是这类矿石碱性高的主要原因.此外, 矿石中的矿物以氧化物为主, 矿石的氧化率和结合率都很高, 属于典型的难处理低品位氧化铜矿[7-8].
低品位氧化铜矿常采用硫酸浸出的方式, 但针对高碱性脉石型低品位氧化铜矿若采用常规酸浸工艺, 不仅耗酸量大、经济效益小, 而且在浸出过程中产生的大量硫酸钙吸附在矿堆上发生板结现象, 严重恶化后续的溶液渗透效果, 而若采用氨浸工艺处理该类矿物, 则能避免钙、镁等高碱性物质浸入溶液中, 保证铜氨溶液中铜的纯度[9-10].目前国内外针对该类矿物大都采用氨浸[11-13], 但这些研究中氨水浓度均较高, 达到2 mol/L以上, 由于高浓度氨水在生产中容易挥发及腐蚀设备, 恶化操作环境, 难以在工业上大规模推广.因此研究低氨浸出对高碱性脉石低品位氧化铜矿的工业应用具有重要意义.
本文以难处理高碱性脉石低品位氧化铜矿为研究对象, 针对该矿样的主要含铜矿物孔雀石, 基于质量和电荷双守恒的条件下构建的浸出体系中建立Cu2(OH)2CO3-(NH4)2SO4-NH3-H2O的热力学模型, 进行热力学计算.在此基础上, 对氨水浸出实验进行了验证.
1 实验内容1.1 实验原料矿样取自刚果(金)某高碱性脉石氧化铜矿, 金属矿物主要有孔雀石(Cu2(OH)2CO3)、蓝铜矿(Cu3(OH)2(CO3)2)、赤铜矿(Cu2O)、辉铜矿(Cu2S)、铜蓝(CuS); 脉石矿石主要有石英、方解石.矿样的主要化学成分列于表 1.
表 1(Table 1)
| 表 1 矿样的主要化学成分(质量分数) Table 1 Chemical compositions analysis of copper oxide ore(mass fraction) ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
由表 1可知, 原矿中铜品位较低, 脉石主要成分为硅、钙、镁和铝, 属于典型的高碱性脉石低品位氧化铜矿.经过ICP定量分析, 测得矿样Cu质量分数仅为0.89%.对该矿样进行粒度分析, 结果见表 2.
表 2(Table 2)
| 表 2 粒度分析结果 Table 2 Granularity composition analysis results |
由表 2可知, 试样-7.29 μm粒级占33.85%, 其中7.29~74.12 μm占60.52%.
1.2 实验方法因该矿样含有大量的钙盐和镁盐, 如果采用酸浸, 则会在浸出的过程中产生硫酸钙和硫酸镁微溶物堵塞浸出通道, 这样会延长浸出周期、降低浸出效率、增加生产成本.因此, 实验中采用氨浸来进行浸出实验.操作步骤如下.
称取5.00 g矿粉于50 mL锥形瓶中, 加入一定浓度的氨水-硫酸铵溶液, 在带有集热式磁力搅拌器的水浴锅中加热, 温度升至设定温度后搅拌并计时.反应结束后抽滤, 将浸出液定容至50 mL, 用铜试剂分光光度计法分析其中铜的质量浓度, 计算铜浸出率.
1.3 浸出原理氨浸法是对高碱性脉石低品位氧化铜矿最有效的浸出手段, 矿石中的铜通过与氨生成稳定的络合离子浸入溶液中, 而杂质钙、镁等金属不参加反应, 从而使目的金属与杂质金属钙、镁等分离.氨浸法的优点是浸出剂用量少, 选择性高, 得到的溶液纯度高.
主要氧化铜矿为孔雀石、蓝铜矿、赤铜矿、辉铜矿、铜蓝, 其氨浸反应方程式分别如下.
 | (1) |
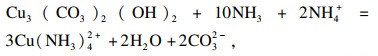 | (2) |
 | (3) |
 | (4) |
 | (5) |
溶液中各离子的活度系数很难获取, 因此本文的计算均采用浓度来代替活度, 体系中相关配合离子的稳定常数(25℃)如表 3所示.
表 3(Table 3)
| 表 3 相关配合离子的稳定常数 Table 3 Stability constants of related complex ions |
2.1.1 热力学模型建立Cu2(OH)2CO3-(NH4)2SO4-NH3-H2O体系存在以下物相:Cu2+, Cu(NH3)j2+(j=1, 2, 3, 4, 5), Cu(OH)k2-k(k=1, 2, 3, 4), CuNH3(OH)+, CuNH3(OH)3-, Cu(NH3)2(OH)2(aq), NH3, NH4+, HnCO32-n(n=1, 2), CuCO3·Cu(OH)2(aq), H+, OH-, SO42-, CO32-.
当体系中平衡固相为Cu2(OH)2CO3时, 其在溶液中的溶解方程式为[17]
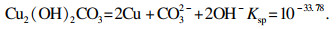 | (6) |
 | (7) |
 | (8) |
 | (9) |
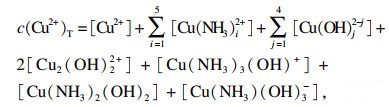 | (10) |
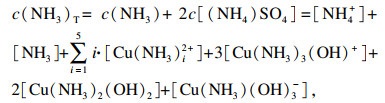 | (11) |
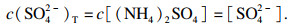 | (12) |
 | (13) |
将溶液中铜组分指数方程以及相应系数分别代入式(10)~(13), 并以氨浓度c(NH3)和硫酸铵浓度c[(NH4)2SO4]为自变量, 让其在0~5 mol/L之间变化, 这样溶液未知变量的个数为4个, 通过使用Matlab软件中的fsolve函数求解上述方程组可求出溶液中的其他组分浓度.
2.1.2 热力学结果1) c(NH3)和c[(NH4)2SO4]关系曲面图.
根据式(10)~(13)计算结果, 得到Cu2(OH)2CO3-NH3-(NH4)2SO4-H2O体系中[NH3], pH, [SO42-]和c(Cu2+)T随c(NH3)和c[(NH4)2SO4]在0~5 mol/L之间的关系, 如图 1~图 4所示.
图 1(Fig. 1)
 | 图 1 游离氨浓度的平衡曲面Fig.1 Free ammonia concentration equilibrium curved surface |
图 2(Fig. 2)
 | 图 2 pH值的平衡曲面Fig.2 pH equilibrium curved surface |
图 3(Fig. 3)
 | 图 3 游离硫酸根浓度的平衡曲面Fig.3 Free sulfate concentration equilibrium curved surface |
图 4(Fig. 4)
 | 图 4 总铜浓度的平衡曲面Fig.4 Total copper concentration equilibrium curved surface |
从图 1~图 3可以看出, 游离氨浓度受到c(NH3)和c[(NH4)2SO4]共同控制, 但主要由c(NH3)提供, c[(NH4)2SO4]起到的作用非常小, c(NH3)对pH升高有促进作用, c[(NH4)2SO4]对pH升高起抑制作用, 当c(NH3)在0~1 mol/L之间, pH与c(NH3)成线性关系, 游离硫酸根离子由c[(NH4)2SO4]提供且随着c[(NH4)2SO4]增加而增加, 由图 4可知, c(Cu2+)T受到c(NH3)和c[(NH4)2SO4]共同影响, 在氨-硫酸铵体系中, 已知铜氨络合离子是溶液中的主要离子, 而溶液中的氨主要由c(NH3)提供, 硫酸铵在该体系中起到调节溶液中氨浓度和pH的作用, 但不能精确表示c(Cu2+)T随着c(NH3)和c[(NH4)2SO4]的具体变化规律, 为此, 需要进一步分析.
2) c(Cu2+)-c(NH3)和c[(NH4)2SO4]关系曲线图.
由图 4容易看出c(Cu2+)T随c(NH3)和c[(NH4)2SO4]变化的关系, 但不能精确表示具体变化规律, 将图 4分别向平面c(NH3)-0-c(Cu2+)T和c[(NH4)2SO4]-0-c(Cu2+)T进行投影, 得到c(Cu2+)T分别与c(NH3)和c[(NH4)2SO4]的平面图, 如图 5~6所示.
图 5(Fig. 5)
 | 图 5 c(Cu2+)T随c(NH3)的变化关系Fig.5 The relationship between c(Cu2+)T and c(NH3) |
图 6(Fig. 6)
 | 图 6 c(Cu2+)T随c[(NH4)2SO4]的变化关系Fig.6 The relationship between c(Cu2+)T and c[(NH4)2SO4] |
由图 5可知, c(Cu2+)T与c(NH3)是近似线性关系, 当c[(NH4)2SO4]>3 mol/L时, c(Cu2+)T随c(NH3)增加而直线增加, 而当c[(NH4)2SO4] < 3 mol/L时, c(Cu2+)T随c(NH3)增加而近似直线增加.说明当c[(NH4)2SO4]一定时, 随着溶液中c(NH3)增加, 会促进Cu(NH3)j2+的生成, 并加速矿石中Cu2(OH)2CO3的溶解, 进而导致溶液中c(Cu2+)T增大; 这说明在平衡过程中, 增加c(NH3)有利于提高浸出过程中c(Cu2+)T.
由图 6可知, 溶液为纯硫酸铵溶液时, 孔雀石的溶解度非常小, 也就是说纯硫酸铵基本不能浸出孔雀石, 当c(NH3)=0~5 mol/L的范围内, c(Cu2+)T先随c[(NH4)2SO4]增加而增加再逐渐趋于平缓, 在这一变化过程可以观察曲线有一个明显的转折点, 即为曲线的拐点, 但由于方程组数量较多且形式复杂, 难以通过公式运算的方法求得.因此, 采用直线搜索的算法, 先以氨浓度0 mol/L为起点, 初始搜索步长为0.1, 通过以0.5为一个区间长度对图 6中横坐标进行区间划分判断拐点可能出现的区间, 再对拐点可能出现的区间的硫酸铵浓度以0.1 mol/L为间隔进行取点, 代入式(10)~(13)算出总铜离子浓度, 将上述的氨分别与硫酸铵和总铜离子浓度进行拟合得到拟合程度大于0.99的方程, 再对方程求导得到曲线拐点所对应的氨、硫酸铵和总铜离子浓度的值, 进行下一轮搜索.通过这种方法可获得不同硫酸铵浓度时氨浸出孔雀石的最佳氨浓度, 如图 7所示.
图 7(Fig. 7)
 | 图 7 c[(NH4)2SO4]与c(NH3)的关系Fig.7 The relationship between c[(NH4)2SO4] and c(NH3) |
由图 7可知, 当c[(NH4)2SO4]=0~1.5 mol/L的区间内, c(NH3)随c[(NH4)2SO4]的变化呈现出单峰函数的关系, 峰值出现在c[(NH4)2SO4]=0.6 mol/L附近, 当c[(NH4)2SO4]>1.5 mol/L, 曲线呈现上升趋势且增长速率持续变大.在此基础上, 绘制最佳氨铵比时c(Cu2+)T与c(NH3)的曲线如图 8所示.
图 8(Fig. 8)
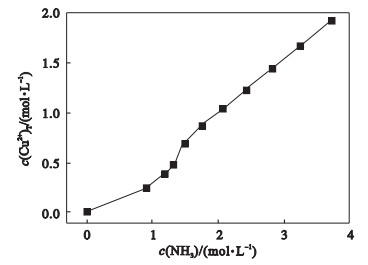 | 图 8 最佳氨铵比下c(Cu2+)T与c(NH3)的关系Fig.8 The relationship between c(Cu2+)T and c(NH3) under the best ammonia-ammonium ratio |
图 8表明, 随着氨水浓度增大, 铜理论浸出率持续增加.根据热力学计算结果(图 6~图 8)可知, 当硫酸铵浓度为0.6 mol/L, 氨水浓度为1.3 mol/L时, 铜浸出率较高.
2.2 浸出工艺条件对浸出率影响2.2.1 氨水浓度对铜浸出率的影响反应条件:浸出温度25 ℃, 转速240 r/min, 液固比2:1, 氨铵比2:1, 浸出时间4 h, 结果图 9所示.
图 9(Fig. 9)
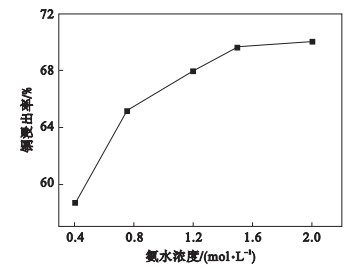 | 图 9 氨水浓度对铜浸出率的影响Fig.9 The influence of ammonia concentration on copper leaching rate |
由图 9可知, 氨水浓度对铜浸出率影响显著, 随着氨水浓度增加, 铜的浸出率逐渐提升.当氨水浓度由0.4 mol/L增加到1.2 mol/L, 铜浸出率提高了9.3个百分点, 因此, 可以适当提高氨水浓度, 有利于矿石中铜的浸出.但氨水浓度过高, 浸出体系pH值升高, 而过高的pH值会导致氨水稳定性变弱, 挥发性增强, 造成氨气大量挥发, 大大降低设备使用寿命.所以, 氨水浓度应选择为1.2 mol/L.
2.2.2 氨铵比对铜浸出率的影响上述其他实验条件不变, 当氨水浓度为1.2 mol/L时, 氨铵比对铜浸出影响如图 10所示.
图 10(Fig. 10)
 | 图 10 氨铵比对铜浸出率的影响Fig.10 Effect of ammonia-ammonium ratio on copper leaching rate |
由图 10可知, 氨铵比对铜浸出率的影响并不明显.在氨水浓度一定的条件下, 随着硫酸铵用量增加, 铜的浸出率逐渐提升, 但氨铵比由2:1变化到1:4时, 铜浸出率仅提高了2%.因此, 氨铵比应选择为2:1.
2.2.3 液固比对铜浸出率的影响上述其他实验条件不变, 当氨铵比为2:1时, 液固比对铜浸出率影响如图 11所示.
图 11(Fig. 11)
 | 图 11 液固比对铜浸出率的影响Fig.11 The effect of liquid-solid ratio on copper leaching rate |
由图 11可知, 随着液固比增加, 铜的浸出率逐渐提升, 随着液固比由2:1变化至3:1时, 铜浸出率提高了1.4%, 这是因为较好的液固比会降低料浆的黏度, 增加料浆与浸出剂之间的接触面积, 提高矿石中铜的浸出效果.因此, 液固比应选择为3:1.
综上所述, 高碱性脉石氧化铜矿石适宜浸出条件为氨水浓度1.2 mol/L, 氨铵比2:1(硫酸铵浓度为0.6 mol/L), 液固比3:1, 该条件下铜浸出率较高, 达到约70%.对照热力学计算结果得到的硫酸铵浓度为0.6 mol/L, 氨水浓度为1.3 mol/L条件下, 浸出率较高, 实验结果与理论分析基本吻合.
3 结论1) 对矿样的主要含铜矿物孔雀石建立Cu2(OH)2CO3-(NH4)2SO4-NH3-H2O的热力学模型计算, 采用Matlab的拟合功能与diff和solve函数算出不同硫酸铵浓度时氨浸出孔雀石的最佳氨浓度和总铜离子浓度, 当硫酸铵浓度为0.6 mol/L, 氨水浓度为1.3 mol/L时, 浸出率较高.
2) 实验表明, 高碱性脉石氧化铜矿石适宜浸出条件为氨水浓度1.2 mol/L, 氨铵比2:1(硫酸铵浓度为0.6 moL/L), 液固比3:1, 该条件下铜浸出率较高, 达到约70%.实验结果与理论分析基本吻合.
参考文献
| [1] | Rosenberg R, Edelstein D C, Hu C K, et al. Copper metallization for high performance silicon technology[J]. Annual Review of Materials Research, 2000, 30: 229-262. |
| [2] | 熊靓辉, 李调丽, 张会琼, 等. 国内外铜矿资源供需现状及趋势分析[J]. 矿产勘查, 2019, 10(2): 159-164. (Xiong Liang-hui, Li Tiao-li, Zhang Hui-qiong, et al. Analysis on supply and demand status and trend analysis of copper resources in the world and China[J]. Mineral Exploration, 2019, 10(2): 159-164. DOI:10.3969/j.issn.1674-7801.2019.02.001) |
| [3] | Liu M L, Wen J K, Tan G K, et al. Experimental studies and pilot plant tests for acid leaching of low-grade copper oxide ores at the Tuwu Copper Mine[J]. Hydrometallurgy, 2016, 165: 227-232. DOI:10.1016/j.hydromet.2016.04.009 |
| [4] | Yin S H, Wang L M, Wu A X. Enhancement of copper recovery by acid leaching of high-mud copper oxides: a case study at Yangla Copper Mine, China[J]. Journal of Cleaner Production, 2018, 202: 321-331. DOI:10.1016/j.jclepro.2018.08.122 |
| [5] | 宋志鹏. 刚果(金)氧化铜矿碳酸铵浸出——负压蒸氨的工艺研究[D]. 长沙: 中南大学, 2008. (Song Zhi-peng.Study on process of ammonium carbonate leaching of the D.R.Congo copper oxide ore: negative pressure distillation[D].Changsha: Central South University, 2008. ) |
| [6] | 王成彦. 低品位铜湿法冶炼的现状及发展趋势[J]. 新疆地质, 2001, 19(4): 281-284+287. (Wang Cheng-yan. Situation and developing trend of copper hydrometallurgy in China[J]. Xinjiang Geology, 2001, 19(4): 281-284+287. DOI:10.3969/j.issn.1000-8845.2001.04.010) |
| [7] | Hao M, Wang P, Song L L, et al. Spatial distribution of copper in-use stocks and flows in China: 1978-2016[J]. Journal of Cleaner Production, 2020, 261: 121260. DOI:10.1016/j.jclepro.2020.121260 |
| [8] | Han J W, Liu W, Xue K. Influence of NH4HF2 activation on leaching of low-grade complex copper ore in NH3-NH4Cl solution[J]. Separation and Purification Technology, 2017, 181: 29-36. DOI:10.1016/j.seppur.2017.03.012 |
| [9] | 李强, 郜伟, 阮书峰. 低品位氧化铜钴矿的直接还原浸出[J]. 矿冶, 2019, 28(3): 60-63. (Li Qiang, Gao Wei, Ruan Shu-feng. Direct reduction leaching of a low-grade copper-cobalt oxide ore[J]. Mining and Metallurgy, 2019, 28(3): 60-63.) |
| [10] | Deng J S, Wen S M, Deng J Y. Extracting copper from copper oxide ore by a zwitter ionic reagent and dissolution kinetics[J]. International Journal of Minerals Metallurgy and Materials, 2015, 22(3): 241-248. DOI:10.1007/s12613-015-1067-1 |
| [11] | Bing?l D, Canbazolu M. Dissolution kinetics of malachite in ammonia/ammonium carbonate leaching[J]. Hydrometallurgy, 2005, 76: 55-62. DOI:10.1016/j.hydromet.2004.09.006 |
| [12] | Gargul K. Ammonia leaching of slag from direct-to-blister copper smelting technology[J]. AIMS Materials Science, 2020, 7(5): 565-580. DOI:10.3934/matersci.2020.5.565 |
| [13] | Alban T, Olak S, Yeilyurt M. Optimization of leaching of copper from oxidized copper ore in NH3-(NH4)2SO4 medium[J]. Chemical Engineering Communications, 2005, 192: 1515-1524. DOI:10.1080/009864490896106 |
| [14] | 曹才放, 王旭, 赵天瑜, 等. CuO-CO2-NH3-H2O体系孔雀石浸出的热力学分析[J]. 有色金属科学与工程, 2014, 5(5): 82-86. (Cao Cai-fang, Wang Xu, Zhao Tian-yu, et al. Thermodynamic analysis of leaching malachite in CuO-CO2-NH3-H2O system[J]. Nonferrous Metals Science and Engineering, 2014, 5(5): 82-86.) |
| [15] | Liu W, Tang M T, Tang Z B, et a1. Thermodynamics of solubility of Cu2(OH)2CO3 in ammonia-ammonium chloride-ethylenediamine(En)-water system[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(2): 336-343. DOI:10.1016/S1003-6326(09)60143-6 |
| [16] | Smith R M, Martell A E. Critical stability constants Vol 4:inorganic complexes[M]. New York: Plenum Press, 1976: 31-133. |
| [17] | Li Y, Kawashima N, Li J, et al. A review of the structure, and fundamental mechanisms and kinetics of the leaching of chalcopyrite[J]. Advances in Colloid & Interface Science, 2013, 197/198: 1-32. |
