

1. 中国科学院沈阳应用生态研究所 污染生态与环境工程重点实验室,辽宁 沈阳 110016;
2. 中国科学院大学,北京 100049
收稿日期:2021-06-02;接收日期:2021-08-20;网络出版时间:2021-08-24
基金项目:国家重点研发计划(No. 2019YFC1804400),国家自然科学基金(Nos. 41673126, 41907287, 41977295),中国科学院前沿科学重点研究计划(No. ZDBS-LY-DQC038),辽宁省“兴辽英才计划”(No.XLYC1807139) 资助
作者简介:杨毅??博士,中国科学院沈阳应用生态研究所研究员、博士生导师。2007、2009年于武汉大学获得环境工程、法学双学士学位、环境工程硕士学位;2012、2016年于美国田纳西大学获得环境工程硕士和博士学位;2017年至2018年在美国佐治亚大学海洋科学系从事博士后研究;2018年5月进入中国科学院沈阳应用生态研究所工作。多年来一直从事环境微生物及其应用研究,包括发现新型一氯乙烯厌氧降解微生物(Dehalogenimonas),分离两株低pH值有机氯厌氧降解微生物(Sulfurospirillum),以及利用VBA语言开发BioPIC工具用于污染场地清除技术评估等。近年来主持国家自然青年科学基金项目、中科院重点实验室开放基金课题项目、中国科学院基础前沿科学研究计划从0到1原始创新项目、“场地土壤污染成因与治理技术”重点专项子课题等项目.
摘要:1, 2, 3-三氯丙烷(1, 2, 3-trichloropropane,1, 2, 3-TCP) 是一种人工合成的脂肪族氯代烃,在工、农业生产中得到广泛应用。1, 2, 3-TCP作为环氧氯丙烷工业生产的中间产物,可作为前体物质用于生产土壤熏蒸剂、有机溶剂等。因其环境持久性、迁移性和生态毒性,国内外机构逐渐开始关注该有机氯污染物的环境归趋、生态健康风险和环境管控。当前,1, 2, 3-TCP污染物的降解与场地修复仍然是研究热点,但是对于1, 2, 3-TCP降解转化机制尚缺乏深入研究与总结。鉴于此,文中在讨论1, 2, 3-TCP的来源、环境污染、生态效应及物理化学降解方法与技术等的基础上,进一步综述了1, 2, 3-TCP的微生物降解与修复机制(如好氧共代谢降解、厌氧降解等);重点讨论了地下水等厌氧环境中1, 2, 3-TCP的厌氧微生物降解转化途径与机制,并从热力学角度论证了厌氧条件下1, 2, 3-TCP作为电子受体被有机卤呼吸微生物利用并降解的可行性;最后,对1, 2, 3-TCP污染场地原位生物修复进行了总结并对未来研究发展方向进行了展望。
关键词:1, 2, 3-三氯丙烷污染修复生物降解有机卤呼吸细菌
Fdvances in degradation mechanisms of 1, 2, 3-trichloropropane and remediation technology of contaminated sites
Yaozhi Zhang1,2, Huijuan Jin1,2, Xiuying Li1, Yufang Song1, Jun Yan1, Yi Yang1


1. Key Laboratory of Pollution Ecology and Environmental Engineering, Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, Liaoning, China;
2. University of Chinese Academy of Sciences, Beijing 100049, China
Received: June 2, 2021; Accepted: August 20, 2021; Published: August 24, 2021
Supported by: National Key Research and Development Program of China (No. 2019YFC1804400), National Natural Science Foundation of China (Nos. 41673126, 41907287, 41977295), Key Research Program of Frontier Sciences, Chinese Academy of Sciences (No. ZDBS-LY-DQC038), LiaoNing Revitalization Talents Program (No. XLYC1807139)
Corresponding author: Yi Yang. Tel: +86-24-83970426; E-mail: yangyi@iae.ac.cn.
Abstract: 1, 2, 3-trichloropropane (TCP) is an industrially synthesized aliphatic chlorinated hydrocarbon and an intermediate product in the industrial production of epichlorohydrin, which can be used as a precursor for the manufacture of soil fumigant and organic solvents. Due to its biological toxicity, environmental persistence and strong environmental migration ability, 1, 2, 3-TCP is listed as an emerging organochlorine pollutant in the environment and regulated by many international organizations. Currently, the degradation of 1, 2, 3-TCP and the remediation of 1, 2, 3-TCP-contaminated sites receive great attention, but the degradation mechanism of 1, 2, 3-TCP has not been summarized in depth. This article discussed the origin of 1, 2, 3-TCP, its environmental impact and ecological effects, and the physical and chemical degradation techniques. This was followed by summarizing the degradation mechanisms of 1, 2, 3-TCP (e.g., aerobic co-biodegradation, anaerobic biodegradation). Specially, the pathways and mechanisms of microbial biodegradation and transformation of 1, 2, 3-TCP in anoxic environments (e.g., groundwater) were thoroughly reviewed. The feasibility of using 1, 2, 3-TCP as an electron acceptor by organohalide-respiring bacteria under anoxic conditions was predicted based on thermodynamic analysis. Last but not least, in situ bioremediation of 1, 2, 3-TCP contaminated sites was summarized, and prospects for future research were discussed.
Keywords: 1, 2, 3-trichloropropaneremediationbiodegradationorganohalide-respiring bacteria
1 1, 2, 3-三氯丙烷的来源、环境污染及危害1, 2, 3-三氯丙烷(1, 2, 3-TCP) 是一种人工合成的有机溶剂,作为环氧氯丙烷生产的主要副产物,它的年产量高达1.14×104 t/年,约占世界总产量的12.29%[1-2]。1, 2, 3-TCP也是很多化学品生产的中间体及其他有机溶剂合成的原材料。例如,它是土壤熏蒸剂1, 3-二氯丙烯、矮壮素及燕麦敌等农药的前体物质[3]。1, 2, 3-TCP在工、农业生产中也有着十分广泛的用途,如油漆稀释剂、除漆剂和脱脂剂中均含有1, 2, 3-三氯丙烷[4]。1, 2, 3-TCP经氟化后也可用于弹性体聚合材料的合成(如交联剂六氟丙烯)。
正是由于1, 2, 3-TCP的广泛、大量使用,使其成为了环境中常见的有机污染物之一[5-6]。1, 2, 3-TCP在土壤中具有较强的迁移能力,导致其能逐渐渗透进入地下水环境,造成严重的有机氯污染。例如,2019年在美国加利福尼亚州圣华金河谷地区的地下水样品中1, 2, 3-TCP检出率较高,其原因是20世纪50年代加州当地曾大量使用1, 2, 3-TCP来生产农药和土壤熏蒸剂。在我国的地下水环境中1, 2, 3-TCP也有被检出的报道。例如,张华等发现在有机化工原料桶清洗厂的地下水中检测出浓度高达83.2 μg/L的1, 2, 3-TCP,该浓度远超出荷兰地下水干涉值标准(11 μg/L)[7]。地下水中的高检出率主要是由于1, 2, 3-TCP降解的速率相对较慢,在25 ℃、pH 7的环境条件下降解半衰期长达(680±180) 年,导致1, 2, 3-TCP可长期持久性地存在于地下水环境中[4, 8],成为地下水中难降解的持久性有毒有害有机污染物之一[9]。
Robert等研究发现,1, 2, 3-TCP具有潜在致癌、致病、致突变等毒性作用。当1, 2, 3-TCP的浓度达到1.36×10–6 mol/L时会对人体产生毒性效应,而浓度高于5.29×10–6 mol/L则会产生潜在致癌效应[10]。鉴于此,1, 2, 3-TCP被美国有毒物质和疾病登记局(Agency for Toxic Substances and Disease Registry,ATSDR)列入优先污染物名单(Substance priority list,SPL) (https://www.atsdr.cdc.gov/spl)。该名单中共有857种危险有毒有害化合物,而1, 2, 3-TCP则位列第275位。美国环境保护署(Environmental Protection Agency,EPA,https://www.epa.gov) 和欧盟化学品管理局(European Chemicals Agency,ECHA,https://echa.europa.eu) 等国际机构和组织对日用品或地下水中1, 2, 3-TCP的含量进行了管控。1, 2, 3-TCP还被世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC) 和中国食品药品检定研究院等机构列入二A类疑似致癌物清单(https://www.iarc.who.int)。2020年天津市生态环境局更新的天津市建设用地土壤污染风险管控和修复名录中将1, 2, 3-TCP列为土壤和地下水的主要污染物(http://sthj.tj.gov.cn/ZWGK4828/ZCWJ6738/sthjjwj/202012/t20201209_4728633.html)。
2 1, 2, 3-三氯丙烷的降解转化与修复技术近年来,研究者针对1, 2, 3-TCP的生物与非生物降解转化进行了相关研究。非生物降解方法中的物理法主要包括物理吸附法、热脱附法和气相抽提法;化学法主要包括化学氧化法和化学还原法,如芬顿(Fenton) 和类芬顿氧化法、臭氧氧化法和过硫酸盐氧化法等。化学还原法中最常见的是零价金属材料化学还原法,即利用零价金属材料化学还原降解1, 2, 3-TCP等有机氯污染物。而生物降解主要是通过厌氧或好氧微生物的自身代谢活动(例如,能量代谢、共代谢、合成代谢等) 来利用1, 2, 3-TCP,使其降解转化为无害物。针对1, 2, 3-TCP污染场地当前修复技术的优点与问题汇总如表 1所示。
表 1 1, 2, 3-TCP污染及场地修复技术的优点与问题Table 1 Pros and cons of the currently available technologies for 1, 2, 3-TCP remediation
| Methods | Advantages | Limitations |
| Physical remediation | Low remediation cost; easy to operate; suitable for ex-situ | Weak adsorption capacity; low efficiency |
| Chemical remediation | Efficient; easy to implement | May cause secondary pollution; short-lived; influencing the environmental conditions |
| Bioremediation | Environmentally friendly; sustainable; easy to prepare and manufacture | Extended degradation period |
表选项
2.1 物理修复物理修复的原理是利用物理过程将污染物从污染介质中去除或分离[11]。其中,物理吸附作为处理挥发性有机物常见方法之一,对低浓度有机污染物去除效率较高。活性炭因其孔径分布广、微孔发达、吸附过程快等特点成为当前用途最广的吸附剂;同时,活性炭的非极性、疏水性表面使它对非极性物质的吸附有较好的选择性[12]。热脱附法则是通过直接或间接加热方式将污染介质加热至足够高的温度,使得污染物等受热挥发而与之分离,并利用特殊设备收集气态污染物[13]。气相抽提法是一种真空抽提或通风技术,是去除土壤中挥发性有机物的一种原位修复技术,其工艺原理是将新鲜空气通过管道注入土壤污染区域,由空气解吸并携带土壤中的挥发性有机物,通过抽气井流回到地面上收集并处理[11]。
目前在土壤和地下水中进行原位修复1, 2, 3-TCP污染的难度较大[14],通常使用颗粒活性炭(Granular activated carbon,GAC) 吸附或通过真空抽提技术来处理被污染的地下水和土壤[4]。例如,对加利福尼亚州和夏威夷州地下水中1, 2, 3-TCP的去除就主要依靠以颗粒活性炭为主的物理方法;对宾夕法尼亚州费城附近被1, 2, 3-TCP污染的土壤及地下水的修复则采用真空抽提法,然后将抽出的水和蒸气再用活性炭处理,以达到去除1, 2, 3-TCP的目的[15]。但由于1, 2, 3-TCP挥发性较低、土壤分配系数低和溶解度较高等特点,导致曝气法、抽提法和颗粒状活性炭等修复技术均不能有效地将低浓度的1, 2, 3-TCP从受污染介质中去除[15]。因此,可通过联合物理修复方法和其他修复方法(例如生物修复技术) 来达到彻底清除土壤和地下水中存在的1, 2, 3-TCP等污染物的目的。
2.2 化学氧化法化学氧化法是一种可将环境中难分解的有机污染物直接矿化的修复方法,其原理是将反应过程中产生的强氧化性自由基作为主要氧化剂降解有机污染物,使有机污染物矿化为无害物CO2和H2O,包括芬顿(Fenton) 和类芬顿氧化法、臭氧氧化法、过硫酸盐氧化法等,其降解方式可总结为图 1[4]。芬顿氧化法是将羟基自由基作为中间产物,通过氢提取、亲电加成及电子转移等机制实现有机污染物降解[16]。该方法具有很强的氧化性,需在Fenton体系内引入其他还原剂以提高并控制羟自由基的生成速率和数量[17]。芬顿试剂在pH 2–4酸性条件下降解1, 2, 3-TCP的能力最佳,而O3/H2O2体系也可以在中性条件下快速氧化1, 2, 3-TCP产生CO2和HCl。由于O3和H2O2很难直接氧化1, 2, 3-TCP,需借助H2O2在水中分解产生的H2O-,H2O-与O3反应产生的羟基自由基才能分解1, 2, 3-TCP[18]。结果表明,在最优的O3/H2O2摩尔比条件(O3: H2O2=100:3)下,对100 mg/L和10 mg/L的TCP降解率分别可以达到30%和60%。
 |
| 图 1 1, 2, 3-TCP非生物降解示意图[4] Fig. 1 Schematic diagram of abiotic degradation of 1, 2, 3-TCP[4]. |
| 图选项 |
过硫酸盐氧化也是一种有效降解1, 2, 3-TCP的方法,其原理是通过紫外线、加热和过渡金属等活化过硫酸盐(S2O82-) 生成硫酸根自由基进而降解1, 2, 3-TCP,且产物主要为CO2和HCl[19]。李卉等研究了3种不同的氧化方法降解1, 2, 3-TCP的效率,发现使用Fe2+活化过硫酸盐同时利用柠檬酸(Citric acid,CA) 作为螯合剂,可以有效降解1, 2, 3-TCP;当S2O82-、Fe2+、CA摩尔比为20:5:1时,TCP降解率为40.8%[20]。
2.3 化学还原法活性零价金属(如零价铁、零价锌等) 也常用于1, 2, 3-TCP等有机氯污染物的降解,其降解有机氯化物的原理是一种化学还原反应。该方法具有高效、成本较低等特点。纳米零价铁(nZVI) 是粒径在1–100 nm之间的零价铁颗粒,其比表面积和表面能较大,具有良好的吸附性和反应活性,可用于吸附和降解水体中的有机氯污染物。零价铁的反应体系中一般存在3种还原剂Fe2+、Fe0和H2,分别对应3种可能的有机氯化合物降解机制:氢解、还原消除以及加氢还原[21]。
活性零价金属还原方法因金属的价态组成不同而导致1, 2, 3-TCP降解产物的不同。Khan等通过研究不同类型铁(Fe2+、Fe3+和Fe0/H2O2) 去除1, 2, 3-TCP的能力,发现如果使用Fe2+和Fe3+,则降解产物为1, 3-二氯丙酮和2, 3-二氯-1-丙烯;如果使用Fe0,则降解产物为异丙醇和丙醛[22]。Klausen等发现地下水环境的化学组分差异对铁颗粒的活性和寿命有很大影响,进而影响1, 2, 3-TCP和1, 1-二氯乙烷等多种有机氯污染物的去除[23]。Arnold等发现,有机氯化物的降解是Fe0参与的还原性脱氯反应和金属铁表面的吸附反应同时在起作用。因此,零价金属铁还原1, 2, 3-TCP的能力取决于铁的含量、溶液的pH值和零价铁颗粒的表面积等因素[24]。Salter等发现零价金属锌也能对环境中的1, 2, 3-TCP达到有效去除,但地下水环境中的理化因素对金属的腐蚀程度则会影响到1, 2, 3-TCP的去除效率,因为零价金属Zn的腐蚀形成了ZnO或Zn(OH)2惰性层会影响活性金属的性能[14]。对场地投放大量零价锌或零价铁修复1, 2, 3-TCP污染,造成二价锌或二价铁离子大量释放,是否会对环境造成二次污染还需进一步评估。
总之,通过非生物修复方法降解1, 2, 3-TCP虽然能在短时间内产生显著效果,但长远来看并非一劳永逸的方法,非生物法在处理污染时使用的加热脱附方法或引入的化学试剂还可能会对环境造成二次影响,例如原位微生物的生理活性与生态功能可能会受到不可逆的损伤和影响。
3 生物修复生物修复具有高效、成本较低、绿色、环境友好以及可持续等优点,是一种实用而越来越受到欢迎和重视的修复技术,尤其是在环境污染物减排、有机污染物降解去除中逐渐发挥出更重要的作用[25]。1, 2, 3-TCP可能通过以下3种方式进行降解:(1) 微生物好氧降解,即在有氧环境中,好氧微生物以1, 2, 3-TCP为碳源或能源供给细胞生长,从而将其降解转化为毒性较小甚至完全无害的物质;(2) 微生物厌氧降解,即在无氧或低氧环境中,微生物利用氢气、乳酸盐等作为电子供体、1, 2, 3-TCP作为电子受体来实现1, 2, 3-TCP的降解转化;(3) 微生物厌氧发酵,即微生物同时利用1, 2, 3-TCP作为电子供体和电子受体进行发酵代谢。
3.1 微生物好氧降解3.1.1 微生物有氧共代谢目前,尚未发现在有氧环境中可以直接利用1, 2, 3-TCP的微生物菌株[26]。然而,有研究指出某些微生物可在有氧条件下以共代谢的方式间接转化包括1, 2, 3-TCP在内的多种卤代脂肪烃。其中,广泛存在的单加氧酶对1, 2, 3-TCP的降解转化起到了非常重要的作用,如甲烷单加氧酶、丙烷单加氧酶及卤代烷脱卤酶等[27]。甲烷营养型细菌Methylosinus trichosporium菌株OB3b (图 2) 产生的可溶性甲烷单加氧酶可降解1, 2, 3-TCP生成中间产物二氯丙醛或二氯丙酮,而后经醇脱氢酶的作用最终转化为二氯丙醇。在甲烷单加氧酶转化1, 2, 3-TCP的过程中,氧的插入优先发生在末端碳原子上,这会产生氯代羰基化合物,这些羰基化合物非常活泼,会通过消除反应生成二氯丙醛[28]。Wang等研究发现丙烷氧化细菌(Propane-oxidizing bacteria,PrOB)中的丙烷单加氧酶(Propane monooxygenase,PrMO) 也可以降解1, 2, 3-TCP,但是必须在培养基中加入丙烷作为碳源,意味着该微生物可能通过PrMO酶以共代谢的方法降解1, 2, 3-TCP。该研究选取的4种丙烷氧化细菌Rhodococcus ruber ENV425、Mycobacterium vaccae JOB5、Rhodococcus jostii RHA1以及Sphingopyxis sp. AX-A均验证了这一结果[29]。Coyle等的研究表明,在碱性有氧条件下,硝化细菌所合成的氨单加氧酶(Ammonia monooxygenase,AMO) 也可以降解包括1, 2, 3-TCP在内的多种氯代烷烃[30]。
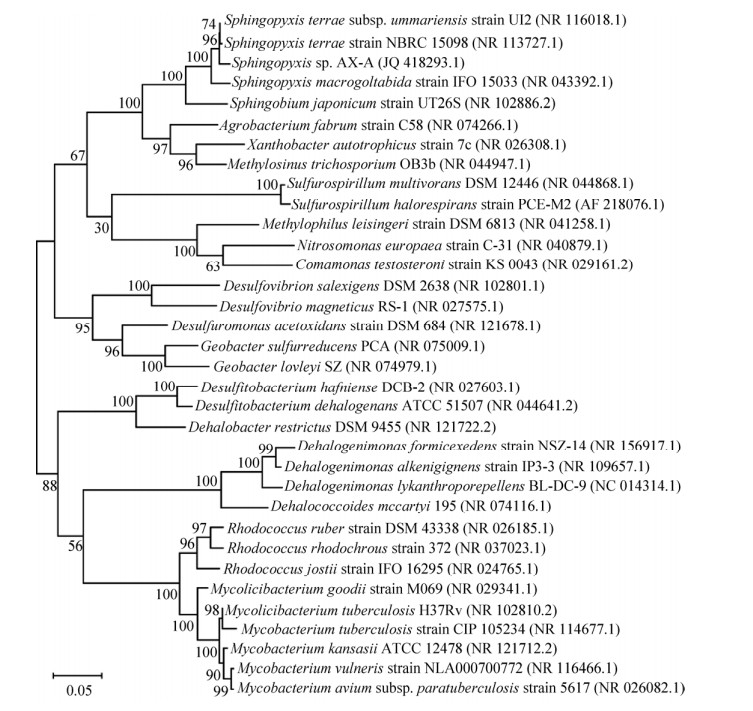 |
| 图 2 基于1, 2, 3-TCP降解微生物16S rRNA序列的进化树 Fig. 2 16S rRNA phylogeny of 1, 2, 3-TCP-degrading bacteria. |
| 图选项 |
卤代烷脱卤酶(Haloalkane dehalogenase,DhaA)可通过与卤代脂肪烃形成烷基-酶中间体催化卤代烷烃的水解[31]。Monincova等发现,Sphingobium japonicum UT26中参与降解γ-六氯环己烷的卤代烷脱卤酶(LinB) 对1, 2, 3-TCP有弱活性,该酶与DhaA的蛋白序列有44.7%的相似性[32]。Yokota等使用来自菌株Corynebacterium m15-3的酶证明了卤代烷脱卤酶对1, 2, 3-TCP的转化,但活性较低[33]。
1, 2, 3-TCP可在有氧条件下通过微生物共代谢的作用实现转化(图 3),但多数共代谢反应的转化效率较低[34],有如下可能的原因:(1) 由于酶存在底物特异性,导致酶与1, 2, 3-TCP污染底物之间的亲和性较低,如Sphingobium japonicum菌株的卤代烷脱卤酶(LinB) 对1, 2, 3-TCP的弱活性;(2) 通过共代谢的方式降解1, 2, 3-TCP还需考虑降解产物毒性的问题,例如,Methylosinus trichosporium菌株OB3b通过单加氧酶催化降解1, 2, 3-TCP,产物包括具有较强生物毒性的二氯丙醇和2-氯丙烯醛等;(3) 微生物对降解产物毒性的敏感性同样是生物转化活性的主要限制因素之一,如果微生物转化过程中产生的中间产物毒性大于母体化合物,不仅对微生物产生抑制作用,而且这一中间产物也可能影响生物修复顺利进行[35]。
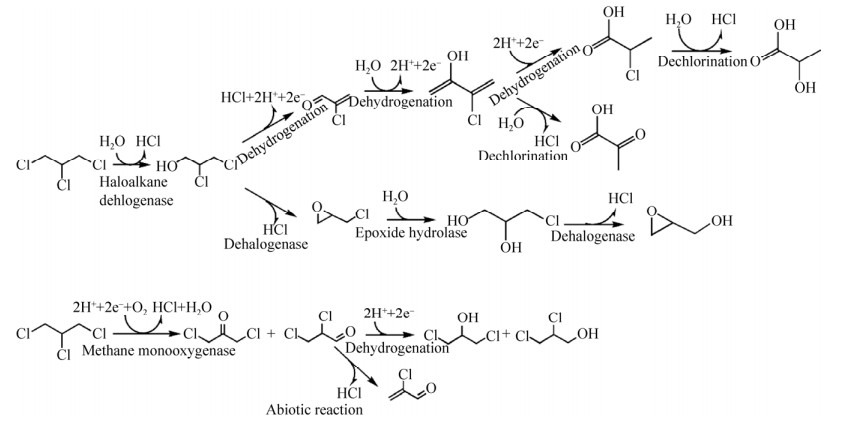 |
| 图 3 1, 2, 3-TCP好氧生物降解路径及产物示意图[4] Fig. 3 Schematic diagram of aerobic degradation of 1, 2, 3-TCP[4]. |
| 图选项 |
3.1.2 基因工程和蛋白质工程分子生物学、蛋白质工程学和合成生物学的发展为构建高效降解1, 2, 3-TCP的好氧菌株提供了有力工具,人们尝试通过结合异源基因表达和蛋白质工程来获得能够降解1, 2, 3-TCP的微生物,构建的基因工程菌株也逐步引入到生物修复领域[36]。要想在有氧环境中获得高效降解1, 2, 3-TCP的细菌,就要克服卤代烷烃脱卤酶(Haloalkane dehalogenase) 的底物选择性以及是否可以利用二氯丙醇为碳源生长的问题。Bosma等结合了随机诱变和基因工程技术,构建了1株能够利用1, 2, 3-TCP生长的工程菌株。其方法是通过随机诱变和菌落筛选提高了Rhodococcus sp. m15-3所拥有的卤代烷脱卤酶(Haloalkane dehalogenase,DhaA) 活性,获得的酶突变体能够将1, 2, 3-TCP降解为2,3-二氯-1-丙醇,将该酶基因导入可利用二氯丙醇的Agrobacterium radiobacter AD1细菌基因组,所得菌株能够利用1, 2, 3-TCP作为唯一的碳源和能源[37]。通过基因工程将具有1, 2, 3-TCP降解活性的卤代烷烃脱卤酶引入可降解1, 2-二氯丙烷的细菌Pseudomonas putida MC4中,结果证明基因工程改造细菌Pseudomonas putida MC4-5222可在有氧的条件下缓慢完全地降解1, 2, 3-TCP[38]。又有研究报道,通过将γ-六氯环己烷(γ-HCH) 和1, 2, 3-TCP生物降解途径整合到Pseudomonas putida KT2440的基因组中,创建了1株能够完全矿化γ-HCH和1, 2, 3-TCP的新型菌株P. putida KTLTG[39]。通过蛋白质工程也能有效地提高卤代烷脱卤酶对1, 2, 3-TCP的转化效果,Gray等开展了卤代烷烃酶蛋白质工程研究,得到了1种耐高温且具有更高1, 2, 3-TCP降解活性的突变酶[40]。还可通过微生物固定化技术提高不同脱卤酶降解1, 2, 3-TCP的转化效率。有研究表明,用无载体交联酶聚集体固定化方法对卤代烷烃脱卤酶、卤醇脱卤酶和环氧化物水解酶进行了有效固定化,也能实现污染物1, 2, 3-TCP的高效降解。廖茜等通过采用交联酶聚集体(Cross-linked enzyme aggregates,CLEAs) 固定化技术对优化过的卤代烷烃脱卤酶突变体DhaA31、野生型卤醇脱卤酶HheC和野生型环氧化物水解酶EchA进行固定化,可将1, 2, 3-TCP完全脱氯降解转化为甘油[41]。虽然基因工程微生物的构建为1, 2, 3-TCP等难降解有机卤污染物提供了新的方法与途径,但与此同时也带来了潜在风险或不确定性。基因工程改造后的优良菌株引入环境后所面临的生态环境健康风险不容忽视。因此,在引入高效工程菌株到污染场地进行修复应用之前,还需按照政策与法规开展必要的风险评估,以避免造成衍生环境风险及生物安全问题。
3.2 微生物厌氧降解3.2.1 热力学计算预测可能的厌氧降解途径从热力学的角度讲,通过氧化反应将1, 2, 3-TCP转化为CO2、H2O和HCl是可行的[42]。有机污染物的生物降解本质上是微生物介导的一类氧化还原化学反应。微生物在还原降解有机物的过程中,利用还原性强的物质作为电子供体,通过一系列中间过程将电子传递到作为电子受体的有机物,从中获取能量来供给自身生长和繁殖。可根据热力学计算来预测微生物能否通过氧化还原反应获取能量供给自身生长[43-44]。表 2列出了在生化标准条件下(标准大气压1.01×105 Pa,pH 7.0,氯离子浓度1 mmol/L,其他物质浓度1 mol/L),1, 2, 3-TCP及其产物参与的还原性脱氯半反应的生化标准吉布斯自由能(ΔG0?) 及氧化还原电位(E0?)。热力学计算表明,1, 2, 3-TCP及其产物的还原脱氯反应均是放热反应。因此,从理论上可以确定1, 2, 3-TCP及其产物均可以作为电子受体为厌氧环境中的有机卤呼吸微生物所利用。
表 2 部分化合物参与的还原反应在25 ℃、pH 7.0时的吉布斯自由能和标准还原电位a, bTable 2 Gibbs free energy changes and standard reduction potentials of selected organic and inorganic redox couples at 25 ℃ and pH 7 a, b
| Electron accepter | Half-reaction of reductive dehalogenation | ΔGo? (kJ/e–) | Eo? (mV) | |
| 1, 2, 3-TCP | 1, 2, 3-TCP+H++2e– | →1, 2-DCP+Cl– | –87.9 | 911.0 |
| 1, 2, 3-TCP | 1, 2, 3-TCP+H++2e– | →1, 3-DCP+Cl– | –88.5 | 917.2 |
| 1, 2, 3-TCP | 1, 2, 3-TCP+2e– | →Allyl chloride+2Cl– | –158.5 | 1 642.7 |
| 1, 2-DCP | 1, 2-DCP+H++2e– | →1-CP+Cl– | –73.3 | 759.7 |
| 1, 3-DCP | 1, 3-DCP+H++2e– | →1-CP+Cl– | –72.8 | 754.5 |
| 1, 2-DCP | 1, 2-DCP+2e– | →Propene+2Cl– | –151.1 | 1 566.0 |
| 1, 3-DCP | 1, 3-DCP+2e– | →Propene+2Cl– | –150.6 | 1 560.9 |
| Allyl chloride | Allyl chloride +H++2e– | →Propene+Cl– | –80.5 | 834.3 |
| 1-CP | 1-CP+H++2e– | →C3H8+Cl– | –71.2 | 737.9 |
| SO42– | SO42–+9H++8e– | →HS-+4H2O | +20.9 | –217.0 |
| NO3– | NO3–+2H++2e– | →NO2-+H2O | –41.7 | 432.0 |
| O2 | O2+4H++4e– | →2H2O | –78.7 | 816.0 |
| HCO3– | HCO3–+9H++8e– | →CH4+3H2O | +23.0 | –238.0 |
| Fe2+ | Fe2++2e– | →Fe(0) | +42.5 | –440.0 |
| Fe3+ | Fe3++e– | →Fe2+ | –74.4 | 771.0 |
| Zn2+ | Zn2++2e– | →Zn(0) | +73.6 | –763.0 |
| Al3+ | Al3++3e- | →Al(0) | +160.4 | –1 662.0 |
| Proton (pH 7) | 2H++2e- | →H2 | +40.5 | –420.0 |
| Note: thermodynamic data were obtained from eQuilibrator (http://equilibrator.weizmann.ac.il/) and references[ | ||||
表选项
3.2.2 1, 2, 3-三氯丙烷的厌氧降解微生物研究在无氧环境中存在一类厌氧微生物,它们能够以氢气或小分子有机酸为电子供体,以有机卤化物为电子受体供给自身能量代谢,这类微生物统称为有机卤呼吸细菌(Organohalide-respiring bacteria,OHRB)。有机卤呼吸细菌作为卤族元素及有机卤化物生物地球化学的重要参与者[48-49],目前在无污染的自然环境和受人为影响的污染场地中均被检测到,主要分布于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes) 和绿弯菌门(Chloroflexi)[50] (图 2)。已知的有机卤呼吸细菌可分为仅利用有机卤呼吸作用完成其能量代谢的专性有机卤呼吸细菌和存在多种能量代谢方式的兼性有机卤呼吸细菌[51-52]。厚壁菌门的脱卤杆菌属(Dehalobacter)、绿弯菌门的脱卤拟球菌属(Dehalococcoides) 和脱卤单胞菌属(Dehalogenimonas)[53-55]等均为专性有机卤呼吸细菌。与之相比,兼性有机卤呼吸细菌可利用多种电子受体(如,三价铁、硫酸根、硝酸根等) 和电子供体(如,氢气、乙酸、乳酸、丙酮酸等) 供给生长,例如地质菌属(Geobacter)、脱硫杆菌属(Desulfuromonas)、脱硫弧菌属(Desulfovibrio) 和脱硫杆菌属(Desulfitobacterium) 等[56-57]。
有机卤呼吸细菌利用有机卤化物的主要机制包括氢解和二卤脱除两种还原性脱卤反应[58-59]。目前,仅发现部分有机卤呼吸细菌可利用还原性脱卤酶催化二卤脱除反应将1, 2, 3-TCP降解为3-氯-1-丙烯[1],而结合厌氧生物与非生物过程降解1, 2, 3-TCP的机制已有一些研究报道(图 4)。2009年,Yan等报道,从美国路易斯安那州某超级基金场地受污染的地下水中首次分离出2株可厌氧降解1, 2, 3-TCP到3-氯-1-丙烯的菌株,分别命名为Dehalogenimonas lykanthropropepellens 菌株BL-DC-8和菌株BL-DC-9[1]。2016年,又有研究报道了1株名为Dehalogenimonas alkenigignens IP3-3的新型有机卤呼吸细菌,它同样可以利用H2为电子供体,1, 2, 3-TCP作为电子受体生长[60]。
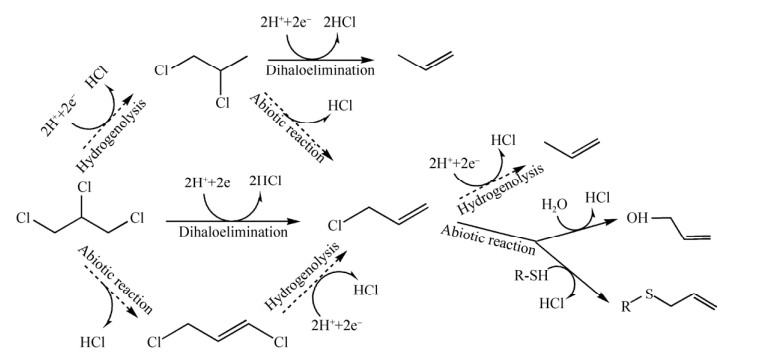 |
| 图 4 1, 2, 3-TCP厌氧生物降解示意图 Fig. 4 Schematic diagram of anaerobic degradation of 1, 2, 3-TCP. |
| 图选项 |
2017年,Key等从同一超级基金污染场地中又分离出了另1株可降解多种高浓度氯代烷烃类化合物的厌氧细菌,随后将其命名为Dehalogenimonas formicexedens NSZ-14。研究表明,该菌株也可通过双脱氯反应分别把1, 2-二氯乙烷、1, 2-二氯丙烷、1, 1, 2-三氯乙烷和1, 2, 3-TCP降解为乙烯、丙烯、氯乙烯和烯丙基氯(3-氯-1-丙烯)[61]。当前,虽然已分离出多种可在厌氧条件下降解1, 2, 3-TCP的有机卤呼吸微生物(如Dehalogenimonas lykanthroporepellens BL-DC-9和Dehalogenimonas alkenigignens IP3-3等),但利用这些有机卤呼吸微生物开展1, 2, 3-TCP污染场地原位修复还需进一步开展验证和机制的研究。
4 1, 2, 3-三氯丙烷污染场地原位生物修复技术展望1, 2, 3-三氯丙烷是一类具有高生物毒性的难降解有机物,严重威胁饮用水安全及地下生态环境健康。当前主要通过物理法、化学氧化法和化学还原法等非生物方法去除环境中的1, 2, 3-TCP,非生物方法虽可在短时间内降解去除1, 2, 3-TCP,但可能会对原位生态环境产生不可逆影响。而原位生物修复技术则具有可持续、环境友好等特点,是当前最具潜力的修复技术之一。针对特定污染物的原位微生物修复技术的开发尚有很多亟待解决的问题,真正实现大规模的实际应用还任重道远。好氧共代谢修复技术在土壤有氧环境下有着潜在的应用前景,但如何提高酶的活性以及在不同环境条件下的稳定性还需通过合成生物学技术等手段进行优化。同时,由于1, 2, 3-TCP等有机氯污染物通过迁移渗透进入土壤或地下水中的厌氧环境,因此还需有针对性地研究和开发厌氧环境条件下的微生物修复技术。例如,如何分离与培养高效降解1, 2, 3-TCP的厌氧微生物菌株;如何使这些降解菌能够在原位异质性环境中稳定生存生长;如何开发基于厌氧有机卤呼吸微生物降解1, 2, 3-TCP至丙烯的无毒化修复技术等。此外,在土壤或地下水中可能存在不同氧化还原电位层,结合好氧微生物与厌氧微生物的不同生态位开展联合微生物修复技术也具有可行性。
结合非生物与生物修复的各自优势进行地下水和土壤的原位有机氯污染修复也具有较好前景。例如,微米级零价铁(mZVI) 与生物刺激(Biostimulation) 相结合可有效降解地下水中不同类型氯代脂肪烃复合污染[62],原因在于经纳米铁处理的地下水环境中,降低的氧化还原电势有助于可厌氧降解有机氯污染物的微生物生长,同时引入的生物刺激营养物质(碳源、乙酸/乳酸等小分子电子供体和钴胺素等生长因子) 会大大促进地下水中功能微生物的生长繁殖。因此,非生物技术与厌氧有机卤呼吸微生物降解技术的联用可为将来修复1, 2, 3-TCP污染场地提供潜在的修复技术路径。
参考文献
| [1] | Yan J, Rash BA, Rainey FA, et al. Isolation of novel bacteria within the chloroflexi capable of reductive dechlorination of 1, 2, 3-trichloropropane. Environ Microbiol, 2009, 11(4): 833-843. DOI:10.1111/j.1462-2920.2008.01804.x |
| [2] | 张宁宁. 水体中1, 2, 3—三氯丙烷的降解及微生物群落演化. 北京: 中国地质大学(北京), 2020. Zhang NN. Biodegradation of 1, 2, 3-trichloropropane and evolutionary of microbial community in water. Beijing: China University of Geosciences, 2020 (in Chinese). |
| [3] | Tesoriero AJ, L?ffler FE, Liebscher H. Fate and origin of 1, 2-dichloropropane in an unconfined shallow aquifer. Environ Sci Technol, 2001, 35(3): 455-461. DOI:10.1021/es001289n |
| [4] | Samin G, Janssen DB. Transformation and biodegradation of 1, 2, 3-trichloropropane (TCP). Environ Sci Pollut Res Int, 2012, 19(8): 3067-3078. DOI:10.1007/s11356-012-0859-3 |
| [5] | Tesoriero AJ, L?ffler FE, Liebscher H. Fate and origin of 1, 2-dichloropropane in an unconfined shallow aquifer. Environ Sci Technol, 2001, 35(3): 455-461. DOI:10.1021/es001289n |
| [6] | Volpe A, Del Moro G, Rossetti S, et al. Remediation of PCE-contaminated groundwater from an industrial site in southern Italy: a laboratory-scale study. Process Biochem, 2007, 42(11): 1498-1505. DOI:10.1016/j.procbio.2007.07.017 |
| [7] | 张华, 蒋鹏, 许石豪, 等. 有机污染场地环境初步调查与风险评估. 安全与环境工程, 2012, 19(6): 64-68. Zhang H, Jiang P, Xu SH, et al. Preliminary environmental investigation and risk assessment of an organic contaminated site. Saf Environ Eng, 2012, 19(6): 64-68 (in Chinese). DOI:10.3969/j.issn.1671-1556.2012.06.013 |
| [8] | Pagan M, Cooper WJ, Joens JA. Kinetic studies of the homogeneous abiotic reactions of several chlorinated aliphatic compounds in aqueous solution. Appl Geochem, 1998, 13(6): 779-785. DOI:10.1016/S0883-2927(98)00005-5 |
| [9] | Sarathy V, Salter AJ, Nurmi JT, et al. Degradation of 1, 2, 3-trichloropropane (TCP): hydrolysis, elimination, and reduction by iron and zinc. Environ Sci Technol, 2010, 44(2): 787-793. DOI:10.1021/es902595j |
| [10] | Tardiff RG, Carson ML. Derivation of a reference dose and drinking water equivalent level for 1, 2, 3-trichloropropane. Food Chem Toxicol, 2010, 48(6): 1488-1510. DOI:10.1016/j.fct.2010.03.016 |
| [11] | 沈铁孟, 黄国强, 李凌, 等. 石油污染土壤的原位修复技术. 环境科学动态, 2002, 27(3): 13-15. Shen TM, Huang GQ, Li L, et al. In-situ remediation technology of petroleum contaminated soil. Environment and Sustainable Development, 2002, 27(3): 13-15 (in Chinese). DOI:10.3969/j.issn.1673-288X.2002.03.005 |
| [12] | 许伟, 刘军利, 孙康. 活性炭吸附法在挥发性有机物治理中的应用研究进展. 化工进展, 2016, 35(4): 1223-1229. Xu W, Liu JL, Sun K. Application progresses in the treatment of volatile organic compounds by adsorption on activated carbon. Chem Ind Eng Prog, 2016, 35(4): 1223-1229 (in Chinese). |
| [13] | 周际海, 黄荣霞, 樊后保, 等. 污染土壤修复技术研究进展. 水土保持研究, 2016, 23(3): 366-372. Zhou JH, Huang RX, Fan HB, et al. A review on the progresses of remediation technologies for contaminated soils. Res Soil Water Conserv, 2016, 23(3): 366-372 (in Chinese). |
| [14] | Salter AJ, Johnson RL, Tratnyek Paul G. Degradation of 1, 2, 3-trichloropropane by zero-valent zinc: laboratory assessment for field application. Seventh International Conference on Remediation of Chlorinated and Recalcitrant Compounds, Monterey, CA. [2010-03-10]. |
| [15] | Merrill JP, Suchomel EJ, Varadhan S, et al. Development and validation of technologies for remediation of 1, 2, 3-trichloropropane in groundwater. Curr Pollut Rep, 2019, 5(4): 228-237. DOI:10.1007/s40726-019-00122-7 |
| [16] | Lin SH, Lin CM, Leu HG. Operating characteristics and kinetic studies of surfactant wastewater treatment by Fenton oxidation. Water Res, 1999, 33(7): 1735-1741. DOI:10.1016/S0043-1354(98)00403-5 |
| [17] | Olmez-Hanci T, Arslan-Alaton I. Comparison of sulfate and hydroxyl radical based advanced oxidation of phenol. Chem Eng J, 2013, 224: 10-16. DOI:10.1016/j.cej.2012.11.007 |
| [18] | 王妍妍, 张猛, 李卉, 等. O3与O3/H2O2工艺对地下水中TCP降解效率与机理研究. 环境科学与技术, 2018, 41(10): 62-68. Wang YY, Zhang M, Li H, et al. Degradation effect and study on the mechanism of 1, 2, 3-trichloropropane in groundwater by O3 and O3/H2O2. Environ Sci Technol, 2018, 41(10): 62-68 (in Chinese). |
| [19] | Furman OS, Teel AL, Watts RJ. Mechanism of base activation of persulfate. Environ Sci Technol, 2010, 44(16): 6423-6428. DOI:10.1021/es1013714 |
| [20] | 李卉, 韩占涛. 不同氧化还原方法对1, 2, 3-三氯丙烷降解效果的研究. 环境污染与防治, 2019, 41(3): 274-278. Li H, Han ZT. Study of the degradation effect of 1, 2, 3-trichloropropane by different oxidation-reduction methods. Environ Pollut Control, 2019, 41(3): 274-278 (in Chinese). |
| [21] | 陈宜菲. 零价金属脱氯降解有机氯化污染物研究进展. 安庆师范学院学报(自然科学版), 2005, 11(3): 38-42. Chen YF. Study on reductive dechlorination of chlorinated organic pollutants by zero-valent metal. J Anqing Teach Coll (Nat Sci Ed), 2005, 11(3): 38-42 (in Chinese). DOI:10.3969/j.issn.1007-4260.2005.03.012 |
| [22] | Khan E, Wirojanagud W, Sermsai N. Effects of iron type in Fenton reaction on mineralization and biodegradability enhancement of hazardous organic compounds. J Hazard Mater, 2009, 161(2/3): 1024-1034. |
| [23] | Klausen J, Vikesland PJ, Kohn T, et al. Longevity of granular iron in groundwater treatment processes: solution composition effects on reduction of organohalides and nitroaromatic compounds. Environ Sci Technol, 2003, 37(6): 1208-1218. DOI:10.1021/es025965s |
| [24] | Arnold WA, Roberts AL. Pathways and kinetics of chlorinated ethylene and chlorinated acetylene reaction with Fe(0) particles. Environ Sci Technol, 2000, 34(9): 1794-1805. DOI:10.1021/es990884q |
| [25] | Taheran M, Davoodi SM, Miri SB. Bioremediation of unconventional oil contaminated ecosystems. Environ Sci Technol, 2020, 54(4): 2054-2067. DOI:10.1021/acs.est.9b00906 |
| [26] | 钱永. 1, 2, 3-三氯丙烷在地下水中的环境行为研究——以某氯代烃有机污染场地为例. 北京: 中国地质大学(北京), 2016. Qian Y. Research on environmental behavior of 1, 2, 3-trichloropropane in groundwater of a contaminated site with chlorinated pollutants. Beijing: China University of Geosciences, 2016 (in Chinese). |
| [27] | Hanson RS, Tsien HC, Tsuji K, et al. Biodegradation of low-molecular-weight halogenated hydrocarbons by methanotrophic bacteria. FEMS Microbiol Rev, 1990, 87(3/4): 273-278. |
| [28] | Bosma T, Janssen DB. Conversion of chlorinated propanes by Methylosinus trichosporium OB3b expressing soluble methane monooxygenase. Appl Microbiol Biotechnol, 1998, 50(1): 105-112. DOI:10.1007/s002530051263 |
| [29] | Wang BX, Chu KH. Cometabolic biodegradation of 1, 2, 3-trichloropropane by propane-oxidizing bacteria. Chemosphere, 2017, 168: 1494-1497. DOI:10.1016/j.chemosphere.2016.12.007 |
| [30] | Coyle CG, Waisner SA, Medina VF, et al. Use of dilute ammonia gas for treatment of 1, 2, 3-trichloropropane and explosives-contaminated soils. J Environ Manage, 2017, 204(pt 2): 775-782. |
| [31] | Krooshof GH, Ridder IS, Tepper AW, et al. Kinetic analysis and X-ray structure of haloalkane dehalogenase with a modified halide-binding site. Biochemistry, 1998, 37(43): 15013-15023. DOI:10.1021/bi9815187 |
| [32] | Monincová M, Prokop Z, Vévodová J, et al. Weak activity of haloalkane dehalogenase LinB with 1, 2, 3-trichloropropane revealed by X-ray crystallography and microcalorimetry. Appl Environ Microbiol, 2007, 73(6): 2005-2008. DOI:10.1128/AEM.02416-06 |
| [33] | Yokota T, Omori T, Kodama T. Purification and properties of haloalkane dehalogenase from Corynebacterium sp. strain m15-3. J Bacteriol, 1987, 169(9): 4049-4054. DOI:10.1128/jb.169.9.4049-4054.1987 |
| [34] | Rieger PG, Meier HM, Gerle M, et al. Xenobiotics in the environment: present and future strategies to obviate the problem of biological persistence. J Biotechnol, 2002, 94(1): 101-123. DOI:10.1016/S0168-1656(01)00422-9 |
| [35] | van Hylckama Vlieg JET, Janssen DB. Formation and detoxification of reactive intermediates in the metabolism of chlorinated ethenes. J Biotechnol, 2001, 85(2): 81-102. DOI:10.1016/S0168-1656(00)00364-3 |
| [36] | Bosma T, Kruizinga E, de Bruin EJ, et al. Utilization of trihalogenated propanes by Agrobacterium radiobacter AD1 through heterologous expression of the haloalkane dehalogenase from Rhodococcus sp. strain M15-3. Appl Environ Microbiol, 1999, 65(10): 4575-4581. DOI:10.1128/AEM.65.10.4575-4581.1999 |
| [37] | Bosma T, Damborsky J, Stucki G, et al. Biodegradation of 1, 2, 3-trichloropropane through directed evolution and heterologous expression of a haloalkane dehalogenase gene. Appl Environ Microbiol, 2002, 68(7): 3582-3587. DOI:10.1128/AEM.68.7.3582-3587.2002 |
| [38] | Samin G, Pavlova M, Arif MI, et al. A Pseudomonas putida strain genetically engineered for 1, 2, 3-trichloropropane bioremediation. Appl Environ Microbiol, 2014, 80(17): 5467-5476. DOI:10.1128/AEM.01620-14 |
| [39] | Zhao Y, Che Y, Zhang F, et al. Development of an efficient pathway construction strategy for rapid evolution of the biodegradation capacity of Pseudomonas putida KT2440 and its application in bioremediation. Sci Total Environ, 2021, 761: 143239. DOI:10.1016/j.scitotenv.2020.143239 |
| [40] | Gray KA, Richardson TH, Kretz K, et al. Rapid evolution of reversible denaturation and elevated melting temperature in a microbial haloalkane dehalogenase. Adv Synth Catal, 2001, 343(6/7): 607-617. |
| [41] | 廖茜. 环境污染物1, 2, 3-三氯丙烷降解途径的构建及优化. 成都: 电子科技大学, 2018. |
| [42] | Dolfing J, Janssen DB. Estimates of Gibbs free energies of formation of chlorinated aliphatic compounds. Biodegradation, 1994, 5(1): 21-28. |
| [43] | Torralba-Sanchez TL, Bylaska EJ, Salter-Blanc AJ, et al. Reduction of 1, 2, 3-trichloropropane (TCP): pathways and mechanisms from computational chemistry calculations. Environ Sci: Processes Impacts, 2020, 22(3): 606-616. DOI:10.1039/C9EM00557A |
| [44] | Thauer RK, Jungermann K, Decker K. Energy conservation in chemotrophic anaerobic bacteria. Bacteriol Rev, 1977, 41(1): 100-180. DOI:10.1128/br.41.1.100-180.1977 |
| [45] | Dolfing J, Eekert Mv, Mueller J, et al. Thermodynamics of low Eh reactions[C]. Fifth International Conference on Remediation of Chlorinated and Recalcitrant Compounds, Monterey, CA, [2006-05-22] |
| [46] | Dolfing J, van Eekert M, Seech A, et al. In situ chemical reduction (ISCR) technologies: significance of low eh reactions. Soil Sediment Contam: Int J, 2007, 17(1): 63-74. DOI:10.1080/15320380701741438 |
| [47] | Dolfing J. Protocols for calculating reaction kinetics and thermodynamics. Springer Protocols Handbooks. Berlin Heidelberg: Springer-Verlag Press, 2015: 1-9. |
| [48] | Oberg G. The natural chlorine cycle——fitting the scattered pieces. Appl Microbiol Biotechnol, 2002, 58(5): 565-581. DOI:10.1007/s00253-001-0895-2 |
| [49] | Gribble GW. Naturally occurring organohalogen compounds-A comprehensive update. Vienna: Springer Vienna, 2010. |
| [50] | Hug LA, Maphosa F, Leys D, et al. Overview of organohalide-respiring bacteria and a proposal for a classification system for reductive dehalogenases. Philos Trans R Soc Lond B Biol Sci, 2013, 368(1616): 20120322. DOI:10.1098/rstb.2012.0322 |
| [51] | Maphosa F, de Vos WM, Smidt H. Exploiting the ecogenomics toolbox for environmental diagnostics of organohalide-respiring bacteria. Trends Biotechnol, 2010, 28(6): 308-316. DOI:10.1016/j.tibtech.2010.03.005 |
| [52] | McMurdie PJ, Hug LA, Edwards EA, et al. Site-specific mobilization of vinyl chloride respiration islands by a mechanism common in Dehalococcoides. BMC Genomics, 2011, 12: 287. DOI:10.1186/1471-2164-12-287 |
| [53] | Holliger C, Hahn D, Harmsen H, et al. Dehalobacter restrictus gen. nov. and sp. nov., a strictly anaerobic bacterium that reductively dechlorinates tetra- and trichloroethene in an anaerobic respiration. Arch Microbiol, 1998, 169(4): 313-321. DOI:10.1007/s002030050577 |
| [54] | Kaster AK, Mayer-Blackwell K, Pasarelli B, et al. Single cell genomic study of Dehalococcoidetes species from deep-sea sediments of the Peruvian Margin. Isme J, 2014, 8(9): 1831-1842. DOI:10.1038/ismej.2014.24 |
| [55] | Wasmund K, Schreiber L, Lloyd KG, et al. Genome sequencing of a single cell of the widely distributed marine subsurface Dehalococcoidia, phylum Chloroflexi. Isme J, 2014, 8(2): 383-397. DOI:10.1038/ismej.2013.143 |
| [56] | Maymó-Gatell X, Chien Y, Gossett JM, et al. Isolation of a bacterium that reductively dechlorinates tetrachloroethene to ethene. Science, 1997, 276(5318): 1568-1571. DOI:10.1126/science.276.5318.1568 |
| [57] | Villemur R, Lanthier M, Beaudet R, et al. The Desulfitobacterium genus. FEMS Microbiol Rev, 2006, 30(5): 706-733. DOI:10.1111/j.1574-6976.2006.00029.x |
| [58] | Atashgahi S, H?ggblom MM, Smidt H. Organohalide respiration in pristine environments: implications for the natural halogen cycle. Environ Microbiol, 2018, 20(3): 934-948. DOI:10.1111/1462-2920.14016 |
| [59] | Richardson RE. Genomic insights into organohalide respiration. Curr Opin Biotechnol, 2013, 24(3): 498-505. DOI:10.1016/j.copbio.2013.02.014 |
| [60] | Key TA, Richmond DP, Bowman KS, et al. Genome sequence of the organohalide-respiring Dehalogenimonas alkenigignens type strain (IP3-3(T)). Stand Genom Sci, 2016, 11: 44. DOI:10.1186/s40793-016-0165-7 |
| [61] | Key TA, Bowman KS, Lee I, et al. Dehalogenimonas formicexedens sp. nov., a chlorinated alkane-respiring bacterium isolated from contaminated groundwater. Int J Syst Evol Microbiol, 2017, 67(5): 1366-1373. DOI:10.1099/ijsem.0.001819 |
| [62] | Wu NJ, Zhang W, Wei WX, et al. Field study of chlorinated aliphatic hydrocarbon degradation in contaminated groundwater via micron zero-valent iron coupled with biostimulation. Chem Eng J, 2020, 384: 123349. DOI:10.1016/j.cej.2019.123349 |
