

东北农业大学 动物科学技术学院,黑龙江 哈尔滨 150030
收稿日期:2020-11-13;接收日期:2021-03-26;网络出版时间:2021-05-06
基金项目:国家自然科学基金(No. 31902195),黑龙江省自然科学基金(No. YQ2019C007) 资助
摘要:铰链结构,又称铰链区或转角,是部分抗菌肽序列中存在的一种特殊结构。但目前抗菌肽结构的研究多集中于标准的α-螺旋和β-折叠二级结构,对于铰链结构及其作用总结较少。铰链结构对抗菌肽生物活性有重要影响,主要原因是铰链结构能够提高抗菌肽的结构灵活性,促进其对细菌细胞膜的破坏作用或与胞内作用靶点的结合效率,进而提高抗菌肽的抗菌活性。同时,降低的抗菌肽结构刚性,消减了抗菌肽对真核细胞的毒性。文中结合了笔者课题组相关工作,就铰链结构特点、对抗菌肽生物活性的影响以及在抗菌肽分子设计方面的应用进行了综述,以期为新型抗菌肽的设计和开发提供参考。
关键词:抗菌肽铰链结构生物活性分子设计
The effects of hinge structure on the biological activity of antimicrobial peptides and its application in molecular design: a review
Yinfeng Lü, Jinni Bai, Dezhi Tan, Tingting Chen, Anshan Shan


College of Animal Science and Technology, Northeast Agricultural University, Harbin 150030, Heilongjiang, China
Received: November 13, 2020; Accepted: March 26, 2021; Published: May 6, 2021
Supported by: National Natural Science Foundation of China (No. 31902195), Natural Science Foundation of Heilongjiang Province, China (No. YQ2019C007)
Corresponding author: Anshan Shan. Tel: +86-451-55190685; Fax: +86-451-55103336; E-mail: asshan@neau.edu.cn.
Abstract: The hinge structure, also known as hinge region or bend, is a special structure found in some antimicrobial peptides. Most studies on antimicrobial peptides focused on the standard secondary structure of α-helix and β-sheet, while the hinge structure and its functions were rarely studied. The hinge structure confers the antimicrobial peptides an improved structural flexibility, which may promote their disruptive effect on bacterial membrane or their binding efficiency to the intracellular targets, thus resulting in a higher antibacterial activity. Meanwhile, the hinge structure may reduce the structural rigidity, which may eliminate the cytotoxicity of antimicrobial peptides to eukaryotic cells. This article reviews the structural characteristics of the hinge structure, its effects on the biological activity of antimicrobial peptides and application in the molecular design, with the aim to provide a reference for the design and development of new antimicrobial peptides.
Keywords: antimicrobial peptideshinge structurebiological activitymolecular design
世界正走向后抗生素时代,抗生素的研发效率无法赶上细菌对其产生耐药性的速度,致使人类健康面临巨大威胁[1-2]。近年来,研究工作者逐渐将目光转向寡聚糖、益生菌、植物提取物、抗菌肽等物质,以期找到抗生素的替代物[3-5]。抗菌肽是存在于生物体免疫系统中的一类小分子多肽。自从1981年,第一种内源性抗菌肽——天蚕素被Boman等发现以来,在植物、动物、细菌等许多生物体内均发现抗菌肽的存在,目前发现的天然抗菌肽已经超过2 000种[6]。研究表明,抗菌肽具有多种生物活性,可杀死或抑制细菌、真菌、病毒及寄生虫等,不易产生抗药性,并且对机体正常细胞毒性作用较低[7]。不仅如此,还发现抗菌肽能够参与免疫调节,增强机体免疫功能[8]。基于这些特质,抗菌肽作为具备广阔市场前景的抗生素替代物,逐渐成为近年来国内外的研究热点。
但目前抗菌肽的开发与应用还受到很多限制,主要表现为动植物体内抗菌肽含量少、提取困难、技术成本高、部分抗菌肽抗菌活性低,且具有一定的细胞毒性[9-10],这使得人们开始尝试将天然抗菌肽进行改造和分子设计,以期得到理想性能的抗菌肽。人们最关注的抗菌肽生物活性是抗菌活性与溶血活性两方面,影响抗菌肽生物活性的因素包括正电荷性、疏水性、两亲性以及结构(如铰链结构、特殊氨基酸残基等) 等[11]。因此,抗菌肽的改造与全新设计也主要从以上几个方面入手。
随着对抗菌肽结构研究的不断深入,人们发现天然抗菌肽中存在一种铰链结构,在螺旋型抗菌肽中表现出“螺旋-铰链-螺旋”结构,铰链区可以使抗菌肽分子局部发生弯曲,有利于其在膜环境中改变构象[12]。一些研究将铰链结构引入天然抗菌肽中,得到了具备更高抗菌活性且低溶血活性的新型抗菌肽,但是目前对于含有铰链结构抗菌肽的介绍较少。本文以铰链结构为切入点,将铰链结构对抗菌肽生物活性的影响及其在抗菌肽分子设计中的应用进行总结,以期为高效低毒抗菌肽的开发及临床应用提供一定参考。
1 抗菌肽铰链结构的氨基酸组成及结构特点组成抗菌肽铰链区的氨基酸通常为甘氨酸、脯氨酸、丙氨酸、异亮氨酸、天冬酰胺等。除氨基酸种类外,构成铰链结构氨基酸残基的数目较为灵活,仅一个氨基酸也可以在疏水环境下形成铰链区。如中华大蟾蜍Bufo bufo gargarizans胃组织中分离得到的抗菌肽buforin Ⅱ,其铰链区(第11个残基) 为脯氨酸(Pro),二级结构如图 1所示[13]。
 |
| 图 1 丝带模型模拟buforin Ⅱ在50% TFE溶液中的结构(由N端无规卷曲、延伸螺旋、铰链、C端规则螺旋构成两亲性结构。氨基酸残基的颜色:正电荷残基,红色;其他亲水性残基,蓝色;脯氨酸,白色;其他疏水性氨基酸,黄色[13]) Fig. 1 Ribbon-model representation of the backbone structure of buforin Ⅱ in 50% trifluoroethanol. The N-terminal random coil, the extended helix, the hinge, and the C-terminal regular helix form an overall amphipathic structure. The amino acid residues are colored as follows: positively charged residues, red; other hydrophilic residues, blue; proline, white; other hydrophobic residues, yellow[13]. |
| 图选项 |
含有铰链结构的抗菌肽大多为线性阳离子α-螺旋抗菌肽,肽链长度通常小于50个氨基酸,其N端富含亲水性氨基酸残基,如赖氨酸、精氨酸,C端则富含疏水性氨基酸,在疏水环境中两端呈现螺旋结构,而中间区域存在铰链区。比较典型的如天蚕素A (Cecropin A) 由37个氨基酸残基组成,依靠铰链连接两端的α-螺旋区域,第一个α-螺旋从N端第5–21个氨基酸残基,具有两亲性结构;第二个α-螺旋从第24–37个氨基酸残基,含有较多疏水性氨基酸[14]。某些抗菌肽的铰链结构属于保守序列,如提取自惜古比天蚕、中国柞蚕和家蚕的抗菌肽都含有由丙氨酸-甘氨酸-脯氨酸构成的铰链结构。随着研究的不断深入,各国****在多种抗菌肽中发现铰链结构的存在,较有代表性的有两栖类抗菌肽蛙皮素(Magainins),其铰链结构由甘氨酸-异亮氨酸-甘氨酸组成;昆虫抗菌肽蜂毒素(Melittin),其在疏水环境的铰链区组成为“甘氨酸-亮氨酸”;鸡源抗菌肽Fowlicidin-3 (Fow-3),在其二级结构中发现由“丙氨酸-甘氨酸-异亮氨酸-天冬酰胺”构成的铰链结构[15-16]。
在某些二级结构为伸展结构(无序结构) 的抗菌肽中,也存在铰链区,这类抗菌肽通常富含甘氨酸和脯氨酸等,如牛源cathelicidins家族抗菌肽indolicidin[17]。脯氨酸和甘氨酸富集形成铰链,阻止抗菌肽形成标准二级结构(α-螺旋或β-折叠),最终形成线性无规则卷曲结构[18]。
在具有标准二级结构(如α-螺旋) 抗菌肽的序列中引入柔性的铰链结构,能够改变抗菌肽的构象,提高其结构灵活性。天蚕素A与天蚕素B在模拟的膜环境中,都含有两个α-螺旋结构,由相同的铰链(丙氨酸-甘氨酸-脯氨酸) 连接,在接触细菌细胞膜时,两个α-螺旋结构会呈现特定夹角,夹角形成的特定空间构象会影响抗菌肽与革兰氏阴性菌细胞壁上脂多糖的结合效力[15]。铰链结构改变抗菌肽螺旋区域的夹角也会影响抗菌肽对真核细胞膜的插入作用。Srisailam等[19]通过人工改造天蚕素B,得到衍生物天蚕素B1,与天然抗菌肽天蚕素A相比,二者抗菌活性相似,但天蚕素B1杀死癌细胞能力更强,尤其是对白血病细胞,天蚕素A的IC50值大约是天蚕素B1的IC50值的2–7倍。对比二者铰链区,发现天蚕素B1两段α-螺旋之间的夹角在100°到110°之间,而天蚕素A的夹角在70°到100°之间。天蚕素B1更窄的夹角变化范围可能是导致其对癌细胞具有较高膜裂解能力的原因之一,决定了膜裂解早期抗菌肽向细胞膜的插入效率。柔性铰链结构对抗菌肽生物活性的影响为抗菌肽的构效关系研究及高效低毒抗菌肽的设计提供了更多的可能。
2 铰链结构对抗菌肽生物活性的影响铰链结构对抗菌肽生物活性的影响主要是由于构成铰链的氨基酸结构较为灵活(如甘氨酸),柔性铰链结构赋予抗菌肽更高的结构灵活性,有利于其插入细菌细胞膜,进而增强其抗菌活性,并保持较低的溶血活性[16, 20]。
2.1 对抗菌活性的影响α-螺旋抗菌肽在发挥抗菌活性时会形成特定的二级结构,这需要抗菌肽具备较好的溶解性和一定的结构灵活性。有研究表明,将氨基酸残基(丙氨酸-甘氨酸-脯氨酸-丙氨酸) 作为铰链插入到抗菌肽PAF54中,可增加肽的溶解度,进而提高抗菌肽的抗菌活性[21]。在构成铰链的氨基酸中,脯氨酸由于其亚氨基缺少一个形成氢键的质子,它的出现会破坏α-螺旋结构,导致α-螺旋序列中出现铰链结构[18]。脯氨酸的结构特殊性引起了很多****的关注,并开始深入研究脯氨酸破坏完整的α-螺旋结构对抗菌肽活性的影响。Yang等[22]研究发现脯氨酸能增加抗菌肽骨架弹性,促进抗菌肽穿过细菌细胞壁,并快速到达细胞膜与之结合。此外,Yang等[23]分析了富含脯氨酸的猪骨髓源抗菌肽PMAP-23的二级结构,发现在其序列中心位置存在一个PXXP (X为除脯氨酸外的任意氨基酸) 的灵活铰链结构,将抗菌肽的N端和C端分成两个螺旋区域,应用生物传感技术检测了抗菌肽对细菌细胞膜的绑定和插入过程,发现铰链的存在提高了抗菌肽对细菌细胞膜的插入作用,并提出了如图 2所示的动态模型,抗菌肽首先通过N端的螺旋区域与细胞膜绑定,之后PXXP铰链区发生弯曲旋转,进而带动C端螺旋区域插入到细胞膜的脂质双分子层中。
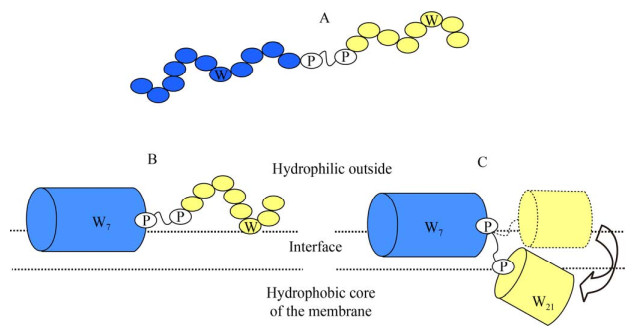 |
| 图 2 抗菌肽PMAP-23与细菌细胞膜相互作用示意图[23] Fig. 2 Proposed model for the interaction of antimicrobial peptide PMAP-23 with bacterial cell membrane[23]. |
| 图选项 |
2.2 对细胞毒性的影响部分抗菌肽存在一定的细胞毒性是制约其在临床中应用的主要原因之一,而铰链结构的引入可降低抗菌肽的毒性,提高细胞选择性。IsCT (ILGKIWEGIKSLF-NH2)是从马达加斯加后棘蝎Opisthacanthus madagascariensis分离得到的13个氨基酸残基的短链抗菌肽,对革兰氏阳性菌和革兰氏阴性菌都具有强抗菌活性,但同时也具有较高的毒性,Lim等[24]通过氨基酸替代,在不改变原肽两亲性的前提下,通过在肽序列中心位置引入脯氨酸,提高了抗菌肽的结构灵活性,大大降低了抗菌肽的细胞毒性。进一步分析发现,构成铰链的氨基酸残基构型不同,对抗菌肽的活性也有较大影响。****们通过将天然抗菌肽中的铰链结构消除,进一步反向证实了铰链结构可降低抗菌肽的细胞毒性。Brevin-1BYa是一种从黄脚蛙皮肤分泌物中分离出来的抗菌肽,由甘氨酸13-脯氨酸14作为铰链连接两端的α-螺旋序列[25]。Timmons等[20]的研究表明,Brevin-1BYa序列中心的脯氨酸与甘氨酸形成氢键,使抗菌肽在螺旋区域间形成灵活铰链结构,而应用丙氨酸替代脯氨酸后,抗菌肽的结构灵活性降低,毒性升高。
2.3 铰链结构影响抗菌肽生物活性的机制抗菌肽的抗菌机制一般分为膜损伤和非膜损伤两种方式[26-27]。铰链结构对这两种作用机制均有影响。
大部分抗菌肽采用膜损伤的杀菌机制,其过程大致可以分为3个阶段(图 3A-D):(1) 膜绑定作用:阳离子抗菌肽与细菌细胞膜上呈负电性成分(如LPS) 通过静电吸引绑定到细菌细胞膜上,然后在疏水作用的影响下,抗菌肽不断聚集,发生构象改变;(2) 与膜相互作用:抗菌肽在细菌表面聚集达到一定阈值浓度后,开始以多种模式(如桶板式、地毯式或环形孔式) 插入细胞膜中;(3) 破坏细胞膜结构,杀死细胞:抗菌肽与细胞膜发生作用后,通过改变膜结构,破坏细胞膜完整性,最终致使细胞死亡[27]。而铰链结构在抗菌肽与细菌细胞膜相互作用过程中发挥着重要作用。Chia等[28]的研究表明,提取自澳大利亚树蛙的抗菌肽caerin 1.1和maculatin 1.1均是由铰链区连接两个螺旋区域的α-螺旋抗菌肽,其在与革兰氏阳性菌作用时,采用地毯模型的膜损伤机制,抗菌肽发生结构弯曲形成微团结构,破坏细菌细胞膜完整性,杀死细菌。
 |
| 图 3 抗菌肽的作用机理[27] Fig. 3 Mechanism underpinning the role of antibacterial peptides[27]. |
| 图选项 |
非膜损伤机制发挥抗菌作用的抗菌肽通过不破坏细胞膜的方式进入细胞,在细胞质中聚集,与特定靶位点结合,通过抑制细菌细胞壁、蛋白或DNA的合成等途径发挥其抗菌作用(图 3 E–I)[27, 29]。而铰链结构会影响抗菌肽进入细胞的效率,进而影响抗菌肽的抗菌活性。Park等[13]研究发现,将buforin Ⅱ铰链区(第11个残基) 的脯氨酸替换为亮氨酸后,抗菌活性显著降低;而除去脯氨酸铰链的buforin Ⅱ衍生物无法穿透细菌细胞质膜,丧失进入细胞的能力,降低了细胞内抗菌肽的有效浓度,抑制了抗菌肽的抗菌效力。
尽管关于抗菌肽作用机理的研究很多,但无论是哪种作用方式,抗菌肽都需要穿过细胞膜,这样的作用方式决定了抗菌肽需要改变构象,而铰链结构的存在能促进抗菌肽在膜环境中形成特定构象。Shin等[30]通过对CA-ME柔性铰链区的替换和删除以探究其对抗菌活性的影响,发现由“甘氨酸-谷氨酰胺-甘氨酸-异亮氨酸-甘氨酸”或“谷氨酰胺-甘氨酸-异亮氨酸”构成的铰链区可以促进肽的C端疏水区穿透细胞膜的脂质双分子层,这对保持膜损伤机制抗菌肽的高抗菌活性是非常重要的。值得注意的是,Shin等[30]在此研究中还指出,铰链结构的引入量需要控制,过多引入柔性铰链结构(甘氨酸-谷氨酰胺-甘氨酸-脯氨酸-甘氨酸) 会使抗菌肽活性急剧降低。
3 铰链结构在抗菌肽分子设计方面的应用铰链结构对抗菌肽生物活性的积极影响使其在分子设计方面得到广泛应用。基于抗菌肽结构特点,对抗菌肽进行改造或全新设计,以获得兼具高抗菌活性和低细胞毒性的抗菌肽是当前的研究热点[31-32]。
3.1 天然抗菌肽改造天然抗菌肽中某些氨基酸残基或片段具有特殊作用,如富含精氨酸和缬氨酸的α-螺旋抗菌肽具有较高的抗菌活性,为高效改造抗菌肽提供了理想模板[33]。定向选取天然抗菌肽序列,对某些特殊位点的氨基酸进行替换是抗菌肽改造最常用且行之有效的方法。Lee等[34]将HP(2-20) 的类似物HPA3改造,用脯氨酸取代了位于HPA3第9位的谷氨酸和第12位的苯丙氨酸,设计得到一个螺旋-铰链-螺旋结构的抗菌肽HPA3P2。与HPA3相比,HPA3P2保持了原肽的高抗菌活性,且显著降低了毒性。而蜂毒素作为高细胞毒性抗菌肽的代表,Saravanan等[35]将蜂毒素部分α-螺旋和铰链区的氨基酸(缬氨酸5、缬氨酸8、亮氨酸11、赖氨酸16) 替换为相应的D-型氨基酸后,有效降低了抗菌肽的溶血活性。
3.2 杂合抗菌肽设计在天然抗菌肽改造基础上,根据需要将不同抗菌肽的活性区域进行截取、通过铰链连接,是一种将不同抗菌肽的优势结合到新的结构中,以开发出兼具多种抗菌肽优点的高效低毒杂合抗菌肽的有效策略[36-37]。Xi等[38]利用此方法,以富含甘氨酸的灵活接头将菌丝霉素和LH28连接,设计得到杂合肽LHP7,与原肽相比,杂合肽LHP7具有更高的抗菌活性和稳定性。更重要的是,利用这种方法还可以实现不同来源抗菌肽间的杂合,以期获得完全不同于原肽的新抗菌肽。尹佳[39]将蛙皮素Ⅱ和提取自日本林蛙的抗菌肽Japonicin Ⅱ用一段柔性序列连接得到了更优的杂合抗菌肽MgJ。
3.3 全新短链抗菌肽设计有****认为天然抗菌肽改造和杂合肽设计可以获得高效低毒的抗菌肽分子,但筛选效率较低,不具有普遍适用性,且与天然抗菌肽序列的高度相似性可能引起免疫原性[40]。因此,越来越多的****将研究焦点转移到全新短链抗菌肽人工设计上。全新短链抗菌肽设计是利用较少种类与有限数量的氨基酸,通过特定排布得到全新序列的短链抗菌肽。相较于天然抗菌肽,全新设计可以定向优化抗菌肽的特定功能,降低细胞毒性和免疫原性,提出适用性更强的抗菌肽设计模板,提高抗菌肽的开发效率,且较短的肽链可大幅降低合成成本,有利于其推广应用。笔者课题组在抗菌肽全新设计及构效关系研究领域做了大量工作,在最新的研究中,笔者在猪源抗菌肽基础上设计得到了全新序列的仅含有12个氨基酸的短链抗菌肽,并阐明了电荷数、疏水性等重要理化参数对十二肽活性的影响[41]。为了研究转角结构对完美螺旋结构抗菌肽生物活性的影响,我们设计了多条序列长度为14个氨基酸、正电荷数为6的短链抗菌肽。结果显示,转角结构的引入有效降低了抗菌肽的细胞毒性,提高了细胞选择性。荧光光谱和电镜观察结果表明,含有转角结构的抗菌肽能够与细菌细胞膜相互作用,通过渗透细胞膜、破坏膜完整性杀死细菌细胞[40]。
4 总结与展望抗生素滥用引发的细菌耐药性问题迫使我们必须加快新型抗菌剂的研发步伐。抗菌肽广谱的抗菌能力以及独特的抗菌机理,使其在医药工业、食品工业、畜牧业、环境科学等领域都具有重要的研发价值与应用前景。但天然抗菌肽抗菌活性低、存在细胞毒性等问题仍是抗菌肽研发与应用的主要阻碍。笔者课题组一直致力于开发高效低毒的抗菌肽分子,已成功设计得到α-螺旋和β-折叠等结构的抗菌肽,但为了提高抗菌肽的活性,降低其系统毒性,我们将在抗菌肽的铰链、环化等特殊结构领域进一步开展研究工作,深入解析抗菌肽的构效关系,以期寻找到更加有效的高效低毒抗菌肽设计方法。
铰链结构作为部分抗菌肽中含有的一种特殊结构,通过赋予抗菌肽结构一定的灵活性,提高抗菌肽进入细菌细胞膜的效率,在增加抗菌肽抗菌活性的同时,降低了抗菌肽的结构刚性,进而降低细胞毒性,提高抗菌肽的细胞选择性,为高效低毒抗菌肽的分子设计提供了新思路。铰链结构的深入挖掘,有望攻克抗菌肽研发的关键技术瓶颈问题。
因此,本文基于抗菌肽的结构特点,总结了铰链结构对抗菌肽生物活性的影响及其在抗菌肽分子设计中的应用。在未来,铰链结构在抗菌肽设计方面的应用将更加广泛,并且随着对抗菌肽构效关系研究的不断深入,将极大地推动抗菌肽替代抗生素在医疗卫生、食品保存、畜牧生产等多领域的广泛应用,保障人类健康。
参考文献
| [1] | Gorityala BK, Guchhait G, Goswami S, et al. Hybrid antibiotic overcomes resistance in P. aeruginosa by enhancing outer membrane penetration and reducing efflux. J Med Chem, 2016, 59(18): 8441-8455. DOI:10.1021/acs.jmedchem.6b00867 |
| [2] | Li JW, Shang L, Lan J, et al. Targeted and intracellular antibacterial activity against S. agalactiae of the chimeric peptides based on pheromone and cell-penetrating peptides. ACS Appl Mater Interfaces, 2020, 12(40): 44459-44474. DOI:10.1021/acsami.0c12226 |
| [3] | Sola R, Mardirossian M, Beckert B, et al. Characterization of cetacean proline-rich antimicrobial peptides displaying activity against ESKAPE pathogens. Int J Mol Sci, 2020, 21(19): 7367. DOI:10.3390/ijms21197367 |
| [4] | Zhang R, Li Y, Zhou M, et al. Photodynamic chitosan nano-assembly as a potent alternative candidate for combating antibiotic-resistant bacteria. ACS Appl Mater Interfaces, 2019, 11(30): 26711-26721. DOI:10.1021/acsami.9b09020 |
| [5] | Man A, Santacroce L, Jacob R, et al. Antimicrobial activity of six essential oils against a group of human pathogens: a comparative study. Parhogens, 2019, 8(1): 15. |
| [6] | Mikut R, Ruden S, Reischl M, et al. Improving short antimicrobial peptides despite elusive rules for activity. Biochim Biophys Acta (BBA)-Biomembranes, 2016, 1858(5): 1024-1033. DOI:10.1016/j.bbamem.2015.12.013 |
| [7] | Lyu YF, Chen TT, Shang L, et al. Design of Trp-rich dodecapeptides with broad-spectrum antimicrobial potency and membrane-disruptive mechanism. J Med Chem, 2019, 62(15): 6941-6957. DOI:10.1021/acs.jmedchem.9b00288 |
| [8] | De Cruz CR, Yamamoto FY, Ju M, et al. Efficacy of purified nucleotide supplements on the growth performance and immunity of hybrid striped bass Morone chrysops x Morone saxatilis. Fish Shellfish Immun, 2020, 98: 868-874. DOI:10.1016/j.fsi.2019.11.046 |
| [9] | Yang ZY, He SQ, Wang JJ, et al. Rational design of short peptide variants by using Kunitzin-RE, an amphibian-derived bioactivity peptide, for acquired potent broad-spectrum antimicrobial and improved therapeutic potential of commensalism coinfection of pathogens. J Med Chem, 2019, 62(9): 4586-4605. DOI:10.1021/acs.jmedchem.9b00149 |
| [10] | Chang R, Subramanian K, Wang M, et al. Enhanced antibacterial properties of self-assembling peptide amphiphiles functionalized with heparin-binding cardin-motifs. ACS Appl Mater Interfaces, 2017, 9(27): 22350-22360. DOI:10.1021/acsami.7b07506 |
| [11] | Winderickx S, De Brucker K, Bird MJ, et al. Structure-activity relationship study of the antimicrobial CRAMP-derived peptide CRAMP20-33. Peptides, 2018, 109: 33-38. DOI:10.1016/j.peptides.2018.08.013 |
| [12] | Joodaki F, Martin LM, Greenfield ML. Computational study of helical and helix-hinge-helix conformations of an anti-microbial peptide in solution by molecular dynamics and vibrational analysis. J Phys Chem B, 2021, 125(3): 703-721. DOI:10.1021/acs.jpcb.0c07988 |
| [13] | Park CB, Yi KS, Matsuzaki K, et al. Structure-activity analysis of buforin Ⅱ, a histone H2A-derived antimicrobial peptide: the proline hinge is responsible for the cell-penetrating ability of buforin Ⅱ. Proc Natl Acad Sci USA, 2000, 97(15): 8245-8250. DOI:10.1073/pnas.150518097 |
| [14] | Holak TA, Engstr?m A, Kraulis PJ, et al. The solution conformation of the antibacterial peptide cecropin A: a nuclear magnetic resonance and dynamical simulated annealing study. Biochemistry, 1988, 27(20): 7620-7629. DOI:10.1021/bi00420a008 |
| [15] | Brady D, Grapputo A, Romoli O, et al. Insect cecropins, antimicrobial peptides with potential therapeutic applications. Int J Mol Sci, 2019, 20(23): 5862. DOI:10.3390/ijms20235862 |
| [16] | Qu P, Gao W, Chen HX, et al. The central hinge link truncation of the antimicrobial peptide fowlicidin-3 enhances its cell selectivity without antibacterial activity loss. Antimicrob Agents Chemother, 2016, 60(5): 2798-2806. DOI:10.1128/AAC.02351-15 |
| [17] | 李杰, 杭柏林, 宁春妹, 等. 牛源cathelicidin类抗菌肽的生物信息学分析. 河南科技学院学报(自然科学版), 2019, 47(1): 37-42. Li J, Hang BL, Ning CM, et al. Bioinformatic analysis of bovine cathelicidin antimicrobial peptides. J Henan Inst Sci Technol (Natl Sci Ed), 2019, 47(1): 37-42 (in Chinese). |
| [18] | Vermeer LS, Lan Y, Abbate V, et al. Conformational flexibility determines selectivity and antibacterial, antiplasmodial, and anticancer potency of cationic α-helical peptides. J Biol Chem, 2012, 287(41): 34120-34133. DOI:10.1074/jbc.M112.359067 |
| [19] | Srisailam S, Arunkumar AI, Wang W, et al. Conformational study of a custom antibacterial peptide cecropin B1: implications of the lytic activity. Biochim Biophys Acta (BBA) Protein Struct Mol Enzymol, 2000, 1479(1/2): 275-285. |
| [20] | Timmons PB, O'Flynn D, Conlon JM, et al. Structural and positional studies of the antimicrobial peptide brevinin-1BYa in membrane-mimetic environments. J Pept Sci, 2019, 25(11): e3208. |
| [21] | López-García B, Harries E, Carmona L, et al. Concatemerization increases the inhibitory activity of short, cell-penetrating, cationic and tryptophan-rich antifungal peptides. Appl Microbiol Biotechnol, 2015, 99(19): 8011-8021. DOI:10.1007/s00253-015-6541-1 |
| [22] | Yang ST, Lee JY, Kim HJ, et al. Contribution of a central proline in model amphipathic α-helical peptides to self-association, interaction with phospholipids, and antimicrobial mode of action. FEBS J, 2006, 273(17): 4040-4054. DOI:10.1111/j.1742-4658.2006.05407.x |
| [23] | Yang ST, Jeon JH, Kim Y, et al. Possible role of a PXXP central hinge in the antibacterial activity and membrane interaction of PMAP-23, a member of cathelicidin family. Biochemistry, 2006, 45(6): 1775-1784. DOI:10.1021/bi051524k |
| [24] | Lim SS, Kim Y, Park Y, et al. The role of the central L- or D-Pro residue on structure and mode of action of a cell-selective α-helical IsCT-derived antimicrobial peptide. Biochem Biophys Res Commun, 2005, 334(4): 1329-1335. DOI:10.1016/j.bbrc.2005.07.029 |
| [25] | Timmons PB, O'Flynn D, Conlon JM, et al. Insights into conformation and membrane interactions of the acyclic and dicarba-bridged brevinin-1BYa antimicrobial peptides. Eur Biophys J, 2019, 48(8): 701-710. DOI:10.1007/s00249-019-01395-y |
| [26] | Malanovic N, Lohner K. Gram-positive bacterial cell envelopes: the impact on the activity of antimicrobial peptides. Biochim Biophys Acta (BBA)-Biomembranes, 2016, 1858(5): 936-946. DOI:10.1016/j.bbamem.2015.11.004 |
| [27] | Jenssen H, Hamill P, Hancock REW. Peptide antimicrobial agents. Clin Microbiol Rev, 2006, 19(3): 491-511. DOI:10.1128/CMR.00056-05 |
| [28] | Chia BCS, Carver JA, Mulhern TD, et al. Maculatin 1.1, an anti-microbial peptide from the Australian tree frog, Litoria genimaculata: solution structure and biological activity. Eur J Biochem, 2000, 267(7): 1894-1908. DOI:10.1046/j.1432-1327.2000.01089.x |
| [29] | 郝刚, 乐国伟, 施用晖. 抗菌肽BuforinⅡ衍生物特异性结合金黄色葡萄球菌DNA抑菌机理的研究. 畜牧兽医学报, 2014, 45(7): 1154-1161. Hao G, Le GW, Shi YH. The bactericidal mechanism of two analogues of the antimicrobial BuforinⅡ specific binding to Staphylococcus aureus genomic DNA. Acta Veter Zootech Sin, 2014, 45(7): 1154-1161 (in Chinese). |
| [30] | Shin SY, Kang JH, Lee DG, et al. Influences of hinge region of a synthetic antimicrobial peptide, cecropin A(1-13)-melittin(1-13) hybrid on antibiotic activity. Bull Korean Chem Soc, 1999, 20(9): 1078-1084. |
| [31] | Shao CX, Li WZ, Tan P, et al. Symmetrical modification of minimized dermaseptins to extend the spectrum of antimicrobials with endotoxin neutralization potency. Int J Mol Sci, 2019, 20(6): 1417. DOI:10.3390/ijms20061417 |
| [32] | Hollmann A, Martinez M, Maturana P, et al. Antimicrobial peptides: interaction with model and biological membranes and synergism with chemical antibiotics. Front Chem, 2018, 6: 204. DOI:10.3389/fchem.2018.00204 |
| [33] | 孙雯宇, 马清泉, 单安山, 等. 富含缬氨酸和赖氨酸的α-螺旋型抗菌肽的设计. 中国预防兽医学报, 2013, 35(12): 1008-1011. Sun WY, Ma QQ, Shan AS, et al. Design of a amphipathic and α-helical antimicrobial peptide with Val and Lys residues. Chin J Preven Veterin Med, 2013, 35(12): 1008-1011 (in Chinese). |
| [34] | Lee JK, Park SC, Hahm KS, et al. A helix-PXXP-helix peptide with antibacterial activity without cytotoxicity against MDRPA-infected mice. Biomaterials, 2014, 35(3): 1025-1039. DOI:10.1016/j.biomaterials.2013.10.035 |
| [35] | Saravanan R, Bhunia A, Bhattacharjya S. Micelle-bound structures and dynamics of the hinge deleted analog of melittin and its diastereomer: implications in cell selective lysis by D-amino acid containing antimicrobial peptides. Biochim Biophys Acta (BBA)-Biomembranes, 2010, 1798(2): 128-139. DOI:10.1016/j.bbamem.2009.07.014 |
| [36] | Tan TT, Wu D, Li WZ, et al. High specific selectivity and membrane-active mechanism of synthetic cationic hybrid antimicrobial peptides based on the peptide FV7. Int J Mol Sci, 2017, 18(2): 339. DOI:10.3390/ijms18020339 |
| [37] | Lee J, Seo CH, Luchian T, et al. Antimicrobial peptide CMA3 derived from the CA-MA hybrid peptide: antibacterial and anti-inflammatory activities with low cytotoxicity and mechanism of action in Escherichia coli. Antimicrob Agents Chemother, 2016, 61(1): 495-506. |
| [38] | Xi D, Teng D, Wang XM, et al. Design, expression and characterization of the hybrid antimicrobial peptide LHP7, connected by a flexible linker, against Staphylococcus and Streptococcus. Process Biochem, 2013, 48(3): 453-461. DOI:10.1016/j.procbio.2013.01.008 |
| [39] | 尹佳. 杂合抗菌肽MgJ基因真核表达载体的构建. 中国酿造, 2013, 32(8): 88-90. Yin J. Construction of the eukaryotic expression vectors for recombinant antibacterial peptide MgJ. China Brew, 2013, 32(8): 88-90 (in Chinese). |
| [40] | Shao CX, Tian HT, Wang TY, et al. Central β-turn increases the cell selectivity of imperfectly amphipathic α-helical peptides. Acta Biomater, 2018, 69: 243-255. DOI:10.1016/j.actbio.2018.01.009 |
| [41] | Lyu YF, Yang CY, Chen TT, et al. Characterization of an antibacterial dodecapeptide from pig as a potential food preservative and its antibacterial mechanism. Food Funct, 2020, 11(5): 4090-4102. DOI:10.1039/D0FO00380H |
