
 , 喻长远1
, 喻长远1

1. 北京化工大学 生命科学与技术学院,北京 100029;
2. 塔里木大学 生命科学学院 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300
收稿日期:2020-08-28;接收日期:2020-12-23
基金项目:中央高校基本科研业务费(No. buctrc201910),京津冀基础研究合作专项(No. 19JCZDJC65800(Z)),国家重点研发计划(No.2017YFA0105900) 资助
摘要:原发性肝癌是一种发生在肝脏的侵袭性肿瘤,具有极易发生转移和复发的特点。原发性肝癌主要包括肝细胞癌、肝内胆管癌、混合肝细胞胆管癌和纤维板层型肝细胞癌等。目前,手术切除、放射性和化学治疗仍是肝癌治疗的主要手段,但其特异性差、临床效果有限,肝癌患者5年总生存率仅为18%。肝癌干细胞是存在于肝癌组织中特定的细胞亚群,具有自我更新能力和强致瘤性,驱动肝癌起始、转移、耐药和复发。因此,肝癌干细胞分子标志物的鉴定及其干性维持机制的阐明,不仅能够揭示肝癌发病的分子机理,也为肝癌的分子分型、预后评估和靶向治疗奠定了理论基础。最新研究表明,5-氟尿嘧啶与CD13抑制剂联合使用,能够抑制CD13+肝癌干细胞的增殖,从而减少肿瘤体积。因此,肝癌干细胞是非常有前景的治疗靶标。文中将从分子标志物、干性维持机制及靶向治疗方面总结肝癌干细胞的最新进展。
关键词:肝癌干细胞分子标志物干性维持机制靶向治疗
Molecular markers and mechanisms for stemness maintenance of liver cancer stem cells: a review
Nan Zhang1, Suhang Bai1, Fuhan Zhang1, Mengran Shi1, Luyao Wang1, Lei Wang1, Lida Xu1, Zhao Yang1,2

 , Changyuan Yu1
, Changyuan Yu1

1. College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China;
2. Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin of Xinjiang Production and Construction Corps, College of Life Science, Tarim University, Alar 843300, Xinjiang, China
Received: August 28, 2020; Accepted: December 23, 2020
Supported by: Fundamental Research Funds for the Central Universities (No. buctrc201910), Beijing-Tianjin-Hebei Basic Research Cooperation Special Project (No. 19JCZDJC65800(Z)), National Key Research and Development Program of China (No. 2017YFA0105900)
Corresponding author: Zhao Yang. Tel: +86-10-64421335; E-mail: yangzhao@mail.buct.edu.cn;
Changyuan Yu. Tel: +86-10-64421335, E-mail: yucy@mail.buct.edu.cn.
Abstract: Primary liver cancer (PLC) is an aggressive tumor and prone to metastasize and recur. According to pathological features, PLC are mainly categorized into hepatocellular carcinoma, intrahepatic cholangiocarcinoma, mixed hepatocellular cholangiocarcinoma, and fibrolamelic hepatocellular carcinoma, etc. At present, surgical resection, radiotherapy and chemotherapy are still the main treatments for PLC, but the specificities are poor and the clinical effects are limited with a 5-year overall survival rate of 18%. Liver cancer stem cells (LCSCs) are a specific cell subset existing in liver cancer tissues. They harbor the capabilities of self-renewal and strong tumorigenicity, driving tumor initiation, metastasis, drug resistance and recurrence of PLC. Therefore, the identification of molecular markers and the illustration of mechanisms for stemness maintenance of LCSCs can not only reveal the molecular mechanisms of PLC tumorigenesis, but also lay a theoretical foundation for the molecular classification, prognosis evaluation and targeted therapy of PLC. The latest research showed that the combination of 5-fluorouracil and CD13 inhibitors could inhibit the proliferation of CD13+ LCSCs, thereby reducing overall tumor burden. Taken together, LCSCs could be the promising therapeutic targets of PLC in the future. This review summarizes the latest progress in molecular markers, mechanisms for stemness maintenance and targeted therapies of LCSCs.
Keywords: liver cancer stem cellsmolecular markersmechanisms for stemness maintenancetargeted therapy
肝癌是一种发生在肝脏的恶性肿瘤,具有复发率高和化学耐药性高的特点[1]。肝癌在全球癌症发病率中位于第6位[2]。在2012年肝癌导致746 000人死亡,成为仅次于肺癌的第二高死亡人数的癌症[3]。最新研究表明,2020年肝和肝内胆管肿瘤的预估新发病例和死亡病例分别为42 810例和30 160例,5年生存率为18%[4]。诱发肝癌的主要因素包括由乙型肝炎病毒和丙型肝炎病毒诱发的病毒性肝炎,以及酗酒和非酒精性脂肪肝疾病。黄曲霉毒素B1和烟草是肝细胞癌的共发展因子,共发展因子的存在能够增加肝癌的发生率[5]。肝内胆管癌是第二常见的肝癌,病因包括原发性硬化胆管炎、胆管囊肿、肝结石病和吸虫性胆道感染[6]。
肝癌主要包括肝细胞癌(Hepatocellular carcinoma,HCC)、肝内胆管癌(Intrahepatic cholangiocarcinoma,ICC)、混合肝细胞胆管癌(Combined hepatocellular and cholangiocarcinoma, cHCC-ICC)和纤维板层型肝细胞癌(Fibrolamellar carcinoma of liver,FLC)等[7]。HCC和ICC是最常见的原发性肝癌,其中HCC约占所有原发性肝癌病例的90%[6]。2010年,美国癌症联合委员会对肝细胞癌的TNM分期系统进行修订,确定肿瘤的数量以及肿瘤内血管入侵程度为肝细胞癌的最重要的预后因素[8]。修订的TNM系统不通过肝硬化和肿瘤分级来确定最终的肿瘤分期,而是采用肝纤维化水平作为临床上重要的分期标准。HCC和ICC的5年生存率分别低于12%[9]和10%[10]。TNMⅠ、Ⅱ和Ⅲ期的5年生存率分别为55%、37%和16%[11]。手术治疗目前仍然是治疗肝癌的主要方案,但是由于术后发生转移和复发的频率很高,因此肝癌预后仍然较差。
肿瘤干细胞(Cancer stem cell,CSC),又称肿瘤起始细胞,是指存在于肿瘤中具有自我更新能力和干细胞特性的一类细胞亚群,具有产生异质性肿瘤的能力,具有高度的侵袭性和致瘤性,能够驱动肿瘤的生长转移和复发[12]。白血病干细胞是最先发现的肿瘤干细胞。1976年,Nowell从白血病患者血液中分离出的某些癌细胞,经过移植后能够重新进行增殖并形成集落最终形成白血病[13]。在此基础上,科学家已经成功在肺癌、乳腺癌、白血病、结直肠癌、宫颈癌、肝癌和膀胱癌中鉴定了肿瘤干细胞[14]。
靶向杀伤肝癌干细胞能够在不影响正常组织活性的条件下,抑制肿瘤的耐药与复发,具有良好的特异性。本文对肝癌干细胞的分子标志物、干性维持机制及靶向治疗研究进展进行综述。
1 肝癌的临床治疗1.1 手术治疗手术切除是治疗保留肝功能HCC患者的主要治疗方式。随着腹腔镜肝脏切除术的进展,使得术中失血量、手术时间和住院时间的缩短[15]。进行手术切除的患者必须有可操作的肿瘤位点、充足的肝脏储备和足够的肝脏剩余。早期HCC并保留肝功能的患者经切除手术的5年生存率可达到40%–70%[11]。术后复发仍然是肝切除治疗的主要问题,常见的复发方式包括肝内局部复发及第二原发灶复发[16]。肝移植具有避免潜在肝硬化、降低术后肝衰竭风险的优势,通常被认为是早期HCC患者的最佳治疗方案[11]。
1.2 化学治疗HCC是一种传统意义上对化学疗法不敏感的恶性肿瘤[17]。化学疗法是治疗晚期肝癌方式之一。它用于治疗不适合进行手术切除和局部射线消融治疗的患者[18]。索拉非尼已被确立为晚期HCC患者一线治疗的标准治疗药物。但索拉非尼对HCC患者的疗效十分有限,患者中位生存期不足1年且肿瘤缓解率不足5%[18]。另外,对于索拉非尼耐药的晚期HCC患者,没有合适的二线化疗药物[19]。阿霉素的联合治疗并未能提高阿霉素对HCC的疗效[17]。
1.3 免疫治疗免疫治疗可以分为增强已有免疫反应和刺激不存在的免疫反应两种策略。增强已有免疫反应主要包括检查点抑制剂和阻断抑制性细胞因子,刺激不存在的免疫反应主要包括过继细胞治疗和靶向抗原抗体治疗[20]。与检查点抑制疗法主动增强免疫反应相反,过继细胞转移治疗是通过离体培养后被动通过自身淋巴细胞来改善HCC预后[21]。在HCC中广泛研究的细胞亚群包括自然杀伤细胞、细胞因子诱导细胞、肿瘤浸润淋巴细胞和嵌合抗原受体T细胞[20]。
1.4 临床问题肝癌的最主要的两个临床问题分别为早期诊断困难及术后复发率高。由于在肝癌治疗的过程中缺少特异性靶点,导致肝癌具有较高的死亡率。最新研究表明,肝癌源自内源性或外源性肝起源的成年肝组织中的肝干细胞[14]。但是,对于肝癌的复发机制尚未明确。肝癌干细胞被认为与肿瘤的生长、转移和复发以及对放化疗的抵抗有关[14]。结合肝癌具有易复发的特性以及肝癌干细胞与复发的相关性,常用临床方法虽能杀死大部分肝癌细胞,但由于对肝癌干细胞的杀伤能力有限,导致肝癌干细胞的存活,并最终引起复发。通过靶向肝癌干细胞进行治疗可能减少肝癌的复发及转移。因此针对所存在的临床问题,本文主要综述了肝癌干细胞标志物和干性维持机制的最新研究进展。
2 肝癌干细胞尽管肝癌的发病机制尚不清楚,但由于肝癌中存在表达不同标志物的肿瘤细胞亚群,因此认为肝癌干细胞是肝癌形成且表现出异质性的关键[14]。关于肝癌干细胞的形成方式仍然存在争议,普遍认为肝祖细胞转化、肝细胞突变或去分化是形成肝癌干细胞的主要方式[22]。根据最新报道,CD44、CD90、CD133、CD13、乙醛脱氢酶(Acetaldehyde dehydrogenase,ALDH)和上皮细胞粘附分子(Epithelial cell adhesion molecule,EpCAM)是肝癌干细胞的分子标志物(图 1);肝癌干细胞主要通过转化生长因子-β (Transforming growth factor-β,TGF-β)[23]、Wnt/β-catenin[24]、Hippo-YAP/TAZ[25]、Hedgehog[26]、Notch[27]和Nanog[28]等信号通路维持干细胞特征。
 |
| 图 1 肝癌干细胞分子标志物 Fig. 1 Molecular markers of liver cancer stem cells. |
| 图选项 |
成熟的肝细胞具有在肝损伤过程中再生的能力,并且可以分化为具有干细胞特性的肝细胞和胆管细胞[22]。Holczbauer等将致癌Ras基因转导入小鼠肝祖细胞、成纤维细胞和成熟肝细胞中。通过转录组分析测定转导细胞的肿瘤干细胞特性。结果表明,转化细胞都具有干细胞特性且上皮间质转化(Epithelial to mesenchymal transition,EMT) 相关基因失调,激活C-myc及其靶基因才能将成年肝细胞重编程为肿瘤干细胞,并导致肿瘤发展[29]。Nishiyama等从人肝癌细胞系SK-HEP-1中诱导了肝癌干细胞表型细胞,并进行了转录组RNA测序分析,通过实时荧光定量PCR和流式细胞仪对EMT相关基因的表达进行测定。与亲代癌细胞相比,肿瘤干细胞导致肝转移的频率显著增加,间充质标志物波形蛋白、转录因子Snail和Twist1表达升高。RNA测序分析结果表明,与亲代肿瘤细胞相比,类肿瘤干细胞中EMT的分子标记显著富集[30]。
肝祖细胞是小的椭圆形的细胞亚群,通常位于赫令氏管和胆小管中。肝祖细胞可分化为肝细胞和胆管细胞并参与肝再生[31]。肝母细胞的大规模转化可能是最直接产生肝癌干细胞的方法[22]。另外,当存在长期炎症和慢性肝病会促进肝祖细胞转化生成肝癌干细胞。Wu等[32]将大鼠多能肝祖细胞在低剂量的TGF-β中连续培养18周,以模拟肝硬化过程中TGF-β表达的增强。结果表明,TGF-β的长期处理导致肝祖细胞的特性受到明显抑制,但CD133表达增加2倍,CD90表达增加1.5倍,自我更新能力明显增强。不仅如此,5-氟尿嘧啶(5-fluorouracil,5-FU) 处理条件下,TGF-β的长期处理组中凋亡细胞的比例为对照组的33%。体内实验表明,TGF-β长期处理组对免疫缺陷小鼠的成瘤率为75%,而对照组的成瘤率为0%。
2.1 分子标志物2.1.1 CD133CD133是报道最多的肝癌干细胞标志物之一[14],其是由Prominin-1基因编码的一种膜糖蛋白[33]。CD133首先被确定为造血干细胞标志物,随后证明其可作为前列腺癌、结肠癌、胃癌和卵巢癌中的肿瘤干细胞的标志物。Paschall等在体外利用5-FU处理结肠癌细胞,结果表明CD133阳性细胞亚群数量增加[34]。Hermann等[35]发现将CD133+ CXCR4+表型的细胞耗竭能够消除转移表型,但不会影响成瘤能力,即CD133+CXCR4+肝癌细胞驱动了肝癌的转移。Suetsugu等从Huh7肝癌细胞系中分离出的CD133+肝癌细胞经体外培养7 d后,细胞由50.8% CD133+肝癌细胞和49.2% CD133–肝癌细胞组成。此外,异种移植实验结果表明,CD133+肝癌细胞形成的肿瘤直径至少为10 mm,而CD133–肝癌细胞仅能形成很小的肿瘤或不能形成肿瘤[36]。Ma等用多柔比星和5-FU对来自HCC细胞系和异种移植模型的CD133+肝癌细胞进行处理。实验结果表明,5-FU处理条件下,CD133+肝癌细胞的凋亡比例为86.99%,低于CD133–肝癌细胞的97.41%;多柔比星处理条件下,CD133+肝癌细胞的凋亡比例为12.8%,低于CD133–肝癌细胞的46.88%[37]。Piao等研究发现与CD133–肝癌细胞相比,CD133+肝癌细胞MAPK/PI3K信号通路被激活。异种移植实验结果表明,皮下注射CD133+肝癌细胞的15只小鼠全部形成肿瘤、注射CD133–肝癌细胞的15只小鼠中仅有6只小鼠形成肿瘤;在接种后8周,以15 Gy对注射CD133+肝癌细胞的小鼠进行辐射,发现小鼠仍可形成肿瘤,而在注射CD133–肝癌细胞的小鼠中无肿瘤形成[38]。以上结果表明,相比于CD133–肝癌细胞,CD133+肝癌细胞具有更强的致瘤性和更强的耐药性,因此说明CD133是肝癌干细胞的标志物。
2.1.2 ALDH乙醛脱氢酶是一种能氧化醛的胞内氧化酶,并且通过将视黄醇氧化为视黄酸参与干细胞分化[39]。ALDH是许多肿瘤干细胞的标志物,包括乳腺癌、膀胱癌、前列腺癌等。Kim等将胰腺癌患者的肿瘤异位移植到非肥胖糖尿病/重症联合免疫缺陷(NOD/SCID) 小鼠中,研究ALDH在胰腺癌形成过程中的作用。结果表明,向NOD/SCID小鼠注射1 000个细胞时,ALDH–/CD133+细胞成瘤率为14.2%;ALDH–/CD133–细胞成瘤率为18.2%,显著低于ALDH+/CD133+细胞成瘤率75%和ALDH+/CD133?细胞成瘤率100%,说明ALDH是与CD133相对独立的肿瘤标志物[40]。Koppaka等对从肝癌细胞系中分离的CD133+肝癌细胞和CD133?肝癌细胞进行了蛋白质分析。结果表明,大多数ALDH+肝癌细胞是CD133+,但并非所有CD133+肝癌细胞都是ALDH+。异种移植实验结果表明,在NOD/SCID小鼠中,500个CD133+ALDH+肝癌细胞足以在小鼠体内形成肿瘤,至少需要1 000个CD133+肝癌细胞或100 000个CD133+ALDH?肝癌细胞才能稳定地产生肿瘤[41]。与CD133单阳性肝癌细胞和ALDH?CD133+肝癌细胞相比,更少的ALDH+CD133+细胞就能形成肿瘤。说明ALDH与CD133双阳性的肝癌细胞具有更强的致瘤能力。
2.1.3 CD90CD90是细胞与外界相互作用的基础,能够对细胞凋亡、粘附、转移和纤维化进行调控[42]。CD90的表达对细胞干性的维持有重要作用,CD90在肝祖细胞中表达在成熟肝细胞中不表达[43]。Jiang等对胃癌干细胞进行了功能鉴定,并在非粘附、无血清的条件下对CD90+胃癌细胞进行富集。高致瘤性组中CD90+细胞的数量和百分比及CD90的RNA表达水平均显著高于低致瘤性组[44]。Yang等对肝癌细胞系和肿瘤样本中肿瘤干细胞进行了功能鉴定。实验结果表明,1 000个CD90+肝癌细胞,能够在裸鼠中形成皮下移植瘤;但10 000个CD90–的肝癌细胞不能在裸鼠中形成肿瘤。所有肿瘤样本中的CD90+CD45–肝癌细胞在重度联合免疫缺陷型小鼠中均能够产生肿瘤[45]。Zhu等根据CD90和CXCR4对肝癌细胞进行分类,其中双阳性细胞占0.2%。将不同细胞亚群连续过继移植到NOD/SCID小鼠中,实验结果表明,与CD90–CXCR4+肝癌细胞相比,CD90+ CXCR4+肝癌细胞具有更高的成球能力和促进癌转移的特性[46]。连续梯度稀释移植实验结果表明,CD90+肝癌细胞具有更强的成瘤能力和转移能力,说明CD90+肝癌细胞具有更强的干细胞特性。
2.1.4 CD44CD44是一种具有多种结构和功能的细胞表面糖蛋白,涉及细胞间的粘附和细胞与胞外基质相互作用,与细胞迁移、细胞增殖和血管生成相关[47]。另有研究表明,CD44是透明质酸的受体,已经被确认为是乳腺癌、结肠癌、前列腺癌、膀胱癌、胰腺癌等多种癌症的肿瘤干细胞标志物。Ghuwalewala等发现从人口腔癌细胞系中分离出的CD44+CD24–细胞中Oct-4、Nanog、Sox2、C-myc等干细胞相关基因表达显著增加,E-钙黏蛋白与波形蛋白的比率显著降低,且能够分化产生其他细胞类型。CD44+CD24–细胞的成球能力有所增强,且CD44+CD24–中侵袭细胞的数量是CD44?CD24+细胞类型的2.5倍[48]。Han等通过引入Oct-4、Sox2、Klf4和C-myc基因的方法建立了肝癌干细胞,并通过CRISPR/Cas9在肝癌干细胞中敲除CD44基因。相比于CD44–肝癌干细胞,CD44+肝癌干细胞中Oct-4、Sox2和Nanog等干细胞标志物的表达增加,且能够分化产生肿瘤细胞[49]。另有研究表明,在Huh7、SMMC7721、MHCCLM3和MHCC97L四种HCC细胞系中,CD44在CD133+的细胞亚群中表达量更高。与CD133+CD44?肝癌细胞相比,CD133+CD44+肝癌细胞的β-catenin和Bmi1的RNA表达水平更高[50]。CD44是多种癌症中的干细胞表面标志物,在肝癌中CD44+细胞同样高表达干细胞相关基因并且具有更强的成瘤能力。
2.1.5 CD13CD13是一种膜结合的锌依赖性Ⅱ型外肽酶,广泛分布在哺乳动物的许多组织中,参与营养物质水解和生物活性分子的降解[14]。Haraguchi等通过实验证明CD13是肝癌干细胞标志物。在NOD/SCID小鼠中,100个CD13+CD133+肝癌细胞能够形成肿瘤(2/4),1 000个CD13–CD133+肝癌细胞能够形成肿瘤(3/4),而CD13–CD133–肝癌细胞未形成肿瘤。CD13在由Huh7诱导形成的肿瘤球细胞中的表达显著增强(对照组中为2.0%,肿瘤球细胞中为67.0%)。多柔比星或5-FU对Huh7处理后,CD13表达量明显增强(对照组中CD13+CD133+为2.0%;阿霉素处理后为40.3%;5-FU处理后为44.3%)[51]。Wang等通过免疫组化和Western Blotting分析了CD13在肝癌中的表达特征。结果表明,CD13在原发性肝癌和转移性肝癌中都高表达[52]。相比于CD13–肝癌细胞,CD13+肝癌细胞具有更强的成瘤能力和耐药性。诱导形成的肿瘤球中CD13表达量明显上升,说明CD13是肝癌干细胞的标志物。
2.1.6 EpCAMEpCAM是由胞外结构域EpEX、胞内结构域EpICD以及跨膜结构域组成的I型跨膜糖蛋白。EpCAM可以介导细胞与细胞之间的接触并将信号传递到核内并调节基因转录[53]。EpCAM不仅在上皮细胞中表达,在组织干细胞和胚胎干细胞中表达显著上调[54]。Yamashita等对235例EpCAM+AFP+肝细胞癌和EpCAM–AFP–肝细胞癌进行免疫组化分析和成瘤实验。异种移植实验结果表明,10 000个EpCAM+肝癌细胞在100%的小鼠中形成肿瘤,而相同数量的EpCAM–肝癌细胞仅在30%的小鼠中形成了肿瘤[55]。Park等通过免疫组化对280例人肝癌组织中EpCAM的表达进行测定。结果表明,EpCAM阳性的患者根治性手术后的复发频率高于EpCAM阴性的患者。在用Hepa1-6细胞进行的小鼠实验中,EpCAMhigh Hepa1-6细胞形成的肿瘤(2 000 cm2) 明显大于EpCAMlow Hepa1-6细胞形成的肿瘤(1 000 cm2)[56]。异种移植实验和复发频率结果表明,EpCAM+细胞具有更强的成瘤能力,EpCAM高表达的患者更容易发生复发,说明EpCAM+细胞具有更强的肿瘤干细胞特性,EpCAM是可靠的肝癌干细胞标志物。
2.2 干性维持机制及靶向治疗策略2.2.1 TGF-βTGF-β能够调控细胞的免疫抑制、生长抑制、EMT、细胞迁移等细胞过程[57]。TGF-β在肿瘤形成的不同时期起到不同的作用。在肿瘤形成的早期阶段,TGF-β能够充当肿瘤抑制因子;在晚期肿瘤中,TGF-β能够促进肿瘤的生长[58]。
TGF-β信号通路主要存在两种形式:依赖Smad蛋白和非依赖Smad蛋白。TGF-β信号通过由Ⅰ型和Ⅱ型丝苏氨酸激酶受体(Transforming growth factor beta receptor 1,TβRⅠ和Transforming growth factor beta receptor 2,TβRⅡ) 构成的跨膜复合物实现信号传导。在复合物活化过程中,TGF-β首先与TβRⅡ结合,从而募集TβRⅠ[59]。活化的TβRI诱导Smad2/3磷酸化,磷酸化的Smad2/3与Smad4形成异聚体,所形成的异聚体在细胞核中积累以调节靶基因的表达。Smad7通过将E3泛素连接酶募集到TβRⅠ,起到抑制Smad的作用。ARKADIA-RNF12-AXIN2通过靶向Smad7的多泛素化和降解来增强TGF-β信号传导。泛素特异性蛋白酶4/15通过去泛素化可以从TβRⅠ去除泛素链,从而稳定TβRⅠ受体。FAF1通过募集VCP/E3连接酶复合物使细胞表面的TβRⅡ不稳定,限制了过量的TGF-β反应[57]。非依赖Smad蛋白的TGF-β途径主要包括几个分支:PI3K-AKT-TOR途径、Erk途径、p38途径和MAPK级联途径[60](图 2)。
 |
| 图 2 转化生长因子-β信号通路[23] Fig. 2 Transforming growth factor-β signaling pathway[23]. |
| 图选项 |
1990年,Evarts等通过免疫组化和原位杂交技术对Solt-Farber原发性肝癌模型中肝癌发生过程进行了研究。他们发现,在肝癌细胞异常增殖的早期过程中,TGF-β1阳性细胞和多能卵圆形细胞紧紧挨在一起,并促进肿瘤的发生[61]。此外,Crosas-Moist等通过基因表达特征分析和免疫组化技术,证明肝硬化性肝癌同时具有胆管癌表型和干细胞基因表达特征。其中,TGF-β通路在肝硬化性肝癌中过表达,并调节肝硬化性肝癌[62]。以上结果表明,TGF-β1与肝癌干细胞的形成相关,并促进肝癌干细胞相关基因的表达。Zhou等通过TGF-β1处理HCC细胞建立了EMT模型,miR-125b的表达受到明显抑制。miR-125b负调控包括ABCC1、ABCG2和PGP在内的多种耐药基因;miR-125b过表达导致Huh7细胞和Li-7细胞形成的肿瘤球直径分别减少了28.13%和33.37%。miR-125b通过Smad2和Smad4抑制HCC细胞的EMT并抑制了N-钙黏蛋白、β-catenin和CD13表达,降低了干细胞特性[63]。Su等的最新研究表明,MAPK激活的Ras反应元件结合蛋白1 (Ras responsive element binding protein 1,RREB1) 将激活的Smad募集到Snail蛋白。染色质易接近性研究结果表明,活化的RREB1和Smad能够促进EMT相关基因表达。肿瘤细胞中TGF-β-Smad和RREB1激活Snail蛋白表达促进肿瘤生长的纤维化因子表达。在小鼠表皮祖细胞中,Nodal-Smad和RREB1结合能够诱导Snail和中胚层分化基因的表达。说明RREB1维持Ras和TGF-β途径之间的分子关联,共同诱导EMT[64]。
Xia等进行的异种移植实验结果表明,先注射Smad活化抑制剂SB431542,然后再使用顺铂进行联合治疗,能够有效减少小鼠的肿瘤体积。SB431542进行预处理后再进行化学疗法,使得肿瘤的质量减小了57%。SB431542预治疗后进行顺铂治疗的小组成瘤率为43%,而所有对照组的成瘤率均为100%。与对照组相比,SB431542治疗后进行顺铂治疗使CD90+肝癌细胞数量减少了89%。顺铂单独治疗使CD90+肝癌细胞亚群数量减少37.5%。说明SB431542通过诱导肝癌干细胞分化,从而增强化学治疗方法的效果[65]。
TGF-β对肿瘤的抑制和促进受环境调控作用明显[66]。TGF-β作为肝癌干细胞干性维持机制的重要组成部分,能够导致肝癌的形成和转移。通过靶向TGF-β信号通路中的特定蛋白,能够靶向抑制TGF-β通路实现靶向抑制肝癌干细胞,减少肝癌的复发和转移从而改良患者的预后。
2.2.2 Wnt/β-cateninWnt/β-catenin通路与多种癌症相关,对细胞的生长、存活和自我更新至关重要。Wnt途径主要分为两个途径:依赖β-catenin途径和不依赖β-catenin途径。在依赖β-catenin的Wnt途径中,Wnt能够抑制β-catenin的降解,从而可以调节多种基因的转录。Wnt蛋白与跨膜卷曲蛋白(Frizzled class receptor,FZD) 和LRP5/6组成的表面受体结合,激活细胞质蛋白Dvl,诱导GSK-3β从Axin蛋白上解离,并导致GSK-3β的表达受到抑制。GSK-3β的抑制导致β-catenin的去磷酸化和降解。在细胞质中积累的β-catenin易位进入细胞核,导致C-myc和细胞周期蛋白D1等靶基因转录,RNF43/ZNRF3促进FZD受体更新。RSPO蛋白与RNF43/ZNRF3结合,导致复合物的泛素化降解和细胞表面FZD蛋白受体增加[67-68]。不依赖β-catenin的Wnt途径主要是Wnt/Ca2+和Wnt/PCP途径。在Wnt/Ca2+途径中,Wnt与FZD的结合激活Dv1,导致Ca2+从内质网释放,激活钙结合蛋白、蛋白激酶C和钙调蛋白依赖性激酶Ⅱ。Ca2+进行的信号转导激活能够活化T细胞的核因子。Wnt/PCP途径由GTP酶RhoA和Ras调控,主要通过RhoA-Rho激酶或JNK相关通路对细胞骨架进行调控[67](图 3)。
 |
| 图 3 Wnt/β-连环蛋白信号通路[24] Fig. 3 Wnt/β-catenin signaling pathway[24]. |
| 图选项 |
2008年,Yang等通过OV6的表达在HCC细胞系和原发性HCC中确定了肿瘤干细胞,发现肿瘤干细胞内Wnt/β-catenin信号通路被激活。在NOD/SCID小鼠中,5 000个OV6+细胞足以形成肿瘤,产生相似肿瘤所需的OV6–细胞至少是OV6+细胞的50–100倍。OV6+HCC祖细胞样细胞的化学耐药性可通过慢病毒传递的靶向β-catenin的microRNA稳定表达而逆转[69]。Yamashita等对235例肿瘤样本进行免疫组化和基因表达特征分析,对EpCAM+肝癌细胞的干细胞特性进行分析。结果表明,EpCAM+细胞具有自我更新和分化的能力,表现肝癌干细胞样特征。Wnt/β-catenin通路激活导致EpCAM+细胞增加。EpCAM为Wnt通路的靶标,通过对EpCAM进行RNA干扰能够抑制肝癌干细胞的活性[55]。Wang等对CD133+CD13+和CD133–CD13–的细胞进行转录组分析,确定lncTCF7在肝癌干细胞中高表达。沉默lncTCF7导致肝癌干细胞相关基因Sox2、Nanog、Oct-4表达下降。与对照组相比,lncTCF7过表达能够促进肿瘤生长(对照组肿瘤体积为2 000 mm3,过表达组肿瘤体积为500 mm3)。lncTCF7募集SWI/SNF复合体到TCF7的启动子以调节其表达,从而激活Wnt信号传导促进肝癌干细胞的自我更新[70]。Fan等对97个石蜡包埋的HCC肿瘤样本进行分析。酪氨酸激酶2的表达与肝癌患者肝癌干细胞标志物的表达,总体生存率和无复发生存率相关。酪氨酸激酶2通过促进HCC细胞中β-catenin的核积累来激活Wnt/β-catenin信号传导,导致HCC复发和索拉非尼耐药。此外,酪氨酸激酶2表达与其启动子甲基化水平呈负相关性[71]。
肝癌中的Mycn的表达与肝癌干细胞中Wnt/β-catenin通路正相关。Qin等对无环类维生素A的抗肿瘤功能进行研究。无环类维生素A抑制Mycn的表达,导致细胞增殖和集落形成受到抑制,促进Caspase-8活化诱导细胞凋亡。流式分选结果表明,EpCAM+细胞Mycn表达增加且对无环类维生素A更敏感。说明无环类维生素A通过抑制Mycn的表达,抑制了Wnt/β-catenin通路,能够靶向杀伤肝癌干细胞[72]。Yen等对Gynura divaricata (GD) 提取物的抗癌和癌症稳定作用进行研究。体外结果表明,GD提取物使Huh7细胞对顺铂治疗敏感并降低肝癌干细胞标志物的表达,并导致Wnt通路的靶基因表达下降。体内实验表明,GD提取物处理的异种移植肿瘤中β-catenin的表达下调。GD提取物处理25 d后,处理组小鼠的肿瘤体积约为对照组的20%[73]。
由于Wnt/ β-catenin通路能够促进肝损伤和肝再生以及肝癌干细胞的干性维持[24],因此通过靶向Wnt/β-catenin通路的抑制剂能够实现特异性杀伤肝癌干细胞,降低肝癌细胞的耐药性和肿瘤的生长速度。由于Wnt/β-catenin通路具有多效性,因此需要开发特异性的递送方法,从而提高特异性[24]。
2.2.3 Hippo-YAP /TAZHippo信号通路能够调节细胞存活、增殖和分化并抑制肿瘤生长,但信号通路发生突变会导致肿瘤过度生长[74]。Hippo信号通路的核心是由一系列MST1/2、SAV1、MOB1和LATS1/2等激酶构成的级联反应。当Hippo信号被激活时,MST1/2通过与SAV1发生相互作用实现MST1/2的磷酸化,导致MOB1和LATS1/2的磷酸化。Yes相关蛋白转录激活位点和PDZ结合位点,在细胞质被磷酸化或降解。当Hippo信号关闭时,YAP/ TAZ去磷酸化并进入细胞核,在核内YAP/TAZ与包括TEAD、Smad和TBX5在内的转录因子形成复合物,对相关基因的表达进行调控[75](图 4)。
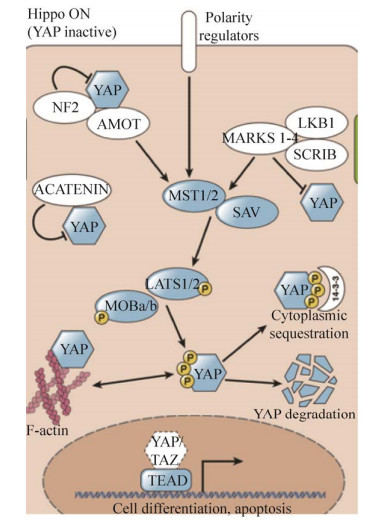 |
| 图 4 Hippo-YAP/TAZ信号通路[25] Fig. 4 Hippo-YAP/TAZ signaling pathway[25]. |
| 图选项 |
2010年,Lu等通过在果蝇中产生SAV1、MST1和MST2的条件等位基因研究Hippo通路与肝癌干细胞形成的相关性。结果表明,MST1/2突变的果蝇肝脏形成多个肿瘤灶,表明MST1和MST2在肝细胞中具有抑癌作用。特异性缺失SAV1可促进MST1和MST2的活化。MST1/2突变的肝组织学和免疫学特征表明,在导管周围区域大量卵形圆细胞积累。说明Hippo通路与肝癌的形成相关,且能够抑制肝癌干细胞的形成[76]。Hayashi等对TAZ/YAP在肝细胞癌中的作用进行了研究。结果表明,TAZ抑制了肝癌细胞的生长。与对照组相比,抑制TAZ蛋白的表达能够降低肝癌细胞对5-FU的耐药性。TAZ敲低诱导了代偿性YAP表达,导致CD90表达上调2倍。用5-FU连续治疗诱导YAP表达并促进体内肿瘤形成。同时敲除TAZ/YAP会降低肝癌细胞的成瘤率(对照组的成瘤率为86.7%,敲除组的成瘤率为0%)。与TAZ敲除相比,YAP敲除促进了HCC细胞的生长,说明TAZ耗尽后YAP表达能够维持肿瘤干细胞特性[77]。Chang等对SWI/SNF蛋白复合物失活的基本机制进行相关研究。结果表明,含有ARID1A的SWI/SNF复合体能作为YAP和TAZ2的抑制剂。ARID1A能够介导YAP/TAZ与SWI/SNF形成复合物。细胞通过机械转导调节ARID1A-SWI/SNF和YAP/TAZ之间的关联。在高机械应力下,核F-肌动蛋白与ARID1A-SWI/SNF结合,从而防止了ARID1A-SWI/SNF-YAP/TAZ复合物的形成,促进TEAD和YAP/TAZ之间的结合[78]。Wang等对Hippo通路在肝细胞癌中失调的原因进行了分析,他们发现MORC2的高表达与肝癌干细胞的致癌性和对索拉非尼的耐药性密切相关[79]。机制方面,MORC2在NF2和KIBRA的启动子上与DNA甲基转移酶形成复合物,导致NF2和KIBRA的启动子超甲基化抑制转录,从而抑制Hippo通路。
Yuan等确定NUAK激酶2是YAP驱动肝癌形成的必要调控因子,并确定抑制剂HTH-02-006能够通过抑制NUAK激酶2的表达实现对Hippo-YAP通路进行调控,从而抑制肿瘤的形成和进展。与对照组相比,HTH-02-006处理后Ki67+细胞比例减少50%。体内实验中,HTH-02-006处理30 d后,处理组与对照组的肿瘤体积分别为150 mm3和250 mm3,表明HTH-02-006具有一定的抗肿瘤活性[80]。Zhao等研究了活性生物碱Evodiamine作用于Hippo-YAP信号通路的效果和机制。异种移植实验结果表明,Evodiamine处理组与对照组28 d后的肿瘤体积分别为200 mm3和500 mm3。随着Evodiamine浓度的增加使Hippo通路中的关键基因MST1/2的水平以及Lats1和YAP蛋白的磷酸化增强,下游效应子CTGF和Survivin的表达下降,说明Evodiamine通过靶向Hippo通路抑制肿瘤生长[81]。
Hippo通路成分在维持哺乳动物的肝细胞静止和调节器官大小中起重要作用,但它们的失调可通过多种机制导致干细胞扩增、过度生长和肿瘤发生[82]。Hippo通路的失调对于肝癌干细胞的干性维持具有重要作用,而YAP/TAZ是通路下游的重要组成部分。因此抑制YAP/TAZ可能是靶向Hippo通路特异性杀伤肝癌干细胞、降低肝癌转移和复发的新治疗方案。
2.2.4 HedgehogHedgehog (HH) 信号通路与胚胎发育、正常组织修复以及EMT相关[83]。传统HH信号通路涉及HHC自催化作用和由SKN、Dispatched蛋白介导HHN配体(IHH, DHH和SHH) 的释放。在PTCH没有与HHN配体结合的情况下,PTCH与SMO相互结合并抑制SMO的活性。HHN配体与PTCH的结合,减弱了PTCH对SMO的抑制作用,导致SMO积聚并阻断COS和SUFU蛋白与Gli转录因子结合,从而释放了Gli转录因子并在核中发挥其作用。KIF3A和β-arrestin完成对SMO定位。Gli1/2促进了与肿瘤发生有关的基因表达模式[84](图 5)。
 |
| 图 5 Hedgehog信号通路[88] Fig. 5 Hedgehog signaling pathway[88]. |
| 图选项 |
为了研究Hedgehog通路在原发性肝癌中的活化情况,Huang等检测了SHH、PTCH1和Gli1在115例HCC和44个癌旁组织中的表达。约60%的HCC中检测到SHH表达,在50%以上的肿瘤中检测到PTCH1和Gli1表达,说明Hedgehog通路在肝癌中被激活。SMO抗原、KAAD-cyclopamine和SHH中和抗体通过抑制Hedgehog通路,能够显著抑制肿瘤细胞生长并诱导其发生细胞凋亡[85]。Wu等对CD13+CD133+细胞和CD13–CD133–细胞进行转录组分析,确定lncHDAC2在原发性肝癌中的表达和功能。结果表明,lncHDAC2在HCC和肝癌干细胞中高表达。在肝癌干细胞中,lncHDAC2将NuRD复合体募集到Hedgehog受体PTCH1的启动子上以抑制其表达,从而激活Hedgehog通路。PTCH1表达水平与HCC分期分级负相关[26]。Zhang等通过实时荧光定量PCR、Western Blot和癌症基因组数据库对CD90+肝癌干细胞中SHH信号通路和CD90表达的相关性进行分析。结果表明,CD90表达与Hedgehog通路中Gli1和Gli3的表达呈正相关。Gli1和Gli3敲低抑制了CD90+肝癌细胞的干细胞特性,说明SHH/Gli通路能够调节CD90+肝癌细胞的干细胞特性[86]。
Philips等以Mdr2–/–小鼠为模型对Hedgehog通路活化与HCC发展的相关性进行研究。结果表明,用Hedgehog通路抑制剂GDC-0449处理Mdr2缺陷的衰老小鼠可显著抑制肝Hedgehog通路活性,减少肝成纤维细胞和肝祖细胞,减少肝纤维化,促进肝内HCC的消退并减少转移性HCC的数量并且降低死亡率[87]。
Hedgehog通路参与肝癌干细胞的干性维持,使细胞在进行化疗期间大部分处于静息状态,从而增强了肝癌干细胞对放化疗的抗性,然后重新分化成为肝癌细胞导致复发并形成潜在的转移灶[88]。Hedgehog通路抑制剂抑制了肝癌干细胞的活性,并实现了肿瘤体积的减少和抑制转移。
2.2.5 NotchNotch通路主要由配体(DLL1,DLL3,DLL4,JAG1,JAG2) 和受体(Notch1–4) 构成。细胞表面的配体与相邻细胞上的受体结合时,Notch途径被激活。Notch途径激活后,通过去整合蛋白、金属蛋白酶ADAM和γ-分泌素引发受体胞质结构域的蛋白水解切割。切割后将Notch细胞内结构域释放到细胞质中,并转移到细胞核中,并且通过CBF1、CSL/RBPJ转录因子激活目的基因转录[89](图 6)。
 |
| 图 6 Notch信号通路 Fig. 6 Notch signaling pathway. |
| 图选项 |
1998年,Varnum-Finney等对造血细胞中Notch-1、Notch-2和Jagged-1的表达进行检测。在Lin-sca-1+c-kit+细胞中检测到Notch-1和Notch-2,在原代培养的鼠胎肝基质和鼠骨髓基质中均检测到Jagged-1。将Lin-sca-1+ c-kit+细胞与3T3细胞共培养后的结果表明,与对照组相比,Jagged-1表达能够显著提高原始前体细胞群的数量(2–3倍)[90]。肝祖细胞转化是形成肝癌干细胞的主要途径之一,说明Notch能够对肝癌干细胞的形成进行调控。Wang等对肝癌干细胞中Notch通路的功能进行确定。成球实验结果表明,与亲代细胞相比,肝癌干细胞中Notch1的mRNA水平提高2倍。异种移植实验结果表明,Notch通路抑制剂DAPT能够抑制荷瘤小鼠中肿瘤的形成和生长(处理组肿瘤体积为500 mm3,对照组肿瘤体积为1 500 mm3)。DAPT处理后,肝癌干细胞相关基因(Nanog和Sox2) 和干细胞分子标志物(CD90、CD44和CD133) 表达均下降。另外,Notch1胞内结构域(NICD) 表达的活性取决于Wnt/β-catenin通路是否被激活。Notch1能够对Wnt/β-catenin通路进行负调控。通过ShRNA敲除Notch1可促进β-catenin的活化[91]。Wang等研究一氧化氮合酶(Nitric oxide synthase,iNOS) 与HCC关系时发现,iNOS在CD24+CD133+肝癌干细胞中特异性表达。iNOS过表达导致Notch1的转录和NICD的表达与相应的对照组相比分别增加了2倍和3.2倍。说明iNOS通过激活Notch通路来促进肝癌干细胞的形成。iNOS产生NO,导致环磷酸鸟苷的产生、PKG的激活和TACE的磷酸化。磷酸化的TACE与iRhom2互作,促进TACE对细胞膜蛋白Notch1进行切割,从而激活Notch通路[27]。
Wu等对新型Notch抑制剂PF-03084014在肝细胞癌中的抗肿瘤和抗转移作用进行研究。与对照组相比,PF-03084014处理组在第2、4、6、8周的肿瘤生长速度分别减少了75%、87%、67%和68.5%。PF-03084014处理8周后的肿瘤体积减小了69%,肿瘤质量减少了68%。0.25 μmol/L DMSO和0.5 μmol/L PF-03084014处理组的单细胞球形成率分别为46%和38%。异种移植实验结果表明,PF-03084014处理组的成瘤率为37.5%,而DMSO处理组的成瘤率为100%[92]。
Notch通路与Wnt/β-catenin通路和Hedgehog通路均为进化程度保守的细胞干性维持通路,与肝癌干细胞形成、血管生成和肿瘤免疫等方面相关[84]。通过为不同的患者确定合理的Notch通路抑制剂,并确定合理的药效生物标志物的方法,能够改善肝癌患者的预后。
2.2.6 NanogNanog位于12号染色体,由4个外显子、3个内含子和1个915 bp的开放阅读框构成。Nanog在整个基因组中多拷贝,包括一个串联重复序列Nanog2 (又被称为NanogP1) 和10个无内含子逆向转座类似物(NanogP2至NanogP11)[93]。细胞能够在转录水平、mRNA水平和蛋白水平对Nanog基因的表达进行调控。在转录水平上,雄激素受体通过与Nanog启动子结合增强表达。缺氧条件下,HIF与Nanog启动子结合促进Nanog的表达。HCV可提高STAT3的活性,并提高pSTAT3与Nanog调控区的结合,从而诱导Nanog表达。PKCα和PKCδ抑制Oct-4-Sox复合体与Nanog启动子结合,促进Nanog转录。在mRNA水平上,大多数miRNA直接结合到Nanog基因的3?-非解链区域互补位点,并诱导翻译抑制和转录降解。在蛋白质水平上,PKCε通过第200位和280位苏氨酸磷酸化来增强Nanog的活性。Nanog与FAK形成复合物,进而使第35位和174位酪氨酸磷酸化,从而提高Nanog活性[28](图 7)。
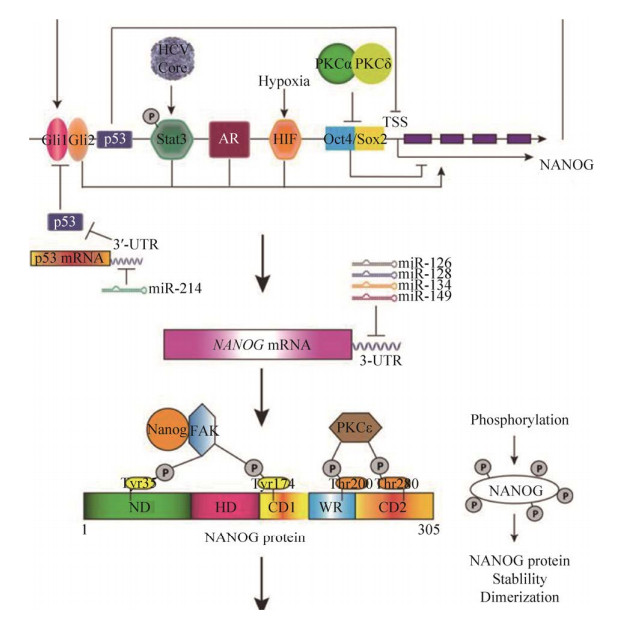 |
| 图 7 Nanog信号通路[28] Fig. 7 Nanog signaling pathway[28]. |
| 图选项 |
2009年,Xu等分别建立了原发性肝细胞癌和复发性肝细胞癌细胞系Hep-11和Hep-12。100个Hep-12细胞能够形成肿瘤而至少需要10 000个Hep-11细胞才能够形成肿瘤;90%以上的Hep-12细胞ALDH检测呈阳性。Western blotting的结果表明Hep-12细胞中Nanog含量显著高于Hep-11,说明Nanog与Hep-12细胞的干细胞特征的维持相关[94]。Kumar等对高胆固醇和饱和脂肪对肝癌形成的影响进行了研究。高胆固醇和饱和脂肪喂养后,NS5A转基因小鼠发生肝肿瘤的比例(39%) 高于不表达HCV-NS5A小鼠(6%)。高胆固醇和饱和脂肪喂养的小鼠肝脏中TLR4、Nanog、pSTAT3和Twist1蛋白的水平增加。与癌旁相比,小鼠肝癌中TLR4、Nanog、pSTAT3和Twist1的水平升高。启动子报告实验结果表明,Twist1转录起始位点–209至–51区间对于Twist1的TLR4依赖性诱导至关重要。高胆固醇、饱和脂肪和HCV-NS5A共同激活TLR4-Nanog-pSTAT3信号通路,可通过增强Twist1的表达促进肝癌干细胞的形成[95]。Siddique等对NUMB-p53相互作用及p53稳定性维持的分子机制进行研究。结果表明,NUMB的磷酸化能够降低p53的稳定性并通过Nanog通路促进肝癌干细胞的自我更新。PKCζ对NUMB进行磷酸化会破坏NUMB-p53相互作用和p53蛋白水解作用,并破坏肝癌干细胞中的自我更新[96]。
Wu等对lncRNA DLX6-AS1影响肝癌干细胞的形成和肝细胞癌发育的机制进行研究。异种移植实验结果表明,lncRNA DLX6-AS1过表达组形成肿瘤的体积是敲低组的4倍(过表达组肿瘤体积为800 mm3,敲低组的肿瘤体积为200 mm3),lncRNA DLX6-AS1过表达组和敲低组的成瘤率分别为10/12和3/12,说明lncRNA DLX6-AS1是潜在的肝癌干细胞治疗靶标[97]。
Nanog是同源域转录因子,其指导未分化的人胚胎干细胞繁殖并进行多能性分化的诱导[98]。通过对Nanog上游调控机制的分析,进一步明确Nanog的表达与肝癌干细胞形成的相关性。可以通过靶向Nanog的上游调控因子,实现特异性杀伤肝癌干细胞,改良患者的预后。
3 总结与展望根据最新报道,CD133、ALDH、CD90、CD44、CD13和EpCAM等多种分子被鉴定为潜在的肝癌干细胞标志物;TGF-β、Wnt/β-catenin、Hippo- YAP/TAZ、Hedgehog、Notch、Nanog等多条信号通路参与肝癌干细胞的干性维持,这为揭示肝癌的发病机制及开发新型靶向治疗策略奠定了基础。但许多肝癌干细胞分子标志物也在正常干细胞表面进行表达,靶向这些标志物的药物会对正常干细胞产生损伤。为了靶向肝癌干细胞且对正常干细胞不会造成不必要的影响,需要更加明确其中的分子差异。采用多种标志物的组合可以特异性标记肝癌干细胞,为靶向肝癌干细胞进行治疗提供基础。
通过开发新型肝癌干细胞分子标志物能够实现靶向肝癌干细胞进行治疗,但是实现靶向肝癌干细胞的治疗仍在存在以下几点问题。首先,缺乏特异性肝癌干细胞标志物。肝癌干细胞分子标志物通常也在正常肝细胞表面高表达,例如CD133在肝母细胞样细胞中高表达[99],Oct-4和Nanog是胚胎干细胞分子标志物,CD44和CD90是骨髓间充质干细胞标志物[100],即目前已经发现的肝癌干细胞分子标志物缺乏特异性。为了提高靶向肝癌干细胞的精确性,亟需开发新型特异性肝癌干细胞标志物。
其次,肝癌干细胞存在很强的异质性。最新实验结果表明,肝癌干细胞内部的不同细胞亚群,分别驱动肿瘤起始、转移、耐药和复发等功能。在药物敏感性实验中,肝癌干细胞的不同亚群对化学治疗药物体现出了不同程度耐药性。上述结果说明肝癌干细胞具有不同的起源和特征,未来的研究需要在单细胞水平进一步解析肝癌干细胞不同亚群的功能。
相关研究表明,分化的肝癌细胞可以通过重编程机制重新生成肝癌干细胞。因此,仅仅针对性地消除已存在的肝癌干细胞并不足以改善患者预后。对肝癌干细胞进行靶向治疗应该从以下3方面进行考虑。1) 肝癌干细胞亚群已经存在于肿瘤中,通过依赖肝癌干细胞分子标志物靶向抑制肝癌干细胞干性维持机制消除肝癌干细胞是目前主要靶向肝癌干细胞的治疗方案。2) 结合重编程机制,筛选促进肿瘤干细胞分化的药物,以防止产生不同类型的肿瘤干细胞。3) 肿瘤微环境及特异亚群的核心转录因子表观遗传修饰网络被视为潜在靶标。尽管不同类型的肿瘤干细胞被不同的信号通路调控,但肿瘤干细胞应该具有相同的由转录因子表观遗传修饰网络调控的转录模式[101]。
全身性放化疗已被证明不能治愈转移性实体瘤,患者通常死于进展性疾病并导致器官衰竭。当前大多数疗法对癌细胞具有细胞毒性或抑制细胞生长的作用,但是它们消除癌细胞干细胞的能力仍然未知。对肿瘤干细胞生物学行为的日益了解为这些细胞的检测、分离和靶向治疗提供了机会。通过更好地了解肝癌干细胞的基本生物学特性,改进功能评估模型以及在生物技术方面取得的相关进展,正在逐步实现特异性杀伤肝癌干细胞、治疗肝癌并抑制其转移和复发,改良患者预后。
参考文献
| [1] | Nio K, Yamashita T, Kaneko S. The evolving concept of liver cancer stem cells. Mol Cancer, 2017, 16(1): 4. DOI:10.1186/s12943-016-0572-9 |
| [2] | Zhang S, Zhou D. Role of the transcriptional coactivators YAP/TAZ in liver cancer. Curr Opin Cell Biol, 2019, 61: 64-71. DOI:10.1016/j.ceb.2019.07.006 |
| [3] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [4] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [5] | Castelli G, Pelosi E, Testa U. Liver cancer: molecular characterization, clonal evolution and cancer stem cells. Cancers (Basel), 2017, 9(9): 127. DOI:10.3390/cancers9090127 |
| [6] | Sia D, Villanueva A, Friedman SL, et al. Liver cancer cell of origin, molecular class, and effects on patient prognosis. Gastroenterology, 2017, 152(4): 745-761. DOI:10.1053/j.gastro.2016.11.048 |
| [7] | Affo S, Yu LX, Schwabe RF. The role of cancer-associated fibroblasts and fibrosis in liver cancer. Annu Rev Pathol, 2017, 12: 153-186. DOI:10.1146/annurev-pathol-052016-100322 |
| [8] | Edge SB, Compton CC. The American joint committee on cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol, 2010, 17(6): 1471-1474. DOI:10.1245/s10434-010-0985-4 |
| [9] | El-Serag HB. Hepatocellular carcinoma. N Engl J Med, 2011, 365(12): 1118-1127. DOI:10.1056/NEJMra1001683 |
| [10] | Rizvi S, Gores GJ. Pathogenesis, diagnosis, and management of cholangiocarcinoma. Gastroenterology, 2013, 145(6): 1215-1229. DOI:10.1053/j.gastro.2013.10.013 |
| [11] | Liu CY, Chen KF, Chen PJ. Treatment of liver cancer. Cold Spring Harb Perspect Med, 2015, 5(9): a021535. DOI:10.1101/cshperspect.a021535 |
| [12] | Henkin RI. Clinical and therapeutic implications of cancer stem cells. N Engl J Med, 2019, 381(10): e19. DOI:10.1056/NEJMc1908886 |
| [13] | Nowell PC. The clonal evolution of tumor cell populations. Science, 1976, 194(4260): 23-28. DOI:10.1126/science.959840 |
| [14] | Sun JH, Luo Q, Liu LL, et al. Liver cancer stem cell markers: progression and therapeutic implications. World J Gastroenterol, 2016, 22(13): 3547-3557. DOI:10.3748/wjg.v22.i13.3547 |
| [15] | Orcutt ST, Anaya DA. Liver Resection and surgical strategies for management of primary liver cancer. Cancer Control, 2018, 25(1): 1073274817744621. |
| [16] | Stewart CL, Warner S, Ito K, et al. Cytoreduction for colorectal metastases: liver, lung, peritoneum, lymph nodes, bone, brain. when does it palliate, prolong survival, and potentially cure?. Curr Probl Surg, 2018, 55(9): 330-379. DOI:10.1067/j.cpsurg.2018.08.004 |
| [17] | Burroughs A, Hochhauser D, Meyer T. Systemic treatment and liver transplantation for hepatocellular carcinoma: two ends of the therapeutic spectrum. Lancet Oncol, 2004, 5(7): 409-418. DOI:10.1016/S1470-2045(04)01508-6 |
| [18] | Ikeda M, Morizane C, Ueno M, et al. Chemotherapy for hepatocellular carcinoma: current status and future perspectives. Jpn J Clin Oncol, 2018, 48(2): 103-114. DOI:10.1093/jjco/hyx180 |
| [19] | Han P, Li H, Jiang X, et al. Dual inhibition of Akt and c-Met as a second-line therapy following acquired resistance to sorafenib in hepatocellular carcinoma cells. Mol Oncol, 2017, 11(3): 320-334. DOI:10.1002/1878-0261.12039 |
| [20] | Johnston MP, Khakoo SI. Immunotherapy for hepatocellular carcinoma: current and future. World J Gastroenterol, 2019, 25(24): 2977-2989. DOI:10.3748/wjg.v25.i24.2977 |
| [21] | Baruch EN, Berg AL, Besser MJ, et al. Adoptive T cell therapy: an overview of obstacles and opportunities. Cancer, 2017, 123(S11): 2154-2162. DOI:10.1002/cncr.30491 |
| [22] | Cheng Z, Li X, Ding J. Characteristics of liver cancer stem cells and clinical correlations. Cancer Lett, 2016, 379(2): 230-238. DOI:10.1016/j.canlet.2015.07.041 |
| [23] | Rao S, Zaidi S, Banerjee J, et al. Transforming growth factor-beta in liver cancer stem cells and regeneration. Hepatol Commun, 2017, 1(6): 477-493. DOI:10.1002/hep4.1062 |
| [24] | Russell JO, Monga SP. Wnt/beta-catenin signaling in liver development, homeostasis, and pathobiology. Annu Rev Pathol, 2018, 13: 351-378. DOI:10.1146/annurev-pathol-020117-044010 |
| [25] | Patel SH, Camargo FD, Yimlamai D. Hippo signaling in the liver regulates organ size, cell fate, and carcinogenesis. Gastroenterology, 2017, 152(3): 533-545. DOI:10.1053/j.gastro.2016.10.047 |
| [26] | Wu J, Zhu P, Lu T, et al. The long non-coding RNA LncHDAC2 drives the self-renewal of liver cancer stem cells via activation of Hedgehog signaling. J Hepatol, 2019, 70(5): 918-929. DOI:10.1016/j.jhep.2018.12.015 |
| [27] | Wang R, Li Y, Tsung A, et al. iNOS promotes CD24+CD133+ liver cancer stem cell phenotype through a TACE/ADAM17-dependent Notch signaling pathway. Proc Natl Acad Sci USA, 2018, 115(43): E10127-E10136. DOI:10.1073/pnas.1722100115 |
| [28] | Gong S, Li Q, Jeter CR, et al. Regulation of NANOG in cancer cells. Mol Carcinog, 2015, 54(9): 679-687. DOI:10.1002/mc.22340 |
| [29] | Holczbauer A, Factor VM, Andersen JB, et al. Modeling pathogenesis of primary liver cancer in lineage-specific mouse cell types. Gastroenterology, 2013, 145(1): 221-231. DOI:10.1053/j.gastro.2013.03.013 |
| [30] | Nishiyama M, Tsunedomi R, Yoshimura K, et al. Metastatic ability and the epithelial-mesenchymal transition in induced cancer stem-like hepatoma cells. Cancer Sci, 2018, 109(4): 1101-1109. DOI:10.1111/cas.13527 |
| [31] | Ko S, Russell JO, Molina LM, et al. Liver progenitors and adult cell plasticity in hepatic injury and repair: knowns and unknowns. Annu Rev Pathol, 2020, 15: 23-50. DOI:10.1146/annurev-pathmechdis-012419-032824 |
| [32] | Wu K, Ding J, Chen C, et al. Hepatic transforming growth factor beta gives rise to tumor-initiating cells and promotes liver cancer development. Hepatology, 2012, 56(6): 2255-2267. DOI:10.1002/hep.26007 |
| [33] | Thamm K, Simaite D, Karbanova J, et al. Prominin-1 (CD133) modulates the architecture and dynamics of microvilli. Traffic, 2019, 20(1): 39-60. DOI:10.1111/tra.12618 |
| [34] | Paschall AV, Yang D, Lu C, et al. CD133+CD24lo defines a 5-fluorouracil-resistant colon cancer stem cell-like phenotype. Oncotarget, 2016, 7(48): 78698-78712. DOI:10.18632/oncotarget.12168 |
| [35] | Hermann PC, Huber SL, Herrler T, et al. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell, 2007, 1(3): 313-323. DOI:10.1016/j.stem.2007.06.002 |
| [36] | Suetsugu A, Nagaki M, Aoki H, et al. Characterization of CD133+ hepatocellular carcinoma cells as cancer stem/progenitor cells. Biochem Biophys Res Commun, 2006, 351(4): 820-824. DOI:10.1016/j.bbrc.2006.10.128 |
| [37] | Ma S, Lee TK, Zheng BJ, et al. CD133+ HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway. Oncogene, 2008, 27(12): 1749-1758. DOI:10.1038/sj.onc.1210811 |
| [38] | Piao LS, Hur W, Kim TK, et al. CD133+ liver cancer stem cells modulate radioresistance in human hepatocellular carcinoma. Cancer Lett, 2012, 315(2): 129-137. DOI:10.1016/j.canlet.2011.10.012 |
| [39] | Kim D, Choi BH, Ryoo IG, et al. High NRF2 level mediates cancer stem cell-like properties of aldehyde dehydrogenase (ALDH)-high ovarian cancer cells: inhibitory role of all-trans retinoic acid in ALDH/NRF2 signaling. Cell Death Dis, 2018, 9(9): 896. DOI:10.1038/s41419-018-0903-4 |
| [40] | Kim MP, Fleming JB, Wang H, et al. ALDH activity selectively defines an enhanced tumor-initiating cell population relative to CD133 expression in human pancreatic adenocarcinoma. PLoS ONE, 2011, 6(6): e20636. DOI:10.1371/journal.pone.0020636 |
| [41] | Koppaka V, Thompson DC, Chen Y, et al. Aldehyde dehydrogenase inhibitors: a comprehensive review of the pharmacology, mechanism of action, substrate specificity, and clinical application. Pharmacol Rev, 2012, 64(3): 520-539. DOI:10.1124/pr.111.005538 |
| [42] | Kumar A, Bhanja A, Bhattacharyya J, et al. Multiple roles of CD90 in cancer. Tumour Biol, 2016, 37(9): 11611-11622. DOI:10.1007/s13277-016-5112-0 |
| [43] | Weiss TS, Dayoub R. Thy-1 (CD90)-positive hepatic progenitor cells, hepatoctyes, and non-parenchymal liver cells isolated from human livers. Methods Mol Biol, 2017, 1506: 75-89. |
| [44] | Jiang J, Zhang Y, Chuai S, et al. Trastuzumab (herceptin) targets gastric cancer stem cells characterized by CD90 phenotype. Oncogene, 2012, 31(6): 671-682. DOI:10.1038/onc.2011.282 |
| [45] | Yang ZF, Ho DW, Ng MN, et al. Significance of CD90+ cancer stem cells in human liver cancer. Cancer Cell, 2008, 13(2): 153-166. DOI:10.1016/j.ccr.2008.01.013 |
| [46] | Zhu L, Zhang W, Wang J, et al. Evidence of CD90+CXCR4+ cells as circulating tumor stem cells in hepatocellular carcinoma. Tumour Biol, 2015, 36(7): 5353-5360. DOI:10.1007/s13277-015-3196-6 |
| [47] | Chen C, Zhao S, Karnad A, et al. The biology and role of CD44 in cancer progression: therapeutic implications. J Hematol Oncol, 2018, 11(1): 64. DOI:10.1186/s13045-018-0605-5 |
| [48] | Ghuwalewala S, Ghatak D, Das P, et al. CD44(high) CD24(low) molecular signature determines the cancer stem cell and EMT phenotype in oral squamous cell carcinoma. Stem Cell Res, 2016, 16(2): 405-417. DOI:10.1016/j.scr.2016.02.028 |
| [49] | Han S, Guo J, Liu Y, et al. Knock out CD44 in reprogrammed liver cancer cell C3A increases CSCs stemness and promotes differentiation. Oncotarget, 2015, 6(42): 44452-44465. DOI:10.18632/oncotarget.6090 |
| [50] | Zhu Z, Hao X, Yan M, et al. Cancer stem/progenitor cells are highly enriched in CD133+CD44+ population in hepatocellular carcinoma. Int J Cancer, 2010, 126(9): 2067-2078. |
| [51] | Haraguchi N, Ishii H, Mimori K, et al. CD13 is a therapeutic target in human liver cancer stem cells. J Clin Invest, 2010, 120(9): 3326-3339. DOI:10.1172/JCI42550 |
| [52] | Wang Q, Chen N, Yu C, et al. Aberrant expression of CD13 and stem cell markers in CD133– induced liver cancer in mice. J BUON, 2019, 24(4): 1408-1413. |
| [53] | Martowicz A, Seeber A, Untergasser G. The role of EpCAM in physiology and pathology of the epithelium. Histol Histopathol, 2016, 31(4): 349-355. |
| [54] | Dolle L, Theise ND, Schmelzer E, et al. EpCAM and the biology of hepatic stem/progenitor cells. Am J Physiol Gastrointest Liver Physiol, 2015, 308(4): G233-250. DOI:10.1152/ajpgi.00069.2014 |
| [55] | Yamashita T, Ji J, Budhu A, et al. EpCAM-positive hepatocellular carcinoma cells are tumor-initiating cells with stem/progenitor cell features. Gastroenterology, 2009, 136(3): 1012-1024. DOI:10.1053/j.gastro.2008.12.004 |
| [56] | Park DJ, Sung PS, Kim JH, et al. EpCAM-high liver cancer stem cells resist natural killer cell-mediated cytotoxicity by upregulating CEACAM1. J Immunother Cancer, 2020, 8(1): e000301. DOI:10.1136/jitc-2019-000301 |
| [57] | Xie F, Ling L, van Dam H, et al. TGF-beta signaling in cancer metastasis. Acta Biochim Biophys Sin (Shanghai), 2018, 50(1): 121-132. DOI:10.1093/abbs/gmx123 |
| [58] | Huynh LK, Hipolito CJ, Ten Dijke P. A perspective on the development of TGF-beta inhibitors for cancer treatment. Biomolecules, 2019, 9(11): 743. DOI:10.3390/biom9110743 |
| [59] | Wrana JL, Attisano L, Wieser R, et al. Mechanism of activation of the TGF-beta receptor. Nature, 1994, 370(6488): 341-347. DOI:10.1038/370341a0 |
| [60] | Zhang YE. Non-Smad signaling pathways of the TGF-beta family. Cold Spring Harb Perspect Biol, 2017, 9(2): a022129. DOI:10.1101/cshperspect.a022129 |
| [61] | Evarts RP, Nakatsukasa H, Marsden ER, et al. Cellular and molecular changes in the early stages of chemical hepatocarcinogenesis in the rat. Cancer Res, 1990, 50(11): 3439-3444. |
| [62] | Crosas-Molist E, Bertran E, Fabregat I. Cross-talk between TGF-beta and NADPH oxidases during liver fibrosis and hepatocarcinogenesis. Curr Pharm Des, 2015, 21(41): 5964-5976. DOI:10.2174/1381612821666151029112126 |
| [63] | Zhou JN, Zeng Q, Wang HY, et al. MicroRNA-125b attenuates epithelial-mesenchymal transitions and targets stem-like liver cancer cells through small mothers against decapentaplegic 2 and 4. Hepatology, 2015, 62(3): 801-815. DOI:10.1002/hep.27887 |
| [64] | Su J, Morgani SM, David CJ, et al. TGF-beta orchestrates fibrogenic and developmental EMTs via the RAS effector RREB1. Nature, 2020, 577(7791): 566-571. DOI:10.1038/s41586-019-1897-5 |
| [65] | Xia W, Lo CM, Poon RYC, et al. Smad inhibitor induces CSC differentiation for effective chemosensitization in cyclin D1- and TGF-beta/Smad-regulated liver cancer stem cell-like cells. Oncotarget, 2017, 8(24): 38811-38824. DOI:10.18632/oncotarget.16402 |
| [66] | Katz LH, Likhter M, Jogunoori W, et al. TGF-beta signaling in liver and gastrointestinal cancers. Cancer Lett, 2016, 379(2): 166-172. DOI:10.1016/j.canlet.2016.03.033 |
| [67] | Krishnamurthy N, Kurzrock R. Targeting the Wnt/beta-catenin pathway in cancer: update on effectors and inhibitors. Cancer Treat Rev, 2018, 62: 50-60. DOI:10.1016/j.ctrv.2017.11.002 |
| [68] | Yan KS, Janda CY, Chang J, et al. Non-equivalence of Wnt and R-spondin ligands during Lgr5+ intestinal stem-cell self-renewal. Nature, 2017, 545(7653): 238-242. DOI:10.1038/nature22313 |
| [69] | Yang W, Yan HX, Chen L, et al. Wnt/beta-catenin signaling contributes to activation of normal and tumorigenic liver progenitor cells. Cancer Res, 2008, 68(11): 4287-4295. DOI:10.1158/0008-5472.CAN-07-6691 |
| [70] | Wang Y, He L, Du Y, et al. The long noncoding RNA lncTCF7 promotes self-renewal of human liver cancer stem cells through activation of Wnt signaling. Cell Stem Cell, 2015, 16(4): 413-425. DOI:10.1016/j.stem.2015.03.003 |
| [71] | Fan Z, Duan J, Wang L, et al. PTK2 promotes cancer stem cell traits in hepatocellular carcinoma by activating Wnt/beta-catenin signaling. Cancer Lett, 2019, 450: 132-143. DOI:10.1016/j.canlet.2019.02.040 |
| [72] | Qin XY, Suzuki H, Honda M, et al. Prevention of hepatocellular carcinoma by targeting MYCN-positive liver cancer stem cells with acyclic retinoid. Proc Natl Acad Sci USA, 2018, 115(19): 4969-4974. DOI:10.1073/pnas.1802279115 |
| [73] | Yen CH, Lai CC, Shia TH, et al. Gynura divaricata attenuates tumor growth and tumor relapse after cisplatin therapy in HCC xenograft model through suppression of cancer stem cell growth and Wnt/beta-catenin signalling. J Ethnopharmacol, 2018, 213: 366-375. DOI:10.1016/j.jep.2017.07.019 |
| [74] | Taha Z, Janse van Rensburg HJ, Yang X. The Hippo Pathway: immunity and cancer. Cancers (Basel), 2018, 10(4): 94. DOI:10.3390/cancers10040094 |
| [75] | Park JA, Kwon YG. Hippo-YAP/TAZ signaling in angiogenesis. BMB Rep, 2018, 51(3): 157-162. DOI:10.5483/BMBRep.2018.51.3.016 |
| [76] | Lu L, Li Y, Kim SM, et al. Hippo signaling is a potent in vivo growth and tumor suppressor pathway in the mammalian liver. Proc Natl Acad Sci USA, 2010, 107(4): 1437-1442. DOI:10.1073/pnas.0911427107 |
| [77] | Hayashi H, Higashi T, Yokoyama N, et al. An imbalance in TAZ and YAP expression in hepatocellular carcinoma confers cancer stem cell-like behaviors contributing to disease progression. Cancer Res, 2015, 75(22): 4985-4997. DOI:10.1158/0008-5472.CAN-15-0291 |
| [78] | Chang L, Azzolin L, Di Biagio D, et al. The SWI/SNF complex is a mechanoregulated inhibitor of YAP and TAZ. Nature, 2018, 563(7730): 265-269. DOI:10.1038/s41586-018-0658-1 |
| [79] | Wang T, Qin ZY, Wen LZ, et al. Epigenetic restriction of Hippo signaling by MORC2 underlies stemness of hepatocellular carcinoma cells. Cell Death Differ, 2018, 25(12): 2086-2100. DOI:10.1038/s41418-018-0095-6 |
| [80] | Yuan WC, Pepe-Mooney B, Galli GG, et al. NUAK2 is a critical YAP target in liver cancer. Nat Commun, 2018, 9(1): 4834. DOI:10.1038/s41467-018-07394-5 |
| [81] | Zhao S, Xu K, Jiang R, et al. Evodiamine inhibits proliferation and promotes apoptosis of hepatocellular carcinoma cells via the Hippo-Yes-associated protein signaling pathway. Life Sci, 2020, 251: 117424. DOI:10.1016/j.lfs.2020.117424 |
| [82] | Clara JA, Monge C, Yang Y, et al. Targeting signalling pathways and the immune microenvironment of cancer stem cells—a clinical update. Nat Rev Clin Oncol, 2020, 17(4): 204-232. |
| [83] | Guen VJ, Chavarria TE, Kroger C, et al. EMT programs promote basal mammary stem cell and tumor-initiating cell stemness by inducing primary ciliogenesis and Hedgehog signaling. Proc Natl Acad Sci USA, 2017, 114(49): E10532-E10539. DOI:10.1073/pnas.1711534114 |
| [84] | Takebe N, Miele L, Harris PJ, et al. Targeting Notch, Hedgehog, and Wnt pathways in cancer stem cells: clinical update. Nat Rev Clin Oncol, 2015, 12(8): 445-464. DOI:10.1038/nrclinonc.2015.61 |
| [85] | Huang S, He J, Zhang X, et al. Activation of the hedgehog pathway in human hepatocellular carcinomas. Carcinogenesis, 2006, 27(7): 1334-1340. DOI:10.1093/carcin/bgi378 |
| [86] | Zhang K, Che S, Pan C, et al. The SHH/Gli axis regulates CD90– mediated liver cancer stem cell function by activating the IL6/JAK2 pathway. J Cell Mol Med, 2018, 22(7): 3679-3690. DOI:10.1111/jcmm.13651 |
| [87] | Philips GM, Chan IS, Swiderska M, et al. Hedgehog signaling antagonist promotes regression of both liver fibrosis and hepatocellular carcinoma in a murine model of primary liver cancer. PLoS ONE, 2011, 6(9): e23943. DOI:10.1371/journal.pone.0023943 |
| [88] | Hanna A, Shevde LA. Hedgehog signaling: modulation of cancer properies and tumor mircroenvironment. Mol Cancer, 2016, 15: 24. DOI:10.1186/s12943-016-0509-3 |
| [89] | Matsui WH. Cancer stem cell signaling pathways. Medicine (Baltimore), 2016, 95(1 Suppl 1): S8-S19. |
| [90] | Varnum-Finney B, Purton LE, Yu M, et al. The Notch ligand, Jagged-1, influences the development of primitive hematopoietic precursor cells. Blood, 1998, 91(11): 4084-4091. DOI:10.1182/blood.V91.11.4084 |
| [91] | Wang R, Sun Q, Wang P, et al. Notch and Wnt/beta-catenin signaling pathway play important roles in activating liver cancer stem cells. Oncotarget, 2016, 7(5): 5754-5768. DOI:10.18632/oncotarget.6805 |
| [92] | Wu CX, Xu A, Zhang CC, et al. Notch inhibitor PF-03084014 inhibits hepatocellular carcinoma growth and metastasis via suppression of cancer stemness due to reduced activation of Notch1-Stat3. Mol Cancer Ther, 2017, 16(8): 1531-1543. DOI:10.1158/1535-7163.MCT-17-0001 |
| [93] | Yang F, Zhang J, Liu Y, et al. Structure and functional evaluation of porcine NANOG that is a single-exon gene and has two pseudogenes. Int J Biochem Cell Biol, 2015, 59: 142-152. DOI:10.1016/j.biocel.2014.12.009 |
| [94] | Xu XL, Xing BC, Han HB, et al. The properties of tumor-initiating cells from a hepatocellular carcinoma patient's primary and recurrent tumor. Carcinogenesis, 2010, 31(2): 167-174. DOI:10.1093/carcin/bgp232 |
| [95] | Uthaya Kumar DB, Chen CL, Liu JC, et al. TLR4 signaling via NANOG cooperates with STAT3 to activate Twist1 and promote formation of tumor-initiating stem-like cells in livers of mice. Gastroenterology, 2016, 150(3): 707-719. DOI:10.1053/j.gastro.2015.11.002 |
| [96] | Siddique HR, Feldman DE, Chen CL, et al. NUMB phosphorylation destabilizes p53 and promotes self-renewal of tumor-initiating cells by a NANOG-dependent mechanism in liver cancer. Hepatology, 2015, 62(5): 1466-1479. DOI:10.1002/hep.27987 |
| [97] | Wu DM, Zheng ZH, Zhang YB, et al. Down- regulated lncRNA DLX6-AS1 inhibits tumorigenesis through STAT3 signaling pathway by suppressing CADM1 promoter methylation in liver cancer stem cells. J Exp Clin Cancer Res, 2019, 38(1): 237. DOI:10.1186/s13046-019-1239-3 |
| [98] | van Schaijik B, Davis PF, Wickremesekera AC, et al. Subcellular localisation of the stem cell markers OCT4, SOX2, NANOG, KLF4 and c-MYC in cancer: a review. J Clin Pathol, 2018, 71(1): 88-91. DOI:10.1136/jclinpath-2017-204815 |
| [99] | Wang J, Sun M, Liu W, et al. Stem cell-based therapies for liver diseases: an overview and update. Tissue Eng Regen Med, 2019, 16(2): 107-118. DOI:10.1007/s13770-019-00178-y |
| [100] | Li H, Ghazanfari R, Zacharaki D, et al. Isolation and characterization of primary bone marrow mesenchymal stromal cells. Ann N Y Acad Sci, 2016, 1370(1): 109-118. DOI:10.1111/nyas.13102 |
| [101] | Eun K, Ham SW, Kim H. Cancer stem cell heterogeneity: origin and new perspectives on CSC targeting. BMB Rep, 2017, 50(3): 117-125. DOI:10.5483/BMBRep.2017.50.3.222 |
