
 , 孙于茹1,4, 李金磊1, 宋英今1, 颜蓓蓓1
, 孙于茹1,4, 李金磊1, 宋英今1, 颜蓓蓓1 1. 天津大学 环境科学与工程学院,天津 300072;
2. 西藏大学 理学院,西藏 拉萨 850012;
3. 天津商业大学,天津 300134;
4. 北京建工环境修复股份有限公司 污染场地安全修复技术国家工程实验室,北京 100015
收稿日期:2021-02-02;接收日期:2021-04-16;网络出版时间:2021-05-11
基金项目:天津市自然科学基金(No. 19JCQNJC13900),河北省重点研发计划(No. 18226507D) 资助
作者简介:陈冠益??天津大学、天津商业大学、西藏大学理学院教授、博士生导师,天津商业大学副校长。现为天津市可持续发展研究会理事长、国家乡村环境治理科技创新联盟副理事长、国际标准化组织ISO-TC255技术委员会环境与安全工作组WG4召集人、天津市生物质废物利用重点实验室主任。入选********、全国优秀科技工作者,享受国务院政府特殊津贴。主要研究领域为废弃物生物质高效利用及相关的环境污染控制。排名第一获得国家科学技术进步奖二等奖、环境保护科学技术奖一等奖、天津市技术发明奖和科技进步奖一等奖、天津市专利金奖、中国可再生能源学会科学技术奖一等奖以及教育部/环保部科技进步二等奖。近5年作为主席组织国际会议/研讨会6次,在国际会议/研讨会受邀报告近20次;主讲“大气污染控制”国家精品课程,获得国家教学成果二等奖和天津市教学成果一等奖。累计发表论文300余篇,授权专利37项,主编专著6部.
摘要:随着人民生活水平的提高,环境保护问题愈发受到人们重视。其中石油烃的土壤污染因其持续时间长、污染去除难度大而受到广泛关注。在各类修复技术中,原位微生物修复强化技术因其成本较低、环境影响小、无二次污染、可原位修复的特点成为了当前的技术热门。文中综述了生物投加法、生物刺激法、联合修复法等原位微生物修复技术,并介绍了一些典型工程案例,为原位微生物修复强化技术的选择及工程应用提供了参考,并对未来原位微生物修复强化技术的研究重点进行了展望。
关键词:石油污染土壤微生物降解石油烃微生物修复生物强化
Advances in bioremediation of hydrocarbon-contaminated soil
Lei Zhong1, Jinwu Qing1, Hongyun Chen1, Gaoyuan Li1, Guanyi Chen1,2,3

 , Yuru Sun1,4, Jinlei Li1, Yingjin Song1, Beibei Yan1
, Yuru Sun1,4, Jinlei Li1, Yingjin Song1, Beibei Yan1 1. School of Environmental Science and Engineering, Tianjin University, Tianjin 300072, China;
2. School of Sciences, Tibet University, Lhasa 850012, Tibet, China;
3. Tianjin University of Commerce, Tianjin 300134, China;
4. National Engineering Laboratory for Site Remediation Technologies, Beijing Construction Engineering Group Environmental Remediation Co., Ltd., Beijing 100015, China
Received: February 2, 2021; Accepted: April 16, 2021; Published: May 11, 2021
Supported by: Natural Science Foundation of Tianjin, China (No. 19JCQNJC13900), Key Research and Development Project of Hebei Province, China (No. 18226507D)
Corresponding author: Guanyi Chen. Tel: +86-22-87401929; E-mail: chen@tju.edu.cn.
Abstract: With continuous improvement of people's living standards, great efforts have been paid to environmental protection. Among those environmental issues, soil contamination by petroleum hydrocarbons has received widespread concerns due to the persistence and the degradation difficulty of the pollutants. Among the various remediation technologies, in-situ microbial remediation enhancement technologies have become the current hotspot because of its low cost, environmental friendliness, and in-situ availability. This review summarizes several in-situ microbial remediation technologies such as bioaugmentation, biostimulation, and integrated remediation, as well as their engineering applications, providing references for the selection of in-situ bioremediation technologies in engineering applications. Moreover, this review discusses future research directions in this area.
Keywords: petroleum contaminated soilmicrobial degradationpetroleum hydrocarbonsmicrobial remediationbiological enhancement
石油,被誉为工业的血液,是人类工业社会必不可少的资源。随着人类工业的发展,越来越多的土地也随之被石油所污染。石油井、炼油厂、加油站甚至是道路两旁的农田中的土壤石油烃含量都较高。而石油因其自身特殊的理化性质,在进入土壤后会对土壤造成持久且难以修复的破坏,对生活在其上的动植物生态系统造成严重的不良影响[1-2]。目前,土壤石油烃污染的修复技术主要有物理法、化学法和生物法[3-4]。而生物法中的原位微生物修复及其强化技术因其高效、经济、环境友好等优点成为了研究热点,被认为是理想的修复手段[5]。早在1972年,美国在清除宾夕法尼亚州的Ambler管线汽油泄露事件中便运用了微生物修复技术,而后在1989年Exxon石油公司Valdez油轮在阿拉斯加海滩溢油事件中开启了微生物修复的首次大规模应用[6]。在土壤修复方面,早在1992年的阿根廷Puerto Rosales附近的油罐泄露事件便通过营养物质投加的微生物刺激修复技术清除了700 t的石油污染。仅在国内,微生物修复技术在胜利油田、辽河油田和吉林油田进行的工程应用便累计处理超120 000 t污染土壤,取得了巨大的经济和生态效益。可见,石油烃污染的微生物修复技术具有良好的修复效果及应用前景。
本文基于国内外现有的研究成果,着重从技术特点、修复效果、优缺点等方面对实际应用的石油烃土壤污染的原位微生物修复及其强化技术进行了综述。在此基础上,对该技术的发展方向进行了展望,为我国石油烃土壤污染的微生物修复技术应用研究提供参考。
1 微生物修复机理及影响条件微生物具有对复杂多样物质的分解代谢能力与强大的适应性,因此针对石油烃污染,在自然选择的作用下,部分微生物可进化出降解石油烃的能力。目前已知的能够降解石油烃的微生物有100余属、200多种,包括细菌、真菌、放线菌、及藻类[7-9]。在一般环境中,能降解石油烃的微生物仅占群落总数的不到1%;而在石油烃污染环境中,降解菌的比例可达到10%左右[10]。一般认为,细菌对石油烃的降解能力比真菌、放线菌强得多。但李凤梅等[11]在辽河油田石油污染土壤中采集筛选得到的土著降解菌对辽河油田洼一联采油厂的稠油降解效果研究表明F2006黄曲霉菌(真菌) 的降解能力最好。许多放线菌也具有石油烃的降解能力,但它们很难在污染土壤中取得竞争优势[12]。而藻类和某些原生动物的降解能力不太显著,鲜有相关研究。
微生物可通过对石油烃的代谢,将石油烃污染物质代谢生成如水、二氧化碳、微生物自身的生物量等无毒稳定物质而完成对污染的修复。
1.1 石油烃的组成石油的主要成分是由碳和氢两种元素(约占组成石油的元素的96%–99%) 组成的碳氢化合物。碳氢化合物简称烃,它是石油加工和利用的主要对象。
石油烃作为一类在环境中广泛存在的有机污染物质,包括了各类石油燃料、润滑剂和石油化学品。尽管各类石油烃的物理、化学、生物降解性能均不相同,但从化学组成结构上可以把石油碳氢化合物分子分为四大类:饱和烃(支链、无支链烷烃和环烷烃)、芳香族环烃分子如单环芳烃和多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)、树脂(溶于饱和芳烃中的极性油表面结构)[13]以及沥青质(呈胶态分散在饱和烃和芳烃中的深棕色非晶固体)[13-14]。
根据Van Hamme等[15]的研究,微生物降解各类石油烃能力的相对强弱为直链烷烃 > 支链烷烃 > 低分子量的烷基芳烃 > 单环芳烃 > 环烷烃 > 多环芳烃 > 沥青质。也即石油烃污染物质碳链越短,结构越简单,越容易被微生物降解。
1.2 微生物降解与修复机理不同微生物对于土壤石油烃污染的降解性能、代谢反应条件有所差别,但基本途径却相同:吸附、转运、降解。首先石油烃物质被吸附于微生物细胞膜上;而后微生物通过细胞膜对石油烃物质进行传递,传递至细胞内部;最后微生物通过细胞生理反应、酶促反应将石油烃物质分解成为CO2、H2O及无污染无毒物质等。
其中微生物对石油烃的降解有两种主要的方式:以石油烃作为唯一的碳源和能源或将石油烃与其他有机质进行共代谢。Bertrand等[16]与Rontani等[17]的研究发现微生物会通过共氧化作用对难降解的沥青质进行降解,且依赖于共代谢物质烷烃(C12–C18) 的存在。
如图 1所示,以直链烷烃为例,一般微生物对其的降解反应通过氧化酶酶促进行,在C/N比适当的情况下,直链烷烃首先被氧化成醇,而后在醇脱氢酶的作用下被氧化为相应的醛,醛再通过醛脱氢酶的作用氧化成为相应的脂肪酸,脂肪酸再经β-氧化为乙酰辅酶A,乙酰辅酶A进入三羧酸循环,最终分解成为二氧化碳、水、营养物质及其他副产物[18]。这一过程可简单表示为下式:石油烃+微生物+O2+N源→CO2+H2O+副产物+生物质。
 |
| 图 1 直链烷烃的微生物利用途径[18] Fig. 1 Microbial utilization of normal alkanes[18]. |
| 图选项 |
在微生物降解石油烃的过程中,酶起到了至关重要的作用。而微生物因其较高的繁殖速度以及代谢的多样性与遗传的变异性,使得微生物的酶系拥有了较高的适应性,能通过一系列变异对外界环境的变化如石油烃污染产生适应。不同的微生物在降解不同的石油烃过程中,其参与代谢过程的关键酶、降解转化反应过程及代谢产物也会有所不同,其中代谢关键酶对于石油烃的高效安全降解起到了决定性作用[19]。细菌对石油烃的降解主要通过氧化酶促反应进行,在加氧酶及一系列脱氢酶的催化下完成反应[20];真菌则通过漆酶(Laccases)、细胞色素P-450 (Cytochrome P-450) 单氧酶等首先完成对烃类的氧化,而后在一系列胞外酶及胞内酶的作用下完成对石油烃的降解[21-22]。
2 影响微生物降解石油烃的因素2.1 环境因素微生物的生长主要受到所处环境的影响,诸多环境因素,如温度、含水率、氧气、pH值、盐度、土壤质地、表面活性剂等,均会对微生物的石油烃降解能力产生影响。
2.1.1 温度温度影响微生物降解的机制主要包含3种:首先温度会对石油烃的理化性质产生影响;其次温度会影响微生物细胞膜的流动性进而影响到细胞与外界的物质交换能力;同时温度也会影响各种物质在水中的溶解度,从而影响细胞从外界获得物质的能力,最终影响到微生物的生长代谢。因此,温度会对石油烃物质的理化性质、微生物的生长代谢及群落结构产生较为显著的影响[23-24]。Jahangeer等[25]研究发现,当温度较低时,石油烃物质的黏度会增大,一些有毒的短链烷烃、芳香烃的挥发性降低,石油烃在水中的溶解度也随之减小,微生物降解过程中的关键酶活性也一同降低,微生物降解周期延长;而温度较高时,如高于40 ℃时,虽然酶的活性有一定程度的提高,但细胞膜受到石油烃的毒性也会不断加强。因此,一般情况下,微生物在土壤中的最佳好氧降解温度范围是30–40 ℃[26]。
2.1.2 含水率微生物的代谢过程离不开水的参与,土壤水作为优良的溶剂在土壤颗粒等物质与微生物间的营养交换起到了至关重要的作用。研究表明,维持微生物活性所需条件为土壤最大持水量的25%–85%,降解的最适值为30%–90%[27]。当土壤含水率过低时,细胞活性受到抑制,代谢效率降低;而含水量过高时又会堵塞土壤间隙,影响氧气的供应,抑制细胞活性。因此对于干旱地区的石油烃土壤修复,可采用间歇喷淋等手段保持土壤的最优含水率。
2.1.3 氧气在有氧环境下,氧气是微生物降解石油烃的最优先电子受体;在缺氧环境下,虽然其他物质也可作为电子受体参与石油烃的降解过程,但相较于有氧降解,无氧降解石油烃污染物质的速率较低且条件苛刻。因此,氧气常常成为微生物降解石油烃污染物质的限速因子,尤其是在下层土壤中[28]。
2.1.4 pH值土壤pH值变化会使细胞中蛋白质、核酸等生物大分子的电荷发生改变,从而影响其生物活性;同时会引起细胞膜的电荷改变,影响微生物与外界的物质交换能力,改变细胞质膜的通透性、稳定性及代谢酶的活性。因此,pH值对微生物的生长代谢有很大的影响;也会使环境中有害物质的毒性有所不同。尤其是对于某些产生生物表面活性剂的降解菌,pH值会影响发酵液中生物表面活性剂的聚集模式,使石油烃的分散状态改变,进而影响降解菌与石油烃的接触状态,最终影响微生物对石油烃的摄取。综上可知,pH值对于微生物降解石油烃的效率有较大的影响,一般而言,最佳的石油烃微生物降解pH值范围为7.0–8.0。Balachandran等[29]在链霉菌Streptomyces降解萘和菲的实验中发现:培养7 d后,当pH为7时,链霉菌对萘和菲的去除率分别为99.14%和17.5%;当pH为8时,链霉菌对萘去除率下降,而对菲的去除率有所上升。
2.1.5 盐度土壤盐度通常用土壤含盐量来表征,是土壤中所含盐分(主要是氯盐、硫酸盐、碳酸盐) 的质量占干土质量的百分数。一般而言,微生物在等渗透压下生长情况良好(5.0–8.5 g/L);在低渗透压下,溶液中的水分会大量渗入微生物体内导致细胞膨胀甚至破裂,引发微生物死亡;在高渗透压下,微生物细胞内的水分会大量渗透至外界溶液中,细胞内水分大量流失引发细胞内部的化学反应环境变化,最终导致微生物脱水死亡。因此盐度会对微生物的数量和活性有较大的影响,通常情况下,盐度越高,微生物的数量和活性越受到抑制,微生物对石油烃的降解能力也越弱[30-31]。
2.1.6 土壤质地质地不同的土壤其物理化学性质也不同,如土壤黏粒大小、含量、土壤孔隙率、阳离子交换量和土壤有机质含量等,而土壤的理化性质又是影响自养固碳微生物数量、活性和群落结构的重要生态因子[32-34]。不同的土壤质地对石油烃物质在土壤和孔隙水的迁移转化也有着重要的影响。张文[35]对比了微生物在壤土和砂土中降解石油烃的情况发现,砂土中的平均石油降解率(84.90%) 高于壤土(69.80%),认为土壤中的黏粒和有机质含量越高,对石油污染物的吸附能力越大,石油的生物可用性越低。土壤孔隙率对土壤中的物质迁移有着巨大的影响,包括氧气、水分、无机盐、污染物质等,物质迁移过程对微生物活性影响巨大。在粗质土壤中,因孔隙率较大导致土壤污染物较易向深层土壤迁移,导致石油烃污染物质在土壤环境中的长期残留,因此土壤粒径越大,对石油污染越敏感[36]。李政等[37]在对克拉玛依油田石油污染土壤生物修复条件优化的研究认为,55%的土壤孔隙率为最适修复条件,当孔隙率低于55%时,微生物降解石油烃的速率会受到抑制,当孔隙率高于55%时,则会导致土壤持水能力过低,需要频繁地补充水分。
2.1.7 表面活性剂研究表明,能在石油烃污染环境中生长的微生物通常自身能够产生生物表面活性剂,提高微生物的降解速率[38]。目前对于生物表面活性剂发挥作用的模式有三类:1) 微生物的细胞膜能够直接从表面活性剂包裹下的小油滴中吸收污染物质[39];2) 微生物仅能吸收溶解于水相中的污染物质,表面活性剂仅起到了运输小油滴,分散大油团的作用[40];3) 生物表面活性剂会改变微生物细胞膜的疏水性,促进微生物与成液滴形态的石油污染物质直接接触。同时有研究表明阴离子表面活性剂的效果明显优于阳离子表面活性剂的效果,研究指出阳离子表面活性剂在土壤水中电离出的阳离子既对微生物的生长有抑制作用又干扰了微生物对石油烃污染物质的吸收[41]。不同的表面活性剂对石油烃作用不同,张强等[42]分别用了十二烷基磺酸钠、曲拉通100和鼠李糖脂进行SWH-1降解菌与SWH-2降解菌修复石油烃污染土壤实验,与不添加表面活性剂相比降解率各提高了5%、7%和8%。
2.2 微生物的种类一般来说,特定微生物只对某一类或几类石油烃组分具有降解能力。通常情况下,即使是对石油烃中的单一组分,其生物降解往往也需要多重酶和多种微生物的共同参与[43]。Kumari等[44]的研究便指出了嗜麦芽寡养单胞菌Stenotrophomonas maltophilia、人苍白杆菌Ochrobactrum anthropi、门多萨假单胞菌Pseudomonas mendocina、酯香微杆菌Microbacterium esteraromaticum和铜绿假单胞菌Pseudomonas aeruginosa对原油中PAHs降解能力存在差异。因此土壤中的微生物数量、种类及群落结构对石油烃的污染降解效果有着重大影响。
故在实际作业中对石油烃污染进行工程处理时,通常会接种多种微生物以获得较高的降解效果。而石油烃污染物的降解转化也会影响土壤环境,从而对影响范围内的微生物数量、种类及群落结构产生逆向驯化作用[45]。
2.3 石油烃的浓度与种类石油烃的降解效率除了受到分解者微生物的数量种类、生物活性等影响外,也受到石油烃自身的组分及含量影响,不同的石油烃其理化性质与生物可利用性也不同。通常而言,碳链越短的石油烃越容易被降解,环越少的石油烃越容易被降解。一般而言,线状的降解难度最低,角状其次,其他复杂的结构降解难度更高。除此之外,石油烃作为降解微生物的碳源,石油烃的浓度对微生物的降解率也有着直观影响。李琦[46]开展的石油污染物浓度、表面活性剂含量、投菌量三因素的正交实验,认为石油污染物浓度是最强的影响因数。石油烃浓度过高会限制营养物质和氧气的传输,同时对微生物产生毒害,浓度过低时又不足以维持石油烃降解菌的生长繁殖,达不到降解效果。
3 原位微生物修复强化技术研究进展自然环境下能够对石油烃污染物质有降解能力的微生物数量较少,仅占微生物总量的0.1%[47],因此自然修复效果差,修复周期较长,难以抑制污染物质的迁移扩散。因此,往往需要采用各种手段来强化这一修复过程,如投加微生物菌剂,通风,投加营养物质、电子受体、表面活性剂,对微生物进行载体固定化等。原位微生物修复强化技术主要包括生物投加法、生物刺激法、生物通风法和微生物燃料电池等。
3.1 生物投加法3.1.1 微生物菌剂的投加通过将筛选出的石油烃降解微生物制成菌剂,对受石油烃污染的土壤投加以解决土著菌种群数量不足、活性被抑制等问题,较大提升了降解能力与降解速度。张旭等[48]对山东省淄博市淄河滩的石油烃污染土壤的研究发现,在投加入富集菌使土壤细菌含量提高一个数量级后,油半衰期由自然土壤的990 d减少到346 d。Soleimani等[49]认为添加菌剂对降低石油污染土壤的毒性起到了关键作用。用于投加的微生物包括筛选出的土著菌、外源微生物、基因工程菌。王华金等[50]对被广州石化的原油污染的增城水稻田表层土壤进行的研究发现添加外源菌剂的降解率为64.4%,显著高于不添加外源菌剂的对照组的降解率(16.8%)。钟磊等[51]于天津大港油田筛选出的高效石油降解菌TDYN1T (伪苍白杆菌Falsochrobactrum sp.,保藏号:CGMCC No.18061) 制成的菌剂在最优条件下的7 d降解率可达90%以上。
虽然外源菌种与基因工程菌种通常具有更高的降解能力,但投加到土壤中后,会与环境中的土著微生物形成竞争关系,甚至被原生动物所捕食[52],在工程实际应用中难以预估竞争结果,不一定能够对石油烃污染的降解起到促进作用。何云馨[53]对天津港的BXPT原油污染土壤降解研究中发现添加外源菌剂时的降解率低于不添加菌剂的降解率,认为外源菌剂与土著微生物恶性竞争,起到抑制作用,导致了修复效果的下降。
因此,从被污染的土壤环境中筛选土著菌群,构建能够互相协作的高效菌群被认为是提高菌剂的环境适应性和竞争性的有效手段[54]。Shankar等[55]从印度的金奈北部(Chennai) 的加油站、汽车车间和炼油厂筛选出32种菌,将其部分或全部菌种复配并用于修复重度石油污染土壤,发现全部菌种复配的混合菌种可在30 d内去除近100%的石油烃,优于使用部分菌种复配的修复效果。
细菌与真菌之间同样可以形成协同作用,互相促进生物量的生长,提高细胞活性,从而构建高效菌群。Schink[56]的研究发现,石油烃中碳链长度为4–20的直链烷烃易于被细菌降解,而碳链更长、结构更复杂的石油烃则难以被细菌利用;并且细菌可生产生物表面活性剂乳化石油烃物质,提高石油烃的生物可利用率。Kakinuma等[57]首次从枯草芽孢杆菌Bacillus subtilis发酵液中提取的表面活性剂是目前效果最好的脂肽类表面活性剂之一,可将水的表面张力从72 mN/m降低至27 mN/m。Parthipan等[58]研究发现能产生生物表面活性剂的枯草芽孢杆菌可降解87%的石油烃,表明了该种生物表面活性剂对微生物降解石油烃的帮助。而真菌属于真核生物,能够分泌多种胞外氧化还原酶和水解酶以降解石油烃中难降解的部分,对于不可溶的污染物也可部分氧化为可溶性物质,进而被微生物降解[59-61]。韩慧龙等[61]从河南濮阳原油田筛选得到了阴沟肠杆菌Enterobacter cloacae和刺孢小克银汉霉菌Cunninghamella echinulata,在对泥浆体系的12 d降解实验中发现细菌-真菌混合的总石油烃(Total petroleum hydrocarbon,TPH) 降解率(25.7%) 高于细菌(9.7%) 与真菌(3.1%) 之和。
3.1.2 固定化微生物的投加微生物固定化技术(Immobilized microorganism,IM) 是指通过物理或化学手段将游离的微生物限制在特定空间区域即载体内高度富集,为微生物提供良好的微环境,帮助其抵抗土壤中不良环境的侵害,有助于其与土著菌的竞争[62-63],从而提高微生物的活性及稳定性,能够克服微生物菌剂投加后启动速度慢、环境适应性低、竞争性弱的缺点,进而提升微生物的降解能力。除此之外,固定载体还会影响土壤的理化性质,加大土壤的孔隙度,进而提升含氧量,提高微生物的石油烃降解能力。
近年来,能够自然降解且不会对土壤造成二次污染的环境友好型固定化载体逐渐成为了研究热点,研究者们通过实验筛选出了如生物炭[64]、花生壳粉末等有机材料作为固定载体,解决了载体在土壤环境中不易回收的问题。
3.1.3 植物-微生物的联合投加植物-微生物联合修复技术是利用植物-微生物协同作用[65]以增强彼此对环境的适应能力,促进彼此对石油烃污染的降解能力。Zhang等[66]对山东省东营市胜利油田采集的石油污染土壤的修复研究发现,牵牛花和菌群联合作用的石油降解率(27.63%–67.42%) 比无植被时的石油降解率(10.20%–35.61%) 有显著提升。
一方面,植物的根系改善了土壤的理化性质,明显增大了土壤孔隙率,为微生物提供了良好的微环境,并为微生物的生长提供了良好的条件,如营养物质及更多的氧气;另一方面,微生物降解了石油烃污染物质,降低了其对植物的毒性,协助转化其成为植物所能利用的碳源,提高了植物的生物量[67-68]。除此之外,Heinonsalo等[69]通过对不同根际、菌根根际和块茎土壤中细菌群落碳源利用特征的多元分析提出了菌根根际假说,在石油烃污染土壤中,植物通过根际分泌富碳基质促进了微生物的代谢活性,增强了微生物对石油烃的利用能力[70-71]。Huesemann等[72]提出了植物根系与根际微生物的共代谢降解理论,即根系渗出物中的广泛有机底物和无机矿质,由于根区变化而增加的氧水平,以及根系释放的植物酶刺激了微生物的共代谢作用。菌根效应见图 2。Nie等[73]通过研究石油烃污染盐渍化土壤中根际土壤和周围土壤的细菌丰度和多样性的差异发现,在根际土壤中的石油烃降解菌数量和石油烃降解量显著高于非根际土壤。
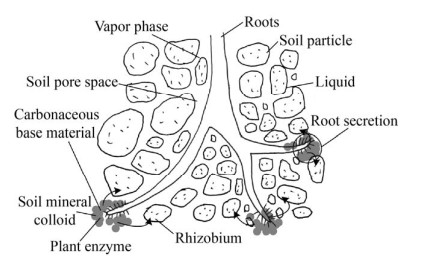 |
| 图 2 菌根效应[69-72] Fig. 2 Mycorrhizal effect[69-72]. |
| 图选项 |
3.2 生物刺激法生物刺激法是人为地对石油污染土壤中的土著菌落进行刺激,促进其繁殖与生长,如改善土壤中的氧气条件、添加肥料或者投入其他添加剂(如表面活性剂等)来加速微生物生长并提升其活性,进而提升微生物降解土壤石油烃污染效率的一种手段。图 3是微生物刺激作用途径。
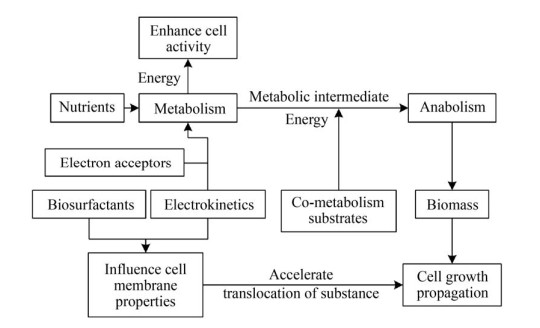 |
| 图 3 微生物刺激作用途径[74] Fig. 3 Pathways for microbial stimulation[74]. |
| 图选项 |
3.2.1 营养物质的投加石油降解菌除了需要石油烃作为碳源外,还需要如氮、磷等营养物质以进行其正常的生长代谢活动。因此,土壤中氮、磷等营养物质的含量对微生物降解石油烃的速率有较大的影响。氮、磷等营养物质的缺乏会抑制降解菌的活性,限制其降解速率;但Vyas等[75]对白色马利诺球藻Marinococcus albus、中生甲基杆菌Methylobacterium mesophilicum和诺卡氏菌Nocardia otitidiscaviarum的研究表明,氮、磷等营养物质的浓度过高会对微生物的生长产生毒害作用,反而降低了其降解速率。因此,适量的营养物质添加是确保微生物降解效率的重要保障。Xu等[76]在石油污染土壤中添加氮磷营养元素(NH4NO3︰K2HPO4=4︰1),8周的修复后石油降解率达到30%,优于未加营养盐的8%降解率,并且使土壤石油烃含量的半衰期从833 d减少到75 d。
3.2.2 电子受体的投加研究发现,电子受体对于石油烃的微生物氧化还原过程也有着重要影响[77]。其中最常见的电子受体是氧气,此外适当添加H2O2等氧化剂也可改善微生物对石油烃污染物质的氧化降解。其次,微生物的厌氧降解也需要电子受体,如Fe3+、NO3–、SO42–等[78]。并且电子受体的量也会影响微生物的降解进程[79]。Lu等[80]研究了海洋沉积环境中的微生物对TPH的降解,研究发现硝酸盐条件下其生物降解率更高,参与芳香化合物厌氧基因表达也同时增加了2个数量级。Qin等[81]研究了不同硝酸盐(亚硝酸盐) 与苯并[a]芘(Benzo(a)pyrene,BaP) 浓度比下的电子受体浓度及微生物的降解能力,实验表明,微杆菌Microbacterium sp.可以利用硝酸盐(亚硝酸盐) 的反硝化产物NO、N2O作为电子受体来降解BaP,BaP/硝酸盐为1︰33时降解率最大(84.2%)。
3.2.3 生物表面活性剂的投加石油烃的憎水性强,易被土壤中的天然有机物所吸附,游离在土壤水中的含量较少,难以被微生物所降解。通过投加表面活性剂,可降低石油烃组分的介质表面和界面张力,促进石油烃污染物从固相转移到水相,也扩大了其可扩散范围,提高其生物可利用性;与此同时,表面活性剂与细胞膜发生作用,改变其流动性,增加了细胞对疏水性物质的结合能力,促进了微生物对石油烃的降解。Cameotra等[82]的研究结果得出生物表面活性剂的投加对石油烃污染的微生物修复的强化作用优于营养物质的投加。李琦[46]进行了100 d的植物-微生物联合修复实验,认为生物表面活性剂(鼠李糖脂) 会同时促进植物和假单胞菌的生长繁殖进而提高修复效果。
3.2.4 共代谢生长基质的投加石油烃中的难降解组分往往不能直接被微生物利用,需要通过微生物的共代谢作用去除。共代谢作用是指微生物在生长基质(可作为唯一碳源和能源的物质) 存在的情况下对非生长基质(不能直接作为碳源和能源的物质) 也进行代谢的一种现象。有研究指出在共代谢过程中既能代谢生长基质又能代谢非生长基质的非专一性酶是关键酶[83]。而该关键酶是在特定的生长基质诱导下产生的,这类生长基质被称为共代谢生长基质。因此,投加共代谢生长基质可以诱导共代谢关键酶的生成,进而促进微生物对石油烃污染物质中的大分子物质的降解。Chen等[84]发现拜叶林克氏菌Beijerinckia在一般条件下无法降解苯并蒽,但在投加了共代谢生长基质水杨酸和联苯后,Beijerinckia氧化降解了苯并蒽。
3.2.5 电动-微生物联合修复技术电动-微生物联合修复技术主要利用电场作用于土壤环境产生影响,具体来说有电迁移、电渗析、电泳以及电化学氧化4种机制。对于石油烃污染的微生物修复过程来说,电场可明显促进土壤中各类离子的迁移速率,进而提高微生物的物质摄取能力,促进微生物的生长繁殖从而提高对石油烃污染物质的降解能力[85]。在实际工程应用中,可通过直接插入电极制造电场或通过新型的微生物电池技术制造电场。但长期处于电场中会对土壤生态环境及微生物群落结构产生影响,故不适用于长期修复[86]。
3.3 联合修复法在实际工程应用中,往往会采用多种简单易行的石油烃污染去除技术相结合应用。如采用物理法与生物法相结合、化学法与生物法相结合等从而以较低成本达到较高的污染降解效率。
3.3.1 物理-生物联合修复对于原位微生物修复技术而言,可与其结合的物理法修复手段一般是机械翻耕,通过机械翻耕作用,防止土壤板结,增大土壤孔隙率,为微生物提供更好的环境及充足的氧气等,从而提高微生物的生长代谢活性,进而提升微生物的降解能力。张旭等[48]对山东省淄博市淄河滩的石油烃污染土壤的研究发现,在翻耕调湿的条件下,石油烃的降解速率得到极大提升,油半衰期由无措施组的1 773 d减少到90 d;而在物理-生物联合修复下,油半衰期缩减至42 d。
3.3.2 化学-生物联合修复化学-生物联合修复是先通过化学手段对石油烃污染物质进行预处理,使其更容易被微生物所降解。其中化学处理部分主要是化学淋洗技术和催化氧化技术。化学淋洗技术以有机溶剂作用于土壤,使土壤中污染物质发生溶解或转移,通常使用表面活性剂等;催化氧化技术则通过添加催化剂促进石油烃在土壤中的分解或直接添加化学氧化剂对石油烃进行氧化。对于石油烃污染土壤来说,通常使用催化氧化技术,促进土壤中难降解的石油烃大分子有机污染物转化为小分子物质或者二氧化碳与水等无机物质,降低其毒性并增大其生物可利用性,使得微生物能够更容易降解污染物质[87]。
但投放的化学试剂被消耗殆尽时,化学试剂的辅助效果也随之消失。付文怡[88]在对以蒽为代表的多环芳烃土壤污染的化学-微生物修复过程研究中发现,在24 h之后降解速率不再提高,在24 h之前降解速率明显提升。而投放化学试剂过多时又会对土壤环境造成破坏,甚至产生二次污染,因此在实际工程应用过程中如何正确地投加化学试剂以达到最大效用比便成为了一个值得探索的问题。
3.4 原位微生物修复强化技术的对比生物投加法通过生物投加,人为地制造或促进土壤中高效降解菌群的产生,从而提高土壤微生物菌群降解石油烃污染物质的能力。生物投加法可以选择性地根据污染物组分和当地土壤环境、气候条件等进行选择性投加从而达到最佳的降解效率,如在高寒地区投加低温降解菌剂等。然而,筛选高效适宜的菌株不仅需要投入大量人力、物力,甚至需要通过基因工程技术对菌株进行改造以提升其应用前景,要形成成熟的修复技术需要大量的前期研究基础。
生物刺激法则是充分利用受污染环境土壤中的土著菌落,通过各种方法刺激土著石油降解菌的生长代谢,保障其生长繁殖,从而促进土壤中的石油烃污染降解进程。或直接通过各种手段促进土著菌对石油烃污染物质的利用,从而促进了其生长繁殖与石油烃降解能力。但生物刺激法会受到较大的环境影响而导致修复效果差异大;又因在投加刺激剂如营养物质、电子受体等时需要适量,过度的投加可能会抑制微生物的降解能力,因此这为实际工程操作带来了困难。
联合修复技术则通过不同领域技术的联合实施带来了更高效的降解,实现了技术优势上的互补,修复效果较好。
在实际进行土壤石油烃污染的工程修复时,应当根据实际的土壤污染情况并结合经济条件、作业周期、环境指标等因素综合考量,对微生物原位修复强化技术进行选取。在条件许可时,应当采取小批量对比实验以确定大规模修复技术方案。
4 工程案例一般而言,实际工程修复中往往将多种修复技术联合应用,以应对污染环境中的复杂情况,如复杂的土壤地质条件、土著菌落的竞争等,从而达到一个理想的修复效果。
笔者团队曾与中海石油环保服务(天津) 有限公司共同参与天津市科技计划项目——石油污染土壤热强化-生化修复技术集成与应用示范(No. 19JCQNJC1390),从天津市某石油污染场地采集表层(0–20 cm) 土壤中筛选得到60株石油烃降解菌,选取了PDB1食碱戈登氏菌Gordonia alkanivorans菌株,石油烃降解率达(55.5±9.6)%,以硅藻土作为载体,吸附制备了耐盐石油烃降解菌菌剂,是联合修复法——固定化微生物修复技术的典型应用。
而后进行石油污染土壤化学氧化-生物联合修复小试,采用Fenton试剂对石油污染土壤进行化学氧化,待其充分与石油烃反应加入制备的菌剂,80 d石油烃降解率达77.6%。
在工程示范中,对天津市滨海新区某中等盐渍化石油污染土壤(面积2 120 m2) 进行的化学氧化-生物联合修复,修复前的污染土壤整体TPH < C16和 > C16含量分别为(683.1±360.4) mg/kg和(6 843.0±4 370.0) mg/kg,修复后分别降至(65.4±38.5) mg/kg和(1 595.8±736.5) mg/kg,分别满足DB11/T811-2011工业用地标准620 mg/kg和10 000 mg/kg要求。由此可见,多技术联合修复是一个行之有效的手段,用多个较简单而有效的技术联合来达到预期效果并且经济快速,是实际工程应用的常用思路。
山东碧泉环境工程技术有限公司针对辽宁省盘锦市辽河油田主产区的污染区采用了异地生物修复技术[89]:强化生物堆修复工艺,经过对污染区域的测量后划定污染土壤修复范围,而后按照设计修复深度开挖污染土壤,将其堆置,埋置通风及营养液、水分喷灌系统,底部铺设防渗膜,内部设置监测点进行检测分析,以便于系统的优化工作。可见该生物堆是生物刺激法-电子受体投加与营养元素投加的综合微生物修复强化技术的工程体现。在生物堆运行过程中,保持土壤碳氮磷比为100︰10︰1,含水率30%–40%,含氧量不低于7%,温度在30–40 ℃,pH值6.0–7.8。在对多达9 300 m2、约4 650 m3的土量进行6个月的修复运行后,达到了修复目标,平均石油烃浓度159.1 mg/kg低于修复目标值(500 mg/kg)。该异地生物修复案例修复效果较好,但工程量大,修复时间长,异地堆置的工程费用也十分高昂。
胜利油田森诺胜利工程有限公司对江苏省某原油管道泄露石油污染土壤进行了物理-微生物联合修复[90]。因该地污染为原油管道泄露所致,故该地污染状况较为复杂,涉及地下土层。该地污染区域包含两个部分,一是表层已清挖污染土,二是下层待清挖污染土。在大规模工程实施前,森诺胜利工程公司开展了中试试验以确保技术可行性。经过4组对照试验,确定了施工参数为生物修复药剂投加比2%,土壤含水率保持35%,pH值为7,机械通风,修复时间90 d。在实际的工程修复中,采用了旋耕机进行药剂的混匀施加和搅拌通风,并通过定期人工洒水保证土壤含水率35%。在对4 902.5 m3的土量进行90 d修复后石油烃平均浓度为1 476.7 mg/kg,低于修复目标(4 500 mg/kg)。该修复案例修复效果比上一案例略弱,但工程量及工程费用大大降低,性价比高。
刘继朝[91]对中原油田采油区进行的修复试验,以原油为唯一的碳源和营养从中原油田石油污染土壤中筛选石油降解微生物结合狗牙根与棉花,进行原位修复盆钵模拟试验。120 d的模拟试验表明,棉花与微生物的联合修复效率最佳,达到了85.67%,超过了它们单独修复的去除率之和。该微生物-植物投加修复案例则工程量最小,修复效果也较为出色。
唐智新对陕北长庆油田的采油井井台周围土壤进行了原位微生物联合修复[92]。在山顶延安油井附近土壤实地划分了2.4 m长1.2 m宽0.3 m深的试验田,就石油烃污染强度、营养物质的投加与否、翻耕与否、菌剂投加与否4个因素设置了8组试验。在实验期间,每天人工加水以保证土壤含水率在15%左右,气温在20–25 ℃之间,系统运行79 d。其中营养物质的投加极大地增强了石油降解率,在都投加营养物质的情况下,加菌翻耕(67.0%)、加菌不翻耕(71.0%)、不加菌翻耕(72.4%)、不加菌不翻耕(72.1%)。其中加菌组降解率均小于未加菌组,可能是投加的外源菌剂与土著微生物恶性竞争,两败俱伤,因此降解率反而更低。这也是外源菌剂在实际工程应用中可能会遇到的困难,对土著菌群筛选制备的菌剂可以很好地解决该问题,但却面临着筛选制备周期长、投入资金大、人力成本高、影响总修复周期的问题。工程实例修复方法及效果比较见表 1。
表 1 微生物修复石油烃土壤污染工程实例Table 1 Engineering cases for microbial remediation of hydrocarbon-contaminated soil
| Location | Max pollution conditions (mg/kg) | Remedial tech. | Repair time (d) | Repair results (%) | References |
| Liaohe oilfield | 20 000 | Enhanced biopiles | 180 | 96.2 | [89] |
| A crude oil pipeline in Jiangsu Province | 45 322 | Chemical-biological integrated tech | 90 | 84.5 | [90] |
| Zhongyuan oilfield | 23 325 | Plant-microorganisms dosing | 120 | 85.7 | [91] |
| Changqing oildfiel | 15 340 | Physical-biological integrated tech | 79 | 72.4 | [92] |
表选项
综上可以看出,原位微生物修复是土壤石油烃污染工程修复的极佳选择,具有工程量小、成本低、修复效果佳、易于其他技术联合修复的特点。
5 总结与展望在土壤微生物修复过程中,石油烃会逐步降解,通常我们用总石油烃含量来度量土壤的石油烃污染程度[93]。然而,即使总石油烃含量达到了环境标准,也并不意味着生物修复的成功,由于难降解组分、次生代谢产物或中间产物的存在,其残留毒性可能依旧很强,对土壤生态功能依旧有极大破坏[94]。因此,恢复污染土壤原有生态功能并非易事,是一个长期复杂的系统工程。现有的微生物对长碳链、多环芳烃、沥青质等物质难以降解,无法彻底修复土壤环境,因此还需要进一步地发展微生物修复强化技术,提升技术的应用前景与效率。
(1) 研发新型环境友好的微生物固定载体,提升微生物活性与修复效率。传统的微生物载体主要有生物炭、沸石、硅藻土等,虽然成本低廉但是效果有限。随着材料科学的发展,利用一些高分子复合材料、纳米材料等性能优良的材料作为微生物的载体可以有效地提升微生物的活性及降解效率,但如何降低材料的制作生产成本并确保材料的环境友好性、不会产生二次污染成为该技术领域需要解决的瓶颈问题。
(2) 在挖掘现有高效微生物资源的基础上,利用基因工程技术研发高效降解工程菌。随着微生物组学和基因工程技术的发展,利用基因强化与沉默技术开发高效的工程菌株成为了当下的研究热点,在掌握关键功能基因的基础上,重组构建石油烃降解关键酶和功能优化的基因工程菌。
(3) 如何快速高效地构建复合菌群体系,提升微生物修复的应用范围及效率。众所周知,单一的修复菌株往往只对某一类或者特定类型的石油烃组分有较高的降解效率,且往往只能在特定的土壤环境中才能发挥作用,极大地限制了微生物修复的工业化应用。而通过不同的菌株构建修复菌群体系可以有效地解决这些问题。但菌群体系的构建往往需要耗费大量的时间及人力物力,且见效慢。随着现有微生物菌株数据库的不断完善,如何运用大数据分析的手段进行复合菌群体系的智能构建与优化,确保不同菌株之间能够形成协同效应并提升体系的抗逆性和对环境的适应能力,将是未来的发展方向之一。
(4) 构建面向工程化应用的联合修复技术包。实验室的微生物修复研究实验环境因素较真实环境大大简化,干扰少,其修复效果可能很好;而放到真实环境下,环境因素复杂,干扰多,修复效果往往不佳。因而在工程实际中为达到最佳修复效率通常采用多技术联合的手段,且必须融合环境工程、水利学、环境化学及土壤学等多学科知识。因此如何结合我国典型污染场地和土壤的特征,构建出一套因地因时的污染土壤修复工程技术包,以针对污染场地的特点智能设计出相匹配的修复方案及相关修复设备,可为未来的土壤石油烃污染修复乃至环境修复领域提供更广阔的应用前景。
参考文献
| [1] | Dumitran C, Onu?u I, Dinu F. Extraction of hydrophobic organic compounds from soils contaminated with crude oil. Revista De Chimie, 2009, 60(11): 1224-1227. |
| [2] | Li Q, You P, Hu Q, et al. Effects of co-contamination of heavy metals and total petroleum hydrocarbons on soil bacterial community and function network reconstitution. Ecotoxicol Environ Saf, 2020, 204: 111083. DOI:10.1016/j.ecoenv.2020.111083 |
| [3] | Brien PLO, DeSutter TM, Casey FXM, et al. Evaluation of soil function following remediation of petroleum hydrocarbons—a review of current remediation techniques. Curr Pollut Rep, 2017, 3(3): 192-205. DOI:10.1007/s40726-017-0063-7 |
| [4] | Martin BC, George SJ, Price CA, et al. The role of root exuded low molecular weight organic anions in facilitating petroleum hydrocarbon degradation: current knowledge and future directions. Sci Total Environ, 2014, 472: 642-653. DOI:10.1016/j.scitotenv.2013.11.050 |
| [5] | Lim MW, Lau EV, Poh PE. A comprehensive guide of remediation technologies for oil contaminated soil—present works and future directions. Mar Pollut Bull, 2016, 109(1): 14-45. DOI:10.1016/j.marpolbul.2016.04.023 |
| [6] | Robert Bellandi OG. Innovative engineering technologies for hazardous waste remediation. New York: Van Nostrand Reinhold, 1995. |
| [7] | Tang X, He LY, Tao XQ, et al. Construction of an artificial microalgal-bacterial consortium that efficiently degrades crude oil. J Hazard Mater, 2010, 181(1/2/3): 1158-1162. |
| [8] | Hassanshahian M, Emtiazi G, Cappello S. Isolation and characterization of crude-oil-degrading bacteria from the Persian Gulf and the Caspian Sea. Mar Pollut Bull, 2012, 64(1): 7-12. DOI:10.1016/j.marpolbul.2011.11.006 |
| [9] | Chandra S, Sharma R, Singh K, et al. Application of bioremediation technology in the environment contaminated with petroleum hydrocarbon. Ann Microbiol, 2013, 63(2): 417-431. DOI:10.1007/s13213-012-0543-3 |
| [10] | Atlas RM. Microbial degradation of petroleum hydrocarbons: an environmental perspective. Microbiol Rev, 1981, 45(1): 180-209. DOI:10.1128/mr.45.1.180-209.1981 |
| [11] | 李凤梅, 郭书海, 牛之欣, 等. 稠油降解菌的筛选及其对胶质和沥青质生物降解. 土壤通报, 2006, 37(4): 764-767. Li FM, Guo SH, Niu ZX, et al. Isolation of viscous-oil degradative microorganism and biodegradation to resin and asphaltene. Chin J Soil Sci, 2006, 37(4): 764-767 (in Chinese). |
| [12] | Jensen V. Bacterial flora of soil after application of oily waste. Oikos, 1975, 26(2): 152. DOI:10.2307/3543704 |
| [13] | Speight JG. The chemical and physical structure of petroleum: effects on recovery operations. J Petroleum Sci Eng, 1999, 22(1/2/3): 3-15. |
| [14] | Balba MT, Al-Awadhi N, Al-Daher R. Bioremediation of oil-contaminated soil: microbiological methods for feasibility assessment and field evaluation. J Microbiol Methods, 1998, 32(2): 155-164. DOI:10.1016/S0167-7012(98)00020-7 |
| [15] | Van Hamme JD, Singh A, Ward OP. Recent advances in petroleum microbiology. Microbiol Mol Biol Rev, 2003, 67(4): 503-549. DOI:10.1128/MMBR.67.4.503-549.2003 |
| [16] | Bertrand JC, Rambeloarisoa E, Rontani JF, et al. Microbial degradation of crude oil in sea water in continuous culture. Biotechnol Lett, 1983, 5(8): 567-572. DOI:10.1007/BF01184950 |
| [17] | Rontani JF, Bosser-Joulak F, Rambeloarisoa E, et al. Analytical study of Asthart crude oil asphaltenes biodegradation. Chemosphere, 1985, 14(9): 1413-1422. DOI:10.1016/0045-6535(85)90161-4 |
| [18] | 李洲. 微生物对石油烃的降解机理研究. 云南化工, 2018, 45(9): 179-180. Li Z. Study on the mechanism of microbial degradation of petroleum hydrocarbons. Yunnan Chem Technol, 2018, 45(9): 179-180 (in Chinese). |
| [19] | Zeng J, Lin XG, Zhang J, et al. Oxidation of polycyclic aromatic hydrocarbons by the bacterial laccase CueO from E. coli. Appl Microbiol Biotechnol, 2011, 89(6): 1841-1849. DOI:10.1007/s00253-010-3009-1 |
| [20] | Van Beilen JB, Li Z, Duetz WA, et al. Diversity of alkane hydroxylase systems in the environment. Oil & Gas Science And Technology - Rev IFP, 2003, 58(4): 427-440. |
| [21] | Bezalel L, Hadar Y, Cerniglia CE. Enzymatic mechanisms involved in phenanthrene degradation by the white rot fungus Pleurotus ostreatus. Appl Environ Microbiol, 1997, 63(7): 2495-2501. DOI:10.1128/aem.63.7.2495-2501.1997 |
| [22] | Collins PJ, Kotterman M, Field JA, et al. Oxidation of anthracene and benzo. Appl Environ Microbiol, 1996, 62(12): 4563-4567. DOI:10.1128/aem.62.12.4563-4567.1996 |
| [23] | Margesin R, Schinner F. Biodegradation and bioremediation of hydrocarbons in extreme environments. Appl Microbiol Biotechnol, 2001, 56(5/6): 650-663. |
| [24] | Van Stempvoort D, Biggar K. Potential for bioremediation of petroleum hydrocarbons in groundwater under cold climate conditions: a review. Cold Reg Sci Technol, 2008, 53(1): 16-41. DOI:10.1016/j.coldregions.2007.06.009 |
| [25] | Jahangeer, Kumar V. An overview on microbial degradation of petroleum hydrocarbon contaminants. Int J Engine Tech Res, 2013, 1(8): 34-37. |
| [26] | Das N, Chandran P. Microbial degradation of petroleum hydrocarbon contaminants: an overview. Biotechnol Res Int, 2011, 2011: 1-13. |
| [27] | 张从, 夏立江. 污染土壤生物修复技术. 北京: 中国环境科学出版社, 2000. Zhang C, Xia LJ. Bioremediation technology of contaminated soil. Beijing: China Environmental Science Press, 2000 (in Chinese). |
| [28] | Abdel-Shafy HI, Mansour MSM. Microbial degradation of hydrocarbons in the environment: an overview. Microb Action Hydrocarbons, 2018, 353-386. |
| [29] | Balachandran C, Duraipandiyan V, Balakrishna K, et al. Petroleum and polycyclic aromatic hydrocarbons (PAHs) degradation and naphthalene metabolism in Streptomyces sp. (ERI-CPDA-1) isolated from oil contaminated soil. Bioresour Technol, 2012, 112: 83-90. DOI:10.1016/j.biortech.2012.02.059 |
| [30] | Riis V, Kleinsteuber S, Babel W. Influence of high salinities on the degradation of diesel fuel by bacterial consortia. Can J Microbiol, 2003, 49(11): 713-721. DOI:10.1139/w03-083 |
| [31] | Minai-Tehrani D, Minoui S, Herfatmanesh A. Effect of salinity on biodegradation of polycyclic aromatic hydrocarbons (PAHs) of heavy crude oil in soil. Bull Environ Contam Toxicol, 2009, 82(2): 179-184. DOI:10.1007/s00128-008-9548-9 |
| [32] | Yuan H, Ge T, Chen C, et al. Significant role for microbial autotrophy in the sequestration of soil carbon. Appl Environ Microbiol, 2012, 78(7): 2328-2336. DOI:10.1128/AEM.06881-11 |
| [33] | Yuan H, Ge T, Wu X, et al. Long-term field fertilization alters the diversity of autotrophic bacteria based on the ribulose-1, 5-biphosphate carboxylase/oxygenase (RubisCO) large-subunit genes in paddy soil. Appl Microbiol Biotechnol, 2012, 95(4): 1061-1071. DOI:10.1007/s00253-011-3760-y |
| [34] | Xiao KQ, Nie SN, Bao P, et al. Rhizosphere effect has no effect on marker genes related to autotrophic CO2 fixation in paddy soils?. J Soils Sediments, 2014, 14(6): 1082-1087. DOI:10.1007/s11368-014-0864-x |
| [35] | 张文. 应用表面活性剂强化石油污染土壤及地下水的生物修复[D]. 北京: 华北电力大学, 2012. Zhang W. Application of surfactant in enhancing bioremediation of petroleum-contaminated soil and groundwater[D]. Beijing: North China Electric Power University, 2012 (in Chinese). |
| [36] | Southam G, Whitney M, Knickerbocker C. Structural characterization of the hydrocarbon degrading bacteria-oil interface: implications for bioremediation. Int Biodeterior Biodegrad, 2001, 47(4): 197-201. DOI:10.1016/S0964-8305(01)00051-8 |
| [37] | 李政, 顾贵洲, 宁春莹, 等. 固体微生物菌剂在克拉玛依石油污染土壤生物修复中的应用. 石油学报(石油加工), 2016, 32(6): 1195-1204. Li Z, Gu GZ, Ning CY, et al. Application of solid microbial agent in bioremediation of petroleum contaminated soil in Karamay oilfield. Acta Petrolei Sin Petroleum Process Sect, 2016, 32(6): 1195-1204 (in Chinese). |
| [38] | 任华峰, 张雨山, 王静, 等. 石油烃降解菌的分离鉴定及其产生乳化剂条件. 化学工业与工程, 2010, 27(3): 189-194. Ren HF, Zhang YS, Wang J, et al. Isolation and characterization of a hydrocarbon-degrading bacterial strain. Chem Ind Eng, 2010, 27(3): 189-194 (in Chinese). |
| [39] | Miller RM, Bartha R. Evidence from liposome encapsulation for transport-limited microbial metabolism of solid alkanes. Appl Environ Microbiol, 1989, 55(2): 269-274. DOI:10.1128/aem.55.2.269-274.1989 |
| [40] | Schippers C, Ge?ner K, Müller T, et al. Microbial degradation of phenanthrene by addition of a sophorolipid mixture. J Biotechnol, 2000, 83(3): 189-198. DOI:10.1016/S0168-1656(00)00304-7 |
| [41] | 魏德洲, 秦煜民. 表面活性剂对石油污染物生物降解的影响. 东北大学学报, 1998, 19(2): 18-20. Wei DZ, Qin YM. Influence of surfactants upon the bioremediation of petroleum contaminators. J Northeast Univ, 1998, 19(2): 18-20 (in Chinese). |
| [42] | 张强, 郑立稳, 孔学, 等. 助剂对石油污染土壤生物修复的强化作用. 山东科学, 2015, 28(1): 78-81. Zhang Q, Zheng LW, Kong X, et al. Enhanced bioremediation of additive on petroleum contaminated soil. Shandong Sci, 2015, 28(1): 78-81 (in Chinese). |
| [43] | Husain S. Literature overview: microbial metabolism of high molecular weight polycyclic aromatic hydrocarbons. Remediation, 2008, 18(2): 131-161. DOI:10.1002/rem.20165 |
| [44] | Kumari S, Regar RK, Manickam N. Improved polycyclic aromatic hydrocarbon degradation in a crude oil by individual and a consortium of bacteria. Bioresour Technol, 2018, 254: 174-179. DOI:10.1016/j.biortech.2018.01.075 |
| [45] | Vila J, Nieto JM, Mertens J, et al. Microbial community structure of a heavy fuel oil-degrading marine consortium: linking microbial dynamics with polycyclic aromatic hydrocarbon utilization. FEMS Microbiol Ecol, 2010, 73(2): 349-362. |
| [46] | 李琦. 鼠李糖脂强化石油污染土壤植物—微生物联合修复研究[D]. 西安: 西安建筑科技大学, 2011. Li Q. The effect of rhamnolipid on phytoremediation and microbial remediation of petroleum contaminated soil[D]. Xi'an: Xi'an University of Architecture and Technology, 2011 (in Chinese). |
| [47] | Atlas RM. Microbial hydrocarbon degradation- bioremediation of oil spills. J Chem Technol Biotechnol, 2007, 52(2): 149-156. DOI:10.1002/jctb.280520202 |
| [48] | 张旭, 李广贺, 黄巍. 石油烃污染土层生物修复模拟实验研究. 清华大学学报(自然科学版), 2000, 40(11): 106-108. Zhang X, Li GH, Huang W. Bioremediation of petroleum hydrocarbons-polluted soil. J Tsinghua Univ Sci Technol, 2000, 40(11): 106-108 (in Chinese). |
| [49] | Soleimani M, Farhoudi M, Christensen JH. Chemometric assessment of enhanced bioremediation of oil contaminated soils. J Hazard Mater, 2013, 254/255: 372-381. DOI:10.1016/j.jhazmat.2013.03.004 |
| [50] | 王华金, 朱能武, 杨崇, 等. 石油污染土壤生物修复对土壤酶活性的影响. 农业环境科学学报, 2013, 32(6): 1178-1184. Wang HJ, Zhu NW, Yang C, et al. Effect of soil enzyme activities during bioremediation of crude oil-contaminated soil. J Agro - Environ Sci, 2013, 32(6): 1178-1184 (in Chinese). |
| [51] | 钟磊, 田静楠, 陈冠益, 等. 一种高效石油降解菌TDYN1T及其应用: 中国, CN110724650A, 2020-01-24. Zhong L, Tian JN, Chen GY, et al. A high-efficiency petroleum-degrading bacterium TDYN1T and its application: China, CN110724650A, 2020-01-24. |
| [52] | Crisafi F, Giuliano L, Yakimov MM, et al. Isolation and degradation potential of a cold-adapted oil/PAH-degrading marine bacterial consortium from Kongsfjorden (Arctic region). Rendiconti Lincei, 2016, 27(1): 261-270. |
| [53] | 何云馨. 不同类型溢油污染潮间带生物修复可行性现场中试研究[D]. 青岛: 中国海洋大学, 2010. He YX. The pilot study on the feasibility of bioremediation on the different types of oil-spilled shoreline[D]. Qingdao: Ocean University of China, 2010 (in Chinese). |
| [54] | Li X, Zhao L, Adam M. Biodegradation of marine crude oil pollution using a salt-tolerant bacterial consortium isolated from Bohai Bay, China. Mar Pollut Bull, 2016, 105(1): 43-50. DOI:10.1016/j.marpolbul.2016.02.073 |
| [55] | Shankar S, Kansrajh C, Dinesh MG, et al. Application of indigenous microbial consortia in bioremediation of oil-contaminated soils. Int J Environ Sci Technol, 2014, 11(2): 367-376. DOI:10.1007/s13762-013-0366-1 |
| [56] | Schink B. Synergistic interactions in the microbial world. Antonie Van Leeuwenhoek, 2002, 81(1/2/3/4): 257-261. |
| [57] | Kakinuma A, Hori M, Isono M, et al. Determination of amino acid sequence in surfactin, a crystalline peptidelipid surfactant produced by Bacillus subtilis. Agric Biol Chem, 1969, 33(6): 971-972. DOI:10.1080/00021369.1969.10859408 |
| [58] | Parthipan P, Preetham E, Machuca LL, et al. Biosurfactant and degradative enzymes mediated crude oil degradation by bacterium Bacillus subtilis A1. Front Microbiol, 2017, 8: 193. |
| [59] | Pointing SB. Feasibility of bioremediation by white-rot fungi. Appl Microbiol Biotechnol, 2001, 57(1/2): 20-33. |
| [60] | Bogan BW, Lamar RT. Polycyclic aromatic hydrocarbon-degrading capabilities of Phanerochaete laevis HHB-1625 and its extracellular ligninolytic enzymes. Appl Environ Microbiol, 1996, 62(5): 1597-1603. DOI:10.1128/aem.62.5.1597-1603.1996 |
| [61] | 韩慧龙, 汤晶, 江皓, 等. 真菌-细菌修复石油污染土壤的协同作用机制研究. 环境科学, 2008, 29(1): 189-195. Han HL, Tang J, Jiang H, et al. Synergy between fungi and bacteria in fungi-bacteria augmented remediation of petroleum-contaminated soil. Environ Sci, 2008, 29(1): 189-195 (in Chinese). |
| [62] | Partovinia A, Rasekh B. Review of the immobilized microbial cell systems for bioremediation of petroleum hydrocarbons polluted environments. Crit Rev Environ Sci Technol, 2018, 48(1): 1-38. DOI:10.1080/10643389.2018.1439652 |
| [63] | Su D, Li PJ, Wang X, et al. Biodegradation of benzo[a]Pyrene in soil by immobilized fungus. Environ Eng Sci, 2008, 25(8): 1181-1188. DOI:10.1089/ees.2006.0171 |
| [64] | Huang WH, Lee DJ, Huang C. Modification on biochars for applications: a research update. Bioresour Technol, 2021, 319: 124100. DOI:10.1016/j.biortech.2020.124100 |
| [65] | Li N, Liu R, Chen J, et al. Enhanced phytoremediation of PAHs and cadmium contaminated soils by a Mycobacterium. Sci Total Environ, 2021, 754: 141198. DOI:10.1016/j.scitotenv.2020.141198 |
| [66] | Zhang Z, Zhou Q, Peng S, et al. Remediation of petroleum contaminated soils by joint action of Pharbitis nil L. and its microbial community. Sci Total Environ, 2010, 408(22): 5600-5605. DOI:10.1016/j.scitotenv.2010.08.003 |
| [67] | Agnello AC, Bagard M, Van Hullebusch ED, et al. Comparative bioremediation of heavy metals and petroleum hydrocarbons co-contaminated soil by natural attenuation, phytoremediation, bioaugmentation and bioaugmentation-assisted phytoremediation. Sci Total Environ, 2016, 563/564: 693-703. DOI:10.1016/j.scitotenv.2015.10.061 |
| [68] | Nanekar S, Dhote M, Kashyap S, et al. Microbe assisted phytoremediation of oil sludge and role of amendments: a mesocosm study. Int J Environ Sci Technol, 2015, 12(1): 193-202. DOI:10.1007/s13762-013-0400-3 |
| [69] | Heinonsalo J, J?rgensen KS, Haahtela K, et al. Effects of Pinus sylvestris root growth and mycorrhizosphere development on bacterial carbon source utilization and hydrocarbon oxidation in forest and petroleum-contaminated soils. Can J Microbiol, 2000, 46(5): 451-464. DOI:10.1139/w00-011 |
| [70] | Phillips LA, Greer CW, Germida JJ. Culture-based and culture-independent assessment of the impact of mixed and single plant treatments on rhizosphere microbial communities in hydrocarbon contaminated flare-pit soil. Soil Biol Biochem, 2006, 38(9): 2823-2833. DOI:10.1016/j.soilbio.2006.04.038 |
| [71] | Shann JR. The role of plants and plant/microbial systems in the reduction of exposure. Environ Health Perspect, 1995, 103(Suppl 5): 13-15. DOI:10.1289/ehp.95103s413 |
| [72] | Huesemann MH, Hausmann TS, Fortman TJ, et al. In situ phytoremediation of PAH-and PCB-contaminated marine sediments with eelgrass (Zostera marina). Ecol Eng, 2009, 35(10): 1395-1404. DOI:10.1016/j.ecoleng.2009.05.011 |
| [73] | Nie M, Zhang XD, Wang JQ, et al. Rhizosphere effects on soil bacterial abundance and diversity in the Yellow River Deltaic ecosystem as influenced by petroleum contamination and soil salinization. Soil Biol Biochem, 2009, 41(12): 2535-2542. DOI:10.1016/j.soilbio.2009.09.012 |
| [74] | 李小康, 鱼涛, 李红, 等. 外源刺激促进微生物降解原油研究进展. 应用化工, 2020, 49(3): 729-734. Li XK, Yu T, Li H, et al. Advances in research on exogenous stimulation promoting microbial degradation of crude oil. Appl Chem Ind, 2020, 49(3): 729-734 (in Chinese). |
| [75] | Vyas TK, Dave BP. Effect of addition of nitrogen, phosphorus and potassium fertilizers on biodegradation of crude oil by marine bacteria. Indian J Mar Sci, 2010, 39(1): 143-150. |
| [76] | Xu JL, Zhang J, Huang TL, et al. Comparative bioremediation of oil contaminated soil by natural attenuation, biostimulation and bioaugmentation. Adv Mater Res, 2013, 777: 258-262. DOI:10.4028/www.scientific.net/AMR.777.258 |
| [77] | Sarkar P, Roy A, Pal S, et al. Enrichment and characterization of hydrocarbon-degrading bacteria from petroleum refinery waste as potent bioaugmentation agent for in situ bioremediation. Bioresour Technol, 2017, 242: 15-27. DOI:10.1016/j.biortech.2017.05.010 |
| [78] | Chen SH, Gong WQ, Mei GJ, et al. Anaerobic biodegradation of ethylthionocarbamate by the mixed bacteria under various electron acceptor conditions. Bioresour Technol, 2011, 102(22): 10772-10775. DOI:10.1016/j.biortech.2011.09.030 |
| [79] | Philipp B, Schink B. Different strategies in anaerobic biodegradation of aromatic compounds: nitrate reducers versus strict anaerobes. Environ Microbiol Rep, 2012, 4(5): 469-478. DOI:10.1111/j.1758-2229.2011.00304.x |
| [80] | Lu XY, Li B, Zhang T, et al. Enhanced anoxic bioremediation of PAHs-contaminated sediment. Bioresour Technol, 2012, 104: 51-58. DOI:10.1016/j.biortech.2011.10.011 |
| [81] | Qin W, Zhu Y, Fan FQ, et al. Biodegradation of benzo(a)Pyrene by Microbacterium sp. strain under denitrification: degradation pathway and effects of limiting electron acceptors or carbon source. Biochem Eng J, 2017, 121: 131-138. DOI:10.1016/j.bej.2017.02.001 |
| [82] | Cameotra SS, Makkar RS. Recent applications of biosurfactants as biological and immunological molecules. Curr Opin Microbiol, 2004, 7(3): 262-266. |
| [83] | 张锡辉, Bajpai R.. 以关键酶为基础共代谢模型的建立——以甲烷细菌共代谢三氯乙烯为例. 环境科学学报, 2000, 20(5): 558-562. Zhang XH, Bajpai R.. Development of a key-enzyme based model for cometabolism—a case study on cometabolism of trichloroethylene by methanotrohpic bacteria. Acta Sci Circumstantiae, 2000, 20(5): 558-562 (in Chinese). |
| [84] | Chen SH, Aitken MD. Salicylate stimulates the degradation of high-molecular weight polycyclic aromatic hydrocarbons by Pseudomonas saccharophila P15. Environ Sci Technol, 1999, 33(3): 435-439. |
| [85] | Lear G, Harbottle MJ, Van Der Gast CJ, et al. The effect of electrokinetics on soil microbial communities. Soil Biol Biochem, 2004, 36(11): 1751-1760. |
| [86] | Fan RJ, Ma WP, Zhang HL. Microbial community responses to soil parameters and their effects on petroleum degradation during bio-electrokinetic remediation. Sci Total Environ, 2020, 748: 142463. |
| [87] | Zhang BW, Guo Y, Huo JY, et al. Combining chemical oxidation and bioremediation for petroleum polluted soil remediation by BC-nZVI activated persulfate. Chem Eng J, 2020, 382: 123055. |
| [88] | 付文怡. 多环芳烃污染土壤的化学氧化修复及微生物群落多样性研究[D]. 上海: 华东师范大学, 2018. Fu WY. Chemical oxidation remediation and microbial community diversity research of pahs contaminated soil[D]. Shanghai: East China Normal University, 2018 (in Chinese). |
| [89] | 崔朋, 刘骁勇, 刘敏, 等. 强化生物堆修复石油污染土壤的工程案例. 山东化工, 2019, 48(4): 215-217. Cui P, Liu XY, Liu M, et al. Engineering case of enhanced biopiles for remediation of oil-contaminated soil. Shandong Chem Ind, 2019, 48(4): 215-217 (in Chinese). |
| [90] | 崔双超, 齐世明, 殷晓波, 等. 石油烃污染土壤生物修复工程实例. 绿色科技, 2019(4): 83-87. Cui SC, Qi SM, Yin XB, et al. An project example of bioremediation project of petroleum contaminated soil. J Green Sci Technol, 2019(4): 83-87 (in Chinese). |
| [91] | 刘继朝. 中原油田石油污染土壤生物修复技术研究[D]. 北京: 中国地质科学院, 2009. Liu J(C/Z). Research on bioremediation of petroleum contaminated soils in Zhongyuan oil field[D]. Beijing: Chinese Academy of Geological Sciences, 2009 (in Chinese). |
| [92] | 唐智新. 西北黄土地区石油污染土壤生物修复研究[D]. 西安: 西安建筑科技大学, 2007. Tang ZX. The study of bioremediation of petroleum polluted soil in northwest loess area[D]. Xi'an: Xi'an University of Architecture and Technology, 2007 (in Chinese). |
| [93] | 刘五星, 骆永明, 滕应, 等. 石油污染土壤的生态风险评价和生物修复Ⅱ.石油污染土壤的理化性质和微生物生态变化研究. 土壤学报, 2007, 44(5): 848-853. Liu WX, Luo YM, Teng Y, et al. Eco-risk assessment and bioremediation of petroleum contaminated soil Ⅱ. changes in physico-chemical properties and microbial ecology of petroleum contaminated soil. Acta Pedol Sin, 2007, 44(5): 848-853 (in Chinese). |
| [94] | Al-Mutairi N, Bufarsan A, Al-Rukaibi F. Ecorisk evaluation and treatability potential of soils contaminated with petroleum hydrocarbon-based fuels. Chemosphere, 2008, 74(1): 142-148. |
