

1. 有研科技集团有限公司 生物冶金国家工程实验室,北京 100088;
2. 有研资源环境技术研究院 (北京) 有限公司,北京 101400;
3. 北京有色金属研究总院,北京 100088
收稿日期:2021-06-01;接收日期:2021-09-01
基金项目:国家自然科学基金(Nos. 51974279, U1402234, 41573074),国家重点研发计划(No. 2019YFC1805903) 资助
作者简介:刘兴宇?? 博士,中组部****青年拔尖人才,有研资源环境技术研究院(北京)有限公司生物冶金国家工程实验室副主任、博士生导师、教授级高级工程师,有色学会环保委员会委员,广西、江西土壤环境管理专家库专家。长期从事矿冶区重金属污染微生物治理理论与技术研究工作。开辟了重金属污染的微生物修复理论与技术新方向,实现该技术在矿冶区包括尾矿库、冶炼场地土壤、冶炼危废渣堆、煤矿排土场、重金属污染农田等方面的工程应用,主持完成国内首个有色金属尾矿库微生物原位修复示范工程(3.33 hm2)。发表SCI、EI论文50余篇,授权发明专利16项。获得省部级科技奖励4项,其中2项为第一完成人.
摘要:目前,我国历史遗留铬渣堆场多数采用湿法解毒工艺进行处理,但大量化学药剂的添加不仅增加了成本,引入了污染物,而且随时间的延长铬渣中的Cr(Ⅵ) 源源不断的返溶,场地出现返黄现象,形成二次污染。为了持久稳定的修复铬渣,研究人员提出用微生物修复技术处理湿法解毒后铬渣中Cr(Ⅵ) 的返溶。文中综述了国内外微生物修复铬渣污染场地的研究进展,首先简述了铬渣的危害、处理现状及传统的铬污染修复技术,并以湿法解毒铬污染为例,重点揭示了处理后铬渣中Cr(Ⅵ) 的返溶机理,由此可知湿法解毒后的二次污染不可避免。随后详述了微生物修复Cr(Ⅵ) 过程中生物还原、生物吸附和生物矿化三大作用机理,并阐述了铬污染场地修复过程中微生物物种的响应及群落结构的演替,最后,总结了微生物修复铬渣的研究进展并展望了未来的研究方向。
关键词:微生物修复铬渣湿法解毒生物修复机理
Advances in microbial remediation of the re-dissolved chromium contaminated sites
Xiao Yan1,2, Jianlei Wang1,2, Mingjiang Zhang1,2, Xuezhe Zhu1,2,3, Xingyu Liu1,2


1. National Engineering Laboratory of Biohydrometallurgy, GRINM Group Corporation Limited, Beijing 100088, China;
2. GRINM Resources and Environment Tech. Co., Ltd., Beijing 101400, China;
3. General Research Institute for Nonferrous Metals, Beijing 100088, China
Received: June 1, 2021; Accepted: September 1, 2021
Supported by: National Natural Science Foundation of China (Nos. 51974279, U1402234, 41573074), Key Research and Development Project of China (No. 2019YFC1805903)
Corresponding author: Xingyu Liu. Tel: +86-10-82241312; E-mail: wellwoodliu@163.com.
Abstract: Wet detoxification has traditionally been seen as the most promising technology for treating chromium-contaminated sites. However, the addition of chemicals in the wet detoxification process not only increases the cost but also introduces extra pollutants. Moreover, the chromium-containing slag may be re-dissolved in the form of Cr(Ⅵ), and the increased concentration of Cr(Ⅵ) results in a serious "returning to yellow" phenomenon in the chromium-contaminated sites, causing undesirable secondary pollution. Microbial remediation is a promising technology to address the re-dissolution of chromium-containing slag after wet detoxification, and this article reviews the advances in this area. Firstly, the toxicity, current situation and conventional technologies for treating the chromium-containing slag were briefly summarized. The mechanisms of the inevitable re-dissolution of chromium-containing slag after wet detoxification were summarized. Three main mechanisms, namely bioreduction, biosorption and biomineralization, which are involved in the environmental-friendly and efficient microbial remediation technology, were reviewed. The variation of microbial species and the succession of microbial community during the bioremediation of chromium-contaminated sites were discussed. Finally, future research directions were prospected with the aim to develop long-term, stable and sustainable technologies for remediating the chromium-contaminated sites.
Keywords: microbial remediationchromium-containing slagwet detoxificationbioremediation mechanism
近年来,随着工业化的快速推进,金属在各行各业的需求量与日俱增,引起金属矿山资源的采、选、冶等产业迅速发展,金属冶炼及应用过程中产生了大量含重金属废弃物,这些废弃物的无组织堆存和不达标排放会给周边环境带来极大的危害,在日积月累的扩散过程中引起了周边土壤及水源中重金属含量超标,环保科学家们称该过程为“有色之伤”[1-4]。重金属复合污染物通过食物链的递进富集,不仅影响人们的身体健康,同时也引起一些对金属较敏感的生物加速灭绝。据估计,至2010年,已造成生态圈中生物约3%的年寿命损失,严重影响着生物圈的生态多样性[5-6]。近年来,重金属污染事件的频发,造成严重的经济损失,并威胁着人们的生命健康,特别是美国太平洋燃气电力公司(Pacific gas and electric company) 排放含铬污水到周边环境中,造成周边的饮用水Cr(Ⅵ) 超标60余倍,给周边居民带来致命的疾病威胁[7]。鉴于此,含铬废弃物的源头控制和历史遗留渣堆场无害化处理已成为解决含铬污染物扩散到环境的必要途径[8]。目前,我国对含铬废弃物的处理工作仍处于初级阶段,大多数历史遗留铬渣场未开展有效的治理措施,因周边土壤铬污染严重也引起大片土地资源的浪费,因此,对铬污染场地的无害化和资源化处置具有重大意义[9-10]。
本文基于对铬污染场地处理技术的调研,着重对化学法处理铬渣的湿法解毒工艺,解毒后的返溶机理进行归纳总结,在此基础上,提出微生物修复技术处理湿法解毒后Cr(Ⅵ) 返溶的技术特点,并综述了微生物修复湿法解毒后返溶铬渣的作用机理和修复过程中微生物群落结构变化规律及该技术应用于铬渣修复的研究进展,为我国铬污染场地的微生物修复技术应用研究提供参考。
1 常用的铬渣修复技术我国铬渣堆场及遗留厂区共计60余处,分布于19个省,占地面积达210万m2,我国历史堆存铬渣量超过600万t。目前,已完成治理和正在治理的占15%,已做完调研的约50%,未开展相关工作的约34%。传统上,对于铬渣堆场污染的治理技术包括:客土/换土法(工程措施),化学还原法[5-6]。客土/换土法是向铬污染场地添加或将其置换成健康土壤,通过稀释污染物浓度,增加环境容量的方式进行处理。该法不仅需要大量的客土资源、同时耗费人力物力而且“治标不治本”,无法大规模的应用。近十年来,化学还原法广泛应用于铬污染场的处理。化学还原法又称湿法解毒工艺,该工艺是将污染物Cr(Ⅵ) 从渣样中浸出到液相中,再通过添加过量的化学药剂将其还原为Cr(Ⅲ) 沉淀[11],从而对铬渣进行解毒[12-13]。该工艺短期内效果非常显著,且操作简单,但修复后场地Cr(Ⅵ) 易于返溶。经文献调研可知,湿法解毒一段时间后,Cr(Ⅵ) 逐渐返溶,场地出现“泛黄”现象,无法彻底地解决铬污染问题。鉴于传统的铬渣处理多采用湿法解毒工艺,且目前修复场地均出现了不同程度的Cr(Ⅵ) 返溶的问题。文中着重综述了湿法解毒后铬渣返溶的机理。目的是通过返溶机制的分析,革新出绿色、环保且可持续的修复技术。
2 铬渣返溶的机理及研究进展基于对湿法解毒的相关案例调研发现,湿法解毒不能彻底消除铬渣中铬污染,经湿法解毒3–5年后,铬渣中Cr(Ⅵ) 返溶严重,引起二次污染。例如,某铬渣样品经湿法解毒铬的稳定态比例显著增加,但几年后稳定态比例逐渐下降,非稳定态呈现上升趋势。经检测,湿法解毒五年后,非稳定态铬的比例上升至20%左右,Cr(Ⅵ) 返溶严重,场地出现大片“返黄”现象[14]。另外,某铬渣场地添加过量硫化钠对铬渣进行湿法解毒,解毒后铬渣中的Cr(Ⅵ) 含量小于5 mg/kg,稳定性检测发现,解毒后铬渣中铬的赋存状态不稳定,容易发生价态转化,随后一些时间铬渣中Cr(Ⅵ)浓度不断增加,甚至高达21–28 mg/kg[15]。再者,西北地区某铬盐厂历史堆场铬渣50余万t,经过添加化学药剂进行湿法解毒工艺处理后,铬渣满足我国相关法律的排放标准,然后,根据与固体废物控制标准相关的规定将铬渣实行深度填埋。但该场区铬渣处置8年后,填埋场地出现严重的“返黄”现象,经采样检测发现,填埋场渗滤液泄露,造成周边土壤及水源中Cr(Ⅵ) 含量超标数倍,引起相关部门的重视[16]。另外,国外关于铬渣湿法解毒后Cr(Ⅵ) 返溶的研究表明,应用化学药剂连二亚硫酸钠还原铬渣中Cr(Ⅵ),当药剂添加量为理论值的12倍,且处理时间为15 d时,铬渣中Cr(Ⅵ) 能够迅速降低至达标水平。但3年后测得场地Cr(Ⅵ) 浸出浓度超出美国环境保护署(Environmental Protection Agency) 规定标准限制(5 mg/L) 的近5倍[17]。
通过文献调研,归纳湿法解毒后铬渣堆场Cr(Ⅵ) 返溶的机理如图 1所示,湿法解毒的过程中投加过量化学药剂,如亚铁盐,在开放环境下,广泛存在的氧化性微生物迅速氧化Fe2+成Fe3+,引起环境电位上升,营造成强氧化态电位,引起体系内铬价态的变化,氧化已经沉淀的Cr(Ⅲ) 为溶解性的Cr(Ⅵ),形成生物冶金的过程,造成铬渣中Cr(Ⅵ) 源源不断地返溶。为了降低铬渣中Cr(Ⅵ) 浓度需反复添加过量亚铁盐,随后经历自然氧化过程,Cr(Ⅵ) 再次复溶,形成恶性循环。说明湿法解毒后铬渣返溶问题不可避免,仅依靠湿法解毒工艺处理铬渣,并不能持续地消除铬渣中Cr(Ⅵ) 的危害。
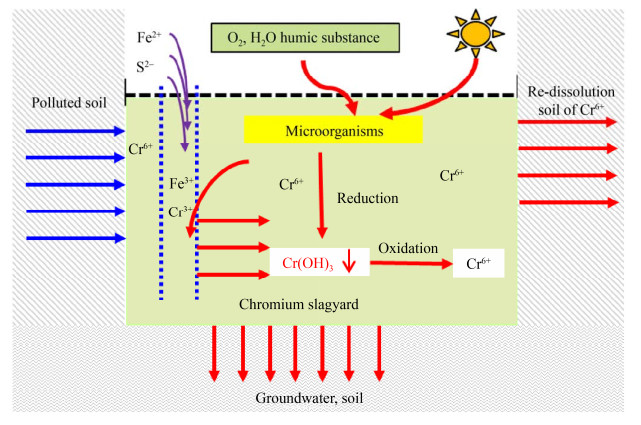 |
| 图 1 铬渣中Cr(Ⅵ) 返溶机理 Fig. 1 Mechanisms of the re-dissolution of Cr(Ⅵ) in the chromium-containing slag. |
| 图选项 |
3 微生物修复法处理返溶铬渣为了解决湿法解毒后铬渣中Cr(Ⅵ) 返溶问题并缓解场地“返黄”现象,实现持久稳定地修复铬渣,寻找一种绿色可持续技术至关重要[18]。目前,微生物修复技术被认为是一种环境友好的替代技术。
3.1 微生物原位修复法微生物原位修复技术主要是刺激具有还原能力的属地微生物以及接种实验室驯化后的工程菌到返溶的铬渣环境中,通过生物还原、生物吸附或生物矿化作用固化返溶的Cr(Ⅵ)[19]。微生物利用环境中的阳光、水分以及有机质等必需的生长要素,通过生长代谢过程中分泌的胞外聚合物及铬还原酶等代谢产物,粘附/还原铬离子,将高毒性的Cr(Ⅵ) 还原固化成低毒性的化合物沉淀[20]。同时,微生物在环境及铬渣中Cr(Ⅵ) 的胁迫下,形成有利于生物修复的属地微生物群落结构,从而实现持久稳定地修复铬渣中的Cr(Ⅵ)。
目前,微生物修复铬污染技术已在实验室范围内取得一些成果。王慕华等[21]在铬酸盐浓度500 mg/kg的土壤体系中接种黑曲霉,15 d内铬的除去率高达70%以上;Polti等[22]研究了链霉属(Streptomyces sp. MC1) 对土壤中Cr(Ⅵ) 的修复效果,结果表明,在不搅动属地环境的条件下,该菌能够自给自足、生长代谢并还原Cr(Ⅵ),研究发现,7 d内该菌能够有效地修复铬污染土壤(50 mg/kg),Cr(Ⅵ) 固化率高达94%。相关文献研究表明,从铬污染属地选育出的高效工程菌株可以生物还原/吸附Cr(Ⅵ),有效限制其迁移扩散,降低被动植物富集的风险,从而降低其生物可利用性[23-24]。有文献表明,在厌氧或兼性厌氧条件下,多种微生物具有固化Cr(Ⅵ) 的能力。如硫酸盐还原菌(Sulfate reducing bacteria,SRB),能够在氧气稀薄的环境中还原硫酸盐产生H2S,进而还原Cr(Ⅵ)[25];Dey等[26]也发现从铬污染的土壤中分离的嗜热-氧化碳链霉菌Streptomyces thermocarboxydus在厌氧环境中,48 h内能够将100? μmol/L的Cr(Ⅵ) 完全还原。Wang等[27]将脱硫弧杆菌Desulfovibrio desulfuicans应用到含有Cd、Ni和Cr多种重金属的海洋环境中进行微生物修复的研究,结果表明,当重金属离子浓度在100 mg/L时厌氧环境中该菌能有效去除多种重金属离子,其去除率分别为99.9%、98.3%和74.2%,并生成重金属硫化物沉淀,从而高效修复多种重金属污染的环境。目前,已分离筛选出具Cr(Ⅵ)还原能力的微生物如表 1所示[27]。
表 1 已筛选分离获得还原Cr(Ⅵ) 的微生物[27]Table 1 List of the microorganisms capable of reducing Cr(Ⅵ)[27]
| Algae | Fungi | Bacteria |
| Spirogyra | Aspergillus niger | Zoogloea ramigera |
| Dunaliella | Rhizopus arrhizus | Bacillus sp. |
| Chlorella vulgaris | Penicillium chrysogenum | Aeromonas caviae |
| Ecklonia sp. | Penicillium purpurogenum | Bacillus thuringiensis |
| Scenedesmus obliquus | Rhizopus nigricans | Pantoea sp. TEM18 |
| Synechocystis sp. | Neurospora crassa | Citrobacter luteola TEM05 |
| Cladophora crispata | Lentinus sajor caju | Pseudomonas putida |
| Sargassum wightii | Unmethylated yeast | Pseudomonas aeruginosa |
| Turbinaria sp. | Methylated yeast | Sulfate reducing bacteria |
| Chlamydomonas angulosa | Trichoderma | Iron reducing bacteria |
表选项
3.2 微生物修复铬污染的机理针对污染重、毒性高的铬污染场地,研究者常常通过添加外源微生物来强化微生物修复能力[28]。明确功能微生物去除Cr(Ⅵ) 的机理,是改善Cr(Ⅵ) 去除效率的理论前提,对于提高微生物对铬污染场地的生物修复效率尤为重要[29-30]。
近十多年来,关于微生物还原Cr(Ⅵ) 的机理研究引起了众多****的广泛关注[31]。目前已知的微生物主要通过3种机理修复铬污染(图 2):生物还原,生物吸附和生物矿化[19]。生物还原是指在微生物的作用下,水溶性Cr(Ⅵ)被还原,转化为较稳定的Cr(Ⅲ) 沉淀的过程[32]。不同的铬还原菌对Cr(Ⅵ) 的还原途径也不相同[33]。有些微生物对Cr(Ⅵ) 的还原是通过功能酶直接催化还原或另一些微生物产生具有还原性的中间产物进行间接还原[33]。
 |
| 图 2 铬污染的微生物修复机理[19] Fig. 2 Microbial bioremediation of chromium contamination[19]. |
| 图选项 |
(1) 直接还原
功能微生物受到Cr(Ⅵ) 刺激后产生的铬还原酶,在铬还原酶的催化作用下将Cr(Ⅵ) 还原为Cr(Ⅲ)[34]。铬还原酶一般累积在胞内和胞膜上[35-36]。微生物直接还原Cr(Ⅵ) 的机理如图 3所示[14]。微生物在好氧或厌氧环境中分泌并累积不同类型的还原酶,能将Cr(Ⅵ) 转化为Cr(Ⅲ)[23, 26, 35, 37-38]。目前已报道的可溶性还原酶包括Pseudomonas putida的ChrR,E. coli的YieF和NfsA[38-39]。还原酶种类会对Cr(Ⅵ) 转化过程中电子转移数目产生重要影响,因而使得Cr(Ⅵ) 的好氧还原涉及两步或多步的电子传递过程。Cr(Ⅵ) 还原酶ChrR对Cr(Ⅵ) 的还原历程为,
 |
| 图 3 好氧及厌氧条件下Cr(Ⅵ) 的酶还原示意图[14] Fig. 3 Schematic diagram of the enzyme-catalyzed reduction of Cr(Ⅵ) under aerobic and anaerobic conditions[14]. |
| 图选项 |
厌氧条件下,微生物能以糖类、蛋白质、脂肪、氢气、还原型辅酶(NADH和NADPH) 和细胞内源性储物为电子供体,在还原酶作用下,将电子通过细胞色素并经呼吸电子传递链而最终传递给Cr(Ⅵ) [40]。E. coli和Bacillus sp. QC1-2菌株能够在辅酶因子作用下,通过生长代谢产生的可溶性蛋白还原Cr(Ⅵ);Enterobacter cioacae和P. fluorescens LB300能够利用膜结合蛋白还原Cr(Ⅵ)[25]。
(2) 间接还原
有些微生物不能直接产生铬还原酶进行催化还原Cr(Ⅵ),但是它们能够在自身生长代谢过程中生成具有还原性的中间产物,为Cr(Ⅵ) 提供电子,从而实现Cr(Ⅵ) 的还原,其转化机理如图 4所示[9]。目前,SRB应用于还原尾矿废渣中的重金属已被广泛的报道,该类微生物能够利用铬渣中铁及硫酸根离子提供生长代谢的能源,该过程还原SO42–为S2–[42-43]。S2–具有强还原性,还原Cr(Ⅵ) 为Cr(Ⅲ),其反应历程如下:
 |
| 图 4 细菌对Cr(Ⅵ) 的间接还原机理[9] Fig. 4 Indirect reduction of Cr(Ⅵ) by bacteria[9]. |
| 图选项 |
(a) SRB利用有机碳源或者二氧化碳和H2还原SO42–,见(1.1)。
| $\begin{gathered} {\text{C}}{{\text{H}}_{\text{2}}}{\text{O }}(碳源) + {\text{SO}}_4^{2-} \to \hfill \\ {{\text{H}}_{\text{2}}}{\text{S + }}2{\text{HCO}}_3^ - (有机物) \hfill \\ \end{gathered} $ | (1.1) |
| ${\text{2CrO}}_4^{2 - } + {{\text{S}}^{2-}} + 5{{\text{H}}_2}{\text{O}} \to {\text{C}}{{\text{r}}_2}{{\text{O}}_3} + 10{\text{O}}{{\text{H}}^-} + {\text{S}}$ | (1.2) |
| ${\text{C}}{{\text{r}}^{6 + }} + 3{\text{O}}{{\text{H}}^-} \to {\text{Cr}}{\left( {{\text{OH}}} \right)_3} \downarrow $ | (1.3) |
生物吸附是通过微生物本身及其产生的代谢产物等大分子基团为铬渣中Cr(Ⅵ) 提供结合位点形成络合物或螯合物沉淀[44]。该法能够迅速吸附Cr(Ⅵ) 并有效控制污染的进一步扩散。苍白杆菌(Ochrobactrum sp.) 产生的胞外聚合物包含大量功能基团(羟基、羧基及氨基等) 能够有效吸附Cr(Ⅵ),从而降低环境污染物浓度[45]。Vendruscolo等研究发现,微生物作为吸附剂利用其自身新陈代谢的作用能够长期有效地固化Cr(Ⅵ)[44]。研究表明,Bacillus sp. 具有较强的生物吸附能力,能够24 h内完全吸附100 mg/L的Cr(Ⅵ)[20]。经过培养工艺的优化,Pseudomonas stutzeri对Cr(Ⅵ) 的耐受高达1 000 mg/L,且能够在24 h内对100 mg/L的Cr(Ⅵ) 吸附率高达97%[23]。然而,微生物作为吸附剂能够提供的结合位点有限,且吸附后还存在解吸的风险,所以探索微生物吸附Cr(Ⅵ) 后生成产物的稳定性十分必要[46]。研究表明,吸附产物的不稳定是造成铬渣中Cr(Ⅵ) 返溶的主要原因。
生物矿化是微生物成矿的过程,指在微生物的作用下土壤中游离态的铬与碳酸根、磷酸钙或铁锰等结合,产生稳定的晶体矿物的现象[11]。已有研究表明,微生物能够促进铬与土壤中的铁锰形成稳定的晶体结构,有效地固化土壤中游离态的铬[47-48]。这就解释了微生物修复铬污染土壤的过程中铬的铁锰结合态占比随着时间的延长而增加。经文献调研发现,生物修复过程中,生物矿化约占10%,且该比例随修复时间不断增加[47-48]。所以生物矿化主要的限制因素是修复时间,短时间的生物矿化仅形成不充分的晶体碎片,但随微生物的长期矿化过程可以形成稳定的晶体物质[49]。
综述微生物修复铬渣过程中存在的三大机理如图 5所示[50]。生物还原、生物吸附和生物矿化同时存在,目的是通过不同的机理转化铬的赋存形态、减小毒性、限制迁移性并降低其生物可利用性,使湿法解毒后铬渣返溶出的Cr(Ⅵ) 固定化,并通过环境的自然驯化和微生物的新陈代谢,在污染场地形成有利于生物修复的属地微生物群落结构,持久稳定地修复铬渣中返溶的Cr(Ⅵ),实现生物修复的可持续性。
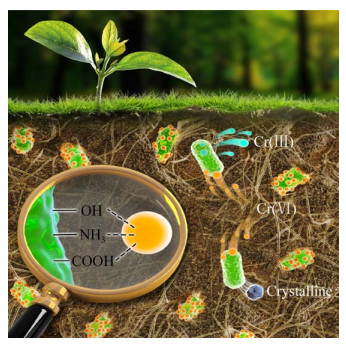 |
| 图 5 微生物修复铬渣示意图[50] Fig. 5 Cartoon of microbial remediation of chromium- containing slag[50]. |
| 图选项 |
3.3 微生物修复铬渣堆场的微生物学表征微生物在维持土壤健康的生态环境中承担着重要的作用,参与地球化学循环的整个过程(如分解、吸附、解毒、增肥等),为土壤环境营造一个健康的生态体系[51]。但是,当有害的铬离子进入健康的土壤或水源,致使环境中铬含量明显高于背景值,引起属地微生物群落丰度和多样性的降低,造成生态环境的恶化[52]。例如高浓度Cr(Ⅵ) 环境不仅对土壤基质产生不利影响,对微生物的数量、活性及种群也会造成不可逆转的损害,从而影响土壤生态系统结构和功能的稳定[53]。
(1) 微生物物种对铬污染的响应
对于铬污染土壤,因Cr(Ⅵ) 的毒性严重影响到属地微生物的数量、种类及活性,物种丰度和多样性也较健康土壤更弱。土壤中Cr(Ⅵ) 浓度越高,对微生物的影响越大,可能会抑制微生物的生长代谢、甚至导致微生物死亡。其中细菌、真菌、放线菌及藻类等微生物对土壤中铬的耐受度差异很大。有研究表明,铬污染土壤中细菌种类最为丰富,细菌在土壤铬污染修复过程中担任着重要的作用。如有机污染场地中,有机物降解菌(Pseudomonas sp.,Mycobacterium sp. 等) 相对丰度较高、矿山生物冶金过程中浸矿微生物(Acidithiobacillus sp.,Leptospirillum sp. 等) 相对丰度较高,而重金属(Cr(Ⅵ)) 污染的修复场地中一些固化微生物(Bacillus sp.,Stenotrophomonas sp. 等) 含量较为丰富[54]。对于Cr(Ⅵ),土壤中超过0.5 mg/kg时,会对属地微生物的数量及活性产生不利影响[55]。但随着铬污染场地的自然驯化过程,一些能够耐受Cr(Ⅵ) 的微生物物种被筛选存活下来,其增强竞争能力、增加相对丰度,成为优势物种。其他的微生物随Cr(Ⅵ) 浓度的增加、毒性增强而呈现自然消亡。
(2) 铬污染土壤中微生物群落结构的演替
由于铬污染土壤中Cr(Ⅵ) 对微生物存在不同程度的毒害作用,影响细菌的形态和代谢,抑制原有的细胞功能,如功能酶的合成和细胞膜的完整性。导致土壤微生物群落结构的变化,Cr(Ⅵ)对99%以上的细菌都有毒害性。该环境中土著微生物必须调整其结构以适应污染的生境;另一方面,铬污染的环境会降低微生物生物量及其活性,同时对属地微生物群落结构产生不利影响[56]。例如,土壤中Cr(Ⅵ) 浓度升高造成生态系统中微生物的酶失活,影响属地稳定的群落结构。随着基因组学、蛋白组学以及生物信息学技术的快速发展,越来越多的科学家关注于土壤中铬污染对微生物群落结构和多样性的生态效应方面的研究[57]。对铬渣堆存场土壤微生物群落结构的研究表明,铬渣堆存场土壤和周边健康土壤之间的微生物群落结构发生了显著变化[58]。铬渣堆场土壤中随着铬污染的扩散,在自然驯化的情况下,Cr(Ⅵ) 耐受微生物数量增加,促使该类微生物演替为优势菌群发挥生物修复的作用[59]。
4 微生物修复铬渣的研究现状目前,多数研究仍聚焦于从Cr(Ⅵ) 污染场地中筛选高效还原Cr(Ⅵ) 的微生物,其试验效果也往往是在实验室理想的条件下获得。随着实验室内的微生物修复铬污染技术的相关机理研究的推进,为现场应用提供了理论指导,促使将微生物修复技术从实验室的研究应用于铬污染场地的现场修复。
对于实验室研究,现已发现多种微生物具有将Cr(Ⅵ) 还原为Cr(Ⅲ) 的功能,其中选育出的Bacillus能够耐受Cr(Ⅵ) 的浓度为4 800 mg/L,且在37 ℃条件下48 h内可将100 mg/L的Cr(Ⅵ)还原至0.79 mg/L,还原率高达99%以上[60-61],高效功能微生物可实现Cr(Ⅵ) 的长效还原固定,具有良好的工业应用前景[62]。近几年,微生物修复铬污染技术的中试柱实验逐渐搭建起来。相关报道指出,通过添加优化后的营养物质,并接种具有Cr(Ⅵ) 修复功能的微生物到中试柱中,随修复时间的延长,中试体系中功能微生物的相对丰度不断增加,逐渐成为优势菌群,构建成有利于生物修复的微生物群落结构体系[63]。邓红艳等[64]对土壤铬污染的微生物修复中试研究中发现,功能微生物对Cr(Ⅵ) 的去除效果较实验室研究中略有降低,分析其原因可知,中试柱中的铬污染土壤中存在大量的属地微生物与功能微生物竞争营养,且功能微生物接种到中试柱中需要一段时间适应铬污染环境,另外,中试体系中,pH值、温度及其他离子的胁迫也会影响微生物对Cr(Ⅵ) 的去除率。关于国外铬污染微生物修复技术的中试研究表明,随着修复体系中微生物群落的演替,功能微生物逐渐成为了优势菌群,且随微生物的生长代谢,体系中渗透率逐渐降低,修复体系中Cr(Ⅵ) 的浓度逐渐降低,有效地限制了Cr(Ⅵ) 的扩散[64]。目前,针对微生物修复技术现场应用方面的研究还很有限。虽然我国遗留铬渣堆场部分已进行湿法解毒处置,短期内控制了污染物的扩散。但为了解决湿法解毒后Cr(Ⅵ) 的返溶,保持长期的修复效果。加强推进微生物修复技术的现场应用已十分紧迫。
5 未来展望本文对湿法解毒后铬渣返溶问题进行了调研,并对微生物技术修复铬渣中返溶的Cr(Ⅵ) 进行了归纳综述,分析发现,铬渣污染修复仍有一些工作有待进一步的完善和解决:
(1) 基于我国铬渣堆场数量多、污染重、处理难度大的事实,单一的处理方式很难彻底解决铬污染问题。所以,急需多种处理方式联合应用,力争实现铬污染彻底消除的目的。
(2) 开展以生物修复铬污染代谢机制的相关研究。利用宏基因组学和转录组学知识解析微生物修复过程中的一些关键元素(Cr、Fe、C、N、S等) 的代谢路径,并构建代谢网络,研究重金属迁移转化过程中关键基因的网络结构。结合蛋白组学相关知识,提取并纯化铬还原酶,确定各种还原酶表达还原Cr(Ⅵ) 的基因片段,构建具有强还原能力的工程菌,用于生物修复铬污染。
(3) 进一步开展大规模场地修复仍需要探索,场地修复不同于实验室研究,它往往具有恶劣的自然环境(干旱、贫瘠、寒冷、强酸/强碱或污染物浓度高、成分复杂、污染面积广等),同时,现场的铬渣成分较为复杂,不易于微生物的生长代谢,影响着生物修复的效果,所以,对生物修复技术应用于现场的工艺优化十分必要,且微生物技术与其他技术联合修复铬污染将会有更广阔的应用前景。
参考文献
| [1] | 张辉, 付融冰, 郭小品, 等. 铬污染土壤的还原稳定化修复. 环境工程学报, 2017, 11(11): 6163-6168. Zhang H, Fu RB, Guo XP, et al. Experimental research onstabilization remediation of chromium contaminated soil. Chin J Environ Eng, 2017, 11(11): 6163-6168 (in Chinese). DOI:10.12030/j.cjee.201702022 |
| [2] | Hedayatkhah A, Cretoiu MS, Emtiazi G, et al. Bioremediation of chromium contaminated water by diatoms with concomitant lipid accumulation for biofuel production. J Environ Manag, 2018, 227: 313-320. DOI:10.1016/j.jenvman.2018.09.011 |
| [3] | 卢鑫, 罗启仕, 刘馥雯, 等. 硫化物对电镀厂铬污染土壤的稳定化效果及其机理研究. 环境科学学报, 2017, 37(6): 2315-2321. Lu X, Luo QS, Liu FW, et al. Effect and mechanism of stabilization of chromium contaminated soils in electroplating factory by sulfide-based stabilizers. Acta Sci Circumstantiae, 2017, 37(6): 2315-2321 (in Chinese). |
| [4] | 孟春瑜, 荆乾坤, 马骏, 等. 微生物技术在稀有金属资源利用中的研究概况. 稀有金属, 2015, 39(4): 371-378. Meng CY, Jing QK, Ma J, et al. Overview of microbiological technology for recovery of rare metal resources. Chin J Rare Met, 2015, 39(4): 371-378 (in Chinese). |
| [5] | Dhal B, Thatoi HN, Das NN, et al. Chemical and microbial remediation of hexavalent chromium from contaminated soil and mining/metallurgical solid waste: a review. J Hazard Mater, 2013, 250/251: 272-291. DOI:10.1016/j.jhazmat.2013.01.048 |
| [6] | GracePavithra K, Jaikumar V, Kumar PS, et al. A review on cleaner strategies for chromium industrial wastewater: present research and future perspective. J Clean Prod, 2019, 228: 580-593. DOI:10.1016/j.jclepro.2019.04.117 |
| [7] | Yin K, Wang QN, Lv M, et al. Microorganism remediation strategies towards heavy metals. Chem Eng J, 2019, 360: 1553-1563. DOI:10.1016/j.cej.2018.10.226 |
| [8] | 许国静. 铬渣的微生物"解毒—介囊化"稳定化机制研究. 重庆: 重庆大学, 2017. Xu GJ. Study on the stabilization mechanism of microbial detoxification and encapsulation of chromium slag. Chongqing: Chongqing University, 2017 (in Chinese). |
| [9] | 邓红艳. 某工厂厂区土壤铬污染及其微生物修复研究. 重庆: 重庆大学, 2016. Deng HY. Chromium pollution and research on bioremediation of chromium contaminated soil in a plant. Chongqing: Chongqing University, 2016 (in Chinese). |
| [10] | 刘仕业, 岳昌盛, 彭犇, 等. 铬污染毒性土壤清洁修复研究进展与综合评价. 工程科学学报, 2018, 40(11): 1275-1287. Liu SY, Yue CS, Peng B, et al. Research progress on remediation technologies of chromium- contaminated soil: a review. Chin J Eng, 2018, 40(11): 1275-1287 (in Chinese). |
| [11] | Jobby R, Jha P, Yadav AK, et al. Biosorption and biotransformation of hexavalent chromium[Cr(Ⅵ)]: a comprehensive review. Chemosphere, 2018, 207: 255-266. DOI:10.1016/j.chemosphere.2018.05.050 |
| [12] | 兰霜, 王秀丽, 黄强, 等. 干湿法解毒铬渣的综合利用研究. 环境科学与管理, 2016, 41(9): 82-85. Lan S, Wang XL, Huang Q, et al. Study on comprehensive utilization of detoxified chromium residue by dry-wet process. Environ Sci Manag, 2016, 41(9): 82-85 (in Chinese). DOI:10.3969/j.issn.1673-1212.2016.09.019 |
| [13] | Chen T, Zhou Z, Xu S, et al. Adsorption behavior comparison of trivalent and hexavalent chromium on biochar derived from municipal sludge. Bioresour Technol, 2015, 190: 388-394. DOI:10.1016/j.biortech.2015.04.115 |
| [14] | Fu F, Wang Q. Removal of heavy metal ions from wastewaters: a review. J Environ Manage, 2011, 92(3): 407-418. DOI:10.1016/j.jenvman.2010.11.011 |
| [15] | Li Y, Liang J, He X, et al. Kinetics and mechanisms of amorphous FeS2 induced Cr(Ⅵ) reduction. J Hazard Mater, 2016, 320: 216-225. DOI:10.1016/j.jhazmat.2016.08.010 |
| [16] | 周光, 刘春慧. 铬渣湿法和干法解毒技术的应用对比. 中国环保产业, 2012(10): 34-36, 40. Zhou G, Liu CH. Application contrast of detoxification technology between wet process and dry process of chrome residue. China Environ Prot Ind, 2012(10): 34-36, 40 (in Chinese). |
| [17] | Li YY, Cundy AB, Feng JX, et al. Remediation of hexavalent chromium contamination in chromite ore processing residue by sodium dithionite and sodium phosphate addition and its mechanism. J Environ Manag, 2017, 192: 100-106. DOI:10.1016/j.jenvman.2017.01.031 |
| [18] | Qian J, Zhou JM, Wang LL, et al. Direct Cr (Ⅵ) bio-reduction with organics as electron donor by anaerobic sludge. Chem Eng J, 2017, 309: 330-338. DOI:10.1016/j.cej.2016.10.077 |
| [19] | Durán U, Coronado-Apodaca KG, Meza-Escalante ER, et al. Two combined mechanisms responsible to hexavalent chromium removal on active anaerobic granular consortium. Chemosphere, 2018, 198: 191-197. DOI:10.1016/j.chemosphere.2018.01.024 |
| [20] | Shanker AK. Chromium: environmental pollution, health effects and mode of action. Encyclopedia of Environmental Health. Amsterdam: Elsevier, 2019, 624-633. |
| [21] | 王慕华, 徐宏英, 苏槟楠. 黑曲霉菌丝球还原水中六价铬的研究. 科学技术与工程, 2010, 10(26): 6472-6476, 6487. Wang MH, Xu HY, Su BN. Study on reduction of chromium(Ⅵ) in water by Aspergillus niger. Sci Technol Eng, 2010, 10(26): 6472-6476, 6487 (in Chinese). DOI:10.3969/j.issn.1671-1815.2010.26.022 |
| [22] | Polti MA, García RO, Amoroso MJ, et al. Bioremediation of chromium(Ⅵ) contaminated soil by Streptomyces sp. MC1. J Basic Microbiol, 2009, 49(3): 285-292. DOI:10.1002/jobm.200800239 |
| [23] | Shahid M, Shamshad S, Rafiq M, et al. Chromium speciation, bioavailability, uptake, toxicity and detoxification in soil-plant system: a review. Chemosphere, 2017, 178: 513-533. DOI:10.1016/j.chemosphere.2017.03.074 |
| [24] | Rajyalaxmi K, Merugu R, Girisham S, et al. Chromate reduction by purple non sulphur phototrophic bacterium Rhodobacter sp. GSKRLMBKU-03 isolated from pond water. Proc Natl Acad Sci India Sect B: Biol Sci, 2019, 89(1): 259-265. DOI:10.1007/s40011-017-0939-8 |
| [25] | Yue ZB, Li Q, Li CC, et al. Component analysis and heavy metal adsorption ability of extracellular polymeric substances (EPS) from sulfate reducing bacteria. Bioresour Technol, 2015, 194: 399-402. DOI:10.1016/j.biortech.2015.07.042 |
| [26] | Dey S, Pandit B, Paul AK. Reduction of hexavalent chromium by viable cells of chromium resistant bacteria isolated from chromite mining environment. J Min, 2014, 2014: 1-8. |
| [27] | Wang J, Lo Q, Li MM, et al. Competitive adsorption of heavy metal by extracellular polymeric substances (EPS) extracted from sulfate reducing bacteria. Bioresour Technol, 2014, 163: 374-376. DOI:10.1016/j.biortech.2014.04.073 |
| [28] | Ma J, Liu H, Zhang C, et al. Joint response of chemistry and functional microbial community to oxygenation of the reductive confined aquifer. Sci Total Environ, 2020, 720: 137587. DOI:10.1016/j.scitotenv.2020.137587 |
| [29] | Joutey NT, Sayel H, Bahafid W, et al. Mechanisms of hexavalent chromium resistance and removal by microorganisms. Rev Environ Contam Toxicol, 2015, 233: 45-69. |
| [30] | Huang XN, Min D, Liu DF, et al. Formation mechanism of organo-chromium (Ⅲ) complexes from bioreduction of chromium (Ⅵ) by Aeromonas hydrophila. Environ Int, 2019, 129: 86-94. DOI:10.1016/j.envint.2019.05.016 |
| [31] | Hou SY, Wu B, Peng DH, et al. Remediation performance and mechanism of hexavalent chromium in alkaline soil using multi-layer loaded nano-zero-valent iron. Environ Pollut, 2019, 252: 553-561. DOI:10.1016/j.envpol.2019.05.083 |
| [32] | Chen Z, Song S, Wen Y. Reduction of Cr(Ⅵ) into Cr(Ⅲ) by organelles of Chlorella vulgaris in aqueous solution: an organelle-level attempt. Sci Total Environ, 2016, 572: 361-368. DOI:10.1016/j.scitotenv.2016.07.217 |
| [33] | Wu MH, Li YZ, Li JJ, et al. Bioreduction of hexavalent chromium using a novel strain CRB-7 immobilized on multiple materials. J Hazard Mater, 2019, 368: 412-420. DOI:10.1016/j.jhazmat.2019.01.059 |
| [34] | Thatoi H, Das S, Mishra J, et al. Bacterial chromate reductase, a potential enzyme for bioremediation of hexavalent chromium: a review. J Environ Manage, 2014, 146: 383-399. DOI:10.1016/j.jenvman.2014.07.014 |
| [35] | Li MK, He ZG, Hu YT, et al. Both cell envelope and cytoplasm were the locations for chromium (Ⅵ) reduction by Bacillus sp. M6. Bioresour Technol, 2019, 273: 130-135. DOI:10.1016/j.biortech.2018.11.006 |
| [36] | Ishak AF, Abdul Karim N, Ahmad WA, et al. Chromate detoxification using combination of ChromeBac? system and immobilized chromate reductase beads. Int Biodeterior Biodegrad, 2016, 113: 238-243. DOI:10.1016/j.ibiod.2016.03.020 |
| [37] | Su CQ, Li LQ, Yang ZH, et al. Cr(Ⅵ) reduction in chromium-contaminated soil by indigenous microorganisms under aerobic condition. Trans Nonferrous Met Soc China, 2019, 29(6): 1304-1311. DOI:10.1016/S1003-6326(19)65037-5 |
| [38] | Wani PA, Wahid S, Khan MSA, et al. Investigation of the role of chromium reductase for Cr(Ⅵ) reduction by Pseudomonas species isolated from Cr(Ⅵ) contaminated effluent. Biotechnol Res Innov, 2019, 3(1): 38-46. DOI:10.1016/j.biori.2019.04.001 |
| [39] | Wani PA, Hussaini NA, Garba SH, et al. Prospective of chromium (Ⅵ) reduction under in vitro and in vivo conditions and stimulation of antioxidant defense of cowpea under the exposure of Cr(Ⅵ). Appl Soil Ecol, 2018, 132: 187-193. DOI:10.1016/j.apsoil.2018.07.012 |
| [40] | Baldiris R, Acosta-Tapia N, Montes A, et al. Reduction of hexavalent chromium and detection of chromate reductase (ChrR) in Stenotrophomonas maltophilia. Molecules, 2018, 23(2): E406. DOI:10.3390/molecules23020406 |
| [41] | Xu R, Wu K, Han H, et al. Co-expression of YieF and PhoN in Deinococcus radiodurans R1 improves uranium bioprecipitation by reducing chromium interference. Chemosphere, 2018, 211: 1156-1165. DOI:10.1016/j.chemosphere.2018.08.061 |
| [42] | Xiao W, Yang X, He Z, et al. Chromium-resistant bacteria promote the reduction of hexavalent chromium in soils. J Environ Qual, 2014, 43(2): 507-516. DOI:10.2134/jeq2013.07.0267 |
| [43] | Yan J, Ye W, Liang X, et al. Enhanced reduction of sulfate and chromium under sulfate-reducing condition by synergism between extracellular polymeric substances and graphene oxide. Environ Res, 2020, 183: 109157. DOI:10.1016/j.envres.2020.109157 |
| [44] | Vendruscolo F, da Rocha Ferreira GL, Antoniosi Filho NR. Biosorption of hexavalent chromium by microorganisms. Int Biodeterior Biodegrad, 2017, 119: 87-95. DOI:10.1016/j.ibiod.2016.10.008 |
| [45] | Jobby R, Jha P, Yadav AK, et al. Biosorption and biotransformation of hexavalent chromium[Cr(Ⅵ)]: a comprehensive review. Chemosphere, 2018, 207: 255-266. DOI:10.1016/j.chemosphere.2018.05.050 |
| [46] | de Freitas GR, da Silva MGC, Vieira MGA. Biosorption technology for removal of toxic metals: a review of commercial biosorbents and patents. Environ Sci Pollut Res Int, 2019, 26(19): 19097-19118. DOI:10.1007/s11356-019-05330-8 |
| [47] | He J, Chen XY, Zhang QZ, et al. More effective immobilization of divalent lead than hexavalent chromium through carbonate mineralization by Staphylococcus epidermidis HJ2. Int Biodeterior Biodegrad, 2019, 140: 67-71. DOI:10.1016/j.ibiod.2019.03.012 |
| [48] | Bech J, Abreu MM, Chon HT, et al. Remediation of potentially toxic elements in contaminated soils PHEs Environ Hum Heal, 2014. DOI: 10.1007/978-94-017-8965-3_7. |
| [49] | Sinha V, Pakshirajan K, Chaturvedi R. Chromium tolerance, bioaccumulation and localization in plants: an overview. J Environ Manage, 2018, 206: 715-730. DOI:10.1016/j.jenvman.2017.10.033 |
| [50] | 闫潇, 刘兴宇, 张明江, 等. 铬污染的微生物吸附技术研究进展. 稀有金属, 2021, 45(2): 240-250. Yan X, Liu XY, Zhang M J, et al. Research progress in biosorption technology for chromium contamination. Chin J Rare Met, 2021, 45(2): 240-250 (in Chinese). |
| [51] | Wang XF, Xing ML, Shen Y, et al. Oral administration of Cr(Ⅵ) induced oxidative stress, DNA damage and apoptotic cell death in mice. Toxicology, 2006, 228(1): 16-23. DOI:10.1016/j.tox.2006.08.005 |
| [52] | Huang J, Li J, Wang G. Production of a microcapsule agent of chromate-reducing Lysinibacillus fusiformis ZC1 and its application in remediation of chromate-spiked soil. Springerplus, 2016, 5: 561. DOI:10.1186/s40064-016-2177-6 |
| [53] | Aparicio J, Simón Solá MZ, Benimeli CS, et al. Versatility of Streptomyces sp. M7 to bioremediate soils co-contaminated with Cr(Ⅵ) and lindan. Ecotoxicol Environ Saf, 2015, 116: 34-39. DOI:10.1016/j.ecoenv.2015.02.036 |
| [54] | Xu R, Wu K, Han H, et al. Co-expression of YieF and PhoN in Deinococcus radiodurans R1 improves uranium bioprecipitation by reducing chromium interference. Chemosphere, 2018, 211: 1156-1165. DOI:10.1016/j.chemosphere.2018.08.061 |
| [55] | Kim KR, Owens G, Kwon SL. Influence of Indian mustard (Brassica juncea) on rhizosphere soil solution chemistry in long-term contaminated soils: a rhizobox study. J Environ Sci (China), 2010, 22(1): 98-105. DOI:10.1016/S1001-0742(09)60080-2 |
| [56] | Maji D, Misra P, Singh S, et al. Humic acid rich vermicompost promotes plant growth by improving microbial community structure of soil as well as root nodulation and mycorrhizal colonization in the roots of Pisum sativum. Appl Soil Ecol, 2017, 110: 97-108. DOI:10.1016/j.apsoil.2016.10.008 |
| [57] | Wang YY, Peng B, Yang ZH, et al. Bacterial community dynamics during bioremediation of Cr(Ⅵ)-contaminated soil. Appl Soil Ecol, 2015, 85: 50-55. DOI:10.1016/j.apsoil.2014.09.002 |
| [58] | Zhao X, Huang J, Lu J, et al. Study on the influence of soil microbial community on the long-term heavy metal pollution of different land use types and depth layers in mine. Ecotoxicol Environ Saf, 2019, 170: 218-226. DOI:10.1016/j.ecoenv.2018.11.136 |
| [59] | Qu ZL, Liu B, Ma Y, et al. Differences in bacterial community structure and potential functions among Eucalyptus plantations with different ages and species of trees. Appl Soil Ecol, 2020, 149: 103515. DOI:10.1016/j.apsoil.2020.103515 |
| [60] | Das S, Mishra J, Das SK, et al. Investigation on mechanism of Cr(Ⅵ) reduction and removal by Bacillus amyloliquefaciens, a novel chromate tolerant bacterium isolated from chromite mine soil. Chemosphere, 2014, 96: 112-121. DOI:10.1016/j.chemosphere.2013.08.080 |
| [61] | Liu YG, Xu WH, Zeng GM, et al. Cr(Ⅵ) reduction by Bacillus sp. isolated from chromium landfill. Process Biochem, 2006, 41(9): 1981-1986. DOI:10.1016/j.procbio.2006.04.020 |
| [62] | GracePavithra K, Jaikumar V, Kumar PS, et al. A review on cleaner strategies for chromium industrial wastewater: present research and future perspective. J Clean Prod, 2019, 228: 580-593. DOI:10.1016/j.jclepro.2019.04.117 |
| [63] | Parker DL, Borer P, Bernier-Latmani R. The response of Shewanella oneidensis MR-1 to Cr(Ⅲ) toxicity differs from that to Cr(Ⅵ). Front Microbiol, 2011, 2: 223. |
| [64] | 邓红艳, 陈刚才, 叶姜瑜. 一株抗铬细菌的分离鉴定及其还原特性研究. 安全与环境学报, 2015, 15(3): 234-237. Deng HY, Chen GC, Ye JY. Isolation, identification and reduction characteristics of a strain of bacteria resistant to Cr(Ⅵ). J Saf Environ, 2015, 15(3): 234-237 (in Chinese). |
