
 , 袁丽杰1
, 袁丽杰1

1. 华北理工大学 基础医学院 河北省慢性疾病基础医学重点实验室 唐山市慢性病临床基础研究重点实验室,河北 唐山 063210;
2. 中国医学科学院 北京协和医学院 医药生物技术研究所 国家新药 (微生物) 筛选实验室,北京 100050
收稿日期:2020-11-04;接收日期:2020-02-05;网络出版时间:2021-02-23
基金项目:中国医学科学院医学与健康科技创新工程(No. 2016-12M-3-014),国家科技重大专项重大新药创制(No. 2019ZX09721001-004-006),河北省自然科学基金(No. H2021209027) 资助
摘要:革兰阴性菌脂多糖转运蛋白(Lipopolysaccharide transport,Lpt) LptA和LptC通过稳定的相互作用对脂多糖装配起到重要作用,它们相互作用的阻断会导致脂多糖层缺损和菌体死亡,因此具备成为抗菌药物筛选靶标的可行性。文中应用生物膜干涉(Biolayer interferometry,BLI) 技术对LptA/LptC相互作用进行检测,为建立体外的LptA/LptC蛋白相互作用阻断剂筛选方法奠定基础。首先在大肠杆菌Escherichia coli BL21(DE3) 中进行大肠杆菌LptA全长、LptA去信号肽和LptC蛋白的表达;纯化的蛋白使用生物素标记后结合到预先稀释液封闭的超级链霉亲和素(Super streptavidin,SSA) 生物传感器,然后再检测与未标记蛋白之间的结合信号,同时做无蛋白的稀释液对照;使用同样的方法检测生物素化蛋白与小分子的结合以及相互作用的阻断;空白对照采用未结合生物素化蛋白的传感器,检测上述系列稀释样品。响应信号采用稳态分析(Steady state analysis) 方式拟合,计算样品平衡常数(KD) 值。本研究成功获得高纯度的LptA和LptC蛋白,并且检测到结合传感器的LptC蛋白与LptA全长蛋白和LptA去信号肽蛋白均具有良好的结合活性,KD值分别为2.9e-7±7.9e-8、6.0e-7±2.8e-8;结合传感器的LptA去信号肽蛋白与LptC蛋白具有良好的结合活性,KD值为9.6e-7±7.2e-9;所有结合曲线呈现出明显的快结合-快解离形态。小分子化合物IMB-881能够与LptA结合来阻断LptA/LptC之间的相互作用,与LptC之间无结合活性。文中首次建立了基于BLI技术的LptA/LptC相互作用检测方法,并且证实该方法能够用于小分子阻断剂阻断活性的评价,为后续的LptA/LptC蛋白相互作用阻断剂筛选奠定了基础。
关键词:生物膜干涉脂多糖脂多糖转运蛋白LptALptCLptA/LptC相互作用
Development of a BLI assay-based method for detecting LptA/LptC interaction
Xiaowei Dai1, Xiaohong Zhu2, Shuyi Si2, Yan Li2

 , Lijie Yuan1
, Lijie Yuan1

1. Tangshan Key Laboratory for Preclinical and Basic Research on Chronic Disease, Hebei Key Laboratory for Chronic Diseases, School of Basic Medical Science, North China University of Science and Technology, Tangshan 063210, Hebei, China;
2. National Center for Drug (Microbiology) Screening Laboratory, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
Received: November 4, 2020; Accepted: February 5, 2020; Published: February 23, 2021
Supported by: CAMS Initiative for Innovative Medicine (No. 2016-12M-3-014), National Mega-Project for Innovative Drugs (No. 2019ZX09721001-004-006), Natural Science Foundation of Hebei Province, China (No. H2021209027)
Corresponding author: Yan Li. Tel: +86-10-63180623; E-mail: 13391513480@163.com;
Lijie Yuan. Tel: +86-315-8805507; E-mail: yuanlijie1970@163.com.
Abstract: In Gram-negative bacteria, lipopolysaccharide transport (Lpt) protein LptA and LptC form a complex to transport LPS from the inner membrane (IM) to the outer membrane (OM). Blocking the interaction between LptA and LptC will lead to the defect of OM and cell death. Therefore, Lpt protein interaction could be used as a target to screen new drugs for killing Gram-negative bacteria. Here we used biolayer interferometry (BLI) assay to detect the interaction between LptA and LptC, with the aim to develop a method for screening the LptA/LptC interaction blockers in vitro. Firstly, LptC and LptA with or without signal peptide (LptAfull or LptAno signal) were expressed in E. coli BL21(DE3). The purified proteins were then labeled with biotin and the super streptavidin (SSA) biosensor was blocked with diluent. The biotin labeled protein sample was mixed with the sensor, and then the binding of the protein with a series of diluted non biotinylated protein was detected. At the same time, non-biotinylated protein was used as a control. The binding of biotinylated protein to a small molecule IMB-881 and the blocking of interaction were also detected by the same method. In the blank control, the biosensor without biotinylated protein was used to detect the serially diluted samples. The signal response constant was calculated by using steady analysis. The results showed that biotinylated LptC had a good binding activity with LptAfull and LptAno signal with KD value 2.9e-7±7.9e-8 and 6.0e-7±2.8e-8, respectively; biotinylated LptAno signal had a good binding activity with LptC, with a KD value of 9.6e-7±7.2e-9. All binding curves showed obvious fast binding and fast dissociation morphology. The small molecule compound IMB-881 can bind to LptA to block the interaction between LptA and LptC, but has no binding activity with LptC. In summary, we developed a method for detecting the LptA/LptC interaction based on the BLI technology, and confirmed that this method can be used to evaluate the blocking activity of small molecule blockers, providing a new approach for the screening of LptA/LptC interaction blockers.
Keywords: biolayer interferometry (BLI)lipopolysaccharide (LPS)lipopolysaccharide transport (Lpt)LptALptCLptA/LptC interaction
革兰阴性菌(G-菌) 感染率近年来逐年增高,已经成为临床细菌感染的主要病原菌[1-2]。耐药细菌的不断出现与传播使得细菌感染的预防与治疗面临严峻的挑战,因药物作用靶标发生改变而引起的耐药是主要耐药机制之一,因此发现新靶标,进而发现新型抗生素对抗菌药物的研发具有重要的意义。
脂多糖(Lipopolysaccharide,LPS) 是革兰阴性菌特有的结构,是菌体抵御外界环境的重要屏障,也是革兰阴性菌固有耐药的重要因素,因此LPS作为抗革兰阴性菌药物研发的靶标近年来受到越来越多的关注[3]。LPS在细胞内膜内侧合成后,经由脂多糖转运蛋白复合体(Lipopolysaccharide transport,Lpt) 转运到外膜进行组装,形成完整的LPS层[4-5]。Lpt复合物由7种蛋白(Lpt A-G)组成,其中位于内膜的LptC蛋白能够结合LPS,然后依靠内膜蛋白LptBFG提供的能量,将LPS传递给周质蛋白LptA,进而传递给外膜蛋白LptD和LptE进行组装,通过这种桥链作用完成LPS的转运和装配,最终形成LPS层[6-8]。LptA能够结合LPS,它与LptC蛋白和LptDE复合体也能形成稳定的相互作用,这种相互作用保证了LptA蛋白稳定地存在于周质空间,并且完成LPS的转运作用[9]。Lpt蛋白相互作用的阻断会破坏LPS的跨膜转运,进而影响外膜的生成,导致细菌死亡[10-11]。此外,Lpt蛋白具有较高的保守性,在哺乳动物细胞中也并不存在,目前尚未有以Lpt蛋白为靶标的抗菌药物应用于临床,因此Lpt蛋白相互作用具有成为抗革兰阴性菌药物发现靶标的潜力[12-13]。
生物膜干涉(Biolayer interferometry,BLI) 技术是一种光干涉技术和光纤信号测量技术相结合的光学分析技术,分子与分子之间的特异性作用会改变传感器表面生物膜的厚度,从而形成光谱位移值。因此,该技术可以实时检测蛋白和小分子之间或者蛋白之间的相互作用,通过平衡常数(KD) 来表示相互作用的强弱。该技术近年来在抗体筛选、配体受体研究以及蛋白与小分子结合方面多有应用[14]。
鉴于LptA/LptC蛋白相互作用在革兰阴性菌中的重要作用,本研究建立了基于BLI技术的LptA/LptC蛋白相互作用的检测方法,并在此基础上检测已报道的阻断剂IMB-881的阻断活性,以进一步评价BLI技术能否应用于LptA/LptC蛋白相互作用阻断剂的筛选,也为建立基于BLI技术的LptA/LptC蛋白相互作用阻断剂筛选模型和阻断活性评价模型奠定基础,推动Lpt蛋白相互作用作为抗菌药物筛选靶标的研究。
1 材料与方法1.1 材料1.1.1 试剂IMB-881由中国医学科学院医药生物技术研究所国家新药(微生物) 筛选实验室合成;蛋白标准分子量购自BioRad公司;XhoⅠ、BamHⅠ购自TaKaRa公司;蛋白胨、酵母粉、琼脂粉购自Clontech公司;氨苄西林、卡那霉素、异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactoside,IPTG) 购自Aladdin公司;免疫印迹膜、HisTrapTM层析柱购自GE公司;BCA (Bicinchoninic acid) 蛋白质定量试剂盒购自Thermo公司;小鼠抗组氨酸(Histidine,His) 标签单克隆抗体、辣根过氧化物酶(Horseradish peroxidase,HRP) 标记的羊抗小鼠IgG购自康为世纪公司;HRP底物化学发光液(ECL) 购自美国Millipore公司;96孔板购自Corning Costar公司;磷酸盐缓冲液(Phosphate buffered solution,PBS) 购自北京中杉金桥生物技术有限公司;吐温-20 (Tween-20) 购自Sigma公司;生物素化标记试剂NHS-LC-LC-Biotin购自Thermo公司;牛血清白蛋白(Bovine serum albumin,BSA)购自索莱宝公司;Zeba desalting spin columns脱盐柱购自Thermo公司;SSA传感器购自ForteBio公司;pET-28a表达载体由本实验室保存;其他试剂均为国产分析纯。
1.1.2 仪器超净工作台(哈东联Clean Benah公司);加热制冷型金属浴(Thermo公司);高速冷冻离心机(Hitachi公司);蛋白质电泳仪(GE公司);半干转膜仪(Bio-Rad公司);恒温摇床(北京沃德创技贸有限公司);超声破碎仪(B.Braun Biotech International公司);AKTA层析系统(GE公司);凝胶成像系统(上海天能公司);多功能微孔板检测仪(PerkinElmer公司);分子相互作用检测仪器(Octet Red96,美国Pall公司)。
1.2 方法1.2.1 LptA和LptC蛋白的原核表达和纯化在NCBI数据库中检索LptA基因(GenBank登录号:QBC14848.1) 和LptC基因(GenBank登录号:QBC14847.1),然后对Lpt基因序列进行GC含量计算与基因序列优化,优化的序列中避免XhoⅠ与BamHⅠ酶切位点。在优化的LptA、LptC基因序列5′端和3′端分别加入XhoⅠ与BamHⅠ酶切位点进行基因合成。构建重组质粒pET-28a-LptA全长、pET-28a-LptA去信号肽和pET-28a-LptC,以热激法转化到大肠杆菌Escherichia coli BL21(DE3) 感受态细胞中,再以卡那霉素抗性筛选法进行阳性重组子筛选。随机挑取重组子接种到含30 μg/mL卡那霉素抗性的LB液体培养基中,37 ℃培养。当OD值达到0.6时,添加0.5 mmol/L诱导剂IPTG,继续培养。分别于20 ℃条件下培养过夜或37 ℃条件下培养6 h诱导表达,未添加诱导剂的为阴性对照,再以12% SDS-PAGE进行分析。
为了获得纯化的蛋白,将诱导后的菌体(0.5 mmol/L IPTG,20 ℃,过夜) 以超声波法破碎后,离心收集上清。按照HisTrapTM亲和层析法进行蛋白分离纯化。纯化的蛋白分别以0.2% 月桂酰肌氨酸钠(Sarkosyl,SKL) 溶液透析和蛋白质浓缩超滤管浓缩,0.45 μm滤膜过滤后以BCA法定量,应用蛋白质印迹分析方法检测蛋白的正确表达。
1.2.2 BLI技术检测蛋白间相互作用1) 样品制备:参照说明书对准备结合到传感器的LptA和LptC蛋白进行生物素化,LptA全长、LptA去信号肽和LptC浓度分别为0.6 mg/mL、0.8 mg/mL和0.24 mg/mL,生物素浓度1 mmol/L,生物素化的蛋白使用脱盐柱处理后,使用PBST (含有0.02%吐温-20的PBS) 缓冲液稀释至25 μg/mL。
2) 蛋白相互作用检测:4根SSA传感器分别置于传感器支架第一、二列,每列两根,第一列结合生物素化蛋白,第二列为空白对照。待测样品使用PBST缓冲液自25 μg/mL起2倍梯度稀释至浓度为1.56 μg/mL。在96孔板中按照表 1所示加入样品,A行为待测样品,将对照行B的样品孔替换为等量的PBST缓冲液,其余各孔不变。
在Data Acquisition 9.0软件中将检测条件设置如下:传感器在第一孔PBS浸润10 min之后,按照Baseline (60 s)、Loading (600 s)、Wash (60 s)进行生物素化蛋白的结合,然后按照Baseline (60 s)、Association (90 s) 和Dissociation (90 s) 检测不同样品孔与传感器的结合。
1.2.3 BLI技术检测蛋白与IMB-881的相互作用检测LptA全长、LptA去信号肽、LptC分别与小分子IMB-881的相互作用,SSA传感器的预处理及检测方法与1.2.2相同。使用PBST-BSA (含有0.1% BSA的PBST,pH 6.0) 缓冲液将IMB-881化合物自38.6 μmol/L浓度起梯度稀释至0.15 μmol/L,表 1中的S换成稀释好的IMB-881化合物,R为PBST-BSA缓冲液。
表 1 样品排布Table 1 Sample arrangement
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| A | B | L | B | B | B | B | B | S | S | S | S | S |
| B | B | L | B | B | B | B | B | R | R | R | R | R |
| B: buffer, PBS; L: loading, biotinylated protein; S: sample; R: reference, PBST. | ||||||||||||
表选项
1.2.4 BLI技术检测IMB-881对蛋白的阻断作用SSA传感器的预处理及检测与1.2.2中相同。但是表 1中的S换成均由PBST-BSA缓冲液稀释的IMB-881化合物和蛋白的混合液,R为PBST-BSA缓冲液。
1.2.5 数据分析使用Data analysis 9.0软件对数据进行分析。以对应的未结合蛋白的传感器及缓冲液对照作为对照进行扣除,以稳态分析(Steady state analysis)方式拟合,如R2≥0.95,则检测有效,计算响应值与KD值。
2 结果与分析2.1 LptA和LptC基因的优化基因序列的优化有利于提高其在大肠杆菌中的表达量[15],在本研究中应用SnapGene和DNAMAN软件分析,LptA全长原始序列的GC含量为49%,经优化后GC含量为50%且均匀分布;LptA去信号肽原始序列的GC含量为50%,经优化后GC含量为49%,但均匀分布;LptC原始序列的GC含量为47%,经优化后GC含量为51%且均匀分布(图 1)。
 |
| 图 1 LptA全长、LptA去信号肽及LptC基因优化前后的序列比较 Fig. 1 Comparison of the sequences of LptAfull, LptAno signal and LptC before and after optimization. |
| 图选项 |
2.2 LptA和LptC原核表达质粒的构建与鉴定信号肽对于蛋白的跨膜定位具有重要的作用,蛋白表达中也发现带有信号肽的蛋白更容易以可溶性蛋白形式表达[16],但是在周质空间中的LptA蛋白是切除了信号肽的蛋白,信号肽可能会影响蛋白间相互作用。为了获得可溶性的活性蛋白,而且不影响蛋白之间的相互作用,同时表达了带有信号肽的蛋白(LptA全长) 和去掉信号肽的蛋白(LptA去信号肽)。
因而在LptA构建策略中,分别构建氨基端含信号肽与去信号肽的重组质粒。将优化的基因合成后,以XhoⅠ和BamHⅠ为酶切位点,连接到pET-28a表达载体中构建重组质粒pET-28a-LptA全长、pET-28a-LptA去信号肽、pET-28a-LptC,羧基端仅融合多聚组氨酸标签。重组质粒以双酶切法进行鉴定,得到了与预期大小(550 bp) 一致的LptA全长基因片段(图 2A),同样方法得到预期大小(489 bp) 一致的LptA去信号肽基因片段(图 2B)。在LptC构建策略中,构建羧基端带有融合多聚组氨酸标签的无信号肽蛋白重组质粒。重组质粒以双酶切法进行鉴定,得到了与预期大小(483 bp) 一致的LptC基因片段(图 2C)。上述序列经测序比对分析显示,其基因序列与预期优化序列完全一致,氨基酸序列与天然Lpt一级结构完全相同,表明成功构建了重组质粒pET-28a-LptA全长、pET-28a-LptA去信号肽和pET-28a-LptC。
 |
| 图 2 LptA全长、LptA去信号肽及LptC原核表达质粒的酶切鉴定 Fig. 2 Enzymatic identification of LptAfull, LptAno signal and LptC prokaryotic expression plasmid. 1: DNA marker; 2: gene. |
| 图选项 |
2.3 LptA和LptC原核表达及纯化卡那霉素抗性筛选的重组子分别在20 ℃和37 ℃,1 mmol/L的IPTG诱导表达,经由SDS-PAGE分析发现在22 kDa、19 kDa和20 kDa均有明显条带,LptA蛋白在沉淀中,LptC蛋白在上清中(图 3A)。
 |
| 图 3 LptA、LptC原核表达及纯化检测 Fig. 3 Prokaryotic expression and purification of LptA and LptC. (A) Protein-induced expression. LptAfull and LptC: M: protein marker; 1: total cell protein before induction; 2: cellular lysate supernatant at 20 ℃; 3: inclusion body at 20 ℃; 4: cellular lysate supernatant at 37 ℃; 5: inclusion body at 37 ℃; LptAno signal: M: protein marker; 1: total cell protein before induction; 2, 4: cellular lysate supernatant at 20 ℃; 3, 5: inclusion body at 20 ℃; 6: cellular lysate supernatant at 37 ℃; 7: inclusion body at 37 ℃. (B) Analysis of the purified Lpt using SDS-PAGE analysis. (C) Analysis of the purified Lpt using Western blotting assay. |
| 图选项 |
纯化后的蛋白经由SDS-PAGE分析,结果表明,纯化的2种LptA蛋白和LptC蛋白经考马斯亮蓝染色后,分别在预期分子量22 kDa、19 kDa和20 kDa位置呈单一条带,说明纯化的3种蛋白具有较高的纯度(图 3B)。蛋白质印迹分析实验结果显示,在相同分子量位置仍有单一条带,证实了3种蛋白的正确表达(图 3C)。纯化的LptA全长、LptA去信号肽和LptC蛋白经透析和浓缩后,其浓度分别为0.80 mg/mL、0.60 mg/mL和0.24 mg/mL。
2.4 BLI技术检测蛋白间的相互作用对两种LptA蛋白与LptC蛋白之间的相互作用分别进行了检测(图 4)。结果发现,传感器结合生物素化的LptC蛋白时,LptC与2个LptA蛋白均能够结合,LptA蛋白从3.125 μg/mL上升至25 μg/mL时,LptC与LptA全长的信号值从0.046 3上升至0.101 3,与LptA去信号肽的信号值从0.027 5上升至0.080 9,具有浓度依赖性。传感器结合生物素化的LptA全长或LptA去信号肽时,也能检测到两个蛋白与LptC的相互作用,随着LptC浓度从3.125 μg/mL上升至12.5 μg/mL,LptA全长响应值从0.001 2上升至0.016 0,LptA去信号肽的信号值则由0.025 9上升至0.082 6,均具有浓度梯度依赖性。
 |
| 图 4 LptA/LptC相互作用检测 Fig. 4 Detection of LptA/LptC interaction. (A) The interaction between LptC protein and LptAfull protein. (B) The interaction between LptC protein and LptAno signal protein. (C) The interaction between LptAfull protein and LptC protein. (D) The interaction between LptAno signal protein and LptC protein. |
| 图选项 |
此外,这些结果也表明信号肽是否存在对LptA和LptC蛋白的结合并没有明显影响。但是传感器在结合生物素化LptA全长时,检测值明显低于结合LptA去信号肽的值,这可能与LptA全长与传感器的结合能力较弱有关系,信号肽的存在可能会影响LptA蛋白生物素化或与传感器的结合。
2.5 BLI技术检测蛋白与小分子相互作用IMB-881是已经报道的具有LptA/LptC相互作用阻断活性的小分子化合物[17],该化合物能够通过与LptA结合阻断两个蛋白的相互作用。为了验证BLI技术是否能够应用于检测小分子化合物对相互作用的阻断,以IMB-881为阳性化合物进行了评价(图 5)。因为传感器结合LptA全长蛋白时,与LptC蛋白相互作用信号值比较弱,所以在IMB-881与蛋白的结合以及后面的阻断实验中,选用了LptA去信号肽蛋白。结果发现,IMB-881能够与LptA结合,并且响应值随着化合物浓度的升高而增加,具有浓度依赖性,在9.65 μmol/L和38.60 μmol/L时的响应值分别为0.020 2和0.037 7。IMB-88与LptC无相互作用,这与已经报道的结果相一致[17]。
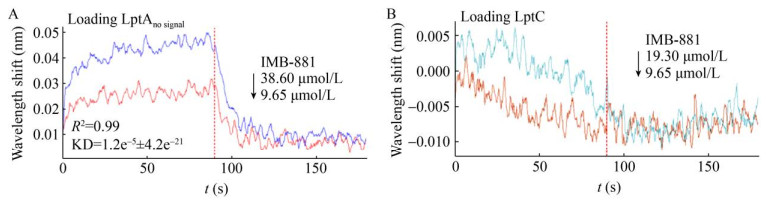 |
| 图 5 蛋白与IMB-881相互作用的检测 Fig. 5 Detection of protein interaction with IMB-881. (A) The interaction between LptAno signal protein and IMB-881. (B) The interaction between LptC protein and IMB-881. |
| 图选项 |
2.6 BLI技术检测小分子对蛋白的阻断作用为了验证IMB-881能够阻断LptA-LptC相互作用,将生物素化的LptA去信号肽固化到传感器上,使用不同浓度的IMB-881与LptC蛋白共孵育后流经进行检测。由于IMB-881与空传感器具有较强的非特异性结合,会掩盖相互作用的结果,在查阅相关文献[18]后,对缓冲液进行优化,使用PBST-BSA缓冲液对未结合蛋白的空传感器进行一定的封闭。结果如图 6所示,IMB-881能够阻断LptA-LptC相互作用,且具有浓度依赖性。
 |
| 图 6 IMB-881对LptA-LptC相互作用阻断的检测 Fig. 6 Disruption of LptA-LptC protein interaction by IMB-881. |
| 图选项 |
3 讨论作为革兰阴性菌特有的重要结构,近年来LPS在抗菌药物研发中受到越来越多的关注,以它的合成、跨膜转运以及在外膜的组装各个环节的关键调控因子为靶标的药物研究也多有报道[4, 19],最早研究的LPS合成抑制相关的Lipid A合成关键酶LpxC抑制剂在体内外均表现出良好的抗菌活性[20]。随着LPS转运和组装机制的解析,以其中的关键因子为靶标的药物发现也多有研究[21-23]。
在2018年,Zhang等构建了LptA和LptC相互作用的酵母双杂交模型,并在此基础上发现了具有抗菌活性的IMB-881化合物,提示了该相互作用作为抗菌药物靶标的可行性[17]。基于酵母双杂交模型的筛选方法简单,能够实现高通量筛选,但是因为酵母细胞壁与细菌细胞壁的差异很大、化合物对酵母细胞本身也会产生毒性或者抑制报告基因的表达,从而导致漏筛和假阳性的产生。此外,筛选得到的阳性化合物也需要在分子水平上进一步的确认,基于表面等离子共振(Surface Plasmon Resonance,SPR) 技术建立了LptA/LptC相互作用的检测方法,该方法的灵敏度比较高,但是该方法通量低,8通道的仪器也只能做到同时对7个样本的检测,而且检测时间较长,很难实现高通量的相互作用评价和筛选。免疫共沉淀和拉下(Pull down) 等传统技术中因为蛋白质印迹分析技术的复杂操作,也很难应用于高通量的评价和筛选,因此,有必要建立一种简单的蛋白相互作用和阻断活性评价方法,以推动分子水平上的相互作用阻断剂的筛选和后续的阻断活性的鉴定。BLI技术是新一代检测生物分子相互作用的实时分析监测技术,由于其分析速度快、无标记、特异性强等优点而被广泛应用于快速检测[14, 24-25]。蛋白生物素化提高了蛋白与芯片的结合能力,提高了灵敏性,而96通道甚至384通道仪器的开发也使得该技术能够快速地同时测定多个蛋白相互作用或者同时评价蛋白与多个化合物的相互作用,使得高通量筛选成为可能。BLI技术在研究抗原/抗体相互作用[26]、蛋白与小分子化合物相互作用方面多有应用,但是在蛋白相互作用方面并不多见。本研究建立了基于BLI技术的LptA/LptC蛋白相互作用的检测方法,发现生物素化的LptA和LptC蛋白能够很好地结合到传感器上,能够检测到较高的相互作用信号,以IMB-881为阳性药物也能发现化合物与蛋白的结合和相互作用的阻断。这为后续的相互作用小分子的筛选和阻断活性的评价奠定了良好的基础,也推动了BLI技术在蛋白相互作用方面的应用。
在进行IMB-881阻断LptA-LptC相互作用时发现,IMB-881与空探针的非特异性结合较强,会掩盖阻断活性的结果。在本研究中,采用0.1% BSA封闭未结合蛋白的探针位点来消除非特异性结合。同时发现在检测相互作用阻断时,不同的蛋白结合到传感器上对阻断的结果影响也不相同。因此,直接应用两个蛋白进行相互作用筛选阻断剂是很困难的,因此在实际应用BLI技术进行相互作用筛选阻断剂时,更为可行的筛选策略应该是首先应用单一蛋白筛选与蛋白相互作用的小分子化合物,在得到阳性化合物后再进行阻断活性的复筛。
综上所述,本研究基于BLI技术实时检测分子间相互作用,建立优化的基于BLI技术检测小分子抑制剂阻断Lpt蛋白相互作用的方法,为后续的小分子抑制剂的筛选以及阻断活性的评价奠定了实验基础。
参考文献
| [1] | Van Duin D, Paterson DL. Multidrug-resistant bacteria in the community: trends and lessons learned. Infect Dis Clin North Am, 2016, 30(2): 377-390. DOI:10.1016/j.idc.2016.02.004 |
| [2] | Wellington EMH, Boxall ABA, Cross P, et al. The role of the natural environment in the emergence of antibiotic resistance in Gram-negative bacteria. Lancet Infect Dis, 2013, 13(2): 155-165. DOI:10.1016/S1473-3099(12)70317-1 |
| [3] | Sperandeo P, Villa R, Martorana AM, et al. New insights into the Lpt machinery for lipopolysaccharide transport to the cell surface: LptA-LptC interaction and LptA stability as sensors of a properly assembled transenvelope complex. J Bacteriol, 2011, 193(5): 1042-1053. DOI:10.1128/JB.01037-10 |
| [4] | Simpson BW, Trent MS. Pushing the envelope: LPS modifications and their consequences. Nat Rev Microbiol, 2019, 17(7): 403-416. DOI:10.1038/s41579-019-0201-x |
| [5] | Raetz CRH, Whitfield C. Lipopolysaccharide endotoxins. Annu Rev Biochem, 2002, 71: 635-700. DOI:10.1146/annurev.biochem.71.110601.135414 |
| [6] | Holst O. The structures of core regions from enterobacterial lipopolysaccharides — an update. FEMS Microbiol Lett, 2007, 271(1): 3-11. DOI:10.1111/j.1574-6968.2007.00708.x |
| [7] | Steeghs L, Den Hartog R, Den Boer A, et al. Meningitis bacterium is viable without endotoxin. Nature, 1998, 392(6675): 449. DOI:10.1038/33046 |
| [8] | Meredith TC, Aggarwal P, Mamat U, et al. Redefining the requisite lipopolysaccharide structure in Escherichia coli. ACS Chem Biol, 2006, 1(1): 33-42. DOI:10.1021/cb0500015 |
| [9] | Tran AX, Dong CJ, Whitfield C. Structure and functional analysis of LptC, a conserved membrane protein involved in the lipopolysaccharide export pathway in Escherichia coli. J Biol Chem, 2017, 292(45): 33529-33539. |
| [10] | Sperandeo P, Lau FK, Carpentieri A, et al. Functional analysis of the protein machinery required for transport of lipopolysaccharide to the outer membrane of Escherichia coli. J Bacteriol, 2008, 190(13): 4460-4469. DOI:10.1128/JB.00270-08 |
| [11] | Sperandeo P, Cescutti R, Villa R, et al. Characterization of lptA and lptB, two essential genes implicated in lipopolysaccharide transport to the outer membrane of Escherichia coli. J Bacteriol, 2007, 189(1): 244-253. DOI:10.1128/JB.01126-06 |
| [12] | Schultz KM, Fischer MA, Noey EL, et al. Disruption of the E. coli LptC dimerization interface and characterization of lipopolysaccharide and LptA binding to monomeric LptC. Protein Sci, 2018, 27(8): 1407-1417. DOI:10.1002/pro.3429 |
| [13] | Schultz KM, Feix JB, Klug CS. Disruption of LptA oligomerization and affinity of the LptA-LptC interaction. Protein Sci, 2013, 22(11): 1639-1645. DOI:10.1002/pro.2369 |
| [14] | 张艳, 姜丽艳, 张晓光, 等. 生物膜干涉技术在生物分子间相互作用检测中的应用. 生命科学仪器, 2019, 18(2): 49-52, 42. Zhang Y, Jiang LY, Zhang XG, et al. Application of biolayer interferometry in detection of biomolecular interaction. Life Sci Instrum, 2019, 18(2): 49-52, 42 (in Chinese). |
| [15] | 陈云雨, 付正豪, 闫干干, 等. 基于密码子优化策略的新型冠状病毒主蛋白酶在大肠杆菌中的表达条件优化与活性鉴定. 生物工程学报, 2020, 37(4): 1-12. Chen YY, Fu ZH, Yan GG, et al. Expression condition optimization and proteolytic activity analysis of codon-optimized SARS-CoV-2 main protease in Escherichia coli. Chin J Biotech, 2020, 37(4): 1-12 (in Chinese). |
| [16] | 郑屠园, 李娅慧, 周继勇, 等. 信号肽序列对A型流感病毒H1N1 HA蛋白表达的影响. 畜牧与兽医, 2020, 52(8): 64-67. Zheng TY, Li YH, Zhou JY, et al. Effect of signal peptide on the expression of the H1N1 HA protein of the influenza A virus. Animal Husband Vet Med, 2020, 52(8): 64-67 (in Chinese). |
| [17] | Zhang XL, Li Y, Wang WW, et al. Identification of an anti-Gram-negative bacteria agent disrupting the interaction between lipopolysaccharide transporters LptA and LptC. Int J Antimicrob Agents, 2019, 53(4): 442-448. DOI:10.1016/j.ijantimicag.2018.11.016 |
| [18] | 张峰, 武刚, 于传飞, 等. 应用生物膜干涉技术测定治疗性单抗与新生儿Fc受体的亲和力. 中国新药杂志, 2016, 25(16): 1861-1867. Zhang F, Wu G, Yu CF, et al. Detection of affinity between therapeutic monoclonal antibodies and neonatal Fc receptor using biolayer interferometry. Chin J New Drugs, 2016, 25(16): 1861-1867 (in Chinese). |
| [19] | Ho H, Miu A, Alexander MK, et al. Structural basis for dual-mode inhibition of the ABC transporter MsbA. Nature, 2018, 557(7704): 196-201. DOI:10.1038/s41586-018-0083-5 |
| [20] | Tomaras AP, McPherson CJ, Kuhn M, et al. LpxC inhibitors as new antibacterial agents and tools for studying regulation of lipid A biosynthesis in Gram-negative pathogens. mBio, 2014, 5(5): e01551-14. |
| [21] | Vetterli SU, Zerbe K, Müller M, et al. Thanatin targets the intermembrane protein complex required for lipopolysaccharide transport in Escherichia coli. Sci Adv, 2018, 4(11): eaau2634. DOI:10.1126/sciadv.aau2634 |
| [22] | Moura ECCM, Baeta T, Romanelli A, et al. Thanatin impairs lipopolysaccharide transport complex assembly by targeting LptC-LptA interaction and decreasing LptA stability. Front Microbiol, 2020, 11: 909. DOI:10.3389/fmicb.2020.00909 |
| [23] | Srinivas N, Jetter P, Ueberbacher BJ, et al. Peptidomimetic antibiotics target outer-membrane biogenesis in Pseudomonas aeruginosa. Science, 2010, 327(5968): 1010-1013. DOI:10.1126/science.1182749 |
| [24] | 杨国泰, 吴鑫, 李福来, 等. 生物膜层干涉技术在生物分子分析和检测中应用的研究进展. 分析测试学报, 2017, 36(8): 1055-1060. Yang GT, Wu X, Li FL, et al. Research progress in application of biolayer interferometry in analysis and detection of biomolecules. J Instrum Anal, 2017, 36(8): 1055-1060 (in Chinese). DOI:10.3969/j.issn.1004-4957.2017.08.020 |
| [25] | Cusano AM, Aliberti A, Cusano A, et al. Detection of small DNA fragments by biolayer interferometry. Analyt Biochem, 2020, 607: 113898. DOI:10.1016/j.ab.2020.113898 |
| [26] | Poosarla VG, Li T, Goh BC, et al. Computational de novo design of antibodies binding to a peptide with high affinity. Biotechnol Bioeng, 2017, 114(6): 1331-1342. DOI:10.1002/bit.26244 |
