

1. 上海海洋大学 食品学院 农业部水产品贮藏保鲜质量安全风险评估实验室 (上海),上海 201306;
2. 上海市计量测试技术研究院 生物计量实验室,上海 201203
收稿日期:2020-11-27;接收日期:2021-03-04;网络出版时间:2021-03-24
基金项目:国家自然科学基金(Nos. 21775102,21775104),上海市自然科学基金(No. 20ZR1424100) 资助
摘要:脱氧核糖核酸(Deoxyribonucleic acid,DNA) 不仅可作为生物遗传的物质基础,又以其可编程性、功能多样性、生物相容性和生物可降解性等优点,在生物材料的构建方面表现出巨大的潜力。DNA水凝胶是一种主要由DNA参与形成的三维网状聚合物材料,同时因其保留的DNA生物性能与自身骨架的机械性能的完美融合使得它成为近年来最受关注的新兴功能高分子材料之一。目前,基于各种功能核酸序列或通过结合不同的功能材料制备的单组分或多组分DNA水凝胶,已广泛用于生物医学、分子检测及环境保护的研究或应用领域中。文中主要总结了近十几年来DNA水凝胶制备方法上的研究进展,探讨了DNA水凝胶的分类策略,并进一步综述了DNA水凝胶在药物运输、生物传感、细胞培养等方面的应用研究。最后对DNA水凝胶未来的发展方向以及可能面临的挑战进行了展望。
关键词:单组分DNA水凝胶多组分DNA水凝胶药物运输生物传感细胞培养
Preparation and application of DNA hydrogels: a review
Qing Tao1, Xiaojun Bian1, Tong Zhang1, Gang Liu2, Juan Yan1


1. Laboratory of Quality & Safety Risk Assessment for Aquatic Products on Storage and Preservation of the Ministry of Agriculture (Shanghai), College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;
2. Laboratory of Biometrology, Shanghai Institute of Metrology and Testing Technology, Shanghai 201203, China
Received: November 27, 2020; Accepted: March 4, 2021; Published: March 24, 2021
Supported by: National Natural Science Foundation of China (Nos. 21775102, 21775104), Natural Science Foundation of Shanghai Municipal, China (No. 20ZR1424100)
Corresponding author: Juan Yan. E-mail: j-yan@shou.edu.cn.
Abstract: Deoxyribonucleic acid (DNA) not only serves as the material basis of biological inheritance, but also shows great potential in the development of novel biological materials due to its programmability, functional diversity, biocompatibility and biodegradability. DNA hydrogel is a three-dimensional mesh polymer material mainly formed by DNA. It has become one of the most interesting emerging functional polymer materials in recent years because of the perfect combination of the DNA biological properties that it retained and the mechanical properties of its own skeleton. At present, single- or multi-component DNA hydrogels developed based on various functional nucleic acid sequences or by combining different functional materials have been widely used in the field of biomedicine, molecular detection, and environmental protection. In this paper, the development of preparation methods and classification strategies of DNA hydrogels are summarized, and the applications of DNA hydrogels in drug delivery, biosensing and cell culture are also reviewed. Finally, the future development direction and potential challenges of DNA hydrogels are prospected.
Keywords: single-component DNA hydrogelsmulti-component DNA hydrogelsdrug deliverybiosensingcell culture
DNA作为遗传信息载体可参与遗传信息的编码以及基因的表达,美国纽约大学N.Seeman教授对DNA纳米技术的研究引起了人们对DNA的关注,利用DNA的纳米尺度、序列可编程性和独特的物理化学性质可以完成人工DNA纳米结构的构建[1-2]。在过去的几十年中,DNA作为纳米尺度上的分子构建块已经获得了显著的研究成果,其在药物传递、诊断、催化反应、传感器等方面都具有重要的理论和实践意义[3-6]。
通过固相合成和分子生物学技术,可以设计、合成具有某些序列的核酸,实现可编程和可预测的方式精确制备一维、二维和三维DNA纳米结构的目标[7-9]。DNA水凝胶(DNA hydrogel) 是有DNA参与形成的一种介于流体和固体之间的亲水材料,在水中可显著溶胀,一般为三维网络结构,通过设计可以呈现出不同形状和尺寸,根据成分组成可分为单组分DNA水凝胶和多组分DNA水凝胶。由于水凝胶的高负荷容量、优异的机械稳定性和粘弹性,可实现生物活性分子(如核苷酸、蛋白质、抗体和药物) 的有效包封,并保留其生物活性[10-12]。通过向水凝胶序列中引入具备催化能力的脱氧核酶(Deoxyribozyme,DNAzymes)、有分子识别功能的适配体(Aptamer)、能基因调节的siRNA、有免疫激活能力的CpG寡核苷酸、pH驱动的C-G·C+或T-A·T三链体等各类功能性核酸(Functional nucleic acids,FNAs),可赋予水凝胶广泛的功能和特性[13-19]。DNA是一种带有大量负电荷的高分子聚合物,其碱基具有芳香环结构特征,同时DNA又可以用许多官能团进行修饰,如丙烯酸酯、氨基、羧基和硫醇等,这些独特的性质使得DNA可通过共价作用、静电、氢键、范德华力等与一些聚合物或是纳米材料结合,进一步拓展了DNA水凝胶的应用范围[20-22]。本文主要总结了近年来DNA水凝胶在制备方法及其实践应用方面的研究进展,并探讨了DNA水凝胶可能的未来研究方向和应用前景。
1 DNA水凝胶分类1.1 单组分DNA水凝胶将DNA作为水凝胶的唯一组分、骨架或交联剂,通过化学作用(由化学键作为交联点) 或物理作用(非共价作用如氢键、范德华力或DNA分子链间的缠绕作用等) 形成纯DNA水凝胶。目前,已发展了许多不同的交联方法来形成DNA水凝胶网络,包括:1) 构建分支DNA作为构建块,然后通过自组装或酶连接交联构建块[23-24];2) 借助聚合酶链式反应(Polymerase chain reaction,PCR)、杂交链式反应(Hybridization chain reaction,HCR)、滚环扩增技术(Rolling circle amplification,RCA) 等核酸扩增技术制备出具有三维网络结构的DNA水凝胶[25-28]。我们将在下文中详细介绍。
1.2 多组分DNA水凝胶为了进一步提高DNA水凝胶的机械性能和稳定性,改善其功能单一的局限性,开展多组分DNA水凝胶的研发是一个重要的研究方向,除了DNA外,聚合物(如聚丙烯酰胺[29]、壳聚糖[30]、多肽[31-32]、纤维素[33]) 以及纳米材料(如磁性纳米颗粒[34]、纳米金[35-36]、碳纳米管[37-38]、量子点[26]、膨润土[39]等) 皆可参与形成多组分DNA水凝胶。这些材料的参与在一定程度上提高了DNA水凝胶骨架的机械性能、粘弹性等物理性质,同时扩展了水凝胶的响应功能,包括了对磁、光、pH、温度和金属离子等多重刺激的响应[40-42],也可以在一定程度上缓解仅仅以DNA交联合成水凝胶带来的高成本问题,有助于功能核酸DNA水凝胶的大量制备。
2 DNA水凝胶制备方法2.1 利用DNA纳米结构单元目前已有的几种构成DNA水凝胶的单元有X-型、T-型或者Y-型形状的DNA纳米结构(图 1A)。Um等[43]于2006年首次报道了一种完全由支化DNA经酶(T4 DNA连接酶) 催化DNA单元通过磷酯键共价连接,制成DNA水凝胶的构建方法,由3种不同形状结构单元(X-型、T-型、Y-型) 分别组装形成的DNA水凝胶,均具有可降解性和良好的生物相容性。由DNA纳米单元构建的水凝胶,其孔径可以精确控制,与孔间距规则排列的X-DNA水凝胶相比,Y-DNA形成的凝胶和T-DNA形成的凝胶孔间距更随机。由于酶连接所需时间较长,研究人员进一步改进由DNA纳米结构单元形成水凝胶的过程,利用DNA本身具有的碱基间的互补配对作用制备了DNA物理水凝胶。如Xing等[44]在设计了含有3个“粘性末端”的Y-型构建单元同时引入一个两头含“粘性末端”的线性DNA双链作为“连接剂”,通过Y-型构建块与连接剂“粘性末端”之间的杂交形成水凝胶。制备的DNA水凝胶在没有任何化学处理的情况下迅速形成(1 min内) 且具有可逆热刺激响应和酶响应性(图 1B)。在后续的研究报道中,研究人员发现通过拉长和缩短DNA连接剂的长度或插入错配位点,水凝胶可以分别增强、软化甚至流化[18];通过在DNA结构单元的粘性末端序列或是连接剂中引入功能核酸序列,则可以制备刺激响应型DNA水凝胶[13, 45-46]。此外,DNA纳米单元在组织形成DNA水凝胶过程中的溶胶-凝胶转变的效率在成胶体系中基本保持稳定。
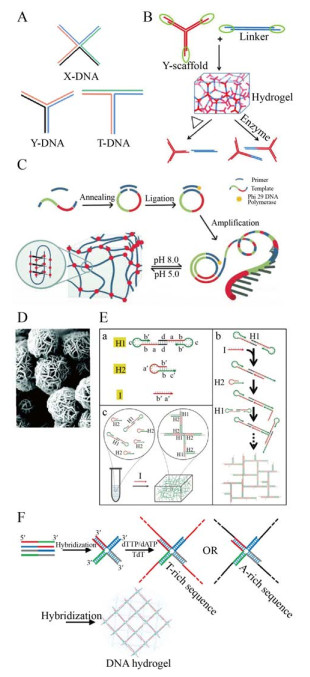 |
| 图 1 DNA水凝胶制备方法(A:三种常见制备水凝胶的DNA纳米结构单元;B:Y-型构建块与线性DNA双链通过粘性末端杂交形成具有可逆热刺激响应和酶响应性的DNA水凝胶[44];C:RCA技术形成含i-motif序列的DNA水凝胶示意图[47];D:纳米花结构[51];E:C-HCR制备DNA水凝胶的机理[54];F:TdT参与形成水凝胶[58]) Fig. 1 Preparation of DNA hydrogels. (A) Three common building units for DNA hydrogel preparation. (B) DNA hydrogels forming by the "sticky ends" of the building blocks (Y-scaffold and linker) respond to thermal stimulus and enzymes[44]. (C) The schematic mechanism of DNA hydrogel containing i-motif sequence by RCA[47]. (D) The DNA nanoflowers[51]. (E) Schematic diagram of DNA hydrogel designed by C-HCR[54]. (F) The formation mechanism of DNA hydrogel by TdT[58]. |
| 图选项 |
2.2 利用核酸扩增技术由于DNA构建块的形成需要大量化学合成的脱氧寡核苷酸(30–100 nt) 参与组成,其较高的制作成本在一定程度上限制了DNA水凝胶的实际应用。相比之下,核酸扩增技术以较低的错误率、较好的稳定性实现快速扩增,逐渐被应用于DNA水凝胶的制备。研究人员通过引入更多的恒温扩增方法,降低了扩增过程对变温仪器的依赖性。
2.2.1 滚环扩增技术滚环扩增是以环状单链DNA (Single-stranded DNA,ssDNA) 为模板,在等温(30 ℃) 条件下借助φ29 DNA聚合酶合成含有周期性重复序列的超长单链DNA分子,这些大分子量的线性DNA链通过物理纠缠搭建DNA水凝胶骨架。通过将各类功能核酸序列的互补序列设计入环状模板,可赋予RCA凝胶相应的功能。Xu等[47]根据i-motif形成序列在酸性条件下能够形成i-motif结构的性质,利用RCA技术扩增出含有i-motif形成序列的重复单元,通过形成分子间/分子内i-motif成功制备了pH刺激响应水凝胶(图 1C)。Huang等[48]则在RCA产物中引入分子间的G-四联体,交联形成水凝胶,同时G-四联体与血红素结合形成具有过氧化氢酶活性的DNA模拟酶。值得注意的是,RCA参与形成的DNA水凝胶在微观尺度上可以观察到大小均匀(直径约为2–3 μm)、由DNA和DNA聚合副产物焦磷酸镁(Mgppi) 自组装成的纳米花结构(图 1D),而这些纳米花结构在核酸酶、人血清、高温、尿素或稀释处理下,仍可保持其结构完整性[49-50]。研究人员也已证实,纳米花的大小和密度可以通过序列设计和控制酶的反应来完成[51-52]。
2.2.2 杂交链式反应杂交链式反应是一种无需酶参与的等温核酸扩增技术。当DNA发夹探针遇到引发DNA链时,由自由能驱动的两个亚稳态DNA发夹探针通过交替杂化的链式反应形成长线性DNA双链[53]。基于HCR产物的平均尺寸与引发剂浓度成反比关系的特性,对于HCR参与形成的DNA水凝胶可以通过设计DNA链序列、反应浓度等实现定量调控。Fan课题组[54]发展了一种新型的钳式杂交链式反应(Clamped hybridization chain reaction,C-HCR),其中一个DNA发夹探针是由两个相同的发夹结构通过其回文片段的杂交形成发夹二聚体(H1),可由两端向下游发生链的聚合,实现一维线性HCR产物向三维交联网络的转变(图 1E)。通过定点定时加入DNA引发链(I),非酶催化DNA杂交形成稳定的DNA水凝胶,实现在凝胶化过程中对空间和时间的精确控制。Li等[55]在钳式杂交链式反应的基础上,进一步赋予该凝胶化行为pH响应性。通过引入一段DNA,其在中性的条件下可与C-HCR反应的引发链杂交形成pH响应的分子开关,在酸性条件下该DNA形成C-G·C+三链结构而将C-HCR反应的引发链释放触发体系发生溶胶-凝胶转变。
2.2.3 末端脱氧核苷酸转移酶扩增末端脱氧核苷酸转移酶(Terminal deoxynucleotidyl transferase,TdT) 可在无模板的情况下,催化脱氧核苷酸个数大于3 nt的双链或单链DNA的3′-OH末端聚合脱氧核苷酸延伸DNA分子[56-57]。Xiang等[58]借助TdT扩增技术以单一碱基(dATP或dTTP) 延伸X-型DNA单元中3′羟基端以获得两种构建块(X-DNA-An和X-DNA-Tn),通过构建块的polyA尾和polyT尾互补杂交形成凝胶,TdT的参与减少了所需的原始DNA量,杂交介导的构建块交联使凝胶具有较高的机械强度(图 1F)。Gao等[59]利用TdT技术在四面体的顶点进行链的延伸,获得分别含有polyA和polyT的两种四面体,由TdT扩增产物通过Watson-Crick碱基配对原则交联,形成DNA水凝胶。
2.3 共价作用通过共价作用制备的多组分DNA水凝胶发展较早,主要是以DNA作为链支路修饰亲水性聚合物链,然后通过交联分支形成多组分的DNA水凝胶,又称DNA杂化水凝胶。1996年,Nagahara和Matsuda首次报道了DNA-聚合物杂化水凝胶[60];他们将两种丙烯酸酯修饰的ssDNA分别与丙烯酰胺单体共聚,从而将ssDNA结合到聚丙烯酰胺(Polyacrylamide,PAAm) 链中(DNA-PAA),如图 2A所示,一种是由poly T-衍生共聚物和poly A作为交联剂杂交形成的水凝胶;另一种是由poly T-衍生共聚物和poly A-衍生共聚物通过碱基互补配对原则杂交形成的水凝胶。通过使用类似的策略,研究人员将接枝在聚合物上的寡聚核酸序列替换为功能性核酸,通过环境刺激触发作为交联剂的核酸构象变化以获得不同功能的杂化水凝胶;亦可以利用聚合物本身的性质制备多功能的DNA杂化水凝胶,Li等[61]通过接枝在多肽上的线性DNA和线性DNA双链(连接剂) 的“粘性末端”杂交制备了一种超分子多肽DNA水凝胶,振荡剪切流变试验中该水凝胶的G′为(4 845.5±95.6) Pa (固定应变1%,频率为1 Hz,25 ℃),并且利用多肽骨架的二级结构对pH敏感的性质调节该水凝胶的力学性能。
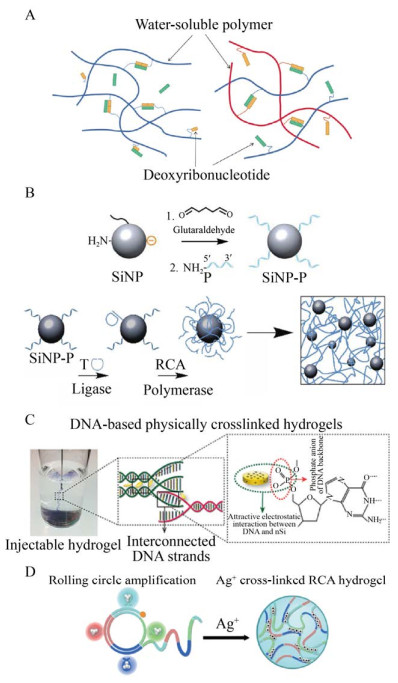 |
| 图 2 多组分DNA水凝胶的制备(A:寡核苷酸接枝在聚丙烯酰胺链上通过碱基互补配对形成水凝胶[60];B:DNA、二氧化硅纳米粒子作为多组分水凝胶的成分[62];C:二维硅酸盐纳米圆盘与DNA骨架通过静电相互作用产生物理交联[65];D:银纳米簇交联富胞嘧啶核酸序列制备DNA水凝胶[66]) Fig. 2 Preparation of multi-component DNA hydrogels. (A) Hydrogel formation via hybridization of oligonucleotides grafted in PAAm[60]. (B) DNA and SiNP worked as components of multi-component DNA hydrogel[62]. (C) two-dimensional silicate nanodisks produces physical cross-linking with DNA through electrostatic interaction[65]. (D) DNA hydrogel cross-linked at the cytosine-rich sequences through cytosine-Ag+-cytosine interactions[66]. |
| 图选项 |
纳米材料和DNA同样可以通过共价作用交联以制备多组分DNA水凝胶的制备。M. Niemeyer教授研究团队[62-63]将二氧化硅纳米粒子(Silica nanoparticles,SiNP) 与氨基烷基修饰的ssDNA引物通过戊二醛基交联偶联,得到引物修饰的SiNP-ssDNA,RCA技术进行DNA的扩增获得DNA、SiNP交织的多组分DNA水凝胶(图 2B)。Basu等[64]利用DNA核苷酸中的胺基可以和氧化海藻酸钠(Oxidized alginate,OA) 的醛基之间形成可逆的共价亚胺键,赋予了水凝胶自愈和剪切变薄的特性。
2.4 其他方法通过物理相互作用,如DNA纠缠或DNA与带正电荷材料之间的静电相互作用可以实现多组分DNA水凝胶的制备。如Paul课题组[65]利用二维硅酸盐纳米圆盘(Two-dimensional silicate nanodisks,nSi) 的各向异性电荷分布,与DNA骨架的静电相互作用创造额外的物理网络交联点,从而增强了水凝胶的机械弹性(图 2C)。Song等[35]通过静电作用将纳米金棒(AuNRs) 稳定地结合到由X-型DNA构建块组装形成的水凝胶孔隙中。
此外,金属离子在核酸的构象维持、生物合成、功能发挥及调控等方面发挥着重要作用,以金属配体配位的方式同样可以形成多组分DNA水凝胶,比较常见的例子是富含胸腺嘧啶(Thymine,T) 与胞嘧啶(Cytosine,C) 的长单链DNA分子,在Hg2+和Ag+的驱动下分别形成T-Hg2+-T以及C-Ag+-C的金属-碱基对,从而发生分子内折叠形成特殊结构。Li等使用RCA技术扩增出富含胞嘧啶的长单链DNA分子,通过银纳米簇和胞嘧啶的相互作用在富胞嘧啶序列上交联形成水凝胶(图 2D)[66]。
DNA水凝胶的机械性能可通过流变学测试进行表征,材料的储存模量(G′) 需要大于损失模量(G"),才能证明为真实凝胶。水凝胶的机械性能和内部结构密切相关,一般而言,交联点越密集,机械强度越强,双链结构的水凝胶比以单链为主的水凝胶具有更好的机械强度,通过比较上述方法制备的单组分DNA,我们发现双链为主的DNA水凝胶的G′通常在100 Pa左右,但是由于参与DNA纳米结构单元交联的交联剂(双链、基序等) 不同,会产生不同的交联密度,进而得到具有不同网络拓扑结构和孔径分布的水凝胶,使得由DNA单元构建的三维网络结构的G′可以达到1 000 Pa,甚至更高;而以C-HCR制备获得的水凝胶,由于样品中的DNA量和序列设计的不同,其机械强度的储存模量在100–3 000 Pa之间变化。以DNA单链为主的DNA水凝胶G′通常在100 Pa以下,具有更好的形状适应性,更适合于软机器人的构建,而DNA双链为主的DNA水凝胶因其刚性结构而在三维细胞培养及成像方面的研究较多。此外,DNA水凝胶与不同材料的共价作用或是其他作用(静电相互作用、金属配体配位作用) 形成的多组分DNA水凝胶的G′一般在1 000 Pa左右甚至更高,同时因为参与组分的不同,多组分DNA水凝胶会剪切变稀或变稠。
3 DNA水凝胶的应用DNA水凝胶提供的生物相容性平台在众多领域得以广泛应用。在此我们详细介绍近几年水凝胶在药物的负载与缓释、生物传感和细胞培养等领域的研究进展。
3.1 药物的负载与缓释DNA分子高度交联形成的水凝胶可作为药物递送载体,负载的药物可以通过化学附着或物理包裹结合到DNA水凝胶网络中,具体表现为:1) 药物接枝到DNA链上;2) 药物通过非共价键如静电相互作用、沟槽组合和嵌插结合与DNA交联。通过对凝胶网络施加物理、化学或生物的刺激可以实现负载药物的释放,DNA水凝胶也在控制和延长释放、局部给药、刺激开关释放等方面表现出了重要的优势;3) 水凝胶对药物直接包封实现药物的释放。
3.1.1 化疗药物的负载与释放近年来,智能药物输送系统(Smart drug delivery systems,DDSs) 可以增强抗癌药物的稳定性并减少癌症治疗的毒副作用,在癌症治疗领域备受关注。由于DNA的生物可降解性和生物相容性,DNA水凝胶作为智能药物负载载体应用于局部化疗展现出独特的优势。Zhang等[67]将药物喜树碱(Camptothecin,CPT) 接枝到硫代磷酸酯DNA的骨架上,DNA组装的两种Y-型构建块分层连接在一起,形成可注射的载药水凝胶(图 3A)。由于酶降解,水凝胶可以逐渐分解成纳米颗粒,进而渗透到残留的肿瘤组织中,并被细胞有效地吸收,实验表明该策略对残留肿瘤细胞具有较强的抗肿瘤作用,为预防肿瘤复发提供了新的途径。
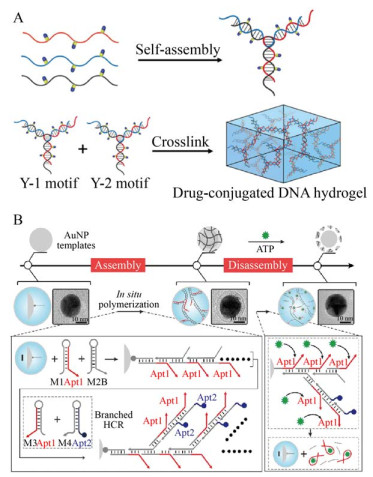 |
| 图 3 DNA水凝胶在药物的负载与缓释中的应用(A:喜树碱接枝到DNA链上制备载药水凝胶[67];B:ATP响应的负载多柔比星DNA水凝胶制备原理[70]) Fig. 3 Application of DNA hydrogels in drug loading and release. (A) Camptothecin (CPT) was grafted on backbones of the DNAs to form drug-containing hydrogels[67]. (B) Scheme illustration of preparation of ATP-responsive SNAgel loaded with Doxorubicin (Dox)[70]. |
| 图选项 |
通过引入功能核酸如适配体,可以实现靶向肿瘤细胞中精确的药物释放。多柔比星(Doxorubicin,Dox) 是一种广泛应用于多种癌症的化疗药物,可作为DNA插层药物,嵌入到DNA骨架的5′-GC-3′或者5′-CG-3′中进行富集,利用此性质许多研究团队将Dox与DNA水凝胶进行结合,设计了不同的DDSs系统[68-69]。Pei团队[70]基于前人细胞内ATP可以刺激触发DDSs系统中有效药物释放的相关研究,制备一个具有DNA toehold开关的球形核酸水凝胶(Switch-engineered spherical nucleic acid-templated hydrogel,SNAgel),对于ATP具有刺激响应性,实现抗癌药物Dox的释放。如图 3B所示,以纳米金(Gold nanoparticles,AuNPs) 为核心,引发DNA链(I) 通过Au-S键组装其上,形成多价SNA具有多个反应位点,后续引发HCR反应。设计了两种DNA发夹结构,分别含有两段适配体序列,Apt1为ATP特定的toehold反应开关,Apt2是可和特定肿瘤细胞过表达的PTK7结合的适配体。引发的HCR反应有两种,分别是线性HCR和支化HCR。具有线性结构的Au-I触发了带有M1Apt1和M2B的LP线性聚合得到聚合物。随后,M2B引发发夹M3Apt1和发夹M4Apt2参与的支化HCR得到SNAgel。Apt2d的存在使得SNAgel可以选择性地进入特定肿瘤细胞中。ATP特异性地与Apt1结合,使toehold开关结构变化破坏了DNA双链,最终导致SNAgel解离,实现预先嵌入的Dox迅速释放达到治疗浓度。此外该凝胶还可以通过适配体toehold的链长调控解组装速率,选择性结合肿瘤细胞,显著增强抗肿瘤治疗效果,同时降低毒副作用。Singh等[71]通过碳点连接富胞嘧啶(C) 的DNA,通过形成i-motif序列交联DNA,形成水凝胶,化疗药物可通过Dox嵌入DNA链或是和碳点的静电相互作用包封在多组分DNA水凝胶中。水凝胶在正常生理pH下可稳定一个月,在肿瘤酸性pH的微环境下Dox缓慢释放(10–11 d以上)。
Ren等[72]利用DNA水凝胶良好的生物相容性和生物降解性,将治疗过敏性结膜炎(Allergic conjunctivitis,AC) 相关抗炎化合物地塞米松(Dexamethasone,DEX) 与制备的多组分水凝胶(DNA/聚乳酸(PLGA) 水凝胶) 结合,DEX在水凝胶中有效积累,并介导了DEX在眼科细胞和组织中的逐渐释放,在水凝胶作用过程中两种AC动物模型眼部炎症症状明显减轻。
3.1.2 抑菌剂的负载与释放抗细菌剂(如抗生素、金属纳米粒子、抗菌聚合物和抗菌肽等) 可在较低的剂量下与水凝胶等纳米材料相结合形成局部抗菌材料,在一定程度上克服了病原微生物抗生素耐药性问题,并减少了其他不良副作用[73]。
水凝胶作为抑菌材料的抗菌谱一般取决于其所携带的抗菌成分。由于纳米粒子和其他抗菌成分的抑菌机制不同,所制备的水凝胶对各种细菌的抗菌性能不同。银以其良好的抗菌性能和相对较低的毒性而被广泛应用于抗微生物研究中。Geng等[74]将DNA水凝胶与银纳米团簇(Silver nanoclusters,AgNCs) 结合在一起,制备的混合RCA凝胶兼具了DNA和AgNCs的优点,包括荧光性、可注射性、生物相容性和抗菌性,并且该材料对革兰氏阴性菌(大肠杆菌Escherichia coli) 具有很高的抗菌活性,而对革兰氏阳性菌(金黄色葡萄球菌Staphylococcus aureus) 没有抑菌作用,由此推测AgNCs-DNA水凝胶的抗菌活性可能是因为其对细菌细胞壁造成损伤。Rachel Ee课题组[75]首次提出利用聚阴离子DNA纳米结构与阳离子抗菌肽(Antimicrobial peptides,AMPs) 之间的高结合亲和力静电相互作用来控制负载的阳离子肽从DNA水凝胶中释放到细菌病原体或伤口环境中。其中水凝胶网络是由Y-型构建块与线性DNA双链可以通过粘性末端之间的碱基互补形成,在凝胶化前将模型抗菌肽L12与预凝胶纳米结构混合,实现负载药物100%原位加载到凝胶基质中。杀伤效率法评价L12-DNA水凝胶对大肠杆菌、金黄色葡萄球菌抗菌活性表明,该水凝胶对金黄色葡萄球菌表现出良好的抗微生物活性,抑菌机理是利用致病性金黄色葡萄球菌感染分泌的内切酶快速水解切割纳米结构释放模型肽L12,实现在感染部位附近局部抑菌作用。Jiang等[76]利用DNA和绿色工业杀微生物剂四羟甲基硫酸磷(Tetrakis(hydroxymethyl)-phosphonium sulfate,THPS) 的分子间静电相互作用和氢键制备了THPS-DNA水凝胶,具有自愈、剪切变薄、可注射性以及广谱抗菌能力。其中水凝胶释放的带正电荷的THPS被静态吸附到带负电荷的细菌脂质膜上,破坏细菌细胞膜的完整性和通透性,最终导致膜的逐渐溶解和细胞死亡。此外,由于碳点(Carbon dot,CD) 在可见光照射下产生活性氧(Reactive oxygen species,ROS),可作为抑菌剂引入DNA水凝胶使水凝胶具有良好的抗菌活性。如Das课题组[38]分别将原卟啉Ⅸ (Protoporphyrin Ⅸ,PpⅨ)和碳点共价结合到富胞嘧啶的ssDNA的5′-磷酸末端。CD-DNA和PpⅨ-DNA结合物中形成i-motif结构,制备CD-DNA-PpⅨ多组分水凝胶,其中CD作为水凝胶中的交联剂以及能量供体,激发光敏剂(Photosensitizer,PS)、PpⅨ,通过CD的能量转移或用可见光直接照射PpⅨ,观察到杂化水凝胶中PpⅨ (受体) 激发后ROS产生,杀灭革兰氏阳性细菌S. aureus。Das课题组[77]又以DNA和聚乙烯基吡咯烷酮(Poly(vinylpyrrolidone),PVP) 同时结合到CD上,通过在中性到酸性pH的变化下DNA形成i-motif构象,并和PVP的非共价相互作用进一步交联,实现了抑菌多组分DNA水凝胶的制备,同时由于PVP材料的引入,水凝胶还被赋予了自愈和形状记忆特性。
3.2 生物传感随着DNA纳米技术的发展,基于DNA结构的生物传感系统同样引起了人们的关注,通过合理的序列设计,DNA水凝胶可响应特定环境因素的刺激,从而特异性识别目标物质,如生物活性物质、重金属和抗生素等。此外,DNA水凝胶可将传统的液相检测体系转入3D网络结构中,从而提高分析物的负载能力。
3.2.1 生物活性物质的检测酶催化所产生的信号指示被广泛地应用在生物传感器的构建上,具有高特异性、高选择性及高催化性能等优点。辣根过氧化物酶(Horseradish peroxidase,HRP) 是DNA水凝胶在生物传感领域应用较多的酶,HRP催化H2O2与2, 2′-氨基-二(3-乙基-苯并噻唑啉-6-磺酸(2, 2′-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid,ABTS) 生成的产物具有特征的绿色并在422 nm处有特征吸收。Song等[78]以精确修饰含生物素的双链DNA (Double-stranded DNA,dsDNA) 为构建支架,在链霉亲和素存在下形成包封有葡萄糖氧化酶(Glucose oxidase,GOx)、HRP、磁性纳米粒子的磁性DNA水凝胶,用于低浓度葡萄糖的检测。以葡萄糖为底物,葡萄糖可被GOx氧化,生成葡萄糖酸和H2O2,H2O2触发HRP酶活性,借助HRP反应产物的紫外吸收峰来监测葡萄糖浓度。葡萄糖浓度在6.0–135 μmol/L范围内,吸光度与葡萄糖浓度之间具有良好的线性关系,检测限为0.6 μmol/L。由于磁性纳米粒子的参与,该水凝胶可以实现反应介质的快速分离。Mao等[79]采用表面引物诱导策略合成了表面固定化纯DNA水凝胶,水凝胶能牢固地包封酶,包括HRP和胆红素氧化酶(Bilirubin oxidase,BOD),可以实现血清中H2O2和胆红素的比色及电化学检测。通过比色分析,血清中H2O2的检测限为22 nmol/L,电化学测定血清中H2O2的检测限为13 nmol/L;比色法检出胆红素的检测限为32 nmol/L,可用于黄疸诊断。
由于表面增强拉曼散射(Surface-enhanced Raman spectroscopy,SERS) 具有灵敏度高、谱带窄、重现性好、指纹信息丰富等优点,DNA水凝胶与SERS技术的结合用于检测生物活性物质的相关应用正逐渐兴起,研究较多的是检测肿瘤生物标志物如microRNA、糖蛋白等。利用水凝胶的三维结构,Chai课题组[80]在水凝胶形成之前分别加入拉曼报告分子甲苯胺蓝(Tb),使Tb包封在水凝胶的三维网络中,且该DNA-丙烯酰胺水凝胶可由目标miRNA打开,释放TB产生强拉曼信号;而没有目标miRNA时,TB由水凝胶包封远离SERS基底,DNA水凝胶呈现弱拉曼信号。由此构建了一种SERS生物传感器来灵敏地、选择性地定量检测micRNA155,线性范围为0.1 fmol/L至100 pmol/L,检出限为0.083 fmol/L。Wang等[81]将肝癌特异性标志物α-甲胎蛋白(α-fetoprotein,AFP) 适配体引入DNA水凝胶,利用DNA水凝胶的包封能力嵌入免疫球蛋白G (Immunoglobulin G,IgG),在AFP存在下,AFP-适配体特异性识别AFP,形成AFP-适配体复合物,从而导致水凝胶网状结构的解离和IgG的释放。释放的IgG被SERS探针和生物功能磁珠通过形成三明治状结构捕获,故而经磁选作用上清液的拉曼信号减弱,该方法AFP的检出限为50 pg/mL,检测线性范围为50 pg/mL至0.5 μg/mL。
3.2.2 重金属的检测重金属如汞、镉、铅、铬等进入人体后会抑制人体正常蛋白质的合成、破坏酶的代谢,对健康有着重大危害,然而进入人体的重金属的毒性往往需要较长时间的积累才会显示出来,重金属很难被早期检测。随着DNA中的金属-碱基配对的研究逐渐成熟,基于DNA技术的各类生物传感器在重金属检测和去除方面引起了人们的广泛关注[82-84]。胸腺嘧啶-Hg2+-胸腺嘧啶(T-Hg2+-T)结构的应用相对较多[84-86]。Shao等[87]开发了一种Hg2+响应的DNA水凝胶,当Hg2+存在时,由于T-Hg2+-T结构的形成触发了C-HCR扩增出的三维DNA纳米结构,产生的水凝胶能够在其网络中捕获AuNPs,作为生物传感器的视觉和定量读出,对Hg2+的检测可低至2.8 pmol/L。
功能核酸DNAzyme对特定的金属离子和共存的干扰金属离子具有很高的选择性。Wang课题组[88]将线性DNA聚丙烯酰胺共轭物与功能核酸DNAzyme结合,制备了铀酰离子(UO22+) 响应的DNA水凝胶,当UO22+存在时水凝胶内部的拉曼报告分子释放产生拉曼信号,可实现生物和环境样品中(鱼类和海带) UO22+的灵敏和选择性检测,线性范围从1 pmol/L到0.1 μmol/L,低检出限为0.838 pmol/L。近日,海南大学王宁教授等[89]将DNAzyme负责选择性与铀酰离子结合的单链DNA环化成环状,以此作为环状模板,通过滚环扩增技术合成DNA水凝胶,利用DNAzyme与铀酰中的铀原子形成5个配位键与铀酰结合的作用机理,实现6.06 mg/g的高铀吸附能力,比天然海水中铀对钒的选择性高18.95倍。
3.2.3 毒素的检测Tang等[90]以线性透明质酸接枝单链DNA复合物为骨架,黄曲霉毒素B1 (Aflatoxin B1,AFB1)适配体和聚乙烯亚胺为交联剂,构建了AFB1响应的双交联水凝胶,AFB1的存在可以与高亲和力的适配体结合,并导致适配体从水凝胶中释放。核酸外切酶Ⅰ (Exonuclease Ⅰ,EXO Ⅰ) 辅助靶向再循环放大策略,使得信号可由电子天平作为读出装置,AFB1在31.2 μg/kg到6.2 mg/kg有良好的线性范围,检出限为9.4 μg/kg。Hao等[14]基于适配体和RCA制备了一种DNA水凝胶型的荧光传感器,用于对赭曲霉毒素A (Ochratoxin A,OTA) 的灵敏检测,OTA在0.05–100 ng/mL范围有良好的线性关系,检测限为0.01 ng/mL。Sun等[91]报道了一种基于DNA水凝胶和刻蚀金纳米棒(AuNRs) 检测存在于小麦、玉米和燕麦等谷物中的各种镰刀菌产生的次级代谢物T-2毒素的方法。以T-2毒素适配体作为水凝胶的交联剂,在DNA水凝胶内包封HRP,T-2毒素存在时,其与适配体结合,会导致水凝胶塌陷并释放嵌入的HRP,催化H2O2与KI反应生成I2刻蚀AuNRs,刻蚀后的AuNRs紫外光谱蓝移,该方法检测限达0.87 pg/mL,检测范围在0.01–10 000 ng/mL之间。Wu等[92]借助适配体功能化的DNA水凝胶包封拉曼报告分子,检测微囊藻毒素-LR,其线性范围为4.0–10 000 ng/L,检测限为3.0 ng/L。
3.3 细胞培养DNA水凝胶可为活细胞的增殖和迁移提供弹性、温和的类细胞外基质(Extracellular matrix,ECM) 环境和条件,其3D网络孔隙结构可起到运输营养物质和排出细胞代谢废物的作用[93-94]。Zuo课题组[95]设计了一种适配体触发的C-HCR,以形成多孔DNA水凝胶用于进行CTC细胞的直接捕获与释放(图 4A)。其中,atcHCR引发链上的适配体序列可特异性识别CTC细胞表面的上皮细胞粘附分子(Epithelial cell adhesion molecule,EpCAM),引发链的分支迁移触发随后的atcHCR,共聚焦显微镜图像证明该方法制备的多孔DNA水凝胶可原位捕获活CTC细胞,且DNA水凝胶捕获的细胞损伤小,仍保持着良好的细胞活力。同时,水凝胶中设计有ATP响应的序列,当体系中含有ATP,可使水凝胶从细胞表面脱溶,细胞释放。Yao等[96]利用RCA技术扩增出含有多个干细胞的适配体序列的超长DNA链特异性锚定、捕获干细胞;通过链间的杂交互补配对形成三维DNA水凝胶网络完成了干细胞的包封,由于DNA网络在核酸酶作用下被降解,干细胞可控释放。与前二者设计的DNA水凝胶包裹整个细胞不同,Cao等[97]则构建了一个稳定三维细胞培养系统应用于细胞固定化和成像,通过在由Y-型构建块和线性DNA双链构成的DNA超分子水凝胶中,共价聚丙烯酰胺为第二网络(图 4B),与单组分水凝胶相比,双网络水凝胶在拉伸和剪切时表现出更好的力学性能,且细胞固定在其中的三维分布良好。
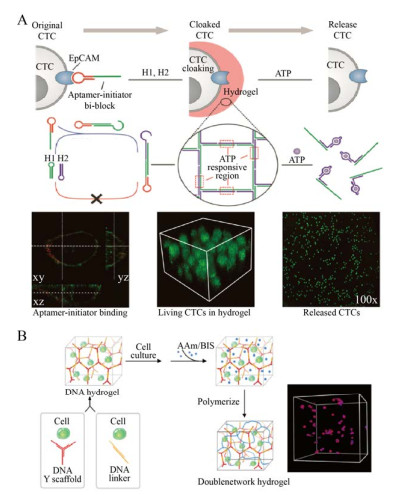 |
| 图 4 DNA水凝胶在细胞培养中的应用(A:基于适配体-Toehold的DNA水凝胶对细胞的识别、包封和释放的原理图和荧光成像[95];B:通过在DNA水凝胶中共价第二网络形成三维细胞培养系统[97]) Fig. 4 Application of DNA hydrogels in cell culture. (A) Schematic of DNA hydrogel with aptamer-toehold-based recognition, enwrapping and releasing of Cells and their fluorescence image[95]. (B) A three-dimensional cell culture system forming by covalent second network in DNA hydrogels[97]. |
| 图选项 |
3.4 其他应用DNA水凝胶在其他方面如无细胞蛋白质的生产、环境保护、机械传感等也体现了其独特的应用价值[98-99]。
研究人员发现DNA水凝胶可以作为一个无细胞的蛋白质生产平台(Cell-free protein-producing hydrogel,P-gel),区别于传统的蛋白质生产方法(从动物中提取或通过工程细菌表达和化学合成),避免了一些情况下蛋白质构象变化、对宿主细菌的生长抑制和生物活性降低等不足,并且有着更好的蛋白质产量。Park等[100-101]将X-DNA构建块与线性质粒通过T4 DNA连接酶的作用共价交联形成P-gel,该平台表达的蛋白质产率高达5 mg/mL,高于传统方法300倍,根据所需的蛋白质数量,合成过程在1–3 d,先后在P-gel中成功表达了包括膜和毒性蛋白等16种蛋白质。
除了检测环境污染物,如重金属和持久性有机污染物,或是通过负载生物活性分子对污染物进行转变和处理外,Wang等[102]基于DNA具有独特的物理和化学性质,包括遗传编码能力、低提取成本、水溶性、独特的酶反应性,将生物质(蓝绿藻、大肠杆菌、洋葱和鲑鱼睾丸) DNA的2-胺基与聚乙二醇二丙烯酸酯(Poly(ethylene glycol) diacrylate,PEGDA) 的碳碳双键通过aza-Michael加成形成氮碳键,交联在一起制备生物质DNA水凝胶,再通过不同的后处理(氨气处理、脱水)可实现大规模、低成本地应用于可降解和可再生薄膜、塑料的制造,以替代大部分石化产品来减少消耗。
Merindol等[103]利用DNA水凝胶的粘弹性、可修饰性等独特的性质,通过RCA技术和荧光共振能量转移(Fluorescence resonance energy transfer,FRET) 制备了机械荧光DNA水凝胶。将获得的机械荧光DNA水凝胶分别和纤维素(纸张)、聚苯乙烯(Polystyrene,PS) 微球做成复合材料,研究了它们拉伸及荧光性能;还将DNA水凝胶液氮冷冻,研究了冰晶的生长对水凝胶的影响。借助DNA水凝胶将力敏感响应过程可视化,揭示了微妙的力学行为和复杂的应变场。
江雷院士成功在DNA水凝胶空间负电荷的三维网络结构中控制离子电流和整流比阴阳离子传输的方向,提高了DNA离子传输能力[104],为DNA水凝胶在多功能纳米通道方面开拓应用方向,如水凝胶网络在微流体系统、传感器和海水淡化装置中的实际应用。
4 总结与展望通过引入功能核酸、纳米材料或是结合其他聚合物,使DNA水凝胶在本身具备高柔韧性、低毒性、生物相容性和生物降解性等一系列优良性能的基础上,展示了水凝胶的多元化应用潜力,如精确的分子识别能力、可预测的刺激响应、催化活性和治疗潜力。当然,在DNA水凝胶的制备过程中,由于组分类型、交联方式不同,水凝胶的理化参数包括机械强度、微观结构、含水量等都有着不同的变化,如DNA链的刚性或柔性对DNA水凝胶力学性能有一定的影响,以双链为主的DNA水凝胶(刚性) 比通过DNA链缠结形成的水凝胶(柔性) 具有更高的剪切储存模量,而由柔性链为主形成的水凝胶比刚性链为主的水凝胶具有更好的稳定性、延展性和弹性模量;笔者课题组发现不同的序列对形成的DNA水凝胶的致密程度有不同的影响。此外,水凝胶的微观形貌在一定程度上影响着物质在其中的装载率、包封效果、释放速率及生理环境的稳定性。
因此,DNA水凝胶在以下方面仍具有较大的研究空间。1) 水凝胶动力学的深度参与:目前DNA水凝胶的制备方法多是以获得功能性作为出发点,是较为定性的方式。水凝胶动力学的研究可以为水凝胶的优化及实际应用提供参考。如对溶胶-凝胶转换动力学、产生的转换力和转换可逆性的研究可以为形状记忆水凝胶的制备、水凝胶与生物活性物质结合后的可控释放等研究提供更好的理论基础。2) 理化参数的精确调控:目前来说,大多数DNA水凝胶材料若想要应用于生物医学材料领域,其机械性能还有待进一步提高,拉伸强度要求达到生物组织强度(10 MPa),而对于柔性电子器件、软体机器人等领域,需要较低的储能模量,对DNA水凝胶理化参数精确调控的研究可为实现其在应对不同功能时低、中、高强度状态之间转换提供参考。此外,通过在DNA水凝胶中引入自修复、可拉伸等一系列概念后,DNA水凝胶在重构、拉伸、位移等过程中原有功能的稳定性、耐久性是否会在几个驱动周期后下降的相关研究还较少,因此,DNA水凝胶在此类新型材料的研究中,理化参数的精确把握显得尤为重要。3) 成本控制与实际应用:目前研究论文中合成的DNA水凝胶普遍是以微升作为计量单位,如何推动DNA水凝胶从微量制备到宏量制备值得研究人员思考、探索。另外,利用诸多天然聚合物与DNA之间的相互作用,如壳聚糖与DNA之间的静电引力、海藻酸钠与DNA之间的醛胺缩合、β-葡聚糖与polyA之间的氢键相互作用等;利用羧甲基纤维素、丙烯酸酯等无毒无害的合成聚合物作为水凝胶骨架,接枝短DNA链产生交联,这些大分子材料生产工艺成熟,成本较低,可工业化大规模生产将它们与DNA材料整合,可能会成为制备低成本、高产量、多用途的DNA水凝胶的有效方法。
参考文献
| [1] | Seeman NC. Nucleic acid junctions and lattices. J Theor Biol, 1982, 99(2): 237-247. DOI:10.1016/0022-5193(82)90002-9 |
| [2] | Seeman NC. DNA nanotechnology: novel DNA constructions. Annu Rev Biophys Biomol Struct, 1998, 27: 225-248. DOI:10.1146/annurev.biophys.27.1.225 |
| [3] | Zhang SX, Chen C, Xue C, et al. Ribbon of DNA lattice on gold nanoparticles for selective drug delivery to cancer cells. Angew Chem Int Ed Engl, 2020, 59(34): 14584-14592. DOI:10.1002/anie.202005624 |
| [4] | Mela I, Vallejo-Ramirez PP, Makarchuk S, et al. DNA nanostructures for targeted antimicrobial delivery. Angew Chem Int Ed Engl, 2020, 132(31): 12798-12802. DOI:10.1002/ange.202002740 |
| [5] | Kwon PS, Ren SK, Kwon SJ, et al. Designer DNA architecture offers precise and multivalent spatial pattern-recognition for viral sensing and inhibition. Nat Chem, 2020, 12(1): 26-35. DOI:10.1038/s41557-019-0369-8 |
| [6] | Hamada S, Yancey KG, Pardo Y, et al. Dynamic DNA material with emergent locomotion behavior powered by artificial metabolism. Sci Robot, 2019, 4(29): eaaw3512. DOI:10.1126/scirobotics.aaw3512 |
| [7] | Zhang Q, Lin SY, Shi SR, et al. Anti-inflammatory and antioxidative effects of tetrahedral DNA nanostructures via the modulation of macrophage responses. ACS Appl Mater Interfaces, 2018, 10(4): 3421-3430. DOI:10.1021/acsami.7b17928 |
| [8] | Tian TR, Zhang T, Zhou TF, et al. Synthesis of an ethyleneimine/tetrahedral DNA nanostructure complex and its potential application as a multi-functional delivery vehicle. Nanoscale, 2017, 9(46): 18402-18412. DOI:10.1039/C7NR07130B |
| [9] | Zhang HL, Chao J, Pan D, et al. DNA origami-based shape IDs for single-molecule nanomechanical genotyping. Nat Commun, 2017, 8: 14738. DOI:10.1038/ncomms14738 |
| [10] | Ji XT, Wang ZB, Niu SY, et al. Non-template synthesis of porous carbon nanospheres coated with a DNA-cross-linked hydrogel for the simultaneous imaging of dual biomarkers in living cells. Chem Commun(Camb), 2020, 56(39): 5271-5274. DOI:10.1039/D0CC00499E |
| [11] | Shao Y, Sun ZY, Wang YJ, et al. Designable immune therapeutical vaccine system based on DNA supramolecular hydrogels. ACS Appl Mater Interfaces, 2018, 10(11): 9310-9314. DOI:10.1021/acsami.8b00312 |
| [12] | He MH, Nandu N, Uyar TB, et al. Small molecule-induced DNA hydrogel with encapsulation and release properties. Chem Commun (Camb), 2020, 56(53): 7313-7316. DOI:10.1039/D0CC03439H |
| [13] | Cheng EJ, Xing YZ, Chen P, et al. A pH-triggered, fast-responding DNA hydrogel. Angew Chem Int Ed Engl, 2009, 48(41): 7660-7663. DOI:10.1002/anie.200902538 |
| [14] | Hao LL, Wang W, Shen XQ, et al. A fluorescent DNA hydrogel aptasensor based on the self-assembly of rolling circle amplification products for sensitive detection of ochratoxin A. J Agric Food Chem, 2020, 68(1): 369-375. DOI:10.1021/acs.jafc.9b06021 |
| [15] | Guo WW, Lu CH, Orbach R, et al. pH-stimulated DNA hydrogels exhibiting shape-memory properties. Adv Mater, 2015, 27(1): 73-78. DOI:10.1002/adma.201403702 |
| [16] | Alford A, Tucker B, Kozlovskaya V, et al. Encapsulation and ultrasound-triggered release of G-quadruplex DNA in multilayer hydrogel microcapsules. Polymers (Basel), 2018, 10(12): 1342. DOI:10.3390/polym10121342 |
| [17] | Yan L, Zhu Z, Zou YA, et al. Target-responsive "sweet" hydrogel with glucometer readout for portable and quantitative detection of non-glucose targets. J Am Chem Soc, 2013, 135(10): 3748-3751. DOI:10.1021/ja3114714 |
| [18] | Simon AJ, Walls-Smith LT, Freddi MJ, et al. Simultaneous measurement of the dissolution kinetics of responsive DNA hydrogels at multiple length scales. ACS Nano, 2017, 11(1): 461-468. DOI:10.1021/acsnano.6b06414 |
| [19] | Lu SS, Wang S, Zhao JH, et al. A pH-controlled bidirectionally pure DNA hydrogel: reversible self-assembly and fluorescence monitoring. Chem Commun (Camb), 2018, 54(36): 4621-4624. DOI:10.1039/C8CC01603H |
| [20] | Finke A, Schneider AK, Spreng AS, et al. Functionalized DNA hydrogels produced by polymerase-catalyzed incorporation of non-natural nucleotides as a surface coating for cell culture applications. Adv Healthc Mater, 2019, 8(9): 1900080. DOI:10.1002/adhm.201900080 |
| [21] | Li J, Mo LT, Lu CH, et al. Functional nucleic acid-based hydrogels for bioanalytical and biomedical applications. Chem Soc Rev, 2016, 45(5): 1410-1431. DOI:10.1039/C5CS00586H |
| [22] | Zhang Z, Han JL, Pei YX, et al. Chaperone copolymer-assisted aptamer-patterned DNA hydrogels for triggering spatiotemporal release of protein. ACS Appl Bio Mater, 2018, 1(4): 1206-1214. DOI:10.1021/acsabm.8b00450 |
| [23] | Fernandez-Castanon J, Bianchi S, Saglimbeni F, et al. Microrheology of DNA hydrogel gelling and melting on cooling. Soft Matt, 2018, 14(31): 6431-6438. DOI:10.1039/C8SM00751A |
| [24] | Nishida Y, Ohtsuki S, Araie Y, et al. Self-assembling DNA hydrogel-based delivery of immunoinhibitory nucleic acids to immune cells. Nanomedicine, 2016, 12(1): 123-130. DOI:10.1016/j.nano.2015.08.004 |
| [25] | Eguchi Y, Kato T, Tanaka T, et al. A DNA-gold nanoparticle hybrid hydrogel network prepared by enzymatic reaction. Chem Commun, 2017, 53(43): 5802-5805. DOI:10.1039/C7CC02435E |
| [26] | Li CL, Li HK, Ge JJ, et al. Versatile fluorescence detection of microRNA based on novel DNA hydrogel-amplified signal probes coupled with DNA walker amplification. Chem Commun, 2019, 55(27): 3919-3922. DOI:10.1039/C9CC00565J |
| [27] | Yata T, Takahashi Y, Tan MM, et al. Efficient amplification of self-gelling polypod-like structured DNA by rolling circle amplification and enzymatic digestion. Sci Rep, 2015, 5: 14979. DOI:10.1038/srep14979 |
| [28] | Hartman MR, Yang DY, Tran TNN, et al. Thermostable branched DNA nanostructures as modular primers for polymerase chain reaction. Angew Chem Int Ed Engl, 2013, 52(33): 8699-8702. DOI:10.1002/anie.201302175 |
| [29] | Cangialosi A, Yoon C, Liu JY, et al. DNA sequence-directed shape change of photopatterned hydrogels via high-degree swelling. Science, 2017, 357(6356): 1126-1130. DOI:10.1126/science.aan3925 |
| [30] | Nomura D, Saito M, Takahashi Y, et al. Development of orally-deliverable DNA hydrogel by microemulsification and chitosan coating. Int J Pharm, 2018, 547(1/2): 556-562. |
| [31] | Li C, Faulkner-Jones A, Dun AR, et al. Rapid formation of a supramolecular polypeptide-DNA hydrogel for in situ three-dimensional multilayer bioprinting. Angew Chem Int Ed Engl, 2015, 54(13): 3957-3961. DOI:10.1002/anie.201411383 |
| [32] | Li C, Chen P, Shao Y, et al. A writable polypeptide-DNA hydrogel with rationally designed multi-modification sites. Small, 2015, 11(9/10): 1138-1143. |
| [33] | Wang C, Fadeev M, Zhang JJ, et al. Shape-memory and self-healing functions of DNA-based carboxymethyl cellulose hydrogels driven by chemical or light triggers. Chem Sci, 2018, 9(35): 7145-7152. DOI:10.1039/C8SC02411A |
| [34] | Ma XZ, Yang ZQ, Wang YJ, et al. Remote controlling DNA hydrogel by magnetic field. ACS Appl Mater Interfaces, 2017, 9(3): 1995-2000. DOI:10.1021/acsami.6b12327 |
| [35] | Song J, Im K, Hwang S, et al. DNA hydrogel delivery vehicle for light-triggered and synergistic cancer therapy. Nanoscale, 2015, 7(21): 9433-9437. DOI:10.1039/C5NR00858A |
| [36] | Yata T, Takahashi Y, Tan MM, et al. DNA nanotechnology-based composite-type gold nanoparticle-immunostimulatory DNA hydrogel for tumor photothermal immunotherapy. Biomaterials, 2017, 146: 136-145. DOI:10.1016/j.biomaterials.2017.09.014 |
| [37] | Hu Y, Rehnlund D, Klein E, et al. Cultivation of exoelectrogenic bacteria in conductive DNA nanocomposite hydrogels yields a programmable biohybrid materials system. ACS Appl Mater Interfaces, 2020, 12(13): 14806-14813. DOI:10.1021/acsami.9b22116 |
| [38] | Kumari S, Prasad SR, Mandal D, et al. Carbon dot-DNA-protoporphyrin hybrid hydrogel for sustained photoinduced antimicrobial activity. J Colloid Interface Sci, 2019, 553: 228-238. DOI:10.1016/j.jcis.2019.06.034 |
| [39] | Uzumcu AT, Guney O, Okay O. Highly stretchable DNA/clay hydrogels with self-healing ability. ACS Appl Mater Interfaces, 2018, 10(9): 8296-8306. DOI:10.1021/acsami.8b00168 |
| [40] | Tang JP, Yao C, Gu Z, et al. Super-soft and super-elastic DNA robot with magnetically driven navigational locomotion for cell delivery in confined space. Angew Chem Int Ed Engl, 2019, 59(6): 2490-2495. |
| [41] | Hu YW, Guo WW, Kahn JS, et al. A shape-memory DNA-based hydrogel exhibiting two internal memories. Angew Chem Int Ed Engl, 2016, 55(13): 4210-4214. DOI:10.1002/anie.201511201 |
| [42] | Kang HZ, Liu HP, Zhang XL, et al. Photoresponsive DNA-cross-linked hydrogels for controllable release and cancer therapy. Langmuir, 2011, 27(1): 399-408. DOI:10.1021/la1037553 |
| [43] | Um SH, Lee JB, Park N, et al. Enzyme-catalysed assembly of DNA hydrogel. Nat Mater, 2006, 5(10): 797-801. DOI:10.1038/nmat1741 |
| [44] | Xing YZ, Cheng EJ, Yang Y, et al. Self-assembled DNA hydrogels with designable thermal and enzymatic responsiveness. Adv Mater, 2011, 23(9): 1117-1121. DOI:10.1002/adma.201003343 |
| [45] | Zhou X, Li C, Shao Y, et al. Reversibly tuning the mechanical properties of a DNA hydrogel by a DNA nanomotor. Chem Commun (Camb), 2016, 52(70): 10668-10671. DOI:10.1039/C6CC04724F |
| [46] | Simon AJ, Walls-Smith LT, Plaxco KW. Exploiting the conformational-selection mechanism to control the response kinetics of a "smart" DNA hydrogel. Analyst, 2018, 143(11): 2531-2538. DOI:10.1039/C8AN00337H |
| [47] | Xu WL, Huang YS, Zhao HR, et al. DNA hydrogel with tunable pH-responsive properties produced by rolling circle amplification. Chemistry-A European Journal, 2017, 23(72): 18276-18281. DOI:10.1002/chem.201704390 |
| [48] | Huang YS, Xu WL, Liu GY, et al. A pure DNA hydrogel with stable catalytic ability produced by one-step rolling circle amplification. Chem Commun (Camb), 2017, 53(21): 3038-3041. DOI:10.1039/C7CC00636E |
| [49] | Zhu GZ, Hu R, Zhao ZL, et al. Noncanonical self-assembly of multifunctional DNA nanoflowers for biomedical applications. J Am Chem Soc, 2013, 135(44): 16438-16445. DOI:10.1021/ja406115e |
| [50] | Shopsowitz KE, Roh YH, Deng ZJ, et al. RNAi-microsponges form through self-assembly of the organic and inorganic products of transcription. Small, 2014, 10(8): 1623-1633. DOI:10.1002/smll.201302676 |
| [51] | Song H, Zhang YZ, Cheng P, et al. A rapidly self-assembling soft-brush DNA hydrogel based on RCA products. Chem Commun (Camb), 2019, 55(37): 5375-5378. DOI:10.1039/C9CC01022J |
| [52] | Lee JB, Peng SM, Yang DY, et al. A mechanical metamaterial made from a DNA hydrogel. Nat Nanotechnol, 2012, 7(12): 816-820. DOI:10.1038/nnano.2012.211 |
| [53] | Dirks RM, Pierce NA. Triggered amplification by hybridization chain reaction. Proc Natl Acad Sci USA, 2004, 101(43): 15275-15278. DOI:10.1073/pnas.0407024101 |
| [54] | Wang JB, Chao J, Liu HJ, et al. Clamped hybridization chain reactions for the self-assembly of patterned DNA hydrogels. Angew Chem Int Ed Engl, 2017, 56(8): 2171-2175. DOI:10.1002/anie.201610125 |
| [55] | Li YJ, Chen J, Dong YC, et al. Construction of pH-triggered DNA hydrogels based on hybridization chain reactions. Chem Res Chin Univ, 2020, 36(2): 243-246. DOI:10.1007/s40242-019-0034-1 |
| [56] | Motea EA, Berdis AJ. Terminal deoxynucleotidyl transferase: the story of a misguided DNA polymerase. Biochim Biophys Acta, 2010, 1804(5): 1151-1166. DOI:10.1016/j.bbapap.2009.06.030 |
| [57] | Fowler JD, Suo ZC. Biochemical, structural, and physiological characterization of terminal deoxynucleotidyl transferase. Chem Rev, 2006, 106(6): 2092-2110. DOI:10.1021/cr040445w |
| [58] | Xiang BB, He KY, Zhu R, et al. Self-assembled DNA hydrogel based on enzymatically polymerized DNA for protein encapsulation and enzyme/DNAzyme hybrid cascade reaction. ACS Appl Mater Interfaces, 2016, 8(35): 22801-22807. DOI:10.1021/acsami.6b03572 |
| [59] | Gao X, Li XY, Sun XZ, et al. DNA tetrahedra-cross-linked hydrogel functionalized paper for onsite analysis of DNA methyltransferase activity using a personal glucose meter. Anal Chem, 2020, 92(6): 4592-4599. DOI:10.1021/acs.analchem.0c00018 |
| [60] | Nagahara SJ, Matsuda T. Hydrogel formation via hybridization of oligonucleotides derivatized in water-soluble vinyl polymers. Polymer Gels Networks, 1996, 4(2): 111-127. DOI:10.1016/0966-7822(96)00001-9 |
| [61] | Li C, Zhou X, Shao Y, et al. A supramolecular hydrogel with identical cross-linking point density but distinctive rheological properties. Mater Chem Front, 2017, 1(4): 654-659. DOI:10.1039/C6QM00176A |
| [62] | Hu Y, Dominguez CM, Bauer J, et al. Carbon-nanotube reinforcement of DNA-silica nanocomposites yields programmable and cell-instructive biocoatings. Nat Commun, 2019, 10: 5522. DOI:10.1038/s41467-019-13381-1 |
| [63] | Hu Y, Niemeyer CM. Designer DNA-silica/carbon nanotube nanocomposites for traceable and targeted drug delivery. J Mater Chem B, 2020, 8(11): 2250-2255. DOI:10.1039/C9TB02861G |
| [64] | Basu S, Pacelli S, Paul A. Self-healing DNA-based injectable hydrogels with reversible covalent linkages for controlled drug delivery. Acta Biomater, 2020, 105: 159-169. DOI:10.1016/j.actbio.2020.01.021 |
| [65] | Basu S, Pacelli S, Feng Y, et al. Harnessing the noncovalent interactions of DNA backbone with 2D silicate nanodisks to fabricate injectable therapeutic hydrogels. ACS Nano, 2018, 12(10): 9866-9880. DOI:10.1021/acsnano.8b02434 |
| [66] | Li J, Yu JT, Huang YS, et al. Highly stable and multiemissive silver nanoclusters synthesized in situ in a DNA hydrogel and their application for hydroxyl radical sensing. ACS Appl Mater Interfaces, 2018, 10(31): 26075-26083. DOI:10.1021/acsami.8b09152 |
| [67] | Zhang J, Guo YY, Pan GF, et al. Injectable drug-conjugated DNA hydrogel for local chemotherapy to prevent tumor recurrence. ACS Appl Mater Interfaces, 2020, 12(19): 21441-21449. DOI:10.1021/acsami.0c03360 |
| [68] | Nishikawa M, Mizuno Y, Mohri K, et al. Biodegradable CpG DNA hydrogels for sustained delivery of doxorubicin and immunostimulatory signals in tumor-bearing mice. Biomaterials, 2011, 32(2): 488-494. DOI:10.1016/j.biomaterials.2010.09.013 |
| [69] | Bi S, Xiu B, Ye JY, et al. Target-catalyzed DNA four-way junctions for CRET imaging of microRNA, concatenated logic operations, and self-assembly of DNA nanohydrogels for targeted drug delivery. ACS Appl Mater Interfaces, 2015, 7(41): 23310-23319. DOI:10.1021/acsami.5b07827 |
| [70] | Xiao MS, Lai W, Wang F, et al. Programming drug delivery kinetics for active burst release with DNA toehold switches. J Am Cheml Soc, 2019, 141(51): 20354-20364. DOI:10.1021/jacs.9b10765 |
| [71] | Singh S, Mishra A, Kumari R, et al. Carbon dots assisted formation of DNA hydrogel for sustained release of drug. Carbon, 2017, 114: 169-176. DOI:10.1016/j.carbon.2016.12.020 |
| [72] | Ren N, Sun R, Xia K, et al. DNA-based hybrid hydrogels sustain water-insoluble ophthalmic therapeutic delivery against allergic conjunctivitis. ACS Appl Mater Interfaces, 2019, 11(30): 26704-26710. DOI:10.1021/acsami.9b08652 |
| [73] | Yang KR, Han Q, Chen B, et al. Antimicrobial hydrogels: promising materials for medical application. Int J Nanomed, 2018, 13: 2217-2263. DOI:10.2147/IJN.S154748 |
| [74] | Geng JH, Yao C, Kou XH, et al. A fluorescent biofunctional DNA hydrogel prepared by enzymatic polymerization. Adv Healthc Mater, 2018, 7(5): 1700998. DOI:10.1002/adhm.201700998 |
| [75] | Obuobi S, Tay HKL, Tram NDT, et al. Facile and efficient encapsulation of antimicrobial peptides via crosslinked DNA nanostructures and their application in wound therapy. J Control Release, 2019, 313: 120-130. DOI:10.1016/j.jconrel.2019.10.013 |
| [76] | Jiang XX, Li M, Gao XX, et al. Self-assembled DNA-THPS hydrogel as a topical antibacterial agent for wound healing. ACS Appl Bio Mater, 2019, 2(3): 1262-1269. DOI:10.1021/acsabm.8b00818 |
| [77] | Nayak S, Prasad SR, Mandal D, et al. Hybrid DNA-carbon dot-poly (vinylpyrrolidone) hydrogel with self-healing and shape memory properties for simultaneous trackable drug delivery and visible-light-induced antimicrobial photodynamic inactivation. ACS Appl Bio Mater, 2020, 3(11): 7865-7875. DOI:10.1021/acsabm.0c01022 |
| [78] | Song JY, He WT, Shen H, et al. Self-assembly of a magnetic DNA hydrogel as a new biomaterial for enzyme encapsulation with enhanced activity and stability. Chem Commun (Camb), 2019, 55(17): 2449-2452. DOI:10.1039/C8CC09717H |
| [79] | Mao XX, Chen GF, Wang ZH, et al. Surface-immobilized and self-shaped DNA hydrogels and their application in biosensing. Chem Sci, 2018, 9(4): 811-818. DOI:10.1039/C7SC03716C |
| [80] | He Y, Yang X, Yuan R, et al. Switchable target-responsive 3D DNA hydrogels as a signal amplification strategy combining with SERS technique for ultrasensitive detection of miRNA 155. Anal Chem, 2017, 89(16): 8538-8544. DOI:10.1021/acs.analchem.7b02321 |
| [81] | Wang Q, Hu YJ, Jiang NJ, et al. Preparation of aptamer responsive DNA functionalized hydrogels for the sensitive detection of α-fetoprotein using SERS method. Bioconjugate Chem, 2020, 31(3): 813-820. DOI:10.1021/acs.bioconjchem.9b00874 |
| [82] | Zhou WH, Saran R, Liu JW. Metal sensing by DNA. Chem Rev, 2017, 117(12): 8272-8325. DOI:10.1021/acs.chemrev.7b00063 |
| [83] | Kondo J, Yamada T, Hirose C, et al. Crystal structure of metallo DNA duplex containing consecutive Watson-Crick-like T-HgⅡ-T base pairs. Angew Chem Int Ed Engl, 2014, 53(9): 2385-2388. DOI:10.1002/anie.201309066 |
| [84] | Helwa Y, Dave N, Froidevaux R, et al. Aptamer-functionalized hydrogel microparticles for fast visual detection of mercury (Ⅱ) and adenosine. ACS Appl Mater Interfaces, 2012, 4(4): 2228-2233. DOI:10.1021/am300241j |
| [85] | Wang Q, Yang XH, Yang XH, et al. An enzyme-free colorimetric assay using hybridization chain reaction amplification and split aptamers. Analyst, 2015, 140(22): 7657-7662. DOI:10.1039/C5AN01592H |
| [86] | Gao F, Zhang TS, Chu YR, et al. Ultrasensitive impedimetric mercury (Ⅱ) sensor based on thymine-Hg(Ⅱ)-thymine interaction and subsequent disintegration of multiple sandwich-structured DNA chains. Microchim Acta, 2018, 185(12): 555-563. DOI:10.1007/s00604-018-3097-7 |
| [87] | Shao XL, Feng YX, Zhu LJ, et al. Three dimensional DNA nanotracks: a novel method for ultrasensitive and visible mercury (Ⅱ) detection. Sens Actuat B Chem, 2020, 303: 126988. DOI:10.1016/j.snb.2019.126988 |
| [88] | He X, Zhou X, Liu W, et al. Flexible DNA hydrogel SERS active biofilms for conformal ultrasensitive detection of uranyl ions from aquatic products. Langmuir, 2020, 36(11): 2930-2936. DOI:10.1021/acs.langmuir.9b03845 |
| [89] | Yuan YH, Liu TT, Xiao JX, et al. DNA nano-pocket for ultra-selective uranyl extraction from seawater. Nat Commun, 2020, 11: 5708. DOI:10.1038/s41467-020-19419-z |
| [90] | Tang LY, Huang YY, Lin CY, et al. Highly sensitive and selective aflatoxin B1 biosensor based on Exonuclease Ⅰ-catalyzed target recycling amplification and targeted response aptamer-crosslinked hydrogel using electronic balances as a readout. Talanta, 2020, 214: 120862. DOI:10.1016/j.talanta.2020.120862 |
| [91] | Sun YF, Li S, Chen RP, et al. Ultrasensitive and rapid detection of T-2 toxin using a target-responsive DNA hydrogel. Sens Actuat B: Chem, 2020, 311: 127912. DOI:10.1016/j.snb.2020.127912 |
| [92] | Wu P, Li S, Ye XS, et al. Cu/Au/Pt trimetallic nanoparticles coated with DNA hydrogel as target-responsive and signal-amplification material for sensitive detection of microcystin-LR. Anal Chim Acta, 2020, 1134: 96-105. DOI:10.1016/j.aca.2020.08.004 |
| [93] | Wang YJ, Shao Y, Ma XZ, et al. Constructing tissuelike complex structures using cell-laden DNA hydrogel bricks. ACS Appl Mater Interfaces, 2017, 9(14): 12311-12315. DOI:10.1021/acsami.7b01604 |
| [94] | Jin J, Xing YZ, Xi YL, et al. A triggered DNA hydrogel cover to envelop and release single cells. Adv Mater, 2013, 25(34): 4714-4717. DOI:10.1002/adma.201301175 |
| [95] | Song P, Ye DK, Zuo XL, et al. DNA hydrogel with aptamer-toehold-based recognition, cloaking, and decloaking of circulating tumor cells for live cell analysis. Nano Lett, 2017, 17(9): 5193-5198. DOI:10.1021/acs.nanolett.7b01006 |
| [96] | Yao C, Tang H, Wu WJ, et al. Double rolling circle amplification generates physically cross-linked DNA network for stem cell fishing. J Am Chem Soc, 2020, 142(7): 3422-3429. DOI:10.1021/jacs.9b11001 |
| [97] | Cao TY, Jia HY, Dong YC, et al. In situ formation of covalent second network in a DNA supramolecular hydrogel and its application for 3D cell imaging. ACS Appl Mater Interfaces, 2020, 12(4): 4185-4192. DOI:10.1021/acsami.9b11534 |
| [98] | Kahn JS, Ruiz RCH, Sureka S, et al. DNA microgels as a platform for cell-free protein expression and display. Biomacromolecules, 2016, 17(6): 2019-2026. DOI:10.1021/acs.biomac.6b00183 |
| [99] | Wang YR, Zhu Y, Hu Y, et al. How to construct DNA hydrogels for environmental applications: advanced water treatment and environmental analysis. Small, 2018, 14(17): 1703305. DOI:10.1002/smll.201703305 |
| [100] | Park N, Um SH, Funabashi H, et al. A cell-free protein-producing gel. Nat Mater, 2009, 8(5): 432-437. DOI:10.1038/nmat2419 |
| [101] | Park N, Kahn JS, Rice EJ, et al. High-yield cell-free protein production from P-gel. Nat Protoc, 2009, 4(12): 1759-1770. DOI:10.1038/nprot.2009.174 |
| [102] | Wang D, Cui JH, Gan MZ, et al. Transformation of biomass DNA into biodegradable materials from gels to plastics for reducing petrochemical consumption. J Am Chem Soc, 2020, 142(22): 10114-10124. DOI:10.1021/jacs.0c02438 |
| [103] | Merindol R, Delechiave G, Heinen L, et al. Modular design of programmable mechanofluorescent DNA hydrogels. Nat Commun, 2019, 10: 528. DOI:10.1038/s41467-019-08428-2 |
| [104] | Wu YF, Wang DY, Willner I, et al. Smart DNA hydrogel integrated nanochannels with high ion flux and adjustable selective ionic transport. Angew Chem Int Ed Engl, 2018, 57(26): 7790-7794. DOI:10.1002/anie.201803222 |
