

1. 湖北工业大学 发酵工程教育部重点实验室/细胞调控与分子药物“111”引智基地,湖北 武汉 430068;
2. 三峡大学 医学院 肿瘤微环境与免疫治疗湖北省重点实验室,湖北 宜昌 443002
收稿日期:2020-09-08;接收日期:2020-11-03
基金项目:国家自然科学基金(Nos. 31670768, 31971150),湖北省****基金(No. 2019CFA069),武汉市基础前沿研究项目(No. 2018060401011319) 资助
摘要:鸟氨酸脱羧酶(Ornithine decarboxylase,ODC) 是多胺生物合成途径中的关键酶,其主要功能是催化鸟氨酸脱羧生成腐胺。在多种疾病和肿瘤细胞中,ODC的表达水平和催化活性都高于正常细胞,因此抑制ODC的活性是相关疾病预防和治疗的一个潜在途径。ODC抑制剂的发现和检验依赖于对其催化反应进程的监测,常采用的途径包括利用高效液相色谱法检测腐胺产量和利用同位素标记法检测二氧化碳的产量等。这些检测方法的繁琐操作和成本极大地限制了其应用,尤为突出的问题是这些方法很难实现高通量检测和实时检测。文中研究了基于大环分子葫芦[6]脲(Cucurbit[6]uril,CB6) 与荧光染料DSMI (Trans-4-[4-(dimethylamino)styryl]-1-methylpyridinium iodide) 的ODC酶活实时无标记检测法,系统分析了其应用范围和局限性,并对其进行了优化。最后,利用优化后的方法实现了对不同机制ODC抑制剂的活性评价。
关键词:鸟氨酸脱羧酶抑制剂实时无标记酶活检测
Optimization of a cucurbit[6]uril-based real-time label-free method for analyzing the activity of ornithine decarboxylase
Jing Wang1,2, Xiangchen Liu1, Hongyan Ma1,2, Qiang Chen1, Sen Liu1,2


1. Key Laboratory of Fermentation Engineering (Ministry of Education) & National "111" Center for Cellular Regulation and Molecular Pharmaceutics, Hubei University of Technology, Wuhan 430068, Hubei, China;
2. Key Laboratory of Tumor Microenvironment and Immunotherapy, Medicsl School of China Three Gorges University, Yichang 443002, Hubei, China
Received: September 8, 2020; Accepted: November 3, 2020
Supported by: National Natural Science Foundation of China (Nos. 31670768, 31971150), Hubei Outstanding Youth Foundation of China (No. 2019CFA069), Wuhan Science and Technology Bureau of China (No. 2018060401011319)
Corresponding author: Sen Liu. Tel: +86-27-59590100; E-mail: senliu.ctgu@gmail.com.
Abstract: Ornithine decarboxylase (ODC) is a key enzyme in the biosynthetic pathway of polyamines and catalyzes the decarboxylation of ornithine to produce putrescine. Inhibition of ODC activity is a potential approach for the prevention and treatment of many diseases including cancer, as the expression levels and the activities of ODC in many abnormal cells and tumor cells are generally higher than those of normal cells. The discovery and evaluation of ODC inhibitors rely on the monitoring of the reaction processes catalyzed by ODC. There are several commonly used methods for analyzing the activity of ODC, such as measuring the yield of putrescine by high performance liquid chromatography, or quantifying the yield of isotope labelled carbon dioxide. However, the cumbersome operation and cost of these assays, as well as the difficulty to achieve high-throughput and real-time detection, hampered their applications. In this work, we optimized a real-time label-free method for analyzing the activity of ODC based on the macromolecule cucurbit[6]uril (CB6) and a fluorescent dye, DSMI (trans-4-[4-(dimethylamino) styryl]-1-methylpyridinium iodide). Finally, the optimized method was used to determine the activities of different ODC inhibitors with different inhibition mechanisms.
Keywords: ornithine decarboxylaseinhibitorreal-timelabel-freeenzyme activity analysis
多胺(主要指腐胺、精脒和精胺) 是一类在几乎所有细胞中都存在的天然有机小分子,它们对细胞的正常生长至关重要,在细胞发育、蛋白质合成与功能、DNA氧化性损伤、细胞增殖和分化等[1-4]多种细胞活动中发挥功能。在细胞内,生物合成、分解代谢和跨膜运输三者协同作用,维持胞内多胺浓度的稳定,从而保障细胞的正常功能[5]。研究发现,多胺生物合成速率的上升和细胞内多胺浓度的增加在多种肿瘤细胞中都有出现,因此多胺生物合成途径是肿瘤治疗的潜在靶标[6-8]。鸟氨酸脱羧酶(Ornithine decarboxylase,ODC) 是一种磷酸吡哆醛(Pyridoxal 5′-phosphate,PLP) 依赖性酶,它催化鸟氨酸脱羧成腐胺,后者为精脒和精胺的合成提供原料[9]。ODC是多胺生物合成途径的第一个限速酶,其活性与多种组织中DNA合成和细胞增殖的速率呈正相关[10]。因此,ODC被认为是治疗多种癌症的潜在靶点,而ODC抑制剂的发现也成为研究热点。α-二氟甲基鸟氨酸(α-difluoromethylornithine,DFMO) 是ODC的不可逆自杀性抑制剂,该化合物被催化脱羧并与ODC形成不可逆共价结合,从而抑制ODC活性[11]。磷酸吡啶氧基-鸟氨酸(N-(4′-pyridoxyl)- ornithine (BOC)-OMe,POB) 是ODC的共价辅酶-底物加合物,是一种基于过渡态原理发现的ODC非共价抑制剂[12]。多年的研究[11-12]发现,虽然DFMO和POB抑制ODC活性的机制不同,但是两者在体外和细胞水平都能显著抑制ODC的活性。遗憾的是,DFMO和POB迄今都还没有在肿瘤的临床治疗上得到应用,因此新的ODC抑制剂的发现将具有重要潜在价值。
为了筛选、比较和评价ODC抑制剂,建立方便、有效的ODC酶活检测方法具有重要意义。目前,较常用于ODC酶活检测的方法有同位素标记法[13]、分光光度检测法[14]、高效液相色谱法[15]等,其原理都是通过检测产物的生成量来反映ODC的活性。然而,同位素标记法和高效液相色谱法的样品制备烦琐、成本较高,而分光光度法的灵敏度较低,这些缺点限制了这些方法的应用范围。更为重要的是,这些方法都很难实现对反应进程的实时监测,也很难应用于抑制剂的高通量筛选。近年来,Nilam等[16]运用超分子偶联酶法[17]建立了一种ODC酶活性的无标记连续荧光检测法,该方法利用大环受体葫芦[6]脲(Cucurbit[6]uril,CB6) 和荧光染料DSMI (Trans-4-[4-(dimethylamino) styryl]-1-methylpyridinium iodide) 组成的报告对进行实时检测。适量的DSMI可与CB6结合产生荧光信号。在反应过程中,ODC酶促反应的产物腐胺与CB6有更高的亲和力,因此其竞争性置换与CB6结合的DSMI,引起荧光信号降低。这种方法提供了一种简单、廉价、灵敏且无标记的方法来实时监测ODC的酶促反应,可能具有更为广泛的应用前景。
为了探讨Nilam等[16]的方法(本文简称为ODC-CB6法) 在ODC抑制剂发现与评价中的应用价值,我们在本研究中对该检测方法进行了系统分析,发现该方法虽然能够检测DFMO的抑制能力,但并不能检测POB的抑制效果。因此,我们对ODC-CB6法进行了条件优化,建立了具有更广泛适用范围的改进方法(简称为ODC-CB6-opt法)。最后,利用ODC-CB6-opt法定量分析了我们近期发现的一种新型ODC多功能抑制剂的抑制效果。本研究建立的ODC-CB6-opt法将对ODC抑制剂的筛选和评价具有重要价值。
1 材料与方法1.1 材料与试剂三羟甲基氨基甲烷(Tris)、异丙基硫代半乳糖苷(IPTG)、4-羟乙基哌嗪乙磺酸(HEPES)、十二烷基硫酸钠(SDS)、甘氨酸(广州赛国生物科技有限公司);DSMI、CB6、腐胺、二硫苏糖醇(DTT) (美国Sigma公司);L-鸟氨酸、磷酸吡哆醛(PLP)、Bradford法蛋白质定量检测试剂盒(生工生物工程(上海) 股份有限公司);乙二胺四乙酸(EDTA)、吐温-80、Na2HPO4·12H2O、NaCl (中国国药集团化学试剂有限公司);DFMO (美国MCE公司);POB (德国MERCK公司);黑色96孔板(德国Greiner Bio-One公司);透明96孔板(3599) (美国Corning公司);Ni-NTA琼脂糖树脂(生工生物工程(上海) 股份有限公司);咪唑(中国上海阿拉丁生化科技股份有限公司);SDS-PAGE凝胶快速制备试剂盒(中国上海雅酶生物科技有限公司);5×SDS-PAGE上样缓冲液(中国上海碧云天生物技术有限公司)。
1.2 仪器与设备PHS-2C精密pH计(中国上海司乐仪器有限公司);电热恒温培养箱(DH3600B Ⅱ型) (天津市泰斯特仪器有限公司);Synergy H1多功能荧光酶标仪(美国BioTek公司);电子天平(XB 220A) (瑞士Precisa公司);高压均质细胞破碎仪(AH-1500) (中国苏州安拓思纳米技术有限公司);Sephacryl S-200 HR层析柱(美国GE公司)。
1.3 实验方法1.3.1 溶液配制配制10 mmol/L Tris-HCl (pH 7.5) 的缓冲溶液;用10 mmol/L Tris-HCl配制260 μmol/L DSMI、130 μmol/L CB6、1 mmol/L PLP;临用前用10 mmol/L Tris-HCl配制含1 mmol/L EDTA、25 mmol/L DTT、1 mmol/L PLP、1%吐温-80的ODC-PLP储备液以及含1 mmol/L EDTA、25 mmol/L DTT、1%吐温-80的ODC储备液;用10 mmol/L Tris-HCl配制不同浓度的L-鸟氨酸和腐胺标准品。
1.3.2 光谱检测使用多功能荧光酶标仪和透明96孔板在460 nm处检测DSMI (10 μmol/L) 中加入CB6 (0–6 μmol/L) 的吸光度值;使用多功能荧光酶标仪和黑色96孔板进行CB6与DSMI的结合荧光测定和之后的酶促反应连续监测,检测荧光强度时,使用的滤光片组为激发485/20 nm、发射528/20 nm。
1.3.3 结合测定DSMI (3 μmol/L) 中加入CB6 (0–1 μmol/L)检测其荧光强度;L-鸟氨酸(0–10 mmol/L) 或腐胺(0–1 μmol/L) 加入到含CB6 (0.5 μmol/L) 和DSMI (3 μmol/L) 的体系中检测其竞争性荧光强度;检测体系为10 mmol/L Tris-HCl (pH7.5) 的缓冲溶液,检测(λexc=460nm,λem=590 nm) 时的荧光强度。
1.3.4 ODC蛋白的表达与纯化将人野生型ODC序列克隆到pET28a载体中,获得pET28a-hODC的质粒,然后将质粒转化到大肠杆菌Escherichia coli BL21中。在28 ℃条件下,用0.5 mmol/L异丙基硫代半乳糖苷(IPTG) 诱导蛋白过表达6 h后收集得到菌泥,并将菌泥用含有20 mmol/L咪唑、20 mmol/L Na2HPO4和500 mmol/L NaCl (pH 7.6) 的缓冲液重悬后经高压均质细胞破碎仪破碎得到粗提取物,高速离心得蛋白裂解液上清。将蛋白裂解液上清上样至含有Ni-NTA琼脂糖树脂填料的重力柱,使用含有20 mmol/L咪唑、20 mmol/L Na2HPO4和500 mmol/L NaCl (pH 7.6) 的缓冲液冲洗重力柱以除去杂蛋白。然后用含有不同浓度咪唑(50、100、150、250、350、500 mmol/L)、20 mmol/L Na2HPO4和500 mmol/L NaCl (pH 7.6) 的缓冲液进行梯度洗脱,于50 mmol/L和100 mmol/L咪唑浓度时得到目的蛋白。接着将所得目的蛋白使用含有0.1 mmol/L EDTA、20 mmol/L NaCl和10 mmol/L HEPES (pH 7.5) 的缓冲液在Sephacryl S-200 HR层析柱中进行进一步纯化,得到高纯度的目的蛋白。最后用Bradford方法测定目的蛋白浓度,用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE) 分析目的蛋白纯度。
1.3.5 酶促反应连续监测ODC-CB6法:将234 μL含有3 μmol/L DSMI、0.5 μmol/L CB6、10 mmol/L Tris-HCl (pH 7.5) 的溶液加入黑色96孔板的孔中并在37 ℃条件下平衡10 min,然后加入24 μL含有EDTA、DTT、PLP、ODC和1%吐温-80的ODC-PLP储备液,得到含0.1 mmol/L EDTA、2.5 mmol/L DTT、0.1 mmol/L PLP、0.1%吐温-80和1 ng/μL (约19 nmol/L) ODC的溶液;最后通过加入2 μL 10 mmol/L Tris-HCl (pH 7.5) 溶液配制的鸟氨酸引发反应,反应初始体系中鸟氨酸浓度为200 μmol/L。对于含抑制剂的体系,需将抑制剂与ODC、PLP在37 ℃下孵育40 min后再进行反应,并且每个孔终体积为260 μL。在开始反应后,将黑色96孔板立即放入酶标仪中,并以特定的时间间隔记录每个孔的荧光强度(λexc=460 nm,λem=590 nm)。
ODC-CB6-opt法:将232 μL含有6 μmol/L DSMI、2 μmol/L CB6、10 mmol/L Tris-HCl (pH 7.5) 的溶液加入黑色96孔板的孔中并在37 ℃下平衡10 min,然后加入26 μL不含PLP的ODC储备液,得到不含PLP、其他物质浓度与ODC-CB6法相同、ODC浓度为4 ng/μL (约77 nmol/L) 的溶液;最后通过加入2 μL 10 mmol/L Tris-HCl (pH 7.5) 溶液配制的鸟氨酸和PLP混合液引发反应,PLP终浓度为75 nmol/L,鸟氨酸最终浓度2 μmol/L。对于含抑制剂的体系,需将抑制剂与ODC在37 ℃下孵育40 min再进行反应,每个孔终体积为260 μL。在开始反应后,操作同ODC-CB6法。
1.3.6 数据分析每组实验重复测定3次,结果表示为平均值±标准偏差(x±s),其中结合常数Ka根据Y=Bmax*X/(1/Ka+X)进行拟合,米氏常数根据Michaelis-Menten方程拟合分析,而抑制剂的抑制常数Ki则根据希尔方程拟合,采用GraphPad Prism 8.0软件进行处理分析。
2 结果与分析2.1 ODC-CB6法的验证2.1.1 CB6/DSMI报告对的表征葫芦[n]脲(CB[n],简称CB) 及其衍生物由于其特殊的性能被广泛关注,其中CB6对某些生物胺具有较高结合力,尤其是多胺中的腐胺[18]。与此同时,CB6还可与具有紫外吸收的荧光染料如DSMI进行结合[19]。DSMI是一种阳离子半菁染料,与CB6结合后在激发光照射下可产生强烈的荧光信号[20]。结果显示,CB6的加入不会显著影响DSMI在460 nm处的吸光度(图 1A),但是会使体系产生明显的荧光发射信号(λexc=460 nm,λem=590 nm),并且信号强度具有显著的剂量依赖性(图 1B)。通过λem=590 nm处的荧光数值和对应的CB6浓度拟合得到CB6与DSMI的结合常数Ka为(4.5±0.1)×105 L/mol (图 1C)。L-鸟氨酸的加入使CB6/DSMI荧光强度略有降低,但浓度依赖趋势不变(图 1D),拟合得到CB6与L-鸟氨酸的结合常数Ka为(146±20) L/mol (图 1E)。图 1F是加入腐胺后CB6/DSMI的荧光变化图,拟合得到CB6与腐胺的结合常数Ka为(3.7±0.2)×106 L/mol (图 1G)。以上结合常数的数据与文献[16]数据相当。这些数据表明,ODC酶促反应中底物鸟氨酸与CB6的结合能力远低于DSMI或腐胺与CB6的结合能力,因此对CB6/DSMI报告对的影响很微弱。同时,腐胺与CB6的亲和力显著高于DSMI与CB6的亲和力,能够竞争性取代与CB6结合的DSMI,而且腐胺存在时的荧光强度与腐胺的浓度呈线性关系(在0–0.5 μmol/L范围内R2 > 0.99),可见CB6与腐胺的结合是定量的。
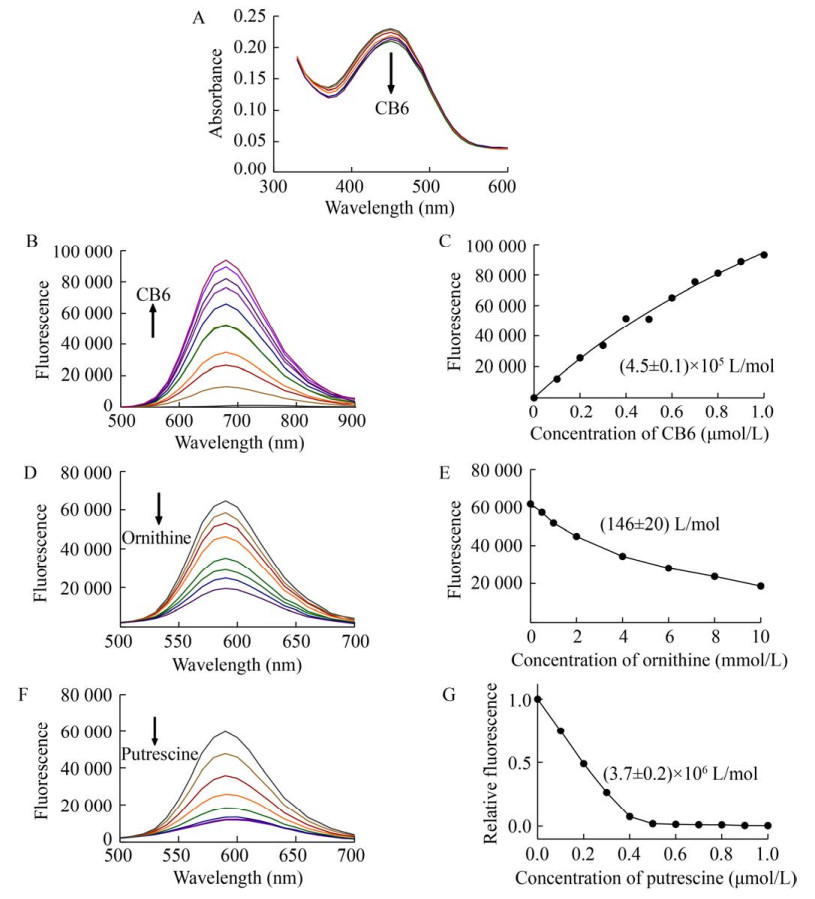 |
| 图 1 CB6/DSMI>报告对的表征 Fig. 1 Characterization of CB6/DSMI report pairs. (A) Absorption spectral changes upon addition of CB6 (0–6 μmol/L) to 10 μmol/L DSMI. (B) Fluorescence changes upon addition of CB6 (0–1 μmol/L) to 3 μmol/L DSMI. (C) Binding constant of CB6 and DSMI. (D) Competitive fluorescence intensity of L-ornithine for CB6/DSMI reporter pair. (E) Binding constant of CB6 and L-ornithine. (F) Competitive fluorescence intensity of L-ornithine for CB6/DSMI reporter pair. (G) Binding constant of CB6 and putrescine. |
| 图选项 |
2.1.2 酶动力学的测定首先,我们获得了高纯度的ODC蛋白(51.7 kDa),接下来,我们利用ODC-CB6法进行了ODC酶催化活性的实时监测(图 2)。如图 2B所示,随着ODC浓度的增加,根据荧光强度变化计算得到的DSMI被替换速率也更快,反映出随着酶浓度的增加,酶初始反应速率也随之增加(图 2C)。在固定的ODC浓度下,底物鸟氨酸浓度的增加也使DSMI的被替换速率加快(图 2D),反映出酶初始反应速度对底物浓度具有依赖性。经Michaelis- Menten方程拟合分析(图 2E) 得出ODC对鸟氨酸的Km为(16±2) μmol/L,kcat为(0.36±0.10) s–1。该数据与文献报道数据相当(Km=(24±1) μmol/L,kcat=(0.12±0.01) s–1[16];Km=80 μmol/L,kcat=3.3 s–1[21]),验证了ODC-CB6法的可靠性。
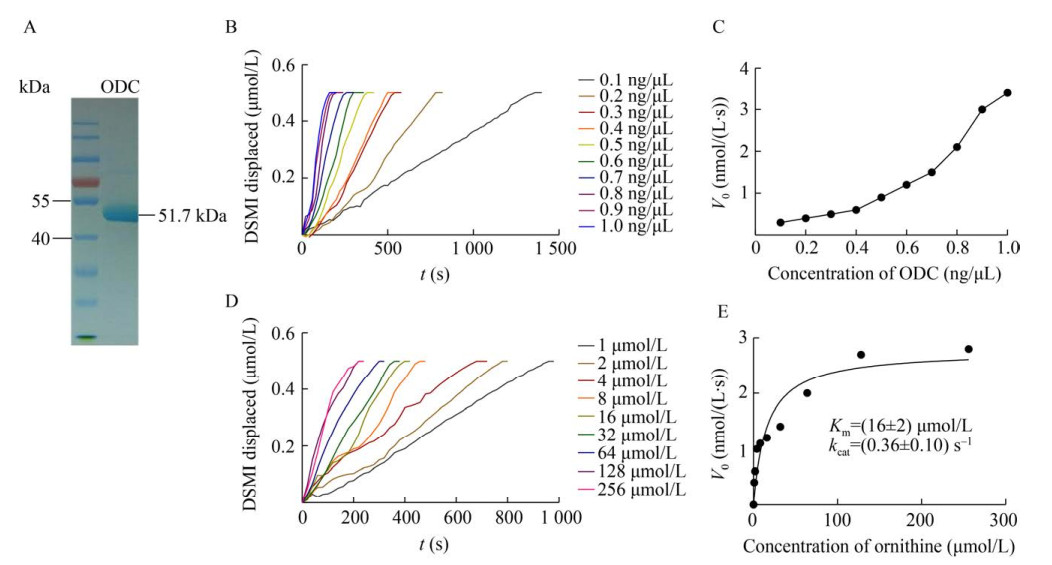 |
| 图 2 酶动力学测定 Fig. 2 Determination of enzyme kinetics. (A) Purified ODC. (B) Kinetics of enzymatic reactions with different ODC concentrations (0.1–1.0 ng/μL). (C) Dependence of the initial reaction rate on enzyme concentration (with 200 μmol/L L-ornithine). (D) Kinetics of enzymatic reactions with different ornithine concentrations (1–256 μmol/L). (E) Dependence of the initial reaction rate on substrate concentration (with 1.0 ng/μL ODC). |
| 图选项 |
2.1.3 抑制常数的测定DFMO是目前研究最广泛的ODC自杀性抑制剂,它在脱羧后与ODC活性位点中的半胱氨酸残基形成共价键,从而不可逆地抑制ODC活性[22]。根据上述ODC-CB6方法,我们实时检测了在不同浓度DFMO存在下ODC的酶促反应过程(图 3A),通过拟合荧光曲线获得酶初始反应速度,进一步得到不同浓度DFMO的抑制率,拟合得到DFMO对ODC的Ki等于(0.45±0.10) μmol/L(图 3B)。该数据与文献[16]中的Ki值(4.4±0.2) μmol/L较为接近。因此,ODC-CB6方法可有效定量评价DFMO对ODC的抑制能力。
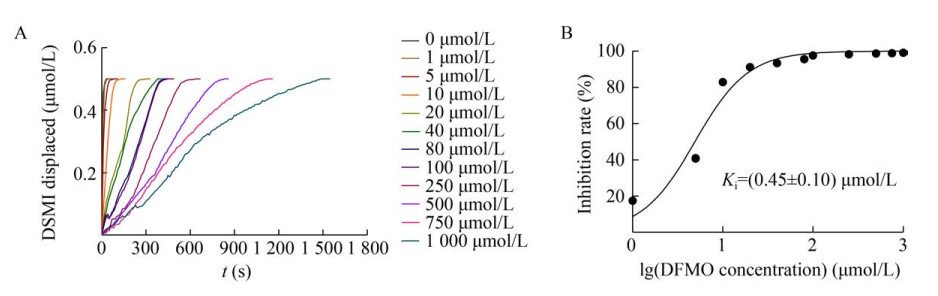 |
| 图 3 DFMO抑制常数的测定 Fig. 3 Determination of the DFMO inhibition constant. (A) Kinetics of enzymatic reaction of ODC in the presence of different concentrations of DFMO (0–1 000 μmol/L). (B) Inhibition constant of DFMO. |
| 图选项 |
2.2 ODC-CB6法的应用局限性2.2.1 鸟氨酸脱羧酶抑制剂POB对ODC的作用磷酸吡啶氧基-鸟氨酸(POB) 是基于ODC的辅酶PLP与底物鸟氨酸在反应过程中形成的过渡态复合物而设计的过渡态类似物[12]。我们使用ODC-CB6法检测了POB (0.25% DMSO) 对ODC的抑制作用,但是该方法未能准确反映出POB对ODC酶活的抑制作用(图 4)。
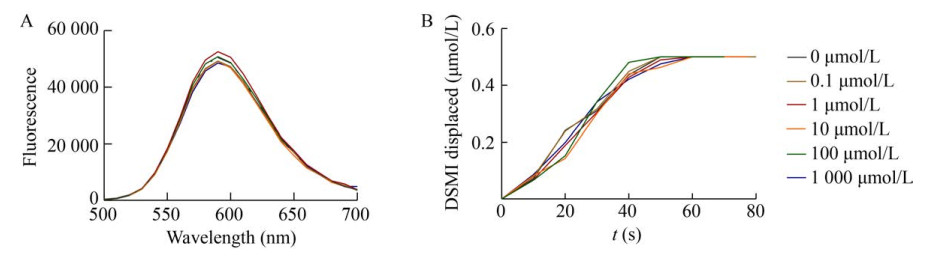 |
| 图 4 鸟氨酸脱羧酶抑制剂POB对ODC的影响 Fig. 4 Effects of ornithine decarboxylase inhibitor POB on ODC. (A) Fluorescence changes upon addition of POB (0–1 000 μmol/L) to the CB6/DSMI reporter pair (DSMI: 3 μmol/L; CB6: 0.5 μmol/L). (B) Kinetics of enzymatic reaction of ODC in the presence of different concentrations of POB (0–1 000 μmol/L). |
| 图选项 |
2.2.2 溶剂DMSO对检测体系的影响在上述实验中我们注意到,DFMO溶解于水中,而POB溶解于DMSO中,同时考虑到多数有机分子也常利用DMSO进行溶解,因此我们分析了DMSO对ODC-CB6法的影响。如图 5A和5B所示,随着DMSO浓度的增加,体系的荧光强度逐渐减弱。为了分析DMSO是否影响对ODC抑制剂的评价,我们在1% DMSO (V/V) 存在下检测了不同浓度DFMO对ODC的抑制作用。结果显示,虽然DMSO会导致体系荧光强度降低且拟合曲线波动增大(图 5C),但是并不显著影响对DFMO抑制作用的定量评价(Ki=(0.32±0.10) μmol/L) (图 5D)。因此,ODC-CB6法未能准确反映出POB对ODC酶活的抑制作用并不是DMSO所导致的。
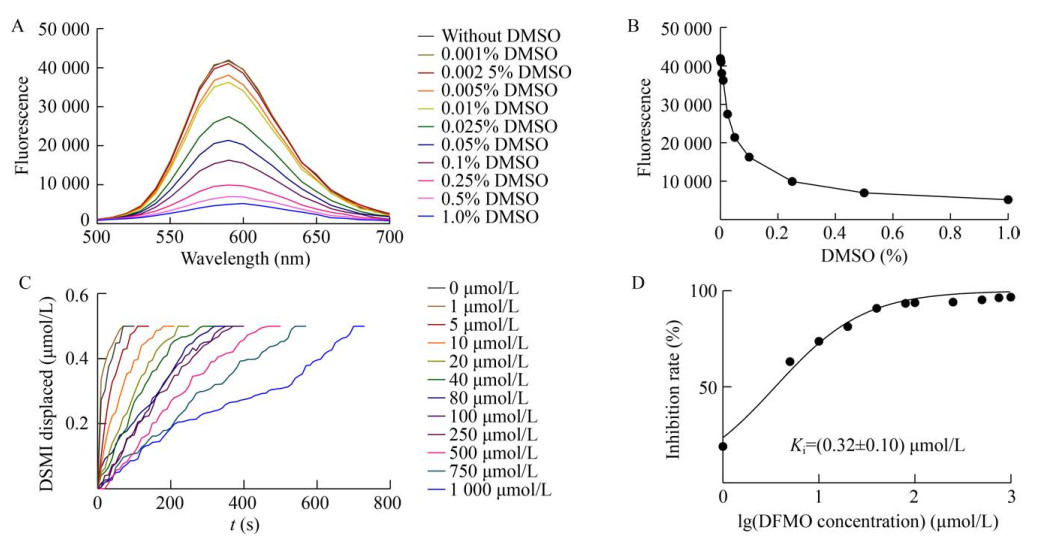 |
| 图 5 溶剂DMSO对检测系统的影响 Fig. 5 Effect of solvent DMSO on detection system. (A) Fluorescence changes upon addition of DMSO (0–1%) to the CB6/DSMI reporter pair (DSMI: 3 μmol/L; CB6: 0.5 μmol/L). (B) Fluorescence intensity at λem=590 nm in the presence of different concentrations of DMSO (0–1%). (C) Effects of DFMO at different concentrations (0–1 000 μmol/L) on ODC in the presence of 1% DMSO. (D) Inhibition constant of DFMO. |
| 图选项 |
2.3 ODC-CB6法的优化与应用2.3.1 DSMI与CB6量的优化以上实验表明DMSO对DSMI/CB6检测体系的荧光强度有淬灭作用,所以为了提高荧光强度,以增强数据分辨率和稳定性,我们对体系中DSMI和CB6的终浓度进行了优化。DSMI与CB6以1︰1的比例进行结合[20],因此为使CB6饱和,DSMI的浓度要高于CB6。为便于小分子抑制剂的评价和筛选,我们在体系中添加了1% (V/V) 的DMSO。如图 6所示,随着DSMI和CB6的浓度的升高,体系的荧光强度随之增强。基于该结果,同时结合后期ODC催化反应的浓度设置区间情况,我们将DSMI的终浓度设定为6 μmol/L,CB6的终浓度设定为2 μmol/L。
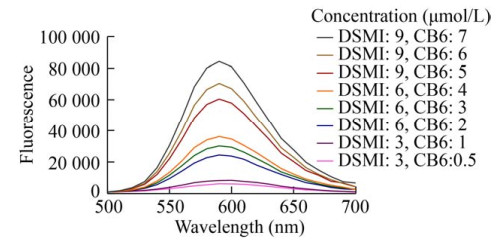 |
| 图 6 在1% DMSO存在下CB6/DSMI的荧光强度 Fig. 6 Fluorescence intensity of CB6/DSMI in the presence of 1% DMSO. |
| 图选项 |
2.3.2 ODC、鸟氨酸和PLP的量的优化磷酸吡哆醛(PLP) 是ODC的重要辅因子,而鸟氨酸是ODC的底物[23]。Nilam等[16]提到PLP在DSMI的激发波长下有一定的光吸收(在0.1 mmol/L PLP时约0.4),因此,在上述优化DSMI和CB6浓度的基础上,我们参考分光光度检测法[14]和高效液相色谱法[15],将体系中PLP的终浓度调整为75 nmol/L。同时,按照ODC︰PLP=1︰1的比例将ODC的终浓度调整为4.0 ng/μL (约77 nmol/L)。我们利用优化后的条件实时检测了酶反应对底物浓度的依赖性,并拟合得到鸟氨酸对ODC的Km为(20±3) μmol/L,kcat为(0.14±0.01) s–1 (图 7)。该结果与原方法得到的结果(图 2) 相当。为了在检测过程中可以使CB6被腐胺完全饱和,实现荧光值的最大变化量,我们将抑制剂评价时体系中鸟氨酸浓度确定为2 μmol/L。为便于区分,将优化后的体系命名为ODC-CB6-opt法。
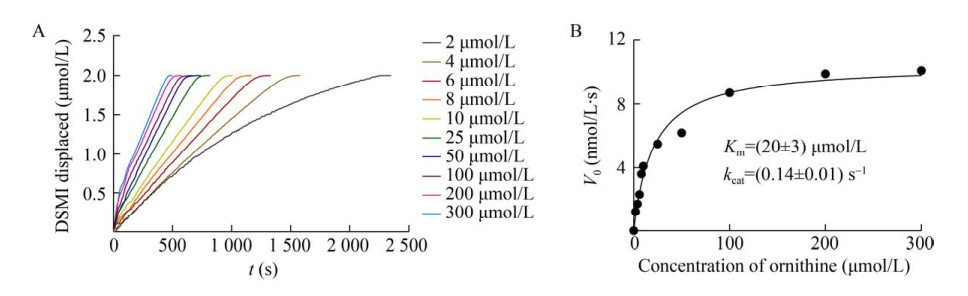 |
| 图 7 ODC的米氏常数 Fig. 7 Km of ODC. (A) Kinetics of enzymatic reactions with different ornithine concentrations (2–300 μmol/L). (B) Dependence of the initial reaction rate on substrate concentration (with 4.0 ng/μL ODC). |
| 图选项 |
2.3.3 ODC-CB6-opt法检测DFMO和POB对ODC的抑制作用为了验证ODC-CB6-opt法的可靠性,我们分析了DFMO和POB对ODC的抑制作用。图 8A为在1% DMSO存在时DFMO对ODC抑制作用的实时检测曲线,结果经拟合得到Ki为(4.94±0.98) μmol/L (图 8B),该数据与前述ODC-CB6法的检测结果相当(图 3)。由于共价抑制剂的抑制作用具有时间依赖性,因此我们检测了DFMO对ODC抑制作用的时间依赖(图 8C)。结果表明,随着孵育时间的延长,DFMO的抑制效果越好,符合其共价抑制剂的特性。进一步,我们利用ODC-CB6-opt法检测了POB对ODC的抑制作用(图 8D),并拟合得到其IC50为(15.52±0.49) μmol/L,Ki为(13.80±0.44) μmol/L (图 8E),虽没有文献报道POB在体外对ODC的抑制效果,但Wu等[12]发现POB在LN229细胞中的IC50约50 μmol/L。由于POB为非共价抑制剂,且其机制与DFMO不同,其实时检测曲线不如DFMO显著,但该结果明显体现出ODC-CB6-opt法比ODC-CB6法具有更好的适用范围。
 |
| 图 8 ODC-CB6-opt法检测DFMO和POB对ODC的抑制作用 Fig. 8 Using ODC-CB6-opt method to analyze the inhibitory effect of DFMO and POB on ODC. (A) Kinetics of enzymatic reaction of ODC in the presence of different concentrations of DFMO (0–1 000 μmol/L). (B) Inhibition constant of DFMO. (C) Time-dependent decrease of ODC activity with increasing incubation times with DFMO (4.0 ng/μL ODC, 100 μmol/L DFMO). (D) Kinetics of enzymatic reaction of ODC in the presence of different concentrations of POB (0–982 μmol/L). (E) Inhibition constant of POB. |
| 图选项 |
2.3.4 ODC-CB6-opt法检测ODC-MPI-1对ODC的抑制作用近期我们发现了一类新型ODC多功能抑制剂,其中最具有代表性的是ODC-MPI-1[24]。我们利用ODC-CB6法和ODC-CB6-opt法对ODC-MPI-1的ODC酶活抑制能力进行了的检测。首先,ODC-MPI-1不影响CB6/DSMI检测体系的荧光信号,表明其不干预CB6与DSMI的结合(图 9A)。其次,利用ODC-CB6法无法显著检测到ODC-MPI-1对ODC的抑制作用(图 9B)。但是,利用ODC-CB6-opt法能够明显检测出ODC-MPI-1对ODC的抑制作用(图 9C–D)。
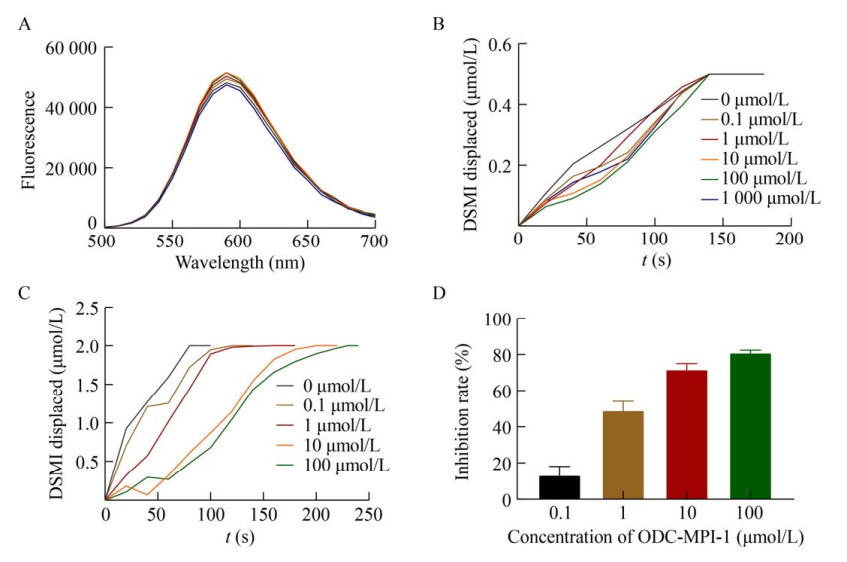 |
| 图 9 ODC-CB6-opt法检测ODC-MPI-1对ODC的抑制作用 Fig. 9 Using ODC-CB6-opt method to analyze the inhibitory effect of ODC-MPI-1 on ODC. (A) Fluorescence changes upon addition of ODC-MPI-1 (0–1 000 μmol/L) to the CB6/DSMI reporter pair (DSMI: 3 μmol/L; CB6: 0.5 μmol/L). (B) ODC-CB6 method to detect the effect of ODC-MPI-1 (0–1 000 μmol/L) on ODC. (C) OPT-CB6 method to detect the effect of ODC-MPI-1 (0–100 μmol/L) on ODC. (D) Inhibition of ODC by ODC-MPI-1. |
| 图选项 |
3 讨论多胺的生物合成速率和细胞内多胺浓度与肿瘤的发生密切相关,而ODC作为多胺生物合成途径中的重要限速酶,被认为是肿瘤治疗的潜在靶标。DFMO和POB为具有代表性的两种ODC抑制剂,其中DFMO为底物类似物,POB为底物与辅酶的过渡态类似物。虽然ODC抑制剂暂时还没有在肿瘤的临床治疗中获得应用,但DFMO已被用于多种肿瘤治疗的临床试验中。DFMO的主要缺点是其有效浓度非常高,并有不同程度的副作用(如暂时性失聪)[25]。因此,发现新的ODC抑制剂具有重要的价值。
高通量筛选是药物发现的一个重要且有效的途径,但是目前常采用的几种ODC活性检测方法具有较大的局限性,不能有效应用于ODC抑制剂的高通量筛选。Nilam等[16]提出的ODC-CB6法利用超分子偶联酶法建立了一种ODC酶活的无标记连续荧光检测法,其操作流程简单,实验成本低廉,也可以高通量进行。但是我们研究发现ODC-CB6法的适用范围具有一定的局限性。因此我们在原ODC-CB6法的基础上对其进行了优化,首先调整了DSMI和CB6的配比组成,使其可以在DMSO的存在下进行灵敏、稳定的检测。其次,我们调整了ODC、鸟氨酸和PLP的终浓度,并建立了ODC-CB6-opt法。我们的研究表明,ODC-CB6-opt法可以适应不同机制ODC抑制剂(DFMO和POB) 的评价。最后,我们利用ODC-CB6-opt法对本实验室近期发现的一种新型ODC多功能抑制剂ODC-MPI-1进行了验证。
在使用ODC-CB6-opt法检测POB和ODC-MPI-1的抑制作用时,荧光曲线比DFMO体系的波动大。我们认为可能是由于DFMO的作用机制与POB和ODC-MPI-1不同导致。例如,DFMO是共价抑制剂,其并不影响ODC活性二聚体的稳定性,而ODC-MPI-1能够在抑制ODC的同时推动ODC形成无活性二聚体[24]。但是,这种荧光信号的波动并不显著影响对抑制剂效果的评价。同时,这也暗示该方法有可能可以进一步应用于ODC抑制剂作用机制的分析研究。
综上所述,本研究改进和建立了一种经济、便捷、无标记的ODC活性实时检测方法ODC-CB6-opt法,并利用其实现了对多种ODC抑制剂的定量评价。该方法未来将有助于新型ODC抑制剂的发现和评价。
参考文献
| [1] | Pegg AE. Mammalian polyamine metabolism and function. IUBMB Life, 2009, 61(9): 880-894. DOI:10.1002/iub.230 |
| [2] | Tanaka H, Takeda K, Imai A. Polyamines alleviate the inhibitory effect of the DNA cross-linking agent mitomycin C on root growth. Plant Signal Behav, 2019, 14(11): 1659687. DOI:10.1080/15592324.2019.1659687 |
| [3] | Liao CZ, Wang YL, Tan X, et al. Discovery of novel inhibitors of human S-adenosylmethionine decarboxylase based on in silico high-throughput screening and a non-radioactive enzymatic assay. Sci Rep, 2015, 5: 10754. DOI:10.1038/srep10754 |
| [4] | Li JK, Zhang LY, Xiong JW, et al. Polyamines disrupt the KaiABC oscillator by inducing protein denaturation. Molecules, 2019, 24(18): 3351. DOI:10.3390/molecules24183351 |
| [5] | Wallace HM, Fraser AV, Hughes A. A perspective of polyamine metabolism. Biochem J, 2003, 376(Pt 1): 1-14. |
| [6] | Gerner EW, Meyskens FL Jr. Polyamines and cancer: old molecules, new understanding. Nat Rev Cancer, 2004, 4(10): 781-792. DOI:10.1038/nrc1454 |
| [7] | Ai YB, Yu LL, Tan X, et al. Discovery of covalent ligands via noncovalent docking by dissecting covalent docking based on a "Steric-Clashes Alleviating Receptor (SCAR)" strategy. J Chem Inf Model, 2016, 56(8): 1563-1575. DOI:10.1021/acs.jcim.6b00334 |
| [8] | Zhang Y, Zheng Q, Zhou Y, et al. Repurposing clinical drugs as AdoMetDC inhibitors using the SCAR strategy. Front Pharmacol, 2020, 11: 248. DOI:10.3389/fphar.2020.00248 |
| [9] | Qiu SQ, Liu J, Xing FY. Antizyme inhibitor 1: a potential carcinogenic molecule. Cancer Sci, 2017, 108(2): 163-169. DOI:10.1111/cas.13122 |
| [10] | Murray-Stewart T, Casero RA. Regulation of polyamine metabolism by curcumin for cancer prevention and therapy. Med Sci (Basel), 2017, 5(4): 38. |
| [11] | Logiudice NL, Le L, Abuan I, et al. Alpha-difluoromethylornithine, an irreversible inhibitor of polyamine biosynthesis, as a therapeutic strategy against hyperproliferative and infectious diseases. Med Sci (Basel), 2018, 6(1): 12. |
| [12] | Wu F, Grossenbacher D, Gehring H. New transition state-based inhibitor for human ornithine decarboxylase inhibits growth of tumor cells. Mol Cancer Ther, 2007, 6(6): 1831-1839. DOI:10.1158/1535-7163.MCT-07-0045 |
| [13] | Jaenisch S, Squire M, Butler R, et al. In vitro development and validation of a non-invasive 13C-stable isotope assay for ornithine decarboxylase. J Breath Res, 2016, 10(2): 026009. DOI:10.1088/1752-7155/10/2/026009 |
| [14] | Ngo TT, Brillhart KL, Davis RH, et al. Spectrophotometric assay for ornithine decarboxylase. Anal Biochem, 1987, 160(2): 290-293. DOI:10.1016/0003-2697(87)90049-2 |
| [15] | Gaboriau F, Havouis R, Groussard K, et al. Measurement of ornithine decarboxylase activity in cell extracts using mass spectrometry detection of dansylated putrescine. Anal Biochem, 2005, 341(2): 385-387. DOI:10.1016/j.ab.2005.01.026 |
| [16] | Nilam M, Gribbon P, Reinshagen J, et al. A label-free continuous fluorescence-based assay for monitoring ornithine decarboxylase activity with a synthetic putrescine receptor. SLAS Discov, 2017, 22(7): 906-914. |
| [17] | Dsouza RN, Hennig A, Nau WM. Supramolecular tandem enzyme assays. Chemistry, 2012, 18(12): 3444-3459. DOI:10.1002/chem.201103364 |
| [18] | Rekharsky MV, Ko YH, Selvapalam N, et al. Complexation thermodynamics of cucurbit[6]uril with aliphatic alcohols, amines, and diamines. Supramol Chem, 2007, 19(1/2): 39-46. |
| [19] | Dsouza RN, Pischel U, Nau WM. fluorescent dyes and their supramolecular host/guest complexes with macrocycles in aqueous solution. Chem Rev, 2011, 111(12): 7941-7980. |
| [20] | Li ZY, Sun SG, Liu FY, et al. Large fluorescence enhancement of a hemicyanine by supramolecular interaction with cucurbit[6]uril and its application as resettable logic gates. Dyes Pigments, 2012, 93(1/3): 1401-1407. |
| [21] | Dufe VT, Ingner D, Heby O, et al. A structural insight into the inhibition of human and Leishmania donovani ornithine decarboxylases by 1-amino-oxy- 3-aminopropane. Biochem J, 2007, 405(2): 261-268. DOI:10.1042/BJ20070188 |
| [22] | Qu N, Ignatenko NA, Yamauchi P, et al. Inhibition of human ornithine decarboxylase activity by enantiomers of difluoromethylornithine. Biochem J, 2003, 375(Pt 2): 465-470. |
| [23] | Kern AD, Oliveira MA, Coffino P, et al. Structure of mammalian ornithine decarboxylase at 1.6 A resolution: stereochemical implications of PLP-dependent amino acid decarboxylases. Structure, 1999, 7(5): 567-581. DOI:10.1016/S0969-2126(99)80073-2 |
| [24] | Chai XY, Zhan JQ, Pan J, et al. The rational discovery of multipurpose inhibitors of the ornithine decarboxylase. FASEB J, 2020, 34(9): 10907-12921. DOI:10.1096/fj.202001222R |
| [25] | Lao CD, Backoff P, Shotland LI, et al. Irreversible ototoxicity associated with difluoromethylornithine. Cancer Epidemiol Biomarkers Prev, 2004, 13(7): 1250-1252. |
