

西南大学 药学院,重庆 400716
收稿日期:2020-06-25;接收日期:2020-09-01;网络出版时间:2020-10-14
基金项目:重庆市基础科学与前沿项目(No. cstc2018jcyjAX0612),重庆市留创计划(No. cx2018086) 资助
摘要:线粒体是细胞内的一种多功能细胞器,主要负责能量产生、细胞凋亡等生命过程。线粒体缺陷与临床上百种疾病相关。越来越多的研究已表明,细胞外的线粒体可被细胞内吞,进入到细胞内,然后以完整的形态发挥作用。研究发现,线粒体是对氧含量和酸碱度极为敏感的细胞器,细胞内环境可影响线粒体的功能。外源线粒体进入到生理环境中的细胞后,将提高细胞能量供应、促进细胞存活;但线粒体进入到缺氧和酸性的肿瘤组织后,将大量产生氧自由基、诱发细胞死亡。线粒体这种环境响应性的药理特性,可应用于清除肿瘤细胞、恢复受损组织的功能。目前线粒体已用于治疗中枢神经系统疾病(帕金森氏病、抑郁症、精神分裂症等)、外周系统疾病(缺血性心肌损伤、脂肪肝、肺气肿等)和肿瘤等,为线粒体相关疾病的治疗提供了新的方法。文中对这种新型生物治疗方法的研究进展、医学应用和存在的挑战进行综述。
关键词:线粒体治疗神经系统疾病肿瘤心肌损伤安全性
Mitochondrial therapy: a new strategy for treating mitochondrion-associated diseases
Zhao Zizhen, Fu Ailing


College of Pharmaceutical Sciences, Southwest University, Chongqing 400716, China
Received: June 25, 2020; Accepted: September 1, 2020; Published: October 14, 2020
Supported by: Basic Science and Frontier Project of Chongqing, China (No. cstc2018jcyjax0612), Chongqing Innovation Program, China (No. cx2018086)
Corresponding author: Ailing Fu. Tel/Fax: +86-23-68251225; E-mail: fal@swu.edu.cn.
Abstract: Mitochondrion is a multifunctional organelle in cells and responsible for energy production, cell apoptosis and various life processes. Dysfunctional mitochondria are associated with hundreds of diseases. Increasing evidences have shown that extracellular mitochondria can be endocytosed by cells, directly into cells, and then play roles in cells. Mitochondria are the organelles that are extremely sensitive to oxygen content and pH of microenvironment that induces the adverse effect based on the cellular environment: mitochondria will increase cell survival and viability when they arrive in cells of physiological environment, but mitochondria will cause cell death when they enter the hypoxic and acidic tumor tissues, because they can produce a large amounts of oxygen free radicals. The pharmacological feature of environmental responsiveness of mitochondria could make them as a potential biological drug to kill cancer cells and restore the function of damaged tissues. Currently, mitochondria are used in the treatment of central nervous system diseases (Parkinson's disease, depression, schizophrenia, etc.), peripheral system diseases (ischemic myocardial injury, fatty liver, emphysema, etc.) and tumor. In this review, we summarize the research progress, medical application and challenges of mitochondrial therapy.
Keywords: mitochondrial therapyneurological diseasestumormyocardial injurysafety
线粒体是为细胞提供能量的主要细胞器,为增殖、迁移和分化等多个生命过程提供动力。线粒体还参与调节细胞凋亡、坏死、自噬等。同时,许多生化反应发生在线粒体内,包括脂肪酸β氧化、三羧酸循环、尿素循环、血红素生物合成以及部分类固醇、心磷脂和泛醌的生物合成等。因此,线粒体的健康对于维持细胞的完整性和功能至关重要[1-2]。
线粒体疾病是指主要由线粒体DNA (Mitochondrial DNA,mtDNA) 和细胞核DNA编码基因异常,引起线粒体结构功能出现障碍,从而产生的疾病,例如线粒体肌病和脑肌病、Leber遗传视神经病等。线粒体疾病的诊断有一套临床方案,其中美国波士顿儿童医院对儿童线粒体疾病的诊断值得借鉴,但目前尚没有针对线粒体疾病的特效药物,常规治疗是给予维生素和辅酶等。此外,在一些疾病的发生发展过程中,线粒体结构功能出现损伤或者线粒体物质能量代谢呈现异常,通过干涉或补偿线粒体功能可影响疾病进程,这些疾病均被统称为线粒体相关疾病。目前有上百种人类疾病与异常的线粒体结构和功能有关,临床表现可影响体内的任何系统,包括神经退行性疾病、精神疾病、肿瘤、衰老、心血管疾病、糖尿病等。这些疾病虽然显现于不同的组织部位并表现出不同的症状,但线粒体障碍是这些疾病的共有特征,主要表现为氧化磷酸化受损导致产能不足、活性氧(Reactive oxygen species,ROS) 增高、细胞凋亡信号异常[3-4]。因此,近几年围绕纠正线粒体结构和功能的研究迅疾开展。例如,通过基因组编辑技术纠正mtDNA的突变,可对疾病有一定的疗效[5]。另外,靶向线粒体的诊疗试剂,可对糖尿病或脑胶质瘤产生特异性的抑制作用[6-7]。虽然这些通过线粒体分子诊疗、基因编辑等技术对线粒体疾病取得了一定的治疗效果,但是在多数疾病的发展过程中,线粒体的结构和功能出现了不可逆损伤或无法修复的破坏,仅针对修复细胞自身线粒体功能的药物只有比较局限的作用。因此,向细胞内补充正常功能的健康线粒体可能是从根本上治疗线粒体疾病的有效方法[8]。在本文中,我们对该新型生物治疗方法的前沿进展、治疗应用、面临的挑战等内容进行综述,以促进线粒体治疗的快速发展。
使用健康线粒体替代细胞内功能障碍线粒体,以用于疾病治疗的方法,被称为线粒体治疗[8]。由于诸多疾病与线粒体障碍相关,因此线粒体治疗可能对线粒体相关疾病具有普适性。在2016年,由第三方女性提供正常线粒体的三亲婴儿出生,明确了外源线粒体移植到细胞后可行使正常功能。这种将线粒体微注射到极体或卵母细胞的方法,可用于治疗先天性的线粒体疾病[9]。但随着年龄增长出现的线粒体疾病,则需要其他的线粒体移植途径。早年研究发现,加入到培养基中的线粒体可修复线粒体受损的细胞[10]。我们的实验也多次证明了这个结果,并将该发现应用于向动物体内直接进行线粒体注射,以恢复受损组织的正常功能[11-12]。将分离的线粒体与受体细胞共同孵育,这种技术可以很容易地应用于许多不同类型的细胞。该方法提供了研究向受体细胞内人工转移的外源线粒体的行为和作用的机会。目前该研究领域逐渐从小众走向大众,并在多种疾病的治疗中快速展开[11-14],成为治疗线粒体疾病的一个崭新的方法。
1 线粒体进入细胞的分子机制线粒体是微米级的细胞器。其进入细胞的机制可参考微纳米脂质体或胶束等进入细胞的途径。但需要指出的是,微纳米脂质体或胶束等在进入细胞后,逐渐破裂释放出所包载的药物;或者与溶酶体融合,经溶酶体酸性环境作用或经酶解,破坏外层膜,造成药物快速释放。然而,线粒体在进入细胞后,绝大部分则以完整形态发挥作用[15],这与微纳米载药系统不同,其机制目前尚不清楚。
1.1 线粒体经肌动蛋白依赖的途径进入细胞线粒体加入到培养基后,可在短短10 min内进入细胞。目前常采用小分子抑制剂来研究荧光标记的线粒体进入细胞的机制,例如,秋水仙碱、细胞松弛素、阿米洛利、氯丙嗪等细胞内吞或巨胞饮抑制剂。线粒体的荧光标记方法常采用依赖于膜电位的荧光探针(包括CMRos系列) 和核编码的靶向线粒体的荧光蛋白等。Kesner等和Patel等的研究表明线粒体进入细胞的方式主要由巨胞饮作用介导[15-16]。但Sun等和Pacak等则报道线粒体是由肌动蛋白依赖性内吞作用,而非巨胞饮作用介导的方式进入细胞[7, 17]。该研究分别使用细胞松弛素D用于抑制肌动蛋白聚合、使用甲基-β-环糊精阻止内吞作用,并使用诺卡多唑来阻断隧道纳米管,结果显示这些抑制剂极大地抑制了细胞对线粒体的摄取,从而推断线粒体进入细胞的途径主要是肌动蛋白依赖的内吞方式。当线粒体经内吞进入细胞后,形成的包含线粒体的微囊可能在细胞中破裂,释放出完整的线粒体发挥作用。
尽管如此,血液中线粒体的通透血管的机制尚不清楚。最近的研究表明,人体血液中含有完整的线粒体,但当机体出现肿瘤等疾病时,血液中线粒体数量明显降低,因此推测游离的线粒体在机体中可能有重要的功能[18]。研究发现,血管内的线粒体可快速穿过血管壁进入组织[10-11]。微纳米级别的微囊或脂质体通透血管的方式一般有两种:转胞吞作用和细胞间的并行传输(Paracellular transport)[19]。其中转胞吞作用可更广泛地使微囊和微纳米颗粒从血管内皮细胞一侧快速转移到另一侧[20-22],因此推测线粒体可能采用转胞吞作用通过血管进入组织液[23]。
线粒体是极富动态的细胞器,在不同环境中呈现出很大的形态变化。虽然其形状被认为是圆形或细长的棒状,但实际上线粒体形状多样。其直径在0.5–1.0 μm之间,其长度则有很大变化,从0.5–10.0 μm。该细胞器的结构特征在于双脂蛋白膜,每个膜的厚度约为7 nm。其外膜光滑,化学成分和生物组成上与真核细胞膜相同,富含胆固醇(在外部培养基中时,可能有助于细胞摄取);而内膜与细菌细胞膜相似,富含心磷脂和?磷脂。线粒体的外膜对线粒体进入细胞至关重要[24],使用洋地黄皂苷或其他破坏线粒体外膜的分子,会显著抑制摄取过程。
1.2 外源线粒体在细胞内破裂吗?线粒体治疗的主要疑问之一是线粒体进入细胞后,是否像人工脂质体、外泌体等在细胞内破裂,从而引起细胞应激反应。但目前所能得到的证据均显示[16, 24],线粒体在细胞内仍保持其完整的双层膜结构,并可以与细胞内源性线粒体进行融合和分裂,即线粒体进入细胞时,细胞缺乏破裂线粒体的机制;在线粒体进入细胞后,细胞缺乏识别内源性和外源性线粒体的机制,这可能与线粒体表面含有的胆固醇或者细胞可识别的蛋白质有关。我们曾以另一种含有核外DNA的细胞器叶绿体为对照,观测线粒体在细胞内是否保持完整形态。结果显示叶绿体在与细胞膜接触后,即发生破裂,带有红色荧光的叶绿素迅速分布于整个胞浆;包裹FITC-BSA的纳米微囊(平均粒径150 nm) 在细胞中呈颗粒状,但随着时间延长,微囊破裂,绿色荧光分布于整个细胞[25];而基因工程构建的GFP标记的荧光线粒体则在细胞中以一个荧光点的形式稳定存在(图 1)。细胞内保持完整的线粒体形态可使其根据细胞本身状态发挥能量支持或者启动细胞死亡的功能。
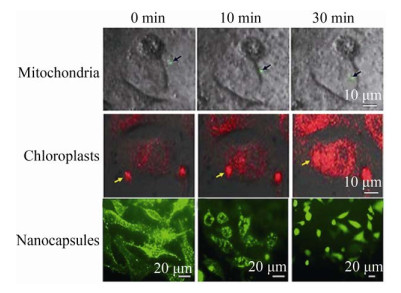 |
| 图 1 线粒体、叶绿体、纳米微囊进入细胞的不同形式[25] Fig. 1 Different types of mitochondria, chloroplast and nanocapsules enter the cells[25]. (A) The green fluorescent labeled mitochondria (mean diameter of 1 μm) enter cells and remain granular in 30 min. (B) The chloroplasts (about 5–10 μm) rupture after contacting with the cell membrane, releasing chlorophyll with red fluorescence. (C) After entering the cells, the nanocapsules with an average diameter of 150 nm show spot-like fluorescence, and then the nanocapsules break down, and the fluorescence gradually distributes in whole cells. |
| 图选项 |
1.3 外源线粒体在细胞内发挥作用当线粒体以完整形态进入细胞后,就能够行使其正常功能。这已经得到明确的结果。当把第三方提供的正常线粒体微注射到极体或卵细胞后,出生的三亲婴儿体内的线粒体依然发挥正常功能[26],明确了外源线粒体进入细胞后,便可行使功能。此外,不同实验室的生化测定均显示,在线粒体直接进入成体细胞后,外源线粒体在细胞中可以发挥物质和能量调节、ROS生成和消除、凋亡和抗凋亡、融合-分裂、线粒体-细胞核相互联系等作用,作为细胞内网络调节的重要细胞器,调控着细胞的存活或死亡。
1.4 影响线粒体治疗效果的因素线粒体治疗的效果受一些因素的影响,包括细胞选择性、线粒体剂量、自体或同种异体及异种线粒体等。线粒体进入不同细胞的效率有所不同(细胞选择性),即线粒体不能无差别地进入不同类型的细胞[27]。推测受体细胞膜的特征会影响细胞与线粒体外膜的相互作用,从而增多或减少外源线粒体进入细胞的数量和效率。细胞类型和功能也可能与摄取有一定的联系:当细胞生长需要的能量较多时,则摄取线粒体的能力增强,线粒体治疗的效果可能较为显著。尽管如此,目前尚没有探寻出确切的有关线粒体治疗的组织异质性或偏好性的规律。
在一定剂量下,线粒体与细胞活力呈量效关系,但到达坪值后,效果不再增加,细胞会通过自噬清除多余的线粒体[28]。此外,临床和实验室研究中采用自体和同种异体的线粒体,均达到较好的结果,而自体线粒体治疗没有伦理学的限制且疗效显著,已进入临床使用。
2 线粒体治疗在医学领域的应用在过去的30年中,线粒体研究出现了两个比较重要的技术发现:1982年,Clark和Shay将分离的线粒体和细胞通过简单共孵育,建立了线粒体转化技术,以及将线粒体直接于体内应用的方法。迄今为止,线粒体在体内已应用于治疗神经系统疾病、组织缺血性疾病、肿瘤等10余种临床相关的疾病。
2.1 神经精神疾病大脑是体内氧耗量最大的器官之一。神经递质的释放和突触可塑性等均有赖于线粒体代谢,因此线粒体对大脑行使认知和记忆等功能非常重要。线粒体障碍可能使神经元功能受损,从而对大脑及其所支配的机体行为等产生显著影响。目前已熟知帕金森氏病、阿尔茨海默症等神经退行性疾病与线粒体功能障碍有关,并且也有大量证据表明线粒体在精神疾病的发生发展中起作用,如精神分裂症、双相情感障碍和重度抑郁症等[29-30]。
线粒体功能障碍的物质基础是线粒体的结构发生改变。例如,mtDNA中的某些等位基因变异或异常修饰能够导致认知、学习、探索或感觉发育障碍;mtDNA中的基因表达减少(mtDNA调节区D-loop基因突变) 与精神疾病患病率增加有关[31]。此外,线粒体氧化磷酸化相关蛋白的结构变异也会导致线粒体功能障碍,如丙酮酸脱氢酶活性缺失与肿瘤等疾病密切相关[32]。采用mtDNA基因修复技术或增强酶活力的方法固然有一定效果,但补充正常线粒体则可能是快速恢复细胞功能的最根本和最直接的方法。
尽管人们对线粒体是否能够通透紧密的血脑屏障(Blood-brain barrier,BBB) 尚存在诸多疑问,但目前的证据表明,线粒体可经BBB进入到受损的神经元,随后重塑神经元膜电位,刺激神经元再生[33-34]。在抑郁症模型中,静脉注射的线粒体可改善动物的抑郁症状,其机制与刺激神经元再生有关。在MTPT诱导的帕金森氏病模型小鼠中,线粒体通过降低ROS水平和阻止细胞凋亡而延缓神经元损伤。在大脑中动脉阻塞(Middle cerebral artery occlusion,MCAO) 的中风动物模型中,向侧脑室内灌注分离的线粒体可快速分布于缺血半影区边界,减小缺血面积并阻止神经元损伤[35]。并且有证据显示直接脑内原位注射分离的线粒体在改善动物运动方面比通过动脉注射的线粒体更有效。但即便如此,动脉注射的线粒体已足以发挥其神经保护作用。
此外,在模拟病毒感染的神经分裂症动物模型中,Robicsek等将线粒体双侧注射到幼年模型小鼠的内侧前额叶皮层中,线粒体能够对神经元产生长期的支持和保护作用,使动物在成年期后,依然能够阻止选择性注意力缺陷症状的出现,其机制可能与线粒体刺激了多能干细胞向神经元的分化有关[36]。然而,Gollihue等的结果则表明,线粒体在治疗实验性的脊髓损伤中不能维持长期效果。线粒体注射时间和浓度依赖性增加脊髓神经元的能量供应和细胞存活率,在注射线粒体后7 d内,线粒体的药理学效应会逐渐丧失[37]。外源线粒体在不同细胞中维持时间不一致的现象也出现在外源线粒体移植入卵母细胞中,大多数胚胎的干细胞内供体mtDNA能够稳定存在,但一些细胞中供体mtDNA却在移植后逐渐丧失[38-39]。由此可见,线粒体的维持时间可能有赖于细胞类型,具体而言即取决于线粒体与不同细胞系中细胞核之间的相容性。
2.2 缺血性心脏病该领域研究最深入的是美国波士顿儿童医院的McCully教授团队,也是目前唯一将线粒体治疗应用于临床的团队。他们早年从缺血性休克的兔子胸肌中分离出线粒体,然后将线粒体注射到缺血的兔心肌中,发现线粒体快速进入心肌细胞,通过提高ATP生成、诱导细胞因子等途径,降低心肌缺血面积并增加心室收缩力,并且线粒体对心肌的保护作用至少持续了28 d,在此期间动物未出现心律失常[40]。此外,经冠状动脉注射的线粒体可在10 min内分布到整个心脏,随后发挥降低心肌损伤的作用[41]。在临床试验中,McCully团队将分离自心肌缺血儿童患者的腿部骨骼肌的线粒体,注射到自体的心肌缺血区,结果显示线粒体可使心肌功能恢复至正常状态,并且没有出现明显的不良作用和并发症(如心律失常或血肿)[42]。
2.3 肺动脉高压和肝脏疾病由于有些线粒体疾病涉及多个组织器官,静脉给予的线粒体可分布到肝脏、肾脏、肺和脑等。但由于血液对药物的稀释作用,静脉给予的线粒体量往往较大,且给予次数较多。在高脂、高胆固醇饮食诱导的小鼠脂肪肝模型中,线粒体经静脉注射后可降低血清转氨酶活性以及胆固醇水平,减少肝脏脂质集聚并降低肝脏的氧化应激损伤。线粒体对肝脏的保护作用也见于对乙酰氨基酚引起的非酒精性脂肪肝的治疗中[12]。此外,线粒体治疗已用于减轻在慢性缺氧环境中引起的大鼠缺氧性肺动脉高压:线粒体经静脉进入到肺动脉平滑肌细胞后,可抑制急性缺氧引起的肺血管收缩并减少缺氧诱导的肺血管重构,从而产生治疗肺动脉高压的效果[43]。线粒体治疗肝脏疾病的共同生化机制在于线粒体提高细胞能量供应,减少组织损伤和氧化应激,并使组织功能得到恢复。
2.4 恶性肿瘤恶性肿瘤和正常细胞的一个主要差别在于肿瘤细胞的代谢重编程。而肿瘤线粒体是代谢重编程的关键细胞器。恶性肿瘤细胞内的线粒体往往发生数量、结构和功能的改变,以适应肿瘤在酸性和缺氧环境中快速增长的需要。例如,肿瘤线粒体诱导细胞凋亡的能力被遏制、氧化磷酸化减弱而无氧糖酵解增强(Warburg效应)、采用截断或反向的三羧酸循环(Tricarboxylic acid cycle,TCA cycle) 生成肿瘤代谢中间产物等[44]。因此,正常线粒体若进入恶性肿瘤细胞中,可能会产生两种不同的结果:(1) 纠正细胞代谢、扭转恶性化方向、促使肿瘤细胞向正常细胞方向转化。(2) 正常线粒体难以忍受肿瘤细胞恶劣的内环境,激活细胞凋亡途径,诱导细胞凋亡。目前的实验证据支持第2种结果[28, 45-47]。
目前线粒体已成功应用于乳腺癌、脑胶质瘤、黑色素瘤等的治疗和研究。总体结果显示,线粒体可抑制肿瘤细胞的生长增殖。Elliott等从人乳腺上皮细胞MCF-12A分离出正常功能的线粒体并进行荧光染色,线粒体与乳腺癌细胞系MCF-7、T47D和MDA-MB-231共孵育后,通过抑制肿瘤细胞糖酵解途径,使细胞增殖速度降低、乳酸生成减少,并提高了肿瘤细胞对药物的敏感性[45]。此外,非癌细胞的线粒体进入到侵袭性的骨肉瘤细胞后,前者可逆转恶性癌细胞的致癌特性,例如降低在缺氧状态下的细胞增殖活力和侵袭能力、提高凋亡能力、降低对抗癌药的耐受性和在软琼脂中的集落形成能力。在动物体内实验中,从正常小鼠肝脏中分离的线粒体可显著抑制黑色素瘤的生长[28, 46]、明显延长荷瘤小鼠的生存期。其抗肿瘤机制与ATP耗竭、诱导细胞凋亡和坏死有关。另外,由于线粒体和细胞核存在密切的相互交流(Cross-talk) 现象,其中线粒体可反向调控细胞核的基因转录,因此线粒体治疗的抗肿瘤机制可能与线粒体-核的互作有关。微阵列分析表明线粒体可调节细胞周期蛋白D1、ras、src和p53等几种致癌途径,参与其抗肿瘤作用[47]。
此外,线粒体是对环境氧和酸碱度极为敏感的细胞器,在不同的环境中发挥促进细胞存活或诱导细胞死亡的两极功能。由于正常生理状态的体细胞以线粒体呼吸作为主要能源,因此补充线粒体可提高其能量供应以改善细胞功能。但在缺氧和酸性环境中的肿瘤细胞,补充外源线粒体则会导致ROS升高、诱导细胞死亡通路[28, 46-47]。线粒体这种环境响应性的特性将可能使其具有选择性抗肿瘤作用。
3 线粒体治疗存在的挑战3.1 线粒体的提取与纯化是线粒体应用的一个关键因素由于目前人们尚未掌握线粒体体外增殖技术,因此从富含线粒体的组织细胞中提取线粒体,为线粒体的主要来源。线粒体的提取方法一般为梯度离心、差速离心法和免疫磁珠分离法。离心法是最常用的方法。由于线粒体与内质网的在结构和功能上紧密联系,共同形成线粒体相关膜,在钙稳态、脂质代谢调节和自噬中起重要作用,因此在离心过程中,极易出现内质网的污染。此外,线粒体分离也可能被其他细胞器污染。
Macheiner等开发了抗TOM22磁珠,以提高分离线粒体的纯度[48]。TOM22是位于线粒体外膜的一个多亚基转位酶。抗TOM22磁珠用于线粒体的分离时,由于能够与线粒体外膜蛋白TOM22片段结合,因此可以提高线粒体分离的纯度。然而,线粒体外膜的结构可能因此受到影响而破损,导致分离的线粒体难以进入细胞,该方法提取纯化的线粒体可能已丧失功能。
为了得到有功能的线粒体,在线粒体提取过程中必须保证外膜和内膜的完整。电子显微镜观测是检查线粒体结构的主要方法,同时可生化测定线粒体的渗透性、氧消耗的呼吸速率、线粒体酶活性等。为使线粒体治疗更广泛的应用,建立规范化和标准化的线粒体提取纯化方法显得尤为迫切。
3.2 线粒体治疗的不良反应和免疫原性在细胞培养基中的过量或破裂的线粒体,可产生细胞毒性。在体内,破裂的线粒体可引起免疫和炎症反应。在小鼠异位心脏移植模型中,循环中的外源线粒体可激活内皮细胞产生炎性细胞因子和趋化因子,引起同种异体移植的排斥反应,造成早期的移植失败[49]。然而,在自体线粒体治疗心肌缺血的临床试验中,没有发现线粒体引起明显的炎症和免疫反应[41, 50]。因此,线粒体对免疫的影响可能与机体状态有关。
3.3 线粒体的来源及伦理学问题众所周知,哺乳动物线粒体主要来自母系遗传,随着年龄增加mtDNA突变逐渐增多并积累起来。mtDNA与核DNA不同,mtDNA缺乏蛋白质的保护和损伤修复机制,并且易受临近的ROS的攻击,因此线粒体更易积累突变,最终造成线粒体功能障碍[51]。而进行线粒体治疗所需求的健康线粒体,是mtDNA突变几乎没有或少至对线粒体功能没有影响的天然线粒体,这就对线粒体的来源有所要求。理论上认为,使用月龄越小的动物线粒体,在线粒体治疗中的效果越好。我们在进行线粒体抗肿瘤研究中,发现从青年小鼠(4周龄) 肝脏中提取的线粒体比从衰老小鼠(12月龄) 的线粒体在抗肿瘤方面作用更强[46]。此外,根据基因多态性设计个性化的线粒体治疗方案,或者定向修饰线粒体使其成为能够根据不同环境而调节自身功能的智能化线粒体,将可能达到更好的治疗效果。
应用线粒体治疗时需考虑伦理学问题。线粒体可从离体培养的细胞和动物体组织提取。根据动物组织和细胞可将线粒体的来源分为3个不同途径:(1) 从自体细胞培养或自体组织中分离的线粒体,此类线粒体治疗不涉及伦理学问题;(2) 从同种属动物的细胞和组织中提取的线粒体;(3) 从异种动物的细胞和组织中提取的线粒体。后两种来源的线粒体不仅涉及伦理学问题,而且还可能具有免疫原性。因此,在线粒体治疗时,首选从自体组织细胞中分离的线粒体。当一次性注射线粒体时,从患者自体中提取线粒体。但当需要多次、多器官的线粒体注射治疗时,则需在体外大量培养自体细胞以得到足够量的线粒体。
4 线粒体可以作为一种治疗药物吗?线粒体障碍在临床上可影响体内的多个系统,尤其是那些需要消耗大量能量的组织或器官。目前的研究结果表明,线粒体治疗的效果显著,且可比一般药物维持更长的时间;此外,自体的线粒体治疗尚未出现明显的不良反应,这些均说明线粒体在一定程度上具有成药性。但线粒体提取纯化的质量控制还有待标准化。
向细胞内补充线粒体往往会出现广泛的网络效应,其机制复杂且网点众多,这是由于线粒体本身是一种多功能的细胞器,但最终的表现则是明确的细胞存活或死亡的两极效果。需要说明的是,线粒体治疗的具体分子机制的相关问题仍有待解答,例如,线粒体通透组织屏障的方式、细胞对外源线粒体的相容性等,这些问题的解决将对揭示线粒体治疗的机制至关重要。尽管如此,作为一个新兴的方法,线粒体对疾病的治疗引人注目并值得期待。
参考文献
| [1] | Molnar MJ, Kovacs GG. Mitochondrial diseases. Handb Clin Neurol, 2017, 145: 147-155. |
| [2] | Wu ZH, Tantray I, Lim J, et al. MISTERMINATE mechanistically links mitochondrial dysfunction with proteostasis failure. Mol Cell, 2019, 75(4): 835-848.e8. DOI:10.1016/j.molcel.2019.06.031 |
| [3] | Ortiz JMP, Swerdlow RH. Mitochondrial dysfunction in Alzheimer's disease: Role in pathogenesis and novel therapeutic opportunities. Br J Pharmacol, 2019, 176(18): 3489-3507. DOI:10.1111/bph.14585 |
| [4] | Hirano M, Emmanuele V, Quinzii CM. Emerging therapies for mitochondrial diseases. Essays Biochem, 2018, 62(3): 467-481. DOI:10.1042/EBC20170114 |
| [5] | Loutre R, Heckel AM, Smirnova A, et al. Can mitochondrial DNA be CRISPRized: pro and contra. IUBMB Life, 2018, 70(12): 1233-1239. DOI:10.1002/iub.1919 |
| [6] | Wu ML, Liao LH, Jiang LH, et al. Liver-targeted Nano-MitoPBN normalizes glucose metabolism by improving mitochondrial redox balance. Biomaterials, 2019, 222: 119457. DOI:10.1016/j.biomaterials.2019.119457 |
| [7] | Sun C, Liu XX, Wang B, et al. Endocytosis-mediated mitochondrial transplantation: Transferring normal human astrocytic mitochondria into glioma cells rescues aerobic respiration and enhances radiosensitivity. Theranostics, 2019, 9(12): 3595-3607. DOI:10.7150/thno.33100 |
| [8] | Chien L, Liang MZ, Chang CY, et al. Mitochondrial therapy promotes regeneration of injured hippocampal neurons. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(9): 3001-3012. DOI:10.1016/j.bbadis.2018.06.012 |
| [9] | Pompei M, Pompei F. Overcoming bioethical, legal, and hereditary barriers to mitochondrial replacement therapy in the USA. J Assist Reprod Genet, 2019, 36(3): 383-393. DOI:10.1007/s10815-018-1370-7 |
| [10] | McCully JD, Cowan DB, Emani SM, et al. Mitochondrial transplantation: From animal models to clinical use in humans. Mitochondrion, 2017, 34: 127-134. DOI:10.1016/j.mito.2017.03.004 |
| [11] | Shi XS, Zhao M, Fu C, et al. Intravenous administration of mitochondria for treating experimental Parkinson's disease. Mitochondrion, 2017, 34: 91-100. DOI:10.1016/j.mito.2017.02.005 |
| [12] | Shi XX, Bai HY, Zhao M, et al. Treatment of acetaminophen-induced liver injury with exogenous mitochondria in mice. Tranl Res, 2018, 196: 31-41. DOI:10.1016/j.trsl.2018.02.003 |
| [13] | Fu AL, Shi XX, Zhang HJ, et al. Mitotherapy for fatty liver by intravenous administration of exogenous mitochondria in male mice. Fron Pharmacol, 2017, 8: 241. DOI:10.3389/fphar.2017.00241 |
| [14] | Zhao ZZ, Yu ZY, Hou YX, et al. Improvement of cognitive and motor performance with mitotherapy in aged mice. Int J Biol Sci, 2020, 16(5): 849-858. DOI:10.7150/ijbs.40886 |
| [15] | Patel D, Rorbach J, Downes K, et al. Macropinocytic entry of isolated mitochondria in epidermal growth factor-activated human osteosarcoma cells. Sci Rep, 2017, 7: 12886. DOI:10.1038/s41598-017-13227-0 |
| [16] | Kitani T, Kami D, Matoba S, et al. Internalization of isolated functional mitochondria: involvement of macropinocytosis. J Cell Mol Med, 2014, 18(8): 1694-1703. DOI:10.1111/jcmm.12316 |
| [17] | Pacak CA, Preble JM, Kondo H, et al. Actin-dependent mitochondrial internalization in cardiomyocytes: evidence for rescue of mitochondrial function. Biol Open, 2015, 4(5): 622-626. DOI:10.1242/bio.201511478 |
| [18] | Al Amir Dache Z, Otandault A, Tanos R, et al. Blood contains circulating cell-free respiratory competent mitochondria. FASEB J, 2020, 34(3): 3616-3630. DOI:10.1096/fj.201901917RR |
| [19] | Tuma PL, Hubbard AL. Transcytosis: crossing cellular barriers. Physiol Rev, 2003, 83(3): 871-932. DOI:10.1152/physrev.00001.2003 |
| [20] | Chen XL, Li J, Hou JJ, et al. Mammalian mitochondrial proteomics: insights into mitochondrial functions and mitochondria-related diseases. Expert Rev Proteomics, 2010, 7(3): 333-345. DOI:10.1586/epr.10.22 |
| [21] | Koren E, Torchilin VP. Drug carriers for vascular drug delivery. IUBMB Life, 2011, 63(8): 586-595. DOI:10.1002/iub.496 |
| [22] | Kuo YC, Chung CY. Transcytosis of CRM197-grafted polybutylcyanoacrylate nanoparticles for delivering zidovudine across human brain-microvascular endothelial cells. Colloids Surf B Biointerfaces, 2012, 91: 242-249. DOI:10.1016/j.colsurfb.2011.11.007 |
| [23] | Simionescu M, Popov D, Sima A. Endothelial transcytosis in health and disease. Cell Tissue Res, 2009, 335(1): 27-40. DOI:10.1007/s00441-008-0688-3 |
| [24] | Kesner EE, Saada-Reich A, Lorberboum-Galski H. Characteristics of mitochondrial transformation into human cells. Sci Rep, 2016, 6: 26057. DOI:10.1038/srep26057 |
| [25] | Wang HB, Chen LG, Sun XC, et al. Intracellular localisation of proteins to specific cellular areas by nanocapsule mediated delivery. J Drug Target, 2017, 25(8): 724-733. DOI:10.1080/1061186X.2017.1323908 |
| [26] | Farnezi HCM, Goulart ACX, Dos Santos A, et al. Three-parent babies: mitochondrial replacement therapies. JBRA Assist Reprod, 2020, 24(2): 189-196. |
| [27] | Fu AL. Mitotherapy as a novel therapeutic strategy for mitochondrial diseases. Curr Mol Pharmacol, 2020, 13(1): 41-49. DOI:10.2174/1874467212666190920144115 |
| [28] | Fu AL, Hou YX, Yu ZY, et al. Healthy mitochondria inhibit the metastatic melanoma in lungs. Int J Biol Sci, 2019, 15(12): 2707-2718. DOI:10.7150/ijbs.38104 |
| [29] | Kim Y, Vadodaria KC, Lenkei Z, et al. Mitochondria, metabolism, and redox mechanisms in psychiatric disorders. Antioxid Redox Signal, 2019, 31(4): 275-317. DOI:10.1089/ars.2018.7606 |
| [30] | Annis S, Fleischmann Z, Khrapko M, et al. Quasi-Mendelian paternal inheritance of mitochondrial DNA: A notorious artifact, or anticipated behavior?. Proc Natl Acad Sci USA, 2019, 116(30): 14797-14798. DOI:10.1073/pnas.1821436116 |
| [31] | Edwards AC, Aggen SH, Cai N, et al. Chronicity of depression and molecular markers in a large sample of Han Chinese women. Depress Anxiety, 2016, 33(11): 1048-1054. DOI:10.1002/da.22517 |
| [32] | 陈伟才, 欧文斌. 丙酮酸脱氢酶活性缺失与疾病发生的研究进展. 生命的化学, 2017, 37(5): 751-760. Chen WC, Ou WB. Advances of pyruvate dehydrogenase inactivation and disease occurrence. Chem Life, 2017, 37(5): 751-760 (in Chinese). |
| [33] | Chang CY, Liang MZ, Chen LY. Current progress of mitochondrial transplantation that promotes neuronal regeneration. Transl Neurodegener, 2019, 8: 17. DOI:10.1186/s40035-019-0158-8 |
| [34] | Smith GM, Gallo G. The role of mitochondria in axon development and regeneration. Dev Neurobiol, 2018, 78(3): 221-237. DOI:10.1002/dneu.22546 |
| [35] | Zhang ZQ, Ma Z, Yan CY, et al. Muscle-derived autologous mitochondrial transplantation: A novel strategy for treating cerebral ischemic injury. Behav Brain Res, 2019, 356: 322-331. DOI:10.1016/j.bbr.2018.09.005 |
| [36] | Robicsek O, Ene HM, Karry R, et al. Isolated mitochondria transfer improves neuronal differentiation of schizophrenia-derived induced pluripotent stem cells and rescues deficits in a rat model of the disorder. Schizophr Bull, 2018, 44(2): 432-442. DOI:10.1093/schbul/sbx077 |
| [37] | Gollihue JL, Patel SP, Eldahan KC, et al. Effects of mitochondrial transplantation on bioenergetics, cellular incorporation, and functional recovery after spinal cord injury. J Neurotrauma, 2018, 35(15): 1800-1818. DOI:10.1089/neu.2017.5605 |
| [38] | Kang EJ, Wu J, Gutierrez N, et al. Mitochondrial replacement in human oocytes carrying pathogenic mitochondrial DNA mutations. Nature, 2016, 540(7632): 270-275. DOI:10.1038/nature20592 |
| [39] | Hudson G, Takeda Y, Herbert M. Reversion after replacement of mitochondrial DNA. Nature, 2019, 574(7778): E8-E11. DOI:10.1038/s41586-019-1623-3 |
| [40] | Masuzawa A, Black KM, Pacak CA, et al. Transplantation of autologously derived mitochondria protects the heart from ischemia-reperfusion injury. Am J Physiol Heart Circ Physiol, 2013, 304(7): H966-H982. DOI:10.1152/ajpheart.00883.2012 |
| [41] | Blitzer D, Guariento A, Doulamis IP, et al. Delayed transplantation of autologous mitochondria for cardioprotection in a porcine model. Ann Thorac Surg, 2020, 109(3): 711-719. DOI:10.1016/j.athoracsur.2019.06.075 |
| [42] | Bertero E, Maack C, O'Rourke B. Mitochondrial transplantation in humans: "magical" cure or cause for concern?. J Clin Invest, 2018, 128(12): 5191-5194. DOI:10.1172/JCI124944 |
| [43] | Zhu LP, Zhang JW, Zhou J, et al. Mitochondrial transplantation attenuates hypoxic pulmonary hypertension. Oncotarget, 2016, 7(31): 48925-48940. DOI:10.18632/oncotarget.10596 |
| [44] | 汤春铃, 向仲怀, 崔红娟. 线粒体功能异常与肿瘤的生成. 生物工程学报, 2013, 29(11): 1548-1557. Tang CL, Xiang ZH, Cui HJ. Essential role of mitochondria in tumorigenesis. Chin J Biotech, 2013, 29(11): 1548-1557 (in Chinese). |
| [45] | Jiang XP, Elliott RL, Head JF. Exogenous normal mammary epithelial mitochondria suppress glycolytic metabolism and glucose uptake of human breast cancer cells. Breast Cancer Res Treat, 2015, 153(3): 519-529. DOI:10.1007/s10549-015-3583-0 |
| [46] | 王庆华, 付琛, 李晓荣, 等. 外源线粒体抑制小鼠皮下黑色素瘤的生长及机制研究. 药学学报, 2019, 54(3): 463-468. Wang QH, Fu C, Li XR, et al. Mechanism of melanoma growth inhibition by exogenous mitochondria. Acta Pharm Sin, 2019, 54(3): 463-468 (in Chinese). |
| [47] | Kaipparettu BA, Ma YW, Park JH, et al. Crosstalk from non-cancerous mitochondria can inhibit tumor properties of metastatic cells by suppressing oncogenic pathways. PLoS ONE, 2013, 8(5): e61747. DOI:10.1371/journal.pone.0061747 |
| [48] | Macheiner T, Fengler VHI, Agreiter M, et al. Magnetomitotransfer: An efficient way for direct mitochondria transfer into cultured human cells. Sci Rep, 2016, 6: 35571. DOI:10.1038/srep35571 |
| [49] | Lin LW, Xu H, Bishawi M, et al. Circulating mitochondria in organ donors promote allograft rejection. Am J Transplant, 2019, 19(7): 1917-1929. DOI:10.1111/ajt.15309 |
| [50] | Moskowitzova K, Liu K, Shin B, et al. Mitochondrial transplantation prolongs cold preservation time in murine cardiac transplantation. J Heart Lung Transplantat, 2018, 37(4S): S22-S23. |
| [51] | Gustafsson CM, Falkenberg M, Larsson NG. Maintenance and expression of mammalian mitochondrial DNA. Annu Rev Biochem, 2016, 85: 133-160. DOI:10.1146/annurev-biochem-060815-014402 |
