

1. 厦门大学 公共卫生学院, 福建 厦门 361102;
2. 国家传染病诊断试剂与疫苗工程技术研究中心 (厦门大学), 福建 厦门 361102
收稿日期:2020-04-28;接收日期:2020-07-29;网络出版时间:2020-08-13
基金项目:国家传染病重大专项(No. 2017ZX10302201-002-003),福建省自然科学基金(No. 2019J02004)资助
摘要:人源单克隆抗体具有免疫原性低、半衰期长等优势, 成为了体内应用中不可或缺的生物制剂。人类抗体库为人源单克隆抗体的制备提供了丰富的来源, 人B细胞永生化是获得人类抗体库的潜在有效方法, 可应用于人源单克隆抗体的制备。由于各平台均有亟待解决的问题, 基于人B细胞永生化的抗体制备尚局限在实验室研究阶段, 且目前尚缺乏一篇系统综述以明确现有的人B细胞永生化抗体制备平台的优劣及其可行性分析。因此文中就基于人B细胞永生化方法制备人源单克隆抗体的研究展开综述, 以期为人源单克隆抗体制备技术的进一步发展提供参考。
关键词:B细胞永生化人源单克隆抗体体外诱导培养囊泡
Advances in immortalization of human B cells
Zhouyue Zhong1,2, Siyuan Yu1,2, Shengxiang Ge1,2


1. School of Public Health, Xiamen University, Xiamen 361102, Fujian, China;
2. National Institute of Diagnostics and Vaccine Development in Infectious Diseases (Xiamen University), Xiamen 361102, Fujian, China
Received: April 28, 2020; Accepted: July 29, 2020; Published: August 13, 2020
Supported by: National Key Program for Infectious Disease of China (No. 2017ZX10302201-002-003), Science and Technology Development Project of Fujian Province, China (No. 2019J02004)
Corresponding author: Shengxiang Ge. Tel: +86-592-2183111; E-mail: sxge@xmu.edu.cn.
Abstract: With the advantages of low immunogenicity and long half-life, human monoclonal antibody has become an indispensable biological agent in vivo. Immortalization of human B cells is a potential and effective method to obtain natural human antibody library, which can provide a rich source for the preparation of human monoclonal antibodies. As there are urgent problems to be solved in each platform, the preparation of antibodies based on human B cell immortalization is still limited to the laboratory research stage. At present, there is a lack of a systematic review to clarify the advantages and disadvantages of the existing human B cell immortalization antibody preparation platform and its feasibility analysis. This paper reviews the research on the preparation of human monoclonal antibody based on human B cells immortalization, and describes an in vitro cell culture method, in which hCD40L vesicles are used instead of feeder cells, in order to provide references for the further development of human monoclonal antibody preparation technology.
Keywords: B cell immortalizationhuman monoclonal antibodyin vitro induction culturevesicles
人源单克隆抗体(Human monoclonal antibody, HuMAb)是指完全由人类基因编码表达的单克隆抗体, 已经成为未来抗体发展的主要方向[1]。HuMAb具有更丰富的表位、更低的免疫原性、更长的半衰期、更佳的生物活性, 在体内应用中表现良好, 如体内诊断、传染病预防、抗体疗法和疾病预后判断等。HuMAb制备过程中还可发掘出高效或/和广泛交叉反应的“超级抗体”, 其具有治疗和预防多种病毒感染及其所致疾病的潜力, 包括抗原性高度可变的病毒和新兴的或具有大流行潜力的病毒[2]。自SARS-CoV-2引起的新冠肺炎(COVID-19)疫情暴发以来, 全球面临着巨大的公共卫生安全威胁, 诊断试剂、抗病毒药物和疫苗的研发迫在眉睫, HuMAb制备技术可以为高效建立新型病毒疫情快速响应平台提供有力的支持。
1 HuMAb制备技术目前, HuMAb的制备主要基于4种技术, 分别是转基因动物、抗体库展示、单细胞克隆和B细胞永生化(表 1), 各技术可独立进行或者联合使用。
表 1 全人源单克隆抗体制备技术Table 1 Human monoclonal antibody preparation technology
| Technology | The main source of B cells | Main preparation methods | Advantage | Limitation | Reference |
| Transgenic animals | Humanized mouse spleen cells | Hybridoma technique | Technical maturity | Longscreening period; differences between transgenic animal immunity and humanacquired immunity. | [8-12] |
| Antibody library display | Natural/immune/ random combination antibody library | Phage display | Short screening period; large antibody capacity | Antigens must be known; antibody fragments are produced by random pairing of variable regions ofheavy and light chains of immunoglobulins cloned respectively. | [4, 13-15] |
| Single B cell cloning | Plasmablasts/ plasma cells from peripheral blood | FCM, RT-PCR | Short screening period | Limited by B cell sorting technology and primer specificity; low throughput; labor-intensive | [16-20] |
| B cells immortalization | Memory B cells fromperipheral blood | EBV-mediated transformation | Short screening period; Screening for antibodies targeting to unknown antigens | Inefficient immortalization transformation | [21-23] |
表选项
通过转基因动物和抗体库展示技术制备HuMAb已有诸多临床转化的成功实例, 但这类抗体不能称之为真正的全人源抗体。小鼠的免疫系统和人类存在很大差异[3], 抗体的亲和成熟、型别转换与人类有差异, 无法代表天然人源抗体库。抗体库展示技术利用DNA重组技术将抗体信息展示于特定载体上[4], 由于抗体片段是分别由克隆的免疫球蛋白重链和轻链可变区的随机配对产生的[5], 因此也不能真实反映生理抗体信息。
直接从人B细胞中获得目的抗体是一种高效快捷的方法, 因为前期无需抗原制备和免疫过程, 且天然的抗体库比随机配对的抗体文库具有更高的敏感性和特异性[6], 从受感染者中制备的HuMAb可以提供有关人抗体表位的信息, 这些表位对于疫苗的开发以及潜在的治疗应用至关重要[7]。虽然抗体库展示、单细胞克隆和B细胞永生化技术均可利用人B细胞获得HuMAb, 但三者差异明显。抗体库展示技术的主要局限如前所述, 单B细胞克隆需要先进行繁琐的抗体异源重组表达后才可进行鉴定筛选, B细胞永生化可先进行功能鉴定, 直接对抗原特异性阳性的细胞池进行克隆化, 与前者相比目的性更强、工作量小、筛选周期更短。
综上, 与传统方式相比, 人B细胞产生的天然抗体经过人类免疫系统选择, 是HuMAb的最佳来源, 而B细胞永生化则是获得HuMAb的潜在有效方法。通过B细胞永生化技术获得的单克隆抗体在生产制备和应用方面具有以下优势:1)筛选周期短, 可实现抗体的快速筛选;2)具有更低的免疫原性, 体内应用良好;3)可以获得更多高亲和力抗体;4)可以从受感染者中获得针对未知抗原的抗体, 应对突发疫情。
2 人B细胞永生化方法使离体培养B细胞有效增殖和活化是获得天然人源抗体最直接的方式, 然而由于B细胞的数量少、分泌抗体量不足以及体外培养存活时间短、仅能进行有限增殖等问题[24], 限制了下游鉴定和分离操作的进行。目前, B细胞永生化方法主要有人类B细胞杂交瘤技术、EBV转化、慢病毒介导的遗传修饰以及CD40L联合多种细胞因子的体外诱导培养等(图 1), 各方法可单独或并行使用。
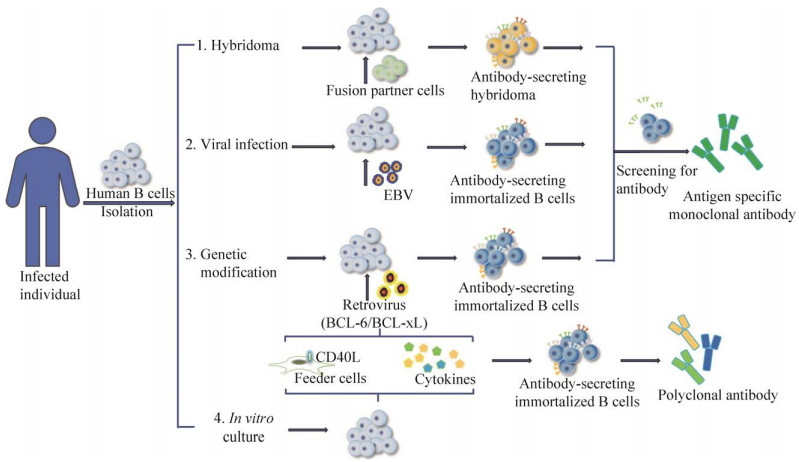 |
| 图 1 人B细胞永生化制备人源抗体的方法示意图 Fig. 1 Schematic of human antibody produced by B cell immortalization methods. |
| 图选项 |
2.1 制备人-鼠/人-人杂交瘤细胞将B细胞与骨髓瘤细胞融合是获得分泌抗体的永生化B细胞最常用的方法。早期通过利用人B细胞和小鼠骨髓瘤细胞融合获得人-鼠异源性杂交瘤细胞, 但因建立细胞株困难而且产量低, 且在传代过程中很可能丢失某些人类染色体, 存在不稳定性[25]。研究者们广泛探索了可替代的融合伴侣细胞, 这些融合伴侣细胞主要有鼠-人嵌合型骨髓瘤细胞系、人骨髓瘤细胞、人骨髓瘤细胞衍生细胞系和人淋巴母样细胞系[20, 26-29]。但是用这类融合伴侣细胞产生的人-人杂交瘤细胞不能有效兼顾产量和稳定性需求[20, 29], 且杂交瘤产生的免疫球蛋白的类型受亲代细胞特性的强烈影响, 因此获得的杂交瘤分泌的抗体类型单一[26]。影响融合效率的另一个重要因素是融合方法, 传统的PEG融合法操作简单、成本低, 但是效率低下;电融合是最适合产生杂交瘤的方式, 但是电融合易导致大量的细胞死亡[30]。
目前人类杂交瘤技术的相关方法存在着融合效率低、亚克隆易丢失、工作量大、抗体产量低等缺陷[15], 应用于人类抗体的产生极为困难, 无法成为挖掘人类抗体库的首选方法。
2.2 病毒感染维持增殖细胞中端粒稳态端粒是保持染色体的完整性和控制细胞分裂周期的重要结构, 端粒维持机制可以抵消DNA复制过程中端粒缩短以及由此引发的DNA损伤反应、细胞周期停滞和凋亡[31], EBV基于端粒维持机制的激活而使宿主细胞永生化。在EBV诱导B细胞永生化的早期和晚期, 端粒酶依赖和非依赖的端粒维持通路在感染细胞中都被激活[31-33]。利用EBV转化的方法, 研究者已成功获得了鉴定识别HIV[34]、H1N1流感病毒[35]、H5N1流感病毒[36]、RSV[37]、SARS-CoV[24]和DENV[38]的人类中和单抗。此外, 有研究报道在未发生淋巴瘤的HBV慢性感染患者的PBMC中建立了具有无限增殖潜力的B细胞[22], 另有研究发现SV40可有效感染人B细胞并明显延长其体外存活时间(观察至100 d)[39], 这些则提示了SV40、HBV感染可能成为转化B细胞永生化的潜在方法。
病毒一般仅感染特定的宿主细胞, 使用EBV介导的B细胞永生化效率低[40], 需要筛选大量的B细胞以获得具有所需特异性的非常罕见的B细胞克隆, 且B细胞的长期生长和永生化可能与染色体畸变有关[41], 细胞在基因突变过程中往往伴随细胞表型的改变, 如发生肿瘤细胞转化[42]、细胞生长停滞[21], 或是传代过程中表现出染色体的不稳定性[43], 这均导致难以进行B细胞单克隆化筛选。不仅如此, 用于生成体内应用抗体的细胞不能含EBV和其他人类病毒, 基于病毒转化的人类抗体的分离纯化难度更高。
2.3 遗传修饰以促进抗凋亡因子表达原癌基因BCL-6属于抗细胞凋亡家族, 具有转录抑制功能, 可促进B细胞增殖, 同时抑制B细胞向浆细胞分化[44], BCL-xL作为BCL-2家族成员蛋白, 通过与促凋亡蛋白的拮抗作用从而抑制细胞凋亡[45]。Kwakkenbos等利用逆转录病毒转导系统将BCL-6和BCL-xL基因导入从人外周血单个核细胞(Peripheral blood mononuclear cell, PBMC)分选的CD27+记忆B细胞中, 创建了B细胞永生化平台——AIMSelect, 并成功进行了多个物种B细胞永生化[46-48]。类似地, Caeser等发现BCL-2与MYC或BCL-6共转导可使GC B细胞长期扩增和存活[24]。FOXP1可直接抑制各种促凋亡基因的转录, 并与CD40和NF-κB信号传导合作, 通过抑制caspase依赖性凋亡来促进B细胞扩增[49], FOXP1还可部分通过控制BCL-xL表达介导成熟B细胞存活[50]。此外, miRNAs介导的细胞转化也可能实现B细胞永生化, 某些宿主和病毒编码的人类miRNA直系同源基因控制着B细胞的细胞生长和存活[51], 这类新发现的刺激B细胞生长的miRNA可在不久的将来作为永生的手段进行尝试。
通过遗传修饰的方式可促进某些抗凋亡因子的表达从而获得永生化B细胞, 但是这种方法制备抗体的效率低, 主要是因为B细胞是一种难转导的原代细胞, 在为数不多的永生化B细胞中, 最终获得阳性克隆的数量极少。
2.4 体外诱导B细胞自发永生化转化CD40-CD40L是特异性免疫反应中重要的共刺激分子, 其在调节初级和/或次级体液免疫反应后的B淋巴细胞活化中起作用[52]。通过向生长培养基中添加CD40L和细胞因子, 可以促进B细胞存活和增殖, 延长体外培养的时间。Banchereau等首次证明CD40与IL-4的交联可诱导人B淋巴细胞进入有限的增殖状态[53], 以这种方式获得的长寿命B淋巴细胞可以分泌IgG、IgM和IgA[54]。
随着B细胞离体培养技术研究的不断深入, 不依赖病毒感染和遗传修饰的体外培养诱导B细胞永生化已成为可能。Wiesner等提出了一种体外诱导人B细胞永生化的方法。在环孢素A和IL-4的存在下, PBMC与过表达人CD40L的饲养细胞共同培养, 获得永生化的B细胞, 成功观察了1 650 d, 且B细胞具有恒定的表型, 随着时间的推移稳定或增加了其端粒长度[41]。Neron等也基于CD40-CD40L相互作用模型, 外源添加多种细胞因子, 在大约50 d内, 从PBMC中分选的IgG+和IgA+记忆B细胞发生了1×106倍扩增, 并可用于人多克隆IgG生产[55]。Haniuda等提出了体外诱导小鼠生发中心B细胞培养系统[56-57], 该系统可诱导幼稚B细胞大规模扩增, 成为具有生发中心B细胞样表型的细胞(iGB), 且不同细胞因子的活化刺激作用可决定iGB细胞的发育命运, 外源添加IL-4可使其发育为记忆B细胞, 外源添加IL-21则引导其发育为长寿命浆细胞, 这为人类B细胞的体外长期培养提供了借鉴意义。
不依赖病毒感染或者遗传修饰的B细胞体外诱导培养操作也可以使B细胞永生化或者近永生化, 具有制备HuMAb的应用潜力。但是通过体外刺激培养诱导B细胞自发进行永生化转化, 涉及到CD40L和多种细胞因子的协调作用, 而相关作用机制尚不明朗, 在初始B细胞种类的选择和培养条件中各组分的形式(可溶性、膜结合型等)、添加量、添加时机等方面还需要进行更深度的探索。
以CD40L为例, 已有研究表明, 不同形式的CD40L的生物学活性有差异, 总体来说, CD40L单克隆抗体<可溶性CD40L重组蛋白<膜结合型CD40L, 其中, 随着稳定多聚体的增加, 可溶性重组CD40L蛋白的生物学活性也相应提高[58-59]。但目前多数研究仍旧采用表达CD40L的饲养细胞进行B细胞离体培养[21, 60-61]。
笔者实验室研究发现, 传统的B细胞体外培养条件中, 经X射线辐照饲养细胞层后饲养细胞的状态存在不稳定性, 对B细胞的离体培养造成明显影响, 辐照强度不足时饲养细胞会与B细胞竞争营养, 饲养细胞代谢产物可能影响B细胞生长, 而辐照过度则会失去维持B细胞生长的效果, 因此, 笔者实验室致力于寻找一种膜结合型CD40L展示方法以期替代饲养细胞在B细胞培养中的功能。已有研究利用细胞膜囊泡展示功能性蛋白[62-63], 受到这些研究的启发, 目前笔者实验室已构建完成人CD40L囊泡, 其可通过外源添加的方式取代饲养细胞支持B细胞体外培养, 同时通过优化及固定制备方案、使用分析型流式细胞仪并加入流式计数荧光微球对囊泡进行绝对计数以确定添加量等方式, 解决了之前存在的培养条件不稳定的问题(图 2)。
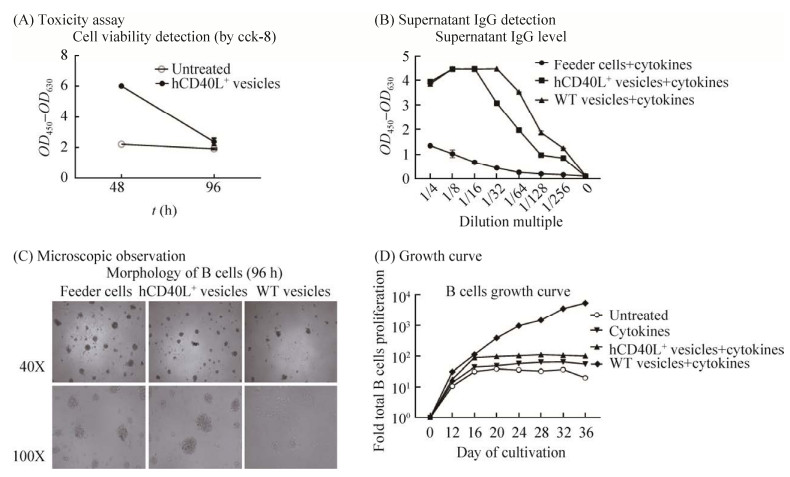 |
| 图 2 人CD40L囊泡对B细胞体外培养的影响 Fig. 2 Effect of hCD40L+ vesicles on B cell culture in vitro. (A) Vesicle toxicity assay: hCD40L+ vesicles were non-toxic to B cells, and the activity of B cells in the vesicle group was higher than that in the untreated group, P < 0.001. Error bars indicate s (B) Supernatant of IgG detection: there was no significant difference in IgG secretion in the supernatant between the hCD40L+ vesicles group and the feeder cells group. (C) Microscopic observation: there was no significant difference in cell growth between the hCD40L+ vesicles group and the feeder cells group, P=0.052 6, and was better than that in the negative vesicle group, P < 0.001. Error bars indicate s (D) B cells growth curve: hCD40L+ vesicles can effectively maintain the survival and proliferation of B cells in vitro. |
| 图选项 |
3 总结与展望直接从分泌天然抗体的人B细胞中获得HuMAb, 是理论上简单有效但技术上存在困难的方法, 因为B细胞在体外培养的寿命有限, 且无法无限增殖, 在细胞数量和抗体分泌量极少的情况下, 难以检测和分离获得抗原特异性B细胞, 而B细胞永生化则从根本上解决了细胞丰度低的问题, 为后续鉴定和分离操作提供了有利条件。
基于B细胞永生化技术的抗体研发平台可以在难以获得免疫原和未获得抗体时进行功能性鉴定和筛选, 目的明确、工作量更小、筛选周期短, 其在疾病的治疗、预防及体内诊断方面具有良好的应用潜力, 特别是肿瘤、慢性病和未知传染性疾病。基于B细胞永生化技术制备HuMAb虽有若干种方法, 但仍停留在实验室研究阶段(表 2)。
表 2 人B细胞永生化方法比较Table 2 Comparison of methods for human B cell immortalization
| Methods | Advantage | Limitation | Application inpreparation of Human antibody | Reference |
| Hybridoma technique | Mature technology andsimple operation | Low fusion efficiency; subclones are easy to lose; high labor intensity | HIV; Influenza Virus | [7, 20, 29, 42, 64] |
| Viral infection | Mature technology | A risk of malignant transformation; generational instability; a risk of infection | HIV; H1N1; H5N1; RSV; SARS-CoV; DENV | [21, 31-32, 35-36, 24, 38] |
| Genetic modification | Stable subclone | Inefficient transduction | RSV; Parechovirus; RA | [46, 65-66] |
| In vitro induction culture | Independent of virusinfection and genetic modification | Lack of mechanism research; long time of immortalization transformation | Human polyclonal antibody | [55-56, 67] |
表选项
综上所述, 理想的B细胞永生化技术应该具备高永生化效率和高筛选效率两个重要特征。已经有研究表明, 人B细胞可以仅通过外部刺激的方式自发进行永生转化, 这种方式不依赖癌病毒感染和基因操纵, 在操作简便性和安全性方面都更具优势。而微流控平台、单细胞分析、荧光光谱法、细胞表面荧光免疫吸附测定等先进技术的
涌入、发展和联合为分离抗原特异性B细胞提供了更高效的方法。
随着B细胞永生化研究的不断深入和技术的不断成熟, 分泌天然人抗的永生化B细胞将进一步为制备HuMAb奠定基础, 使其在生物医药研究和临床应用中发挥更广泛的作用。
参考文献
| [1] | Grilo AL, Mantalaris A. The increasingly human and profitable monoclonal antibody market. Trends Biotechnol, 2019, 37(1): 9-16. DOI:10.1016/j.tibtech.2018.05.014 |
| [2] | Walker LM, Burton DR. Passive immunotherapy of viral infections: 'super-antibodies' enter the fray. Nat Rev Immunol, 2018, 18(5): 297-308. DOI:10.1038/nri.2017.148 |
| [3] | Mestas J, Hughes CCW. Of mice and not men: differences between mouse and human immunology. J Immunol, 2004, 172(5): 2731-2738. DOI:10.4049/jimmunol.172.5.2731 |
| [4] | Dal Ferro M, Rizzo S, Rizzo E, et al. Phage display technology for human monoclonal antibodies. Methods Mol Biol, 2019, 1904: 319-338. |
| [5] | Wilson PC, Andrews SF. Tools to therapeutically harness the human antibody response. Nat Rev Immunol, 2012, 12(10): 709-719. DOI:10.1038/nri3285 |
| [6] | Adler AS, Bedinger D, Adams MS, et al. A natively paired antibody library yields drug leads with higher sensitivity and specificity than a randomly paired antibody library. mAbs, 2018, 10(3): 431-443. DOI:10.1080/19420862.2018.1426422 |
| [7] | Kubota-Koketsu R, Mizuta H, Oshita M, et al. Broad neutralizing human monoclonal antibodies against influenza virus from vaccinated healthy donors. Biochem Biophys Res Commun, 2009, 387(1): 180-185. DOI:10.1016/j.bbrc.2009.06.151 |
| [8] | Osborn MJ, Ma B, Avis S, et al. High-affinity IgG antibodies develop naturally in Ig-knockout rats carrying germline human IgH/Igκ/Igλ loci bearing the rat CH region. J Immunol, 2013, 190(4): 1481-1490. DOI:10.4049/jimmunol.1203041 |
| [9] | Matsushita H, Sano A, Wu H, et al. Triple immunoglobulin gene knockout transchromosomic cattle: bovine lambda cluster deletion and its effect on fully human polyclonal antibody production. PLoS ONE, 2014, 9(3): e90383. DOI:10.1371/journal.pone.0090383 |
| [10] | Flisikowska T, Thorey IS, Offner S, et al. Efficient immunoglobulin gene disruption and targeted replacement in rabbit using zinc finger nucleases. PLoS ONE, 2011, 6(6): e21045. DOI:10.1371/journal.pone.0021045 |
| [11] | Ching KH, Collarini EJ, Abdiche YN, et al. Chickens with humanized immunoglobulin genes generate antibodies with high affinity and broad epitope coverage to conserved targets. mAbs, 2018, 10(1): 71-80. DOI:10.1080/19420862.2017.1386825 |
| [12] | Chen WC, Murawsky CM. Strategies for generating diverse antibody repertoires using transgenic animals expressing human antibodies. Front Immunol, 2018, 9: 460. DOI:10.3389/fimmu.2018.00460 |
| [13] | Lanzavecchia A, Corti D, Sallusto F. Human monoclonal antibodies by immortalization of memory B cells. Curr Opin Biotechnol, 2007, 18(6): 523-528. DOI:10.1016/j.copbio.2007.10.011 |
| [14] | Kennedy PJ, Oliveira C, Granja PL, et al. Monoclonal antibodies: technologies for early discovery and engineering. Crit Rev Biotechnol, 2018, 38(3): 394-408. DOI:10.1080/07388551.2017.1357002 |
| [15] | Bradbury AR, Sidhu S, Dubel S, et al. Beyond natural antibodies: the power of in vitro display technologies. Nat Biotechnol, 2011, 29(3): 245-254. DOI:10.1038/nbt.1791 |
| [16] | Fitzgerald V, Leonard P. Single cell screening approaches for antibody discovery. Methods, 2017, 116: 34-42. DOI:10.1016/j.ymeth.2016.11.006 |
| [17] | Seah YFS, Hu HX, Merten CA. Microfluidic single-cell technology in immunology and antibody screening. Mol Aspects Med, 2018, 59: 47-61. DOI:10.1016/j.mam.2017.09.004 |
| [18] | Lin ZH, Chiang NY, Chai N, et al. In vivo antigen-driven plasmablast enrichment in combination with antigen-specific cell sorting to facilitate the isolation of rare monoclonal antibodies from human B cells. Nat Protoc, 2014, 9(7): 1563-1577. DOI:10.1038/nprot.2014.104 |
| [19] | Wrammert J, Smith K, Miller J, et al. Rapid cloning of high-affinity human monoclonal antibodies against influenza virus. Nature, 2008, 453(7195): 667-671. DOI:10.1038/nature06890 |
| [20] | Misaki R, Fukura N, Kajiura H, et al. Recombinant production and characterization of human anti-influenza virus monoclonal antibodies identified from hybridomas fused with human lymphocytes. Biologicals, 2016, 44(5): 394-402. DOI:10.1016/j.biologicals.2016.05.006 |
| [21] | McFadden K, Hafez AY, Kishton R, et al. Metabolic stress is a barrier to Epstein-Barr virus-mediated B-cell immortalization. Proc Natl Acad Sci USA, 2016, 113(6): E782-E790. DOI:10.1073/pnas.1517141113 |
| [22] | Qi XY, Gui X, Zhuang K. Establishment and characterization of HBV-associated B lymphocytes with an immortalization potential. PLoS ONE, 2019, 14(5): e0217161. DOI:10.1371/journal.pone.0217161 |
| [23] | Traggiai E, Becker S, Subbarao K, et al. An efficient method to make human monoclonal antibodies from memory B cells: potent neutralization of SARS coronavirus. Nat Med, 2004, 10(8): 871-875. DOI:10.1038/nm1080 |
| [24] | Caeser R, Di Re M, Krupka JA, et al. Genetic modification of primary human B cells to model high-grade lymphoma. Nat Commun, 2019, 10: 4543. DOI:10.1038/s41467-019-12494-x |
| [25] | Tatzber F, Pursch E, Resch U, et al. Cultivation and immortalization of human B-cells producing a human monoclonal IgM antibody binding to MDA-LDL: further evidence for formation of atherogenic MDA-LDL adducts in humans in vivo. Oxid Med Cell Longev, 2017, 2017: 6047142. |
| [26] | Shirahata S, Katakura Y, Teruya K. Cell hybridization, hybridomas, and human hybridomas. Methods Cell Biol, 1998, 57: 111-145. |
| [27] | Uherková L, Van?urová I, Vyhlídalová I, et al. Novel human multiple myeloma cell line UHKT-893. Leuk Res, 2013, 37(3): 320-326. DOI:10.1016/j.leukres.2012.12.004 |
| [28] | Kaseko G, Liu M, Li Q, et al. Novel human partner cell line for immortalisation of rare antigen-specific B cells in mAb development. BMC Proc, 2011, 5 Suppl 8(Suppl 8): P130. DOI:10.1186/1753-6561-5-S8-P130 |
| [29] | Soni P, Yasuhara A, Takenaga T, et al. Evaluation of the fusion partner cell line SPYMEG for obtaining human monoclonal antibodies against influenza B virus. J Vet Med Sci, 2018, 80(6): 1020-1024. DOI:10.1292/jvms.18-0146 |
| [30] | Kato M, Sasamori E, Chiba T, et al. Cell activation by CpG ODN leads to improved electrofusion in hybridoma production. J Immunol Methods, 2011, 373(1/2): 102-110. |
| [31] | Kamranvar SA, Masucci MG. Regulation of telomere homeostasis during epstein-barr virus infection and immortalization. Viruses, 2017, 9(8): 217. DOI:10.3390/v9080217 |
| [32] | Sugimoto M, Tahara H, Ide T, et al. Steps involved in immortalization and tumorigenesis in human B-lymphoblastoid cell lines transformed by Epstein-Barr virus. Cancer Res, 2004, 64(10): 3361-3364. DOI:10.1158/0008-5472.CAN-04-0079 |
| [33] | Lin KM, Lin SJ, Lin JH, et al. Dysregulation of dual-specificity phosphatases by epstein-barr virus LMP1 and its impact on lymphoblastoid cell line survival. J Virol, 2020, 94(4): eo1837-19. |
| [34] | Sun ZH, Lu SQ, Yang Z, et al. Isolation and characterization of an HIV-1 envelope glycoprotein-specific B-cell from an immortalized human naive B-cell library. J Gen Virol, 2017, 98(4): 791-798. DOI:10.1099/jgv.0.000706 |
| [35] | Yu XC, Tsibane T, McGraw PA, et al. Neutralizing antibodies derived from the B cells of 1918 influenza pandemic survivors. Nature, 2008, 455(7212): 532-536. DOI:10.1038/nature07231 |
| [36] | Simmons CP, Bernasconi NL, Suguitan AL, et al. Prophylactic and therapeutic efficacy of human monoclonal antibodies against H5N1 influenza. PLoS Med, 2007, 4(5): e178. DOI:10.1371/journal.pmed.0040178 |
| [37] | Corti D, Lanzavecchia A. Efficient methods to isolate human monoclonal antibodies from memory B cells and plasma cells. Microbiol Spectr, 2014, 2(5). |
| [38] | Schieffelin JS, Costin JM, Nicholson CO, et al. Neutralizing and non-neutralizing monoclonal antibodies against dengue virus E protein derived from a naturally infected patient. Virol J, 2010, 7: 28. DOI:10.1186/1743-422X-7-28 |
| [39] | Alaribe FN, Mazzoni E, Rigolin GM, et al. Extended lifespan of normal human B lymphocytes experimentally infected by SV40 or transfected by SV40 large T antigen expression vector. Leuk Res, 2013, 37(6): 681-689. DOI:10.1016/j.leukres.2013.02.003 |
| [40] | Kanki T, Takeuchi S. Immortalization of plasma cells by plasmid DNA and its hybridoma. Hum Antibod, 1995, 6(3): 89-92. DOI:10.3233/HAB-1995-6302 |
| [41] | Wiesner M, Zentz C, Mayr C, et al. Conditional immortalization of human B cells by CD40 ligation. PLoS ONE, 2008, 3(1): e1464. DOI:10.1371/journal.pone.0001464 |
| [42] | Küppers R. B cells under influence: transformation of B cells by Epstein-Barr virus. Nat Rev Immunol, 2003, 3(10): 801-812. DOI:10.1038/nri1201 |
| [43] | Volleth M, Zenker M, Joksic I, et al. Long-term culture of EBV-induced human lymphoblastoid cell lines reveals chromosomal instability. J Histochem Cytochem, 2020, 68(4): 239-251. DOI:10.1369/0022155420910113 |
| [44] | Robinson MJ, Ding ZJ, Pitt C, et al. The amount of BCL6 in B cells shortly after antigen engagement determines their representation in subsequent germinal centers. Cell Rep, 2020, 30(5): 1530-1541. DOI:10.1016/j.celrep.2020.01.009 |
| [45] | Li MX, Wang D, He JH, et al. Bcl-XL: A multifunctional anti-apoptotic protein. Pharmacol Res, 2020, 151: 104547. DOI:10.1016/j.phrs.2019.104547 |
| [46] | Kwakkenbos MJ, Diehl SA, Yasuda E, et al. Generation of stable monoclonal antibody-producing B cell receptor-positive human memory B cells by genetic programming. Nat Med, 2010, 16(1): 123-128. DOI:10.1038/nm.2071 |
| [47] | Kwakkenbos MJ, Bakker AQ, Van Helden PM, et al. Genetic manipulation of B cells for the isolation of rare therapeutic antibodies from the human repertoire. Methods, 2014, 65(1): 38-43. DOI:10.1016/j.ymeth.2013.07.002 |
| [48] | Kwakkenbos MJ, Van Helden PM, Beaumont T, et al. Stable long-term cultures of self-renewing B cells and their applications. Immunol Rev, 2016, 270(1): 65-77. DOI:10.1111/imr.12395 |
| [49] | Van Keimpema M, Grüneberg LJ, Mokry M, et al. FOXP1 directly represses transcription of proapoptotic genes and cooperates with NF-κB to promote survival of human B cells. Blood, 2014, 124(23): 3431-3440. DOI:10.1182/blood-2014-01-553412 |
| [50] | Patzelt T, Keppler SJ, Gorka O, et al. Foxp1 controls mature B cell survival and the development of follicular and B-1 B cells. Proc Natl Acad Sci USA, 2018, 115(12): 3120-3125. DOI:10.1073/pnas.1711335115 |
| [51] | Zhu Y, Haecker I, Yang YJ, et al. γ-herpesvirus-encoded miRNAs and their roles in viral biology and pathogenesis. Curr Opin Virol, 2013, 3(3): 266-275. DOI:10.1016/j.coviro.2013.05.013 |
| [52] | Ducas é, Dussault N, Roy A, et al. Estimation of the number of CD154 molecules in membrane extracts used as a source of CD40 stimulation of human B lymphocytes. J Immunol Methods, 2009, 344(2): 133-137. DOI:10.1016/j.jim.2009.03.009 |
| [53] | Banchereau J, De Paoli P, Valle A, et al. Long-term human B cell lines dependent on interleukin-4 and antibody to CD40. Science, 1991, 251(4989): 70-72. DOI:10.1126/science.1702555 |
| [54] | Arpin C, Dechanet J, Van Kooten C, et al. Generation of memory B cells and plasma cells in vitro. Science, 1995, 268(5211): 720-722. DOI:10.1126/science.7537388 |
| [55] | Néron S, Roy A, Dumont N. Large-scale in vitro expansion of polyclonal human switched-memory B lymphocytes. PLoS ONE, 2012, 7(12): e51946. DOI:10.1371/journal.pone.0051946 |
| [56] | Nojima T, Haniuda K, Moutai T, et al. In-vitro derived germinal centre B cells differentially generate memory B or plasma cells in vivo. Nat Commun, 2011, 2: 465. DOI:10.1038/ncomms1475 |
| [57] | Haniuda K, Nojima T, Kitamura D. In vitro-induced germinal center B cell culture system//Calado D, Ed. Germinal Centers. New York, NY: Humana Press, 2017, 1623: 125-133. |
| [58] | Miconnet I, Pantaleo G. A soluble hexameric form of CD40 ligand activates human dendritic cells and augments memory T cell response. Vaccine, 2008, 26(32): 4006-4014. DOI:10.1016/j.vaccine.2008.05.028 |
| [59] | Holler N, Tardivel A, Kovacsovics-Bankowski M, et al. Two adjacent trimeric Fas ligands are required for Fas signaling and formation of a death-inducing signaling complex. Mol Cell Biol, 2003, 23(4): 1428-1440. DOI:10.1128/MCB.23.4.1428-1440.2003 |
| [60] | Su KY, Watanabe A, Yeh CH, et al. Efficient culture of human naive and memory B cells for use as APCs. J Immunol, 2016, 197(10): 4163-4176. DOI:10.4049/jimmunol.1502193 |
| [61] | Nogales-Gadea G, Saxena A, Hoffmann C, et al. Generation of recombinant human IgG monoclonal antibodies from immortalized sorted B cells. J Vis Exp, 2015(100): e52830. |
| [62] | Zhang PF, Chen YX, Zeng Y, et al. Virus-mimetic nanovesicles as a versatile antigen-delivery system. Proc Natl Acad Sci USA, 2015, 112(45): E6129-E6138. DOI:10.1073/pnas.1505799112 |
| [63] | Zhao C, Busch DJ, Vershel CP, et al. Multifunctional transmembrane protein ligands for cell-specific targeting of plasma membrane-derived vesicles. Small, 2016, 12(28): 3837-3848. DOI:10.1002/smll.201600493 |
| [64] | Akapirat S, Avihingsanon A, Ananworanich J, et al. Variables influencing anti-human immunodeficiency virus type 1 neutralizing human monoclonal antibody (NhMAb) production among infected Thais. Southeast Asian J Trop Med Public Health, 2013, 44(5): 825-841. |
| [65] | Westerhuis BM, Benschop KS, Koen G, et al. Human memory B cells producing potent cross-neutralizing antibodies against human parechovirus: implications for prevalence, treatment, and diagnosis. J Virol, 2015, 89(15): 7457-7464. DOI:10.1128/JVI.01079-15 |
| [66] | Germar K, Fehres CM, Scherer HU, et al. Generation and characterization of anti-citrullinated protein antibody-producing B cell clones from rheumatoid arthritis patients. Arthrit Rheumatol, 2019, 71(3): 340-350. DOI:10.1002/art.40739 |
| [67] | Linterman MA, Beaton L, Yu D, et al. IL-21 acts directly on B cells to regulate Bcl-6 expression and germinal center responses. J Exp Med, 2010, 207(2): 353-363. DOI:10.1084/jem.20091738 |
