
 , 聂铭1, 杨裕然1, 张灿1, 刘璟1
, 聂铭1, 杨裕然1, 张灿1, 刘璟1 1. 西南大学 资源环境学院 土壤多尺度界面过程与调控重庆市重点实验室,重庆 400716;
2. 西南大学 植物保护学院 植物病害生物学重庆市高校重点实验室,重庆 400716
收稿日期:2020-05-31;接收日期:2020-09-14;网络出版时间:2020-10-14
基金项目:国家重点研发计划(No. 2017YFC0404705) 资助
摘要:资源化利用是应对餐厨垃圾(Kitchen waste,KW) 和剩余污泥(Excess sludge,ES) 快速增加的有效方法,而厌氧发酵获得挥发性脂肪酸(Volatile fatty acids,VFAs) 是其中的重要方式之一,但单一底物限制了VFAs的高效生产。近年来,不同底物厌氧共发酵产生VFAs被广泛研究与应用,文中分析了KW和ES单独和协同发酵产酸过程的特点,总结了厌氧发酵产酸过程及其生物代谢机制,阐述了环境因子及微生物群落结构对厌氧发酵产物类型及系统产物回收效率的影响。并进一步提出了针对区域饮食习惯、接种外源微生物构建稳定高效的定向产酸发酵体系以及KW和ES与原位污水间的耦联作用的研究方向。以期减少垃圾回收站及污水处理厂的运行成本,为实现城市有机固体垃圾处理与污水处理共赢提供参考。
关键词:厌氧共发酵挥发性脂肪酸生物代谢机制产酸类型发酵体系
Co-fermentation of kitchen waste and excess sludge for organic acid production: a review
Xuwei Gui1, Yifang Luo2, Zhenlun Li1

 , Ming Nie1, Yuran Yang1, Can Zhang1, Jing Liu1
, Ming Nie1, Yuran Yang1, Can Zhang1, Jing Liu1 1. Chongqing Key Laboratory of Soil Multi-Scale Interfacial Process, College of Resources and Environment, Southwest University, Chongqing 400716, China;
2. Chongqing Key Laboratory of Plant Disease Biology, College of Plant Protection, Southwest University, Chongqing 400716, China
Received: May 31, 2020; Accepted: September 14, 2020; Published: October 14, 2020
Supported by: National Key Research and Development Program of China (No. 2017YFC0404705)
Corresponding author: Zhenlun Li. Tel/Fax: +86-23-68251249; E-mail: lizhlun4740@sina.com.
Abstract: Resource utilization is an effective way to cope with the rapid increase of kitchen waste and excess sludge, and volatile fatty acids produced by anaerobic fermentation is an important way of recycling organic waste. However, the single substrate limits the efficient production of volatile fatty acids. In recent years, volatile fatty acids produced by anaerobic co-fermentation using different substrates has been widely studied and applied. In this paper, we analyze the characteristics of fermentation to produce acid using kitchen waste and excess sludge alone or mixture. Influences of environmental factors and microbial community structure on the type and yield of volatile fatty acids in the anaerobic fermentation system are discussed in detail. Moreover, we propose future research directions, to provide a reference for recycling kitchen waste and excess sludge.
Keywords: anaerobic co-fermentationvolatile fatty acidsbiological metabolic mechanismproduce acid typefermentation system
随着我国城镇化进程不断加快,污水处理总量和餐厨垃圾(Kitchen waste,KW) 数量逐年增长,每年剩余污泥(Excess sludge,ES) 产量高达4 000–6 000万t[1],KW年均产量约9 000万t[2],预计到2025年,全球将产生约22亿t的KW[3]。目前KW和ES处理方法主要有填埋、热能技术(焚烧、水热处理)、生物转化技术(堆肥、厌氧消化) 等[4-6],其中,厌氧消化因其资源回收率高、环境影响小而被认为是一种解决各类有机废物的经济有效方法。厌氧发酵液中小分子物质,如乙酸、丙酸、丁酸等挥发性脂肪酸(Volatile fatty acids,VFAs),在合成生物塑料[7]、螯合重金属[8]、提高土壤肥力[9]等方面均具有重要作用。此外,VFAs作为污水处理过程中反硝化菌的碳源,能显著提高脱氮效率,增加微生物多样性[10],因此,利用ES和KW的厌氧发酵液作为外部碳源的方式在污水处理厂被广泛研究和应用,并在长期运行条件下实现了经济可行性。
本文总结分析了KW与ES单独及其协同下厌氧发酵产酸的优劣势及其机理,以及控制厌氧共发酵产酸的关键因素,以期为降低城市有机固体垃圾处理难度、增加资源循环同时减少环境污染提供参考。
1 单一底物厌氧发酵产酸面临的困境及共发酵产酸的优势在厌氧发酵过程中,复杂有机物在降解菌的作用下转化为有机单体后,可发酵生成各类VFAs,其蛋白质释放量是好氧发酵的4.5倍[11]。有研究发现[12],不同发酵底物构成对VFAs的生产速率具有较大影响,蛋白质发酵产酸过程明显短于其他基质,油脂水解速度快,但多以长链脂肪酸(Long-chain fatty acids,LCFAs) 的形式存在,从而影响VFAs生产速率。
据报道,污水处理厂通过ES厌氧发酵产生VFAs,可实现高达65%的废水处理所需能源自给[13]。目前,国内外研究****分别针对ES厌氧发酵的产物回收率及稳定性进行了研究,其中,碳氮比值(Carbon/Nitrogen,C/N) 低、水解过程中产碱度导致pH值偏高均被认为是限制ES高效生成VFAs的重要原因[14-15]。通常建议发酵C/N在20/1–30/1之间,但原污泥中的C/N仅为7.2/1[16],Morales-Polo等[17]发现,ES碳氮比多数介于6到9之间,刘和等[18]研究发现,增加碳源浓度后,ES的VFAs总量持续增加,发酵产酸途径也由乙酸向丙酸、丁酸逐步转变。
相反,KW中充足的蛋白质、碳水化合物和脂肪类物质具有极高的生物降解性,各种微生物繁殖快,但由于KW存在高盐、微量元素的限制以及水解过程酸化速度过快等特点[3],单独厌氧发酵易使微生物的生物活性受到严重抑制,扰乱产酸发酵过程的稳定性。Zhao等[16]研究发现,相对低浓度(0–8 g/L) 的NaCl可促进KW中可溶性物质的释放和蛋白质转化,为短链脂肪酸的生产提供更多的能源物质,同时抑制产甲烷过程,但相对高浓度(16 g/L) 的NaCl则显著抑制酸化过程。此外,由于KW极易腐败发臭,滋生蚊蝇及病原菌,传统厌氧发酵很难实现无害化处理,而污泥的稳定性可以破坏病原体及减少刺激性气味,因此,二者联合发酵可以很好地弥补各自单独发酵所存在的不足,实现协同效应,显著提升ES发酵系统的性能,增加VFAs产量[19-20]。
在20世纪80年代Hills首次提出厌氧共发酵概念,他将牛粪与大麦秸秆混合发酵后发现:较秸秆单独发酵而言,联合发酵效率明显提高[21]。随后,国内外****对厌氧共发酵进行了大量研究。Wu等[15]证明KW和ES联合发酵可同时增加水解菌和产酸菌数量,平均VFAs产量与平均酸化率均比单独发酵显著提升。Li等[22]的研究也表明厌氧共发酵的VFAs产量比KW单独消化增长了8.38%。
2 厌氧共发酵产酸过程及其生物代谢机制厌氧发酵的水解与产酸并非相互独立的过程,几乎同时进行。有机物在降解过程中,既是电子受体也是电子供体,葡萄糖经糖酵解(Embden-Meyerhof pathway,EMP) 途径转化为丙酮酸,蛋白质在水解成氨基酸后,首先由乙酰辅酶A和丁酰辅酶A分别通过磷酸转乙酰酶(Phosphotransacetylase,PTA) 和磷酸转丁酰酶(Phosphotransbutyrylase,PTB) 转化为乙酰磷酸盐和丁酰磷酸盐,再分别由乙酰激酶(Acetyl kinase,AK) 和丁酰激酶(Butyryl kinase,BK)转化为乙酸和丁酸[23]。脂类物质则在脂肪酶的作用下生成LCFAs和甘油[24],LCFAs遵循β氧化机理进行生物降解,主要产物为乙酸和氢气,甘油则在微生物的作用下分解成1, 3-丙二醇、乳酸、乙醇等(图 1)[22-23]。
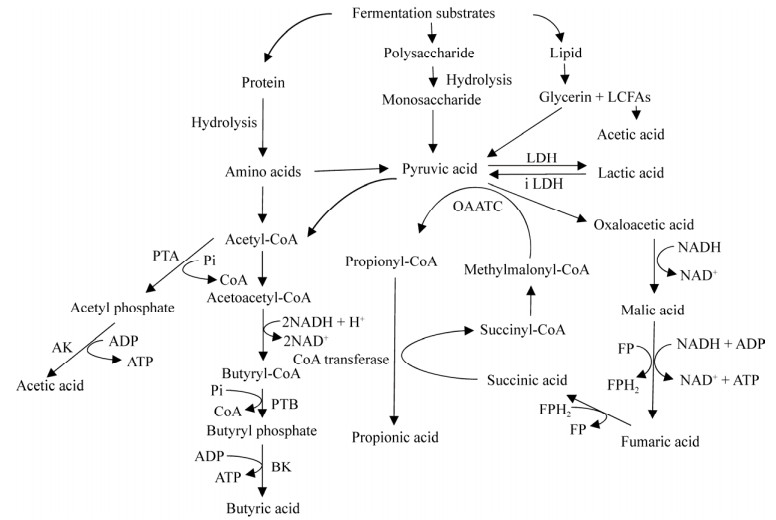 |
| 图 1 有机物厌氧发酵水解和酸化过程简图[23] Fig. 1 Schematic diagram of the hydrolysis and acidification of organic matter in anaerobic fermentation[23]. |
| 图选项 |
2.1 底物单独发酵与共发酵产酸途经及发酵类型的差异根据产酸末端产物组成,可将发酵产酸类型分为:丁酸型发酵、丙酸型发酵、乙醇型发酵。据报道,有机废物组成差异与有机物代谢途径相关联,不同基质将呈现出以某种VFAs或醇类为主的发酵产物或不同产率。研究发现,以可溶性碳水化合物为主的有机废物在高温条件下单独发酵,其主要代谢产物为丁酸,称为丁酸发酵途径,当pH低于5.0时,发酵液还原倾向增强,逐渐向丙酮-丁醇发酵途径转换[12, 25],而以纤维素、蛋白质和脂肪为主的有机物主要代谢产物则为乙酸[26]。
Liu等[27]研究了不同比例的餐厨垃圾在酸性条件下(pH 5.5) 与污泥共发酵产酸的情况,结果表明,VFAs总浓度随着KW占比的增加而增加,共发酵产VFAs的主要成分为丁酸(50.3%–73.2%)和乙酸(23.5%–37.6%),KW单独发酵的VFAs组成与之相似,而ES无论灭菌与否,其主要产物均为乙酸,占总VFAs的71.2%–75.2%。这说明污泥中的微生物并不是影响ES单独发酵与共发酵之间VFAs类型的差异的原因,KW中的有机物可能才是影响发酵过程的主要因素。随着乙酸累积量的增大,部分乙酸向丁酸转化,其他类型酸(甲酸、丙酸) 浓度仍保持相对稳定,说明高有机负荷率(Organic load rate,OLR) 有利于抑制乙酸型产甲烷途径[28]。并且,当KW与ES混合比例大于1︰1时,脂肪酸会出现二次积累现象[29],可能是由于高负荷条件下,可溶性碳水化合物与蛋白质优先降解,脂肪酸在微生物利用后的剩余浓度未达到抑制餐厨垃圾中难降解的部分有机物(如纤维素) 降解的条件,纤维素随着时间增加而溶出利用,进而造成脂肪酸再次积累。另外,低负荷可能会使VFAs的主要类型由乙酸和丁酸向异戊酸、丁酸和乙酸转变[30],Jiang等[31]也得到了相似的研究结果,认为降低负载会减缓乙酸的生成。
2.2 产酸途径及发酵类型的生物代谢调节研究发现,发酵类型的稳定性,主要由NADH/NAD+、ATP产量和发酵产物酸性末端产物量这3个因素来控制,而NADH/NAD+是影响发酵类型的最主要因素,但由于NADH与NAD+的平衡在氧化还原过程中存在失衡现象,因此,需要通过代谢调节来实现平衡状态。任南琪等[25]研究认为,高OLR条件下产乙酸的速率加快,导致H2和NADH产量升高,当NADH出现积累,代谢途径会逐渐向产丙酸途径转变,所以,丙酸积累极有可能是由于NADH产率过高所导致的。任南琪等[32]和王勇等[33]研究还发现C/N可以影响NADH/NAD+水平,促使不同发酵产酸类型的形成。在低C/N条件下,污泥厌氧发酵产酸途径为乙酸发酵,主要是通过氨基酸之间的Stickland反应形成,而随着C/N的增大,丙酸和丁酸的主要代谢途径转变为糖酵解的丙酮酸途径[18]。
此外,通过调控其他限制性因子,也可实现定向选择发酵类型。据赵丹等[34]分析,当pH 5.0,较高的氧化还原电位(Oxidation-reduction potential,ORP),可以使丁酸型发酵菌群和乙醇型发酵菌群被淘汰,转变为丙酸型发酵,而低ORP则形成丁酸型发酵。但ORP较低时,低pH (4.2) 又形成乙醇型发酵,当初始生态位形成后,ORP无论是降低或升高,发酵类型始终保持不变。由此可见,pH和ORP相互制约着产酸相的发酵类型。据报道,碱性条件更利于VFAs的生产,Feng等[23]对pH影响VFAs形成关键酶活性的研究发现,在碱性条件下(pH 8.0),乙酸的产率最高时,AK比PTA活性高,在酸性条件下(pH 4.0–5.0),BK的活性优于PTB,此时生成了更多的丁酸,说明由AK催化乙酰磷酸盐及由BK控制丁酰磷酸盐的生物转化率更高。
2.3 微生物的群落结构影响发酵产酸途径发酵产酸是酸化菌群利用水解产生的小分子有机物转化为更简单的化合物并分泌到细胞外,同时合成新的细胞物质的过程,因此,微生物群落结构组成对发酵途径起着关键性作用。根据产酸微生物降解有机物的产物类型,可将发酵微生物分为乙醇型发酵菌群、丙酸型发酵菌群、丁酸型发酵菌群(图 2)。
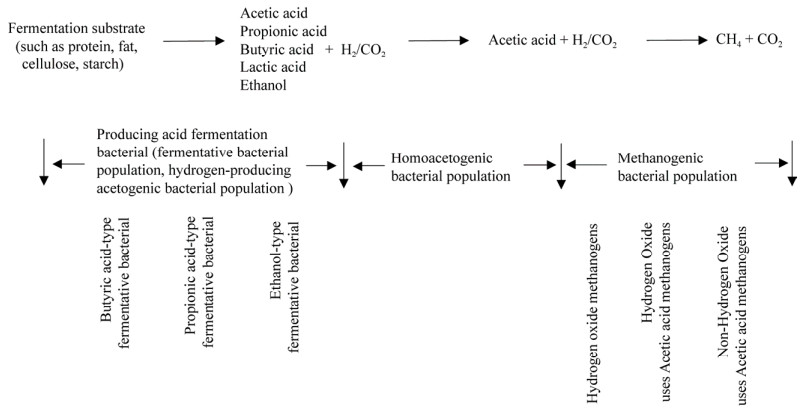 |
| 图 2 产酸发酵微生物代谢途径及群落演替[26] Fig. 2 Metabolic pathways and community succession of acid-producing fermentation microorganisms[26]. |
| 图选项 |
研究发现,丰富的有机物使3种群落在发酵前期同时存在,但仍以丙酸型发酵菌群为主。随着发酵时间延长,可供发酵细菌代谢所需的资源紧缺,各类细菌出现种间竞争,优势菌群的组成及其生理代谢特性不断发生改变,导致有机物代谢途径变化。任南琪等[25]发现,整个发酵过程中梭杆菌属Fusobacterium均占据一定优势,其他优势菌属逐渐从纤毛杆菌属Leptotrichia、梭状芽孢杆菌属Clostridium向拟杆菌属Bacteroides、气杆菌Aerobacter转变,发酵过程呈现丁酸→丙酸→丁酸→乙醇途径变化。丁酸型发酵菌群在发酵过程中两次成为优势菌群,但呈现的优势菌属组成却不同,随着酸性物质积累,Leptotrichia被演替为拟杆菌属Bacteroides。此外,稳定的乙醇型发酵优势菌群除Bacteroides、Clostridium和Fusobacterium外,还有发酵单胞属Zymomonas,但当Bacteroides为唯一优势菌群时,乙醇发酵处于不稳定状态,此时各脂肪酸含量均较低,说明稳定的发酵状态及高VFAs产量是多类微生物共同作用的结果。当废水处理系统中以丙酸杆菌属Propionibacterium、韦氏球菌属Veillonella为主时,丙酸型菌群的主要产酸途径为琥珀酸-丙酸途径。
综上所述,厌氧发酵定向产酸过程的有效性很大程度上取决于功能微生物的多样性和丰度,这是一个多类微生物与环境相互作用、相互适应的过程,因此,表征微生物群落动态对定向提高VFAs的产量具有指导意义。
3 影响厌氧共发酵过程及产VFAs的因素微生物是厌氧共发酵过程的主体,然而温度、pH值、预处理手段、水力停留时间(Hydraulic retention time,HRT)、OLR、混合比例等外部环境因素会影响微生物群落组成与活性,从而影响产酸过程与效率。
3.1 高温有利于微生物代谢产酸及VFAs积累温度对KW和ES的降解速率和产酸效率具有较大影响。适宜的温度会加速厌氧微生物群落的代谢活动及种群动态变化,并对各种化合物的水解动力以及各阶段中间产物的溶解度造成一定影响[15, 35]。据报道,产酸菌的最佳温度在35 ℃左右,当温度低于20 ℃时,产酸效率将降低50%以上[25],Cha等[36]发现,当温度从30 ℃降到15 ℃时,底物的降解速率从92%降低到25%。Yuan等[37]研究结果发现,ES在24.6 ℃发酵6 d时的VFAs产量相当于14 ℃发酵14 d的量,是4 ℃发酵9 d的VFAs产量的3.57倍。
而且高温明显促进底物粒径变小,更有利于蛋白质等有机氮的转换,促进丙酸积累,并缓冲发酵系统的pH[12],因此,厌氧消化一般是在中高温(35–60 ℃) 条件下进行[38]。Zamanzadeh等[39]研究发现,高温(55 ℃) 条件下KW的水解率和VFAs产量高于中温条件,并显著降低甲烷产率,Hao等[40]的研究也证明了这一观点。郑舍予[38]分析不同温度对ES和KW共发酵产酸效果后发现,高温(55 ℃) 条件下的VFAs产量是常温(25 ℃)下的3.05倍,两者共发酵的产量较污泥单独发酵而言提高了1.24–1.87倍,说明高温和共发酵,均能极大程度提高VFAs产量。
3.2 发酵液pH值影响VFAs生成及类型pH值是厌氧发酵系统最重要的参数,产酸菌的敏感性稍低,可在pH 3.0–11.0的范围内发挥作用[20, 41],其中,中性pH值更有利于产酸菌的生长,碱性pH值更利于发酵产酸积累。Chen等[42]和Wu等[43]研究指出碱性条件下产生的VFAs要大于中性和酸性条件,但同时也会产生许多生物无法降解的化合物,并对后续VFAs的产生具有抑制作用[44-45]。研究发现KW和ES共发酵有利于VFAs产生的原因是:KW在水解起始阶段会形成大量的有机酸,导致反应系统pH迅速降低,不利于水解菌和产酸菌生长[46],而ES厌氧发酵初始pH呈碱性,可缓冲KW水解酸化的冲击,使pH维持在水解作用的适宜范围,加速蛋白质和多糖的水解速率,增强底物的溶解[47-48]。
此外,pH还间接影响发酵液中可被产酸菌群利用的可溶性底物质量,进而影响有机物厌氧发酵产VFAs类型和含量的差异。如徐杰[49]研究发现当pH < 5.0时,主要进行乳酸发酵,当pH 5.0–6.0时,丁酸发酵占优势,当pH > 6.0时,主要代谢产物为乙酸和丙酸,且在最优条件下的丙酸浓度达(7.13±0.61) g/L[50]。综上所述,鉴于产甲烷菌的最适pH为6.8–7.2,因此,厌氧发酵系统pH调节至6.0–6.8或7.2–11.0,既有利于产酸微生物生长,又能减少产甲烷菌对VFAs的利用,实现VFAs的积累。
3.3 有机负荷率影响产酸发酵类型及VFAs产量OLR是指每天每体积反应器中输入的有机底物量,能反映厌氧消化过程中微生物处理有机物的能力[51-52]。研究发现,高OLR对厌氧产酸过程的影响是多方面的。首先,大量有机可溶性底物的持续供给,有利于提高VFAs的浓度[31],并缩短HRT[48]。Wainaina等[52]发现,增加OLR 15 d后,所有反应系统的VFAs浓度均呈现上升趋势。李浩[48]也发现,当OLR提升至5.05 g/(L·d) (HRT=15 d) 时,VFAs出现少量积累,提升至15.93 g/(L·d) (HRT=5 d),VFAs浓度提高到5.81 g/(L·d)。其次,OLR也影响VFAs的类型[52],Shen等[53]研究发现,当OLR低于2.0 g/(L·d) 时,整个消化过程主要为乙醇型发酵,随着OLR升高(> 2.0 g/(L·d)),丙酸会迅速积累,占领主导地位。此外,改变OLR也会影响微生物群落结构[52]。Ma等[54]分析表明,随着OLR的增加,预发酵处理氨基酸厌氧降解菌Proteiniphilum的相对丰度由12%增加到32%,成为体系中的优势菌群,并增加了VFAs积累。这可能是由于高OLR条件下,蛋白质降解导致氨基酸浓度升高,为Proteiniphilum的繁殖提供了充足的营养,同时形成的高浓度氨氮也抑制产甲烷菌的生长。
3.4 HRT过长会抑制产酸微生物活性HRT是厌氧共消化中另一个重要参数,它关系到底物在发酵过程中与厌氧微生物接触的时间,从而影响VFAs的产量。随着HRT的增加,水解效率和VFAs产量随之增加,但如果HRT过长,累积的VFAs会导致发酵液过酸,影响水解菌和产酸菌的生长,导致脱氮效率降低和运行成本增加[55-56]。Miron等[57]研究表明:在HRT低于8 d时,产酸菌为优势菌群,而后逐渐被产甲烷菌代替,这可能是不同微生物的世代时间不同导致的。Chen等[58]利用响应面法探究VFAs产量与HRT间的相关性表明,VFAs浓度随着HRT增加呈现先增加后减少的趋势,在HRT 8.8 d时,VFAs达到最高浓度26.48 g/L。综上,对于KW和ES的厌氧共消化,必须严格分析和优化HRT,以避免VFAs不足或累积而影响发酵系统效率。
3.5 预处理促进生物降解速率及VFAs产量由于KW中参与厌氧发酵的有机物多以固态形式存在,而污泥发酵受到胞外聚合物胶结和絮凝的限制,微生物胞外酶很难与这些固态底物直接有效接触,导致整个过程中的水解速率和VFAs的产率降低。因此,采取适当的预处理方式来增加底物的溶解度,并强化有机废物的生物降解速率具有重要意义。目前,促进VFAs从KW和ES中生成的有效途径主要包括物理预处理(超声[59]、微波[60]、热水解[61]、冻融/解冻[62])、化学预处理(氧化法[38]、碱解[63]、表面活性剂、零价铁[64])、生物预处理(生物酶、生物强化[65]) 等。
She等[62]利用冻融/解冻的方法对ES进行–24 ℃预处理8 h,35 ℃解冻2 h,循环操作5次,结果表示,该处理增溶作用显著,化学需氧量(Chemical oxygen demand,COD) 释放量为955.4 mg/L,12 d内VFAs最大累积量为4 852 mg/L,并显著增加了Bacteroidetes和Firmicutes的丰度。Li等[66]研究表明,适当的高温能够强化ES中微生物的溶胞效果,对缩短发酵时间、提高乳酸、VFAs产量具有积极作用,经110 ℃热处理后VFAs产量得到提高。Jiang等[67]采用超声预处理提高KW水解速率,发酵液中碳氮源的含量均出现不同程度的提高,70 h后VFAs的产量高达98.1 g/L。
事实上混合预处理更能达到低成本、高能源回收率的效果。据报道,游离亚硝酸(Free nitrous acid,FNA) 与碱、十二烷基苯磺酸钠、茶皂素或烷基聚葡萄糖苷等配合使用,可产生大量VFAs[68-71]。Wu等[72]证明,FNA和冷冻协同处理可促进增溶和有机物的释放,短链脂肪酸最高浓度分别是冷冻和FNA单独预处理的1.6倍和1.3倍。王率率等[73]研究发现,ES经热-碱混合预处理后,COD比原污泥提高了29倍,VFAs最高为9.1 g/L,可能是由于高温和碱协同作用,加速了污泥胞外聚合物的溶解和胞内有机物的释放。
3.6 其他因素交互影响甲烷及VFAs产量在厌氧发酵产酸的过程中必然伴随产甲烷过程,因此要提高有机废物厌氧发酵积累VFAs需要适当调整发酵条件,从而抑制甲烷生产。目前,对甲烷的抑制主要是针对产酸菌和产甲烷菌之间的生理生化特性差异来实现的,例如通过添加甲烷抑制剂、利用甲烷菌对氧的敏感性、避开其喜好的中性偏碱pH以及降低HRT等方法[25]。有研究表明,ES单独发酵时,短时间内使用1 μmol/mL的2-溴乙烷磺酸(2-Bromoethanesulfonate,BES) 可完全抑制甲烷菌的活性,并增加乙酸积累[74],然而当KW与ES以1︰1混合发酵时,添加BES或增加初始O2对VFAs的产率均没有显著影响,因此,在底物高负荷时,不需要外加BES抑制,底物本身代谢生成的高浓度脂肪酸或者氨氮就能抑制甲烷菌生长[30]。据报道,当总氨浓度控制在1.7–14.0 g/L或NH3-N浓度为0.2–0.5 g/L时,会导致甲烷产量降低约50%[29, 75]。在中温条件下,0.05–0.07 g/L的油酸可抑制50%的消化性能,当油酸浓度达到3 g/L时,可减少约73%的甲烷产生,并积累VFAs[76]。
C/N同样是影响厌氧发酵产酸的一个重要因素,通常的发酵最佳C/N在20–30之间,而KW为高C/N基质,ES的C/N仅6–9,因此采用合适的比例混合厌氧处理,对于改善发酵过程具有重要意义[17]。付胜涛等[77]发现KW和ES以1︰1的中温混合共发酵可显著提高脂肪酸产量,且缓冲效果、系统稳定性和处理效率也较理想。但赵宋敏等[78]和Pan等[79]研究发现,同样是中温发酵,当混合物质量比为4︰1时,脂肪酸的产量达到最高,这可能是KW中基质组成不一样导致的。采用中心复合设计和响应面法对KW和ES生产VFAs的工艺参数分析表明:KW成分占88.03%,水力停留时间为8.92 d,有机负荷为8.31 g VSS/(L·d),发酵pH为6.99时,VFAs产值最高[59]。此外,适当提高发酵底物中溶解盐(即钙、镁、钾和钠) 含量会增强盐析作用,降低脱氢酶活性,导致微生物生长受到抑制,降低甲烷产量。
综上所述,ES和KW协同高效生产VFAs是多种因素共同作用的结果,最主要的原因还是发酵全程各环境因子的动态变化,导致微生物活性、功能微生物的丰度等发生改变,从而引起的产酸代谢途径的不同。
4 厌氧共发酵积累VFAs的总结与展望KW和ES作为一种废物原料,其厌氧发酵液具有较高的资源回收意义[7-10],但KW发酵产酸受高盐、水解过程酸化速度过快及病原物多等因素抑制,而ES存在C/N低、发酵过程产碱度高、功能微生物物种单一等缺点[3, 14-15],单一底物进行发酵很难实现经济可行性。目前大量****利用不同废弃物混合发酵的方法以获得更优的微生物产酸条件及VFAs产量[15, 22],但由于发酵底物组成差异导致KW与ES协同发酵产物重现性差,VFAs类型难以实现定向产出。KW与ES协同发酵过程中,底物粒径对产酸效果影响颇大,前期研究多采用超声波或机械破碎减少餐厨垃圾粒径从而增加接触面积[80],生产工艺相对复杂。生物强化也限于本土微生物驯养或添加生物酶,而驯养本土微生物厌氧发酵是通过改变底物组成及环境因子形成某一特定功能的顶级微生物群落,但在实际商业化应用中很难实现环境条件的实时监控并对它的改变做出及时响应,因此,通过驯化种群繁多的本土微生物来实现高效VFAs生产仍然面临许多挑战。
大量研究表明,底物粒径直接影响消化速率及VFAs的生成量,本实验室前期筛选得到部分高效降解餐厨垃圾的菌株,可在24 h内快速液化餐厨垃圾,使其粒径迅速减小,有助于后期VFAs快速生产。结合该研究结果及目前面临的问题,未来需要从以下方向开展进一步研究:1) 结合地区饮食差异,削减环境因素(盐度、油度、辣度等) 对VFAs产量带来的影响,实现VFAs高效及定向生产。2) 接种外部微生物,构建新的微生物产酸发酵体系。将上述实验室筛选得到的菌株定向接入发酵系统,探索外部微生物迅速在发酵系统中成为优势菌群的条件,通过改变原有微生物群落结构,逆向影响环境条件,形成稳定高效的发酵产酸系统。3) VFAs的分离提取,是一项非常复杂的工艺,为避免分离技术带来的影响,在后续的研究中,将KW与污水处理厂的原废水进行协同处理,接入实验室高效反硝化菌株,可能会表现出更好的消化及反硝化潜能,同时有助于进一步降低污水处理在商业化应用中的运行成本,成为一种新的城市有机固体垃圾处理方法。
参考文献
| [1] | Li XW, Chen LB, Mei QQ, et al. Microplastics in sewage sludge from the wastewater treatment plants in China. Water Res, 2018, 142: 75-85. DOI:10.1016/j.watres.2018.05.034 |
| [2] | 周俊, 王梦瑶, 王改红, 等. 餐厨垃圾资源化利用技术研究现状及展望. 生物资源, 2020, 42(1): 87-96. Zhou J, Wang MY, Wang GH, et al. Research status and prospect of food waste utilization technology. Biotic Resour, 2020, 42(1): 87-96 (in Chinese). |
| [3] | Mehariya S, Patel AK, Obulisamy PK, et al. Co-digestion of food waste and sewage sludge for methane production: Current status and perspective. Bioresour Technol, 2018, 265: 519-531. DOI:10.1016/j.biortech.2018.04.030 |
| [4] | Zhou MM, Yan BH, Wong JWC, et al. Enhanced volatile fatty acids production from anaerobic fermentation of food waste: A mini-review focusing on acidogenic metabolic pathways. Bioresour Technol, 2018, 248: 68-78. |
| [5] | Ng BJH, Mao Y, Chen CL, et al. Municipal food waste management in Singapore: practices, challenges and recommendations. J Mater Cycles Waste Manag, 2017, 19(1): 560-569. DOI:10.1007/s10163-015-0405-8 |
| [6] | Chen YG, Luo JY, Yan YY, et al. Enhanced production of short-chain fatty acid by co-fermentation of waste activated sludge and kitchen waste under alkaline conditions and its application to microbial fuel cells. Appl Energy, 2013, 102: 1197-1204. DOI:10.1016/j.apenergy.2012.06.056 |
| [7] | Pittmann T, Steinmetz H. Potential for polyhydroxyalkanoate production on German or European municipal waste water treatment plants. Bioresour Technol, 2016, 214: 9-15. DOI:10.1016/j.biortech.2016.04.074 |
| [8] | 戴世金, 周紫薇, 张子莎, 等. 餐厨垃圾有机酸发酵液淋洗去除土壤重金属. 环境工程学报, 2019, 13(2): 381-388. Dai SJ, Zhou ZW, Zhang ZS, et al. Removal of heavy metals using organic acids fermentation liquid derived from food waste. Chin J Environ Eng, 2019, 13(2): 381-388 (in Chinese). |
| [9] | Chiang PN, Tong OY, Chiou CS, et al. Reclamation of zinc-contaminated soil using a dissolved organic carbon solution prepared using liquid fertilizer from food-waste composting. J Hazard Mater, 2016, 301: 100-105. DOI:10.1016/j.jhazmat.2015.08.015 |
| [10] | Tang JL, Wang XC, Hu YS, et al. Applying fermentation liquid of food waste as carbon source to a pilot-scale anoxic/oxic-membrane bioreactor for enhancing nitrogen removal: Microbial communities and membrane fouling behaviour. Bioresour Technol, 2017, 236: 164-173. DOI:10.1016/j.biortech.2017.03.186 |
| [11] | Novak JT, Sadler ME, Murthy SN. Mechanisms of floc destruction during anaerobic and aerobic digestion and the effect on conditioning and dewatering of biosolids. Water Res, 2003, 37(13): 3136-3144. DOI:10.1016/S0043-1354(03)00171-4 |
| [12] | 许曼娟. 餐厨垃圾—污泥共发酵过程VFAs的产生及降解特性研究[D]. 西安: 西安建筑科技大学, 2018. Xu MJ. Study on the production and degradation characteristics of VFAs in co-digestion process of food waste and sludge[D]. Xi'an: Xi'an University of Architecture and Technology, 2018 (in Chinese). |
| [13] | Nghiem LD, Koch K, Bolzonella D, et al. Full scale co-digestion of wastewater sludge and food waste: Bottlenecks and possibilities. Renew Sustain Energy Rev, 2017, 72: 354-362. DOI:10.1016/j.rser.2017.01.062 |
| [14] | Huang XD, Zhao JW, Xu QX, et al. Enhanced volatile fatty acids production from waste activated sludge anaerobic fermentation by adding tofu residue. Bioresour Technol, 2019, 274: 430-438. DOI:10.1016/j.biortech.2018.12.010 |
| [15] | Wu QL, Guo WQ, Zheng HS, et al. Enhancement of volatile fatty acid production by co-fermentation of food waste and excess sludge without pH control: The mechanism and microbial community analyses. Bioresour Technol, 2016, 216: 653-660. DOI:10.1016/j.biortech.2016.06.006 |
| [16] | Zhao JW, Zhang C, Wang DB, et al. Revealing the underlying mechanisms of how sodium chloride affects short-chain fatty acid production from the cofermentation of waste activated sludge and food waste. ACS Sustain Chem Eng, 2016, 4(9): 4675-4684. DOI:10.1021/acssuschemeng.6b00816 |
| [17] | Morales-Polo C, Del Mar Cledera-Castro M, Soria BYM. Reviewing the anaerobic digestion of food waste: from waste generation and anaerobic process to its perspectives. Appl Sci, 2018, 8(10): 1804. DOI:10.3390/app8101804 |
| [18] | 刘和, 刘晓玲, 邱坚, 等. C/N对污泥厌氧发酵产酸类型及代谢途径的影响. 环境科学学报, 2010, 30(2): 340-346. |
| [19] | Liu X, Wang W, Shi YC, et al. Pilot-scale anaerobic co-digestion of municipal biomass waste and waste activated sludge in China: Effect of organic loading rate. Waste Manag, 2012, 32(11): 2056-2060. DOI:10.1016/j.wasman.2012.03.003 |
| [20] | Feng LY, Yan YY, Chen YG. Co-fermentation of waste activated sludge with food waste for short-chain fatty acids production: effect of pH at ambient temperature. Front Environ Sci Eng China, 2011, 5(4): 623-632. DOI:10.1007/s11783-011-0334-2 |
| [21] | Hills DJ. Biogas from a high solids combination of dairy manure and barley straw. Trans ASAE, 1980, 23(6): 1500-1504. DOI:10.13031/2013.34805 |
| [22] | Li ZP, Chen Z, Ye H, et al. Anaerobic co-digestion of sewage sludge and food waste for hydrogen and VFA production with microbial community analysis. Waste Manag, 2018, 78: 789-799. DOI:10.1016/j.wasman.2018.06.046 |
| [23] | Feng LY, Chen YG, Zheng X. Enhancement of waste activated sludge protein conversion and volatile fatty acids accumulation during waste activated sludge anaerobic fermentation by carbohydrate substrate addition: the effect of pH. Environ Sci Technol, 2009, 43(12): 4373-4380. DOI:10.1021/es8037142 |
| [24] | 赵建伟. 盐度和油脂对餐厨垃圾和剩余污泥厌氧发酵产短链脂肪酸的影响与机理[D]. 长沙: 湖南大学, 2018. Zhao JW. Effects and mechanisms of salinity, fat, oil and grease (FOG) on short chain fatty acids production from food waste and waste activated sludge anaerobic fermentation[D]. Changsha: Hunan University, 2018 (in Chinese). |
| [25] | 任南琪, 王爱杰, 马放. 产酸发酵微生物生理生态学. 北京: 科学出版社, 2005. Ren NQ, Wang AJ, Ma F. Physiological ecology of acidogens in anaerobic biotreatment process. Beijing: Science Press, 2005 (in Chinese). |
| [26] | 王杰明, 石雅丽, 刘安礼, 等. 生物技术生产丁酸的研究进展. 生物技术进展, 2020, 10(1): 53-59. Wang JM, Shi YL, Liu AL, et al. Research progress on butyric acid production by biotechnology. Curr Biotechnol, 2020, 10(1): 53-59 (in Chinese). |
| [27] | Liu XY, Li RY, Ji M, et al. Hydrogen and methane production by co-digestion of waste activated sludge and food waste in the two-stage fermentation process: substrate conversion and energy yield. Bioresour Technol, 2013, 146: 317-323. DOI:10.1016/j.biortech.2013.07.096 |
| [28] | 许之扬. 餐厨垃圾固态厌氧消化过程内源性抑制效应研究[D]. 无锡: 江南大学, 2014. Xu ZY. Study of endogenous inhibition effects on solid-state anaerobic digestion from food wastes[D]. Wuxi: Jiangnan University, 2014 (in Chinese). |
| [29] | 葛元. 餐厨垃圾与城市剩余污泥混合厌氧发酵研究[D]. 杨凌: 西北农林科技大学, 2019. Ge Y. Co-digestion of food waste and sewage sludge[D]. Yangling: Northwest A & F University, 2019 (in Chinese). |
| [30] | Lukitawesa, Patinvoh RJ, Millati R, et al. Factors influencing volatile fatty acids production from food wastes via anaerobic digestion. Bioengineered, 2020, 11(1): 39-52. DOI:10.1080/21655979.2019.1703544 |
| [31] | Jiang JG, Zhang YJ, Li KM, et al. Volatile fatty acids production from food waste: Effects of pH, temperature, and organic loading rate. Bioresour Technol, 2013, 143: 525-530. DOI:10.1016/j.biortech.2013.06.025 |
| [32] | 任南琪, 赵丹, 陈晓蕾, 等. 厌氧生物处理丙酸产生和积累的原因及控制对策. 中国科学(B辑), 2002, 32(1): 83-89. Ren NQ, Zhao D, Chen XL, et al. Mechanism and controlling strategy of the production and accumulation of propionic acid for anaerobic wastewater treatment. Science in China Series B (Chemistry), 2002, 32(1): 83-89 (in Chinese). |
| [33] | 王勇, 孙寓姣, 任南琪, 等. C/N对细菌产氢发酵类型及产氢能力的影响. 太阳能学报, 2004, 25(3): 375-378. Wang Y, Sun YJ, Ren NQ, et al. Effect of C/N on bacterium pro-hydrogen ferment type and pro-hydrogen ability. Acta Energ Solaris Sin, 2004, 25(3): 375-378 (in Chinese). DOI:10.3321/j.issn:0254-0096.2004.03.023 |
| [34] | 赵丹, 任南琪, 王爱杰. pH、ORP制约的产酸相发酵类型及顶级群落. 重庆环境科学, 2003, 25(2): 33-35, 38. Zhao D, Ren NQ, Wang AJ. Fermentation type and climax community controlled by pH, ORP. Chongqing Environ Sci, 2003, 25(2): 33-35, 38 (in Chinese). DOI:10.3969/j.issn.1674-2842.2003.02.011 |
| [35] | Appels L, Baeyens J, Degrève J, et al. Principles and potential of the anaerobic digestion of waste-activated sludge. Progr Energy Combust Sci, 2008, 34(6): 755-781. DOI:10.1016/j.pecs.2008.06.002 |
| [36] | Cha GC, Chung HK, Chung JC. Suppression of acidogenic activities due to rapid temperature drop in anaerobic digestion. Biotechnol Lett, 1997, 19(5): 461-464. DOI:10.1023/A:1018300312036 |
| [37] | Yuan Q, Sparling R, Oleszkiewicz JA. VFA generation from waste activated sludge: effect of temperature and mixing. Chemosphere, 2011, 82(4): 603-607. DOI:10.1016/j.chemosphere.2010.10.084 |
| [38] | 郑舍予. 剩余污泥联合餐厨垃圾高温共发酵产酸研究[D]. 广州: 华东理工大学, 2019. Zheng SY. Study on waste activated sludge thermophilic co-fermentation of acidification combined with food waste[D]. Guangzhou: East China University of Science and Technology, 2019 (in Chinese). |
| [39] | Zamanzadeh M, Hagen LH, Svensson K, et al. Anaerobic digestion of food waste — Effect of recirculation and temperature on performance and microbiology. Water Res, 2016, 96: 246-254. DOI:10.1016/j.watres.2016.03.058 |
| [40] | Hao JX, Wang H. Volatile fatty acids productions by mesophilic and thermophilic sludge fermentation: Biological responses to fermentation temperature. Bioresour Technol, 2015, 175: 367-373. DOI:10.1016/j.biortech.2014.10.106 |
| [41] | Hwang MH, Jang NJ, Hyun SH, et al. Anaerobic bio-hydrogen production from ethanol fermentation: the role of pH. J Biotechnol, 2004, 111(3): 297-309. DOI:10.1016/j.jbiotec.2004.04.024 |
| [42] | Chen YG, Su J, Yuan HY, et al. Hydrolysis and acidification of waste activated sludge at different pHs. Water Res, 2007, 41(3): 683-689. DOI:10.1016/j.watres.2006.07.030 |
| [43] | Wu HY, Yang DH, Zhou Q, et al. The effect of pH on anaerobic fermentation of primary sludge at room temperature. J Hazardous Mater, 2009, 172(1): 196-201. DOI:10.1016/j.jhazmat.2009.06.146 |
| [44] | Li DZ, Zhou Y, Tan YM, et al. Alkali-solubilized organic matter from sludge and its degradability in the anaerobic process. Bioresour Technol, 2016, 200: 579-586. DOI:10.1016/j.biortech.2015.10.083 |
| [45] | Lu D, Xiao KK, Chen Y, et al. Transformation of dissolved organic matters produced from alkaline-ultrasonic sludge pretreatment in anaerobic digestion: From macro to micro. Water Res, 2018, 142: 138-146. DOI:10.1016/j.watres.2018.05.044 |
| [46] | Kim JK, Oh BR, Chun YN, et al. Effects of temperature and hydraulic retention time on anaerobic digestion of food waste. J Biosci Bioeng, 2006, 102(4): 328-332. DOI:10.1263/jbb.102.328 |
| [47] | Horiuchi JI, Shimizu T, Tada K, et al. Selective production of organic acids in anaerobic acid reactor by pH control. Bioresour Technol, 2002, 82(3): 209-213. DOI:10.1016/S0960-8524(01)00195-X |
| [48] | 李浩. 温度及有机负荷对餐厨垃圾与剩余污泥共发酵特性的影响研究[D]. 西安: 西安建筑科技大学, 2017. Li H. Effects of temperature and organic loading rate on co-digestion of food waste and waste activated sludge[D]. Xi'an: Xi'an University of Architecture and Technology, 2017 (in Chinese). |
| [49] | 徐杰. 厨余垃圾厌氧消化水解产酸及动力学研究[D]. 沈阳: 沈阳航空航天大学, 2014. Xu J. The study of kinetics and hydrolysis and acidogenisis in anaerobic digestion of kitchen waste[D]. Shenyang: Shenyang University of Aeronautics and Astronautics, 2014 (in Chinese). |
| [50] | Chen YG, Li X, Zheng X, et al. Enhancement of propionic acid fraction in volatile fatty acids produced from sludge fermentation by the use of food waste and Propionibacterium acidipropionici. Water Res, 2013, 47(2): 615-622. DOI:10.1016/j.watres.2012.10.035 |
| [51] | 孟栋, 李枘枘, 刘玉玲, 等. 利用剩余活性污泥合成聚羟基脂肪酸酯的研究进展. 生物工程学报, 2019, 35(11): 2165-2176. Meng D, Li RR, Liu YL, et al. Advances in synthesis of polyhydroxyalkanoates by using residual activated sludge. Chin J Biotech, 2019, 35(11): 2165-2176 (in Chinese). |
| [52] | Wainaina S, Awasthi MK, Horváth IS, et al. Anaerobic digestion of food waste to volatile fatty acids and hydrogen at high organic loading rates in immersed membrane bioreactors. Renew Energy, 2020, 152: 1140-1148. DOI:10.1016/j.renene.2020.01.138 |
| [53] | Shen F, Yuan HR, Pang YZ, et al. Performances of anaerobic co-digestion of fruit & vegetable waste (FVW) and food waste (FW): Single-phase vs. two-phase. Bioresour Technol, 2013, 144: 80-85. DOI:10.1016/j.biortech.2013.06.099 |
| [54] | Ma XX, Yu M, Song N, et al. Effect of ethanol pre-fermentation on organic load rate and stability of semi-continuous anaerobic digestion of food waste. Bioresour Technol, 2020, 299: 122587. DOI:10.1016/j.biortech.2019.122587 |
| [55] | He Y, Wang YH, Song XS. High-effective denitrification of low C/N wastewater by combined constructed wetland and biofilm-electrode reactor (CW-BER). Bioresour Technol, 2016, 203: 245-251. DOI:10.1016/j.biortech.2015.12.060 |
| [56] | Feng LY, Wang H, Chen YG, et al. Effect of solids retention time and temperature on waste activated sludge hydrolysis and short-chain fatty acids accumulation under alkaline conditions in continuous-flow reactors. Bioresour Technol, 2009, 100(1): 44-49. DOI:10.1016/j.biortech.2008.05.028 |
| [57] | Miron Y, Zeeman G, Van Lier JB, et al. The role of sludge retention time in the hydrolysis and acidification of lipids, carbohydrates and proteins during digestion of primary sludge in CSTR systems. Water Res, 2000, 34(5): 1705-1713. DOI:10.1016/S0043-1354(99)00280-8 |
| [58] | Chen H, Wu HY. Optimization of volatile fatty acid production with co-substrate of food wastes and dewatered excess sludge using response surface methodology. Bioresour Technol, 2010, 101(14): 5487-5493. DOI:10.1016/j.biortech.2010.02.013 |
| [59] | Cheng C, Zhou Z, Qiu Z, et al. Enhancement of sludge reduction by ultrasonic pretreatment and packing carriers in the anaerobic side-stream reactor: Performance, sludge characteristics and microbial community structure. Bioresour Technol, 2018, 249: 298-306. DOI:10.1016/j.biortech.2017.10.043 |
| [60] | Gelegenis J, Georgakakis D, Angelidaki I, et al. Optimization of biogas production by co-digesting whey with diluted poultry manure. Appl Energy, 2017, 32(13): 2147-2160. |
| [61] | Carlsson M, Lagerkvist A, Morgan-Sagastume F. Energy balance performance of municipal wastewater treatment systems considering sludge anaerobic biodegradability and biogas utilisation routes. J Environ Chem Eng, 2016, 4(4): 4680-4689. DOI:10.1016/j.jece.2016.10.030 |
| [62] | She YC, Hong JM, Zhang Q, et al. Revealing microbial mechanism associated with volatile fatty acids production in anaerobic acidogenesis of waste activated sludge enhanced by freezing/thawing pretreatment. Bioresour Technol, 2020, 302: 122869. DOI:10.1016/j.biortech.2020.122869 |
| [63] | Li H, Li CC, Liu WJ, et al. Optimized alkaline pretreatment of sludge before anaerobic digestion. Bioresour Technol, 2012, 123: 189-194. DOI:10.1016/j.biortech.2012.08.017 |
| [64] | Luo K, Pang Y, Yang Q, et al. A critical review of volatile fatty acids produced from waste activated sludge: enhanced strategies and its applications. Environ Sci Pollut Res, 2019, 26(14): 13984-13998. DOI:10.1007/s11356-019-04798-8 |
| [65] | 刘亚利. 剩余污泥强化预处理及其厌氧产酸产甲烷研究[D]. 哈尔滨: 哈尔滨工业大学, 2015. Liu YL. Study on enhanced pretreatment and anaerobic acidification and methanantion of waste activated sludge[D]. Harbin: Harbin Institute of Technology, 2015 (in Chinese). |
| [66] | Li J, Zhang WJ, Li X, et al. Production of lactic acid from thermal pretreated food waste through the fermentation of waste activated sludge: effects of substrate and thermal pretreatment temperature. Bioresour Technol, 2018, 247: 890-896. DOI:10.1016/j.biortech.2017.09.186 |
| [67] | Jiang JG, Gong CX, Wang JM, et al. Effects of ultrasound pre-treatment on the amount of dissolved organic matter extracted from food waste. Bioresour Technol, 2014, 155: 266-271. DOI:10.1016/j.biortech.2013.12.064 |
| [68] | Zhao JW, Wang DB, Li XM, et al. Free nitrous acid serving as a pretreatment method for alkaline fermentation to enhance short-chain fatty acid production from waste activated sludge. Water Res, 2015, 78: 111-120. DOI:10.1016/j.watres.2015.04.012 |
| [69] | Zhao JW, Liu YW, Ni BJ, et al. Combined effect of free nitrous acid pretreatment and sodium dodecylbenzene sulfonate on short-chain fatty acid production from waste activated sludge. Sci Rep, 2016, 6(1): 21622. DOI:10.1038/srep21622 |
| [70] | Xu QX, Liu XR, Zhao JW, et al. Feasibility of enhancing short-chain fatty acids production from sludge anaerobic fermentation at free nitrous acid pretreatment: Role and significance of Tea saponin. Bioresour Technol, 2018, 254: 194-202. DOI:10.1016/j.biortech.2018.01.084 |
| [71] | Liu Y, Zhao JW, Li XM, et al. Synergistic effect of free nitrite acid integrated with biosurfactant alkyl polyglucose on sludge anaerobic fermentation. Waste Manag, 2018, 78: 310-317. DOI:10.1016/j.wasman.2018.05.053 |
| [72] | Wu YQ, Song K, Sun XY, et al. Mechanisms of free nitrous acid and freezing co-pretreatment enhancing short-chain fatty acids production from waste activated sludge anaerobic fermentation. Chemosphere, 2019, 230: 536-543. DOI:10.1016/j.chemosphere.2019.05.107 |
| [73] | 王率率, 陆小游, 姜谦, 等. 城镇污水厂剩余污泥厌氧发酵产酸工程示范研究. 环境科学研究, 2020, 33(12): 2829-2837. Wang SS, Lu XY, Jiang Q, et al. Full-scale volatile fatty acids production from excess sludge of municipal wastewater treatment plant by anaerobic fermentation. Res Environ Sci, 2020, 33(12): 2829-2837 (in Chinese). |
| [74] | Zinder SH, Anguish T, Cardwell SC. Selective inhibition by 2-bromoethanesulfonate of methanogenesis from acetate in a thermophilic anaerobic digestor. Appl Environ Microbiol, 1984, 47(6): 1343-1345. DOI:10.1128/AEM.47.6.1343-1345.1984 |
| [75] | El Hadj TB, Astals S, Galí A, et al. Ammonia influence in anaerobic digestion of OFMSW. Water Sci Technol, 2009, 59(6): 1153-1158. DOI:10.2166/wst.2009.100 |
| [76] | Dasa KT, Westman SY, Millati R, et al. Inhibitory effect of long-chain fatty acids on biogas production and the protective effect of membrane bioreactor. BioMed Res Int, 2016, 2016: 7263974. |
| [77] | 付胜涛, 于水利, 严晓菊, 等. 剩余活性污泥和厨余垃圾的混合中温厌氧消化. 环境科学, 2006, 27(7): 1459-1463. Fu ST, Yu SL, Yan XJ, et al. Co-digestion of waste activated sludge and kitchen garbage. Environ Sci, 2006, 27(7): 1459-1463 (in Chinese). DOI:10.3321/j.issn:0250-3301.2006.07.040 |
| [78] | 赵宋敏, 李定龙, 戴肖云, 等. 温度对厨余垃圾厌氧发酵产酸的影响. 环境污染与防治, 2011, 33(3): 44-47, 64. Zhao SM, Li DL, Dai XY, et al. The influence of temperature on acid production during anaerobic fermentation of kitchen garbage. Environ Pollut Control, 2011, 33(3): 44-47, 64 (in Chinese). DOI:10.3969/j.issn.1001-3865.2011.03.009 |
| [79] | Pan Y, Zhi ZX, Zhen GY, et al. Synergistic effect and biodegradation kinetics of sewage sludge and food waste mesophilic anaerobic co-digestion and the underlying stimulation mechanisms. Fuel, 2019, 253: 40-49. DOI:10.1016/j.fuel.2019.04.084 |
| [80] | Carlsson M, Lagerkvist A, Morgan-Sagastume, F, et al. The effects of substrate pre-treatment on anaerobic digestion systems: a review. Waste Manag, 2012, 32(9): 1634-1650. DOI:10.1016/j.wasman.2012.04.016 |
