

1. 中国科学院 过程工程研究所 生化工程国家重点实验室,北京 100190;
2. 中国科学院 过程工程研究所 绿色过程与工程院重点实验室,北京 100190;
3. 中国科学院大学 化学工程学院,北京 100049
收稿日期:2020-05-05;接收日期:2020-06-05
基金项目:国家自然科学基金(Nos. 31800030,31872633,21878307) 资助
摘要:作为一种绿色、经济的新兴技术,生物脱硫技术正逐渐受到人们的青睐。然而,处理气体中的有机硫对生物脱硫过程的抑制是一个不容忽视的问题。文中总结了近年来国际上对生物脱硫过程中有机硫影响的相关研究,主要包括有机硫的种类及理化特征、有机硫对脱硫过程的影响、有机硫的作用机理、操作条件与有机硫的相互关系以及耐受有机硫微生物的种类,并据此归纳了缓解有机硫对脱硫过程影响的一些方法,为生物脱硫工艺在实际应用中稳定、高效地运行提供一定的指导。
关键词:有机硫抑制硫氧化生物脱硫单质硫
Inhibition of biological desulfurization by organosulfur: a review
Tingzhen Mu1,2, Maohua Yang1,2, Jianmin Xing1,2,3


1. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
2. Key Laboratory of Green Process and Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
3. School of Chemical Engineering, University of Chinese Academy of Sciences, Beijing 100049, China
Received: May 5, 2020; Accepted: June 5, 2020
Supported by: National Natural Science Foundation of China (Nos. 31800030, 31872633, 21878307)
Corresponding author: Jianmin Xing. Tel: +86-10-62550913; E-mail: jmxing@ipe.ac.cn.
Abstract: As a green and economic emerging technology, biological desulfurization is popular. However, biological desulfurization is inhibited by organosulfur in the treatment gases which cannot be ignored. This article summarizes relevant studies on the influence of organosulfur on biological desulfurization in recent years, including the types and physicochemical characteristics of organosulfur, the influence of organosulfur on the desulfurization process, the reaction mechanism of organosulfur, the interplay between organosulfur and some operating conditions, and species of microorganisms that are tolerant to organosulfur. Methods for mitigating the effect of organosulfur on the desulfurization process are discussed, to provide references for the stable and efficient operation of biological desulfurization.
Keywords: organosulfurinhibitionsulfur-oxidationbiological desulfurizationelemental sulfur
天然气、沼气、炼制气、填埋气等气体中往往含有大量无机和有机的含硫化合物,例如硫化氢(H2S)、硫醇、硫醚等物质[1-2]。由于这些物质往往具有一定的毒性、腐蚀性,并且会造成环境污染。因此,这类气体必须进行脱硫处理才能进一步燃烧或排放[3]。目前,常用的脱硫方法有传统的物理-化学法以及以硫氧化细菌为核心的生物法等[4-8]。与前者相比,生物脱硫法具有反应条件温和、脱除效率高、可回收硫磺、无二次污染、成本低等优势,正受到人们越来越多的关注[9-10]。
目前,生物脱硫技术已实现在沼气脱硫、填埋气净化、天然气脱硫等多个领域的广泛应用,并形成了针对低压沼气的THIOPAQTM[11]和针对高压天然气的Shell-Paques[12]的两类技术。生物脱硫的核心是脱硫菌株,目前,主流碱性生物脱硫工艺所用的脱硫菌株主要是以硫杆菌属Thiobacillus为代表的化能自养硫氧化菌,THIOPAQTM正是基于这种菌株开发的[13]。然而,由于脱硫菌株特性的限制,脱硫工艺的运行pH不能超过8.5,盐度不能超过0.5 mol/L Na+[14-15],在该工艺条件下,系统吸收H2S的能力非常有限,而且抗冲击能力较弱。为此,基于嗜盐嗜碱硫氧化菌,研究人员开发出了新的脱硫工艺;这类菌株主要来自硫碱弧菌Thioalkalivibrio、硫碱微菌Thioalkalimicrobium等属,其中,Thioalkalivibrio属菌株在0.3–4 mol/L Na+和pH 8.5–10.0条件下显示出了很高的活性[16-17]。荷兰瓦赫宁根大学和代尔夫特理工大学合作开发出了实验室规模的嗜盐嗜碱生物脱硫系统,展示了Thioalkalivibrio在生物脱硫中的应用潜力[18-19]。近年来,本团队在多年积累的基础上,开发出了新一代的嗜盐嗜碱生物脱硫技术,并在制药废水沼气脱硫中取得了很好的效果,实现了嗜盐嗜碱生物脱硫技术在国内的首次成功应用[20-21]。
通常,一套完整的生物脱硫工艺主要由气体吸收塔、生物硫氧化反应器和沉降塔3个部分组成(图 1)。气体中H2S的脱除主要经历以下过程[19]:(1) 含H2S气体在吸收塔中与吸收液逆流接触,H2S从气相转入液相,使吸收液成为含HS–的富液(反应1);(2) HS–富液进入生物硫氧化反应器中,在微氧条件下,硫氧化微生物将HS–转化为单质硫(S0) (反应2),并在反应器上部累积形成含S0富液;(3) 将含S0富液导入沉降塔中,在重力作用下沉降形成富硫浆液,上层清液在循环泵的作用下导入吸收塔,进行下一轮吸收。富硫浆液经过下游处理,得到高纯度的硫饼。X射线衍射检测表明,形成的S0是以S8环的形式存在[22]。在生物脱硫反应器中,少量的生物硫磺会被微生物进一步代谢形成硫酸根(SO42–) (反应3),此外,硫代硫酸根(S2O32–) 的形成主要由硫化物和聚硫化物的非生物氧化作用形成(反应4–6)[23-24]。这些产物形成与反应器的条件有直接关系,如底物水平、温度、pH。生物脱硫过程控制优先以S0生成为调控方向,原因如下:第一,S0的生成是产生OH–的反应,而SO42–和S2O32–的生成过程会产生H+,从而导致培养基的酸化,不利于生物脱硫过程的进行(反应2);第二,回收的S0可以被重复利用,比如用于农业肥料、杀虫剂生产等。理论上,形成S0的O2/H2S摩尔比是0.5 mol/mol,而形成SO42–的O2/H2S摩尔比是2.0 mol/mol[25]。显然,在这个氧化过程中,人们不希望发生形成SO42–和S2O32–的反应,这样可以更大程度地将HS–转化为S0,同时还可以降低这个过程中系统因调节pH而产生的对碱的消耗[26]。van den Bosch等发现,在pH为8.5,S2–浓度为0.20–0.25 mmol/L时,H2S到S0的转换率可以达到95%,并且没有发现SO42–的积累[27],通过数学模型预测,S0的生成率可以达到98 mol%[28]。在嗜盐嗜碱条件下,调节O2/H2S摩尔比为0.6,脱硫系统达到最佳处理状态,此时硫化物到S0的转化率为83%,此外,分别约有2%和15%的硫化物转化为SO42–和S2O32–[19]。在实际情况中,操作人员往往通过脱硫系统的氧化还原电位(ORP) 反馈改变供氧水平来提高S0的生成率,让生物氧化反应更大程度上在反应1的水平上进行。
 |
| 图 1 生物脱硫工艺流程 Fig. 1 Biological desulfurization process. |
| 图选项 |
 | (1) 化学过程 |
 | (2) 生物过程 |
 | (3) 生物过程 |
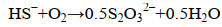 | (4) 化学过程 |
 | (5) 化学过程 |
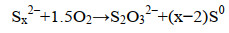 | (6) 化学过程 |
1 有机硫的分类在天然气和一些石化过程产生的气体中,除了含有大量的H2S外,还含有多种有机硫化合物(VOSCs),主要有甲硫醇(MT)、乙硫醇(ET)、丙硫醇(PT)、二硫化碳(CS2)、二甲基硫醚(DMS)、二甲基二硫醚(DMDS)、二甲基三硫醚(DMTS) 等。表 1列举了H2S和一些VOSCs的理化性质,室温下有机硫大多为液态,VOSCs嗅值都比较低,几乎都有令人不愉悦的气味,VOSCs的毒性普遍比H2S小;表 2列举了一些气体中H2S和VOSCs的情况。
表 1 H2S和VOSCs的理化性质Table 1 Physical and chemical properties of H2S and some VOSCs
| Sulfur compound | Boiling point (℃)[2, 32-33] | Melting point (℃)[32-33] | Odor threshold (×10–9 m3/m3)[34] | Odor characterization[35-36] | 50% lethal inhalation concentration for rats (×10–6 m3/m3)[33, 37] |
| H2S | ?60.7 | ?85.5 | 8.5–1 000 | Rotten eggs | 444 |
| MT | 6.2 | ?123.0 | 0.9–8.5 | Disgusting decayed cabbage | 675–1 664 |
| ET | 35.0 | ?147.9 | 0.01–350 | Skunk | 4 970 |
| PT | 67.8 | ?113.1 | 3.1 | Rotten cabbages, skunk | 7 300 |
| DMS | 37.3 | ?98 | 0.6–40 | Unpleasant, decayed vegetables | 40 250 |
| DMDS | 109.7 | ?85 | 0.1–3.6 | Irritating, putrefaction foul | 805 |
表选项
表 2 一些含有硫化物和VOSCs的工业气体Table 2 Some industrial gases with H2S and VOSCs
| Sources | Sulfur compounds | Concentration (×10–6 m3/m3) |
| Brewing wastewater treatment plant [2] | H2S DMS | 4 30 |
| Anaerobic wastewater sludge digester[41] | H2S MT | 100–200 2–4 |
| Landfill gas[42-43] | H2S MT DMS CS2 | > 2 300 > 40 > 9 > 6 |
| Kraft paper production process[2, 44] | H2S MT DMS DMDS | 19 94 17 22 |
| Low pressure fuel gas[45] | H2S MT ET | 12 000 140 50 |
| Liquefied petroleum gas[46] | H2S MT DMS | 60 432 217 |
| Refinery sulfidic spend caustics[47] | S2– MT DMS | 31–67 0.6–20 0–0.63 |
表选项
硫醇是一种类似乙醇结构的物质,它是将乙醇中的氧原子替换成硫原子转变而成的,而R基团一般是烷基或芳基。甲硫醇是硫醇中最常见的物质,也是酸性气体中普遍存在的一种有机硫化合物[38]。硫醇的性质是由它们所带的烃基及弱酸性气体组分决定的,烃基链越长,疏水性越强。硫醇一般都显示弱酸性,而RS-基团具有强亲和性和弱碱性。所以硫醇很容易通过氧化作用形成二硫醚类物质[39]。正是基于硫醇这样的特性,人们将硫醇催化氧化成二硫醚,将其从溶剂中分离出来,并在其他应用领域重复利用[40]。
2 有机硫对生物硫氧化的影响2.1 有机硫在生物反应器中的反应方式利用生物法处理含硫气体时,H2S首先以反应1的方式被吸收下来,同时,气体中的有机硫(如甲硫醇) 也被吸收到液体中(反应7),并进一步在生物反应器中发生一系列的反应。甲硫醇具有很强的亲核性,可以自发地发生一系列化学反应,形成多种聚硫化合物,这个反应的产物主要有硫化物、聚硫化物、二甲基二硫醚(反应8)、二甲基三硫醚,还会形成一些微量的长链二甲基聚硫化物[48]。聚硫化物和聚硫烷主要是由甲硫醇与生物硫磺S8发生化学反应形成的,随后聚硫烷之间发生反应形成亚稳态的中间物,这类中间物很快分解为稳定的二硫或三硫化物类物质(反应9–11)。在嗜盐嗜碱条件下,反应器中有机硫的组成主要为二甲基二硫醚和二甲基三硫醚[30]。
 | (7) |
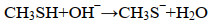 | (8) |
 | (9) |
 | (10) |
 | (11) |
 |
| 图 2 Thioalkalivibrio sp. 的硫代谢途径[20] Fig. 2 Sulfide oxidation pathway in Thioalkalivibrio sp. [20] |
| 图选项 |
从能量角度看,SQR途径更为有利,而且对化合物的毒性更加不敏感[53],然而,在Thioalkalivibrio属中,Fcc催化硫化物氧化是更加普遍的方式。硫醇类有机物中含有巯基结构(-SH),-SH可以破坏分子内的二硫键,硫醇结合到硫化物氧化酶Fcc上,从而改变酶的结构,或结合到酶的活性位点上,使酶的活性降低[54],导致细胞的氧化活性降低,而使培养液中硫化物的化学氧化作用增强。然而,不是所有的硫氧化菌都对硫醇的抑制敏感,例如SQR型硫氧化菌[55]。此外,当脱硫系统处于富氧条件时,ORP水平高(大于?350 mV),生成SO42–的反应程度增强,在加入硫醇后,SO42–的生成明显受到抑制[56]。由于硫化物的8个电子中有6个传递给氧才能形成SO42–,所以作为呼吸链末端的细胞色素c氧化酶保持高活性对硫酸盐的形成至关重要[51],硫醇RSH可与细胞色素c氧化酶的铁血红素位点结合形成细胞色素-硫醇复合物,从而抑制细胞色素c氧化酶的活性,进而影响SO42–的生成[57-59]。研究发现,甲硫醇对系统的生物量有显著的不利影响,这可能与SO42–的生成途径被抑制有关,仅在ORP为?250 mV以上时,这种影响才不会出现,加大生物量后,细胞色素c氧化酶的总水平提高,系统的这种硫氧化能力逐渐恢复[56]。综上所述,在高ORP (大于?350 mV) 条件下,硫醇对SO42–生成的抑制为主,而在低ORP条件下,则对S0生成的影响更明显。
在脱硫系统中,还有一部分甲硫醇与S0反应生成二甲基二硫醚、二甲基三硫醚等,当这些有机硫的浓度超过10 μmol/L时,会引起细胞的分解,进而引起生物量的降低,而当甲硫醇浓度降低至10 μmol/L以下时,反应器的生物量水平会逐步恢复[29]。此外,这些副产物及甲硫醇会部分吸附在硫颗粒上,这个过程类似活性炭、沸石等吸附剂对有机硫的吸附[2, 60],而硫颗粒上附着的蛋白可能与这种吸附作用有关[29, 61],直接分离出来的生物硫磺往往有一点气味,可能也与吸附的有机硫有关。当脱硫系统情况恶化导致反应器中硫化物浓度增加时,甲硫醇等会从硫颗粒中释放出来,这可能是因为在这种条件下,聚硫化物的形成使部分硫颗粒“溶解” (反应5),而自由甲硫醇的浓度(非吸附态)决定了对SO42–形成的抑制水平,因此硫颗粒对甲硫醇的吸附作用有助于降低甲硫醇对细胞的毒害作用[29]。由于甲硫醇等硫醇类物质可以与S0发生化学反应,生成毒性更低的硫醚类物质,而硫醚如二甲基二硫醚可以通过生物氧化作用转为SO42–和CO2,因此,对脱硫系统而言,这类反应往往具有解毒的作用,这也暗示了利用生物法处理含H2S和硫醇气体的可行性[30-31]。作为甲硫醇与生物硫磺的反应产物,二甲基二硫醚相对稳定,对S0的亲和性较低。Kiragosyan等通过实验室装置深入研究发现,在高生物量水平下,二甲基二硫醚可以抑制SO42–生成,并将S0生成率提高到96%;但是,也发现二甲基二硫醚会降低硫化物的生物氧化速率,并伴随着S2O32–一定程度的增加[62]。此外,作者还发现HS–可以与二甲基二硫醚反应形成甲硫醇和二甲基三硫醚,如反应12–14,亚硫酸根(SO32–) 不稳定,可以很快被氧化为SO42–,或与S0反应生成S2O32–[62]。该过程生成挥发能力更弱、疏水性强的双基团聚硫烷物质,这类物质能够吸附在硫颗粒表面,而且硫链越长吸附能力越强,这些吸附物可以随着S0的沉降回收操作从反应器悬浮物中去除[63]。然而,Roman等发现,在反应器中加入RSHs硫醇后,通过化学反应生成的疏水性聚硫醚吸附到硫颗粒上,使原来胶体状生物硫颗粒凝结成更大尺寸的疏水性硫磺颗粒,而且这种硫颗粒吸引大量细胞的附着[64],在进行硫磺沉降分离操作时,细胞被带走,使系统生物量降低,影响系统的稳定性。
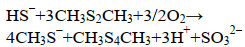 | (12) |
 | (13) |
 | (14) |
2.4 ORP、盐浓度、pH与有机硫之间的关系ORP是反应生物脱硫系统氧化还原状态的关键参数,通过调节ORP可实现对系统内硫氧化反应状态的调控。研究发现,在硫醇存在时,系统的脱硫效率和稳定性明显下降,传统方法中通过控制氧气供应来维持ORP值在设定水平似乎不再准确,因为硫醇的自发氧化过程会影响ORP电极的测量水平,使ORP数值降低,导致系统需要加大供氧能力才能维持到所需的ORP水平上[62-63]。此外,硫醇的一些反应产物如二甲基聚硫烷、二乙基聚硫烷、二丙基聚硫烷等也可显著降低系统的ORP,还原性更强,挥发性更低,相同浓度下后者对系统的毒害作用更大[63],其抑制能力正好与生成它们的相应硫醇的能力相反[67]。此外,研究人员还发现,对比1.5 mol/L [Na++K+]盐浓度,系统在0.5 mol/L的盐浓度下耐受甲硫醇和二甲基二硫醚的浓度要高2–3倍,因此可以降低脱硫系统的盐浓度,有效缓减甲硫醇等对生物氧化的消极影响[30]。降低系统盐浓度还有助于增加溶氧水平,降低细胞为对抗高盐条件产生的能量消耗。van den Bosch等研究发现S2O32–的形成随着系统pH升高而增大,pH 10.2下S2O32–的生成量是pH 8.7下的4倍[27],因此可以推测在高pH条件下,S2O32–化学氧化消耗了更多的氧,导致硫醇的氧化速率可能降低,从而对系统的毒性更大。Arellano- García等利用生物滴滤塔移除二甲基二硫醚,并通过呼吸测试对比发现,中性条件比碱性条件的氧气消耗大约快10倍,中性条件及碱性条件下的二甲基二硫醚的去除率分别为24和17 gDMDS/(m3·h)[6]。
2.5 耐受有机硫的微生物脱硫系统对有机硫的耐受程度与系统中的微生物种类有很大关系。Roman等对运行10年以上的嗜盐嗜碱脱硫系统进行了16S rRNA扩增子高通量测序分析,结果显示,系统中的硫碱杆菌属Thioalkalibacter和碱湖生菌属Alkalimnicola属,而不是Thioalkalivibrio属微生物对耐受硫醇有显著作用[63],而且尽管生物脱硫的核心菌株来自Thioalkalivibrio相属,但是研究发现在硫醇RSHs存在的情况下,Thioalkalibacter相比Thioalkalivibrio去除硫化物的能力更强[68]。同样,Kiragosyan等发现增加二甲基二硫醚的浓度6 d后,系统中Thioalkalivibrio、Thioalkalimicrobium、Alkalimnicola、盐单胞菌属(Halomonas) 的丰度下降,Thioalkalibacter丰度却显著提高[62],而且Thioalkalibacter丰度短时间的提升表明其对有机硫的耐受能力很强,对比发现Thioalkalivibacter的IC50是Thioalkalivibrio的两倍[67],这说明了Thioalkalibacter在生物脱硫过程中耐受有机硫的重要作用,有机硫的存在提高了Thioalkalibacter在脱硫菌群中的竞争性优势。甲硫醇是可以作用于细菌硫氧化活性的竞争性抑制剂,而二甲基二硫醚是一种非竞争性抑制剂,由于甲硫醇很容易通过反应生成二甲基二硫醚[67],因此,二甲基二硫醚是Thioalkalibacter的迅速繁殖的直接原因[62]。此外,上述研究也暗示了在耐受有机硫方面,Thioalkalibacter比Alkalimnicola的能力更全面;而Halomonas尽管代谢有机物的种类较广,但似乎不具备代谢有机硫的能力。因此,在大型脱硫系统启动时,提高种子液中的Thioalkalibacter的丰度,有利于提高系统运行的稳定程度,降低系统对碱的需求和减少可溶性硫化合物的积累。值得一提的是,在pH 10的条件下,Arellano-García利用生物滴滤塔处理H2S和二甲基二硫醚的混合气,二者的移除率接近100%。菌群分析表明,Thioalkalivibrio在细菌中占主导,还发现一种具有氧化S0和S2O32-的镰孢菌属Fusarium在真菌中丰度最高[69]。此外,还有一些利用Thiobacillus同步移除H2S和有机硫的研究[70-72],但是这些工艺的操作pH仅为7.0左右,在大规模气体生物脱硫中应用前景有限,这里不做深入讨论。
为了揭示Thioalkalibacter耐受有机硫的原因,研究人员从细胞内参与电子传递呼吸氧化酶差异的角度进行了深入探究。Thioalkalivibrio仅含有血红素-铜超家族细胞色素c氧化酶,且大部分为cbb3型[52, 73-74],此外,酶学研究显示Alkalimnicola的呼吸氧化酶可能也是cbb3型[75]。而Thioalkalibacter除了有cbb3型外,还存在一种bd型的醌氧化酶[62]。研究表明,有机硫可以抑制细胞色素c氧化酶的活性,而醌氧化酶则对细胞色素c氧化酶的抑制剂不敏感[63, 76]。所以Thioalkalibacter的呼吸氧化方式比较多样化可能是其对有机硫的耐受性更强的原因。
3 提高生物脱硫系统稳定性的策略作为一种竞争性抑制剂,甲硫醇与HS–竞争酶的活性位点及结合率的能力依赖其浓度的大小,通过增加细胞色素c氧化酶的浓度(比如提高生物量) 和底物(S2–)的浓度,可以有效降低其带来的抑制作用,可以通过降低ORP来降低甲硫醇的抑制作用[56]。在一些情况下,通过适量增加甲硫醇,就可以优化S0的形成[29-30]。由于Thioalkalibacter对有机硫耐受性好,因此可以在硫氧化菌种子液中加入一定浓度的Thioalkalibacter或者提高原有种子液中Thioalkalibacter的丰度,有利于提高系统运行的稳定程度。
由于有机硫能够降低系统的ORP,所以当有机硫存在时,只通过ORP来调控脱硫系统的状态不再有效,Kiragosyan等提出了正反馈策略来规避有机硫的影响,即通过实时测定气体中H2S的浓度,并在略高于理论值(0.5) 的固定O2/H2S (0.63) 下调控脱硫反应器的供氧水平,使S0的生成率达到95 mol%以上[66]。Roman也认为在处理含有有机硫的气体时,对供氧水平的控制应该基于硫化物和有机硫的实际浓度,而不是依靠ORP来调控[64]。此外,实时监测系统pH、盐浓度等变化情况,将其及时调节至合适的位置,以保证系统的最佳性能。在实际脱硫操作中,也可参考每一种硫醇的抑制特性的数学模型,设计可以通过增加生物量或底物浓度来阻止抑制发生的全尺度系统[67]。
硫醇很容易发生化学反应生成聚硫醚,后者疏水性强很容易吸附到硫颗粒上,这使得有机硫抑制作用减弱。因此通过提高硫醇到聚硫醚的化学氧化作用可以缓解硫醇对系统的抑制作用。通过延长吸收塔中气液接触时间,有助于提高硫醇的氧化速率。Elzinga等通过控制合适的电流密度,在一台生物电化学系统的阴极上将甲硫醇、乙硫醇、丙硫醇以及二甲基二硫醚转化成了硫化物[77]。若将该方法与生物脱硫技术结合,在一定程度上可以达到降低有机硫抑制脱硫过程的目的,也可以提高生物脱硫过程的可控性以及硫回收率。
4 总结与展望由于条件温和、能耗低、维护成本低、脱硫性能好等显著优势,生物脱硫技术正逐渐受到人们的青睐。本文主要针对生物脱硫过程中有机硫的影响进行了详细的分析总结,甲硫醇和二甲基二硫醚是脱硫气体中经常含有的有机硫类型,甲硫醇对脱硫过程的抑制程度最大,但是微量的甲硫醇又可以促进S0的生成;甲硫醇很容易自发氧化为二甲基二硫醚,从而降低了对系统的毒性,二甲基二硫醚可以通过生物作用被代谢成SO42–;甲硫醇也可以与S0发生反应,生成多种复杂的聚硫烷类物质,其他硫醇类物质也有类似的作用;研究人员还基于6种常见有机硫建立了数学模型,可以用来评估有机硫对系统的影响,有助于指导系统的运行。研究表明,ORP、pH、[Na++K+]盐浓度等因素与脱硫系统的耐受有机硫能力有直接关系。此外,人们还发现Thioalkalibacter是一种耐受有机硫的微生物,因此在脱硫启动时,可以通过提高种子液中Thioalkalibacter的丰度来提高系统运行的稳定性。尽管目前已经有了很多关于脱除有机硫的研究[6-7, 70, 78],但是往往由于H2S和有机硫是相伴而生,而且H2S的浓度比有机硫高很多,所以脱除过程中可能受H2S的影响更大,通过先单独去除有机硫消除对脱硫过程的不利影响是很难实现的,而通过调节菌群结构、优化操作条件,与H2S的处理协同进行可能是比较合理的方式。
随着生物脱硫技术的不断发展和完善,结合国家环保要求的逐渐提高以及人们对天然气、沼气等能源气体需求的不断加大,生物脱硫技术将更加欣欣向荣,不久的将来人们就能看到该技术在气体脱硫领域的广泛应用。
参考文献
| [1] | Muradov N, Smith F. Thermocatalytic conversion of landfill gas and biogas to alternative transportation fuels. Energy Fuels, 2008, 22(3): 2053-2060. DOI:10.1021/ef8000532 |
| [2] | Smet E, Lens P, Van Langenhove H. Treatment of waste gases contaminated with odorous sulfur compounds. Crit Rev Environ Sci Technol, 1998, 28(1): 89-117. DOI:10.1080/10643389891254179 |
| [3] | Kelly D. Global consequences of the microbial production and consumption of inorganic and organic sulfur compounds//Timmis KN, Ed. Handbook of Hydrocarbon and Lipid Microbiology. Berlin, Heidelberg: Springer, 2010. |
| [4] | Gómez-Ramírez M, Zarco-Tovar K, Aburto J, et al. Microbial treatment of sulfur-contaminated industrial wastes. J Environ Sci Health, 2014, 49(2): 228-232. DOI:10.1080/10934529.2013.838926 |
| [5] | Li L, Han YP, Yan X, et al. H2S removal and bacterial structure along a full-scale biofilter bed packed with polyurethane foam in a landfill site. Bioresour Technol, 2013, 147: 52-58. DOI:10.1016/j.biortech.2013.07.143 |
| [6] | Arellano-Garcia L, González-Sánchez A, Van Langenhove H, et al. Removal of odorant dimethyl disulfide under alkaline and neutral conditions in biotrickling filters. Water Sci Technol, 2012, 66(8): 1641-1646. DOI:10.2166/wst.2012.365 |
| [7] | Badr K, Bahmani M, Jahanmiri A, et al. Biological removal of methanethiol from gas and water streams by using Thiobacillus thioparus: investigation of biodegradability and optimization of sulphur production. Environ Technol, 2014, 35(14): 1729-1735. DOI:10.1080/09593330.2014.881404 |
| [8] | De Angelis A. Natural gas removal of hydrogen sulphide and mercaptans. Appl Catal B-Environ, 2012, 113-114: 37-42. DOI:10.1016/j.apcatb.2011.11.026 |
| [9] | Gommers PJ, Buleveld W, Kuenen JG. Simultaneous sulfide and acetate oxidation in a denitrifying fluidized bed reactor—Ⅰ. Start-up and reactor performance. Water Res, 1988, 22(9): 1075-1083. DOI:10.1016/0043-1354(88)90001-2 |
| [10] | Buisman CJN, Geraats BG, Ijspeert P, et al. Optimization of sulphur production in a biotechnological sulphide-removing reactor. Biotechnol Bioeng, 1990, 35(1): 50-56. DOI:10.1002/bit.260350108 |
| [11] | Driessen W, Van Zessen E, Visser M. Full-scale experience with biological biogas desulfurization//16th European Biosolids and Organic Resources Conference, 2011. |
| [12] | Janssen A, Van Den Bosch PL, Van Leerdam RC, et al. Bioprocesses for the removal of volatile sulfur compounds from gas streams//Kennes C, Veiga MC, Eds. Air Pollution Prevention and Control: Bioreactors and Bioenergy. Hoboken: Wiley, 2013: 247-274. |
| [13] | 蒲万芬, 胡佩. 酸性气体中硫化氢的微生物脱除方法. 天然气工业, 2005, 25(3): 166-170. Pu WF, Hu P. Method to remove hydrogen sulfide from sour gas by microorganisms. Nat Gas Ind, 2005, 25(3): 166-170 (in Chinese). DOI:10.3321/j.issn:1000-0976.2005.03.050 |
| [14] | Kelly DP, Wood AP. Confirmation of Thiobacillus denitrificans as a species of the genus Thiobacillus, in the beta-subclass of the Proteobacteria, with strain NCIMB 9548 as the type strain. Int J Syst Evol Microbiol, 2000, 50(2): 547-550. DOI:10.1099/00207713-50-2-547 |
| [15] | Song ZY, Xing JM. Optimization of the bio-desulfurization for coupling with biogas purification. Adv Mater Res, 2012, 518: 1771-1775. |
| [16] | Sorokin DY, Kuenen JG, Muyzer G. The microbial sulfur cycle at extremely haloalkaline conditions of soda lakes. Front Microbiol, 2011, 2: 44. |
| [17] | Sorokin DY, Zacharova EE, Pimenov NV, et al. Sulfidogenesis in hypersaline chloride-sulfate lakes of Kulunda Steppe (Altai, Russia). FEMS Microbiol Ecol, 2012, 79(2): 445-453. DOI:10.1111/j.1574-6941.2011.01228.x |
| [18] | Sorokin DY, Van Den Bosch PL, Abbas B, et al. Microbiological analysis of the population of extremely haloalkaliphilic sulfur-oxidizing bacteria dominating in lab-scale sulfide-removing bioreactors. Appl Microbiol Biotechnol, 2008, 80(6): 965-975. DOI:10.1007/s00253-008-1598-8 |
| [19] | Van Den Bosch PL, Van Beusekom OC, Buisman CJN, et al. Sulfide oxidation at halo‐alkaline conditions in a fed-batch bioreactor. Biotechnol Bioeng, 2007, 97(5): 1053-1063. DOI:10.1002/bit.21326 |
| [20] | 穆廷桢. 嗜盐嗜碱多能硫碱弧菌SOB306代谢工程及脱硫工艺研究[D]. 北京: 中国科学院大学, 2016. Mu TZ. Metabolic engineering of haloalkaliphilic Thialkalivibrio versutus SOB306 and its application in biodesulfurization[D]. Beijing: University of Chinese Academy of Sciences, 2016 (in Chinese). |
| [21] | 苗得露. 高硫酸盐废水碳氮硫共脱除工艺的实验研究[D]. 石家庄: 河北科技大学, 2014. Miao DL. Experimental study on the simultaneous carbon, nitrogen and sulfur removal from high-sulfate wastewater[D]. Shijiazhuang: Hebei University of Science and Technology, 2014 (in Chinese). |
| [22] | Janssen AJ, Van Leerdam R, Van Den Bosch P, et al. Development of a family of large-scale biothechnological processes to desukphurise industrial gases//Proceedings of the Ⅱ International Congress in Biotechniques for Air Pollution Control. La Coruna, Spain: Universidade da Coruna, 2007, 167-183. |
| [23] | O'Brien DJ, Birkner FB. Kinetics of oxygenation of reduced sulfur species in aqueous solution. Environ Sci Technol, 1977, 11(12): 1114-1120. DOI:10.1021/es60135a009 |
| [24] | Kleinjan WE, De Keizer A, Janssen AJH. Kinetics of the chemical oxidation of polysulfide anions in aqueous solution. Water Res, 2005, 39(17): 4093-4100. DOI:10.1016/j.watres.2005.08.006 |
| [25] | Klok JB, Van Den Bosch PL, Buisman CJN, et al. Pathways of sulfide oxidation by haloalkaliphilic bacteria in limited-oxygen gas lift bioreactors. Environ Sci Technol, 2012, 46(14): 7581-7586. DOI:10.1021/es301480z |
| [26] | Cline C, Hoksberg A, Abry E, et al. Biological process for H2S removal from gas streams the Shell-Paques/ThiopaqTM gas desulfurization process//Proceeding of the Laurance Reid Gas Conditioning Conference, 2003. |
| [27] | Van Den Bosch PLF, Sorokin DY, Buisman CJN, et al. The effect of pH on thiosulfate formation in a biotechnological process for the removal of hydrogen sulfide from gas streams. Environ Sci Technol, 2008, 42(7): 2637-2642. DOI:10.1021/es7024438 |
| [28] | Klok JB, De Graaff M, Van Den Bosch PLF, et al. A physiologically based kinetic model for bacterial sulfide oxidation. Water Res, 2013, 47(2): 483-492. DOI:10.1016/j.watres.2012.09.021 |
| [29] | Van Den Bosch PLF, Fortuny-Picornell M, Janssen AJH. Effects of methanethiol on the biological oxidation of sulfide at natron-alkaline conditions. Environ Sci Technol, 2009, 43(2): 453-459. DOI:10.1021/es801894p |
| [30] | Roman P, Veltman R, Bijmans MFM, et al. Effect of methanethiol concentration on sulfur production in biological desulfurization systems under haloalkaline conditions. Environ Sci Technol, 2015, 49(15): 9212-9221. DOI:10.1021/acs.est.5b01758 |
| [31] | Van Den Bosch PL, De Graaff M, Fortuny-Picornell M, et al. Inhibition of microbiological sulfide oxidation by methanethiol and dimethyl polysulfides at natron-alkaline conditions. Appl Microbiol Biotechnol, 2009, 83(3): 579-587. DOI:10.1007/s00253-009-1951-6 |
| [32] | Weast RC, Astle M. Handbook of chemistry and physics CRC Press. Boca Raton (2005–2006), 1981. |
| [33] | Norell J, Louthan RP. Thiols//Kirk RE, Othmer DF, Eds. Encyclopedia of Chemical Technology. New York: John Wiley & Sons, Inc, 1983: 946-964. |
| [34] | De Zwart JMM, Kuenen JG. C1-cycle of sulfur compounds. Biodegradation, 1992, 3(1): 37-59. DOI:10.1007/BF00189634 |
| [35] | Miller FC, Macauley BJ. Odours arising from mushroom composting: a review. Aust J Exp Agric, 1988, 28(4): 553-560. DOI:10.1071/EA9880553 |
| [36] | Bonnin C, Laborie A, Paillard H. Odor nuisances created by sludge treatment: problems and solutions. Water Sci Technol, 1990, 22(12): 65-74. DOI:10.2166/wst.1990.0101 |
| [37] | Health Council of the Netherlands: Committee on Updating of Occupational Exposure Limits. Ethanethiol: health-based reassessment of administrative occupational exposure limits. The Hague: Health Council of Netherlands, 2004, 2000/15OSH/120. |
| [38] | Carlsson AF, Rajani JB. New options for mercaptans removal. Hydrocarb Eng, 2005, 10(2): 23-26. |
| [39] | Klein D. Organic Chemistry. JAMA, 1945, 129(1): 97. DOI:10.1001/jama.1945.02860350099036 |
| [40] | Bricker JC, Laricchia L. Advances in MeroxTM process and catalysis for thiol oxidation. Top Catal, 2012, 55(19/20): 1315-1323. |
| [41] | Iranpour R, Cox HHJ, Fan S, et al. Short-term and long-term effects of increasing temperatures on the stability and the production of volatile sulfur compounds in full‐scale thermophilic anaerobic digesters. Biotechnol Bioeng, 2005, 91(2): 199-212. DOI:10.1002/bit.20518 |
| [42] | B?rjesson G. Inhibition of methane oxidation by volatile sulfur compounds (CH3SH and CS2) in landfill cover soils. Waste Manage Res, 2001, 19(4): 314-319. DOI:10.1177/0734242X0101900408 |
| [43] | Kim KH, Choi YJ, Jeon EC, et al. Characterization of malodorous sulfur compounds in landfill gas. Atmos Environ, 2005, 39(6): 1103-1112. DOI:10.1016/j.atmosenv.2004.09.083 |
| [44] | Karnofski MA. Odor generation in the kraft process. J Chem Educ, 1975, 52(8): 490. DOI:10.1021/ed052p490 |
| [45] | Fredericks EM, Harlow GA. Determination of mercaptans in sour natural gases by gas liquid chromatography and microcoulometric titration. Anal Chem, 1964, 36(2): 263-266. DOI:10.1021/ac60208a006 |
| [46] | Manieh AA, Ghorayeb N. How to design a caustic wash. Hydrocarb Process, 1981, 60(9): 143-144. |
| [47] | Sipma J, Svitelskaya A, Van Der Mark B, et al. Potentials of biological oxidation processes for the treatment of spent sulfidic caustics containing thiols. Water Res, 2004, 38(20): 4331-4340. DOI:10.1016/j.watres.2004.08.022 |
| [48] | Steudel R. The chemistry of organic polysulfanes R?Sn?R (n > 2). Chem Rev, 2002, 102(11): 3905-3946. DOI:10.1021/cr010127m |
| [49] | Dahl C, Friedrich CG. Microbial sulfur metabolism. New York: Springer, 2008. |
| [50] | Chen ZW, Koh M, Van riessche DG, et al. The structure of flavocytochrome c sulfide dehydrogenase from a purple phototrophic bacterium. Science, 1994, 266(5184): 430-432. DOI:10.1126/science.7939681 |
| [51] | Visser JM, Robertson LA, Van Verseveld HW, et al. Sulfur production by obligately chemolithoautotrophic thiobacillus species. Appl Environ Microbiol, 1997, 63(6): 2300-2305. DOI:10.1128/AEM.63.6.2300-2305.1997 |
| [52] | Muyzer G, Sorokin DY, Mavromatis K, et al. Complete genome sequence of "Thioalkalivibrio sulfidophilus" HL-EbGr7. Stand Genomic Sci, 2011, 4(1): 23-35. DOI:10.4056/sigs.1483693 |
| [53] | Brune DC. Sulfur oxidation by phototrophic bacteria. Biochim Biophys Acta -Bioenerget, 1989, 975(2): 189-221. DOI:10.1016/S0005-2728(89)80251-8 |
| [54] | Finkelstein A, Benevenga NJ. The effect of methanethiol and methionine toxicity on the activities of cytochrome c oxidase and enzymes involved in protection from peroxidative damage. J Nutr, 1986, 116(2): 204-215. DOI:10.1093/jn/116.2.204 |
| [55] | Kiragosyan K, Klok JBM, Keesman KJ, et al. Development and validation of a physiologically based kinetic model for starting up and operation of the biological gas desulfurization process under haloalkaline conditions. Water Res X, 2019, 4: 100035. DOI:10.1016/j.wroa.2019.100035 |
| [56] | Roman P, Bijmans MFM, Janssen AJH. Influence of methanethiol on biological sulphide oxidation in gas treatment system. Environ Technol, 2016, 37(13): 1693-1703. DOI:10.1080/09593330.2015.1128001 |
| [57] | Hu TM, Ho SC. Kinetics of redox interaction between cytochrome c and thiols. J Med Sci, 2011, 31(3): 109-115. |
| [58] | Tomková A, Antalik M, Bágel'ová J, et al. Absorption and Raman spectroscopy study of cyt c-thiol complexes in acidic solutions. Gen Physiol Biophys, 1992, 11(3): 273-286. |
| [59] | Wilms J, Lub J, Wever R. Reactions of mercaptans with cytochrome c oxidase and cytochrome c. Biochim Biophys Acta-Bioenerget, 1980, 589(2): 324-335. DOI:10.1016/0005-2728(80)90048-1 |
| [60] | Bashkova S, Bagreev A, Bandosz TJ. Adsorption of methyl mercaptan on activated carbons. Environ Sci Technol, 2002, 36(12): 2777-2782. DOI:10.1021/es011416v |
| [61] | Janssen A, Lettinga G, De Keizer A. Removal of hydrogen sulphide from wastewater and waste gases by biological conversion to elemental sulphur: colloidal and interfacial aspects of biologically produced sulphur particles. Colloids Surf A: Physicochem Eng Aspects, 1999, 151(1/2): 389-397. |
| [62] | Kiragosyan K, Picard M, Sorokin DY, et al. Effect of dimethyl disulfide on the sulfur formation and microbial community composition during the biological H2S removal from sour gas streams. J Hazard Mater, 2020, 386: 121916. DOI:10.1016/j.jhazmat.2019.121916 |
| [63] | Roman P, Klok JBM, Sousa JAB, et al. Selection and application of sulfide oxidizing microorganisms able to withstand thiols in gas biodesulfurization systems. Environ Science Technol, 2016, 50(23): 12808-12815. DOI:10.1021/acs.est.6b04222 |
| [64] | Roman P. Biotechnological removal of H2S and thiols from sour gas streams under haloalkaline conditions[D]. Netherlands: Wageningen University, 2016. |
| [65] | Van Den Bosch PL. Biological sulfide oxidation by natron-alkaliphilic bacteria: application in gas desulfurization[D]. Netherlands: Wageningen University, 2008. |
| [66] | Kiragosyan K. Maximization of sulfur formation in the presence of organic sulfur compounds in a dual bioreactor gas desulfurization system[D]. Wageningen: Wageningen University 2020. |
| [67] | Roman P, Lipińska J, Bijmans MFM, et al. Inhibition of a biological sulfide oxidation under haloalkaline conditions by thiols and diorgano polysulfanes. Water Res, 2016, 101: 448-456. DOI:10.1016/j.watres.2016.06.003 |
| [68] | Sorokin DY, Merkel A, Muyzer G. Thioalkalibacter//Oren A, Ed. Bergey's Manual of Systematics of Archaea and Bacteria. New York: John Wiley & Sons, 2020. |
| [69] | Arellano-García L, Le Borgne S, Revah S. Simultaneous treatment of dimethyl disulfide and hydrogen sulfide in an alkaline biotrickling filter. Chemosphere, 2018, 191: 809-816. DOI:10.1016/j.chemosphere.2017.10.096 |
| [70] | Yao XZ, Chu YX, Wang C, et al. Enhanced removal of methanethiol and its conversion products in the presence of methane in biofilters. J Clean Prod, 2019, 215: 75-83. DOI:10.1016/j.jclepro.2019.01.019 |
| [71] | Cha JM, Cha WS, Lee JH. Removal of organo-sulphur odour compounds by Thiobacillus novellus SRM, sulphur-oxidizing microorganisms. Process Biochem, 1999, 34(6/7): 659-665. |
| [72] | Liu DZ, Feilberg A, Hansen MJ, et al. Modeling removal of volatile sulfur compounds in a full-scale biological air filter. J Chem Technol Biotechnol, 2016, 91(4): 1119-1127. DOI:10.1002/jctb.4696 |
| [73] | Muntyan MS, Cherepanov DA, Malinen AM, et al. Cytochrome cbb3 of Thioalkalivibrio is a Na+-pumping cytochrome oxidase. Proc Natl Acad Sci USA, 2015, 112(25): 7695-7700. DOI:10.1073/pnas.1417071112 |
| [74] | Sorokin DY, Lysenko AM, Mityushina LL, et al. Thioalkalimicrobium aerophilum gen. nov., sp. nov. and Thioalkalimicrobium sibericum sp. nov., and Thioalkalivibrio versutus gen. nov., sp. nov., Thioalkalivibrio nitratis sp. nov., novel and Thioalkalivibrio denitrificancs sp. nov., novel obligately alkaliphilic and obligately chemolithoautotrophic sulfur-oxidizing bacteria from soda lakes. Inter J Syst Evol Microbiol, 2001, 51(2): 565-580. |
| [75] | Sorokin DY, Tourova TP, Kovaleva OL, et al. Aerobic carboxydotrophy under extremely haloalkaline conditions in Alkalispirillum/Alkalilimnicola strains isolated from soda lakes. Microbiology, 2010, 156(3): 819-827. DOI:10.1099/mic.0.033712-0 |
| [76] | Banciu HL, Sorokin DY, Tourova TP, et al. Influence of salts and pH on growth and activity of a novel facultatively alkaliphilic, extremely salt- tolerant, obligately chemolithoautotrophic sufur- oxidizing Gammaproteobacterium Thioalkalibacter halophilus gen. nov., sp. nov. from South-Western Siberian soda lakes. Extremophiles, 2008, 12(3): 391-404. DOI:10.1007/s00792-008-0142-1 |
| [77] | Elzinga M, Liu DD, Klok JBM, et al. Microbial reduction of organosulfur compounds at cathodes in bioelectrochemical systems. Environ Sci Ecotechnol, 2020, 1: 100009. DOI:10.1016/j.ese.2020.100009 |
| [78] | Chen XQ, Liang ZS, An TC, et al. Comparative elimination of dimethyl disulfide by maifanite and ceramic-packed biotrickling filters and their response to microbial community. Bioresour Technol, 2016, 202: 76-83. DOI:10.1016/j.biortech.2015.11.081 |
