

1. 南京工业大学 生物与制药工程学院 药学院 材料化学工程国家重点实验室,江苏 南京 211816;
2. 江南大学 化学与材料工程学院 合成与生物胶体教育部重点实验室,江苏 无锡 214122
收稿日期:2020-06-09;接收日期:2020-08-24
基金项目:国家自然科学基金(No. 21805135),江苏省自然科学基金(No. BK20180712),江南大学合成与生物胶体教育部重点实验室开放课题(No. JDSJ2018-11),南京留学人员科技创新项目择优资助,国家重点研发计划(No. 2018YFA0902200),江苏省生物质能源与材料重点实验室开放基金资助项目(No. JSBEM2016010) 资助
摘要:纳米金属材料具有纳米晶强化效应、光吸收率大、较高的表面能和单磁畴性能等优点,因其在医药、化学催化、抗菌抑毒等方面发挥着越来越重要的作用而受到人们广泛关注。近年来,随着全球石化资源消耗与日俱增,环境污染加剧,基于可再生资源的生物基分子介导纳米材料的制备研究方兴未艾。生物基分子是指直接或间接来源于生物质的小分子或大分子物质,它们多数具有生物相容性好、低毒、可降解、来源广泛、价格低廉等优点。且由于生物基分子多数具有独特的理化性质,如具有生理活性的旋光性、酸碱两性、亲水亲油性以及易与金属离子络合等,其介导合成的纳米材料还兼具其独特功能性,比如消炎、抗癌、抗氧化、抗病毒以及降血糖血脂等,进一步拓宽了纳米金属材料的应用领域。文中对近年来基于生物基分子介导纳米金属材料的制备及应用进行全面综述,为开展相关研究提供参考。
关键词:生物基分子纳米金属材料生物传感抗菌抑毒催化
Bio-based molecules for biosynthesis of nano-metallic materials
Yan Fang1,2, Lingling Fan1, Huiyu Bai2, Binrui Li1, Haowei Zhang1, Fengxue Xin1, Jiangfeng Ma1, Min Jiang1


1. State Key Laboratory of Materials-Oriented Chemical Engineering, School of Pharmaceutical Sciences, College of Biotechnology and Pharmaceutical Engineering, Nanjing Tech University, Nanjing 211816, Jiangsu, China;
2. The Key Laboratory of Synthetic and Biological Colloids, Ministry of Education, School of Chemical and Material Engineering, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: June 9, 2020; Accepted: August 24, 2020
Supported by: National Natural Science Foundation of China (No. 21805135), Jiangsu Province Natural Science Foundation for Youths (No. BK20180712), Open Research Fund of the Key Laboratory of Synthetic and Biological Colloids, Ministry of Education (No. JDSJ2018-11), Science and Technology Innovation Projects for Overseas Talents in Nanjing, National Key Research and Development Program of China (No. 2018YFA0902200), Jiangsu Key Lab of Biomass-based Green Fuels and Chemicals Foundation (No. JSBEM2016010)
Corresponding author: Min Jiang. Tel/Fax: +86-25-58139906; E-mail: bioengine@njtech.edu.cn.
Abstract: Nano-metallic materials are playing an important role in the application of medicine, catalysis, antibacterial and anti-toxin due to their obvious advantages, including nanocrystalline strengthening effect, high photo-absorptivity, high surface energy and single magnetic region performance. In recent years, with the increasing consumption of global petrochemical resources and the aggravation of environmental pollution, nanomaterials based on bio-based molecules have aroused great concern. Bio-based molecules refer to small molecules and macromolecules directly or indirectly derived from biomass. They usually have good biocompatibility, low toxicity, degradability, wide source and low price. Besides, most bio-based molecules have unique physical, chemical properties and physiological activity, such as optical activity, acid/alkali amphoteric property, hydrophilic property and easy coordination with metal ions. Thus, the corresponding nano-materials based on bio-based molecules also have unique functions, such as anti-inflammatory, anti-cancer, anti-oxidation, antiviral fall blood sugar and blood fat etc. In this paper, we give a comprehensive overview of the preparation and application of nano-metallic materials based on bio-based molecules in recent years.
Keywords: bio-based moleculesnano-metallic materialsbiosensorantibacterialcatalysis
纳米科技是21世纪的又一次产业革命。自1861年胶体化学的建立以来,科研工作者就开始对1–100 nm的粒子体系产生兴趣,至1990年第一届国际纳米科学技术会议的成功举办,标志着纳米科学技术的正式诞生。此后数年,众多科研工作者对纳米材料研究不断深入,并成功地实现部分纳米材料产业化。纳米材料是指在结构上具有1–100 nm尺度特征的材料,其纳米尺寸的独特性,使其具有量子尺寸效应、小尺寸效应、表面效应、宏观量子隧道效应等特性,以及因此引起的光学、热学、电学、磁学、力学、化学性质变化的独特性,这些特性为现存难题提供了新的解决思路,也拓展了纳米材料的应用领域。目前,按组成不同可分为金属纳米材料(纯金属、金属合金、有机无机复合) 和非金属纳米材料(石墨烯量子点、碳纳米管、生物纳米材料等)[1-3]。其中金属纳米材料主要包括纳米金、纳米银、纳米铂金等纯贵金属、金属合金、以及有机无机复合金属纳米材料,其具有优良的导电性能[4]、可增强局域表面等离子体共振[5]、表面易被功能化合物修饰[6]等优点,在医学、抗菌抑毒、电化学、化学催化等领域发挥着重要的作用,因而备受关注。
目前,纳米金属材料的制备方法主要有物理法、化学法以及生物合成法。物理法指的是通过物理过程将原有宏观材料粉碎成超微细材料,使其尺寸上达到纳米尺度。主要包括高能机械球磨法、气体冷凝法、压淬法等,该方法具有成本低、产量高、工艺简单等优点,但其耗能高、所制备的颗粒粒径均匀度欠佳、稳定及储藏稳定性不高[7-8]。化学法是指通过物质之间发生的化学反应形成纳米微粒的方法,涉及氧化还原、共沉淀、成核凝聚等多种化学原理,目前主要包括水相氧化还原法、相转移法(主要为Brust法)[9-10]、水热法[11]、晶种生长法(又称种金生长法)[12]、模板法[13]、反相胶束法[14]、微波合成法[15-16]等。化学法合成的纳米材料具有粒径均一性高、稳定性强、化学组分明确的特点,且材料性能稳定,适合工业化生产。但一方面材料表面易有杂质,而且较难去除;另一方面合成过程需要使用有机溶剂,毒性高且多数有机溶剂来源于石化资源,并且转化率较低,很难满足绿色化学的要求。生物合成法主要是利用微生物(细菌、真菌和海藻等) 的生物转化特性,通过培养特定菌并利用其生长代谢过程中细胞内外分泌物(酶、电子供体等) 的氧化还原反应将纳米离子催化转化为纳米粒子,虽然操作简便、过程绿色、关键物质的生产来源于可再生资源,但由于存在微生物体系组分复杂、过程难控制、纳米材料催化合成机理不明,该技术所生产的纳米材料尺寸均一性差、试验重复性也较差、且微生物生物转化所需环境要求高等缺点,此法目前还不能用于工业化生产纳米材料[17-19]。
鉴于以上传统方法在制备纳米金属材料过程中存在的各种问题,且随着全球石化资源消耗与日俱增,环境污染加剧,近年来科研人员提出了基于生物基分子绿色合成纳米金属材料的研究新思路。生物基分子是指直接来源于自然界或间接通过生物法合成的一类小分子或大分子,其一般具有生物相容性好、毒性低以及可降解等优点。此外,大多数生物基分子功能结构特征赋予了相应纳米材料独特的功能性,比如含邻苯三酚结构的单宁酸可消除自由基具有抗氧化性[20],利用单宁酸介导合成的纳米材料也具有抗氧化性,可应用在食品包装上;含有游离氨基的壳聚糖能进行多功能基化学反应(氨基、羟基) 和立体结构修饰,利用壳聚糖修饰可与单抗或配体结合形成的纳米材料可获得主动靶向功能,可应用于药物靶向传递方面[21]。因此,基于生物基分子介导纳米金属材料的绿色制备对实现纳米材料的功能化改造且进一步拓展纳米金属材料在众多领域的广泛应用具有重要的理论和实践意义。
本文旨在全面介绍由生物基分子介导的功能化纳米金属材料的制备及其应用,为行业科研工作者提供纳米材料绿色制备新思路。
1 生物基分子介导纳米金属材料的制备生物基分子介导纳米金属材料的液相还原制备法中,生物基分子可直接作为还原剂、稳定剂或模板剂。该法具有过程绿色高效、材料尺寸均一,形貌可控、分散性佳、稳定性强且适合大规模量产的优点。按照获取方法不同,生物基分子可分为直接提取于自然界生物质的生物基分子及基于生物质发酵获得的生物基分子。由于各种分子理化性质存在差异,因而其在制备金属纳米材料过程中所起的作用机制及工艺条件不同,制备所得的纳米颗粒性质也各不相同(表 1)。
表 1 生物基分子介导纳米金属材料制备汇总Table 1 Bio-based molecular-mediated biological synthesis of nano-metallic materials
| Classification | Bio-based molecules | Nano-metallic materials | Synthesis method and mechanisms | Reaction temperature | Reaction time | Shape | Cost | Applications | References |
| Natural molecules | Tea polyphenol | Nano-silver | Chemical synthesis in liquid phase, reducing agent and stabilizer | Room temperature, high temperature, microwave | ≥12 h | Core-shell structure | High | Biosensor, anti-cancer medicine | [24-28] |
| Natural base | Nano-silver, nano-gold | Chemical synthesis in liquid phase, reducing agent and stabilizer | High temperature | ≥20 min | Spherical, irregular structure | Medium | Antibacterial, Antivirus, anti-cancer medicine, catalyst | [32-34] | |
| Tannic acid | Nano-silver, nano-gold | Chemical synthesis in liquid phase, reducing agent and stabilizer | Room temperature, high temperature | ≥5 min | Spherical, Core-shell structure | Medium | Instrument analysis, conductive ink, catalyst, antibacterial | [41] | |
| Fermented molecules | Dopamine | Nano-silver, nano-gold | Chemical synthesis in liquid phase, reducing agent and stabilizer | Room temperature | ≥8 h | Spherical structure | Medium | Antibacterial, antivirus, Biosensor, anti-cancer medicine | [51] |
| Citric acid | Nano-silver, nano-gold | Chemical synthesis in liquid phase, reducing agent and stabilizer | High temperature | ≥1 h | Irregular structure | High | Antibacterial, antivirus | [62] | |
| Monosaccharide | Nano-silver | Chemical synthesis in liquid phase, reducing agent | Moderate temperature | ≥8 h | Spherical structure | High | Antibacterial, antivirus | [63] | |
| Polysaccharide | Nano-gold | Chemical synthesis in liquid phase, reducing agent and stabilizer | Moderate temperature | ≥24 h | Core-shell structure | High | Ink jet, anti-cancer medicine | [64] | |
| Fatty acids | Nano-silver, nano-cobalt | Chemical synthesis in liquid phase, reducing agent, stabilizer and template | High temperature | ≥4 h | Spherical structure | High | Antibacterial, antivirus, anti-cancer medicine | [11, 68] | |
| Protein | Nano-gold | Chemical synthesis in liquid phase, reducing agent, stabilizer and template | Room temperature | ≥48 h | Spherical, irregular structure | High | Biosensor, Imaging agent, anti-cancer medicine, catalyst? | [76-77] | |
| Polypeptide | Nano-gold | Chemical synthesis in liquid phase, reducing agent, stabilizer and template | Room temperature | ≥96 h | Core-shell structure | High | Anti-cancer medicine | [82] | |
| Biosurfactant | Nano-silver, nano-gold | Chemical synthesis in liquid phase, reducing agent and stabilizer | Moderate temperature | ≥4 h | Core-shell structure | Medium | Antibacterial, antivirus | [87, 95] |
表选项
1.1 直接提取于自然界的生物基分子直接提取于自然界的生物基分子,主要是指通过化学、物理等手段直接提取于动植物的分子。一方面提取物化学组成丰富,含有多糖、萜类、黄酮、生物碱等多类具有还原性的功能分子,可以快速简便地还原金属离子生成纳米金属材料;另一方面动植物提取物来源广,成本低廉,多数无毒、可降解并且可在常温常压下反应[22]。所以,直接提取于自然界的生物基分子介导合成纳米材料的方法值得关注。
1.1.1 茶多酚茶多酚(Green tea polyphenols,GTP) 是不同品种茶叶提取物的主要成分。茶多酚是包括黄酮类化合物、咖啡因、单宁和没食子儿茶素、没食子酸酯等化合物的总称[23],其多酚结构所具有的独特理化性质可以直接作为合成纳米材料的还原剂和包覆剂。Afzal等[24]利用茶叶提取物在1-甲基-2-吡咯烷酮(NMP) 溶液中制备了具有稳定粒径(20 nm)的金(Au) 纳米粒子,其具有很好的电化学特性。Sun等[25]利用茶叶提取物作为还原剂和稳定剂合成纳米银(Ag),直径约为20–90 nm,发现银离子的时间依赖性释放具有良好的稳定性。Zeinab等[26]利用白茶提取物作为还原剂和稳定剂,蒙脱石(MT) 的层状结构作为保护剂和载体制备了Pt/Ag@MT纳米复合材料,所形成的复合纳米银颗粒形态良好,粒子之间尺寸差异较小、没有明显聚集。Hsieh等[27]应用绿茶多酚中的有效成分表没食子儿茶素-3-没食子酸酯(EGCG)合成金纳米颗粒,材料性质较为稳定且对癌细胞具有选择毒性,可有效抑制肿瘤的形成和发展。Fei等[28]利用微波合成法一锅快速合成自荧光茶多酚(TP) 基核@壳金属纳米结构,该纳米复合材料可用于选择性抗菌处理且对细胞表现出低毒性,并且提供了一种合成更复杂的纳米材料的方法,如图 1所示。另外茶多酚类物质还具有抗氧化、抗肥胖、保护心血管和预防糖尿病等多种功效,并且由上可知茶多酚制备纳米材料也兼具功能性,制备过程绿色、高效、低毒[29],所制备的纳米金属材料结构多样、大小可控、分散均匀,因此茶多酚介导合成纳米材料的研究前景广阔。
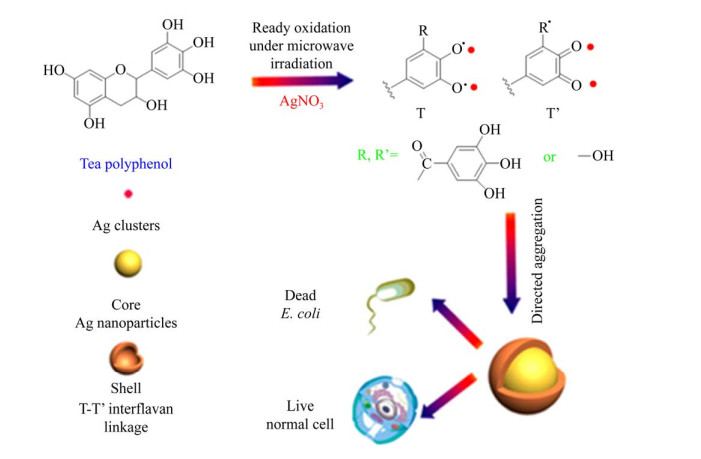 |
| 图 1 微波辅助一锅快速合成自组装多酚基核@壳纳米结构的示意图[28] Fig. 1 Schematic illustration of self-assembly of polyphenol-based core@shell nanostructures within 1 min using microwave-assisted green chemistry[28]. |
| 图选项 |
1.1.2 生物碱生物碱(Alkaloid) 是草本植物及木本植物果实提取液的活性成分[30],其种类繁多,虽然结构有所差别,但生物碱均为含氮的有机化合物,具有一定的还原性和功能性(镇痛、抗肿瘤、抗炎、抗氧化等),所以通过不同植物的提取液得到的生物碱催化合成纳米材料也具有功能性,且应用范围更加广泛[31]。Rai等[32]利用从柠檬草叶提取的生物碱类物质制备金纳米三角,可以通过改变卤素离子和温度影响金纳米三角的形态,合成不同形貌的金纳米三角,可应用在热疗和建筑光学涂层等方面。Liu等[33-34]采用葡萄籽提取物作为还原剂和稳定剂,合成了负载金属银纳米颗粒(AgNPS) 的复合材料,比绿色合成的裸AgNPS具有更好的抗菌活性,在新型抗菌材料的应用中具有广阔的应用前景。Muhammad等[35]以芋头根茎为稳定剂合成纳米复合材料作为化学催化剂,该纳米复合材料对苦味酸/硝基苯酚(TNP)、4-硝基苯胺(4-NA)、4-硝基苯酚(4-NP) 和2-硝基苯酚(2-NP) 等硝基芳烃的催化还原反应效率很高,还可催化硝基芳烃和染料混合物的还原,易于回收且可重复使用,有很好的启发性。生物碱在一步绿色合成过程中将金属离子还原成金属纳米粒子,该方法反应迅速、高效、反应条件温和且环境友好[36]。生物碱结构多样,虽少量具有毒性,但可经结构改造介导合成纳米材料应用于抗菌、药物递送、化学催化等方面。
1.1.3 单宁酸单宁酸(Tannic acid,TA)[37]又可称单宁、鞣酸、没食子酸质等,是五倍子经过浸提、浓缩得到的复杂多酚类化合物。由于单宁酸分子中有多个酚羟基基团,所以它可与金属离子络合还可与蛋白质、生物碱、多糖反应[38],且由于能捕捉自由基具有抗氧化性[20]。另外,水解单宁酸[39]可生成没食子酸和葡萄糖[40],在弱碱性条件下是一种很好的还原剂和稳定剂[41]。早在20世纪早期,单宁酸就被发现可用于纳米金的合成[42],并且经过众多研究者[43-44]的不懈努力,合成了大小可控、制备简单以及稳定存在的纳米金颗粒。Huang等[45]制备了亲水性硅片,然后通过热处理将其表面涂覆单宁酸,可以低成本、高粘附性合成均匀致密的Au纳米颗粒,成功地将纳米材料应用在电化学检测上。Zhang等[46]以单宁酸为还原剂和稳定剂介导合成了平均直径为8–22 nm的近球形的银纳米复合粒子,作为导电油墨,该材料可以以固体形式保存且可储存几个月,简化了制备步骤,对储存和运输非常有益。Shen等[47]用单宁酸-铁离子配合物在聚丙烯酸酯颗粒表面重新组装,生成纳米复合材料。该配合物可降低丙烯酸乳胶涂层粘性,提高涂层强度,促进致密结构的形成,显著延缓了尿素的释放,达到控释肥料的目的,如图 2所示。除此之外,单宁酸还用于介导石墨烯等其他非金属金纳米复合材料的制备[48],比如Abouelmagd等[49]发现单宁酸涂层修饰的聚乳酸-羟基乙酸共聚物有光学惰性,所以单宁酸修饰的多聚物纳米材料不受光学性质和配体表征的干扰,并且该复合材料可容纳白蛋白、壳聚糖和叶酸端聚乙二醇等,能控制细胞与聚合物纳米粒子的相互作用。应用此原理,也可以通过单宁酸连接纳米金属复合材料和功能分子来合成功能化的纳米金属材料,降低其他分子对材料的光学影响。单宁酸介导合成纳米材料尺寸均匀、性能稳定,且可形成核壳结构,这样可以利用单宁酸的生物活性传递纳米金属到目标位置,实现纳米材料的功能。但由于单宁酸独特的多酚羟基结构及氧化反应等独特的化学性质,其在介导纳米材料制备及调控方面的作用机制还有待进一步解析。
 |
| 图 2 聚丙烯酸酯乳液与Fe3+-单宁酸配合物组装的示意图[47] Fig. 2 Schematic illustration of assembly of polyacrylate latex with Fe3+ Tannic acid complexes[47]. |
| 图选项 |
1.1.4 多巴胺多巴胺(Dopamine,DA) 是海洋贻贝粘着蛋白的组成部分,是一种内源性含氮有机化合物,在碱性条件下氧化聚合的多巴胺与胺或硫醇化合物结合可沉积在纳米粒表面形成一个功能性涂层[50]。所以,在生物传感器、生物电子学以及组织和制药工程等各个领域都将发挥着重要的作用。Sureshkumar等[51]利用多巴胺涂层将银锚定在磁性纳米纤维上,使磁性Ag纳米复合材料具有抗菌活性。Xu等[52]制备了一种用多巴胺沉积的微滤膜,然后对Ag和Au纳米颗粒进行功能化,并证明了其对革兰氏阴性大肠杆菌和革兰氏阳性金黄色葡萄球菌的抗菌作用。随后Kung等[53]将多巴胺包覆在玻璃衬底上,成功地将银纳米粒子分散在玻璃上,发现多巴胺/银纳米复合材料与内皮细胞具有选择性相容性,仅对细菌细胞表现出毒性。此外,Han等[54]模仿贻贝的粘附机制,将多巴胺嵌入到粘土纳米层中,使得受限纳米空间中保持高浓度的邻苯二酚基团,原位聚合形成水凝胶,表现出可重复和持久的粘附性,有利于细胞的附着和增殖。多巴胺可氧化自聚合形成球型聚多巴胺粒子,且多巴胺粒子可与贵金属前驱体溶液作用制备聚多巴胺-贵金属纳米粒子,该合成纳米复合材料操作简单、重现性好。此外,聚多巴胺具有良好的生物相容性和生物降解性,适合于体内应用,可作为体内传感器[55]以及用于癌症治疗[56]等方面;但其团聚及光学活性等问题还有待解决。无论如何,多巴胺基纳米材料被认为是用途广泛的多功能性材料[57],已引起了研究人员普遍关注。
1.2 基于生物发酵的生物基分子生物发酵的生物基分子是指利用可再生生物质,包括农作物、树木和其他植物及其残体和内含物为原料,通过生物发酵手段制造的一类小分子或大分子物质。其具有来源广泛、过程绿色、结构可设计等特点,最常见的分子如柠檬酸、糖、脂肪酸等,均已广泛应用于纳米金属材料的介导制备。
1.2.1 柠檬酸柠檬酸(枸橼酸,Citric acid,CA) 在自然界中分布很广,目前约有99%的产品是采用生物发酵方式生产,即利用黑曲霉作为细胞工厂,砂糖、糖蜜、淀粉、葡萄糖等含糖物质作为饲料,经过发酵、浸取、中和、浓缩等一系列步骤生产高纯度的柠檬酸[58]。柠檬酸钠是柠檬酸最重要的钠盐,是一种弱酸强碱盐,游离羧基易与金属耦合,所以它既可以作为还原剂,也可以作为配位剂。在金属纳米粒子的合成中,由于羰基中的自由电子对可以静电稳定纳米粒子,并在具有自由轨道的金属原子的化合物中可以充当配位剂。但柠檬酸分子与金属表面的作用是弱相互作用[59],所以,柠檬酸根离子很容易被其他功能化合物取代,形成功能化的金属纳米粒子。早在1951年,Turkevich等[60]首次利用水相还原法合成纳米金。后来,科学家们用柠檬酸作为还原剂和氧化剂,也成功的合成了纳米银。Gicheva和Yordanov[61]采用柠檬酸钠化学还原方法,得到了一种在40–100 nm范围内具有单个粒径的多面体形状的多分散AgNP胶体。Tan等[62]用柠檬酸钠和水合肼在苯胺存在下还原银离子,得到了形状不均匀的多分散AgNP胶体。虽然柠檬酸钠用于金属纳米材料的制备时通常导致胶体纳米粒尺寸分布较宽,并且形状不可控,这对纳米材料性能的发挥有一定限制,但不可否认,柠檬酸是最优良的还原剂和稳定剂,可以为后续新材料的制备及改造提供前躯体。
1.2.2 糖类糖类(Carbohydrate) 按其分子大小及组成不同可分为小分子糖(葡萄糖、甘露糖等)、大分子糖(淀粉、唾液酸、葡聚糖等) 以及糖类衍生物(熊果苷、VC糖苷等)。动植物多糖由于受到区域和气候的影响,其生产有诸多限制。目前大多选取野生型菌种进行培养,加入碳源进行分批发酵或连续发酵生产。其多羟基醛结构使其具有还原性,且多糖的长链和空腔,在纳米材料的制备中既可以作为还原剂,又可以作为模板发挥稳定剂及结构调控的作用。Virender等[63]报道了在葡萄糖和淀粉水溶液中加入AgNO3溶液得到银纳米粒子。且其应用Tollens工艺,用糖类还原Ag(NH3)2,形成粒径为50–200 nm的AgNP薄膜,颗粒为20–50 nm的Ag水溶胶,以及不同粒径的Ag胶体颗粒,并且表现出较高的抗菌活性。Cai等[64]以溶菌酶-葡聚糖纳米凝胶为还原剂和稳定剂,原位制备尺寸约为200 nm复合纳米金材料。这可以将凝胶负载药物,既能实现纳米金的作用又可以达到药物递送的目的。壳聚糖[65]是发现的唯一呈碱性的多糖,Liu等[66]用季胺化壳聚糖、粘土及Gemini表面活性剂合成26 nm的AgNP及QCS/粘土纳米复合材料。如图 3所示,剥离粘土层的负载AgNP负载的QCS/粘土纳米复合材料表现出优异的抗菌活性,对微生物的最低抑制浓度为0.000 01 wt%。Nikita等[67]为了找到替代有机溶剂油墨的配方,利用微波辅助加热法,通过改变淀粉的水解条件,控制和优化AuNP悬浮液的尺寸、产率和稳定性,合成了一种适合喷墨打印的金纳米粒子(AuNP) 水墨。部分糖类具有还原性,可以与金属纳米粒子前体作用而制备复合纳米材料,过程操作简便、反应温和、产物稳定;且由于多糖是多羟基化合物,其能与许多金属离子以化学键相连,所以形成的复合材料结构稳定;另外糖类多为发酵生产或天然提取,所以有很好的生物相容性且结构多样,这样可以介导合成更多的功能性纳米材料,潜力巨大。
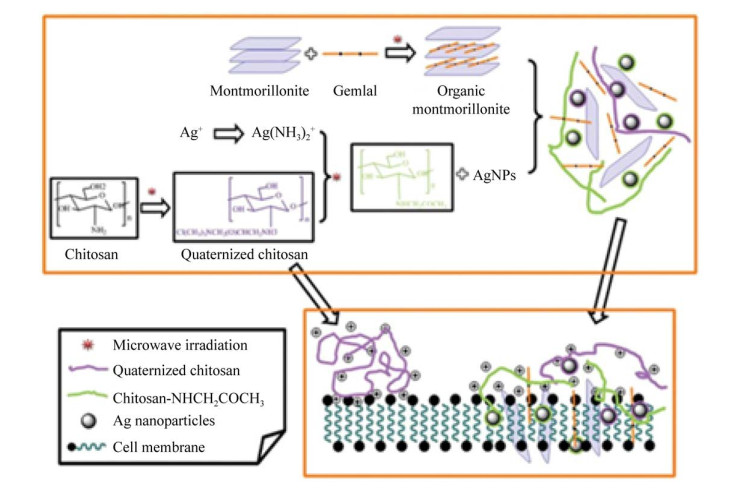 |
| 图 3 AgNP-QCS/粘土纳米复合材料的制备及抗菌机理的猜想示意图[66] Fig. 3 Schematic illustration of the possible preparation and antimicrobial mechanism of exfoliated AgNP-loaded QCS/clay nanocomposite[66]. |
| 图选项 |
1.2.3 脂肪酸类脂肪酸(Fatty acid) 根据其分子中不饱和键的个数分为饱和脂肪酸(丁酸、己酸、辛酸、癸酸、软脂酸和硬脂酸等)、单不饱和脂肪酸(豆蔻油酸、棕榈油酸、菜籽油酸等) 和多不饱和脂肪酸(亚油酸、亚麻酸、花生四烯酸等)。饱和脂肪酸多通过天然油脂水解、石蜡氧化法和α-烯烃氧化法进行大规模生产[68-69],而不饱和脂肪酸用生物发酵法表现出优势,微生物菌种选择较多,目前还在研究中,但已成功合成多种脂肪酸[70]。脂肪酸可以通过调节脂肪酰基链的长度改变分子的亲水疏水性,因此合成的纳米复合材料有不同的功能。比如Sharma等[71]用脂肪酸对壳聚糖进行疏水改性,合成的聚合物纳米胶束可作为基因传递的载体。孟多等[72]采用溶胶-凝胶法以工业水玻璃为纳米SiO2前驱物,癸酸和月桂酸二元低共熔酸为相变芯材,在表面活性剂的参与下,制备出纳米级复合定形相变蓄热材料。该材料具有良好的相变蓄热性能和热稳定性,可作为一种良好的隔热、保温建筑材料。基于脂肪酸合成纳米材料的优势是可通过改变碳链长度调节纳米材料的亲水亲油比,从而使得纳米材料具有靶向性,且采用仿生的理念进行材料改进,赋予其功能。
1.2.4 蛋白质蛋白质(Protein) 是由一条或多条多肽链按照其特定方式折叠而成的高分子化合物[73]。蛋白质可通过天然提取生产,由于微生物细胞工厂具有快速、高效、可操作性和可控性强等优点,目前通过培养微生物细胞(枯草芽孢杆菌、大肠杆菌、酿酒酵母、丝状真菌和链霉菌) 为其提供营养物质并进行发酵,已经可以工业化生产蛋白质[74]。研究发现蛋白质分子在外界环境变化时会表现出不同的形态[75],这些对于金属纳米材料的定向生长及形貌控制具有重要作用[76]。所以利用蛋白质表现的自组装能力和生物相容性的特性合成复合的纳米材料值得关注。比如金纳米粒子可以被伯胺基、羰基、羟基基团修饰,可将金纳米粒子-绿色荧光蛋白(NP-GFP) 阵列建立在细胞表面,用于快速鉴定哺乳动物细胞,从而能够识别细胞类型和癌症状态[77]。并且Kühn等[78]发现加入金纳米粒子的荧光蛋白的荧光强度增强超过20倍,同时使激发态寿命缩短20倍。Hall等[79]以生物素和抗生物素结合对为模型,利用结合抗体的金纳米粒子检测表面结合生物素(图 4),实验发现抗体与分析物结合时的位移的放大率高达400%,显著提高了基于等离子体的生物检测的灵敏度,为单分子检测和临床相关诊断铺平了道路。蛋白质是具有生理活性的物质,可通过化学键和物理吸附方式与金属形成复合纳米材料,一般操作条件温和、制备方式简便,并赋予纳米材料生物学功能,比如抗原抗体特异性结合实现治疗目的,连接蛋白酶进行反应催化。此外,可采用多种手段对蛋白质进行改造,改进蛋白质纳米材料的性能,其在生物医学方面的应用极具前景。
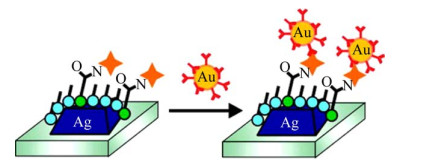 |
| 图 4 生物素端配体功能化的银纳米粒子阵列以及抗生素修饰的金纳米粒子的合成及检测原理示意图[79] Fig. 4 Schematic illustration of the experiment. Biotin is covalently linked to the nanoparticle surface using EDC coupling agent, and antibiotin labeled gold nanoparticles are subsequently exposed to the surface[79]. |
| 图选项 |
1.2.5 多肽多肽(Peptide) 区别于蛋白质的三维高分子结构,尺寸可以达到几纳米并且分子间存在弱相互作用力。多肽作为生物相容性高、序列可设计、易修饰、功能多样化的生物分子,可组装构建结构多样和功能集成的纳米药物系统[80]。生产方法主要以蛋白质或氨基酸为原料,以酶水解法、微生物发酵法和化学水解法等进行生产[81],其中微生物发酵法由于可对工程菌进行改造并能利用原料中多种营养物质且无需蛋白提取,所以成为研究热门。Conde等[82]设计了以金纳米粒子为核体,表面修饰小干扰RNA (Small interfering RNA,siRNA) 和多肽的杂合纳米体系,在抑制肿瘤血管新生和侵袭方面,展示出良好的治疗效果。Hoon等[83]利用18-氨基酸介导磷脂纳米颗粒(小于50 nm) 的合成。该肽可稳定5–7 nm磷脂胶束,负载紫衫醇后,发现该复合纳米药物不仅达到了比原药物更好的抗肿瘤能力,还不被肝细胞吸收,所以该合成方法可以广泛地应用到药物递送领域。多肽相较于蛋白质分子量较小,序列易于调控,并且很多多肽可生物降解、生物兼容、具有生物活性和特异性识别性能。此外,多肽超分子组装体能够在不同的生物环境中进行可控组装和解聚的变构[84],因此多肽介导合成的纳米材料具有生物功能多样化和利于变构的明显优势。在制备纳米金属材料时方法可控、操作步骤少且制备材料性能优良。所以,应用多肽修饰纳米材料,赋予纳米材料功能,尤其在医药领域的应用更值得进一步研究。
1.2.6 生物表面活性剂生物型表面活性剂(Biosurfactant) 主要分为糖脂类、磷脂类和脂肪酸类、中性脂类、脂肽类和脂蛋白类、颗粒生物表面活性剂以及多聚物生物表面活性剂[85-86]。主要通过微生物发酵的方式进行生产,如利用假丝酵母菌为其提供葡萄糖和油酸为双碳源发酵生产槐糖脂[87],利用铜绿假单胞菌发酵生产鼠李糖脂等[88]。相比化学表面活性剂它不仅具有增溶、乳化、润湿、发泡、分散、降低表面张力等表面活性剂所共有的性能,还具有较低毒性和较强的生物降解性以及钙活性和自组装特性,因此受到了广泛的关注[89-92]。Jia等[93]采用鼠李糖脂(具有杀菌活性的阴离子生物表面活性剂) 合成了一种新型的纳米氯磷灰石,发现鼠李糖脂可将悬浮液中的纳米氯磷灰石均匀稳定分布在5 nm左右,大大提高铅(Pb) 和镉(Cd) 的固定化效率。Wan等[94]通过纳米乳化的卵磷脂合成含有共轭亚油酸的纳米乳液,发现这种形式的共轭亚油酸表现出很好的热稳定性以及生物利用度。酸性去乙酰基槐糖脂的脂肪酸部位可以与钴粒子和银粒子反应,糖基得以暴露于溶剂中,有效抑制金属纳米粒子发生聚合反应,可均匀分散在溶剂中[95],已被用作金属和金属氧化物纳米粒子的表面稳定剂。Kasture等[96]将槐糖脂作为封盖剂合成了钴(Co) 纳米粒子,得到的纳米材料稳定且可再分散于水中,该纳米粒子具有良好的稳定性和超磁化性能,可应用于位点载体传递剂、磁性成像应用和磁分离技术方面。Lassenberger等[97]合成了由槐糖脂包覆的单分散氧化铁纳米粒子(图 5),槐糖脂先用硝基多巴胺修饰,暴露出羧基作为单分散氧化铁纳米粒子的表面配体。通过热重分析和小角度X射线和中子散射相结合,发现合成的表面配体极好地稳定了氧化铁纳米粒子,揭示了槐脂作为稳定和无毒的表面涂层在离子基生物医学和生物技术应用中的潜力。生物表面活性剂可使纳米粒子获得亲水性,容易分散且对金属粒子具有双重束缚作用;在介导合成金属纳米材料时可以采用一锅法绿色合成,操作方便快捷。生物来源的生物表面活性剂具备比化学表面活性剂表现出更好的生物相容性,在修饰纳米材料方面优势凸显,更具环境友好特性,所以生物表面活性剂介导纳米材料有很大优势。
 |
| 图 5 核壳型槐糖脂-氧化铁纳米材料的合成及表征。小角度X射线散射(蓝色) 以及小角度中子散射(绿色) 重水中纳米材料的结构分析[97] Fig. 5 The synthesis and characterization of sophorolipid- coated monodisperse iron oxide nanoparticles. SANS (blue) and SAXS (green) profiles for 4.6 nm SL-IONP in D2O[97]. |
| 图选项 |
2 生物基纳米金属材料的应用基于生物基分子介导的纳米材料,由于制备方法绿色、高效且生物基分子的理化、生物学特性赋予了纳米材料独特的功能,在生物传感、抗菌、生物医药等领域具有广泛的应用(图 6)。
 |
| 图 6 生物基纳米金属材料的应用 Fig. 6 Applications of the bio-based nano-metallic materials. |
| 图选项 |
2.1 生物传感生物医学传感器是用于检测人体各种信息的重要工具,它对医学基础研究、临床定量研究和医学仪器开发起着重要作用,将直接影响患者的疾病诊断和治疗进程[98]。目前传感器朝多功能、微型化、高速化方向快速发展。纳米微粒具有的大比表面积、高活性特异物性、极微小性等特点正好与之相互对应,所以纳米技术对促进生物医学传感检测技术进步起着举足轻重的作用。纳米贵金属由于具有局域表面等离子体共振(LSPR)[99]、高电子密度等特点,适合被直接开发成LSPR纳米传感平台用于特定物质的检测[100]。例如由于金纳米粒子表面修饰蛋白形成复合纳米材料,可以识别细胞类型和癌症状态[77]。Tatsuro等[101]用特异性抗体修饰的金纳米颗粒可以通过免疫反应识别其抗原,导致纳米粒子的局部环境变化,并导致LSPR光谱的峰移,实现检测蛋白质的目的。Mariana等[102]将不同纵横比金纳米棒自组装到硫醇化的金电极上,研究发现,纵横比最小的纳米棒的末端与电极结合,而其他纳米棒则表现出侧表面附着性能。并且垂直排列的纳米棒修饰的电极表现出有效的电子转移,表现出最好的电化学响应,这一发现可提高生物传感器的灵敏度。Gao等[103]用抗体修饰磁铁矿纳米粒子发现有类似于过氧化氢酶活性的特性,并有捕获、分离以及探测的功能,应用于非酶电化学传感,降低成本。Heo等[104]通过构建金纳米复合材料在有抗坏血酸存在下可以较为准确地检测多巴胺的浓度。纳米材料在生物医学传感检测方面作用突出,相较其他无机材料贵金属(铂、金、银) 有优异的导电性和优良的电子转移动力学性能。此外,由于生物基分子具有生物相容性、可降解性以及特性结合等优点,所以基于其合成的复合纳米材料具有其独特生物学功能,可以与检测物质特异性结合,提高选择性;并且金属纳米粒子经过生物基分子修饰后,可应用于体内进行实时监测,将进一步推动医学传感检测技术的发展。未来,生物基分子介导合成的金属纳米材料会越来越多地应用在生物医学传感方面。
2.2 抗菌抑毒青霉素等药物的发现让人类阶段性地解决了细菌等致病菌[105]的感染问题,但由于细菌的自然选择和进化,致使各种耐药菌不断出现,同时耐药菌从细菌发展到真菌、病毒、寄生虫,导致了严重的临床感染[106]。抗菌药物的不稳定效应、潜在毒性和抗生素耐药性的增加限制了它们的生物医学应用,所以抗菌抑毒的研究迫在眉睫。纳米技术的发展以及生物基分子的介导合成,为这一问题的解决提供了新方法[107]。金属所形成的纳米材料可以被递送到细菌或者病毒周围释放出金属纳米粒子与蛋白质中的巯基发生反应,或置换酶中的金属离子,使大多数酶失活,达到抗菌抑毒的目的。Shalev等[108]利用新果胶诱导的Ag@AgCl/ZnO纳米复合材料具有良好的光催化抗菌活性。Yu等[109]所提出的绿色工艺为低成本工业上大规模生产抗菌果胶基纳米复合材料提供了新的思路。壳聚糖介导合成的纳米银与壳聚糖-银离子膜相比具有较高的抗菌能力。Parmar等[110]利用以乌根尼亚金波拉纳提取物合成的纳米银,与聚D, L-乳酸-乙醇酸(PLGA) 组合杀菌效果更佳。植物薄荷油也被用来制备纳米金,对人病原真菌的绿色合成金纳米粒子表征及其抗真菌活性[111]。生物基分子介导合成的纳米复合材料表现出优异的抗菌活性,这些材料的发现为解决超级细菌问题提供了新策略,值得进一步研究。
2.3 抗癌药物恶性肿瘤存在发病率和死亡率高、诊疗难度大、易复发和转移等问题,但现有的方法均无法有效降低恶性肿瘤的死亡率[112],纳米技术的应用提供了一个新方法。功能化后的纳米粒子作为载体可以直接携带探针、药物、DNA等进入目标细胞进行诊疗,或者利用金属纳米粒子的光热性等进行癌症的治疗[113]。银纳米复合材料在抗癌领域有很大的潜力。研究发现,以生物基分子介导合成的复合银纳米材料表现出低毒性[26],并且随后研究发现不同生物基分子介导合成的银纳米粒子对HeLa细胞(宫颈癌细胞的细胞系) 的抗癌活性不同[6]。这启示我们可以通过改变生物基分子类型合成纳米复合材料,找到更好的抗癌产品。基于多肽及其衍生物在结构设计上精确可控的特性,可将具有不同生物功能的多肽分子通过可控组装进行模块化功能集成,构建多肽纳米药物[114]。Tran等[115]用Rev肽(病毒颗粒蛋白表达调节因子) 作为还原剂和封盖剂合成了金纳米粒子,并通过调节两者的比例,获得了不同尺寸(20–300 nm) 和形状(球、三角板和多边形) 的纳米金。动物实验发现,该纳米药物比游离的Rev肽对小鼠卵巢表面上皮细胞株表现出更高的细胞毒性作用,是潜在的抗癌药物。Bin等[116]通过适当地将金纳米粒子与特定肽结合,成功地将纳米药物选择性地转运到癌细胞(HSC-3) 的细胞核,并导致DNA损伤、胞质分裂阻滞,最终导致癌细胞死亡。另一方面,基于金或银纳米粒子开发高效和简化的热敏系统来放大成像引导的光热治疗/光动力疗法(PTT/PDT) 也是一种治疗癌症的潜在有效方法。Tan等[117]成功地构建了一种单光触发的吲哚青绿(ICG) 负载聚乙二醇化银纳米粒子核/聚苯胺壳纳米复合材料,其在近红外区有强光吸收、增强光稳定性、优异的局部热疗以及能产生活性氧。生物学实验发现与单一的PTT或PDT相比,纳米复合材料激光触发在体外PTT/PDT联合治疗表现出对人子宫颈癌传代细胞的致命作用和体内肿瘤生长的抑制作用。Huang等[118]合成得到直径为35 nm结合抗体的金纳米球作为有效和选择性的光热吸收剂,在不影响周围非恶性细胞的情况下,用可见氩离子激光破坏癌细胞。利用生物基分子,如多肽分子等的结构特性和生物功能特性等优势,对其分子进行设计、修饰和组装可以实现不同功能生物基分子的模块化及生物功能性集成,精准构筑生物基纳米药物系统[119],该体系有望成为抗肿瘤药物的一个重要突破口。
2.4 化学催化化学反应离不开催化剂的使用,纳米材料大比表面积的特点为制得优良的催化剂提供了保障。最初可以利用物理方法直接生产超细的镍粉、银粉的轻烧结体作为电池中的电极可以增大与液相或气体之间的接触面积,增加电池效率。但这样的处理耗费大量物力而且催化剂结构单一,不是很理想。通过生物基介导合成的纳米材料可作为优良的催化剂,比如以胡芦巴水提物[120]为还原和保护剂得到的金纳米粒子对还原4-硝基苯酚为4-氨基苯酚具有良好的催化活性。一方面合成的纳米材料可以提高催化性能,另一方面还可以节约成本。众所周知,在有机化学中,银一直是一个很好的催化剂,但其价格较高,在工业化生产中限制了其应用。纳米复合材料阶段性地解决了这一问题,Ag基纳米复合材料,包括负载型Ag纳米复合材料和双金属Ag纳米复合材料,由于其高活性和稳定性、易制备、低成本、低毒性等优点,被广泛研究作为高效催化剂[121],并且发现还可以作为循环催化材料[122],这些都为工业生产提供了前提。不仅使用催化剂进行催化,科研工作者为了提高化学反应速率,微流控[123]这项新技术应运而生,发现载有金纳米粒子的微流控装置具有良好的适应性,可以高效催化反应和重复使用,而反应器不损失性能。相较于传统催化剂,一方面少量的纳米催化剂就表现出高效催化效率且还可进行回收再利用,极大地节约了生产成本;另一方面生物基介导合成的纳米材料具有制备条件温和、环境友好性的特点,符合绿色生产的理念。所以,生物基分子介导合成纳米材料在化学催化方面极具潜力。
2.5 仪器分析仪器分析是化学分析的一个重要分支,纳米材料的应用可改善仪器性能并且简化分析步骤。Kim等[124]以糠醇或糠胺为还原剂,合成不同尺寸的金纳米材料,通过简单的滴铸法沉积在硅晶片上,发现材料的SERS增强因子(106–108) 可以作为高活性表面增强拉曼散射基底用于检测亚甲基蓝和结晶紫。Rigano等[125]开发了一种纳米液相色谱-电子电离四极质谱联用(NanoLC/EI-MS) 方法来阐明贻贝样品中的游离脂肪酸谱,避免了气相色谱分析所需的先前衍生步骤。电化学传感检测技术中电化学方法由于其灵敏度高、选择性好、成本低及所需仪器设备简单的优点,被广泛研究。Zhang等[3]利用葡萄糖介导自组装氧化石墨烯-金纳米粒子杂化膜的合成,所制备的功能半透杂化膜在有机和无机溶液中都表现的非常稳定,用此膜制备的H2O2生物传感器,分析发现其具有低检出限、高选择性和长期稳定性的优良性能。纳米材料由于其尺寸带来的表面与界面效应、小尺寸效应、量子尺寸效应以及宏观量子隧道效应,一方面可以改善现有材料的问题,提升检测性能,另一方面可以实现仪器小型化,节约空间。应用生物基分子介导合成的纳米材料可以抗菌、抗蛋白质吸附以及特异性结合,可以延长仪器使用寿命,提高分析方法的准确度,在仪器改进方面有着举足轻重的作用。
2.6 其他应用在日用化学品方面,纳米材料改善日化品的性能,全球化妆品巨头欧莱雅早在2006年已推出了使用纳米技术生产的防晒霜、护发素和乳液等产品[126]。在纺织业方面,纳米布料是用一种特殊的物理和化学处理技术将纳米原料融入面料纤维中得到的,增加和提升了面料的防水、防油、防污、透气、固色等功能;在食品方面,壳聚糖银纳米复合材料可以作为果蔬药用和食用涂层[127];在农业方面,葡萄柚果皮合成的银纳米粒子可影响接种龙葵黄瓜植株超氧化物歧化酶的活性和生长[128],提高存活率和产率;在电池储能方面[129-130],将乌头叶的提取物[131]合成的金纳米粒子分散在多孔碳复合材料中,表现出良好的电化学储能等。鉴于生物基分子独特的理化特性(易降解、结构多样、易于金属络合、光学活性等) 及生物学特性(较好的生物相容性、可特异性结合、可靶向细胞等),其介导制备的纳米材料同样被赋予多样化且优异的功能,这些功能化纳米材料在人们生活的方方面面都将发挥越来越重要的作用。
3 总结与展望自古以来,纳米颗粒就存在于自然环境中,默默影响着人们生活的方方面面。随着近现代纳米技术的蓬勃发展,尤其纳米材料制备技术的发展,使得纳米材料在生产生活中得到广泛应用。然而要进一步发挥纳米材料的优势,推进其进一步广泛应用,纳米材料的新制备技术是关键因素之一。回顾历史,早期为了开发新材料不得不使用毒性试剂、强酸、强还原剂等[132],然而随着石化资源的枯竭及环境污染的剧增,多种生物基分子介导纳米材料的制备方法被提出,该法优点如下:生物基分子多数生物相容性好、低毒、可降解、来源广泛、价格低廉;此外,生物基分子多数具有独特的理化性质,如抗氧化、酸碱两性、亲水亲油性及生理活性等,其介导合成的纳米材料也具有独特功能性,如消炎、抗癌、抗氧化、抗病毒以及降血糖血脂等。生物基分子介导纳米材料的制备为进一步推动纳米事业的发展注入新活力。
虽然目前生物基分子介导纳米金属材料的制备及应用取得了可喜的结果,但某些生物基分子提取物组成复杂、且不同来源的植物提取物成分含量差异大,且发酵产生物基分子的产率还有待提高,某些功能分子的后续分离提纯问题也值得关注。这些不利因素的存在,可能会使得纳米材料批次间有较大差异,纳米材料的稳定性及功能性存在问题,直接可能导致该纳米材料的应用会有隐患,较难从科研走向生产。所以,生物基分子介导合成纳米材料还有待进一步研究和优化:首先是功能分子成分的有效确定,功能组分提取或发酵条件的优化,功能分子的高效分离纯化、各组分介导纳米材料制备过程中相互作用机理的阐明,以及基于其制备纳米材料的可控性的掌握等,任重而道远。
参考文献
| [1] | Arvizo RRR, Bhattacharyya S, Kudgus RA, et al. Intrinsic therapeutic applications of noble metal nanoparticles: past, present and future. Chem Soc Rev, 2012, 41(7): 2943-2970. DOI:10.1039/c2cs15355f |
| [2] | Zhou XJ, Zhang Y, Wang C, et al. Photo-fenton reaction of graphene oxide: a new strategy to prepare graphene quantum dots for DNA cleavage. ACS Nano, 2012, 6(8): 6592-6599. DOI:10.1021/nn301629v |
| [3] | Zhang PP, Zhang XY, Zhang SY, et al. One-pot green synthesis, characterizations, and biosensor application of self-assembled reduced graphene oxide-gold nanoparticle hybrid membranes. J Materi Chem B, 2013, 1(47): 6525-6531. DOI:10.1039/c3tb21270j |
| [4] | Won YH, Huh K, Stanciu LA. Au nanospheres and nanorods for enzyme-free electrochemical biosensor applications. Biosens Bioelectron, 2011, 26(11): 4514-4519. DOI:10.1016/j.bios.2011.05.012 |
| [5] | Anker JN, Hall WP, Lyandres O, et al. Biosensing with plasmonic nanosensors. Nat Mater, 2008, 7(6): 442-453. DOI:10.1038/nmat2162 |
| [6] | Palem RR, Ganesh SD, Kronekova Z, et al. Green synthesis of silver nanoparticles and biopolymer nanocomposites: a comparative study on physico-chemical, antimicrobial and anticancer activity. Bull Mater Sci, 2018, 41(2): 55. DOI:10.1007/s12034-018-1567-5 |
| [7] | Rebello JHD, Subramaniam VV, Sudarshan TS. Diamond growth by laser-driven reactions in a CO/H2 mixture. Appl Phys Lett, 1993, 62(8): 899-901. DOI:10.1063/1.108560 |
| [8] | Chernick ET, Tykwinski RR. Carbon-rich nanostructures: The conversion of acetylenes into materials. J Phys Org Chem, 2013, 26(9): 742-749. DOI:10.1002/poc.3160 |
| [9] | Brust MM, Walker M, Bethell D, et al. Synthesis of thiol-derivatized gold nanoparticles in a 2-phase liquid-liquid system. J Chem Soc Chem Commun, 1994, 7(7): 801-802. |
| [10] | Giersig M, Mulvaney P. Preparation of ordered colloid monolayers by electrophoretic deposition. Langmuir, 1993, 9(12): 3408-3413. DOI:10.1021/la00036a014 |
| [11] | 俞鹏飞, 崔斌, 史启祯. 油酸在纳米材料合成中的研究与应用. 材料科学与工程学报, 2007, 25(5): 792-797. Yu PF, Cui B, Shi QZ. Research and application of oleic acid in the synthesis of nanomaterials. J Mater Sci Eng, 2007, 25(5): 792-797 (in Chinese). DOI:10.3969/j.issn.1673-2812.2007.05.036 |
| [12] | Bastus NG, Comenge J, Puntes V. Kinetically controlled seeded growth synthesis of citrate-stabilized gold nanoparticles of up to 200 nm: size focusing versus ostwald ripening. Langmuir, 2011, 27(17): 11098-11105. DOI:10.1021/la201938u |
| [13] | Zhang SY, Zhao Y. Facile preparation of organic nanoparticles by interfacial cross-linking of reverse micelles and template synthesis of subnanometer Au-Pt nanoparticles. ACS Nano, 2011, 5(4): 2637-2646. DOI:10.1021/nn102666k |
| [14] | Hirai T, Saito T, Komasawa I. Recovery and immobilization of metal sulfide nanoparticles from reverse micellar system onto thiol-modified polystyrene particles. J Phys Chem B, 2000, 104(49): 11639-11643. DOI:10.1021/jp002290b |
| [15] | Vasani RB, Janardanan N, Prieto-Simón B, et al. Microwave heating of poly(N-isopropylacrylamide)- conjugated gold nanoparticles for temperature- controlled display of concanavalin A. ACS Appl Mater Interfaces, 2015, 7(50): 27755-27764. DOI:10.1021/acsami.5b08765 |
| [16] | Bayazit MK, Yue J, Cao EH, et al. Controllable synthesis of gold nanoparticles in aqueous solution by microwave assisted flow chemistry. ACS Sustainable Chem Eng, 2016, 4(12): 6435-6442. DOI:10.1021/acssuschemeng.6b01149 |
| [17] | Zaki S, Elkady MF, Farag S, et al. Determination of the effective origin source for nanosilver particles produced by Escherichia coli strain S78 and its application as antimicrobial agent. Mater Res Bull, 2012, 47(12): 4286-4290. DOI:10.1016/j.materresbull.2012.09.016 |
| [18] | Verma VC, Kharwar RN, Gange AC. Biosynthesis of antimicrobial silver nanoparticles by the endophytic fungus Aspergillus clavatus. Nanomedicine, 2010, 5(1): 33-40. DOI:10.2217/nnm.09.77 |
| [19] | Narayanan KB, Sakthivel N. Biological synthesis of metal nanoparticles by microbes. Adv Colloid Interf Sci, 2010, 156(1/2): 1-13. |
| [20] | Gül?in I, Huyut Z, Elmasta? M, et al. Radical scavenging and antioxidant activity of tannic acid. Arabian J Chem, 2010, 3(1): 43-53. DOI:10.1016/j.arabjc.2009.12.008 |
| [21] | Yin LC, Su T, Chang J, et al. Arginine- and acrylonitrile-modified chitosan nanoparticles for anticancer drug delivery. Nano, 2014, 9(7): 1450075. DOI:10.1142/S1793292014500751 |
| [22] | Kumar V, Yadav SK. Plant-mediated synthesis of silver and gold nanoparticles and their applications. J Chem Technol Biot, 2009, 84(2): 151-157. DOI:10.1002/jctb.2023 |
| [23] | Gan RY, Li HB, Sui ZQ, et al. Absorption, metabolism, anti-cancer effect and molecular targets of epigallocatechin gallate (EGCG): An updated review. Crit Rev Food Sci Nutr, 2018, 58(6): 924-941. DOI:10.1080/10408398.2016.1231168 |
| [24] | Afzal AB, Akhtar MJ, Nadeem M, et al. Investigation of structural and electrical properties of polyaniline/gold nanocomposites. J Phys Chem C, 2009, 113(40): 17560-17565. DOI:10.1021/jp902725d |
| [25] | Sun Q, Cai X, Li JW, et al. Green synthesis of silver nanoparticles using tea leaf extract and evaluation of their stability and antibacterial activity. Colloids Surf A: Physicochem Eng Aspects, 2014, 444: 226-231. DOI:10.1016/j.colsurfa.2013.12.065 |
| [26] | Haghparasti Z, Shahri MM. Green synthesis of water-soluble nontoxic inorganic polymer nanocomposites containing silver nanoparticles using white tea extract and assessment of their in vitro antioxidant and cytotoxicity activities. Mater Sci Eng: C, 2018, 87: 139-148. DOI:10.1016/j.msec.2018.02.026 |
| [27] | Hsieh DS, Wang H, Tan SW, et al. The treatment of bladder cancer in a mouse model by epigallocatechin- 3-gallate-gold nanoparticles. Biomaterials, 2011, 32(30): 7633-7640. DOI:10.1016/j.biomaterials.2011.06.073 |
| [28] | Fei JB, Zhao J, Du CL, et al. One-pot ultrafast self-assembly of autofluorescent polyphenol-based core@shell nanostructures and their selective antibacterial applications. ACS Nano, 2014, 8(8): 8529-8536. DOI:10.1021/nn504077c |
| [29] | Wang ZM, Xu CL, Li X, et al. In situ green synthesis of Ag nanoparticles on tea polyphenols-modified graphene and their catalytic reduction activity of 4-nitrophenol. Colloid Surf A: Physicochem Eng Aspects, 2015, 485: 102-110. DOI:10.1016/j.colsurfa.2015.09.015 |
| [30] | Deng XB, Zhu LP, Fang T, et al. Analysis of isoquinoline alkaloid composition and wound-induced variation in nelumbo using HPLC-MS/MS. J Agr Food Chem, 2016, 64(5): 1130-1136. DOI:10.1021/acs.jafc.5b06099 |
| [31] | Chuang CH, Wu PC, Tsai TH, et al. Development of pH-sensitive cationic PEGylated solid lipid nanoparticles for selective cancer-targeted therapy. J Biomedi Nanotechnol, 2017, 13(2): 192-193. DOI:10.1166/jbn.2017.2338 |
| [32] | Rai A, Singh A, Ahmad A, et al. Role of halide Ions and temperature on the morphology of biologically synthesized gold nanotriangles. Langmuir, 2006, 22(2): 736-741. DOI:10.1021/la052055q |
| [33] | Liu CC, Wang L, Xu H, et al. "One pot" green synthesis and the antibacterial activity of g-C3N4/Ag nanocomposites. Mater Lett, 2016, 164: 567-570. DOI:10.1016/j.matlet.2015.11.072 |
| [34] | Liu CC, Xu H, Wang L, et al. Facile One-pot green synthesis and antibacterial activities of GO/Ag nanocomposites. Acta Metall Sin (Engl Lett), 2017, 30(1): 36-44. DOI:10.1007/s40195-016-0517-8 |
| [35] | Ismail M, Khan MI, Khan SB, et al. Catalytic reduction of picric acid, nitrophenols and organic azo dyes via green synthesized plant supported Ag nanoparticles. J Mol Liq, 2018, 268: 87-101. DOI:10.1016/j.molliq.2018.07.030 |
| [36] | Mittal AK, Chisti Y, Banerjee UC. Synthesis of metallic nanoparticles using plant extracts. Biotechnol Adv, 2013, 31(2): 346-356. DOI:10.1016/j.biotechadv.2013.01.003 |
| [37] | van Buren JP, Robinson WB. Formation of complexes between protein and tannic acid. J Agric Food Chem, 1969, 17(4): 772-777. DOI:10.1021/jf60164a003 |
| [38] | 马志红, 陆忠兵, 石碧. 单宁酸的化学性质及应用. 天然产物研究与开发, 2003, 15(1): 87-91. Ma ZH, Lu ZB, Shi B. Chemical properties and application of tannic acid. Nat Prod Res Dev, 2003, 15(1): 87-91 (in Chinese). DOI:10.3969/j.issn.1001-6880.2003.01.023 |
| [39] | Bors W, Foo LY, Hertkorn N, et al. Chemical studies of proanthocyanidins and hydrolyzable tannins. Antioxid Redox Signal, 2001, 3(6): 995-1008. DOI:10.1089/152308601317203530 |
| [40] | Ranoszek-Soliwoda K, Tomaszewska E, Socha E, et al. The role of tannic acid and sodium citrate in the synthesis of silver nanoparticles. J Nanopart Res, 2017, 19(8): 273. DOI:10.1007/s11051-017-3973-9 |
| [41] | Fang Y, Tan JJ, Lan T, et al. Universal one-pot, one-step synthesis of core-shell nanocomposites with self-assembled tannic acid shell and their antibacterial and catalytic activities. J Appl Polym Sci, 2017, 135(6): 45829. |
| [42] | Sivaraman SK, Kumar S, Santhanam V. Room-temperature synthesis of gold nanoparticles size-control by slow addition. Gold Bull, 2010, 43(4): 275-286. DOI:10.1007/BF03214997 |
| [43] | Aromal SA, Philip D. Facile one-pot synthesis of gold nanoparticles using tannic acid and its application in catalysis. Phys E: Low-Dimensional Syst Nanostruct, 2012, 44(7/8): 1692-1696. |
| [44] | Ahmad T, Khan W. Size Variation of gold nanoparticles synthesized using tannic acid in response to higher chloroauric acid concentrations. World J Nano Sci Eng, 2013, 3(3): 62-68. DOI:10.4236/wjnse.2013.33009 |
| [45] | Huang ZL, Meng GW, Huang Q, et al. Improved SERS performance from Au nanopillar arrays by abridging the pillar tip spacing by Ag sputtering. Adv Mater, 2010, 22(37): 4136-4139. DOI:10.1002/adma.201001179 |
| [46] | Zhang N, Luo J, Liu R, et al. Tannic acid stabilized silver nanoparticles for inkjet printing conductive of flexible electronics. RSC Adv, 2016, 6(87): 83720-83729. DOI:10.1039/C6RA19800G |
| [47] | Shen YZ, Du CW, Zhou JM, et al. Application of nano FeⅢ-tannic acid complexes in modifying aqueous acrylic latex for controlled-release coated urea. J Agric and Food Chem, 2017, 65(5): 1030-1036. DOI:10.1021/acs.jafc.6b05274 |
| [48] | Zhang YW, Liu S, Wang L, et al. One-pot green synthesis of Ag nanoparticles-graphene nanocomposites and their applications in SERS, H2O2, and glucose sensing. RSC Adv, 2011, 2(2): 538-545. |
| [49] | Abouelmagd SA, Meng FF, Kim BK, et al. Tannic acid-mediated surface functionalization of polymeric nanoparticles. ACS Biomater Sci Eng, 2016, 2(12): 2294-2303. DOI:10.1021/acsbiomaterials.6b00497 |
| [50] | Lee H, Dellatore SM, Miller WM, et al. Mussel-inspired surface chemistry for multifunctional coatings. Science, 2007, 318(5849): 426-430. DOI:10.1126/science.1147241 |
| [51] | Sureshkumar M, Siswanto DY, Lee CK. Magnetic antimicrobial nanocomposite based on bacterial cellulose and silver nanoparticles. J Mater Chem, 2010, 20(33): 6948-6955. DOI:10.1039/c0jm00565g |
| [52] | Xu LQ, Chen JC, Wang R, et al. A poly(vinylidene fluoride)-graft-poly(dopamine acrylamide) copolymer for surface functionalizable membranes. RSC Adv, 2013, 3(47): 25204-25214. DOI:10.1039/c3ra42782j |
| [53] | Kung ML, Lin PY, Peng SW, et al. Biomimetic polymer-based Ag nanocomposites as a antimicrobial platform. Appl Mater Today, 2016, 4: 31-39. DOI:10.1016/j.apmt.2016.05.003 |
| [54] | Han L, Lu X, Liu KZ, et al. Mussel-inspired adhesive and tough hydrogel based on nanoclay confined dopamine polymerization. ACS Nano, 2017, 11(3): 2561-2574. DOI:10.1021/acsnano.6b05318 |
| [55] | Qiang WB, Li W, Li XQ, et al. Bioinspired polydopamine nanospheres: a superquencher for fluorescence sensing of biomolecules. Chem Sci, 2014, 5(8): 3018-3024. DOI:10.1039/C4SC00085D |
| [56] | Li N, Li TT, Hu C, et al. Targeted near-infrared fluorescent turn-on nanoprobe for activatable imaging and effective phototherapy of cancer cells. ACS Appl Mater Interfaces, 2015, 8(24): 15013-15023. |
| [57] | Mrówczyński R. Polydopamine-based multifunctional (nano) materials for cancer therapy. ACS Appl Mater Interfaces, 2018, 10(9): 7541-7561. DOI:10.1021/acsami.7b08392 |
| [58] | Kuforiji O, Kuboye AO, Odunfa SA. Orange and pineapple wastes as potential substrates for citric acid production. Int J Plant Biol, 2010, 1(1): 1-4. DOI:10.4081/pb.2010.e1 |
| [59] | Ranoszek-Soliwoda K, Tomaszewska E, Socha E, et al. The role of tannic acid and sodium citrate in the synthesis of silver nanoparticles. J Nanopart Res, 2017, 19(8): 273. DOI:10.1007/s11051-017-3973-9 |
| [60] | Turkevich J, Stevenson PC, Hillier J. A study of the nucleation and growth processes in the synthesis of colloidal gold. Discuss Faraday Soc, 1951, 11: 55-75. DOI:10.1039/df9511100055 |
| [61] | Gicheva G, Yordanov G. Removal of citrate-coated silver nanoparticles from aqueous dispersions by using activated carbon. Colloids Surf A: Physicochem Eng Aspects, 2013, 431: 51-59. DOI:10.1016/j.colsurfa.2013.04.039 |
| [62] | Tan YW, Li YF, Zhu DB. Preparation of silver nanocrystals in the presence of aniline. J Colloid Interf Sci, 2003, 258(2): 244-251. DOI:10.1016/S0021-9797(02)00151-0 |
| [63] | Sharma VK, Yngard RA, Lin Y. Silver nanoparticles: Green synthesis and their antimicrobial activities. Adv Colloid Interf Sci, 2009, 145(1/2): 83-96. |
| [64] | Cai HX, Yao P. In situ preparation of gold nanoparticle-loaded lysozyme-dextran nanogels and applications for cell imaging and drug delivery. Nanoscale, 2013, 5(7): 2892-2900. DOI:10.1039/c3nr00178d |
| [65] | Kumar-Krishnan S, Prokhorov E, Hernández- Iturriaga M, et al. Chitosan/silver nanocomposites: synergistic antibacterial action of silver nanoparticles and silver ions. Eur Polym J, 2015, 67: 242-251. DOI:10.1016/j.eurpolymj.2015.03.066 |
| [66] | Liu B, Shen SQ, Luo JW, et al. One-pot green synthesis and antimicrobial activity of exfoliated Ag NP-loaded quaternized chitosan/clay nanocomposites. RSC Adv, 2013, 3(25): 9714-9722. DOI:10.1039/c3ra41270a |
| [67] | Bacalzo NP Jr, Go LP, Querebillo CJ, et al. Controlled microwave-hydrolyzed starch as a stabilizer for green formulation of aqueous gold nanoparticle ink for flexible printed electronics. ACS Appl Nano Mater, 2018, 1(3): 1247-1256. DOI:10.1021/acsanm.7b00379 |
| [68] | Kim KR, Oh DK. Production of hydroxy fatty acids by microbial fatty acid-hydroxylation enzymes. Biotechnol Adv, 2013, 31(8): 1473-1485. DOI:10.1016/j.biotechadv.2013.07.004 |
| [69] | 汪多仁. 脂肪酸的生产与应用. 表面活性剂工业, 2000(1): 10-12. Wan DR. Production and application of fatty acid. Surfact Ind, 2000(1): 10-12 (in Chinese). |
| [70] | Kimura K, Yamaoka M, Kamisaka Y. Inhibition of lipid accumulation and lipid body formation in oleaginous yeast by effective components in spices, carvacrol, eugenol, thymol, and piperine. J Agric Food Chem, 2006, 54(10): 3528-3534. DOI:10.1021/jf0531149 |
| [71] | Sharma D, Singh J. Synthesis and characterization of fatty acid grafted chitosan polymer and their nanomicelles for nonviral gene delivery applications. Bioconjugate Chem, 2017, 28(11): 2772-2783. DOI:10.1021/acs.bioconjchem.7b00505 |
| [72] | 孟多, 王立久. 脂肪酸/无机纳米颗粒基定形相变材料的制备与热性能. 建筑材料学报, 2013, 16(1): 91-96. Meng D, Wang LJ. Preparation and thermal properties of fatty acid/inorganic nano-particle form-stable phase change material. J Build Mater, 2013, 16(1): 91-96 (in Chinese). DOI:10.3969/j.issn.1007-9629.2013.01.017 |
| [73] | Jones OG, Mezzenga R. Inhibiting, promoting, and preserving stability of functional proteinfibrils. Soft Matter, 2012, 8(4): 876-895. DOI:10.1039/C1SM06643A |
| [74] | Gupta SK, Shukla P. Advanced technologies for improved expression of recombinant proteins in bacteria: perspectives and applications. Crit Rev Biotechnol, 2015, 36(6): 1089-1098. |
| [75] | Lagziel-Simis S, Cohen-Hadar N, Moscovich-Dagan H, et al. Protein-mediated nanoscale biotemplating. Curr Opin Biotechnol, 2006, 17(6): 569-573. DOI:10.1016/j.copbio.2006.10.005 |
| [76] | Voet ARD, Tame JRH. Protein-templated synthesis of metal-based nanomaterials. Curr Opin Biotechnol, 2017, 46: 14-19. DOI:10.1016/j.copbio.2016.10.015 |
| [77] | Bajaj A, Rana S, Miranda OR, et al. Cell surface-based differentiation of cell types and cancer states using a gold nanoparticle-GFP based sensing array. Chem Sci, 2010, 1(1): 134-138. DOI:10.1039/c0sc00165a |
| [78] | Kühn S, H?kanson U, Rogobete L, et al. Enhancement of single-molecule fluorescence using a gold nanoparticle as an optical nanoantenna. Phys Rev Lett, 2006, 97(1): 017402. DOI:10.1103/PhysRevLett.97.017402 |
| [79] | Hall WP, Ngatia SN, Van Duyne RP. LSPR biosensor signal enhancement using nanoparticle- antibody conjugates. J Phys Chem C, 2011, 115(5): 1410-1414. DOI:10.1021/jp106912p |
| [80] | Muntimadugu E, Kommineni N, Khan W. Exploring the potential of nanotherapeutics in targeting tumor microenvironment for cancer therapy. Pharmacol Res, 2017, 126: 109-122. DOI:10.1016/j.phrs.2017.05.010 |
| [81] | Liu HX, Gao L, Han JZ, et al. Biocombinatorial synthesis of novel lipopeptides by COM domain-mediated reprogramming of the plipastatin NRPS complex. Front Microbiol, 2016, 7: 1801. |
| [82] | Conde J, Bao CC, Tan YQ, et al. Dual targeted immunotherapy via in vivo delivery of biohybrid RNAi-peptide nanoparticles to tumor-associated macrophages and cancer cells. Adv Funct Mater, 2015, 25(27): 4183-4194. DOI:10.1002/adfm.201501283 |
| [83] | Choi H, Liu T, Qiao H, et al. Biomimetic nano-surfactant stabilizes sub-50 nanometer phospholipid particles enabling high paclitaxel payload and deep tumor penetration. Biomaterials, 2018, 181: 240-251. DOI:10.1016/j.biomaterials.2018.07.034 |
| [84] | Ji TJ, Lang JY, Ning B, et al. Enhanced natural killer cell immunotherapy by rationally assembling Fc fragments of antibodies onto tumor membranes. Adv Mater, 2019, 31(6): 1804395. |
| [85] | Lang S, Wullbrandt D. Rhamnose lipids — biosynthesis, microbial production and application potential. Appl Microbiol Biotechnol, 1999, 51(1): 22-32. DOI:10.1007/s002530051358 |
| [86] | Desai JD, Banat IM. Microbial production of surfactants and their commercial potential. Microbiol Mol Biol Rev, 1997, 61(1): 47-64. DOI:10.1128/.61.1.47-64.1997 |
| [87] | van Bogaert IN, Saerens K, de Muynck C, et al. Microbial production and application of sophorolipids. Appl Microbiol Biot, 2007, 76(1): 23-34. DOI:10.1007/s00253-007-0988-7 |
| [88] | Abdel-Mawgoud A, Hausmann R, Lépine F, et al. Rhamnolipids: detection, analysis, biosynthesis, genetic regulation, and bioengineering of production//Soberón-Chávez G, ed. Biosurfactants. Berlin, Heidelberg: Springer, 2011, 20: 13-15. |
| [89] | Kakavandi B, Kalantary RR, Farzadkia M, et al. Enhanced chromium (Ⅵ) removal using activated carbon modified by zero valent iron and silver bimetallic nanoparticles. J Environ Health Sci Eng, 2014, 12(1): 115. DOI:10.1186/s40201-014-0115-5 |
| [90] | Konishi M, Imura T, Fukuoka T, et al. A yeast glycolipid biosurfactant, mannosylerythritol lipid, shows high binding affinity towards lectins on a self-assembled monolayer system. Biotechnol Lett, 2007, 29(3): 473-480. DOI:10.1007/s10529-006-9261-x |
| [91] | Lin SC. Biosurfactants: Recent advances. J Chem Technol Biot, 1996, 66(2): 109-120. DOI:10.1002/(SICI)1097-4660(199606)66:2<109::AID-JCTB477>3.0.CO;2-2 |
| [92] | 方艳, 徐帆莉, 姜岷, 等. 一种核壳型微米银及其制备方法与应用. 中国, 108453268B. 2019-07-23. Fang Y, Xu FL, Jiang M, et al. Core-shell type micrometer silver, as well as preparation method and application thereof. CN, 108453268B. 2019-07-23 (in Chinese). |
| [93] | Wan J, Zeng GM, Huang DL, et al. Rhamnolipid stabilized nano-chlorapatite: synthesis and enhancement effect on Pb-and Cd-immobilization in polluted sediment. J Hazardous Mater, 2017, 343: 332-339. |
| [94] | Heo W, Kim JH, Pan JH, et al. Lecithin-based nano-emulsification improves the bioavailability of conjugated linoleic acid. J Agric Food Chem, 2016, 64(6): 1355-1360. DOI:10.1021/acs.jafc.5b05397 |
| [95] | Kasture MB, Patel P, Prabhune AA, et al. Synthesis of silver nanoparticles by sophorolipids: effect of temperature and sophorolipid structure on the size of particles. J Chem Sci, 2008, 120(6): 515-520. DOI:10.1007/s12039-008-0080-6 |
| [96] | Kasture M, Singh S, Patel P, et al. Multiutility sophorolipids as nanoparticle capping agents: ?synthesis of stable and water dispersible Co nanoparticles. Langmuir, 2007, 23(23): 11409-11412. DOI:10.1021/la702931j |
| [97] | Lassenberger A, Scheberl A, Batchu KC, et al. Biocompatible glyconanoparticles by grafting sophorolipid monolayers on monodispersed iron oxide nanoparticles. ACS Appl Bio Mater, 2019, 2(7): 3095-3107. DOI:10.1021/acsabm.9b00427 |
| [98] | Zhou W, Gao X, Liu DB, et al. Gold nanoparticles for in vitro diagnostics. Chem Rev, 2015, 115(19): 10575-10636. DOI:10.1021/acs.chemrev.5b00100 |
| [99] | Yu MX, Zheng J. Clearance pathways and tumor targeting of imaging nanoparticles. ACS Nano, 2015, 9(7): 6655-6674. DOI:10.1021/acsnano.5b01320 |
| [100] | Cassano D, Pocoví-Martínez S, Voliani V. Ultrasmall-in-nano approach: enabling the translation of metal nanomaterials to clinics. Bioconjugate Chem, 2018, 29(1): 4-16. DOI:10.1021/acs.bioconjchem.7b00664 |
| [101] | Endo T, Kerman K, Nagatani N, et al. Multiple label-free detection of antigen-antibody reaction using localized surface plasmon resonance-based core-shell structured nanoparticle layer nanochip. Anal Chem, 2006, 78(18): 6465-6475. DOI:10.1021/ac0608321 |
| [102] | Chirea M, Cruz A, Pereira CM, et al. Size-dependent electrochemical properties of gold nanorods. J Phys Chem C, 2009, 113(30): 13077-13087. DOI:10.1021/jp9018712 |
| [103] | Gao LZ, Zhuang J, Nie L, et al. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles. Nat Nanotechnol, 2007, 2(9): 577-583. DOI:10.1038/nnano.2007.260 |
| [104] | Pananon P, Sriprachuabwong C, Wisitsoraat A, et al. A facile one-pot green synthesis of gold nanoparticle-graphene-PEDOT: PSS nanocomposite for selective electrochemical detection of dopamine. RSC Adv, 2018, 8(23): 12724-12732. DOI:10.1039/C8RA01564C |
| [105] | Dosler S, Karaaslan E. Inhibition and destruction of Pseudomonas aeruginosa biofilms by antibiotics and antimicrobial peptides. Peptides, 2014, 62: 32-37. DOI:10.1016/j.peptides.2014.09.021 |
| [106] | McCarthy M. Hospital transmitted Candida auris infections confirmed in the US. BMJ, 2016, 355: i5978. |
| [107] | Fang Y, Tan JJ, Choi H, et al. Highly sensitive naked eye detection of Iron (Ⅲ) and H2O2 using poly-(tannic acid) (PTA) coated Au nanocomposite. Sensor Actuat B: Chem, 2018, 259: 151-161. |
| [108] | Shalev T, Gopin A, Bauer M, et al. Non-leaching antimicrobial surfaces through polydopamine bio-inspired coating of quaternary ammonium salts or an ultrashort antimicrobial lipopeptide. J Mater Chem, 2012, 22(5): 2026-2032. DOI:10.1039/C1JM13994K |
| [109] | Yu NX, Peng HL, Qiu L, et al. New pectin-induced green fabrication of Ag@AgCl/ZnO nanocomposites for visible-light triggered antibacterial activity. Int J Biol Macromol, 2019, 141: 207-217. DOI:10.1016/j.ijbiomac.2019.08.257 |
| [110] | Parmar A, Kaur G, Kapil S, et al. Green chemistry mediated synthesis of PLGA-silver nanocomposites for antibacterial synergy: introspection of formulation parameters on structural and bactericidal aspects. React Funct Polm, 2019, 141: 68-81. DOI:10.1016/j.reactfunctpolym.2019.04.018 |
| [111] | Thanighaiarassu RR, Sivamai P, Nambikkairaj B. Green synthesis of gold nanoparticles characterization by using plant essential oil Menthapiperita and their antifungal activity against human pathogenic fungi. J Nanomed Nanotechnol, 2014, 5(5): 1000229. |
| [112] | Fitzmaurice C, Akinyemiju TF, Al Lami FH, et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 1990 to 2016: a systematic analysis for the global burden of disease study. JAMA Oncol, 2018, 4(11): 1553-1568. DOI:10.1001/jamaoncol.2018.2706 |
| [113] | Mura S, Nicolas J, Couvreur P. Stimuli-responsive nanocarriers for drug delivery. Nat Mater, 2013, 12(11): 991-1003. DOI:10.1038/nmat3776 |
| [114] | Hofmann S, Bellmann-Sickert K, Beck-Sickinger AG. Chemical modification of neuropeptide Y for human Y1 receptor targeting in health and disease. Biol Chem, 2019, 400(3): 299-311. DOI:10.1515/hsz-2018-0364 |
| [115] | Tran NTT, Wang TH, Lin CY, et al. Direct synthesis of Rev peptide-conjugated gold nanoparticles and their application in cancer therapeutics. Bioconjugate Chem, 2011, 22(7): 1394-1401. DOI:10.1021/bc2001215 |
| [116] | Kang B, Mackey MA, El-Sayed MA. Nuclear targeting of gold nanoparticles in cancer cells induces DNA damage, causing cytokinesis arrest and apoptosis. J Am Chem Soc, 2010, 132(5): 1517-1519. DOI:10.1021/ja9102698 |
| [117] | Tan XX, Wang JP, Pang XJ, et al. Indocyanine green-loaded silver nanoparticle@polyaniline core/ shell theranostic nanocomposites for photoacoustic/ near-infrared fluorescence imaging-guided and single-light-triggered photothermal and photodynamic therapy. ACS Appl Mater Interfaces, 2016, 8(51): 34991-35003. DOI:10.1021/acsami.6b11262 |
| [118] | El-Sayed IH, Huang XH, El-Sayed MA. Selective laser photo-thermal therapy of epithelial carcinoma using anti-EGFR antibody conjugated gold nanoparticles. Cancer Lett, 2006, 239(1): 129-135. DOI:10.1016/j.canlet.2005.07.035 |
| [119] | Chan JM, Zhang LF, Tong R, et al. Spatiotemporal controlled delivery of nanoparticles to injured vasculature. Proc Natl Acade Sci USA, 2010, 107(5): 2213-2218. DOI:10.1073/pnas.0914585107 |
| [120] | Aromal SA, Philip D. Green synthesis of gold nanoparticles using Trigonella foenum-graecum and its size-dependent catalytic activity. Spectrochim Acta A Mol Biomol Spectrosc, 2012, 97: 1-5. DOI:10.1016/j.saa.2012.05.083 |
| [121] | Liao GF, Fang JS, Li Q, et al. Ag-Based nanocomposites: synthesis and applications in catalysis. Nanoscale, 2019, 11(15): 7062-7096. DOI:10.1039/C9NR01408J |
| [122] | Wang WB, Kang YR, Wang AQ. In situ fabrication of Ag nanoparticles/attapulgite nanocomposites: green synthesis and catalytic application. J Nanopart Res, 2014, 16(2): 2281-1162. DOI:10.1007/s11051-014-2281-x |
| [123] | Scholder P, Hafner M, Hassel AW, et al. Gold nanoparticle@polyhedral oligomeric silsesquioxane hybrid scaffolds in microfluidic format — highly efficient and green catalytic platforms. Eur J Inorg Chem, 2016, 2016(7): 951-955. DOI:10.1002/ejic.201501376 |
| [124] | Kim KJ, Kim HC, Park M, et al. Facile preparation of SERS and catalytically active Au nanostructures using furfuryl derivatives. Appl Surf Sci, 2017, 414: 325-334. DOI:10.1016/j.apsusc.2017.04.105 |
| [125] | Rigano F, Albergamo A, Sciarrone D, et al. Nano liquid chromatography directly coupled to electron ionization mass spectrometry for free fatty acid elucidation in mussel. Anal Chem, 2016, 88(7): 4021-4028. DOI:10.1021/acs.analchem.6b00328 |
| [126] | Kim YJ, Kim JW, Ryu JH, et al. Cationic polymer nanoparticles encapsulating an active ingredients, and the cosmetic composition containing the same. US, 8877217B2. 2014-04-11. |
| [127] | Ragunathan R, Kumar R, Tamilenthi A, et al. Green synthesis of chitosan silver nanocomposites, its medical and edible coating on fruits and vegetables. Int J Biol Pharm Res, 2015, 6(2): 129-136. |
| [128] | Faghihi R, Larijani K, Abdossi V, et al. Green synthesis of silver nanoparticles by grapefruit's peel and effect of these nanoparticles on superoxide dismutase enzyme activity and growth of cucumber plants inoculated with rhizoctonia solani. Orient J Chem, 2017, 33(6): 2810-2820. DOI:10.13005/ojc/330614 |
| [129] | 王唯一, 岳红彦, 宋珊珊, 等. SnO2纳米片阵列的制备及其在新能源器件领域的研究. 功能材料, 2019, 50(9): 9033-9036. Wang WY, Yue HY, Song SS, et al. SnO2 nanosheet arrays: preparation and application in new energy devices. J Funct Mater, 2019, 50(9): 9033-9036 (in Chinese). |
| [130] | 王易, 霍旺晨, 袁小亚, 等. 二氧化锰与二维材料复合应用于超级电容器. 物理化学学报, 2020, 36(2): 1904007. Wang Y, Huo WC, Yuan XY, et al. Composite of manganese dioxide and two-dimensional materials applied to supercapacitors. Acta Phys Chim Sin, 2020, 36(2): 1904007 (in Chinese). |
| [131] | Anjana PM, Bindhu MR, Rakhi RB. Green synthesized gold nanoparticle dispersed porous carbon composites for electrochemical energy storage. Mater Sci Energy Technol, 2019, 2(3): 389-395. |
| [132] | Hosseini-Sarvari M, Sodagar E, Doroodmand MM. Nano sulfated titania as solid acid catalyst in direct synthesis of fatty acid amides. J Org Chem, 2011, 76(8): 2853-2859. DOI:10.1021/jo2002769 |
