

中国计量大学 生命科学学院 浙江省海洋食品品质及危害物控制技术重点实验室 浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018
收稿日期:2020-04-30;接收日期:2020-09-30;网络出版时间:2020-11-19
基金项目:浙江省自然科学基金(Nos. LQ18C020001, LY19C020001),国家重点研发计划(No. 2017YFD0801104),金华市科学技术研究项目(No. 2020-2-035),浙江省大学生科技创新活动计划(No. 2018R409044)资助
摘要:为了筛选可供利用的番茄污染安全品种(Pollution-safe cultivar,PSC),减少镉(Cd)污染地区食品安全隐患,通过土培及水培试验研究了南方地区常见不同番茄(Solanum lycopersicum)品种对Cd的积累差异。首先利用土培试验在2.94 mg/kg Cd胁迫下从25个番茄品种中筛选出高低积累品种,并进一步利用水培试验测定高低积累番茄品种对Cd胁迫的响应情况。土培试验结果表明,在2.94 mg/kg Cd胁迫下,25种番茄株高、总生物量以及产量有显著差异,并且25种番茄果实Cd含量均超过国际食品法典委员会(Codex alimentarius commission,CAC)标准的最高限值(0.05 mg/kg)。通过聚类分析,筛选到果实中Cd高积累、中积累、低积累类群分别有7个、4个和14个品种,其中果实Cd含量最高为3.06 mg/kg DW,最低为1.47 mg/kg DW,平均为2.21 mg/kg DW。水培试验结果显示,在相同浓度Cd胁迫下,与Cd低积累品种浙粉3053相比,Cd高积累品种钱塘旭日F1其吸收Cd的速度更快、Cd积累量更大、产生氧化应激反应时间更短、对Cd的耐受性也更强。筛选出来的典型Cd高低积累品种,为重金属污染区域农业生产以及开发污染安全品种的分子辅助育种提供参考。种植低Cd积累PSC品种,结合番茄果实Cd含量动态监控,是在中轻度Cd污染地区目前较为可行的方法。
关键词:镉番茄镉-污染安全品种酶活污染安全品种抗氧化
Screening of tomato cultivars in cadmium-polluted areas and study on their antioxidant capacity
Jiamin Yang*, Hexigeduleng Bao*, Jiayue Wan, Yanfei Ding, Feijuan Wang, Cheng Zhu


Key Laboratory of Marine Food Quality and Hazard Controlling Technology of Zhejiang Province, Zhejiang Provincial Key Laboratory of Biometrology and Inspection & Quarantine, College of Life Sciences, China Jiliang University, Hangzhou 310018, Zhejiang, China
Received: April 30, 2020; Accepted: September 30, 2020; Published: November 19, 2020
Supported by: Natural Science Foundation of Zhejiang Province, China (Nos. LQ18C020001, LY19C020001), National Key Research and Development Program of China (No. 2017YFD0801104), Jinhua Science and Technology Project (No. 2020-2-035), Zhejiang Province University Students' Research and Innovation Program Support Project (No. 2018R409044)
Corresponding author: Cheng Zhu. Tel: +86-571-86836090; E-mail: pzhch@cjlu.edu.cn.
*These authors contributed equally to this study.
Abstract: To screen the available tomato pollution-safe cultivar varieties and reduce the potential food safety risks in Cd-polluted areas, the differences of Cd accumulation in different tomato (Solanum lycopersicum) varieties in southern China were studied by soil culture and hydroponic experiments. Firstly, the high and low accumulation varieties were selected from 25 tomato varieties under 2.94 mg/kg Cd stress by soil culture test, and then the responses of high and low accumulation tomato varieties to Cd stress were determined by hydroponic experiments. The results of soil culture test show that under 2.94 mg/kg Cd stress, there were significant differences in plant height, total biomass and yield among 25 tomato cultivars, and the Cd contents of fruits of all 25 tomato cultivars exceeded the highest limit value (0.05 mg/kg) of CAC (Codex alimentarius commission). Through cluster analysis, 7, 4 and 14 varieties accumulating relatively high, medium, and low concentrations of Cd in the fruits were screened, among which the highest, the lowest, and the average Cd contents in the fruits were 3.06 mg/kg DW, 1.47 mg/kg DW, and 2.21 mg/kg DW, respectively. The results of hydroponic experiment show that under the same concentration of Cd stress, Qiantangxuri F1, a high Cd accumulating variety, absorbed Cd faster, accumulated more Cd, used shorter oxidative stress response time and had stronger tolerance to Cd than Zhefen 3053, a low Cd accumulating variety. The typical high and low Cd accumulating varieties can provide a reference for agricultural production in heavy metal polluted areas and the development of molecular-assisted breeding methods of PSC. At present, cultivating low Cd accumulating PSC varieties and dynamic monitoring of Cd contents in tomato fruits are feasible methods in medium and light Cd-polluted areas.
Keywords: cadmiumtomatoCd-PSCenzyme activitypollution-safe varietiesanti-oxidation
镉(Cadmium,Cd)是一种自然存在的重金属,是对动植物毒性最大的重金属之一[1-2],随着人类活动,如工业生产、大规模农业化肥的使用,土壤中Cd含量不断增加[2]。Cd最终可能通过食物链进入人体[3-5],其在人体内的积累导致骨质疏松症[4]、肾功能障碍、癌症和心血管疾病等[6-8]。Cd污染造成的食品安全问题屡见不鲜,在水稻、蔬菜和水果中也都有报道,为了更好地保障食品安全,减少Cd在可食用植物中的积累变得越来越重要。
中国土壤污染状况调查显示,我国16.1%的耕地污染超标[9],Yang等[10]的研究认为全国蔬菜地土壤污染情况被低估,农业土壤中镉(Cd)的持续污染导致作物中Cd的过量积累,给人类带来了更大的Cd暴露风险。为了减少Cd积累,采用品种选育的方式[11],根据作物Cd含量差异的特点,提出了污染安全品种(Pollution-safe cultivar,PSC)策略,即通过选育低污染物积累品种来降低重金属的污染风险[12]。PSC策略已经在水稻Oryza sativa[13]、菜心Brassica campestris L.[14]、芹菜Apium Graveolens L.[15]、绿叶莴苣Lactuca sativa L.[16]、小白菜Brassica chinensis L.[17]等作物上得到了应用。目前对污染安全品种的研究大多集中在水稻或叶菜类蔬菜上,而对茄果类蔬菜的研究较少。
番茄作为我国栽培最多的反季节温室大宗蔬菜,种类繁多,在蔬菜的年度供应中占着重要地位。作为比较容易吸收积累Cd,且在受污染或污染情况不明的土壤中种植风险较大的农作物种类[18-19],有研究表明在特定Cd胁迫下筛选得到番茄镉污染安全品种(Cd-PSCs)的可行性[18],但目前可供利用的番茄PSC品种仍非常少,并且其对Cd胁迫响应机制也不清楚。因此,本研究收集了我国南方地区25种最常见的广泛栽培的番茄品种,研究了不同番茄品种对Cd吸收和累积的差异,并在此基础上研究了Cd高积累、低积累品种在Cd胁迫下的生理指标差异,为研究番茄Cd积累规律及培育低Cd积累品种奠定基础。
1 材料与方法1.1 材料与试剂供试土壤:未被污染水稻土(Paddy soil),采自浙江省台州市临海后山村(N28°52′23.38″,E121°08′11.14″),土壤理化性质见表 1。土壤使用前经晾晒、磨碎过50目筛(0.3 mm)备用。原位土装箱完毕后,加入CdSO4溶液处理,胁迫处理目标为3 mg/kg。处理后,将根箱土壤搅拌均匀,根据气候情况适当加水(土壤湿度控制在田间土壤含水量的65%左右),每隔1周彻底翻土,以确保Cd分布均匀,直至稳定至60 d。稳定后测定土壤Cd含量为2.94 mg/kg。
表 1 供试土壤理化性质Table 1 Physical and chemical properties of soil used in experiment
| pH | Organic matter (g/kg) | Total nitrogen (%) | Available K (mg/kg) | Available P (mg/kg) | Total Cd (mg/kg) |
| 6.32 | 14.4 | 0.086 | 120 | 57.2 | 0.02 |
表选项
供试番茄:25个品种番茄种子均从浙江勿忘农种业股份有限公司购入,品种、编号名称见表 2。
表 2 供试番茄品种名称及编号Table 2 Name and IDs of the tested tomato varieties
| No. | Variety name |
| A-1 | Zhefen 202 |
| A-2 | Zheza 203 |
| A-3 | Zhefen 702 |
| A-4 | Zheza 809 |
| A-5 | Jiamei |
| A-6 | Hongxiu |
| A-7 | Qiantanghongbao F1 |
| A-8 | Qiantangxuri F1 |
| A-9 | American Red Bull |
| A-10 | Hezuo 903 dahong tomato |
| A-11 | Hangyan No.8 Tomato |
| A-12 | GBS-sterile 903 tomato |
| A-13 | Napras |
| A-14 | Fenbeiying |
| A-15 | Zhefen 2023 |
| A-16 | Zhefen 3053 |
| A-17 | Zheza 503 |
| A-18 | Zhefen 701 |
| A-19 | Jinlingxiuyu |
| A-20 | Jinlingmeiyu |
| A-21 | Jinpeng No.3 |
| A-22 | Yingfen No.8 |
| A-23 | Xianke No.1 |
| A-24 | Xianke No.5 |
| A-25 | Jiahong No.4 |
表选项
试剂:硫酸镉(分析纯,纯度≥99%),次氯酸钠溶液(分析纯,30%),硝酸(优级纯,纯度≥99%),国药集团化学试剂有限公司。
1.2 仪器与设备MARSX 240/50微波消解仪,美国CEM公司;AA-7000原子吸收分光光度计,日本岛津公司;CU-36L5植物生长箱,美国PERCIVAL公司;Optima-max超速离心机,Beckman Coulter;UV-1800紫外分光光度计,日本岛津公司;GZX-9240MBE电热鼓风干燥箱,上海博迅实业有限公司。
1.3 试验方法1.3.1 植物的培养盆栽试验于2018年9月至2019年2月在台州市农业科学院蔬菜大棚内进行。根据番茄生长习性,将25种番茄播种于育苗盆内育苗,待幼苗长至3–4片真叶时进行移苗,每盆移栽两株,所有处理设3个重复。大棚内培养,种植期间根据天气温度适时浇灌、施肥、除病虫害,95 d成熟,测定株高、总生物量,收集供试番茄果实样品用于测量Cd含量。
水培试验于2019年4月至2019年6月在中国计量大学生命科学学院实验室内进行。选取番茄Cd高低积累品种,用0.1%稀HNO3浸泡成熟饱满的番茄种子12 h,使用5%的次氯酸钠溶液进行消毒20 min,蒸馏水漂洗后,30 ℃的培养箱黑暗萌发,7 d后将长势一致的番茄转移至植物生长箱中培养,培养条件为:白天30 ℃,12 h,湿度60%,光照2 000 lx;晚上25 ℃,12 h,湿度60%,光照2 000 lx。番茄营养液按照1/2 Hoagland配方配置,调节pH至6.0,3 d更换一次营养液。培养15 d后加入CdCl2溶液,使番茄营养液镉浓度维持10 μmol/L,分别于0、1、3、5、7 d取番茄相同位置叶片的样品,取样时苗龄为29 d,剪碎后包好用液氮速冻,于?80 ℃冰箱保存待用于生理指标测定。
1.3.2 镉含量测定番茄果实中Cd含量测定参照《食品安全国家标准食品中镉的测定》(GB 5009.15-2014)[20]石墨炉法。番茄整个果实样品用去离子水洗净、切块,烘箱105 ℃杀青30 min,90 ℃烘干至质量不变,混匀磨粉干燥保存。称取0.3 g该前处理番茄果实样品粉末至消化管中,加入6 mL HNO3,静置2 h后,采用微波消解仪(CEM-MARS)消解,去离子水定容至50 mL。利用原子吸收分光光度计测定(AA-7000,日本岛津)测定样品中Cd含量。
富集系数(Bioconcentration factor,BCFCd)用来表示番茄果实部位对Cd的富集能力[21]。计算公式如下:
富集系数(BCFCd)=Cd果实含量/Cd土壤含量
1.3.3 生理指标测定生理指标测定使用的部位是叶片。叶片中H2O2含量测定采用南京建成过氧化氢测试盒(A064-1-1,分光光度法),APX酶活测定采用南京建成抗坏血酸过氧化物酶试剂盒(A123-1-1,分光光度法),MDA含量测定采用南京建成丙二醛测试盒(A003-1,TBA法),CAT酶活测定采用南京建成过氧化氢酶测试盒(A007-1-1,可见光法)[22]。
1.3.4 聚类分析层次聚类是自动按照聚类数从1到对象总数进行聚类,根据对象之间的距离将对象分到不同分支上。本研究中的聚类分析参考Maimon等[23]的方法进行了系统聚类,用SPSS Statistics 20软件采用Ward法,欧氏距离(Squared Euclidean distance)进行分析作图。
1.3.5 数据处理与分析用Excel进行原始数据处理,利用IBM SPSS Statistics 20软件进行显著性分析(P < 0.05),用GraphPad Prism 8.0作图。
2 结果与分析2.1 不同番茄基因型农艺性状在2.94 mg/kg Cd处理下,25个番茄基因型之间株高、生物量以及产量见表 3,部分品种间存在显著性差异。其中,A-7、A-8、A-19番茄品种株高相对较高,A-7单株番茄总生物量最高,A-8单株番茄产量最高;A-20、A-21、A-22三个品种的番茄株高较低,总生物量较低,并且单株番茄平均结果量也是最低的。
表 3 番茄农艺性状的品种间差异比较Table 3 Comparison of agronomic traits among tomato varieties
| Number | Per plant height (cm) | Yield per plant FW (g) | Total biomass per plant FW (g) |
| A-1 | 46.98±1.23hijklm | 275.00±68.74efgh | 393.75±13.15ij |
| A-2 | 41.25±5.87klm | 247.50±95.46fgh | 340.00±17.68jk |
| A-3 | 44.60±7.84ijklm | 275.00±100.37efgh | 395.00±21.79ij |
| A-4 | 40.05±9.87klm | 121.67±20.21ij | 231.67±16.83l |
| A-5 | 39.25±5.64klm | 312.50±67.18defg | 455.83±27.54gh |
| A-6 | 54.60±25.57ghijkl | 410.00±63.64abcd | 560.00±8.66de |
| A-7 | 111.63±13.80abc | 456.67±72.51a | 796.67±73.99a |
| A-8 | 105.20±3.76bcd | 520.00±32.79a | 728.75±19.74b |
| A-9 | 43.63±4.79jklm | 190.00±51.48hij | 313.75±10.31k |
| A-10 | 61.43±24.52fghijk | 210.00±31.22ghi | 330.00±31.62k |
| A-11 | 68.80±7.35efghi | 373.33±58.59bcde | 563.33±39.37de |
| A-12 | 67.43±5.02fghij | 350.00±52.12bcdef | 522.50±29.58def |
| A-13 | 119.13±2.78ab | 377.50±31.82bcde | 657.50±28.28c |
| A-14 | 117.50±3.70abc | 440.00±46.37abc | 672.50±18.48bc |
| A-15 | 114.00±12.54abc | 378.33±50.33bcde | 575.00±25.66d |
| A-16 | 110.20±19.93abcd | 327.50±24.75cdef | 525.83±60.07def |
| A-17 | 113.13±5.57abc | 291.67±7.64efgh | 522.92±32.50def |
| A-18 | 70.13±34.79efgh | 373.33±28.43bcde | 510.00±12.58efg |
| A-19 | 133.88±10.43a | 283.75±46.79efgh | 470.42±23.63fgh |
| A-20 | 25.75±2.78m | 81.25±30.92j | 122.50±6.29n |
| A-21 | 36.50±2.35klm | 105.75±82.56ij | 185.75±8.16lm |
| A-22 | 29.75±5.55lm | 110.00±25.50ij | 168.75±11.09mn |
| A-23 | 75.33±18.79efg | 303.33±57.95defgh | 426.67±7.64hi |
| A-24 | 92.88±9.31cd | 301.67±57.74defgh | 538.33±43.68de |
| A-25 | 86.33±16.65def | 257.50±45.96fgh | 395.00±3.54ij |
| Note: different characters indicate significant differences at P < 0.05 level. | |||
表选项
2.2 番茄果实中Cd含量如图 1所示,土培(Cd=2.94 mg/kg)条件下,25个番茄品种果实Cd含量为1.47–3.06 mg/kg DW,平均为2.21mg/kg,变异系数为23.27%,品种间差异较大。
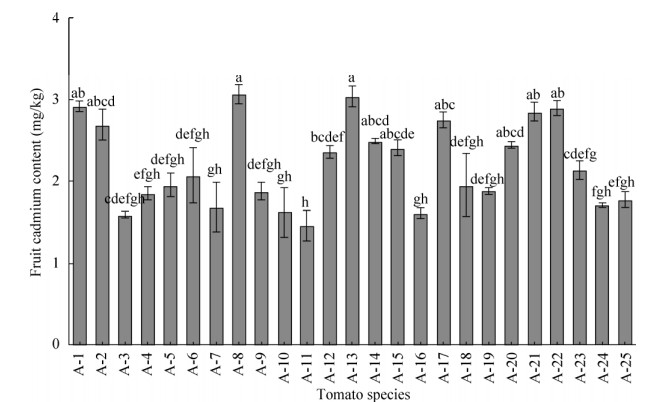 |
| 图 1 25个番茄品种果实Cd含量 Fig. 1 Cd concentrations in the fruits of 25 tomato varieties. Different characters indicate significant differences at P < 0.05 level. |
| 图选项 |
对25个番茄品种果实Cd含量进行聚类分析(图 2),筛选出果实Cd含量高积累、中积累、低积累类群分别有7、4和14个品种,其平均Cd含量依次为2.89 mg/kg,2.43 mg/kg、1.80 mg/kg。对应的分别为果实Cd高积累品种:A-1、A-2、A-8、A-13、A-17、A-21、A-22;果实Cd中积累品种:A-12、A-14、A-15、A-20;果实Cd低积累品种:A-3、A-4、A-5、A-6、A-7、A-9、A-10、A-11、A-16、A-18、A-19、A-23、A-24、A-25。
 |
| 图 2 25个番茄基因型品种果实Cd含量聚类分析 Fig. 2 Cluster analysis of Cd concentrations in the fruits of 25 tomato genotypes. Cluster analysis used system clustering, Ward method, squared Euclidean distance. |
| 图选项 |
同时也测定和计算了番茄果实含水量、鲜重Cd含量以及对Cd的富集系数,结果如表 4所示。
表 4 番茄果实含水量、鲜重Cd含量以及对Cd的富集系数Table 4 Water contents, fresh weight Cd concentrations, and bioconcentration factors (BCFCd) of tomato fruits
| Number | Fruit water content (%) | Cd concentrations FW (mg/kg) | BCFCd | Number | Fruit water content (%) | Cd concentrations FW (mg/kg) | BCFCd |
| A-1 | 87.18 | 0.37±0.01a | 0.99 | A-14 | 89.33 | 0.27±0.01cd | 0.85 |
| A-2 | 92.29 | 0.21±0.02efg | 0.92 | A-15 | 91.40 | 0.21±0.01efg | 0.82 |
| A-3 | 93.07 | 0.11±0.01kl | 0.54 | A-16 | 90.15 | 0.16±0.01hij | 0.55 |
| A-4 | 91.78 | 0.15±0.01hijk | 0.63 | A-17 | 90.87 | 0.25±0.02de | 0.94 |
| A-5 | 92.80 | 0.14±0.02ijk | 0.67 | A-18 | 94.01 | 0.12±0.04jkl | 0.67 |
| A-6 | 92.70 | 0.15±0.04hijk | 0.71 | A-19 | 90.00 | 0.19±0.01fgh | 0.64 |
| A-7 | 90.45 | 0.16±0.05hij | 0.57 | A-20 | 90.57 | 0.23±0.01def | 0.83 |
| A-8 | 94.54 | 0.17±0.01ghi | 1.04 | A-21 | 88.69 | 0.32±0.02b | 0.97 |
| A-9 | 92.09 | 0.15±0.02hijk | 0.64 | A-22 | 89.10 | 0.32±0.02b | 0.99 |
| A-10 | 95.01 | 0.08±0.03l | 0.55 | A-23 | 91.90 | 0.17±0.02ghi | 0.73 |
| A-11 | 91.84 | 0.12±0.03jkl | 0.50 | A-24 | 90.27 | 0.17±0.00ghi | 0.58 |
| A-12 | 90.64 | 0.22±0.01ef | 0.80 | A-25 | 91.45 | 0.15±0.01hijk | 0.61 |
| A-13 | 90.00 | 0.30±0.01bc | 1.03 | ||||
| Note: different characters indicate significant differences at P < 0.05 level. | |||||||
表选项
2.3 高低积累番茄品种MDA和H2O2含量分析根据筛选结果,选取Cd高积累品种A-8 (钱塘旭日F1),以及Cd低积累品种A-16 (浙粉3053)叶片进行进一步的生理指标测定。植物在Cd胁迫下,会产生活性氧(Reactive oxygen species,ROS)[24-25],而由于对于外界环境的胁迫植物本体有一定的抵制机制,ROS的升高会促使植物体内的氧化应激反应[26-27],其中H2O2为ROS重要组成部分。如图 3A所示,在Cd处理1 d后,A-8叶片中的H2O2含量迅速上升76.5%,之后缓慢下降;与之相反,A-16中的H2O2含量在Cd胁迫1 d后显示出明显的下降趋势,之后的1–5 d内又逐渐积累。除了Cd胁迫1 d以外,其余时间点上的H2O2含量上A-8均低于A-16。
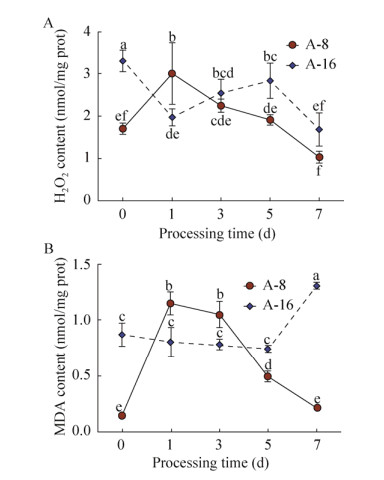 |
| 图 3 Cd胁迫下高低积累番茄叶片中H2O2 (A)、MDA (B)含量的变化 Fig. 3 Changes in H2O2 (A) and MDA (B) content in the leaves of Cd high and low accumulating tomato varieties. Tomato seedlings were treated with 10 μmol/L Cd from seedling age of 22 d. After treatment for 0 d, 1 d, 3 d, 5 d and 7 d, the leaves at the same position were measured. The seedling age was 29 d at the time of sampling. Different characters indicate significant differences at P < 0.05 level. |
| 图选项 |
MDA是细胞膜脂过氧化的产物,植株受胁迫的程度可通过叶片中MDA含量反映。如图 3B所示,A-8叶片在Cd胁迫后MDA含量显示出先上升后下降的趋势,这与其H2O2含量的变化趋势相似。A-16在镉胁迫下起初(0–5 d)其MDA变化不明显,但在处理5–7 d后随着Cd处理时间的延长,其MDA含量急速上升。以上结果表明Cd胁迫后,A-8产生氧化应激反应时间更短,受到的氧化胁迫程度低于A-16,对Cd的耐受性也更强。
2.4 高低积累番茄品种CAT和APX活性分析番茄为维持体内氧化平衡,体内本身就存在着清除活性氧的机制。CAT是一种主要调节氧化反应的抗氧化酶,是清除植物体内H2O2重要的酶促防御系统之一,因此植物体内CAT含量与植物抗逆性密切相关。如图 4A所示,镉胁迫下两种番茄叶片中的CAT活性均产生下降的情况,A-8下降9.1%,A-16下降70.4%。CAT活性在两类番茄中基本与H2O2含量呈负相关,符合CAT特性。3–5 d两类番茄CAT活性均出现一个明显的上升,A-8上升153.9%,A-16上升310.6%。5–7 d,A-16叶片CAT活性上升趋势减慢,上升25.6%,而A-8叶片CAT活性减弱,下降80.4%。第7天,两类番茄CAT活性均下降,A-8下降15.9%,A-16下架25.3%,说明Cd胁迫对植物的损害明显,抗氧化酶CAT含量下降明显。随着Cd积累,低积累A-16 CAT活性开始增加,说明A-16由于其Cd积累含量低,本身清楚活性氧机制启动较慢。Cd高积累品种A-8中CAT呈现出先上升后下降趋势,在第5天的时候达到最高值,发生时间上略迟于H2O2的先上升后下降趋势。Cd低积累品种A-16中CAT呈现出先下降后上升趋势,在第3天的时候达到最低值,发生时间上也略迟于H2O2的先下降后上升的趋势。
 |
| 图 4 Cd胁迫下高低积累番茄叶片中CAT (A)、APX (B)活性的变化 Fig. 4 Changes in the activity of CAT and APX enzymes in the leaves of high and low accumulating tomato varieties. Tomato seedlings were treated with 10 μmol/L Cd from seedling age of 22 d. After treatment for 0 d, 1 d, 3 d, 5 d and 7 d, the leaves at the same position were measured. The seedling age was 29 d at the time of sampling. Different characters indicate significant differences at P < 0.05 level. |
| 图选项 |
APX作为可缓解自由基对番茄形成膜脂过氧化物伤害重要抗氧化酶之一,其活性提高,可使植物体内O2-含量下降。在Cd胁迫下,两种番茄叶片中的APX活性均出现下降趋势,在0–1 d,A-8下降41.1%,A-16下降42.3%。1–5 d,A-16内APX活性开始上升,A-8至3–5 d开始上升。3–5 d两种番茄APX活性出现大幅上升,A-8上升92.9%,A-16上升146.8%。相较于Cd胁迫前,两类番茄APX活性均下降,A-8下降55.7%,A-16下降36.2%。
3 讨论随着工业、采矿等人为活动,Cd的危害正在逐年扩大,容易被植物吸收、运输到不同部位,进入食物链。据前人研究,人类摄入的镉,70%以上来自蔬菜[28]。因此,当务之急是降低蔬菜可食用部分的镉积累量,以减少潜在的健康风险[29-30]。目前修复土壤Cd污染的技术有很多,但局限性条件诸多,如长期休耕、二次污染的潜在风险、成本难以控制等,在实际种植中仍难以完全实施[31]。植物高积累物种排除或低积累污染物的筛选是后续阶段发现污染物水平的主要决定因素。在受污染的土壤中生长,可食用部分的某些污染物浓度低到足以安全消费的品种筛选,已经被引出作为一种经济有效的方式来减少作物中Cd的积累。番茄作为中国广泛种植的大棚蔬菜,灌溉、施肥措施不当极易造成二次Cd污染。本试验对我国南方地区常见、广泛种植的25类番茄在同一Cd污染条件下进行试验,研究表明番茄极易受到Cd污染。土壤Cd浓度为2.94 mg/kg的胁迫条件下,25种番茄果实Cd含量均超过CAC标准的最高限值(0.05 mg/kg),见表 4。这与朱芳等[18]研究结论相同,说明番茄是易受Cd污染的作物类型。其中果实Cd高积累品种7个,中积累品种4个,低积累品种14个。筛选出Cd高积累品种A-8钱塘旭日F1、A-13纳普拉斯,Cd含量分别为3.06 mg/kg、3.04 mg/kg;Cd低积累品种A-11航研8号番茄、A-16浙粉3053,Cd含量分别为1.47 mg/kg、1.61 mg/kg。最高积累品种与最低积累品种之间相差52.0%。但这些品种作为Cd-PSCs在重度Cd胁迫下,Cd吸收量依旧偏高,说明重度Cd污染地区不适合种植番茄。在重度Cd污染地区应该推广种植替代作物如棉花、麻类作物、能源作物等产品质量受Cd污染影响小,土壤中的Cd也不易进入食物链的作物。不过由于蔬菜作物中的Cd积累与产地土壤Cd污染的程度,以及土壤类型和土壤理化性质(如土壤pH值等)等因素密切相关,所以该研究结果也并不说明所有镉污染地区都不适合番茄的种植。此外土壤改良剂的使用、栽培措施的改进等也有助于适当降低蔬菜Cd积累。因此,有中轻度Cd污染的地区,应该结合实际情况,尽可能种植低Cd积累PSC品种,结合番茄果实Cd含量动态监控保障食品安全。在其他作物中,通过育种过程获得了一些低镉品种,例如“Wilwash”马铃薯(Solanum tuberosum L.)[32]和“Strongfield”硬质小麦(Triticum durum Desf)[33]。对于番茄,筛选出来的典型低镉和高镉的品种可用于开发PSC的分子辅助育种。
Cd对植物的有害影响可通过扰乱其生理生化指标体现,植物体内活性氧(ROS)含量及抗氧化酶活性会改变[34],这与López-Millán等[35]研究结果相同。本试验选取Cd高积累品种A-8钱塘旭日F1与Cd低积累品种A-16浙粉3053在Cd含量10 μmol/L环境下培养,进行生化指标试验。低积累品种番茄的过氧化氢含量在不加Cd的情况下就明显高于高积累品种(图 3A),可能是这两个品种的基因型存在差异所造成的。这种低积累品种产生更多过氧化氢的现象在不同Cd积累能力白菜当中也存在[36]。而由于MDA是细胞膜脂过氧化的产物,CAT是清除植物体内H2O2重要的酶,因此更高水平的过氧化氢也可能会提高不加Cd条件下低积累品种的MDA含量和CAT活性(图 3B;图 4A)。在Cd胁迫的7 d内,两类番茄作为Cd胁迫植物的结果,活性氧物(ROS)的数量增加,如羟自由基(OH?)、单线态氧(1O2)和H2O2[37-38],产生氧化应激,导致细胞器膜脂质过氧化和生物分子(如叶绿体色素和核酸)的氧化降解[26]。因此,植物进化出非酶类自由基清除剂,如类胡萝卜素和谷胱甘肽,以及酶类抗氧化剂,如谷胱甘肽S-转移酶(GST)、过氧化物酶(POD)和过氧化氢酶(CAT)[39]。分析0–7 d内H2O2、MDA含量与CAT、APX活性可发现,A-8 H2O2含量上升的速度较快,同时作为细胞膜脂过氧化的产物MDA,在Cd胁迫第1天,随着氧化应激,上升721.4%,但在1–7 d,A-8 H2O2含量、MDA含量出现相同下降趋势。A-16 H2O2含量在1–3 d才出现上升,MDA含量前5天均保持稳定,但5–7 d上升77.0%。两类番茄Cd胁迫7 d后MDA含量均上升50%,可见Cd对两类番茄膜脂过氧化程度接近,但A-8积累速度较快,产生氧化应激反应时间更短。两类番茄在0–1 d内,CAT、APX活性均下降,最终A-8 CAT活性下降15.9%,A-16下降25.3%;A-8 APX活性下降55.7%,A-16下降36.2%。A-16在5–7 dCAT活性开始上升,与此时间段MDA含量上升匹配。3–5 d两种番茄APX活性出现大幅上升,第5天后两个品种H2O2含量均出现下降趋势,APX是利用抗坏血酸为电子供体的H2O2清除剂,说明APX可有效地清除两类番茄叶片中的H2O2。两个品种当中CAT的活性变化趋势均与其H2O2的变化趋势类似,并且均略迟于H2O2的变化趋势,说明CAT在Cd诱导的H2O2的还原过程中起重要作用。相比之下,高积累品种A-8产生氧化应激反应的时间更短,受到的氧化胁迫程度低于A-16,A-8对Cd的耐受性更强。本研究结果表明,Cd胁迫下氧化胁迫程度更低、耐受性更强可能有助于番茄积累更多的Cd。
由于季节限制,番茄很大一部分通过温室里种植,通常使用特殊的基质、涉及水再利用的施肥技术。且本试验研究发现番茄在Cd胁迫下,株高、生物量的生理指标未见明显改变,表现出的耐Cd能力较强,这一特性可能导致土壤的Cd污染状况难以察觉,造成重金属污染的风险增加的情况[40]。通过分子育种手段,得到Cd-PSC番茄,是一种解决土壤污染的新方法。Cd-PSC和非Cd-PSC品种可能采用不同的Cd吸收、转运和解毒机理[41],然而,番茄品种间镉积累分子机制差异的研究仍然较少,下一步应该继续加强这方面的研究。
4 结论本研究通过盆栽试验,发现不同番茄基因型Cd含量差异较大,25种番茄果实Cd含量均超过CAC标准的最高限值。果实Cd含量最高为3.06 mg/kg DW,最低为1.47mg/kg DW,平均为2.21mg/kgDW,筛选出果实Cd含量高积累、中积累、低积累类群分别有7个、4个和14个品种。与Cd低积累品种A-16浙粉3053相比,Cd高积累品种A-8钱塘旭日F1的氧化应激反应时间更短,受氧化胁迫程度更低,耐受性更强,果实中积累更多的Cd。种植低Cd积累PSC品种,结合番茄果实Cd含量动态监控,是在中轻度Cd污染地区目前较为可行的方法。
参考文献
| [1] | DalCorso G, Manara A, Furini A. An overview of heavy metal challenge in plants: from roots to shoots. Metallomics, 2013, 5(9): 1117-1132. DOI:10.1039/c3mt00038a |
| [2] | Thakur S, Singh L, Ab Wahid Z, et al. Plant-driven removal of heavy metals from soil: uptake, translocation, tolerance mechanism, challenges, and future perspectives. Environ Monit Assess, 2016, 188(4): 206. DOI:10.1007/s10661-016-5211-9 |
| [3] | Ali Z, Malik RN, Shinwari ZK, et al. Enrichment, risk assessment, and statistical apportionment of heavy metals in tannery-affected areas. Int J Environ Sci Technol, 2015, 12(2): 537-550. DOI:10.1007/s13762-013-0428-4 |
| [4] | Satarug S, Garrett SH, Sens MA, et al. Cadmium, environmental exposure, and health outcomes. Environ Health Perspect, 2009, 118(2): 182-190. |
| [5] | Aziz R, Rafiq MT, Li TQ, et al. Uptake of cadmium by rice grown on contaminated soils and its bioavailability/toxicity in human cell lines (Caco-2/HL-7702). J Agric Food Chem, 2015, 63(13): 3599-3608. DOI:10.1021/jf505557g |
| [6] | Tamás MJ, Fauvet B, Christen P, et al. Misfolding and aggregation of nascent proteins: a novel mode of toxic cadmium action in vivo. Curr Genet, 2018, 64(1): 177-181. DOI:10.1007/s00294-017-0748-x |
| [7] | Liu Y, Chen MM, Jiang LG, et al. Erratum to: New insight into molecular interaction of heavy metal pollutant—cadmium(Ⅱ) with human serum albumin. Environ Sci Pollut Res, 2016, 23(5): 4959. DOI:10.1007/s11356-016-6066-x |
| [8] | Xiao WD, Ye XZ, Zhang Q, et al. Evaluation of cadmium transfer from soil to leafy vegetables: Influencing factors, transfer models, and indication of soil threshold contents. Ecotoxicol Environ Safe, 2018, 164: 355-362. DOI:10.1016/j.ecoenv.2018.08.041 |
| [9] | Chen NC, Zheng YJ, He XF, et al. Analysis of the report on the national general survey of soil contamination. J Agro-Environ Sci, 2017, 36(9): 1689-1692 (in Chinese). 陈能场, 郑煜基, 何晓峰, 等. 《全国土壤污染状况调查公报》探析. 农业环境科学学报, 2017, 36(9): 1689-1692. |
| [10] | Yang QQ, Li ZY, Lu XN, et al. A review of soil heavy metal pollution from industrial and agricultural regions in China: Pollution and risk assessment. Sci Total Environ, 2018, 642: 690-700. DOI:10.1016/j.scitotenv.2018.06.068 |
| [11] | Da Silva Dias JC. Plant breeding for harmony between modern agriculture production and the environment. Agricult Sci, 2015, 6(1): 87-116. |
| [12] | Guo JJ, Tan X, Fu HL, et al. Selection for Cd pollution-safe cultivars of Chinese kale (Brassica alboglabra L. H. Bailey) and biochemical mechanisms of the cultivar-dependent Cd accumulation involving in Cd subcellular distribution. J Agric Food Chem, 2016, 66(8): 1923-1934. |
| [13] | Yu H, Wang JL, Fang W, et al. Cadmium accumulation in different rice cultivars and screening for pollution-safe cultivars of rice. Sci Total Environ, 2006, 370(2/3): 302-309. |
| [14] | Qiu Q, Wang YT, Yang ZY, et al. Effects of phosphorus supplied in soil on subcellular distribution and chemical forms of cadmium in two Chinese flowering cabbage (Brassica parachinensis L.) cultivars differing in cadmium accumulation. Food Chem Toxicol, 2011, 49(9): 2260-2267. DOI:10.1016/j.fct.2011.06.024 |
| [15] | Zhang K, Wang JB, Yang ZY, et al. Genotype variations in accumulation of cadmium and lead in celery (Apium graveolens L.) and screening for low Cd and Pb accumulative cultivars. Front Environ Sci Eng, 2013, 7(1): 85-96. DOI:10.1007/s11783-012-0399-3 |
| [16] | Zhang K, Yuan JG, Kong W, et al. Genotype variations in cadmium and lead accumulations of leafy lettuce (Lactuca sativa L.) and screening for pollution-safe cultivars for food safety. Environ Sci Process Impacts, 2013, 15(6): 1245-1255. DOI:10.1039/c3em00158j |
| [17] | Xue M, Zhou YH, Yang ZY, et al. Comparisons in subcellular and biochemical behaviors of cadmium between low-Cd and high-Cd accumulation cultivars of pakchoi (Brassica chinensis L.). Front Environ Sci Eng, 2014, 8(2): 226-238. DOI:10.1007/s11783-013-0582-4 |
| [18] | Zhu F, Fang W, Yang ZY. Variations of Cd absorption and accumulation of 36 Lycopersicon esculentum cultivars. Acta Ecol Sin, 2006, 26(12): 4071-4081 (in Chinese). 朱芳, 方炜, 杨中艺. 番茄吸收和积累Cd能力的品种间差异. 生态学报, 2006, 26(12): 4071-4081. DOI:10.3321/j.issn:1000-0933.2006.12.021 |
| [19] | Gao XT, Li S, Jia J, et al. Study on resistance of different tomato varieties to cadmium stress. Acta Agric Boreali-Sin, 2018, 33(2): 169-176 (in Chinese). 高夕彤, 李硕, 贾娟, 等. 不同番茄品种对镉胁迫的耐抗性差异研究. 华北农学报, 2018, 33(2): 169-176. |
| [20] | GB 5009.15–2014. National food safety standard– Determination of cadmium in foods (in Chinese). GB 5009.15–2014, 食品安全国家标准食品中镉的测定. |
| [21] | Yan Z, Peng Q. Absorptive capacity of potato varieties to four heavy metals in soil. Chin Agric Sci Bull, 2020, 36(2): 10-17 (in Chinese). 鄢铮, 彭琼. 马铃薯对土壤中4种重金属富集能力的差异. 中国农学通报, 2020, 36(2): 10-17. |
| [22] | Zhang YT. Study on the molecular and physiological mechanisms of salicylic acid regulating Cd accumulation in rice grain[D]. Hangzhou: China Jiliang University, 2018: 32-36 (in Chinese). 张怡婷.水杨酸调控稻米镉积累的分子生理机制研究[D].杭州: 中国计量大学, 2018: 32-36. |
| [23] | Maimon O, Rokach L, Eds. Data mining and knowledge discovery handbook[M]. Springer US, 2010: 655-664. |
| [24] | Ali E, Maodzeka A, Hussain N, et al. The alleviation of cadmium toxicity in oilseed rape (Brassica napus) by the application of salicylic acid. Plant Growth Regul, 2014, 75(3): 641-655. |
| [25] | Canakci S, Dursun B. Amelioration of Cd toxicity by pretreatment of salicylic acid in Cicer arietinum L. seedlings. J Environ Biol, 2013, 34(6): 1089-1094. |
| [26] | Gill SS, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiol Biochem, 2010, 48(12): 909-930. DOI:10.1016/j.plaphy.2010.08.016 |
| [27] | Nagajyoti PC, Lee KD, Sreekanth TVM. Heavy metals, occurrence and toxicity for plants: a review. Environ Chem Lett, 2010, 8(3): 199-216. DOI:10.1007/s10311-010-0297-8 |
| [28] | Sarwar N, Saifullah, Malhi SS, et al. Role of mineral nutrition in minimizing cadmium accumulation by plants. J Sci Food Agric, 2010, 90(6): 925-937. DOI:10.1002/jsfa.3916 |
| [29] | Qiu Q, Wang YT, Yang ZY, et al. Responses of different Chinese flowering cabbage (Brassica parachinensis L.) Cultivars to cadmium and lead exposure: screening for Cd + Pb pollution-safe cultivars. Clean, 2011, 39(11): 925-932. |
| [30] | Li L, Li JR, He QL, et al. Nutrients, ultrastructures, and Cd subcellular localization in the cottonseeds of three upland cotton cultivars under Cd stress. J Soil Sci Plant Nutr, 2014, 14(2): 278-291. |
| [31] | Bolan N, Kunhikrishnan A, Thangarajan R, et al. Remediation of heavy metal(loid)s contaminated soils-To mobilize or to immobilize?. J Hazardous Mater, 2014, 266: 141-166. |
| [32] | Wang JB, Su LY, Yang JZ, et al. Comparisons of cadmium subcellular distribution and chemical forms between low-Cd and high-Cd accumulation genotypes of watercress (Nasturtium officinale L. R. Br.). Plant Soil, 2016, 396(1/2): 325-337. |
| [33] | Grant CA, Clarke JM, Duguid S, et al. Selection and breeding of plant cultivars to minimize cadmium accumulation. Sci Total Environ, 2008, 390(2/3): 301-310. |
| [34] | Anjum NA, Singh HP, Khan MIR, et al. Too much is bad—an appraisal of phytotoxicity of elevated plant-beneficial heavy metal ions. Environ Sci Pollut Res, 2015, 22(5): 3361-3382. |
| [35] | López-Millán AF, Sagardoy R, Solanas M, et al. Cadmium toxicity in tomato (Lycopersicon esculentum) plants grown in hydroponics. Environ Exp Bot, 2009, 65(2/3): 376-385. |
| [36] | Chen C, Zhu YC, La LP, et al. Screening and tolerance comparison of high and low cadmium accumulating cabbage cultivars in a typical black soil. J Agro-Environ Sci, 2020, 39(3): 462-472 (in Chinese). 陈辰, 朱园辰, 喇乐鹏, 等. 典型黑土环境下的高、低镉积累白菜品种筛选及耐性比较. 农业环境科学学报, 2020, 39(3): 462-472. |
| [37] | Jia L, Liu ZL, Chen W, et al. Hormesis effects induced by cadmium on growth and photosynthetic performance in a hyperaccumulator, Lonicera japonica thunb. J Plant Growth Regul, 2015, 34(1): 13-21. DOI:10.1007/s00344-014-9433-1 |
| [38] | Andresen E, Küpper H. Cadmium toxicity in plants//Sigel A, Sigel H, Sigel R, Eds. Cadmium: From Toxicity to Essentiality. Dordrecht: Springer, 2013: 395-413. |
| [39] | Gallego SM, Pena LB, Barcia RA, et al. Unravelling cadmium toxicity and tolerance in plants: Insight into regulatory mechanisms. Environ Exp Bot, 2012, 83: 33-46. |
| [40] | Gill SS, Khan NA, Tuteja N. Cadmium at high dose perturbs growth, photosynthesis and nitrogen metabolism while at low dose it up regulates sulfur assimilation and antioxidant machinery in garden cress (Lepidium sativum L.). Plant Sci, 2012, 182: 112-120. |
| [41] | Xin JL, Huang BF, Yang ZY, et al. Responses of different water spinach cultivars and their hybrid to Cd, Pb and Cd-Pb exposures. J Hazardous Mater, 2010, 175(1/3): 468-476. |
