

西南大学 资源环境学院 土壤多尺度界面过程与调控重庆市重点实验室,重庆 400716
收稿日期:2019-12-24;接收日期:2020-04-17
基金项目:国家重点研发计划(No. 2017YFC0404705)资助
摘要:亚硝酸盐是氮循环过程的中间产物,其积累超过一定量则会抑制微生物的生长与代谢,也会给人与水生生物带来健康风险。而在高氮污水生物脱氮工艺中,持续维持亚硝酸盐的积累能实现短程硝化过程,降低生物脱氮的能耗进而降低运营成本。本文综述了在水环境中亚硝酸盐积累的生物过程与积累原因,并对影响亚硝酸盐积累的因素进行了总结,旨在为提高污水处理过程中氮的去除效率,降低运营成本,减少排放污水及自然水体中亚硝态氮含量提供参考。
关键词:亚硝酸盐酶氨氧化细菌亚硝酸盐氧化细菌短程硝化短程反硝化
Bioprocess of nitrite accumulation in water – a review
Ming Nie, Zhenlun Li


Chongqing Key Laboratory of Soil Multi-Scale Interfacial Process, College of Resources and Environment, Southwest University, Chongqing 400716, China
Received: December 24, 2019; Accepted: April 17, 2020
Supported by: National Key Research and Development Program of China (No. 2017YFC0404705)
Corresponding author: Zhenlun Li. Tel/Fax: +86-23-68251249; E-mail: lizhlun4740@sina.com.
Abstract: Nitrite is a by-product of the nitrogen cycle. The excessive nitrite not only constrains growth and metabolism of bacteria, but also impairs health of humans and aquatic organisms. On the other hand, the continuous maintaining of nitrite accumulation could achieve the shortcut nitrification process, and reduce energy consumption of biological nitrogen removal to save cost. This article reviews the biological processes and causes of nitrite accumulation in the water environment, and summarizes the factors that affect the accumulation of nitrite, to provide reference for wastewater treatments, including improving the nitrogen removal efficiency, reducing operating costs, decreasing discharge of sewage and nitrite nitrogen in natural water.
Keywords: nitriteenzymeammonia-oxidizing bacterianitrite-oxidizing bacteriapartial nitrificationpartial denitrification
近年来,鉴于亚硝酸盐的摄入会导致人体健康风险和其对水生生物的负面效应[1],诸多****对水体中亚硝酸盐的积累进行了研究。在自然水体中,亚硝酸盐持续存在的原因包括外部和内部两方面,外部主要来源于点源污染,内部主要因为水体和沉积物中与亚硝酸盐相关的氮循环路径的关联中断或氧化还原速率不一致。大量研究表明,水环境中的水温高低、有机物含量、溶解氧含量及光照等多种环境因素都将对亚硝酸盐的内部产生有显著影响。在污水处理方面,对于亚硝酸盐积累的研究主要集中在短程硝化工艺,由于其在脱氮过程中有降低成本提高效率的优点,成为高氮低碳型生活污水生物脱氮的主流工艺。在此工艺中,可通过pH、溶解氧、温度以及化合物抑制等多种因素的调控来维持亚硝酸盐的积累。
本文总结了在微生物作用下水体中亚硝酸盐产生及消耗的过程和原因,以及引起亚硝酸盐积累的影响因素,以期为污水脱氮处理和降低自然水体氮污染提供参考。
1 自然水体亚硝酸盐积累的主要途径近些年,****们观察到河流和溪流中亚硝酸盐的积累。尤其是在城市河流中亚硝酸盐浓度相对较高,例如:德国拉恩河1994年的NO2–-N浓度通常在0.15–0.25 mg/L,而夏季,浓度可达到0.4 mg/L[2];在北爱尔兰的一些河流NO2–-N浓度范围在0.001–1.020 mg/L[3];法国塞纳河2013年的NO2–-N浓度通常在3.5–15.0 μmol/L[4-5]。
河流中的高NO2–浓度与外部和内部来源有关。外部来源包括支流和流域盆地,特别是那些以农业活动为主的区域[6]和污水处理厂(Waste water treatment plant,WWTP)的污水[7]。Smith等[8]报道认为北爱尔兰河流中仅有40%的NO2–-N直接来自与农业生产有关的陆地排水,其余来源于点源污染的含氮沉积物与上覆水的界面转化。塞纳河从广泛的农业和城市形成的面源以及一些点源,点源主要是污水处理厂排放中输入的大量氮[4-5],每日负荷约为(2.4±2.0) t NO2–-N,尽管河道是有氧条件,巴黎下游超过300多公里仍然存在很高的亚硝酸盐浓度[9]。
河流中亚硝酸盐积累的内部来源是由于水体、沉积物以及沉积物-水界面发生的氮转化。在有氧环境中,亚硝酸盐由铵(NH4+)氧化产生,进而氧化成硝酸盐(NO3–)。在缺氧环境中,硝酸盐厌氧反硝化形成亚硝酸盐,进而形成N2。环境中(例如在河水或沉积物中)亚硝酸盐的持久性取决于生产和消耗速率的平衡。亚硝酸盐的氧化速率低于氨氧化速率、氨氧化和亚硝酸盐氧化菌或氨氧化菌和反硝化菌的空间分布不同位置、亚硝酸盐氧化步骤的抑制、不完整的反硝化途径、反硝化过程的不同酶的活性差异,或从氨饥饿中恢复[10-11]等,这些都是导致亚硝酸盐在环境中持续存在的原因。Akbarzadeh等[12]建模分析了塞纳河边污水处理厂上下游亚硝态氮积累和消耗情况,结果表明,亚硝酸盐主要来源于河流沉积物孔隙中的硝化作用,进一步硝化是污水处理厂上游沉积物中亚硝酸盐消耗的主要途径,而厌氧氨氧化是下游去除亚硝酸盐的主要途径。敏感性分析表明,河底亚硝酸盐进入水体的通量大小和转化方向主要依赖底部水体氧化状况和易分解有机物的量。
2 亚硝酸盐转化路径亚硝酸盐是氮循环氧化还原途径中的中间产物[13]。它分别在铵(NH4+)硝化和硝酸盐(NO3–)还原路径中产生。在好氧条件下,亚硝酸盐氧化反应作为整个硝化过程的一部分,消耗NO2–产生NO3–。在厌氧条件下,亚硝酸盐在反硝化或厌氧氨氧化过程中转化为N2,或通过异化和同化硝酸盐还原成铵的途径将亚硝酸盐转化为铵。除了生物转化,Udert等[14]在无菌反应器中的试验证实了亚硝酸盐可经化学氧化成硝酸盐。
2.1 氨氧化和硝酸盐还原路径产生亚硝酸盐硝化作用是通过微生物将氨氧化成亚硝酸盐(亚硝化),然后氧化成硝酸盐(硝化)的过程。该过程由两个系统发育不相关的氨氧化细菌(Ammonia-oxidizing bacteria,AOB)和亚硝酸盐氧化细菌(Nitrite-oxidizing bacteria,NOB)完成。在有氧条件下,硝化的第一步通过膜结合的氨单加氧酶(Ammonia monooxygenase,AMO)催化将氨氧化为羟胺(NH4+→NH2OH),再由羟胺氧化还原酶(Hydroxylamine oxidase,HAO)将羟胺氧化为亚硝酸盐(NH2OH→NO2–),此过程由氨氧化或亚硝化细菌完成。但最新研究表明,HAO只能将羟胺氧化为一氧化氮,而非亚硝酸盐。需经由一种未知的酶参与才能将一氧化氮转化为亚硝酸盐[15]。目前,这一结论有待进一步的探讨和研究。Wehrfritz等[16]纯化出了HAO,发现HAO受EDTA抑制,而Fe2+或Fe3+存在时,可以解除EDTA的抑制。魏旖旎等[17]研究了3种不同碳氮比下,硝化与反硝化过程中羟胺氧化还原酶活性变化与N2O的关联性发现,所有情况下缺氧阶段HAO活性均高于好氧阶段。
反硝化作用是指在缺氧环境下,反硝化细菌将NO3–还原为NO2–、NO和N2O,最终产物为氮气(N2)的生物化学过程。反硝化作用第一步产生的亚硝酸盐,是由于硝酸盐被微生物利用,通过呼吸过程将其转化形成,这一反应被称为异化硝酸盐还原,由膜结合硝酸还原酶(Membrane-bound nitrate reductase,NAR)或周质硝酸还原酶(Periplasmic nitrate reductase,NAP)完成(NO3–→NO2–)。很多微生物包含这两种酶,如副球菌属的反硝化细菌。厌氧环境下,NAR表达占主导地位,而NAP在好氧环境下表达占主导,NAR仅在厌氧条件下发挥作用,NAP在好氧和厌氧条件下都能发挥作用[18]。与NAR相比,NAP更易与底物硝酸盐结合,且叠氮化物对其抑制不敏感[19]。Richardson和Ferguson[20]研究发现,NAP活性很大程度取决于碳源。高浓度氧对反硝化酶有抑制作用,可阻止硝酸盐转移至硝酸盐还原酶的作用位点[21]。存在于细菌和古菌的同化硝酸盐还原酶(Assimilatory nitrate reductase,NAS)和亚硝酸盐氧化还原酶(Nitrite oxidoreductase,NXR)都可同化硝酸盐产生亚硝酸盐(NO3–→NO2–)。细菌中包含的细胞质NAS可将硝酸盐作为氮源。通常情况下,这种NAS由硝酸盐诱导并受铵抑制,但不受氧影响[22]。
2.2 亚硝酸盐氧化为硝酸盐和还原为铵或一氧化氮路径在硝化过程中,亚硝酸盐氧化还原酶(NXR)可将亚硝酸盐氧化为硝酸盐(NO2–→NO3–)。NXR由亚硝酸盐氧化细菌、无氧光养生物和厌氧氨氧化细菌编码[23-26]。由于NXR与膜偶联,一旦分离便失去酶活,故对其反应活性的研究仍以亚硝酸盐氧化菌降解亚硝酸盐能力来表达。Anthonisen等[27]指出游离氨(Free ammonia,FA)和游离亚硝酸(Free nitrite ammonia,FNA)对硝化反应有抑制作用,且作用受pH和温度等因素的影响。
在反硝化过程中,由nirS编码的含血红素cd1亚硝酸还原酶(Haem-containing cd1 nitrite reductase,cd1-NIR)或由nirK编码的含Cu亚硝酸还原酶(Cu-containing nitrite reductase,Cu-NIR)将亚硝酸盐还原为一氧化氮(NO2–→NO)。许多细菌和古菌的周质细胞内都包含这两种酶[28]。变形菌、厌氧氨氧化细菌和拟杆菌等微生物都具有将亚硝酸盐还原为一氧化氮的能力[29]。除此之外,另一些厌氧氨氧化细菌也具备其还原性,但它们并不包含nirS和nirK两种基因[30],而是利用类似于HAO的八面体血红素氧化还原酶来完成这一过程[31]。在亚硝酸盐还原酶抑制方面,Baumann等[32]认为FNA对反硝化活性的抑制可能是由于亚硝酸还原酶mRNA的翻译受到抑制,或者是该酶移位和折叠不当。另外,与pH 7.5相比,较低pH 6.8的亚硝酸还原酶浓度要低10–15倍。因此,他们提出抑制作用可能是由于已经合成的酶失活和/或高浓度的FNA引起的构象变化。Beaumont等[33]指出,FNA的浓度是控制亚硝酸还原酶表达的主要环境变量。Gayle等[34]发现亚硝酸还原酶被氧强烈抑制,在溶解氧存在条件下,硝酸还原酶和亚硝酸还原酶均被抑制,但后者对氧更为敏感,因此导致亚硝酸盐的积累。
在硝酸盐异化还原为铵(Dissimilatory nitrate reduction to ammonium,DNRA)过程中,亚硝酸盐异化还原为铵由nrfAH编码的周质细胞色素c亚硝酸还原酶(Periplasmic cytochrome c nitrite reductase,ccNIR)、八面体血红素亚硝酸盐还原酶(Octahaem nitrite reductase,ONR)[35]或八面体血红素连四硫酸盐还原酶(Octahaem tetrathionate reductase,OTR)[36]催化(NO2–→NH4+)。这一反应通常由嗜热的热球菌属细菌来完成[37]。
亚硝酸盐可被厌氧氨氧化细菌Kuenenia stuttgartiensis还原为铵,但完成这一反应的亚硝酸盐还原酶未知,推测是由一种类似于HAO的蛋白酶来实现[31]。最近研究表明,εHAO是一种被ε-变形菌门编码的羟胺还原酶,也可将亚硝酸盐或羟胺还原为铵(NO2–→NH4+),但效率较低[38]。图 1展示了亚硝酸盐的产生与消耗路径及相关催化酶。
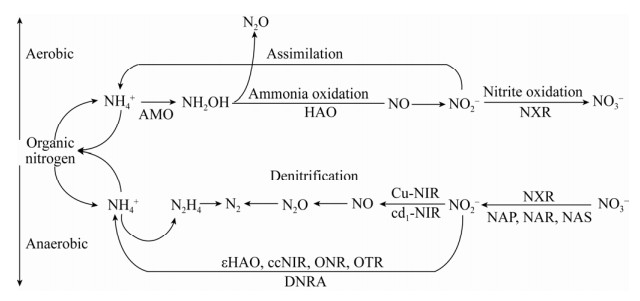 |
| 图 1 亚硝酸盐生产与消耗的路径及相关酶 Fig. 1 Production consumption path and related enzymes of nitrite. |
| 图选项 |
3 亚硝酸盐产生和消耗的影响因素自然水体中,亚硝酸盐生产和消耗之间的平衡由环境变量调控[39-40]。例如,pH、有机物、NH3浓度、温度、微生物生物量、活性和多样性等。在污水处理方面,积累亚硝酸盐是短程硝化(Partial nitrification,PN)或短程反硝化(Partial denitrification,PD)的主要目的,实现短程硝化的主要手段是调控各种因素影响氨氧化菌(AOB)和亚硝酸盐氧化菌(NOB)的生长;实现短程反硝化的主要途径是提升硝酸盐还原酶活性,抑制亚硝酸盐还原酶活性,使硝酸盐还原速率高于亚硝酸盐。积累亚硝酸盐的最终目地是为厌氧氨氧化(ANAMMOX)提供基质。
3.1 调节pH及控制游离氨(FA或NH3)浓度抑制NOB引起亚硝酸盐积累在硝化过程中,调节pH的目的主要有两个:1)适宜的pH有助于为微生物创造良好的生长环境,AOB生长的最佳pH为7.0–8.5,NOB生长的最佳pH为6.0–7.5[41]。2)通过调节pH控制FA的浓度,以此抑制NOB,实现亚硝酸盐的积累。Wu等[42]通过调节进水pH,实现了生物曝气过滤器中亚硝酸盐的积累。最合适的进水pH为6.5–7.0。李刚等[43]在研究利用亚硝化颗粒维持短程硝化的脱氮工艺中发现,随进水pH从8.0降至7.0,游离氨浓度从48.5 mg/L降至5.1 mg/L,亚硝酸盐浓度不断提高,出水NO2–-N/NH4+-N比值从0.5上升至0.95。综上所述,在硝化过程中,pH调节至6.5–7.0既适合微生物生长,又能调控好游离氨对NOB的抑制,更能有效地提升亚硝酸盐的积累。
FA和NH4+是氨氮在污水中存在的两种主要形式,各自比例受pH调控,FA是AOB生长所需物质,而FA过高会对AOB和NOB菌群的生长不利。在过去的研究中,FA对AOB和NOB都会产生抑制作用,但对后者的抑制更强。Qian等[44]研究了厌氧条件下FA对AOB和NOB的抑制作用,发现随着FA浓度从0增加到16.82 mg/L,AOB活性降低了15.9%,而NOB活性降低了29.2%,实现亚硝酸盐的积累。Wang等[45]在研究亚硝酸盐途径的生物除氮过程(NH4+→NO2–→N2)中发现,浓度为210 mg/L的FA对AOB的抑菌作用远低于NOB。在序批式反应器(Sequencing batch reactor,SBR)的活性污泥中,用210 mg/L的FA处理22%的活性污泥1 d后再循环回SBR,40 d内亚硝酸盐积累率高达90%,并在SBR中保持稳定。季民等[46]研究发现,当FA浓度为6.6 mg/L时,产生NOB的抑制现象;随着FA浓度提升至11.8 mg/L,出水的亚硝酸盐含量从1.2 mg/L提升至38.4 mg/L,亚硝酸盐的积累量增加了95.6%,NOB菌群受到严重抑制。因此,调节FA浓度造成对AOB和NOB的抑制差异是实现亚硝酸盐积累的有效手段。
在反硝化过程中,高pH对亚硝酸盐还原菌有毒害作用,亚硝酸盐还原酶受抑制,此时,硝酸盐还原菌对电子供体表现出更强的竞争力。Qian等[47]为实现稳定的短程反硝化,在pH分别为5.0、7.0和9.0的反应器中研究了420 d内pH对反硝化的影响。结果表明,亚硝酸盐累积速率随pH的增加而增加,分别为21%、38%和57%。宏基因组学分析表明,pH为9.0时,较高的亚硝酸盐累积速率与陶厄氏菌属Thauera的富集相关,Thauera的硝酸盐还原酶多于亚硝酸盐还原酶。Shi等[48]研究了以生活污水为碳源实现短程反硝化,控制进水pH约为9.0,在缺氧条件下1 h后短程反硝化启动,亚硝酸盐的积累高达25.2 mg/L。综上所述,pH在9.0左右时,有利于提高亚硝酸盐积累,实现短程反硝化。
3.2 不同浓度的游离亚硝酸(FNA或HNO2)对AOB和NOB选择性抑制游离亚硝酸(FNA)具有广泛的抗菌作用。生活污水中的游离亚硝酸与亚硝酸盐、pH和温度有关[27]。在亚硝酸盐积累条件下,改变FNA浓度最有效的方法是调节pH,将pH从7.0提高到8.0,可将FNA浓度降低90%。此外,降低温度会增加FNA浓度,FNA浓度在10 ℃时比20 ℃时约高20%–25%,冬季有益于FNA的积累[49]。在氮浓度较高、pH和温度相对较低的环境下FNA易积累。在污水处理过程中,利用FNA对NOB的选择性抑制可绕过硝酸盐的产生过程,提高污水处理系统的效率。Ma等[50]研究发现,0.25 mg/L的FNA处理6 h,AOB活性未受影响,NOB活性仅为对照组的35%。将此成果应用于厌氧/好氧工艺中,其出水亚硝酸盐积累率在第28天达到75%。Wang等[51]报道了一种利用FNA处理污泥与控制溶解氧(Dissolved oxygen,DO)相结合的策略实现亚硝化,在反应器中将NH4+完全转化为NO3–后,在侧流装置中用1.82 mg/L的FNA处理1/4的污泥24 h再接入主流反应器,实现约60%的亚硝酸盐积累,NOB的丰度显著降低(从23.0%±4.3%到5.3%±1.9%)。Jiang等[52]在研究短程硝化过程中发现,1.2 mg/L的FNA处理活性污泥18 h,可完全灭活NOB,并保持AOB活性为56.76%,是实现短程硝化的最优条件。
3.3 相对高水温利于AOB生长有助于亚硝酸盐积累合适的温度是保证微生物生长繁殖的重要条件,基于AOB和NOB对温度的不同适应性,调控温度成为了积累亚硝酸盐的有效手段。短程硝化反应器通常在30–35 ℃运行可实现AOB的生长速率高于NOB[53],利于亚硝酸盐积累。Kim等[39]研究了短程硝化过程中游离氨和温度对亚硝酸盐积累的影响,结果发现,氨和亚硝酸盐的氧化速率受到温度显著影响。在低于20 ℃条件下未检测到亚硝酸盐,温度升至20 ℃以上,亚硝酸盐浓度显著增加,并随温度上升其积累变得更加明显。Jia等[54]通过研究温度对短程硝化的影响表明,低温会弱化亚硝酸盐的积累。试验控制温度为35 ℃,氨几乎完全被除去,亚硝酸盐为主要的氮形态,其积累效率达到83.7%,AOB为主要微生物,NOB被淘汰。控制温度为15 ℃,亚硝酸盐积累降低89.8%,测定amoA和nxrA基因丰度证明了NOB的恢复。
自然水体中亚硝酸盐也同样因水温升高而积累。Schaefer等[55]报道了夏季美国佐治亚州萨佩罗岛附近河口水域的亚硝酸盐浓度超过了10 μmol/L,并指出氨和亚硝酸盐氧化在20 ℃和30 ℃之间偶联作用降低导致亚硝酸盐积累,此现象可能是由AOB和NOB对温度升高的反应差异所致。另对29个温带和亚热带河口及泻湖270个站点的现场数据分析表明,亚硝酸盐瞬时积累主要由水温驱动。
3.4 短期维持低溶解氧浓度(DO)或长期维持高DO运行以抑制NOB由于AOB和NOB在对氧竞争力和亲和性上的差异,使得DO调节成为实现短程硝化的重要可优化参数,以往研究中,低DO条件下,AOB和NOB繁殖速率都会下降,而AOB对DO的竞争力大于NOB,补偿了低DO导致的AOB活性下降,同时也抑制NOB生长,能实现短程硝化。Wang等[51]报道了一种利用FNA处理污泥与控制DO相结合的策略实现亚硝化,当主流反应器中的DO浓度从2.5–3.0降至0.3–0.8 mg/L时,亚硝酸盐积累增加至80%。卞伟等[56]在研究短程硝化过程中发现,温度为(25±1) ℃时,亚硝酸盐氮积累率会因为DO浓度升高而呈现下降趋势,当DO浓度达到1.5–2.0 mg/L时,亚硝酸盐氮积累速率几乎不再提升。然而,杨庆等[57]在常温下通过调节DO浓度在序批式反应器系统中实现稳定短程硝化的研究中认为,NOB菌群的2个主要种属(硝化螺旋菌属Nitrospira和硝化杆菌属Nitrobacter)与短程硝化的稳定性密切相关。在低氨氮和亚硝态氮浓度下,Nitrospira更可能主导亚硝酸盐氧化。当DO为0.5 mg/L时,前75个运行周期低DO抑制了Nitrobacter生长,实现了80%以上的亚硝酸盐积累率。但运行了105个周期后,Nitrospira的迅速生长主导了亚硝酸盐氧化过程,使得短程硝化变成了全程硝化。后期再次接种污泥复原系统并把DO提高至2.5 mg/L,在180个运行周期高DO的运行抑制了Nitrospira生长,实现90%以上的亚硝积累率且长期维持短程硝化。综上所述,无论是在短期内维持低DO策略还是长期运行高DO都是依据实际NOB菌群的情况对其抑制来实现亚硝酸盐的积累。
3.5 合适的C/N与碳源利于反硝化过程中的亚硝酸盐积累近年来,由于生活污水低碳的特性使得C/N作为反硝化过程的重要参数来研究,进水C/N在反硝化过程中对亚硝酸盐的积累有显著影响。在反硝化过程中,反硝化菌利用碳源作为电子供体用于硝酸盐和亚硝酸盐的还原。在一定范围内,增加C/N有助于亚硝酸盐的积累,但C/N过高反而不利。Mohan等[58]研究了C/N对间歇式反应器中高强度硝酸盐废水反硝化的影响,用乙酸钠作为碳源,C/N设置为1.5–3.0,完全脱氮时间和最大亚硝酸盐积累量随C/N比的增加而增加。牛萌等[59]以甲醇为碳源,研究了短程反硝化过程中不同碳氮比对亚硝酸盐积累特性的影响,结果表明,亚硝酸盐积累率在C/N为2.5时达到89%,在C/N为3–5阶段开始下降。袁怡等[60]研究了在短程反硝化过程中C/N对亚硝酸盐积累的影响,C/N在2.5和3.0时亚硝酸盐的积累较高,积累率分别为47.50%±1.005%和45.28%±5.469%,C/N在3.5–4.0时,亚硝酸盐积累率显著下降。
除了C/N影响之外,不同碳源也会导致NO3–-N和NO2–-N还原速率差,进而影响亚硝酸盐积累速率。不同碳源的研究丰富了外加碳源的选择,添加合适的碳源进一步推进了污水处理系统的脱氮效率。Le等[61]研究了不同碳源(乙酸、甘油、甲醇和乙醇)和C/N对长短期运行的短程反硝化的影响,结果表明,所有碳源都支持短期短程反硝化。但长期来看,乙酸产生的亚硝酸盐潜力最大。杨世东等[62]研究了醋酸钠、甘油、乙醇和葡萄糖作为外加碳源对含盐废水短程硝化反硝化的影响。以醋酸钠为碳源时,逐步增加NaCl盐度可以实现短程硝化反硝化,总氮平均去除率高于95%。当NaCl盐度为14.2 g/L时,采用醋酸钠和甘油,NO2–-N的累积率分别为98.7%和86.5%,实现短程硝化反硝化效果较好。
3.6 添加化合物抑制NOB维持短程硝化在污水处理中,研究发现某些化合物会对AOB和NOB的活性产生抑制作用,而有些化合物对NOB抑制性更强。Qing等[63]在构建快速渗透系统运用短程硝化反硝化过程,通过在恒定pH 8.4的进水中加入5 mmol/L氯酸钾(KClO3),对NOB强烈抑制,获得最大亚硝酸盐积累率达80%以上,成功地在快速渗透系统中实现并维持了短程硝化。常赜等[64]利用硫化物对NOB的抑制作用,快速启动了短程硝化,在3 h的反应过程中,硫化物浓度为50 mg/L和75 mg/L的处理获得了90%以上的亚硝酸盐积累率,极少硝酸盐生成。空白组只获得了62.5%的亚硝酸盐积累率,并生成了13.9 mg/L的硝酸盐。可见硫化物浓度是抑制NOB实现短程硝化的主要因素。
3.7 其他影响因素在自然界中,光会抑制菌群进行氨氧化。Horak等[65]在两个北太平洋断面上的最大亚硝酸盐浓度区域研究了光、过氧化氢(H2O2)和温度对以奇古菌Thaumarchaeota菌群为主的氨氧化速率的影响。结果表明,在混合层下,光抑制而非H2O2毒性对氨氧化的影响更大。最高的氨氧化率和氨单加氧酶亚基A基因或转录物在深度剖面上的丰度与在全世界海洋透光带底部发现的初级亚硝酸盐最大值的深度一致[66]。
随着对亚硝酸盐积累研究的深入,越来越多的影响因素被发现,并被应用于水处理工艺中。Cao等[67]在不同pH值混合液的反硝化过程研究中发现,硝酸盐会抑制亚硝酸盐还原速率,利于反硝化过程中亚硝酸盐的积累。Jia等[68]在短程硝化过程中施加强度为15 mT的静磁场,显著缩短了短程硝化过程的启动时间,且亚硝酸盐积累增加了18%,施加静磁场的氨氧化细菌amoA基因拷贝数较对照组高40%。Xu等[69]在研究部分亚硝化-厌氧氨氧化除氮工艺过程中指出,当pH为7.8–8.2,溶解氧高于5 mg/L和温度约25 ℃时,在好氧颗粒中添加10 mg/L羟胺可实现稳定短程硝化,亚硝酸盐积累显著,出水中NO2–-N/NOx-N (NO2–+NO3–)比率为99.8%。
4 总结与展望亚硝酸盐是氮循环中的关键环节,它的积累取决于其形成和转化速度的平衡,影响这些平衡的环境参数也很多。水系统中亚硝酸盐的出现可以被认为是硝化菌甚至是微生物群落的整体关联中断信号。在自然水体中亚硝酸盐过量积累会造成人与水生生物的健康风险,也会造成水环境污染风险。因此,研究水生态系统中的亚硝酸盐积累对生态系统平衡起着重要作用。
在污水处理方面,前人研究了如何维持亚硝态氮的积累,从而实现短程硝化和短程反硝化生物脱氮工艺。这些新的生物脱氮工艺可以节省大量的能源和运营成本,保持短程硝化的关键是维持AOB生长优势并抑制或洗出NOB。低溶解氧、高游离氨和游离亚硝酸、短污泥停留时间、高温度、实时控制和抑制剂等过程控制参数已被用于实现短程硝化[51-55]。到目前为止,已经在曝气人工湿地[70]、序批式反应器[68]和浸没式生物过滤器[71]等系统中实现了短程硝化,获得了较高的亚硝酸盐积累百分比。实现短程反硝化的主要途径是提升反硝化过程硝酸盐还原酶活性,抑制亚硝酸盐还原酶活性。高pH、碳源类型和碳氮比是实现短程反硝化的关键因素,污泥源和反应时间也是影响短程反硝化的相关因素[72]。研究亚硝酸盐积累的影响因素以实现短程硝化和短程反硝化对于污水处理领域的节能减排有着重要的研究价值。
未来可从以下方面开展进一步研究:1)针对亚硝酸盐积累与转化相关酶的研究,尤其是NO转化为亚硝态氮的酶类型与特性,更全面地了解硝化作用和其过程。2)在低温(< 15 ℃)条件下,深入研究AOB和NOB影响因子,丰富亚硝酸盐积累控制方法,实现污水处理长期低温的短程硝化。3)在污水处理中应用中,深入探究影响亚硝酸盐分解和积累的相关金属离子,从而利用不同金属离子及其浓度调控亚硝态氮的比例,为调控短程硝化提供更多的技术条件。
参考文献
| [1] | Kroupová HK, Valentová O, Svobodová Z, et al. Toxic effects of nitrite on freshwater organisms: a review. Rev Aquac, 2018, 10(3): 525-542. |
| [2] | van der Wiesche M, Wetzel A. Temporal and spatial dynamics of nitrite accumulation in the River Lahn. Water Res, 1998, 32(5): 1653-1661. |
| [3] | Kelso B, Smith RV, Laughlin RJ, et al. Dissimilatory nitrate reduction in anaerobic sediments leading to river nitrite accumulation. Appl Environ Microbiol, 1997, 63(12): 4679-4785. |
| [4] | Raimonet M, Vilmin L, Flipo N, et al. Modelling the fate of nitrite in an urbanized river using experimentally obtained nitrifier growth parameters. Water Res, 2015, 73: 373-387. |
| [5] | Raimonet M, Cazier T, Rocher V, et al. Nitrifying kinetics and the persistence of nitrite in the Seine River, France. J Environ Qual, 2017, 46(3): 585-595. |
| [6] | Corriveau J, Bochove EV, Savard MM, et al. Occurrence of high in-stream nitrite levels in a temperate region agricultural watershed. Water Air Soil Pollut, 2010, 206(1): 335-347. |
| [7] | Rocher V, Cédric J, Stéphane M, et al. La production de nitrites lors de la dénitrification des eaux usées par biofiltration - Stratégie de contr? le et de réduction des concentrations résiduelles. Revue Des Sciences De Leau, 2017, 31(1). |
| [8] | Smith RV, Foy RH, Lennox SD, et al. Occurrence of nitrite in the lough neagh river system. J Environ Qual, 1995, 24(5): 952-959. |
| [9] | Aissa-Grouz N, Garnier J, Billen G, et al. The response of river nitrification to changes in wastewater treatment (The case of the lower Seine River downstream from Paris). Ann Limnol-Int J Limnol, 2015, 51(4): 351-364. |
| [10] | Park S, Bae W. Modeling kinetics of ammonium oxidation and nitrite oxidation under simultaneous inhibition by free ammonia and free nitrous acid. Proc Biochem, 2009, 44(6): 631-640. |
| [11] | Philips S, Laanbroek HJ, Verstraete W. Origin, causes and effects of increased nitrite concentrations in aquatic environments. Rev Environ Sci Biotechnol, 2002, 1(2): 115-141. |
| [12] | Akbarzadeh Z, Laverman AM, Rezanezhad F, et al. Benthic nitrite exchanges in the Seine River (France): An early diagenetic modeling analysis. Sci Total Environ, 2018, 628/629: 580-593. |
| [13] | Mordy CW, Eisner LB, Proctor P, et al. Temporary uncoupling of the marine nitrogen cycle: Accumulation of nitrite on the Bering Sea shelf. Marine Chem, 2010, 121(1/4): 157-166. |
| [14] | Udert KM, Larsen TA, Gujer W. Chemical nitrite oxidation in acid solutions as a consequence of microbial ammonium oxidation. Environ Sci Technol, 2005, 39(11): 4066-4075. |
| [15] | Caranto JD, Lancaster KM. Nitric oxide is an obligate bacterial nitrification intermediate produced by hydroxylamine oxidoreductase. Proc Natl Acad Sci USA, 2017, 114(31): 8217-8222. |
| [16] | Wehrfritz JM, Reilly A, Spiro S, et al. Purification of hydroxylamine oxidase from Thiosphaera pantotropha: Identification of electron acceptors that couple heterotrophic nitrification to aerobic denitrification. Febs Lett, 1993, 335(2): 246-250. |
| [17] | Wei YN, He ZX, Yuan LJ. Effect of carbon to nitrogen ratios of influent on the activity of hydroxylamine oxidase of the sludge and the produce/emission of nitrous oxide. China Environ Sci, 2016, 36(5): 1417-1425 (in Chinese). 魏旖旎, 何志仙, 袁林江. 进水碳氮比对脱氮污泥羟胺氧化酶活性及N2O产生的影响. 中国环境科学, 2016, 36(5): 1417-1425. |
| [18] | Bell LC, Ferguson SJ. Nitric and nitrous oxide reductases are active under aerobic conditions in cells of Thiosphaera pantotropha. Biochem J, 1991, 273(2): 423-427. |
| [19] | Berks BC, Richardson DJ, Robinson C, et al. Purification and characterization of the periplasmic nitrate reductase from Thiosphaera pantotropha. Eur J Biochem, 1994, 220(1): 117-124. |
| [20] | Richardson DJ, Ferguson SJ. The influence of carbon substrate on the activity of the periplasmic nitrate reductase in aerobically grown Thiosphaera pantotropha. Arch Microbiol, 1992, 157(6): 535-537. |
| [21] | Wilson LP, Bouwer EJ. Biodegradation of aromatic compounds under mixed oxygen/denitrifying conditions: a review. J Ind Microbiol Biotechnol, 1997, 18(2/3): 116-130. |
| [22] | Moreno-Vivián C, Cabello P, Martínez-Luque M, et al. Prokaryotic nitrate reduction: molecular properties and functional distinction among bacterial nitrate reductases. J Bacteriol, 1999, 181(21): 6573-6584. |
| [23] | Daims H, Lücker S, Wagner M. A new perspective on microbes formerly known as nitrite-oxidizing bacteria. Trends Microbiol, 2016, 24(9): 699-712. |
| [24] | Griffin BM, Schott J, Schink B. Nitrite, an electron donor for anoxygenic photosynthesis. Science, 2007, 316(5833): 1870-1870. |
| [25] | Schott J, Griffin BM, Schink B. Anaerobic phototrophic nitrite oxidation by Thiocapsa sp. strain LQ17. Microbiology, 2010, 156(8): 2428-2437. |
| [26] | Strous M, Pelletier E, Mangenot S, et al. Deciphering the evolution and metabolism of an anammox bacterium from a community genome. Nature, 2006, 440(7085): 790-794. |
| [27] | Anthonisen AC, Loehr RC, Prakasam TB, et al. Inhibition of nitrification by ammonia and nitrous acid. J Water Pollut Control Fed, 1976, 48(5): 835-852. |
| [28] | Graf DRH, Jones CM, Hallin S. Intergenomic comparisons highlight modularity of the denitrification pathway and underpin the importance of community structure for N2O emissions. PLoS ONE, 2014, 9(12): e114118. |
| [29] | Maia LB, Moura JJG. How biology handles nitrite. Chem Rev, 114(10): 5273-5357. |
| [30] | Kartal B, Keltjens JT. Anammox biochemistry: a tale of heme c proteins. Trends Biochem Sci, 2016, 41(12): 998-1011. |
| [31] | Kartal B, de Almeida NM, Maalcke WJ, et al. How to make a living from anaerobic ammonium oxidation. FEMS Microbiol Rev, 2013, 37(3): 428-461. |
| [32] | Baumann B, Van Der Meer JR, Snozzi M, et al. Inhibition of denitri?cation activity but not of mRNA induction in Paracoccus denitri?cans by nitrite at a suboptimal pH. Anton Leeuw, 1997, 72(3): 183-189. |
| [33] | Beaumont HJE, Lens SI, Reijnders WNM, et al. Expression of nitrite reductase in Nitrosomonas europaea involves NsrR, a novel nitrite-sensitive transcription repressor. Mol Microbiol, 2004, 54(1): 148-158. |
| [34] | Gayle BP, Boardman GD, Sherrard JH, et al. Biological denitrification of water. J Environ Eng, 1989, 115(5): 930-943. |
| [35] | Tikhonova TV, Slutsky A, Antipov AN, et al. Molecular and catalytic properties of a novel cytochrome c nitrite reductase from nitrate-reducing haloalkaliphilic sulfur-oxidizing bacterium Thioalkalivibrio nitratireducens. Biochim Biophys Acta Proteins Proteom, 2006, 1764(4): 715-723. |
| [36] | Atkinson SJ, Mowat CG, Reid GA, et al. An octaheme c-type cytochrome from Shewanella oneidensis can reduce nitrite and hydroxylamine. FEBS Lett, 2007, 581(20): 3805-3808. |
| [37] | Bl? chl E, Rachel R, Burggraf S, et al. Pyrolobus fumarii, gen. and sp. nov., represents a novel group of archaea, extending the upper temperature limit for life to 113 C. Extremophiles, 1997, 1(1): 14-21. |
| [38] | Haase D, Hermann B, Einsle O, et al. Epsilonproteobacterial hydroxylamine oxidoreductase (εHao): Characterization of a 'missing link' in the multihaem cytochrome c family. Mol Microbiol, 2017, 105(1): 127-138. |
| [39] | Kim JH, Guo XJ, Park HS. Comparison study of the effects of temperature and free ammonia concentration on nitrification and nitrite accumulation. Proc Biochem, 2008, 43(2): 154-160. |
| [40] | Blackburne R, Yuan Z, Keller J. Demonstration of nitrogen removal via nitrite in a sequencing batch reactor treating domestic wastewater. Water Res, 2008, 42(8/9): 2166-2176. |
| [41] | Sun ZS, Ke Q, Chen YX. Mechanism of biodenitrification of SBR and Its effecting factors. China Biogas, 2001, 19(2): 16-19 (in Chinese). 孙振世, 柯强, 陈英旭. SBR生物脱氮机理及其影响因素. 中国沼气, 2001, 19(2): 16-19. |
| [42] | Wu JJ, Qiu LP, Liu YZ, et al. Influence of influent pH value on nitrite accumulation in a biological aerated filter (BAF)//Second International Conference on Mechanic Automation and Control Engineering. Hohhot, China: IEEE, 2011, 7433-7436. |
| [43] | Li G, Wang JF, Shen YL. Influencing factors of nitrosation granular sludge treating wastewater with low carbon and high ammonia concentration. Chin J Eviron Eng, 2018, 12(3): 697-704 (in Chinese). 李刚, 王建芳, 沈耀良. 亚硝化颗粒污泥处理低碳高氨氮废水的影响因素. 环境工程学报, 2018, 12(3): 697-704. |
| [44] | Qian WT, Peng YZ, Li XY, et al. The inhibitory effects of free ammonia on ammonia oxidizing bacteria and nitrite oxidizing bacteria under anaerobic condition. Bioresour Technol, 2017, 243: 1247-1250. |
| [45] | Wang JL, Song MR, Chen BY, et al. Effects of pH and H2O2 on ammonia, nitrite, and nitrate transformations during UV254nm irradiation: Implications to nitrogen removal and analysis. Chemosphere, 2017, 184: 1003-1011. |
| [46] | Ji M, Liu LJ, Qu HY, et al. Mechanism for effects of high free ammonia loadings on biological nitrification. Environ Sci, 2017, 38(1): 260-268 (in Chinese). 季民, 刘灵婕, 翟洪艳, 等. 高浓度游离氨冲击负荷对生物硝化的影响机制. 环境科学, 2017, 38(1): 260-268. |
| [47] | Qian WT, Ma B, Li XY, et al. Long-term effect of pH on denitrification: High pH benefits achieving partial-denitrification. Bioresour Technol, 2019, 278: 444-449. |
| [48] | Shi LL, Du R, Peng YZ. Achieving partial denitrification using carbon sources in domestic wastewater with waste-activated sludge as inoculum. Bioresour Technol, 2019, 283: 18-27. |
| [49] | Zhou Y, Oehmen A, Lim M, et al. The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants. Water Res, 2011, 45(15): 4672-4682. |
| [50] | Ma B, Yang L, Wang QL, et al. Inactivation and adaptation of ammonia-oxidizing bacteria and nitrite-oxidizing bacteria when exposed to free nitrous acid. Bioresour Technol, 2017, 245: 1266-1270. |
| [51] | Wang DB, Wang QL, Laloo A, et al. Achieving stable nitritation for mainstream deammonification by combining free nitrous acid-based sludge treatment and oxygen limitation. Sci Rep, 2016, 6: 25547. |
| [52] | Jiang CC, Xu SJ, Wang R, et al. Comprehensive assessment of free nitrous acid-based technology to establish partial nitrification. Environmental Sci Water Res Technol, 2018, 4(12): 2113-2124. |
| [53] | Hellinga C, Schellen AAJC, Mulder JW, et al. The SHARON process: an innovative method for nitrogen removal from ammonium-rich waste water. Water Sci Technol, 1998, 37(9): 135-142. |
| [54] | Jia WL, Chen YF, Zhang J, et al. Response of greenhouse gas emissions and microbial community dynamics to temperature variation during partial nitrification. Bioresour Technol, 2018, 261: 19-27. |
| [55] | Schaefer SC, Hollibaugh JT. Temperature decouples ammonium and nitrite oxidation in coastal waters. Environ Sci Technol, 2017, 51(6): 3157-3164. |
| [56] | Bian W, Li J, Wang M, et al. Effects of dissolved oxygen on partial nitrification under different temperatures and related research. China Water Wastewater, 2017, 33(7): 92-96 (in Chinese). 卞伟, 李军, 王盟, 等. 不同温度下溶解氧对短程硝化的影响及相关研究. 中国给水排水, 2017, 33(7): 92-96. |
| [57] | Yang Q, Yang YB, Yang ZQ, et al. Effect of dissolved oxygen on the stability and functional microbial communities of the partial nitrification. China Environ Sci, 2018, 38(9): 3328-3334 (in Chinese). 杨庆, 杨玉兵, 杨忠启, 等. 溶解氧对短程硝化稳定性及功能菌群的影响. 中国环境科学, 2018, 38(9): 3328-3334. |
| [58] | Mohan TVK, Nancharaiah YV, Venugopalan VP, et al. Effect of C/N ratio on denitrification of high-strength nitrate wastewater in anoxic granular sludge sequencing batch reactors. Ecol Eng, 2016, 91: 441-448. |
| [59] | Niu M, Wang SY, Du R, et al. Nitrite accumulation properties of partial denitrificationwith methanolas carbon source. China Environ Sci, 2017, 37(9): 3301-3308 (in Chinese). 牛萌, 王淑莹, 杜睿, 等. 甲醇为碳源短程反硝化亚硝酸盐积累特性. 中国环境科学, 2017, 37(9): 3301-3308. |
| [60] | Yuan Y, Huang Y, Deng HP, et al. Effect of C/N ratio on nitrite accumulation during denitrification process. Environ Sci, 2013, 34(4): 1416-1420 (in Chinese). 袁怡, 黄勇, 邓慧萍, 等. C/N比对反硝化过程中亚硝酸盐积累的影响分析. 环境科学, 2013, 34(4): 1416-1420. |
| [61] | Le T, Peng B, Su CY, et al. Impact of carbon source and COD/N on the concurrent operation of partial denitrification and anammox. Water Environ Res, 2019, 91(3): 185-197. |
| [62] | Yang SD, Zhang LH, Fu XY, et al. Effect of carbon sources on shortcut nitrification-denitrification in salinity wastewater. Environ Pollut Control, 2011, 33(9): 42-46 (in Chinese). 杨世东, 张兰河, 伏向宇, 等. 碳源对含盐废水短程硝化反硝化的影响. 环境污染与防治, 2011, 33(9): 42-46. |
| [63] | Qing LF, Wen LX, Zhi JY, et al. Effect of potassium chlorate on the treatment of domestic sewage by achieving shortcut nitrification in a constructed rapid infiltration system. Int J Environ Res Public Health, 2018, 15(4): 670-679. |
| [64] | Chang Z, Sun N, Li ZX, et al. Sulfide-driven and nitrite-oxidizing bacteria (NOB) inhibition shortcut nitrification and denitrification biological nitrogen removal technology. Chin J Environ Eng, 2018, 12(5): 1416-1423 (in Chinese). 常赜, 孙宁, 李召旭, 等. 硫化物抑制亚硝酸氧化菌推动短程硝化反硝化生物脱氮技术. 环境工程学报, 2018, 12(5): 1416-1423. |
| [65] | Horak REA, Qin W, Bertagnolli AD, et al. Relative impacts of light, temperature, and reactive oxygen on thaumarchaeal ammonia oxidation in the North Pacific Ocean. Limnol Oceanogr, 2018, 63(2): 741-757. |
| [66] | Beman JM, Popp BN, Alford SE. Quantification of ammonia oxidation rates and ammonia-oxidizing archaea and bacteria at high resolution in the Gulf of California and eastern tropical North Pacific Ocean. Limnol Oceanogr, 2012, 57(3): 711-726. |
| [67] | Cao XS, Qian D, Meng XZ. Effects of pH on nitrite accumulation during wastewater denitrification. Environ Technol, 2013, 34(1/4): 45-51. |
| [68] | Jia WL, Zhang J, Lu YM, et al. Response of nitrite accumulation and microbial characteristics to low-intensity static magnetic field during partial nitrification. Bioresour Technol, 2018, 259: 214-220. |
| [69] | Xu GJ, Xu XC, Yang FL, et al. Partial nitrification adjusted by hydroxylamine in aerobic granules under high DO and ambient temperature and subsequent Anammox for low C/N wastewater treatment. Chem Eng J, 2012, 213: 338-345. |
| [70] | Hou J, Xia L, Ma T, et al. Achieving short-cut nitrification and denitrification in modified intermittently aerated constructed wetland. Bioresour Technol, 2017, 232: 10-17. |
| [71] | Aslan S, Simsek E. Influence of salinity on partial nitrification in a submerged biofilter. Bioresour Technol, 2012, 118: 24-29. |
| [72] | Zhang XX, Zhang Y, Wang CC, et al. Research advances in application prospect of partial denitrification coupled with anammox: a review. Chem Ind Eng Progr, 2019, 1401 (in Chinese). 张星星, 张钰, 王超超, 等. 短程反硝化耦合厌氧氨氧化工艺及其应用前景研究进展. 化工进展, 2019, 1401. |
