1. 长兴制药股份有限公司 工业生物催化与转化浙江省工程研究中心,浙江 长兴 313100;
2. 江南大学 生物工程学院,江苏 无锡 214122
收稿日期:2019-06-20;接收日期:2019-09-29;网络出版时间:2019-10-24
基金项目:国家高技术研究发展计划(863计划) (No. 2015AA021004)资助
摘要:文中以大肠杆菌BL21(DE3)为宿主,构建两株分别共表达亮氨酸脱氢酶(LDH,来源蜡样芽孢杆菌)/甲酸脱氢酶(FDH,来源水生弯杆菌)和亮氨酸脱氢酶(LDH,来源蜡样芽孢杆菌)/醇脱氢酶(ADH,来源红球菌)的重组大肠杆菌。通过偶联两种不同NADH再生体系,以L-苏氨酸为起始原料,利用苏氨酸脱氨酶(L-TD)与LDH-FDH或LDH-ADH一锅法合成L-2-氨基丁酸,并对LDH-FDH工艺和LDH-ADH工艺进行对比优化。LDH-FDH工艺的最适反应pH为7.5,最适反应温度为35 ℃,通过加入50 g/L甲酸铵、0.3 g/L NAD+、10% LDH-FDH粗酶液(V/V)和7 500 U/L的L-TD酶液,对L-苏氨酸进行分批补加,以便控制2-丁酮酸浓度小于15 g/L,反应28 h,实现了L-2-氨基丁酸的产量为161.8 g/L,产率97%。LDH-ADH工艺的最适pH为8.0,最适反应温度为35 ℃,通过加入0.3 g/L NAD+、10% LDH-ADH粗酶液(V/V)及7 500 U/L的L-TD酶液,分批补加L-苏氨酸及1.2倍摩尔量异丙醇,以便控制2-丁酮酸浓度小于15 g/L,且每生成约40 g/L的L-2-氨基丁酸,抽真空去除丙酮,反应24 h,实现了L-2-氨基丁酸的产量为119.6 g/L,产率98%。文中所采用的工艺及结果可为L-2-氨基丁酸的工业化提供一定的参考依据。
关键词:共表达L-2-氨基丁酸生物催化NADH再生
Synthesis of L-2-aminobutyric acid by leucine dehydrogenase coupling with an NADH regeneration system
Likun Zhang1, Yanming Xiao1, Weihua Yang1, Chao Hua1, Yun Wang1, Jingya Li2, Taowei Yang
1. Zhejiang Engineering Research Center of Industrial Biocatalysis and Transformation, Changxing Pharmaceutical Co. Ltd., Changxing 313100, Zhejiang, China;
2. School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: June 20, 2019; Accepted: September 29, 2019; Published: October 24, 2019
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2015AA021004)
Abstract: In this study, Escherichia coli BL21 (DE3) was used as the host to construct 2 recombinant E. coli strains that co-expressed leucine dehydrogenase (LDH, Bacillus cereus)/formate dehydrogenase (FDH, Ancylobacter aquaticus), or leucine dehydrogenase (LDH, Bacillus cereus)/alcohol dehydrogenase (ADH, Rhodococcus), respectively. L-2-aminobutyric acid was then synthesized by L-threonine deaminase (L-TD) with LDH-FDH or LDH-ADH by coupling with two different NADH regeneration systems. LDH-FDH process and LDH-ADH process were optimized and compared with each other. The optimum reaction pH of LDH-FDH process was 7.5, and the optimum reaction temperature was 35 ℃. After 28 h, the concentration of L-2-aminobutyric acid was 161.8 g/L with a yield of 97%, when adding L-threonine in batches for controlling 2-ketobutyric acid concentration less than 15 g/L and using 50 g/L ammonium formate, 0.3 g/L NAD+, 10% LDH-FDH crude enzyme solution (V/V) and 7 500 U/L L-TD. The optimum reaction pH of LDH-ADH process was 8.0, and the optimum reaction temperature was 35 ℃. After 24 h, the concentration of L-2-aminobutyric acid was 119.6 g/L with a yield of 98%, when adding L-threonine and isopropanol (1.2 times of L-threonine) in batches for controlling 2-ketobutyric acid concentration less than 15 g/L, removing acetone in time and using 0.3 g/L NAD+, 10% LDH-ADH crude enzyme solution (V/V) and 7 500 U/L L-TD. The process and results used in this paper provide a reference for the industrialization of L-2-aminobutyric acid.
Keywords: co-expressionL-2-aminobutyric acidbiocatalysisNADH regeneration
L-2-氨基丁酸(L-2-aminobutyric acid,L-ABA)是抑制人体神经信息传递、促进脑细胞代谢的一种非天然手性氨基酸,也是一种重要的手性医药中间体,通过对其末端羧基还原可用于制备抗结核药物盐酸乙胺丁醇[1],也可通过酰胺化制备抗癫痫药物左乙拉西坦及布瓦西坦[2-3]。目前,L-2-氨基丁酸的合成方法包括化学法和生物法。化学法包括以氨化水解法、丁酮酸还原法、脱硫法等[4],但化学合成反应条件苛刻、易生成副产物和消旋产物、产物分离困难、立体选择性差、工业生产成本高、对环境污染大。生物法包括微生物发酵法和酶催化法,发酵法易伴随副产物生成,产物分离提取较困难。酶催化法具有反应条件温和、立体选择性高、环境污染少等优点。目前酶催化法制备L-2-氨基丁酸主要有两种:一是对消旋DL-氨基丁酸进行拆分[5-7],理论转化为50%;二是通过转氨酶[8-10]或脱氢酶[11-14]以2-丁酮酸(2-ketobutyric acid,2-KBA)为底物进行不对称合成,该方法常偶联苏氨酸脱氨酶(Threonine deaminase,L-TD)将廉价L-苏氨酸(L-Threonine,L-Thr)转化为2-丁酮酸,理论转化可达100%。由于利用转氨酶合成需要引入新氨基酸为氨基供体,反应过程较为复杂,且易伴随副产物生成,产率不理想,工业化较难。目前,比较常用的是用亮氨酸脱氢酶(Leucine dehydrogenase,LDH)[15]以还原型烟酰胺腺嘌呤二核苷酸(还原型辅酶Ⅰ,NADH)作为辅酶,耦合辅酶再生体系用于L-2-氨基丁酸制备。
辅酶再生体系可选用以葡萄糖脱氢酶(Glucose dehydrogenase,GDH)催化葡萄糖、甲酸脱氢酶(Formate dehydrogenase,FDH)催化甲酸铵[16]、醇脱氢酶(Alcohol dehydrogenase,ADH)催化异丙醇用于NADH的循环再生[17]。葡萄糖脱氢酶的NADH再生系统由于伴有大量葡萄糖酸盐副产物的生成,产物分离纯化较难,工业化难度大;基于甲酸脱氢酶的NADH再生系统所产生的副产物为CO2,对产物后分离无影响,尽管反应结束后残留部分甲酸盐,但较前者而言产物分离较易;基于醇脱氢酶NADH再生系统的副产物为丙酮,较前两者更易分离除去。本文将LDH基因分别与FDH基因和ADH基因通过质粒pRSFDuet-1构建pRSFDuet-ldh-fdh及pRSFDuet-ldh-adh,进而利用重组菌串联表达LDH-FDH及LDH-ADH,分别偶联L-TD制备L-2氨基丁酸,并对上述两种工艺进行探究(图 1)[11, 17],提供一条底物转化率高、生产成本低且易于工业化的L-2-氨基丁酸生产工艺。
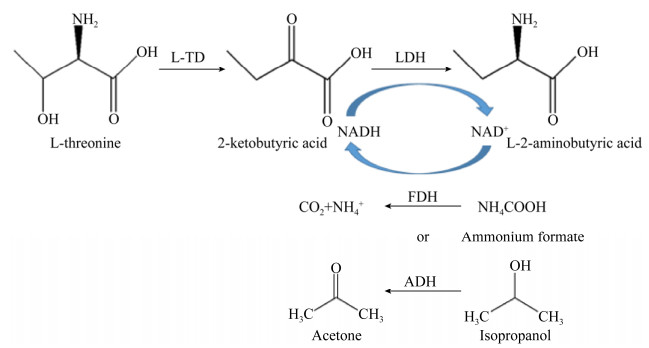 |
| 图 1 生物催化合成L-2-氨基丁酸[11, 17] Fig. 1 Enzyme catalysis L-2-aminobutyric acid[11, 17]. |
| 图选项 |
1 材料与方法1.1 质粒与菌株大肠杆菌E. coli DH5α、E. coli BL21(DE3)、质粒pET28a(+)-ldh、pET28a(+)-adh、pET28a(+)-fdh、pRSFDuet-1与L-TD (GenBank登录号APK04219.1)粗酶液(酶活力2 000 U/mL)均由长兴制药研发中心分子实验平台构建保存。
1.2 培养基发酵培养基:蛋白胨10 g/L,酵母膏5 g/L,NaCl 5 g/L。调节pH至7.2,121 ℃灭菌20 min。向灭菌后的培养基中添加事先配制成一定浓度过滤除菌的卡那霉素,使其终质量浓度为50 μg/mL。
固体培养基:蛋白胨10 g/L,酵母膏5 g/L,NaCl 5 g/L,琼脂20 g/L,调节pH至7.2,121 ℃灭菌20 min。向灭菌后的培养基中添加事先配制成一定浓度过滤除菌的卡那霉素,使其终质量浓度为50 μg/mL。
1.3 主要试剂限制性内切核酸酶、Taq DNA聚合酶、PrimeSTAR DNA聚合酶和T4 DNA连接酶购于TaKaRa;基因组提取试剂盒、质粒提取试剂盒、DNA凝胶回收试剂盒、DNA清洁试剂盒购于生工生物工程(上海)股份有限公司;L-苏氨酸、2-丁酮酸、甲酸铵、L-2-氨基丁酸购于阿拉丁;烟酰胺腺嘌呤二核苷酸(辅酶Ⅰ,NAD+)购于国药集团化学试剂有限公司;其他常规试剂均为市售分析纯。
1.4 重组载体诱导表达1.4.1 重组载体串联构建根据NCBI数据库中亮氨酸脱氢酶基因ldh序列(GenBank登录号CP034551.1)、醇脱氢酶ADH序列(GenBank登录号KDE12735.1)以及甲酸脱氢酶基因fdh序列(GenBank登录号AB091484.1)设计引物,如表 1所示。分别以质粒pET28a(+)-ldh、pET28a(+)-adh、pET28a(+)-fdh为模板,使用表 1中对应的引物进行PCR,分别扩增得到ldh、adh、fdh基因片段,将上述三者DNA片段经琼脂糖凝胶回收后,用对应的限制性内切酶进行双酶切,随后使用DNA清洁试剂盒进行DNA纯化获得酶切产物。fdh或adh基因片段与经同样双酶切处理的线性质粒pRSFDuet-1混匀,用T4 DNA连接酶16 ℃过夜连接,将重组质粒转化到E. coli DH5α感受态细胞,涂布到固体培养基,37 ℃培养18 h,通过菌落PCR将筛选阳性克隆子接入发酵培养基中,37 ℃、150 r/min培养8 h,使用质粒提取试剂盒提取质粒,对重组质粒用NdeⅠ和XhoⅠ进行双酶切验证。获得的重组质粒pRSFDuet-fdh或pRSFDuet-adh用NcoⅠ和NotⅠ进行双酶切,经纯化后与经同样双酶切处理的ldh基因片段混匀,重复上述操作分别获得重组质粒pRSFDuet-ldh-fdh和pRSFDuet-ldh-adh,并进行测序验证。
表 1 本实验用到的引物Table 1 Primers used in this experiment
| Primer name | Primer sequences (5′–3′) | Size (bp) |
| LDH-P1 | CATGCCATGGCAGGAACATTAGAAATCTTCGAATA (NcoⅠ) | 35 |
| LDH-R1 | TTGCGGCCGCTTAGCGACGGCTAATAATATCGTG (NotⅠ) | 34 |
| FDH-P2 | GGAATTCCATATGGCGAAAGTACTCTGCGTTCTCTACG (NdeⅠ) | 38 |
| FDH-R2 | GATCTCGAGTCAGCCGGCTTTTTTGAATTTACCCGCC (XhoⅠ) | 37 |
| ADH-P2 | CGCCATATGAAAGCAGTCCAGTACACCGA (NdeⅠ) | 29 |
| ADH-R2 | CCGCTCGAGTCACGGAACCACGACACCACG (XhoⅠ) | 30 |
| The underlined sequences are restriction enzyme sites. | ||
表选项
1.4.2 重组载体串联表达及粗酶液制备将上述重组质粒转入E. coli BL21(DE3)感受态细胞中,分别获得E. coli BL21(DE3)/pRSFDuet-ldh-fdh和E. coli BL21(DE3)/pRSFDuet-ldh-adh。将上述两种重组菌接种至固体培养基斜面,37 ℃培养12 h,获得斜面菌体;用无菌水洗下培养好的斜面菌体接入装有100 mL发酵培养基的500 mL三角瓶中,37 ℃、150 r/min培养6–8 h后,IPTG诱导量0.3 mmol/L,25 ℃、150 r/min诱导培养10–12 h。将发酵液离心(8 000 r/min,10 min)收集沉淀菌体。用100 mmol/L磷酸钾缓冲液(pH 7.0)悬浮菌体,使菌体终质量浓度为200 g/L,超声破碎(冰浴,功率400 W,工作5 s,间隔5 s) 20 min,4 ℃、6 000 r/min离心25 min,保留上清分别得到LDH-FDH和LDH-ADH粗酶液。
1.5 酶活测定本文通过串联表达获得LDH-FDH或LDH-ADH,若单独测LDH、FDH、ADH酶活不具代表性,将串联表达酶当作整体,以L-2-氨基丁酸生成量为衡量标准更加直观。
LDH-FDH酶活测定:反应体系包括:100 mmol/L 2-丁酮酸,0.2 mmol/L NAD+,120 mmol/L甲酸铵,100 mmol/L NH3/NH4Cl缓冲液(pH 7.5),1 mL LDH-FDH粗酶液,总体积为10 mL。35 ℃反应10 min,强酸终止反应,液相检测L-2-氨基丁酸生成量。酶活定义:上述反应条件下,1 min产生1 μmol L-2-氨基丁酸所需的酶量定义为1个酶活单位,即1 U。
LDH-ADH酶活测定:反应体系包括:100 mmol/L 2-丁酮酸,0.2 mmol/L NAD+,120 mmol/L异丙醇,100 mmol/L磷酸钾缓冲液(pH 8.0),1 mL LDH-ADH粗酶液,总体积为10 mL。35 ℃反应10 min,强酸终止反应,液相检测L-2-氨基丁酸生成量。酶活定义:上述反应条件下,1 min产生1 μmol L-2-氨基丁酸所需的酶量定义为1个酶活单位,即1 U。
1.6 催化反应条件优化为了探索催化反应的最佳反应条件,提高L-2-氨基丁酸产量,分别对甲酸铵工艺(LDH-FDH工艺)和醇脱氢酶工艺(LDH-ADH工艺)条件进行优化。
1.6.1 L-苏氨酸一次性投加催化体系LDH-FDH 500 mL催化体系为:40 g/L L-苏氨酸,15 g/L甲酸铵,0.3 g/L NAD+,用氨水调节反应pH至7.5,加入10% LDH-FDH粗酶液(V/V)和7 500 U/L的L-TD酶液,机械搅拌。反应条件:35 ℃、150 r/min,反应过程中用40%甲酸维持pH 7.5左右,液相监测反应过程。
LDH-ADH 500 mL催化体系为:40 g/L L-苏氨酸,4%异丙醇(V/V),0.3 g/L NAD+,磷酸钾缓冲液(100 mmol/L,pH 8.0)。用氨水调节反应pH至8.0,加入10% LDH-ADH粗酶液(V/V)及7 500 U/L的L-TD酶液,机械搅拌。反应条件:35 ℃、150 r/min,液相监测反应过程。
1.6.2 L-苏氨酸分批投加催化体系LDH-FDH 500 mL催化体系为:10 g/L L-苏氨酸,50 g/L甲酸铵,0.3 g/L NAD+,用氨水调节反应pH至7.5,加入10% LDH-FDH粗酶液(V/V)和7 500 U/L的L-TD酶液,机械搅拌,后续每隔20–40 min补加10 g/L L-苏氨酸,根据体系中2-丁酮酸残留量调整L-苏氨酸补加时间间隔,使体系2-丁酮酸浓度小于15 g/L。反应条件:35 ℃、150 r/min,反应过程中用40%甲酸维持pH 7.5左右,液相监测反应过程。
LDH-ADH 500 mL催化体系为:10 g/L L-苏氨酸,0.8%异丙醇(V/V),0.3 g/L NAD+,用氨水调节反应pH至8.0,加入10% LDH-ADH粗酶液(V/V)及7 500 U/L的L-TD酶液,机械搅拌,后续每隔20–40 min补加10 g/L L-苏氨酸及1.2倍摩尔量异丙醇,根据体系中2-丁酮酸残留量调整L-苏氨酸补加时间间隔,使体系2-丁酮酸浓度小于15 g/L。反应条件:35 ℃、150 r/min,用氨水维持pH 8.0左右,液相监测反应过程。
1.7 分析方法L-苏氨酸、2-丁酮酸和L-2-氨基丁酸的含量均由HPLC测定,L-苏氨酸、L-2-氨基丁酸分析条件:流动相为0.05 mmol/L醋酸钠溶液:甲醇= 7:3,流速为1.0 mL/min,检测紫外波长为334 nm,柱温为30 ℃,进样量为10 μL,色谱柱为Agilent XDB-C8 (150 mm×4.6 mm)。
进样前样品需衍生,衍生剂配制:称取0.343 g邻苯二甲醛和0.147 g N-乙酰半胱氨酸,置于50 mL容量瓶中,加5 mL无水乙醇,用0.1 mmol/L硼酸缓冲液(pH 9.5)定容。2-丁酮酸分析条件:流动相为6 mmol/L硫酸溶液,流速为0.55 mL/min,检测紫外波长为202 nm,柱温为35 ℃,进样量为10 μL,色谱柱为Aminex HPX-87H (300 mm×7.8 mm)。
2 结果与分析2.1 重组酶的表达及酶活检测重组质粒pRSFDuet-ldh-fdh和pRSFDuet-ldh-adh经测序验证无突变,分别转入E. coli BL21(DE3)中按照1.4.2方法制备LDH-FDH和LDH-ADH粗酶液均在E. coli中实现可溶性表达,结果如图 2所示。SDS-PAGE图中LDH、FDH和ADH的理论分子量分别为39.4、43.9和35.2 kDa,与氨基酸序列计算的值一致,表明重组菌能正常串联表达LDH-FDH和LDH-ADH。按1.5方法测定酶活,LDH-FDH粗酶液酶活为72.8 U/mL,LDH-ADH粗酶液酶活为65.1 U/mL。
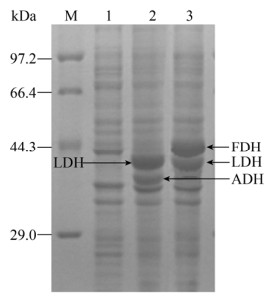 |
| 图 2 重组酶的SDS-PAGE分析 Fig. 2 SDS-PAGE analysis of recombinant enzymes. 1: control of E. coli BL21(DE3)/pRSFDuet-ldh-fdh or E. coli BL21(DE3)/pRSFDuet-ldh-adh which is not induced; 2: E. coli BL21(DE3)/pRSFDuet-ldh-adh after induction; 3: E. coli BL21(DE3)/pRSFDuet-ldh-fdh after induction; M: protein marker. |
| 图选项 |
2.2 pH对催化反应影响甲酸脱氢酶和醇脱氢酶工艺均同时涉及3种酶,因此有必要对催化反应的最适pH进行探索。但由于L-TD作为本企业已商品化的酶,在pH 7.0–8.5均表现为较高酶活,且该酶用量较少,工业化生产成本所占比重较低,因此本文主要考察pH对LDH-FDH和LDH-ADH酶活影响。不同pH下,分别测定LDH-FDH和LDH-ADH的酶活,以最高酶活为100%,结果如图 3所示。LDH-FDH最适pH为7.5,且在pH 7.0–8.0范围内相对酶活均大于90%;LDH-ADH最适pH为8.5,且在pH 7.5–8.5范围内相对酶活均大于90%。
 |
| 图 3 pH对催化反应影响 Fig. 3 Effect of pH on the reaction. |
| 图选项 |
2.3 温度对催化反应的影响L-TD在30–40 ℃均表现出较高酶活,因此本文主要考察温度对LDH-FDH和LDH-ADH酶活影响。由于2-丁酮酸对温度较敏感、不稳定,因此为了确定反应最佳温度,同时检测酶活测量体系中2-丁酮酸的浓度。不同温度下,分别测定LDH-FDH的酶活及体系中L-氨基丁酸与2-丁酮酸含量,结果如图 4A、B所示。LDH-FDH最适温度为35 ℃,此时反应液中L-2-氨基丁酸浓度为72.8 mmol/L,2-丁酮酸浓度为25.1 mmol/L,物料基本守恒,40–45 ℃时,2-丁酮酸剩余量小于理论剩余量,物料表现不平衡,因此选用35 ℃作为LDH-FDH最适催化温度。不同温度下LDH-ADH的酶活及体系中L-2-氨基丁酸与2-丁酮酸含量,结果如图 4C、D所示。LDH-ADH最适温度为40 ℃,此时反应液中L-2-氨基丁酸浓度为65.1 mmol/L,2-丁酮酸浓度为21.9 mmol/L,尽管该温度下L-2-氨基丁酸浓度达最高,但2-丁酮酸浓度为21.9 mmol/L,约为2-丁酮酸理论剩余量的60%,表明该温度会导致2-丁酮酸变质或形成其他副产物,因此选用35 ℃作为LDH-ADH最适催化温度。
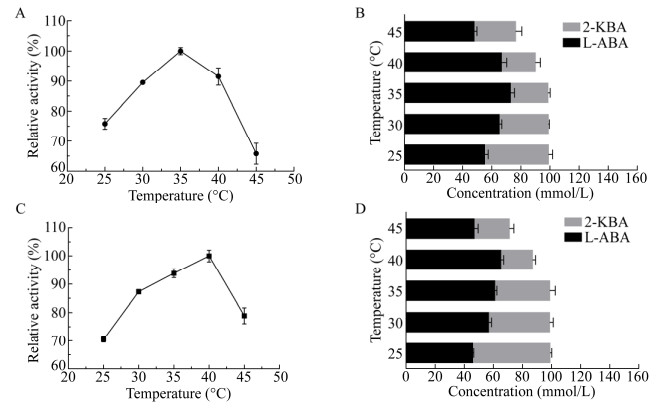 |
| 图 4 温度对催化反应的影响 Fig. 4 Effect of pH on the reaction. (A) Effect of temperature on LDH-FDH activity. (B) L-ABA and 2-KBA concentration in different temperature reaction systems of LDH-FDH. (C) Effect of temperature on LDH-ADH activity. (D) L-ABA and 2-KBA concentration in different temperature reaction systems of LDH-ADH. |
| 图选项 |
2.4 L-苏氨酸浓度对催化反应影响按照1.6.1方法,保持其他条件不变,添加不同浓度L-苏氨酸,反应24 h检测L-2-氨基丁酸生成量及2-丁酮酸残留量,考察L-苏氨酸浓度对催化反应影响。LDH-FDH催化体系结果如图 5A、B所示,随着L-苏氨酸浓度增加,L-2-氨基丁酸产率逐渐下降,2-丁酮酸残留量逐步上升。当L-苏氨酸浓度在40–60 g/L范围时,2-丁酮酸残留量较少,随着底物浓度增加,L-2-氨基丁酸生成量呈线性增长,产率均大于95%。当L-苏氨酸浓度增加至80–120 g/L,2-丁酮酸积累严重,而L-2-氨基丁酸生成量却未有明显增长,表明体系中积累2-丁酮酸会抑制LDH-FDH的活性。LDH-ADH催化体系结果如图 5C、D所示,与LDH-FDH结果相似。以上两种工艺制备L-2-氨基丁酸最高浓度均小于60 g/L,且NAD+利用率较低。
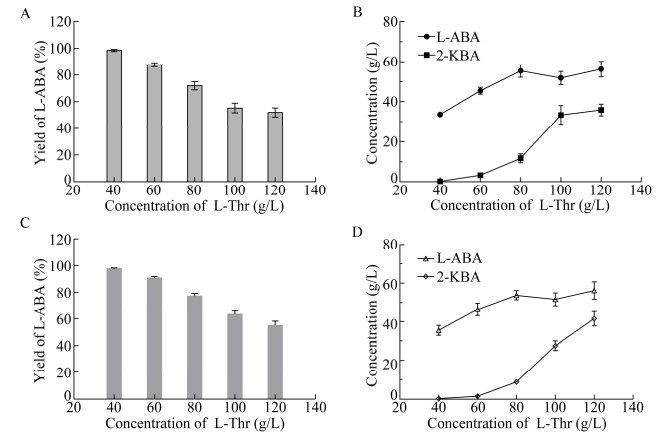 |
| 图 5 L-苏氨酸浓度对催化反应影响 Fig. 5 Effect of the concentration of L-Thr on the reaction. (A) Effect of the concentration of L-Thr on the yield of L-ABA in LDH-FDH process. (B) The concentration of L-ABA and 2-KBA with different concentrations of L-threonine after 24 h reaction in LDH-FDH process. (C) Effect of the concentration of L-Thr on the yield of L-ABA in LDH-ADH process. (D) The concentration of L-ABA and 2-KBA with different concentrations of L-threonine after 24 h reaction in LDH-ADH process. |
| 图选项 |
2.5 2-丁酮酸浓度对催化反应影响按照1.6.1方法,维持其他条件不变,将底物L-苏氨酸更换为2-丁酮酸,反应1 h,考察不同浓度2-丁酮酸对LDH-FDH及LDH-ADH催化反应影响,结果如图 6所示。当2-丁酮酸浓度在5–15 g/L范围时,LDH-FDH及LDH-ADH转化体系中L-2-氨基丁酸产率均大于99%,且L-2-氨基丁酸浓度随着底物浓度增加线性上升,当2-丁酮酸浓度为20 g/L,产物浓度达到最大,后随着2-丁酮酸浓度增加L-2-氨基丁酸产率和转化率均呈下降趋势。表明当2-丁酮酸浓度大于20 g/L时,对LDH-FDH及LDH-ADH开始出现抑制作用,因此为了尽可能降低2-丁酮酸抑制作用,应控制反应体系中2-丁酮酸浓度小于15 g/L。
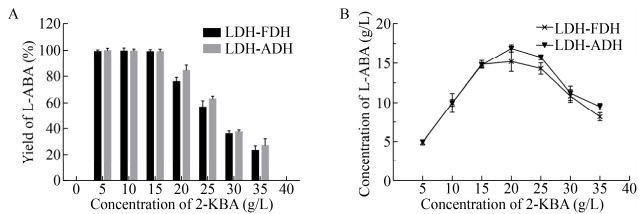 |
| 图 6 2-丁酮酸浓度对催化反应影响 Fig. 6 Effect of the concentration of 2-KBA on the reaction. (A) Effect of the concentration of 2-KBA on the yield of L-ABA in two processes. (B) The concentration of L-ABA with different concentrations of 2-KBA after 1 h reaction in two process. |
| 图选项 |
2.6 分批补加L-苏氨酸催化工艺为了提高上述两种工艺产物浓度及NAD+利用率,本文尝试选用分批补加L-苏氨酸,使生成的2-丁酮酸及时转化为L-2-氨基丁酸,解除2-丁酮酸对酶活性的抑制。按照1.6.2方法,LDH-FDH工艺催化反应进程如图 7A所示。整个反应过程2-丁酮酸浓度均控制在12 g/L以下,反应28 h基本结束,此时L-2氨基丁酸浓度达161.8 g/L,产率大于97%。按照1.6.2方法,LDH-ADH工艺催化反应进程如图 7B所示。反应8 h 2-丁酮酸开始有积累趋势,10 h已停止补加L-苏氨酸,反应10–18 h L-2-氨基丁酸浓度几乎没有增长,而L-苏氨酸浓度一直维持较低水平,表明L-TD活性没有受到抑制;2-丁酮酸消耗速率较慢,表明LDH-ADH活性受到抑制,但整个进程2-丁酮酸未大量积累,排除2-丁酮酸抑制作用,可能是异丙醇生成丙酮抑制LDH-ADH活性。该工艺反应18 h,L-2氨基丁酸浓度达75.7 g/L,产率79%,转化体系仍残留17.3 g/L 2-丁酮酸。
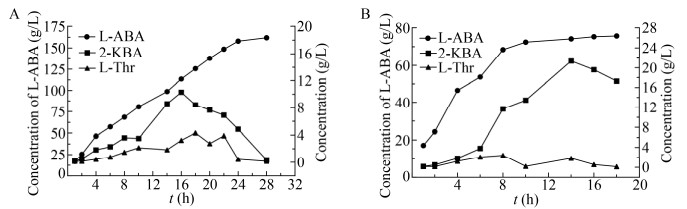 |
| 图 7 两种工艺催化反应进程 Fig. 7 Reaction process of two processes. The concentration of L-threonine, 2-ketobutyric acid and L-2-aminobutyric acid was determined by HPLC at different time points. (A) LDH-FDH process. (B) LDH-ADH process. |
| 图选项 |
2.7 LDH-ADH工艺进一步优化添加不同浓度丙酮,按1.5方法检测LDH-ADH酶活,结果如表 2所示。当丙酮浓度在1%–3%范围时,对LDH-ADH活性抑制作用较小,当丙酮浓度大于4%,开始出现明显抑制作用。由图 6B可知反应4 h 2-丁酮酸未开始积累,表明LDH-ADH活性未受到抑制,此时体系中L-2-氨基丁酸浓度为46.5 g/L,丙酮含量约3%。为了解除丙酮抑制作用,仍按照1.6.2的催化工艺进行,每生成约40 g/L的L-2-氨基丁酸,对反应体系抽真空,35 ℃维持1 h以去除部分丙酮后,需继续补加L-苏氨酸,反应进程如图 8所示。反应24 h基本结束,此时L-2氨基丁酸浓度达119.6 g/L,产率大于98%。
表 2 丙酮浓度对LDH-ADH酶活影响Table 2 Effect of acetone concentration on LDH-ADH activity
| Acetone concentration (V/V) (%) | Activity of LDH-ADH (U/mL) |
| 0 | 65.1±0.6 |
| 1.0 | 63.5±0.3 |
| 2.0 | 63.8±1.2 |
| 3.0 | 61.2±0.5 |
| 4.0 | 52.8±0.8 |
| 5.0 | 35.0±0.6 |
| 6.0 | 18.9±1.0 |
表选项
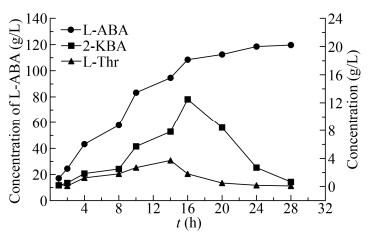 |
| 图 8 优化后的LDH-ADH工艺催化反应进程 Fig. 8 Reaction process of the reaction by optimizing the process of LDH-ADH. |
| 图选项 |
3 讨论本文将ldh与fdh或adh进行串联共表达获得LDH-FDH和LDH-ADH,并结合L-TD对LDH-FDH工艺和LDH-ADH工艺进行对比优化,合成L-2-氨基丁酸。LDH-FDH工艺的最适反应pH为7.5,最适反应温度为35 ℃,通过加入50 g/L甲酸铵、0.3 g/L NAD+、10% LDH-FDH粗酶液(V/V)和7 500 U/L的L-TD酶液,分批补加L-苏氨酸,控制2-丁酮酸浓度小于15 g/L,反应28 h,实现了L-2-氨基丁酸的产量为161.8 g/L,产率97%。LDH-ADH工艺的最适pH为8.0,最适反应温度为35 ℃,通过加入0.3 g/L NAD+、10% LDH-ADH粗酶液(V/V)及7 500 U/L的L-TD酶液,分批补加L-苏氨酸及1.2倍摩尔量异丙醇,控制2-丁酮酸浓度小于15 g/L,且每生成约40 g/L的L-2-氨基丁酸,抽真空去除丙酮,反应24 h,实现了L-2-氨基丁酸的产量为119.6 g/L,产率98%。
Tao等[11]利用甲酸脱氢酶的NADH再生系统工艺,在30 L反应体系中一次性添加L-苏氨酸,底物浓度达到1 mol/L,产物得率97.3%。Wang等[16]通过提高L-苏氨酸脱氨酶的热稳定性以提高L-2-氨基丁酸产量和NADH循环使用次数,产物浓度达0.993 mol/L。目前相较于甲酸脱氢酶的NADH再生系统工艺的报道,本研究考察了不同2-丁酮酸浓度对L-2-氨基丁酸转化体系中酶活力的影响,采用分批补加L-苏氨酸方式降低了2-丁酮酸对转化体系中酶活力抑制作用,促使L-2-氨基丁酸产量进一步提高,产物浓度可达1.57 mol/L,产物得率97%,工业化潜力极大。目前利用基于醇脱氢酶NADH再生系统工艺生产L-2-氨基丁酸报道较少,且产量普遍较低,难以工业化。刘珊等[17]通过优化酶催化条件,采用异丙醇为底物实现NADH再生,产物浓度达43 g/L,产物得率99%。本研究从降低2-丁酮酸与丙酮对酶活力抑制作用着手,采用分批补加L-苏氨酸及反应过程中抽真空去除丙酮的方式,使L-2-氨基丁酸产量显著提高,产物浓度达1.16 mol/L,产物得率98%,使得该工艺表现出一定的工业化潜力。
笔者对上述两种工艺分别进行3 000 L中试放大,均获得良好效果。LDH-FDH工艺获得L-2-氨基丁酸的产量高,NAD+利用率高,但转化结束后,反应体系中会残留约80 g/L甲酸盐,产物分离纯化需进行脱盐处理,进而再次回收利用甲酸盐。小试转化反应过程中产生的CO2对反应进程几乎无影响,中试放大过程中需对反应体系通空气以去除产生的CO2,若CO2积累浓度过高会抑制L-TD活性。LDH-ADH工艺获得L-2-氨基丁酸的产量低于LDH-FDH工艺,且NAD+利用率低,设备要求高,反应过程中需抽真空除去丙酮,但产物分离纯化无需除盐,较为简单。本文为生物催化制备L-2-氨基丁酸工业化生产提供了直接的实验数据支持,从生产成本、设备要求等方面考虑,笔者认为LDH-FDH工艺更适合工业化。
参考文献
| [1] | Nugent WA, Feaster JE. Practical synthesis of methyl Z-2-(N-acetylamino) but-2-enoate.An intermediate to D-and L-2-aminobutyric acid. Synth Commun, 1998, 28(9): 1617-1623. |
| [2] | Liao JC, Zhang KC, Cho KM.Compositions and methods for the production of L-homoalanine: US, 9550980.2017-01-24. |
| [3] | Sasa M. A new frontier in epilepsy:novel antiepileptogenic drugs. J Pharmacol Sci, 2006, 100(5): 487-494. |
| [4] | Yin XQ, Sun F, Ge SX. Development of synthesis of α-aminobutyric acid. Fine Chem Intermed, 2010, 40(1): 12-14 (in Chinese). 尹先清, 孙芳, 葛胜祥. α-氨基丁酸化学合成研究进展. 精细化工中间体, 2010, 40(1): 12-14. |
| [5] | Li X.Enzymatic synthesis of L-2-aminobutyric acid and the immobilization of enzyme[D].Shanghai: East China University of Science and Technology, 2013(in Chinese). 李兴.酶法合成L-2-氨基丁酸及酶的固定化研究[D].上海: 华东理工大学, 2013. |
| [6] | Yasukawa K, Hasemi R, Asano Y. Dynamic kinetic resolution of α-aminonitriles to form chiral α-Amino acids. Adv Synth Catal, 2011, 353(13): 2328-2332. |
| [7] | Xu HM, Xia SW, He CL. Preparation of non-natural L amino acids via deracemization of DL-amino acids catalyzed by immobilized D-amino acid oxidase. J Mol Catal, 2012, 26(2): 192-196 (in Chinese). 徐红梅, 夏仕文, 何从林. 固定化D-氨基酸氧化酶催化DL-氨基酸去消旋化制备非天然L-氨基酸. 分子催化, 2012, 26(2): 192-196. |
| [8] | Fotheringham IG, Grinter N, Pantaleone DP, et al. Engineering of a novel biochemical pathway for the biosynthesis of L-2-aminobutyric acid in Escherichia coli K12. Bioorg Med Chem, 1999, 7(10): 2209-2213. |
| [9] | Zhu L, Tao RS, Wang Y, et al. Removal of L-alanine from the production of L-2-aminobutyric acid by introduction of alanine racemase and D-amino acid oxidase. Appl Microbiol Biotechnol, 2011, 90(3): 903-910. |
| [10] | Ager DJ, Li T, Pantaleone DP, et al. Novel biosynthetic routes to non-proteinogenic amino acids as chiral pharmaceutical intermediates. J Mol Catal B:Enzym, 2001, 11(4/6): 199-205. |
| [11] | Tao RS, Jiang Y, Zhu FY, et al. A one-pot system for production of L-2-aminobutyric acid from L-threonine by L-threonine deaminase and a NADH-regeneration system based on L-leucine dehydrogenase and formate dehydrogenase. Biotechnol Lett, 2014, 36(4): 835-841. |
| [12] | Galkin A, Kulakova L, Yoshimura T, et al. Synthesis of optically active amino acids from alpha-keto acids with Escherichia coli cells expressing heterologous genes. Appl Environ Microbiol, 1997, 63(12): 4651-4656. |
| [13] | Krix G, Bommarius AS, Drauz K, et al. Enzymatic reduction of α-keto acids leading to L-amino acids, D-or L-hydroxy acids. J Biotechnol, 1997, 53(1): 29-39. |
| [14] | Zhang CZ, Yang TW, Zhou JP, et al. Whole-cell biotransformation for simultaneous synthesis of L-2-aminobutyric acid and D-gluconic acid in recombinant Escherichia coli. Chin J Biotech, 2017, 33(12): 2028-2034 (in Chinese). 张蔡喆, 杨套伟, 周俊平, 等. 大肠杆菌全细胞转化联产L-2-氨基丁酸和D-葡萄糖酸. 生物工程学报, 2017, 33(12): 2028-2034. |
| [15] | Xu JM, Cheng F, Fu FT, et al. Semi-rational engineering of leucine dehydrogenase for L-2-aminobutyric acid production. Appl Biochem Biotechnol, 2017, 182(3): 898-909. |
| [16] | Wang Y, Li GS, Qiao P, et al. Increased productivity of L-2-aminobutyric acid and total turnover number of NAD+/NADH in a one-pot system through enhanced thermostability of L-threonine deaminase. Biotechnol Lett, 2018, 40(11/12): 1551-1559. DOI:10.1007/s10529-018-2607-3 |
| [17] | Liu S, Li Y, Zhu J. One-pot enzymatic synthesis of L-2-aminobutyric acid coupling with a NADH regeneration system based on ketoreductase. Chin Biotechnol, 2017, 37(1): 64-70 (in Chinese). 刘珊, 李元, 祝俊. 偶联基于酮还原酶的NADH再生系统一锅法酶催化合成L-2-氨基丁酸. 中国生物工程杂志, 2017, 37(1): 64-70. |
