

清华大学 体育与健康科学研究中心,北京 100084
收稿日期:2018-12-25;接收日期:2019-06-18
基金项目:中国高等教育学高等教育科学研究“十三五”教育科学规划课题(No.17TY021)资助
摘要:基因编辑技术是人为的对基因片段进行修改的一种技术。新型基因编辑技术关注在人工核酸酶剪切技术领域,主要为ZFN技术,TALEN技术,CRISPR技术以及单碱基编辑技术。基因编辑技术的不断完善促进了农业,畜牧业和生物医学等领域的快速发展,但与此同时,技术缺陷和伦理争议也为其自身的发展带来了巨大的挑战。本文将对基因编辑技术的发展与挑战,以及国内外的伦理探讨进行简要综述,期望能启发读者重新认识基因编辑技术。
关键词:基因编辑技术发展挑战伦理学限制
Development and challenges of gene editing technology
Yao Liu, Yingzhe Xiong, Zhenze Cai, Bing Zhang


Sports and Health Science Research Center, Tsinghua University, Beijing 100084, China
Received: December 25, 2018; Accepted: June 18, 2019
Supported by: Topic of Higher Education Science Research for 13th Five-Year Planning supported by China Association of Higher Education (No. 17TY021)
Corresponding author: Bing Zhang. Tel: +86-10-62796932; E-mail: bzhang@tsinghua.edu.cn.
Abstract: Gene editing is a technique for modifying gene fragments. The novel gene editing technology focuses on the field of artificial nuclease cleavage technology, mainly ZFN technology, TALEN technology, CRISPR technology and base editing technology. The continuous improvement of gene editing technology has promoted the rapid development of agriculture, animal husbandry and biomedicine, but at the same time, technical defects and ethical controversy have brought enormous challenges to its own development. This article will briefly discuss the development and challenges of gene editing technology, as well as the views at home and abroad, and hope to inspire readers to recognize gene editing technology.
Keywords: genetic editing technologydevelopmentchallengeethical limitations
基因编辑技术就是对含有遗传信息的基因序列进行插入、删除、替换等修改的一种技术。基因序列改变有可能对蛋白质的表达造成影响,并且蛋白质的一个重要功能是调节生命活动,所以基因序列的改变甚至会影响整个生命体的生理生化活动,例如镰刀形细胞贫血症,唐氏综合征、白化病、色盲、血友病和巨脑症等。
2018年11月26日,我国南方科技大学贺建奎团队宣布一对经过CRISPR/Cas9基因编辑的婴儿已在11月于中国诞生,宣称她们可以天然抵抗艾滋病。这个世界首例宣称可以抵抗艾滋病的基因编辑婴儿的出生,引起了国内外的巨大轰动,对基因编辑技术的质疑和争议也随之而来。
随着技术的不断进步,科学家们也越来越意识到基因编辑技术的巨大能力,不仅可以借助这种技术实现农作物的抗虫、高产,甚至可以通过基因治疗治愈一些疑难杂症。尽管如此,基因编辑技术不断发展的同时,也带给了人们一些困惑。因为作为遗传物质的基因还有很多的未知领域,在没有弄清楚这些本质性的问题之前,贸然地进行一些基因编辑行为,能否精确地解决问题并且不会引起潜在的风险,目前还存在很多的不确定性。为此,文中将从基因编辑技术的发展、应用和目前面临的挑战进行简单讨论,试图引发读者的思考。
1 基因编辑技术的发展最早的基因编辑技术是同源重组技术(Homologous recombination,HR),通过引入外源基因,在同源序列间交换实现基因编辑,但是效率非常低。之后出现了核酸酶的基因编辑技术,不用引入外源基因,即可对特定基因进行修饰,但是传统的核酸酶如限制性内切酶只能切割短并且简单的基因序列,对于复杂的生物体执行效率较低,于是出现了基于人工核酸酶的更加精准简便的基因编辑技术[1-2],即锌指核酸酶技术(Zinc finger nucleases,ZFN)、类转录激活因子效应的核酸酶技术(Transcription activator-like effectors nucleases,TALEN)和规律成簇的间隔短回文重复相关蛋白技术(Clustered regularly interspaced short palindromic repeats,CRISPR)。新型基因编辑技术主要的原理基础是利用核酸酶特异性切割DNA形成双链缺口(Double stranded break,DSB),然后进行目的修复,从而达到修改基因片段的目的。修复缺口的机制有两种,一种是内源性的非同源末端连接(Non-homologous end-joining,NHEJ),这是细胞自身的随机修复机制,易出现碱基的错配和丢失。另一种是同源重组修复(Homology-directed repair,HDR),即在有同源片段的条件下,外源的目的基因能通过同源重组整合入靶基因,降低了错误率。
1.1 ZFN技术第一代基因编辑技术是1996年出现的ZFN,用于动物基因的研究是从2002年ZFN成功用于果蝇基因组编辑时开始的,并在2003年开始了对人类细胞的基因编辑[3-5]。锌指蛋白(Zinc finger protein,ZFP)是一类通过Cys2-His2锌指结构域结合DNA的转录因子,由一个α螺旋和两个反向的β平行形成紧密的ββα结构,能特异性识别3个连续的碱基对。ZFN是通过设计锌指结构域以及多个锌指蛋白的不同连接顺序实现特异性结合靶标基因和限制性核酸内切酶Fok I进行定点切割的技术(图 1A)。值得注意的是,Fok I核酸酶需要形成二聚体才可切割DNA产生DSB,为避免Fok I自身二聚化,将Fok I设计为异源二聚体,这样的设计也增强了ZFN的结合特异性。目前ZFN可以通过HDR或NHEJ来修饰体细胞和多功能干细胞的基因组[6],该技术靶向结合效率高,但是蛋白设计复杂,费时费力,并且无法实现对任意靶基因的结合,也无法实现高通量的基因编辑。
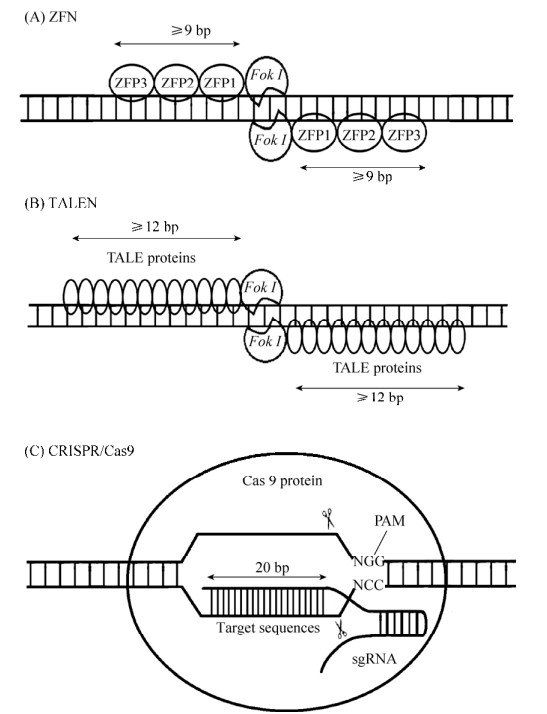 |
| 图 1 ZFN、TALEN及CRISPR/Cas9基因编辑技术 Fig. 1 ZFN, TALEN and CRISPR/Cas9 gene editing technology. |
| 图选项 |
1.2 TALEN技术第二代基因编辑技术是2010年出现的TALEN技术,通过2009年发现的TALE蛋白识别靶标序列,与ZFN类似,同样利用限制性核酸内切酶Fok I进行基因编辑[7-10](图 1B)。TALE蛋白由33–35个氨基酸的重复单元组成,通过位于12位和13位的两个可变氨基酸残基识别并结合DNA序列,这两个位点的氨基酸残基称为重复可变的双氨基酸残基(Repeat variable di-residue,RVD),每个重复单元能特异性识别一个碱基对。TALEN的唯一靶向限制是对N端结构有5'T的要求,因此,通过构建不同的RVD和改变TALE的连接顺序,理论上可以使TALEN被用于几乎任何的序列。TALEN在2011年开始用于人类细胞的基因编辑[11],目前可在人类多功能干细胞和体细胞中有效诱导NHEJ和HDR。与ZFN相比,TALEN的毒性低,蛋白设计相对简单,但是重复序列更多,工作量巨大,此外,TALEN的体积比ZFN更大,这使得某些病毒传递系统的包装较困难,也无法用于高通量的编辑。
1.3 CRISPR/Cas技术从2012年CRISPR/Cas9的体外重构到2013年实现对人类细胞的基因编辑,第三代基因编辑技术CRISPR/Cas9开启了基因编辑技术领域的新篇章[12-13]。
最初在1987年,日本科学家在研究细菌DNA结构时,发现大肠杆菌DNA中会存在一段重复结构[14],之后的时间里有人也发现了这些重复结构,并且在2002年将这些重复结构命名为CRISPR序列[15-16]。这段序列的功能探索持续了20年,直到2007年首次证实了该序列的功能是用于细菌免疫病毒感染[17]。当细菌首次感染病毒时,会将病毒DNA切下来一小段,并且插进自身基因中,为了标记这段插入的序列,前后会加一段重复序列结构,这是第一阶段适应期。当细菌再次遇到病毒侵袭时,CRISPR基因指导Cas9蛋白的表达和sgRNA的组装,sgRNA由经转录和剪切后成熟的CRISPR RNA (crRNA)和反转录式crRNA (Trans-activating crRNA,tracrRNA)组成,用于识别病毒,这是第二阶段表达期。如果和之前记录的病毒DNA一样,Cas9蛋白在sgRNA的引导下结合靶标DNA,并且进行所需要的切割,这是第三阶段干扰期。简而言之,CRISPR/Cas9技术通过sgRNA与靶标DNA中相对保守的PAM序列的上游基因互补配对,再经Cas9蛋白对靶标基因进行切割(图 1c),这种特异性的天然获得性免疫机理,称为CRISPR防御系统[18]。后来研究者意识到改造这个系统的sgRNA,使其与目标片段匹配,就可以精确地针对所有DNA。匹配完成后Cas9剪下DNA形成DBS,为避免NHEJ出现基因变异,可使用外源DNA模板进行HDR,对靶标基因进行目的修饰,从而实现精准基因编辑。而且人工改造过的CRISPR系统可以同时针对多个靶向基因,这在研究复杂的人类疾病上是一个巨大的进步。与ZFN和TALEN相比,CRISPR/Cas9设计简便、成本低、效率高,可用于高通量的基因编辑,但是依旧存在脱靶问题[19-20]。
目前CRISPR系统根据RNA和Cas蛋白的不同组合分为5种类型[21],“基因编辑婴儿”所用的CRISPR/Cas9技术也是目前应用最多的CRISPR Ⅱ型系统。
1.4 单碱基编辑技术2016年出现的单碱基编辑技术(Base editor, BE)目前已成为基因编辑技术的重要组成部分[22]。BE是在CRISPR/Cas9技术的基础上设计的,由sgRNA和融合蛋白组成,融合蛋白则为经过改造的Cas9、胞嘧啶脱氨酶和尿嘧啶糖基化酶抑制子的复合体。胞嘧啶脱氨酶可将胞嘧啶(Cytosine, C)脱氨基变为尿嘧啶(Uracil,U),在DNA复制过程中则变为胸腺嘧啶(Thymine,T)。尿嘧啶糖基化酶抑制子可抑制中间产物U的切除,增加了DNA链上C变为T的效率。经改造过的Cas9有两种类型,一种是无核酸内切酶活性的dCas9 (Catalytically dead Cas9),可结合靶基因但不切割靶基因,另一种是单链DNA切口活性的nCas9 (Cas9 nickase),两种Cas9蛋白均不会产生DBS,从而避免了NHEJ的错配,也不用考虑HDR的低效率问题。2017年实现的从A到G的BE技术进一步推进了通过点突变进行基因编辑的发展[23]。相信随着基因编辑技术的深入研究,未来会出现更多更加高效精准的基因编辑技术,其应用领域也必将越来越广阔。
2 基因编辑技术的应用2.1 农业和畜牧业在自然条件下,某些植株发生基因突变可能会生长更强壮、果实更加硕大,选择这些植株进行扩大培育也就是农作物培育选种的过程。为了缩短自然筛选的过程,最初生物学家用化学物质或者辐射诱导突变,但是诱导突变的过程耗时较长,并且准确度不高。基因工程技术的出现加速了农作物的选种过程,主要是通过引入外源性基因来控制植物体性状的表达从而获得的“转基因”植物,但是转基因食品的食用安全性一直是普通民众争议的话题。CRISPR/Cas9基因编辑技术的出现又让农作物的培育方式发生了改变,在无需引入外源性基因的条件下,直接定向修改植株本体基因,并且成本低、效率高,为培育性状优良的农作物提供了新的选择[24-25]。2017年3月美国农业部已经批准经过基因编辑技术诱导而产生突变的农作物不需要额外的监督管理,他们认为和传统的基因突变过程相似,转基因的农作物和传统育种无差别,但是欧盟目前还没有作出相关定论。同样在畜牧业中,基因编辑技术可以生产美味可口、营养价值高、质量更好的肉、蛋、奶等产品,但是其食用安全性方面目前并没有科学全面的评价。
2.2 生物医学领域基因编辑技术不断完善,为基因领域的研究提供了强有力的研究工具。目前已经建立了基于CRISPR/Cas9的基因表达调控系统[26-27],利用无酶切活性的dCas9与具有不同调节功能结构域的融合,能够抑制或激活目的基因的表达。其次,对于细胞动物模型的构建,基因编辑技术提供了更加简单的造模方法。例如,传统的小鼠模型构建方法是在小鼠胚胎干细胞引入突变,然后将突变成功的干细胞导入囊胚,而基因编辑技术可以直接在胚胎水平对靶基因进行修改,极大地提高了制作效率,目前已经成功运用于大鼠、小鼠、猴子等动物的基因修饰[28-30]。最重要的是,利用基因编辑技术进行基因治疗的研究在近几年进展飞速,通过基因编辑可以从根本上纠正受体有缺陷的基因,从而治疗某些疾病[31],例如在2019年,著名****张锋的基因组编辑公司(Editas Medicine)采用CRISPR/Cas9基因疗法,巧妙地去除由CEP290基因中的IVS26突变产生的异常剪接供体,使CEP290基因正常表达,最终成功恢复了Leber先天性黑蒙症10型的视力[32]。在癌症的治疗上,可通过编辑免疫细胞,增强免疫细胞的功能,使其能够识别并消灭癌细胞,Strimvelis、Kymriah和Yescarta这3个药物都是通过这种方法分别将基因药物整合到患者造血干细胞和T细胞再自体回输来进行癌症治疗的。近些年来基因编辑技术已经对白血病、淋巴瘤、肝癌、肺癌的治疗等展现出了初步的研究结果[33],但是其应用中的风险性也是不能被忽视的。2003年,在一项针对严重复合型免疫缺乏症(SCID)的基因治疗临床试验中,两名受试者在注射药物后患上了白血病。因此,在临床治疗中基因编辑技术还需要不断的探索和完善。另外,值得注意的是基因编辑技术在人类细胞水平和人类胚胎水平的探索和应用也要区别对待。“基因编辑婴儿”事件遭到了科学家们的一致批判与反对,在基因编辑技术尚不够成熟的基础上进行人类胚胎细胞的编辑,这是极其不负责任,在伦理学上也是决不允许的。
3 基因编辑技术的挑战3.1 技术缺陷CRISPR/Cas9技术的出现让基因领域的研究蓬勃发展,但是仍然存在一些技术缺陷需要完善。第一是脱靶效应,也就是识别到非靶标基因也会进行基因编辑,虽然已经有基于CRISPR/Cas9技术的多种衍生改良技术的出现,例如为降低脱靶效率设计的CRISPR/Cas9-nickase基因编辑技术[34]、CRISPR/Cas9-Fok I基因编辑系统[35]和能与Cas9系统实现功能互补的CRISPR/Cas12a基因编辑技术[36],还有能实现对RNA进行基因编辑的Cas13a、Cas13b、Cas13d系统[37-40],这些技术降低了脱靶率并且提高了精准度,但是依旧无法完全解决这个问题。脱靶效应是目前制约基因编辑技术发展的一个重要因素,也是亟待解决的核心问题。第二是效率问题,研究表明CRISPR/Cas9技术进行HDR相比NHEJ的效率低,仅为3.5%到15.6%[13, 41]。有研究显示HDR依赖于sgRNA和Cas9的浓度[42-43],但是提高sgRNA和Cas9的浓度会增加脱靶效应。因此,平衡sgRNA和Cas9的浓度,提高HDR的效率也是需要解决的问题之一。第三是运输问题,目前病毒载体广泛应用于CRISPR/Cas9技术,包括腺病毒载体(AdVs)、整合酶缺陷型慢病毒载体(IDLVs)和重组腺相关病毒载体(rAAVs),这些病毒载体都不会整合入宿主DNA中。IDLV载体容量较大,约10 kb,但是会持久表达Cas9加强脱靶效应。AdVs和rAAV具有低免疫原性和非致病性,缺点是容量较小,约4.5 kb,然而CRISPR-Cas9约为8–10 kb[44]。有研究使用两个独立的rAVV包装CRISPR-Cas9,但这种设计会影响CRISPR/Cas9技术的效率[45]。第四是免疫排斥,CRISPR/Cas9技术来源于原核生物天然获得性免疫系统,人类本身不具有Cas9蛋白,并且存在Cas9抗体[46-47],在基因治疗的过程中,外源性的蛋白以及病毒载体的导入会使机体产生免疫排斥,这必然会让研究者考虑到安全性的问题。第五是副作用,2018年有报道称CRISPR/Cas9高效编辑的同时伴随着人类p53基因的功能抑制[48-49],然而p53基因是人体重要的抑癌基因,这会增加癌细胞的逃逸机会,或让基因编辑过的细胞成为潜在癌细胞。另外,在2018年7月还有研究团队通过第三代测序技术大范围的基因型鉴定,发现CRISPR/Cas9会导致靶点附近大段基因组片段的丢失,甚至还有DNA重排问题[50],但是这个问题仅在细胞中出现,胚胎水平还没有相应大片段丢失的报道。综上所述,在众多技术问题,特别是脱靶效应还未得到明确的解决之前,基因编辑技术尚不能称之为成熟的基因工具。
3.2 伦理问题3.2.1 国内外基因编辑伦理规范的发展目前,国内外对基因编辑的边界和红线都达成了共识(表 1、2),对胚胎发育阶段或生殖系细胞进行体外基因编辑的研究是被允许的,但绝不能用于生殖的目的,而且其研究的过程需要政府主管部门进行严格的监管,流程需要公开透明。很显然目前“基因编辑婴儿”这一事件,突破了国内外共识。
表 1 国外对基因编辑技术的伦理规范Table 1 Ethical norms of gene editing technology abroad
| 时间与主体 | 事件 | 共识 |
| 2015年4月 黄军就团队 | 发表了全球第一篇利用CRISPR技术修改人类胚胎基因的报告[51],试验所使用的胚胎在14天后销毁 | 引起了伦理争议,但试验目的是科学上的有益探索,最终被各国科学家接受[52],并促成了相关国际伦理制约机制的建设 |
| 2015年12月1–3日 国际专家**** | 第一届人类基因组编辑国际峰会[53] | “目前为止,还不具备进行任何生殖细胞临床应用的条件”,应暂时禁止用于人类生殖相关细胞系的基因修饰和编辑”[54] |
| 2016年 R.Isas团队 | Science: Editing policy to fit the genome?[55] | 在人类胚胎干细胞研究中,加拿大、美国、法国、荷兰、澳大利亚的态度是:“政府密切监测在胚胎和生殖细胞中应用基因组技术,试图用胚胎或生殖细胞引发人类的怀孕是非法的”;英国、比利时、中国、韩国、日本、新加坡的态度是: “允许进行广泛的活动,通过相关机构颁发许可证或逐案批准的方式开展研究,但没有明确禁止潜在的临床应用,存在随意应用或不一致的风险” |
| 2017年 美国国家科学院 | 人类基因编辑的声明委员会就基因编辑提出了7条规范标准[56] | 1)没有其他替代手段;2)仅限于编辑已经被证实会致病或强烈影响疾病的基因;3)有关于手术的风险及潜在影响健康的可靠的临床前数据;4)试验期间受到严格监督;5)对基因编辑儿童长期、多代的跟访计划;6)反复评估可能的健康和社会风险、保持公众的参与决策权;7)可靠的监督机制,防止技术被另作他用 |
| 2018年11月 国际专家**** | 第二届人类基因组编辑国际峰会 | 体细胞基因编辑临床试验研究是值得赞赏的,但是任何胚胎或是生殖细胞基因编辑的临床试验是不负责任的。 |
| 2018年12月 FDA局长斯科特·戈特利布 | 利用CRISPR编辑人类胚胎或生殖系细胞应该被严厉监管,并且相关的研究应该被严格限制。 |
表选项
表 2 国内对基因编辑技术的伦理规范及态度声明Table 2 Domestic ethical norms for gene editing technology
| 时间与主体 | 文件 | 规定和态度表明 |
| 2003年 科技部和原卫生部 | 《人胚胎干细胞研究伦理指导原则》 | 利用体外受精、体细胞核移植、单性复制技术或遗传修饰获得的囊胚,其体外培养期限自受精或核移植开始不得超过14 d |
| 2016年12月1日 原卫生部 | 《涉及人的生物医学研究伦理审查办法》 | 涉及人的生物医学研究应当符合知情同意、控制风险等伦理原则。涉及人的生物医学研究的医疗卫生机构是涉及人的生物医学研究伦理审查工作的管理责任主体,应当设立伦理委员会,并采取有效措施保障伦理委员会独立开展伦理审查工作 |
| 2017年 科技部 | 《生物技术研究开发安全管理办法》 | 中国禁止以生殖为目的对人类配子、合子和胚胎进行基因操作 |
| 2018年11月29日 国家卫生健康委;科技部;中国科协 | 国家卫生健康委:“对违法违规行为坚决予以查处”科技部:“已要求有关单位暂停相关科研人员的科研活动”中国科协:“取消贺建奎第十五届‘中国青年科技奖’参评资格” | |
| 2018年11月30日 中国工程院 | 《THE LANCET》 | 对基因编辑婴儿事件,从伦理与道德方面,在严重缺乏科学评估验证,安全性存在不可预知风险的情况下,贸然开展以生殖为目的的人类生殖细胞基因编辑临床操作,严重违背了基本伦理规范和科学道德[57] |
| 2018年11月30日 中国医学科学院 | 《THE LANCET》 | 生殖细胞或早期胚胎的基因组编辑仍处于基础研究阶段,其安全性和有效性尚需全面评估。因此,科研机构和科研人员不应以生殖为目的,开展人体生殖细胞基因组编辑的临床操作,也不应资助相关研究[58] |
| 2018年11月30日 中国艾滋病研究中心 | 《THE LANCET》 | 坚决反对以生殖和预防艾滋病为目的开展针对人类健康生殖细胞和胚胎基因编辑的研究,呼吁相关政策和监管部门彻底调查此次事件,充分保护受试婴儿和家庭的个人隐私和合法权益[59] |
表选项
3.2.2 “基因编辑婴儿”的伦理讨论2015年4月,中山大学黄军就团队利用废弃胚胎进行基因编辑试验[51],这项试验能帮助探讨一些重大疾病在基因层面的成因,并有助于研究胚胎发育过程中基因所发挥的作用,而且试验所使用的胚胎也在14 d后销毁。尽管在当时引起了伦理上的争议,但是试验的目的是科学上的有益探索,试验的结果也是可控的,最终也是被各国的科学家所接受[52],最终促成了相关国际伦理制约机制的建立即第一届人类基因组编辑国际峰会的顺利召开[53]。2016年四川大学卢铀团队进行了癌症基因治疗的临床研究,将肺癌患者的T细胞经过基因编辑后重新注入患者体内,以达到治疗癌症的目的,当时同样引发了很多质疑,但都是在讨论技术安全性方面[60],因为未涉及人类生殖细胞,研究的结果是可控的。相反,前不久中国深圳科学家贺建奎跨过人类胚胎基因编辑技术的体外试验阶段,在胚胎上进行基因编辑并植入母体,最终有2名志愿者怀孕,且其中1名已经产下双胞胎女婴,另1名则仍在孕中。这一事件一经宣布,立即引起了世界的关注,科学家们对此事更多的是质疑和负面评价。首先,从技术层面上,CRISPR/Cas9技术并不是完美无缺的,技术上的缺陷带给了两个“基因编辑婴儿”未知的潜在健康风险。其次,在研究意义上,目前已经有很多种成熟的技术使艾滋病患者孕育健康的婴儿[61],例如父亲是艾滋病感染者,可通过高效抗病毒药物将父亲血液内病毒水平降低到无法检测即可备孕,或者通过体外洗精的方式进行体外受精。如果母亲是艾滋病感染者,可通过高效抗病毒药物治疗,安全助产和科学喂养的方式使传播几率降低到几乎为零,而基因编辑这种高风险的尝试是完全没必要的。科学研究应该优先考虑人类存在的本身意义,然后才是科学探索。
随着科技的发展和研究的深入,特别是“基因魔剪”CRISPR/Cas9技术的问世,基因编辑技术取得了长足的进步。CRISPR/Cas9能够高效率地为我们解决一些复杂问题,并且能够为科研工作者提供全新的视角,但是其潜在的长期安全有效性仍然需要合理并且全面的评价。科学的研究是需要经过长时间的检验的,特别是这种针对人体基因的编辑,它的影响是长远而且深刻的。随着科学技术的日益发展,人类的科研活动避免不了要触及伦理的敏感区,但是科学研究不能因此就停止探索的脚步,应该在科学判断和伦理考虑的基础上,建立起与科技发展相适应的伦理制度。
4 总结和展望最初,基因编辑技术的科学研究是为了治疗或者预防某些疾病,但是随着研究的不断深入,科研人员发现其应用于基因增强、“设计婴儿”等的无限可能。虽然基因编辑技术的无限潜力已经初步显现,但是,随之而来的潜在风险更要引起我们的反思。所以,只有加以控制并且合理地应用基因编辑技术才可能会造福于人类, 反之,没有原则的滥用则可能会带来难以控制的灾难性后果。因此,基因编辑技术的发展与应用必须遵循一定的生命伦理原则。另外,基因编辑技术目前还没有达到理想的水平,作为科研人员应该不断加强自身能力,去完善科学技术上的缺陷,才能最大程度上降低那些未知的风险。最后,科研工作也迫切需要建立相关的法律法规、完善的管理体制,并且要重视对科研人员的科研素养的培养,对可能有潜在风险的科学研究进行严格监管。同时,需要加强对普通民众的科学普及与教育,这次的“基因编辑婴儿”事件,“基因编辑”这个名词已经超出了受试者的认知词汇。因此,不断增强全社会的科研素养,培养树立科研安全意识,对科研的发展具有重要意义。在发展科学技术的同时,尽可能地去降低它带来的负面影响,才能运用科学技术更好地造福人类社会。
参考文献
| [1] | Ahmad HI, Ahmad MJ, Asif AR, et al. A review of CRISPR-based genome editing: survival, evolution and challenges. Curr Issues Mol Biol, 2018, 28: 47-68. |
| [2] | Musunuru K. The hope and hype of CRISPR-Cas9 genome editing: a review. JAMA Cardiol, 2017, 2(8): 914-919. DOI:10.1001/jamacardio.2017.1713 |
| [3] | Kim YG, Cha J, Chandrasegaran S. Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proc Natl Acad Sci USA, 1996, 93(3): 1156-1160. DOI:10.1073/pnas.93.3.1156 |
| [4] | Bibikova M, Golic M, Golic KG, et al. Targeted chromosomal cleavage and mutagenesis in Drosophila using zinc-finger nucleases. Genetics, 2002, 161(3): 1169-1175. |
| [5] | Porteus MH, Baltimore D. Chimeric nucleases stimulate gene targeting in human cells. Science, 2003, 300(5620): 763. DOI:10.1126/science.1078395 |
| [6] | Chandrasegaran S. Recent advances in the use of ZFN-mediated gene editing for human gene therapy. Cell Gene Ther Insights, 2017, 3(1): 33-41. |
| [7] | Christian M, Cermak T, Doyle EL, et al. Targeting DNA double-strand breaks with TAL effector nucleases. Genetics, 2010, 186(2): 757-761. DOI:10.1534/genetics.110.120717 |
| [8] | Li T, Huang S, Jiang WZ, et al. TAL nucleases (TALNs): hybrid proteins composed of TAL effectors and FokI DNA-cleavage domain. Nucleic Acids Res, 2011, 39(1): 359-372. DOI:10.1093/nar/gkq704 |
| [9] | Boch J, Scholze H, Schornack S, et al. Breaking the code of DNA binding specificity of TAL-type Ⅲ effectors. Science, 2009, 326(5959): 1509-1512. DOI:10.1126/science.1178811 |
| [10] | Moscou MJ, Bogdanove AJ. A simple cipher governs DNA recognition by TAL effectors. Science, 2009, 326(5959): 1501. DOI:10.1126/science.1178817 |
| [11] | Miller JC, Tan SY, Qiao GJ, et al. A TALE nuclease architecture for efficient genome editing. Nat Biotechnol, 2011, 29(2): 143-148. |
| [12] | Jinek M, Chylinski K, Fonfara I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 2012, 337(6096): 816-821. DOI:10.1126/science.1225829 |
| [13] | Mali P, Yang LH, Esvelt KM, et al. RNA-guided human genome engineering via Cas9. Science, 2013, 339(6121): 823-826. DOI:10.1126/science.1232033 |
| [14] | Ishino Y, Shinagawa H, Makino K, et al. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. J Bacteriol, 1987, 169(12): 5429-5433. DOI:10.1128/jb.169.12.5429-5433.1987 |
| [15] | Mojica FJM, Diez-Villasenor C, Soria E, et al. Biological significance of a family of regularly spaced repeats in the genomes of Archaea, Bacteria and mitochondria. Mol Microbiol, 2000, 36(1): 244-246. DOI:10.1046/j.1365-2958.2000.01838.x |
| [16] | Jansen R, Van Embden JDA, Gaastra W, et al. Identification of genes that are associated with DNA repeats in prokaryotes. Mol Microbiol, 2002, 43(6): 1565-1575. DOI:10.1046/j.1365-2958.2002.02839.x |
| [17] | Barrangou R, Fremaux C, Deveau H, et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science, 2007, 315(5819): 1709-1712. DOI:10.1126/science.1138140 |
| [18] | Makarova KS, Haft DH, Barrangou R, et al. Evolution and classification of the CRISPR-Cas systems. Nat Rev Microbiol, 2011, 9(6): 467-477. DOI:10.1038/nrmicro2577 |
| [19] | Chandrasegaran S, Carroll D. Origins of programmable nucleases for genome engineering. J Mol Biol, 2016, 428(5): 963-989. DOI:10.1016/j.jmb.2015.10.014 |
| [20] | Lu JN, Chu X, Pan YP, et al. Advances and challenges in gene editing technologies. Bull Chin Acad Sci, 2018, 33(11): 1184-1193 (in Chinese). 卢俊南, 褚鑫, 潘燕平, 等. 基因编辑技术:进展与挑战. 中国科学院院刊, 2018, 33(11): 1184-1193. |
| [21] | Makarova KS, Wolf YI, Alkhnbashi OS, et al. An updated evolutionary classification of CRISPR-Cas systems. Nat Rev Microbiol, 2015, 13(11): 722-736. DOI:10.1038/nrmicro3569 |
| [22] | Komor AC, Kim YB, Packer MS, et al. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature, 2016, 533(7603): 420-424. DOI:10.1038/nature17946 |
| [23] | Gaudelli NM, Komor AC, Rees HA, et al. Programmable base editing of A·T to G·C in genomic DNA without DNA cleavage. Nature, 2017, 551(7681): 464-471. DOI:10.1038/nature24644 |
| [24] | Mao MX, Stephen SH. CRISPR technology accelerate change the way we crops. World Sci, 2018, 479(11): 24-28 (in Chinese). 毛毛熊, 斯蒂芬·霍尔. CRISPR技术加速改变我们种植农作物的方式. 世界科学, 2018, 479(11): 24-28. |
| [25] | Yan F, Zhou HB. Overviews and applications of the CRISPR/Cas9 system in plant functional genomics and creation of new plant germplasm. Sci Sin Vitae, 2016, 46(5): 498-513 (in Chinese). 严芳, 周焕斌. CRISPR/Cas9技术在植物基因功能研究和新种质创制中的应用与展望. 中国科学:生命科学, 2016, 46(5): 498-513. |
| [26] | Qi LS, Larson MH, Gilbert LA, et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell, 2013, 152(5): 1173-1183. DOI:10.1016/j.cell.2013.02.022 |
| [27] | Gilbert LA, Larson MH, Morsut L, et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell, 2013, 154(2): 442-451. DOI:10.1016/j.cell.2013.06.044 |
| [28] | Shen B, Zhang J, Wu HY, et al. Generation of gene-modified mice via Cas9/RNA-mediated gene targeting. Cell Res, 2013, 23(5): 720-723. DOI:10.1038/cr.2013.46 |
| [29] | Shao YJ, Guan YT, Wang LR, et al. CRISPR/Cas-mediated genome editing in the rat via direct injection of one-cell embryos. Nat Protoc, 2014, 9(10): 2493-2512. DOI:10.1038/nprot.2014.171 |
| [30] | Niu YY, Shen B, Cui YQ, et al. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos. Cell, 2014, 156(4): 836-843. DOI:10.1016/j.cell.2014.01.027 |
| [31] | Ji HY, Zhu HZ. Progress of genome editing approaches towards gene therapy. Chin Bull Life Sci, 2015, 27(1): 71-82 (in Chinese). 季海艳, 朱焕章. 基因编辑技术在基因治疗中的应用进展. 生命科学, 2015, 27(1): 71-82. |
| [32] | Maeder ML, Stefanidakis M, Wilson CJ, et al. Development of a gene-editing approach to restore vision loss in Leber congenital amaurosis type 10. Nat Med, 2019, 25(2): 229-233. DOI:10.1038/s41591-018-0327-9 |
| [33] | Xie YF, Wang YM. Principles and applications of genome-editing technologies in cancer research. Chin J Cancer Biother, 2017, 24(8): 815-827 (in Chinese). 谢一方, 王永明. 基因编辑技术的原理及其在癌症研究中的应用. 中国肿瘤生物治疗杂志, 2017, 24(8): 815-827. |
| [34] | Liang PP, Ding CH, Sun HW, et al. Correction of β-thalassemia mutant by base editor in human embryos. Prot Cell, 2017, 8(11): 811-822. DOI:10.1007/s13238-017-0475-6 |
| [35] | Ran FA, Hsu PD, Lin CY, et al. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell, 2013, 154(6): 1380-1389. DOI:10.1016/j.cell.2013.08.021 |
| [36] | Guilinger JP, Thompson DB, Liu DR. Fusion of catalytically inactive Cas9 to Fok I nuclease improves the specificity of genome modification. Nat Biotechnol, 2014, 32(6): 577-582. DOI:10.1038/nbt.2909 |
| [37] | Zetsche B, Gootenberg JS, Abudayyeh OO, et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell, 2015, 163(3): 759-771. DOI:10.1016/j.cell.2015.09.038 |
| [38] | Abudayyeh OO, Gootenberg JS, Konermann S, et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science, 2016, 353(6299): aaf5573. DOI:10.1126/science.aaf5573 |
| [39] | Gootenberg JS, Abudayyeh OO, Lee JW, et al. Nucleic acid detection with CRISPR-Cas13a/C2c2. Science, 2017, 356(6336): 438-442. DOI:10.1126/science.aam9321 |
| [40] | Abudayyeh OO, Gootenberg JS, Essletzbichler P, et al. RNA targeting with CRISPR-Cas13. Nature, 2017, 550(7675): 280-284. DOI:10.1038/nature24049 |
| [41] | Hruscha A, Krawitz P, Rechenberg A, et al. Efficient CRISPR/Cas9 genome editing with low off-target effects in zebrafish. Development, 2013, 140(24): 4982-4987. DOI:10.1242/dev.099085 |
| [42] | Hwang WY, Fu Y, Reyon D, et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat Biotechnol, 2013, 31(3): 227-229. DOI:10.1038/nbt.2501 |
| [43] | Guo XG, Zhang TJ, Hu Z, et al. Efficient RNA/Cas9-mediated genome editing in Xenopus tropicalis. Development, 2014, 141(3): 707-714. DOI:10.1242/dev.099853 |
| [44] | Swiech L, Heidenreich M, Banerjee A, et al. In vivo interrogation of gene function in the mammalian brain using CRISPR-Cas9. Nat Biotechnol, 2014, 33(1): 102-106. |
| [45] | Ran FA, Cong L, Yan WX, et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature, 2015, 520(7546): 186-191. DOI:10.1038/nature14299 |
| [46] | Crudele JM, Chamberlain JS. Cas9 immunity creates challenges for CRISPR gene editing therapies. Nat Commun, 2018, 9(1): 3497. |
| [47] | Charlesworth CT, Deshpande PS, Dever DP, et al. Identification of pre-existing adaptive immunity to Cas9 proteins in humans. bioRxiv, 2018. |
| [48] | Haapaniemi E, Botla S, Persson J, et al. CRISPR-Cas9 genome editing induces a p53-mediated DNA damage response. Nat Med, 2018, 24(7): 927-930. DOI:10.1038/s41591-018-0049-z |
| [49] | Ihry RJ, Worringer KA, Salick MR, et al. p53 inhibits CRISPR-Cas9 engineering in human pluripotent stem cells. Nat Med, 2018, 24(7): 939-946. DOI:10.1038/s41591-018-0050-6 |
| [50] | Kosicki M, Tomberg K, Bradley A. Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements. Nat Biotechnol, 2018, 36(8): 765-771. DOI:10.1038/nbt.4192 |
| [51] | Liang PP, Xu YW, Zhang XY, et al. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Prot Cell, 2015, 6(5): 363-372. DOI:10.1007/s13238-015-0153-5 |
| [52] | Smargon AA, Cox DBT, Pyzocha NK, et al. Cas13b is a type Ⅵ-B CRISPR-associated RNA-guided rnase differentially regulated by accessory proteins Csx27 and Csx28. Mol Cell, 2017, 65(4): 618-630. DOI:10.1016/j.molcel.2016.12.023 |
| [53] | LaBarbera AR. Proceedings of the international summit on human gene editing: a global discussion-Washington, D.C., December 1-3, 2015. J Assist Reprod Genet, 2016, 33(9): 1123-1127. DOI:10.1007/s10815-016-0753-x |
| [54] | Zhao X, Zhao YZ. Dialogue Zhou Qi: Washington Consensus. Chin Sci Bull, 2016, 61(3): 283-284 (in Chinese). 赵欣, 赵迎泽. 对话周琪:华盛顿共识. 科学通报, 2016, 61(3): 283-284. |
| [55] | Isasi R, Kleiderman E, Knoppers BM. Editing policy to fit the genome?. Science, 2016, 351(6271): 337-339. DOI:10.1126/science.aad6778 |
| [56] | Hynes RO, Coller BS, Porteus M. Toward responsible human genome editing. JAMA, 2017, 317(18): 1829-1830. DOI:10.1001/jama.2017.4548 |
| [57] | Zhang BL, Chen ZN, Yi J, et al. Chinese Academy of Engineering calls for actions on the birth of gene-edited infants. Lancet, 2018, 393(10166): 25. |
| [58] | Wang C, Zhai XM, Zhang XQ, et al. Gene-edited babies: Chinese Academy of Medical Sciences' response and action. Lancet, 2018, 393(10166): 25-26. |
| [59] | Zhang LQ, Zhong P, Zhai XM, et al. Open letter from Chinese HIV professionals on human genome editing. Lancet, 2018, 393(10166): 26-27. |
| [60] | Cyranoski D. Chinese scientists to pioneer first human CRISPR trial. Nature, 2016, 535(7613): 476-477. DOI:10.1038/nature.2016.20302 |
| [61] | World Health Organization. Global guidance on criteria and processes for validation: elimination of mother-to-child transmission of HIV and syphilis. Geneva: World Health Organization, 2014. |
