

1. 西南大学 生物技术学院,重庆 400715;
2. 西南大学 生物学研究中心,重庆 400715
收稿日期:2019-01-15;接收日期:2019-04-11;网络出版时间:2019-05-27
基金项目:国家自然科学基金(Nos. 31772532, 31702184),重庆市基础与前沿研究计划(No. cstc2017jcyjAX0177),中央高校基本科研业务费专项基金(No. XDJK2018C011),西南大学博士基金(No. SWU116076)资助
摘要:鉴定并比较野蚕茧与家蚕茧的化学成分对于理解家蚕的驯化具有重要的意义。利用高温高压结合甲醇-水提取的方法获得蚕茧中的化学成分,利用UHPLC-MS技术对野蚕、家蚕大造品种和皓月品种3种蚕茧丝中的小分子成分进行鉴定和比较分析。通过阳离子模式和阴离子模式的UHPLC-MS获得了野蚕、大造和皓月蚕茧丝的代谢指纹图谱,对鉴定到的高丰度化合物进行注释,发现其中包括了氨基酸、黄酮、生物碱、萜类、有机酸和木脂素等成分。PLS-DA的得分图表明,野蚕、家蚕大造品种和皓月品种的3种蚕茧的代谢组存在显著差异。发现脯氨酸、亮氨酸/异亮氨酸和苯丙氨酸在大造茧中的含量显著高于在野蚕和皓月茧中的含量,黄酮类植物次生代谢物在大造茧中的含量显著提高,包括槲皮素、异槲皮素、槲皮素-3-O-槐糖苷、槲皮素-3-O-L-鼠李糖苷、槲皮素-3-O-芸香糖苷和山奈酚;而神经碱、白桥楼碱、毛果芸香次碱、美洲豚草内酯、线叶泽兰素和中缅木莲素等生物碱、萜类和木脂素类的植物次生代谢物在野蚕茧中的含量显著高于在家蚕茧中的含量。在紫外光的激发下观察黄酮的绿色荧光发现家蚕大造茧中的黄酮含量最高,家蚕皓月茧中的黄酮含量最低,而野蚕茧中的黄酮含量居中。生物碱和有机酸是良好的抗虫抗菌剂,它们在野蚕茧中的含量较高,能够提高野蚕茧的防护能力。黄酮类物质在家蚕大造茧中的含量较高,是导致家蚕大造茧呈黄绿色的主要原因。
关键词:家蚕野蚕蚕茧液相色谱-质谱生物碱黄酮
Comparison of chemical constituents of wild silkworm cocoon and domestic silkworm cocoon by UHPLC-MS technology
Yan Zhang1,2, Zhaoming Dong2, Dongchao Zhao2, Haoyun Li2, Lingyan Wang1,2, Ying Lin2, Ping Zhao2


1. College of Biotechnology, Southwestern University, Chongqing 400715, China;
2. Biological Science Research Center, Southwestern University, Chongqing 400715, China
Received: January 15, 2019; Accepted: April 11, 2019; Published: May 27, 2019
Supported by: National Natural Science Foundation of China (Nos. 31772532, 31702184), Chongqing Research Program of Basic Research and Frontier Technology (No. cstc2017jcyjAX0177), Fundamental Research Funds for the Central Universities of China (No. XDJK2018C011), PhD Start-up Foundation of Southwest University (No. SWU116076)
Corresponding author: Ping Zhao. Tel/Fax: +86-23-68250885; E-mail: zhaop@swu.edu.cn.
Abstract: Identifying and comparing the chemical constituents of wild silkworm cocoon and silkworm cocoon is of great significance for understanding the domestication of silkworm. In this study, we used high temperature and high pressure and methanol-water system to extract cocoon chemical constituents. We used UHPLC-MS to identify and compare cocoon chemical constituents of wild silkworm and domestic silkworm Dazao and Haoyue strains. The cocoon metabolic fingerprints of wild silkworm and domestic silkworm Dazao and Haoyue strains were obtained by using the UHPLC-MS in the positive ion mode and negative ion mode. By annotation, we found that cocoon chemical compounds with high abundances contained amino acids, flavonoids, alkaloids, terpenes, organic acids, and lignans. PLS-DA showed that the cocoon components were significantly different among the wild silkworm and two domestic silkworm strains Dazao and Haoyue. Proline, leucine/isoleucine and phenylalanine showed significantly higher abundances in the cocoon of domestic silkworm Dazao strain than in those of wild silkworm and domestic silkworm Haoyue strain. The flavonoid secondary metabolites are abundant in the Dazao cocoon, including quercetin, isoquercetin, quercetin 3-O-sophoroside, quercetin-3-O-α-L-rhamnoside, quercetin-3-O- rutinoside, and kaempferol. The other secondary metabolites, alkaloids, terpenes and lignans, showed higher abundances in the wild silkworm cocoon than in the domestic silkworm cocoon, including neurine, candicine, pilocarpidine, artemisiifolin, eupassopin, and eudesobovatol. By exposing cocoons to UV light and observing the green fluorescence of flavonoids, we found that Dazao cocoon had the most flavonoids, and Haoyue cocoon had least flavonoids and wild silkworm cocoon had mediate flavonoids. Alkaloids and organic acids are good anti-insect and antimicrobial agents, which have high abundance in the wild silkworm cocoon and could enhance the defense ability of wild silkworm cocoon. Flavonoids are abundant in the cocoon of domestic silkworm Dazao strain, which the main factors are leading to the yellow-green cocoon of Dazao.
Keywords: domestic silkworm (Bombyx mori)wild silkworm (Bombyx mandarina)cocoonliquid chromatograph-mass spectrometeralkaloidflavonoid
蚕丝主要是由丝素纤维以及包裹在丝素外层的丝胶所组成的。近年来的研究还从蚕丝中发现了酶、蛋白酶抑制剂和丝蕊(Seroin)等其他的蛋白质组分[1-5]。蚕丝中除了蛋白成分外,还含有一些其他物质,如糖类、蜡质、色素和无机成分等[6]。笔者所在的课题组利用气相色谱-质谱联用的方法从蚕茧丝中鉴定到了几十种化合物[7],发现它们对于保护蚕茧、提高蚕蛹的存活率有着重要作用。然而,由于气相色谱-质谱方法的局限性,导致所鉴定到的蚕茧化学成分并不全面,黄酮类等物质在蚕茧中含量较多却未被鉴定到。因此,利用其他方法全面解析蚕茧的小分子组分,比较分析野蚕茧和家蚕茧的化学成分差异,不仅有利于了解蚕茧中非蛋白组分的生物学功能,而且有利于深入理解驯化过程对于蚕丝组分的影响。
蚕丝的主要组分是丝素蛋白(Fibroin)和丝胶丝蕊蛋白。丝素是纤维蛋白,位于蚕丝的核心,约占丝重的70%–80%。丝胶是胶状的球蛋白,包裹着丝素,起着保护和胶黏的作用。除了丝素蛋白和丝胶外,蚕丝中还存在着蛋白酶抑制剂和丝蕊等抗微生物蛋白[1, 3, 8-9];Guo等[1]发现蚕丝中的蛋白酶抑制剂不仅对真菌蛋白酶表现出高效的抑制活性,还能够抑制白僵菌孢子的萌发。Singh等[9]发现蚕丝中的丝蕊具有抗细菌和抗病毒活性。蚕丝中除了蛋白成分外还含有一些小分子化学成分,它们的含量很少,大部分分布在丝胶中,它们的含量常因蚕的品种、产地、饲养条件、茧层层次而有所差别。Zhang等[7]利用GC-MS的方法从蚕茧丝中鉴定到了糖类、脂肪酸、氨基酸、有机酸和烃类等45种化合物,并且发现17种化合物在野蚕茧中的含量显著高于在家蚕茧中的含量,它们可能对于提高野蚕在野外恶劣环境中的存活率有着重要作用。蚕茧中的柠檬酸有抗菌的活性,而糖类、脂肪酸和长链烃类(蜡质)有防水保水的作用。蚕丝的颜色主要受类胡萝卜素和类黄酮色素的影响[10-17]。蚕丝中的类胡萝卜素包括叶黄素、紫黄质、β-胡萝卜素和α-胡萝卜素。不同茧色家蚕品种的丝腺偏向于积累某一种类的类胡萝卜素,红色茧中的β-胡萝卜素积累量最高,金色茧中的叶黄素积累量最高[18],而野蚕的黄色茧也是含有叶黄素的原因[19]。黄绿色茧丝中的主要色素是黄酮。Tamura等[21]从3种蚕茧中鉴定到了槲皮素-5, 4?-di-O-β-D-葡萄糖苷、槲皮素-5, 7, 4?- tri-O-β-D-葡萄糖苷[20]。黄酮可以提高蚕茧的抗紫外性能,从而增加蚕蛹的存活率。
近年来关于蚕丝蛋白组分的研究已经取得了较多进展,然而关于蚕丝中非蛋白组分的研究仍然较少。目前,气相色谱-质谱联用(GC-MS)和液相色谱-质谱联用(LC-MS)的技术被广泛地应用于鉴定动植物中的化学成分。两者具有不同的工作原理,适合于鉴定不同特性的化学成分。笔者之前的研究已经利用GC-MS的方法对蚕茧丝中的化合物进行了系统的鉴定[7]。为了更好地理解蚕茧丝中的非蛋白质成分的种类与作用,有必要利用LC-MS的方法对蚕茧丝化学成分进行全面的研究。
本研究利用UHPLC-MS方法对野蚕、家蚕大造品种和皓月品种3种蚕茧丝中的小分子成分进行鉴定和比较分析,揭示蚕茧丝中小分子物质的种类与作用,阐明驯化造成的野蚕茧和家蚕茧化学成分的差异及意义。
1 材料与方法1.1 材料与试剂家蚕大造品种和皓月品种由西南大学家蚕基因组生物学国家重点实验室提供。野桑蚕采集自重庆市长寿区。家蚕和野蚕用桑叶进行饲喂,实验材料为新鲜的蚕茧。甲醇、甲酸和乙腈购于Sigma公司。
1.2 蚕茧样品的前处理分别称取野蚕、大造和皓月蚕茧0.01 g,置于2 mL离心管,每管加纯化水200 μL,121 ℃高压2 h。将每管上清吸出置于新的1.5 mL离心管中,沉淀用400 μL 80%甲醇洗脱,将洗脱液与上述1.5 mL离心管合并,再补加800 μL甲醇,使甲醇终浓度为80%,4 ℃静置过夜。14 000×g离心15 min后吸上清浓缩干燥。每管加200 μL 80%甲醇复溶。瓶口用封口膜封住防止挥发,涡旋1 min,超声30 min,振荡5 min。14 000×g离心15 min,取180 μL上清置于质谱上样瓶中。
1.3 液质联用分析条件液相分离条件:Thermo Ultimate 3000超高效液相色谱仪(UHPLC,Thermo scientific),安捷伦- C18色谱柱(1.8 μm, 2.1 mm×100 mm)-阳离子模式下色谱柱;安捷伦-C18色谱柱(1.8 μm,2.1 mm× 100 mm)-阴离子模式下色谱柱。柱温50 ℃,0.1%甲酸-水A和0.1%甲酸-水的乙腈B梯度洗脱:0–1 min 0%–2% B,1–9 min 2%–40% B,9–20 min 40%–75% B,20–27 min 75%–98% B,27–32 min 98% B平衡柱5 min,32–37 min冲洗并平衡柱系统。流速0.2 mL/min,进样量10 μL,进行UHPLC-MS分析,每种蚕茧样品进行8次生物学重复实验。
质谱检测条件:Thermo Q-Exactive (Thermo scientific),ESI+电离模式下,电喷雾电压3 200 V,鞘气(N2)流速35 L/min,辅气(N2)流速5 L/min,传输管温度350 ℃,S-lens为60;ESI-电离模式下,电喷雾电压2 800 V,鞘气(N2)流速35 L/min,辅气(N2)流速5 L/min,传输管温度320 ℃,S-lens为60。质谱扫描范围150–2 000 m/z。
1.4 液质联用数据处理与分析代谢特征提取、滤噪及归一化:运行sieve程序进行代谢特征提取和色谱匹配。将原始代谢指纹数据导入到sieve程序,进行代谢特征提取,同样采用80%规则对峰表进行信号过滤,排除在多于20%实验组与对照组样品中响应值为“0”的代谢特征。之后将所有代谢特征的响应值进行面积归一化,抑制分析过程中质谱信号响应的漂移。按照代谢特征质谱响应信号的强度值进行缺失值补值。使用SIMCA-P 11.5软件进行多元统计分析,包括主成分分析(PCA)和偏最小二乘-判别分析(PLS-DA)。
在R语言环境下运行XCMS程序运行代谢特征提取和色谱匹配。将原始代谢指纹数据转化为NetCDF数据格式后,导入到XCMS程序。使用XCMS默认的xcmsSet算法进行代谢特征提取,代谢特征再经色谱匹配和缺失值补值。采用80%规则对峰表进行信号过滤,即排除在多于20%实验组与对照组样品中响应值为“0”的代谢特征。归一化主要是对样品的操作,由于样品间的化合物浓度差异较大或样品采集过程中容易产生差异,为了缓解这种不均一性,一般使用化合物的相对峰面积响应值,即每个化合物峰面积除以样品的总峰面积乘一个常数,由此来校正个体差异。按照代谢特征质谱响应信号的强度值进行缺失值补值。使用SIMCA-P 11.5软件进行多元统计分析,包括主成分分析(PCA)和偏最小二乘-判别分析(PLS-DA)。
2 结果与分析2.1 野蚕茧和家蚕茧化学成分的鉴定为了鉴定与比较不同蚕茧中的化学成分,我们选择了野蚕、家蚕大造品种和皓月品种3种蚕茧。皓月是我国推广量最大、推广面积最广的家蚕品种之一,其茧色发白、茧大且茧丝品质优良;大造是历史比较悠久的传统品种,其茧色黄绿,茧丝量较低;野桑蚕采集自重庆市长寿区野外,其茧色黄,茧小而丝量低。用80%的甲醇提取了3种蚕茧的化学成分,利用UHPLC-MS进行了8次生物学重复实验。通过阳离子模式和阴离子模式的UHPLC-MS对野蚕、大造和皓月蚕茧的提取物进行了分析,获得了3种蚕茧的代谢指纹图谱,如图 1A所示。在阳离子模式下(图 1A),大造茧中的化合物在1–8 min出现的峰与野蚕茧和皓月茧明显不同,峰更多且更高;同样,在阴离子模式下(图 1B),大造茧中的化合物在5–11 min也出现了比野蚕茧和皓月茧更多且更高的差异峰。
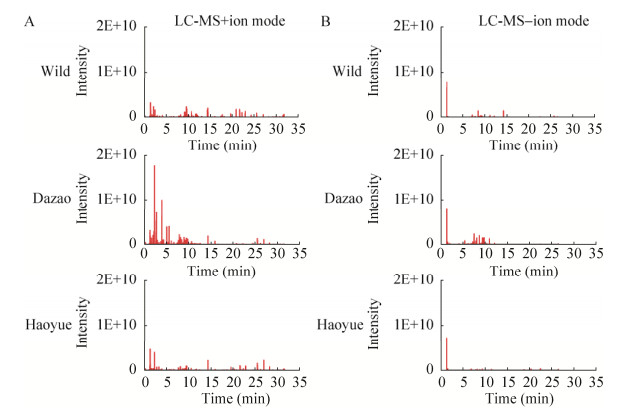 |
| 图 1 野蚕茧和家蚕茧的UHPLC-MS代谢指纹谱 Fig. 1 UHPLC-MS based metabolic profiles of wild silkworm cocoon and domestic silkworm cocoon. (A) +ion mode. (B) –ion mode |
| 图选项 |
对LC-MS中鉴定到的高丰度的化合物进行注释,发现其中包括了氨基酸(苯丙氨酸、亮氨酸/异亮氨酸、脯氨酸、甲基脯氨酸、乙酰丝氨酸和焦谷氨酸)、黄酮(槲皮素、异槲皮素、槲皮素- 3-O-槐糖苷、槲皮素-3-O-L-鼠李糖苷、槲皮素- 3-O-芸香糖苷、山奈酚)、生物碱(神经碱、甲基仙人掌碱、白桥楼碱、毛果芸香次碱)、萜类(线叶泽兰素、美洲豚草内酯)、有机酸(柠檬酸)和木脂素(中缅木莲素)等(表 1和表 2)。其中,阳离子模式的LC-MS鉴定到的主要化学成分是氨基酸和生物碱,阴离子模式的LC-MS鉴定到的主要化学成分是黄酮。
表 1 UHPLC-MS阳离子模式鉴定的野蚕茧和家蚕茧化学成分Table 1 UHPLC-MS +ion mode data for chemical constituents in wild silkworm cocoon and domestic silkworm cocoon
| Compound name | Ion | Rt (min) | Fragments (m/z) | Category |
| Neurine | +1H | 0.06 | 104 | Alkaloid |
| O-Acetyl-DL-serine | +1H | 1.31 | 148 | Amino acid |
| Neurine | +1H | 1.33 | 104 | Alkaloid |
| Allysine | +1H | 1.37 | 146 | Amino acid |
| Methylproline | +1H | 1.41 | 130 | Amino acid |
| Anhalinine | +NH4 | 1.41 | 241 | Alkaloid |
| Proline | +1H | 1.41 | 116 | Amino acid |
| Unknown | +1H | 1.71 | 215 | |
| Citric acid | +Na | 2.06 | 215 | Organic acid |
| Pyroglutamic acid | +1H | 2.23 | 130 | Amino acid |
| Leucine/Isoleucine | +1H | 2.36 | 132 | Amino acid |
| Unknown | +NH4 | 2.9 | 234 | |
| Phloroglucinol | +1H | 3.39 | 144 | |
| Indoline | +1H | 4.03 | 120 | |
| Phenylalanine | +1H | 4.06 | 166 | Amino acid |
| Unknown | +1H | 5.14 | 188 | |
| Unknown | +1H | 5.67 | 188 | |
| Unknown | +1H | 8.24 | 461 | |
| Isoquercetin | +1H | 9.05 | 465 | Flavonoid |
| Candicine | +K | 9.26 | 219 | Alkaloid |
| Eupassopin | +Na | 9.54 | 401 | Terpene |
| Unknown | +Na | 19.69 | 520 | |
| Unknown | +Na | 20.92 | 496 | |
| Eudesobovatol | +1H | 21.71 | 522 | Lignan |
| Unknown | +Na | 25.61 | 525 | |
| Unknown | +NH4 | 27.12 | 524 | |
| Unknown | +1H | 28.38 | 524 |
表选项
表 2 UHPLC-MS阴离子模式鉴定的野蚕茧和家蚕茧化学成分Table 2 UHPLC-MS -ion mode data for chemical constituents in wild silkworm cocoon and domestic silkworm cocoon
| Compound name | Ion | Rt (min) | Fragments (m/z) | Category |
| Heterocladol | -1H | 1.4 | 335 | |
| Unknown | -1H | 1.4 | 383 | |
| Unknown | -1H | 1.4 | 193 | |
| Citric acid | -1H | 1.4 | 191 | Organic acid |
| Unknown | -1H | 1.4 | 191 | |
| Unknown | -1H | 1.5 | 405 | |
| Unknown | -1H | 1.6 | 276 | |
| Unknown | -1H | 5.4 | 315 | |
| Unknown | -1H | 7.2 | 349 | |
| Quercetin 3-O-sophoroside | -1H | 7.2 | 625 | Flavonoid |
| Rutin (quercetin-3-O-rutinoside) | -1H | 7.4 | 609 | Flavonoid |
| Unknown | -1H | 7.6 | 315 | |
| Unknown | -1H | 8.0 | 433 | |
| Unknown | -1H | 8.2 | 403 | |
| Unknown | -1H | 8.5 | 351 | |
| Isoquercetin | -1H | 8.8 | 463 | Flavonoid |
| Unknown | -1H | 9.2 | 681 | |
| Unknown | -1H | 9.4 | 567 | |
| Eupassopin | -1H | 9.4 | 377 | Alkaloid |
| Unknown | -1H | 9.4 | 519 | |
| Quercitrin (Quercetin-3-O-α-L-rhamnoside) | -1H | 9.5 | 447 | Flavonoid |
| Unknown | -1H | 9.6 | 415 | |
| Unknown | -1H | 9.8 | 417 | |
| Unknown | -1H | 9.9 | 417 | |
| Quercetin | -1H | 11.0 | 301 | Flavonoid |
| Artemisiifolin | -1H | 11.3 | 263 | Terpene |
| Kaempferol | -1H | 12.2 | 285 | Flavonoid |
| Unknown | -1H | 14.3 | 421 | |
| Unknown | -1H | 22.6 | 480 | |
| Pilocarpidine | -1H | 25.9 | 193 | Alkaloid |
表选项
2.2 野蚕茧和家蚕茧中化学成分的比较分析从PLS-DA的得分图可以看出,阳离子模式下(图 2A)3种蚕茧样品各自聚集在一起,且相互距离较远,说明3种蚕茧的化学成分差异较大;大造蚕茧和皓月蚕茧的组内的各个生物学重复距离很近,表明其组内样品间的差异很小;而野蚕茧的各次生物学重复之间距离很远,表明其野蚕茧组内样品间的差异较大。阴离子模式(图 2B)下的聚类结果和阳离子模式相似:3种蚕茧的成分差异很大,大造蚕茧和皓月蚕茧的组内差异较小,而野蚕茧的组内差异较大。
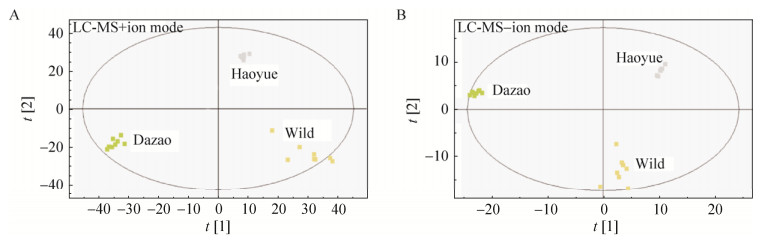 |
| 图 2 野蚕茧和家蚕茧UHPLC-MS代谢数据PLS-DA分析的得分图 Fig. 2 Score plot of PLS-DA analysis of UHPLC-MS based metabolic profiles of wild silkworm cocoon and domestic silkworm cocoon |
| 图选项 |
野蚕、家蚕大造品种和皓月品种的3种蚕茧的化学成分分别存在显著差异(图 2)。对它们中含有的各类化合物进行比较分析后发现,脯氨酸、亮氨酸/异亮氨酸和苯丙氨酸在大造茧中的含量显著高于在野蚕和皓月茧中的含量(图 3);黄酮类植物次生代谢物在大造茧中的含量更高,包括槲皮素、异槲皮素、槲皮素-3-O-槐糖苷、槲皮素-3-O-L-鼠李糖苷、槲皮素-3-O-芸香糖苷和山奈酚(图 3);而神经碱、白桥楼碱、毛果芸香次碱、美洲豚草内酯、线叶泽兰素和中缅木莲素等生物碱、萜类和木脂素类的植物次生代谢物在野蚕茧中的含量显著高于在家蚕茧中的含量(图 4)。
 |
| 图 3 三种氨基酸和六种黄酮在家蚕大造茧中的含量比在野蚕茧和家蚕皓月茧中的含量更高 Fig. 3 Three amino acids and six flavonoids showed higher levels in the cocoon of domestic silkworm strain Dazao than in the cocoon of wild silkworm and domestic silkworm Haoyue. The y-axis represents the compound abundance, which is the value of the peak area computed by the software XCMS. *P < 0.05; **P < 0.01; ***P < 0.001 |
| 图选项 |
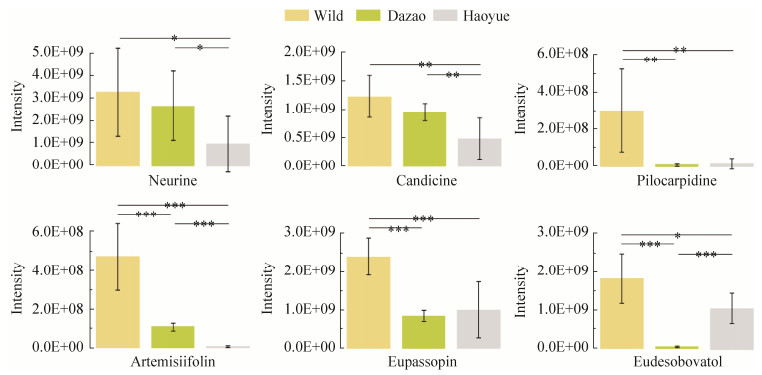 |
| 图 4 六种次生代谢物在野蚕茧中的含量比在家蚕茧中的含量更高 Fig. 4 Six secondary metabolites showed higher levels in the wild silkworm cocoon than in the domestic silkworm cocoon. The y-axis represents the compound abundance, which is the value of the peak area computed by the software XCMS. *P < 0.05; **P < 0.01; ***P < 0.001 |
| 图选项 |
阳离子以及阴离子模式的LC-MS都鉴定到了柠檬酸,我们之前的研究利用GC-MS的方法也从蚕茧中鉴定到了柠檬酸[7],并且得到了相同的结果,即发现柠檬酸在野蚕茧中的含量最高,在大造茧中的含量次之,在皓月茧中的含量最少。阳离子模式的LC-MS鉴定到了脯氨酸,和GC-MS的结果一致[7],都发现脯氨酸在大造茧中的含量更高。阳离子以及阴离子模式的LC-MS都鉴定到了线叶泽兰素和异槲皮素(表 1和表 2),并且两种结果都显示线叶泽兰素在野蚕茧中的含量显著更高,而异槲皮素在大造茧中的含量显著更高。我们通过不同方法得到了相似的结果,证实了结果的可靠性。
2.3 蚕茧黄酮的荧光检测含黄酮较多的家蚕大造茧在普通光下呈黄绿色,而在紫外光(235 nm)的激发下呈现出很强的黄绿色荧光(图 5);家蚕皓月茧的黄酮含量很低,在普通光下呈白色,在紫外光下发出很弱的蓝色荧光(图 5);野蚕茧的黄酮含量居中,在普通光下呈深黄色,在紫外光的激发下发出浅绿色荧光(图 5)。同样我们还观察了蚕茧在蓝光(488 nm)和绿光(543 nm)激发下的荧光,但所能观察到的荧光都非常微弱。可见,在紫外光激发下黄酮的绿色荧光可以初步判断蚕茧中黄酮的含量。
 |
| 图 5 野蚕茧丝、家蚕大造茧丝和皓月茧丝在紫外光下的显微图像 Fig. 5 Microscopic images of cocoon silk after exposure to UV light |
| 图选项 |
3 讨论之前的研究发现蚕丝的蛋白质成分复杂多样[5],其中包含了大量的酶类,如氧化酶、转移酶和水解酶等,它们催化的底物和产物大多是小分子,再加上蚕丝中还存在多种小分子转运蛋白,因此我们认为蚕丝中包含的小分子成分可能也非常复杂。然而目前只有非常少的研究关注于蚕丝的小分子物质,且这些报道多关注于蚕丝中的色素物质。为了揭示蚕丝小分子成分的类型与生物学功能,2017年我们利用了GC-MS对蚕丝的小分子成分进行了鉴定,发现了蚕丝中有糖类、脂类、氨基酸、烷烃、有机酸等小分子[7]。在本研究中,我们利用了基于LC-MS的技术,对蚕丝的小分子成分进行了鉴定,发现了蚕丝中有氨基酸、有机酸、黄酮、生物碱、萜类等小分子物质,与我们之前用GC-MS的鉴定结果有着明显的差异。我们发现,GC-MS与LC-MS技术适合于鉴定不同类型的化合物,GC-MS适合于鉴定可挥发且热稳定的、极性较小的化合物,比如脂类、蜡质等;而LC-MS适合于检测黄酮、生物碱等极性较大的化合物。氨基酸和有机酸是两者都擅长鉴定的物质。结合GC-MS与LC-MS两种技术可以更全面地解析样品中的化学成分。
我们之前的研究通过比较野蚕、家蚕大造品种和皓月品种的蚕茧,发现很多小分子物质在野蚕茧中的含量都显著高于在家蚕茧中的含量,比如有机酸、脂肪酸、醛糖、糖醇和短链烃类[7],而本研究发现生物碱在野蚕茧中的含量也显著高于在家蚕茧中的含量,这可能是由于野蚕的吐丝量低导致茧层比较薄,并且野蚕所处的环境更加恶劣,因此,野蚕茧中更多小分子物质的存在可能是为了加强茧对蛹的保护能力。糖类和脂肪酸在野蚕茧中的含量较高,而氨基酸在野蚕茧中的含量较低,表明糖类和脂类物质在野蚕丝腺中的代谢更活跃。糖、脂等物质的代谢为丝蛋白的合成提供了能量,同时它们分泌到体外后,在蚕茧中可能也发挥着重要的作用。
本研究首次在蚕茧中鉴定到了生物碱[22-23]、萜类[24-25]和木脂素[26-27],它们可能是在桑叶的次生代谢中形成,然后被蚕摄取后吸收进入了丝腺进而分泌到了蚕茧中。我们发现生物碱和有机酸在野蚕茧中的含量很高,它们都是良好的抗虫抗菌剂[28-31],对野蚕茧较差的防护能力能起到很好的弥补作用。
黄酮是另一类植物次生代谢产物,在大造茧中的含量更高,这与之前的研究结果类似,研究者们普遍认为大造茧的黄绿色是源于其中含有的黄酮类物质[32]。皓月茧中几乎不含有黄酮而含有蓝色的荧光物质,所以显示为蓝色,但是蓝色荧光物质至今仍未被阐明[32]。蚕茧中的黄酮来源于桑叶,但是有的黄酮在家蚕体内经过了部分修饰[33],导致其活性发生了变化。黄酮可以提高蚕茧的抗紫外性能,从而增加蚕蛹的存活率[21]。有很多研究发现黄酮是在植物中起防御性的次生物质,对昆虫的发育和生长有抑制作用。昆虫也进化出了多种适应机制来对抗植物中的黄酮,例如家蚕体内存在大量的解毒酶系,包括参与初级代谢的细胞色素P450单加氧酶和羧酸酯酶,参加次级代谢的谷胱甘肽转移酶和葡萄糖醛酸基转移酶等[34],它们的大量表达可以解毒槲皮素和芦丁等次生物质。槲皮素被家蚕吸收以后,在中肠和丝腺中被家蚕的UDP-葡萄糖基转移酶(Bm-UGT10286)催化形成了槲皮素-5-O-葡萄糖苷[33],推测黄酮的糖基化修饰是为了降低其对家蚕组织器官的毒性[35]。
4 结论利用UHPLC-MS技术从蚕茧中鉴定到了氨基酸、有机酸、黄酮、生物碱和萜类等化合物,发现有机酸、生物碱、萜类等物质在野蚕茧中的含量比在家蚕茧中的含量更高。生物碱和有机酸是良好的抗虫抗菌剂,能够提高野蚕茧的防护能力。氨基酸和黄酮类物质在家蚕大造茧中的含量比在野蚕茧和家蚕皓月茧中的含量更高。黄酮类物质是导致家蚕大造茧呈黄绿色的主要原因。
参考文献
| [1] | Guo XM, Dong ZM, Zhang Y, et al. Proteins in the cocoon of silkworm inhibit the growth of Beauveria bassiana. PLoS ONE, 2016, 11(3): e151764. |
| [2] | Dong ZM, Zhao P, Zhang Y, et al. Analysis of proteome dynamics inside the silk gland lumen of Bombyx mori. Sci Rep, 2016, 6: 21158. DOI:10.1038/srep21158 |
| [3] | Dong ZM, Song QR, Zhang Y, et al. Structure, evolution, and expression of antimicrobial silk proteins, seroins in lepidoptera. Insect Biochem Mol Biol, 2016, 75: 24-31. DOI:10.1016/j.ibmb.2016.05.005 |
| [4] | Zhang Y, Zhao P, Dong ZM, et al. Comparative proteome analysis of multi-layer cocoon of the silkworm, Bombyx mori. PLoS ONE, 2015, 10(4): e123403. |
| [5] | Dong ZM, Zhao P, Wang C, et al. Comparative proteomics reveal diverse functions and dynamic changes of Bombyx mori silk proteins spun from different development stages. J Proteome Res, 2013, 11(12): 5213-5222. |
| [6] | Mondal M, Trivedy K, Kumar SN. The silk proteins, sericin and fibroin in silkworm, Bombyx mori Linn.-a review. Caspian J Env Sci, 2007, 5(2): 63-76. |
| [7] | Zhang Y, Zhao DC, Meng Z, et al. Wild silkworm cocoon contains more metabolites than domestic silkworm cocoon to improve its protection. J Insect Sci, 2017, 17(5): 105. |
| [8] | Li YS, Liu HW, Zhu R, et al. Protease inhibitors in Bombyx mori silk might participate in protecting the pupating larva from microbial infection. Insect Sci, 2016, 23(6): 835-842. DOI:10.1111/1744-7917.12241 |
| [9] | Singh CP, Vaishna RL, Kakkar A, et al. Characterization of antiviral and antibacterial activity of Bombyx mori seroin proteins. Cell Microbiol, 2014, 16(9): 1354-1365. DOI:10.1111/cmi.12294 |
| [10] | Oku M. On the natural pigments of raw silk fibre of the domestic cocoon. (Part VII): on the pigments of the green cocoon (Bombyx mori, var. Seihaku). Bull Agric Chem Soc Jpn, 1934, 10(10/12): 158-160. |
| [11] | Oku M. On the natural pigments of raw silk fibre of the domestic cocoon. (Part VIII): isoquercitrin from mulberry leaves. Bull Agric Chem Soc Jpn, 1934, 10(10/12): 164-166. |
| [12] | Oku M. On the natural pigments of row silk fibre of the domestic cocoon. (Part VI): fading of the yellow cocoon. Bull Agric Chem Soc Jpn, 1933, 9(7/9): 93. |
| [13] | Oku M. On the natural pigments of raw silk fibre of the domestic cocoon. (Part V): detection of violaxanthin in the yellow cocoon. Bull Agric Chem Soc Jpn, 1933, 9(4/6): 91-92. |
| [14] | Oku M. On the natural pigments of raw silk fibre of the domestic cocoon. (Part IV): carotin and xanthophyllesters. Bull Agric Chem Soc Jpn, 1932, 8(7/9): 89. |
| [15] | Oku M. On the natural pigments of raw silk fibre of the domestic cocoon. (Part III): melting point of cocoon xanthophyll. Bull Agric Chem Soc Jpn, 1932, 8(1/3): 7-8. |
| [16] | Oku M. On the natural pigments of raw silk fibre of the domestic cocoon. (Part II): xanthophyll of mulberry leaves as a source of yellow cocoon xanthophyll. Bull Agric Chem Soc Jpn, 1930, 6(10/12): 104-105. |
| [17] | Oku M. On the natural pigments of raw silk fibre of the domestic cocoon. (Part I): xanthophyll of the yellow cocoon. Bull Agric Chem Soc Jpn, 1929, 5(10/12): 81-82. |
| [18] | Tang H. 2011. The main pigment accumulation pattern of different yellow-red cocoons strains in Bombyx mori[D]. Chongqing: Southwest University, 2011(in Chinese). 唐辉.家蚕黄红茧系不同品种主要呈色色素的积累规律研究[D].重庆: 西南大学, 2011. |
| [19] | Tsuchida K, Arai M, Tanaka Y, et al. Lipid transfer particle catalyzes transfer of carotenoids between lipophorins of Bombyx mori. Insect Biochem Mol Biol, 1998, 28(12): 927-934. DOI:10.1016/S0965-1748(98)00036-8 |
| [20] | Tamura Y, Nakajima K, Nagayasu KI, et al. Flavonoid 5-glucosides from the cocoon shell of the silkworm, Bombyx mori. Phytochemistry, 2002, 59(3): 275-278. |
| [21] | Daimon T, Hirayama C, Kanai M, et al. The silkworm Green b locus encodes a quercetin 5-O-glucosyltransferase that produces green cocoons with UV-shielding properties. Proc Natl Acad Sci USA, 2010, 107(25): 11471-11476. DOI:10.1073/pnas.1000479107 |
| [22] | Wang TT, Ma TY, Li Q, et al. Research progress in Mori folium. Food Drug, 2018, 20(5): 390-393 (in Chinese). 王婷婷, 马天宇, 李琪, 等. 桑叶化学成分及生物活性研究进展. 食品与药品, 2018, 20(5): 390-393. DOI:10.3969/j.issn.1672-979X.2018.05.019 |
| [23] | Gu GY. Advances in research on chemical constituents and biological activities of mulberry. World Phytomed, 2007, 22(1): 12-17 (in Chinese). 顾关云. 桑的化学成分和生物活性研究进展. 国外医药:植物药分册, 2007, 22(1): 12-17. |
| [24] | Liu ZM, Wang HY, Liu SS, et al. Volatile components of essential oil from mulberry variety "Longsang 1" leaves. Nat Prod Res Dev, 2011, 23(6): 1069-1072, 1084 (in Chinese). 刘志明, 王海英, 刘姗姗, 等. 龙桑一号桑叶精油的挥发性组分. 天然产物研究与开发, 2011, 23(6): 1069-1072, 1084. DOI:10.3969/j.issn.1001-6880.2011.06.019 |
| [25] | Lei W, Tang SH, Zhou QG, et al. Bioinformatics analysis of 3-hydroxy-3-methylglutaryl-CoA reductase (HMGR) in isoprenoid biosynthesis of mulberry. Sci Sericult, 2008, 34(3): 393-399 (in Chinese). 雷桅, 汤绍虎, 周启贵, 等. 桑萜类生物合成酶HMGR的生物信息学分析. 蚕业科学, 2008, 34(3): 393-399. DOI:10.3969/j.issn.0257-4799.2008.03.003 |
| [26] | Zhao M, Chen CC, Yang SQ, et al. Chemical constituents from leaves of Morus alba Linn. Chin Tradit Patent Med, 2012, 34(6): 1126-1131 (in Chinese). 赵明, 陈城城, 杨森桥, 等. 白桑叶化学成分研究. 中成药, 2012, 34(6): 1126-1131. DOI:10.3969/j.issn.1001-1528.2012.06.034 |
| [27] | Chen CC. Study on chemical constituents of the leaves of Morus alba linn[D]. Qiqihar: Qiqihar University, 2012(in Chinese). 陈城城.桑叶化学成分研究[D].齐齐哈尔: 齐齐哈尔大学, 2012. |
| [28] | Zhang J, Tian ZG, Wang JH, et al. Advances in antimicrobial molecular mechanism of organic acids. Acta Vet Zootechn Sin, 2011, 42(3): 323-328 (in Chinese). 张军, 田子罡, 王建华, 等. 有机酸抑菌分子机理研究进展. 畜牧兽医学报, 2011, 42(3): 323-328. |
| [29] | Zheng GY, Liang LY, Yang YQ, et al. The material basis of tea tree resistance. J Tea Bus, 2008, 30(1): 16-18 (in Chinese). 郑高云, 梁丽云, 杨云秋, 等. 茶树抗虫性的物质基础. 茶业通报, 2008, 30(1): 16-18. |
| [30] | Li Y, Zuo GY. Advances in studies on antimicrobial activities of alkaloids. Chin Tradit Herbal Drugs, 2010, 41(6): 1006-1014 (in Chinese). 李杨, 左国营. 生物碱类化合物抗菌活性研究进展. 中草药, 2010, 41(6): 1006-1014. |
| [31] | Chen YL, Yuan XH, Hou DB. Study on chemical composition of diterpenoid alkaloids and insecticidal activity form Aconitum camichaeli debx. J Anhui Agric Sci, 2009, 37(10): 4536-4537, 4540 (in Chinese). 陈亚玲, 袁小红, 侯大斌. 生附子中二萜生物碱化学成分及其杀虫活性的研究. 安徽农业科学, 2009, 37(10): 4536-4537, 4540. DOI:10.3969/j.issn.0517-6611.2009.10.072 |
| [32] | Zheng XJ, Yu XH. Quality studies on cocoon filament from different fluorescent colour cocoons of Bombyx mori. J Text Res, 2001, 22(4): 21-23 (in Chinese). 郑小坚, 虞晓华. 不同荧光色家蚕茧的茧丝质研究. 纺织学报, 2001, 22(4): 21-23. DOI:10.3321/j.issn:0253-9721.2001.04.008 |
| [33] | Hirayama C, Ono H, Tamura Y, et al. Regioselective formation of quercetin 5-O-glucoside from orally administered quercetin in the silkworm, Bombyx mori. Phytochemistry, 2008, 69(5): 1141-1149. DOI:10.1016/j.phytochem.2007.11.009 |
| [34] | Zhang YE. Induction of detoxifying enzyes by quercetin and rutin in the silkworm[D]. Chongqing: Chongqing University, 2012(in Chinese). 张月娥.槲皮素和芦丁在家蚕幼虫中对解毒酶的诱导模式[D].重庆: 重庆大学, 2012. |
| [35] | Xu X, Wang M, Wang Y, et al. Green cocoons in silkworm Bombyx mori resulting from the quercetin 5-O-glucosyltransferase of UGT86, is an evolved response to dietary toxins. Mol Biol Rep, 2013, 40(5): 3631-3639. DOI:10.1007/s11033-012-2437-7 |
