
 , 夏宁邵2,3
, 夏宁邵2,3 1. 厦门大学 生命科学学院,福建 厦门 361102;
2. 厦门大学 公共卫生学院,福建 厦门 361102;
3. 国家传染病诊断试剂与疫苗工程技术研究中心,福建 厦门 361102
收稿日期:2019-01-15;接收日期:2019-03-25
基金项目:国家自然科学基金(No. 81672023)资助
摘要:细胞穿膜肽(Cell-penetrating peptides,CPPs)是一类能够穿过细胞膜或组织屏障的短肽。CPPs可通过内吞和直接穿透等机制运载蛋白质、RNA、DNA等生物大分子进入细胞内发挥其效应功能。相比于其他非天然的化学分子,CPPs具有生物相容性佳、对细胞造成的毒性小、完成入胞转运后可降解、并能与生物活性蛋白直接融合重组表达等优点,因此成为以胞内分子为靶标的药物递送技术发展的重要工具,并在生物医学研究领域具有良好的应用前景。文中针对CPPs的分类特点、入胞转运机制及其治疗应用的新近研究进展进行综述和讨论。
关键词:细胞穿膜肽内化机制入胞递送系统
Advances in the research and application of cell penetrating peptides
Yangyang Xie1,3, Shaojuan Wang2,3, Quan Yuan2,3

 , Ningshao Xia2,3
, Ningshao Xia2,3 1. School of Life Sciences, Xiamen University, Xiamen 361102, Fujian, China;
2. School of Public Health, Xiamen University, Xiamen 361102, Fujian, China;
3. National Institute of Diagnostics and Vaccine Development in Infection Diseases, Xiamen University, Xiamen 361102, Fujian, China
Received: January 15, 2019; Accepted: March 25, 2019
Supported by: National Natural Science Foundation of China (No. 81672023)
Corresponding author: Quan Yuan. Tel/Fax: +86-592-2880627; E-mail: yuanquan@xmu.edu.cn.
Abstract: Cell-penetrating peptides (CPPs) are short peptides that can penetrate the cell membrane or tissue barrier. CPPs can deliver a variety of biomacromolecules, such as proteins, RNA and DNA, into cells to produce intracellular functional effects. Endocytosis and direct penetration have been suggested as the two major uptake mechanisms for CPPs-mediated cargo delivery. Compared with other non-natural chemical molecules-based delivery reagents, the CPPs have better biocompatibility, lower cytotoxicity, are easily degraded after cargo delivery, and can be fused and recombined expressed with bioactive proteins. Because of these advantages, the CPPs have become an important potential tool for delivery of developing drugs which targets intracellular factors. As a novel delivery tool, the CPPs also show promising application prospects in biomedical researches. This review summarized recent advances regarding the classification characteristics, the cellular uptake mechanisms and therapeutic application potentials of CPPs.
Keywords: cell-penetrating peptidescellular uptake mechanismscell-penetrating delivery system
以单克隆抗体(Monoclonal antibodies,mAbs)为代表的生物大分子药物以其靶向特异性和高效性在恶性肿瘤、自身免疫病等重大疾病的治疗中发挥了重要作用。但是,单抗类药物由于分子量大,超过了Lipinski规则的限制[1],不能穿过细胞膜进入细胞内发挥作用,只能用于识别和靶向细胞表面靶标和分泌性蛋白靶标。然而,人类细胞中位于细胞膜表面的蛋白和能够分泌到细胞外的蛋白编码基因仅为6 000–7 000个,仅占全部编码基因的20%不到,大量潜在的疾病治疗靶标位于细胞内部,不能使用蛋白分子进行靶向干预,极大地限制了单抗的应用范围。此外,基因治疗等新兴治疗技术也需要解决核酸(DNA、RNA)等生物大分子的细胞导入问题。因此,药物无法到达指定的细胞且进入细胞内是生物大分子药物进一步拓展应用可及性的主要障碍。多年来,研究者发展了多种可使生物大分子药物穿过细胞膜的入胞转运技术,主要包括显微注射技术、电穿孔技术、脂质体和基于病毒的载体基因转导技术。此类技术已经能较好地实现核酸大分子的体内外入胞,但并不适用于蛋白转导,此外还存在入胞效率低、细胞毒性、特异性差等缺点。1988年,两个独立研究团队首次报道了人类免疫缺陷病毒(Human immunodeficiency virus,HIV)中的反式转录激活因子(Transactivator, TAT),能够有效穿过细胞膜进入细胞内[2]。1994年,英国剑桥大学的研究团队证明了融合表达TAT的蛋白能够被有效导入细胞膜内,并且不受细胞类型的限制[3]。随后,许多不同种类的具有穿越细胞膜能力的蛋白被发现,并被命名为细胞穿膜肽(Cell-penetrating peptides,CPPs)[4]。细胞穿膜肽通常是不超过30个氨基酸的多肽分子,能够不依赖特异膜受体独立穿过细胞膜,甚至有些细胞穿膜肽的入胞并不依赖能量[5]。由于细胞穿膜肽的多肽属性,进入细胞后能被正常分解,具有较好的生物相容性,通常对细胞毒性较小。穿膜肽介导的生物大分子药物的入胞研究在之后蓬勃发展。经过近30年的发展,细胞穿膜肽从被发现到基础研究走向了临床药物的研发。目前,细胞穿膜肽已经成为生物分子穿过细胞膜从而进行细胞内运输的一个强大载体工具[6]。近来,随着抗体在细胞内靶向和免疫功能的进一步揭示,利用穿膜肽递送具有活性的抗体片段(Fab和ScFv等)以靶向细胞内靶标正成为研究的热点。近期笔者团队的一项研究也证实了TAT融合表达识别乙型肝炎病毒(Hepatitis B virus,HBV) HBx蛋白的全分子抗体IgG能够有效进入细胞,并经由TRIM21介导的蛋白降解HBx,进而在细胞模型和动物模型中发挥显著的抗HBV作用[7]。各种细胞穿膜肽衍生肽疗法的临床前评估取得了重大成就,多家世界著名的制药公司正在进行临床开发工作,这也从侧面反映出细胞穿膜肽临床应用具有强大的潜力。
1 细胞穿膜肽的分类根据细胞穿膜肽的序列、来源、功能和入胞机制等特点都可以对其进行分类,目前学界尚无统一分类标准。相对通行的分类方法是根据细胞穿膜肽的物理化学性质将其分为3类:阳离子型、两亲型和疏水型,如表 1所示。
表 1 已报道的部分穿膜肽序列及分类特点Table 1 Sequences and classification characteristics of previously reported cell-penetrating peptides
| Sequence | Name | Class |
| RKKRRQRRR | TAT(49-57) | Cationic |
| R5, R7, R8, R9, R10, R11, R12 | Polyargine | Cationic |
| RQIKIWFQNRRMKWKK | Penetratin | Cationic |
| TRQARRNRRRRWRERQR | Rev | Cationic |
| KMTRAQRRAAARRNRWTAR | Gag | Cationic |
| VKRGLKLRHVRPRVTRMDV | DPV1047 | Cationic |
| TRRNKRNRIQEQLNRK | Prp6 | Cationic |
| KLALKALKALKAALKLA | MAP | Amphipathic |
| GWTLNSAGYLLGKINLKALAALAKKIL | Transportan | Amphipathic |
| KETWWETWWTEWSQPKKRKV | Pep-1 | Amphipathic |
| GLAFLGFLGAAGSTMGAWSQPKKKRKV | MPG | Amphipathic |
| MVKSKIGSWILVLFVAMWSDVGLCKKRP | Bovine Prp | Amphipathic |
| MVRRFLVTLRIRRACGPPRVRV | AFR | Amphipathic |
| LLIILRRRIRKQAHAHSK | pVECVT5 | Amphipathic |
| DPKGDPKGVTVTVTVTVTGKGDPKPD | SAP | Amphipathic |
| VRLPPPVRLPPPVRLPPP | Bac7 | Amphipathic |
| RRIRPRPPRLPRPRPRPLPFPRPG | (PRR)n | Amphipathic |
| PPR)3, (PPR)4, (PPR)5, (PPR)6 | Bip | Amphipathic |
| VPTLK (PMLKE, VPALR, VSALK, IPALK) | C105Y | Hydrophobic |
| CSIPPEVKFNPFVYLI | Pep-7 | Hydrophobic |
| SDLWEMMMVSLACQY | FGF | Hydrophobic |
| PIEVCMYREP | SG3 | Hydrophobic |
| RLSGMNEVLSFRWL | Hydrophobic |
表选项
1.1 阳离子型细胞穿膜肽阳离子型的细胞穿膜肽通常具有较高的净正电荷数。首个被发现的穿膜肽TAT就是一种典型的阳离子型的穿膜肽。常见的阳离子型的细胞穿膜肽还有源于乙酰肝素结合蛋白的DPV1047等一系列DPV穿膜肽[8],源于RNA结合蛋白的HIV-1 Rev、BMV Gag酵母Prp6以及源于DNA结合蛋白的Protamine1和Penetratin[9]。大多数的阳离子型的细胞穿膜肽富含精氨酸和赖氨酸,2002年Park的研究表明TAT蛋白起到穿膜作用的最小结构域为第49–57位的氨基酸序列TAT49-57,这个由9个氨基酸序列组成的穿膜肽含有6个精氨酸[10]。对于多精氨酸类型的细胞穿膜肽的研究显示,即使是简单的多聚精氨酸序列组成的穿膜肽也具有穿膜能力,比如R5、R7、R9和R11[11],并且其穿膜能力与所含精氨酸数量呈现正相关[12]。一些阳离子型的细胞穿膜肽也含有多个赖氨酸残基。研究表明,多聚赖氨酸也具有一定的穿膜功能,但其穿膜能力通常比多聚精氨酸型的要差。Wender及其合作者的研究中阐释了在富含精氨酸的细胞穿膜肽中多个胍基团的存在对于膜穿透性能力发挥了关键的作用:精氨酸的胍基与细胞膜中带负电荷的羧酸、磷酸基团能够相互作用形成氢键,从而穿过细胞膜进入胞内[13-15]。虽然赖氨酸和精氨酸有相同的净正电荷数,但前者不含有胍基,所以穿膜能力不佳。同时Lindgren和Langel的研究认为精氨酸的数量和排列顺序对于穿膜肽的穿膜能力有着重要的影响[16]。虽然精氨酸在阳离子型的细胞穿膜肽中有着决定性的作用,其他的氨基酸残基在阳离子型的细胞穿膜肽中也并非可有可无的,例如在Penetratin穿膜肽中将第14位的色氨酸残基突变成苯丙氨酸后将使其丧失穿膜能力[17]。
1.2 两亲型细胞穿膜肽两亲型的细胞穿膜肽通常同时包含极性基团和非极性基团,从而同时具备亲水性和疏水性。大部分的两亲型细胞穿膜肽含有较多的正电荷,其电荷贡献主要来源于广泛分布的赖氨酸和精氨酸,但它们和阳离子型的细胞穿膜肽的区别在于:决定其具备入胞功能的机制并不是因为它们的正电基团而是它们的两亲性[18]。MAP、Transportan和Pep-1都属于两亲型细胞穿膜。两亲型细胞穿膜肽又可以进一步细分为一级结构两亲型、二级结构两亲型和富含脯氨酸两亲型[18]。许多一级结构的两亲型细胞穿膜肽是将一些蛋白的疏水结构域和核定位信号肽(NLS)相连接组成。例如MPG是由SV40 NLS (PKKRKV)和源于HIV糖蛋白41的疏水序列(GALFLGFLGAAGSTMGA)组成,以及Pep-1是由富含色氨酸的序列(KETWWETWWTEW)和SV40 NLS (PKKRKV)组成。还有一些穿膜肽如Bovine Prp[19]、ARF[20]、pVEC[21]也属于一级结构两亲型,但它们是完全源于天然的蛋白。二级结构两亲型细胞穿膜肽主要包括α-螺旋和β-折叠结构两亲型。在α-螺旋结构中,两性基团分别存在于α-螺旋的两面,通常这种类型的细胞穿膜肽在肽链一端含有一个高度疏水的基团,在另一端可能是正电、负电或者极性基团。目前只有一种β-折叠类型的两亲型细胞穿膜肽VT5 (DPKGDPK GVTVTVTVTVTGKGDPKPD),对于VT5的研究表明这个穿膜肽形成β-折叠结构对其穿膜功能是必不可少的[22]。富含脯氨酸和多聚脯氨酸两亲型穿膜肽在肽链中含有大量的脯氨酸。如SAP[23],来源于γ-玉米蛋白(γ-zein),其序列含有50%的脯氨酸。Bac7[24]和(PRR)n (n=3,4,5,6)[25]也属于这一类。脯氨酸的结构在20种天然氨基酸中比较特别,因其较为特殊的吡咯烷环结构,当在氨基酸序列中大量存在时能够形成一种称为Ⅱ型多聚脯氨酸(PolyprolineⅡ,PPⅡ)的二级结构,可能与其穿膜能力有关。
1.3 疏水型细胞穿膜肽疏水型细胞穿膜肽通常只含有非极性基团,因此具有较低的净电荷数。它们的疏水性基团在穿膜过程中发挥着重要的作用。相比于上述提到的两种类型(阳离子型和两亲型)的穿膜肽,疏水型穿膜肽的目前报道发现数量相对较少,且尚不清楚其入胞机制。常见的疏水型细胞穿膜肽有BIP[26]、C105Y[27]、Pep-7[28]、SG3和FGF[18]等。它们含有60%以上的非极性基团,并且净电荷在?2到+1之间。
2 细胞穿膜肽的入胞机制细胞穿膜肽如何运载蛋白或其他分子从细胞外部转运到细胞内部,最终到达细胞质和细胞核的机制近年来已有较多研究进展,但仍不完全清晰,一些模型和假说还存在一定争议[29]。通常认为,细胞穿膜肽可能通过多种不同途径进入胞内,这些入胞途径可以大致被分为两类,细胞内吞(Endocytosis)途径和直接穿透(Direct penetration)途径[30]。要区分这两种入胞途径技术上并不困难,荧光标记的细胞穿膜肽通过直接穿透途径进入细胞后,胞内的荧光应该是均匀扩散的;而通过内吞作用进入到细胞的穿膜肽,因为囊泡的包裹,胞内的荧光应该是呈现点状的分布。但要精确定义某种穿膜肽的穿膜途径并没有那么简单,即使是同一种穿膜肽,穿膜效率和途径也会受其浓度、温度、细胞种类的影响而改变。例如随使用浓度的增加,TAT和R8类穿膜肽在Hela细胞中的穿膜途径逐渐由内吞作用转变为直接穿透细胞膜[31]。R8进入KG1a悬浮细胞在温度调节下具有类似的效应:在37 ℃时主要通过内吞作用进入细胞,而当温度低于20 ℃时,其能以直接穿透的方式进入胞内[32]。说明部分穿膜肽可能具有多种细胞穿膜途径以应对不同的环境。细胞穿膜肽的内化机制将取决于:肽及底物的性质;细胞类型、融合度、细胞活力以及质膜和细胞外基质的组成;温度、离子强度和pH等环境因素。
2.1 细胞内吞(Endocytosis)途径在多数细胞穿膜肽介导的入胞实验中,通常通过细胞内吞途径进入胞内[33]。细胞内吞途径通常又可细分为巨胞饮作用(Macropinocytosis)、网格蛋白介导的内吞作用(Clathrin-dependent endocytosis)、小窝蛋白介导的内吞作用(Caveolin- dependent endocytosis)以及网格蛋白和小窝蛋白非依赖的内吞作用(Clathrin/caveolin-independent endocytosis) (图 1)[34]。细胞穿膜肽的内吞机制可能涉及上述提到的多种途径。研究穿膜肽的内吞机制可以通过使用抑制剂针对性地阻遏某种特定的内吞途径评估是否对其入胞有重要影响。Soraj等利用多种内吞途径的药物抑制以及siRNA对内吞途径中关键蛋白的敲低,研究对R8和TAT在Hela和A431细胞系中的入胞效果。对网格蛋白、小窝蛋白介导的内吞途径以及网格蛋白、小窝蛋白非依赖的内吞作用的单独抑制都不能对入胞产生明显的影响,只有对巨胞饮作用的抑制能够大幅降低R8和TAT的入胞效率,因此推断巨胞饮作用是R8和TAT的入胞转运中最主要的内化途径。巨胞饮是精氨酸富集的细胞穿膜肽内化机制的典型形式[35],其中肌动蛋白(Actin)起着重要作用,穿膜肽与细胞膜作用导致肌动蛋白的重新排列,可导致细胞膜表面许多地方形成向下凹陷的结构,这些凹陷的膜结构随后形成一个巨大的巨胞饮小体(Macropinosomes)。其直径比其他内吞途径产生的囊泡直径都要大的多,更适合大分子和纳米颗粒的入胞[36]。有研究发现穿膜肽可通过激活蛋白激酶B从而激活巨胞饮作用,并且细胞膜上的乙酰肝素蛋白聚糖(HSPGs)可能作为受体与细胞穿膜肽相互作用促进了RAC蛋白的激活。多配体聚糖(Syndecans)可能也参与了这个过程[37]。巨胞饮作用容易受外部刺激诱导,特别是一些生长因子如表皮生长因子,其在癌细胞和巨噬细胞中很常见[38]。这将有利于穿膜肽介导抗癌药物的递送。Tanaka等发现R12的细胞摄取和巨胞饮作用的诱导依赖于趋化因子受体CXCR4,但对于CXCR4的抑制并不会对R8和TAT的巨胞饮途径有很大的影响[39]。因此,穿膜肽的内吞作用机制中,膜受体可能也发挥着重要的作用,并且可能有更多的受体或蛋白参与到这个机制中。虽然巨胞饮作用是穿膜肽内吞摄取中的关键机制之一,但由于之前的研究都是使用的癌细胞系,其在原代细胞和体内的入胞机制是否与肿瘤细胞存在差异还需进一步研究证明。
 |
| 图 1 细胞内吞途径 Fig. 1 Endocytosis pathway of cell penetrating peptides. (A) Cell membrane is concaved under the action of transmembrane peptide to form endosomes into cells. (B) Cell-penetrating peptide leads to the formation of large and irregular macropinocytosome. |
| 图选项 |
2.2 直接穿透(Direct penetration)机制相比于细胞穿膜肽的内吞途径,直接穿透途径不需要特异细胞蛋白参与,属于非能量依赖型,能够在细胞处于4 ℃的状态下穿透细胞膜。细胞膜磷脂双分子层以及其他组分构成的疏水核心是带电大分子穿越细胞膜的主要障碍。因此当细胞膜某个区域的分子组成和位置发生改变时,则可能改变细胞膜局部的渗透性质。例如,在细胞膜上去除胆固醇能够促进穿膜肽的入胞穿透[40],补充了胆固醇则对直接穿透产生抑制作用[41]。在直接穿透途径中,引起细胞膜变化的原因通常是带正电的穿膜肽和带负电细胞膜的相互作用,因而阳离子型的细胞穿膜肽相比其他类型穿膜肽更有可能具备直接穿透细胞膜的能力。目前关于直接穿膜机制也有3种不同的理论模型:1)穿膜肽导致细胞膜形成孔径通道;2)穿膜肽导致细胞膜形成暂时性的孔径通道;3)穿膜肽导致细胞膜形成反式胶团[42]。第一种模型形成的孔径相对较大并且存在时间相对较长(图 2A),TAT以及其类似的穿膜肽能够与细胞膜上的肌动蛋白骨架以及细胞膜上的受体相互作用以促进不同条件下的不同转运途径,它能通过与磷脂头部基团的多氢键作用使细胞膜产生马鞍型的弯曲,进而导致孔径的形成[43-44]。在第二种模型中,穿膜肽直接穿透过程中在细胞膜表面形成一个亲水性的瞬时孔径,伴随着穿膜肽进入胞内,外部负电的磷脂头部从细胞膜的外部翻转到细胞膜的内部,因此在穿膜肽进入细胞后膜孔能够快速闭合(图 2B)[45]。在第三种模型中,在穿膜肽入胞的过程中,磷脂双分子层形成反式胶团,将穿膜肽包裹其中,通过再次翻转胶束,将穿膜肽释放到细胞质中。在这个模型中需要正电的穿膜肽和细胞膜有较强的相互作用,要求细胞膜带有足够多的负电荷(图 2C)[46]。直接穿膜机制通常是因为穿膜肽造成细胞膜的扰动和不稳定性,从而使细胞膜的渗透性发生改变。神经酰胺是一类神经递质,也能够诱导细胞膜凹陷弯曲,有研究表明其能够促进穿膜肽的入胞[41]。另外,对于阳离子型穿膜肽的研究表明,基于穿膜肽的胍头部基团、脂肪酸、质膜pH的不同,有着多种多样的作用机制[47]。
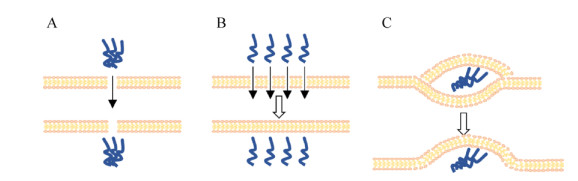 |
| 图 2 直接穿透途径 Fig. 2 Direct penetration of cell penetrating peptides. Schematic drawing of the direct penetration pathway of cell penetrating peptide. (A) Translocation of CPPs through pores in lipid bilayers, the cell membrane form a large pore channel for a long time. (B) Translocation of CPPs through transient prepores in lipidbilayers. The cell membrane form a transient pore with smaller diameter and have a shorter duration. (C) Translocation of CPPs via inverted micelle formation in lipid bilayers. Positively charged CPPs form a neutral complex with negatively charged lipids, which can translocate across the bilayer. |
| 图选项 |
3 穿膜肽的治疗应用由于穿膜肽能够通过共价键或者物理络合方式连接多种生物分子,其应用范围也十分广泛。其中最有价值的是作为递送载体促进药物在疾病治疗中的效果,将药物和其他治疗分子导入细胞的能力使穿膜肽具有巨大的治疗潜力。近期,笔者团队的一项研究探索了细胞穿膜肽连接的全长IgG抗体的有效细胞内递送,在乙型肝炎病毒X蛋白(HBx)抗体9D11的重链C末端融合表达TAT穿膜肽,在不影响其抗原结合活性和Fc介导的功能的情况下在复制和感染模型中都能够有效进入活细胞,并能够通过TRIM21途径对HBx蛋白有很好的清除效果,且在体内模型中,9D11-TAT能够显著降低转基因小鼠血清DNA水平[7]。2017年剑桥大学的研究团队开发的TRIM-AWAY技术,能够基于泛素连接酶和Fc受体TRIM21识别结合内源蛋白的抗体,并将它们靶向蛋白酶体实现内源蛋白的快速清除。9D11-TAT对于胞内HBx的清除与TRIM-AWAY技术有异曲同工之处[48],并使抗体药物在体内的递送实现胞内靶标的清除成为可能。大量的临床前研究也证实了穿膜肽偶联药物在肿瘤、神经性疾病、心脏病等疾病的治疗中具有应用潜力。还有一类特殊的穿膜肽被称为抗菌肽(Antimicrobial peptides,AMPs),对多种细菌、真菌、病毒和寄生虫甚至癌细胞都具有杀伤能力。对于多重耐药的细菌、真菌、病毒和寄生虫感染是很好的药物替代品[49]。
3.1 穿膜肽作为载体的药物递送自从TAT发现以来,穿膜肽作为载体携带蛋白或其他生物分子入胞的能力在体外实验中不断被挖掘。随后在小鼠体内实验中证实了TAT连接的β-半乳糖苷酶经过腹腔注射后能够向小鼠所有组织(包括大脑)完成递送[50]。穿膜肽作为药物递送载体使药物进入细胞,甚至穿越上皮细胞和血脑屏障,开始被应用在许多疾病的治疗中。
3.1.1 穿膜肽作为载体在肿瘤治疗中的应用穿膜肽在肿瘤治疗中最为人熟知的是携带肿瘤靶标p53蛋白入胞。p53是一种肿瘤抑制因子,在50%的肿瘤中发现p53的基因突变。TAT连接的p53蛋白(RI-TAT-p53C)以及R11连接的p53蛋白和血球凝集素HA-2 (d11R-p53C-riHA2),在腹腔注射淋巴瘤小鼠模型后能够有效促进肿瘤细胞的凋亡并且延长了小鼠的寿命[51-52]。TAT连接的P15蛋白也被证实在多个肿瘤细胞模型和体内实验中具有肿瘤抑制作用[53]。
一些小分子的抗肿瘤化疗药物连接穿膜肽后能够提高他们的膜穿透性、药物递送效率、半衰期以及在肿瘤细胞中的聚集[54-55]。R8通过二硫键连接紫杉醇,能够改善药物的水溶性、药代动力学以及耐药性。目前已经发展到了第四代,很有可能成为有效的化疗药物[56-57]。甲氨喋呤(Methotrexate)通过连接两种穿膜肽YTA2和YTA4,与单独的药物对比能够有效提高肿瘤细胞的杀伤能力[58]。最新的一项研究报道了甲氨喋呤连接的一种选择性细胞穿膜肽能够高效并且选择性地靶向肺癌细胞[59]。阿霉素(Doxorubicin)能够与许多穿膜肽连接,常见的有TAT和Penetratin,能够在低浓度下有效诱导CHO细胞或一些人的肿瘤细胞系的凋亡[60]。最近有研究团队设计和发展了多糖-阿霉素-穿膜肽分子复合物,利用整合素靶向和细胞穿膜肽双重协同作用于癌症的治疗,该复合物对骨癌、乳腺癌和脑癌细胞系(SAOS、MCF7和U87)具有高效杀伤作用,同时对正常细胞(如HEK 293)的细胞毒性相对较小[61]。
多数穿膜肽介导的入胞转运并不具备细胞特异性,在肿瘤治疗中也存在较大的风险。因此穿膜肽在肿瘤治疗中的发展趋势向肿瘤细胞或组织特异性发展。可激活细胞穿膜肽(Activatable CPPs,ACPP)是将多聚阳离子穿膜肽和多聚阴离子肽用一个可切割的位点特异性连接肽连接,形成一个发夹结构,正常状态下多聚阴离子能够屏蔽穿膜肽的阳离子性使其失去穿膜功能,在肿瘤组织或肿瘤转移过程中高表达的疾病相关蛋白酶,比如金属蛋白酶2/9 (MMP2/9)能够切割连接肽从而使穿膜肽偶联药物恢复穿膜能力进入肿瘤细胞中发挥作用[62-63]。2009年Tsien利用上述原理设计出了第一种可激活的细胞穿膜肽,在尾静脉注射小鼠后其抑制性结构域能够在肿瘤组织中被金属蛋白酶切割并激活穿膜肽进入肿瘤细胞中[64]。除了多种上调的蛋白酶,肿瘤特殊的微环境——酸性的pH、较低的膜电位、较低的氧浓度等也为可激活穿膜肽的设计提供了许多策略。最近一项关于ACPP的研究利用了肿瘤微环境中pH的变化,将寡聚精氨酸穿膜肽与pH高度敏感并具有屏蔽阳离子信号的组氨酸-谷氨酸重复序列通过多聚甘氨酸连接肽连接((HE)10G5R6)。当pH在7.5时,HE折叠覆盖在CPP上能够很好地屏蔽CPP信号,在肿瘤微环境中pH低于6.5时,CPP肽段能够舒展开进入激活模式[65]。
3.1.2 细胞穿膜肽穿越上皮细胞和血脑屏障大分子药物的非注射给药途径,或者药物穿越血脑屏障的主要障碍是它们不能够有效渗透上皮和内皮。而穿膜肽的一个重要应用是能够作为载体携带多肽和蛋白质跨越肠道[66]、肺上皮[67]以及穿越血脑屏障[68]。
上皮细胞和内皮细胞通常通过紧密连接(Tight junction)构成一个紧密的单细胞层,只允许水和小分子营养物质通过。经典的化学渗透增强剂,如表面活性剂、胆盐等能够促进多肽和蛋白质在上皮细胞中的渗透,但对细胞完整性和细胞形态会产生一定负面影响。而穿膜肽作为安全高效的载体能够弥补这个缺点。2005年,穿膜肽第一次被报道能够穿越上皮细胞,TAT连接的胰岛素能够显著增加其穿越Caco-2单层细胞的能力[69-70]。之后多种穿膜肽被报道能够作为载体携带胰岛素、胰高血糖素样肽-1 (GLP-1)、胃泌素、干扰素-β (INF-β)等[71-72]。其中Penetratin是被研究最多的跨越上皮细胞的穿膜肽载体,Penetratin序列中的精氨酸和赖氨酸的位置可能对其跨越上皮细胞的能力有重要作用[73]。并且将其氨基酸序列中所有的L型氨基酸都替换成D型氨基酸能够提高胰岛素的转运效率和半衰期[74]。
血脑屏障在很大程度上阻碍了对神经性疾病的治疗,穿膜肽也开始被研究应用于穿越血脑屏障的载体。研究者利用细胞模型模拟验证了穿膜肽穿越血脑屏障的能力,一种含有单个α-螺旋的穿膜肽SUV-RF结合在包裹吉非替尼的脂质体上,希望用于治疗转移至脑中的非小细胞肺癌细胞。利用bEnd.3细胞模型模拟血脑屏障,在下方插入tranwell生长肺腺癌PC9细胞,研究表明含有穿膜肽的脂质体能显著降低PC9细胞活力[75]。细胞穿膜肽穿越细胞的能力与穿越血脑屏障的能力并没有太大的相关性,Spiegeleer评价了pVEC、SynB3、Tat 47-57、transportan 10 (TP10)和TP10-2五种细胞穿膜肽穿越血脑屏障的能力,发现pVEC、SynB3和Tat 47-57具有较高的脑内流入速率,而TP10和TP10-2则相对较低。共注射放射性标记的BSA并不能在脑中检测,因此它们穿越血脑屏障并不是由于增加血脑屏障的渗透性而实现。pVEC具有最高的脑流入率,其脑流出率却最低,说明血脑屏障对于穿膜肽的透过是有一定选择性的[68]。
3.2 穿膜肽的抗菌和抗病毒应用抗菌肽通常具有两亲性和较强的阳离子性、热稳定性、产生较低的抗药性以及对真核细胞基本没有毒性等优点[76]。抗菌肽作用于细菌或者真菌的脂质膜,通过在膜上形成孔洞或增加细胞膜的渗透性从而杀死微生物[77]。除了对微生物的直接影响外,AMP也能通过提高免疫细胞如巨噬细胞、淋巴细胞等的积累来控制先天性和适应性免疫应答[78]。目前已经发现的或者人工合成的抗菌肽的种类已经超过了5 000种[79]。抗菌肽具有较强的杀灭致病微生物的能力,包括革兰氏阳性菌、革兰氏阴性菌、原生动物和真菌等。因此抗菌肽可以用于食品和药物应用。已经被发现的具有抗菌效果的穿膜肽包括TAT、pVEC、Pep-1、Tansportan和Penetratin等[80]。
某些抗菌肽在能够杀死细菌、真菌和其他微生物的同时,还具有抗病毒功能。抗病毒穿膜肽可以通过阻断病毒遗传物质的复制过程或者阻止病毒进入细胞实现其抗病毒作用,并且保证宿主细胞不受伤害。最常见的穿膜肽TAT,能够与CXCR4相互作用,抑制HIV-1的病毒复制效率[81]。利用噬菌体展示的方法筛选到的抗病毒穿膜肽G1和G2,能够结合细胞表面的肝素硫酸盐从而阻止HSV-1病毒与细胞之间的相互作用和膜融合[82]。
4 总结与展望自从30年前首个穿膜肽TAT被发现,穿膜肽相关基础和应用研究已取得许多积极进展。一方面,新的具有更高入胞效率的穿膜肽以及理化性质优化的穿膜肽不断被发展出来,形成穿膜肽家族。另一方面,研究证实不同类型的穿膜肽能够在不同条件和细胞类型中通过多样化的机制进入细胞中,并且能够携带治疗性蛋白、抗体或核酸分子入胞发挥效应功能,作为药物递送载体,近期的研究中有大量的穿膜肽用于癌症治疗的体内研究,凸显了人们对于开发穿膜肽作为递送载体的兴趣。另外,穿膜肽还能穿透上皮组织和血脑屏障进行治疗性分子转运,显示了其在临床上的巨大应用潜能。但是,对于细胞穿膜肽的研究和应用还存在诸多不完善的地方。多种因素影响甚至单个细胞穿膜肽入胞使穿膜肽入胞机制的研究复杂化,针对需要穿膜的分子、细胞或者组织屏障可能需要一些量身定做的细胞穿膜肽。并且在穿膜肽内吞机制中穿膜肽及其携带物从囊泡中释放的效率也很大程度上影响着穿膜肽的应用。有研究表明使用一些内涵体溶解序列或者促进膜融合的分子能一定程度提高穿膜肽及其携带分子在囊泡中的释放效率[83]。但还需要寻找更高效的融合序列和分子或者更高效的其他策略。此外,穿膜肽的治疗应用需要特别重视的是其安全性问题,包括免疫原性以及质膜扰动引起的细胞毒性问题[84],两种问题都与细胞穿膜肽的特定序列相关,所以并没有一般性的解决方法。最近已经进行了一些研究以确定对免疫系统的可能作用以及生物体中随后的免疫反应,但是没有观察到一般的免疫应答。关于细胞毒性,目前大部分细胞穿膜肽的细胞毒性较低。但是在新型穿膜肽的开发研究中,这两个安全性问题始终是评估的关键因素。虽然某些穿膜肽被发现具有肿瘤特异性,并且可激活的细胞穿膜肽一定程度上为穿膜肽的特异性靶向提供了方向,但大部分的穿膜肽缺乏选择性仍是一个重要的问题,如何寻找对于大多数穿膜肽都适用的细胞或组织特异性靶向策略尤为关键,例如融合组织特异性的靶向分子或抗体。总之,还需要对穿膜肽入胞机制有更深入的研究,有助于发展可实现特定细胞靶向导入安全高效的生物大分子递送系统,并为设计和发展新型高效穿膜肽奠定理论基础。
参考文献
| [1] | Walters WP. Going further than Lipinski's rule in drug design.Expert Opin Drug Dis, 2012, 7(2): 99–107.DOI: 10.1517/17460441.2012.648612 |
| [2] | Zou L, Peng QL, Wang P, et al. Progress in research and application of HIV-1 TAT-derived cell-penetrating peptide.J Memb Biol, 2017, 250(2): 115–122.DOI: 10.1007/s00232-016-9940-z |
| [3] | Fawell S, Seery J, Daikh Y, et al. Tat-mediated delivery of heterologous proteins into cells.Proc Natl Acad Sci USA, 1994, 91(2): 664–668.DOI: 10.1073/pnas.91.2.664 |
| [4] | Rádis-Baptista G, Campelo IS, Morlighem JéRL, et al. Cell-penetrating peptides (CPPs): from delivery of nucleic acids and antigens to transduction of engineered nucleases for application in transgenesis.J Biotechnol, 2017, 252: 15–26.DOI: 10.1016/j.jbiotec.2017.05.002 |
| [5] | Raucher D, Ryu JS. Cell-penetrating peptides: strategies for anticancer treatment.Trends Mol Med, 2015, 21(9): 560–570.DOI: 10.1016/j.molmed.2015.06.005 |
| [6] | Koren E, Torchilin VP. Cell-penetrating peptides: breaking through to the other side.Trends Mol Med, 2012, 18(7): 385–393.DOI: 10.1016/j.molmed.2012.04.012 |
| [7] | Zhang JF, Xiong HL, Cao JL, et al. A cell-penetrating whole molecule antibody targeting intracellular HBx suppresses hepatitis B virus via TRIM21-dependent pathway.Theranostics, 2018, 8(2): 549–562.DOI: 10.7150/thno.20047 |
| [8] | de Coupade C, Fittipaldi A, Chagnas V, et al. Novel human-derived cell-penetrating peptides for specific subcellular delivery of therapeutic biomolecules.Biochem J, 2005, 390: 407–418.DOI: 10.1042/BJ20050401 |
| [9] | Nakase I, Hirose H, Tanaka G, et al. Cell-surface accumulation of flock house virus-derived peptide leads to efficient internalization via macropinocytosis.Mol Ther, 2009, 17(11): 1868–1876.DOI: 10.1038/mt.2009.192 |
| [10] | Park J, Ryu J, Kim KA, et al. Mutational analysis of a human immunodeficiency virus type 1 Tat protein transduction domain which is required for delivery of an exogenous protein into mammalian cells.J Gen Virol, 2002, 83(Pt 5): 1173–1181. |
| [11] | Alhakamy NA, Berkland CJ. Polyarginine molecular weight determines transfection efficiency of calcium condensed complexes.Mol Pharm, 2013, 10(5): 1940–1948.DOI: 10.1021/mp3007117 |
| [12] | Tunnemann G, Ter-Avetisyan G, Martin RM, et al. Live-cell analysis of cell penetration ability and toxicity of oligo-arginines.J Pept Sci, 2008, 14(4): 469–476.DOI: 10.1002/psc.v14:4 |
| [13] | Stanzl EG, Trantow BM, Vargas JR, et al. Fifteen years of cell-penetrating, guanidinium-rich molecular transporters: basic science, research tools, and clinical applications.Acc Chem Res, 2013, 46(12): 2944–2954.DOI: 10.1021/ar4000554 |
| [14] | Wender PA, Galliher WC, Goun EA, et al. The design of guanidinium-rich transporters and their internalization mechanisms.Adv Drug Deliv Rev, 2008, 60(4/5): 452–472. |
| [15] | Rothbard JB, Garlington S, Lin Q, et al. Conjugation of arginine oligomers to cyclosporin A facilitates topical delivery and inhibition of inflammation.Nat Med, 2000, 6(11): 1253–1257.DOI: 10.1038/81359 |
| [16] | Lindgren M, Langel ü. Classes and prediction of cell-penetrating peptides//Langel ü, Ed. Cell-Penetrating Peptides: Methods and Protocols. New York: Humana Press, 2011: 3–19. |
| [17] | Dupont E, Prochiantz A, Joliot A. Penetratin story: an overview//Langel ü, Ed. Cell-Penetrating Peptides: Methods and Protocols. New York: Humana Press, 2015, 1324: 29–37. |
| [18] | Milletti F. Cell-penetrating peptides: classes, origin, and current landscape.Drug Discov Today, 2012, 17(15/16): 850–860. |
| [19] | Lundberg P, Magzoub M, Lindberg M, et al. Cell membrane translocation of the N-terminal (1–28) part of the prion protein.Biochem Biophys Res Commun, 2002, 299(1): 85–90.DOI: 10.1016/S0006-291X(02)02595-0 |
| [20] | Magzoub M, Sandgren S, Lundberg P, et al. N-terminal peptides from unprocessed prion proteins enter cells by macropinocytosis.Biochem Biophys Res Commun, 2006, 348(2): 379–385.DOI: 10.1016/j.bbrc.2006.07.065 |
| [21] | Avci FG, Akbulut BS, Ozkirimli E. Membrane active peptides and their biophysical characterization.Biomolecules, 2018, 8(3): 77.DOI: 10.3390/biom8030077 |
| [22] | Oehlke J, Krause E, Wiesner B, et al. Extensive cellular-uptake into endothelial cells of an amphipathic β-sheet forming peptide.FEBS Lett, 1997, 415(2): 196–199.DOI: 10.1016/S0014-5793(97)01123-X |
| [23] | Martin I, Teixido M, Giralt E. Design, synthesis and characterization of a new anionic cell-penetrating peptide: SAP(E).Chembiochem, 2011, 12(6): 896–903.DOI: 10.1002/cbic.v12.6 |
| [24] | Mardirossian M, Grzela R, Giglione C, et al. The host antimicrobial peptide Bac71-35 binds to bacterial ribosomal proteins and inhibits protein synthesis.Chem Biol, 2014, 21(12): 1639–1647.DOI: 10.1016/j.chembiol.2014.10.009 |
| [25] | Daniels DS, Schepartz A. Intrinsically cell-permeable miniature proteins based on a minimal cationic PPⅡ motif.J Am Chem Soc, 2007, 129(47): 14578–14579.DOI: 10.1021/ja0772445 |
| [26] | Gomez JA, Chen J, Ngo J, et al. Cell-penetrating penta-peptides (CPP5s): measurement of cell entry and protein-transduction activity.Pharmaceuticals, 2010, 3(12): 3594–3613.DOI: 10.3390/ph3123594 |
| [27] | Jones S, Lukanowska M, Suhorutsenko J, et al. Intracellular translocation and differential accumulation of cell-penetrating peptides in bovine spermatozoa: evaluation of efficient delivery vectors that do not compromise human sperm motility.Hum Reprod, 2013, 28(7): 1874–1889.DOI: 10.1093/humrep/det064 |
| [28] | Gao S, Simon MJ, Hue CD, et al. An unusual cell penetrating peptide identified using a plasmid display-based functional selection platform.ACS Chem Biol, 2011, 6(5): 484–491.DOI: 10.1021/cb100423u |
| [29] | Brock R. The uptake of arginine-rich cell-penetrating peptides: putting the puzzle together.Bioconjugate Chem, 2014, 25(5): 863–868.DOI: 10.1021/bc500017t |
| [30] | Kosuge M, Takeuchi T, Nakase I, et al. Cellular internalization and distribution of arginine-rich peptides as a function of extracellular peptide concentration, serum, and plasma membrane associated proteoglycans.Bioconjugate Chem, 2008, 19(3): 656–664.DOI: 10.1021/bc700289w |
| [31] | Duchardt F, Fotin-Mleczek M, Schwarz H, et al. A comprehensive model for the cellular uptake of cationic cell-penetrating peptides.Traffic, 2007, 8(7): 848–866.DOI: 10.1111/j.1600-0854.2007.00572.x |
| [32] | Fretz MM, Penning NA, Al-Taei S, et al. Temperature-, concentration- and cholesterol-dependent translocation of L- and D-octa-arginine across the plasma and nuclear membrane of CD34+ leukaemia cells.Biochem J, 2007, 403(2): 335–342. |
| [33] | Palm-Apergi C, L?nn P, Dowdy SF. Do cell-penetrating peptides actually "penetrate" cellular membranes?.Mol Ther, 2012, 20(4): 695–697.DOI: 10.1038/mt.2012.40 |
| [34] | LeCher JC, Nowak SJ, McMurry JL. Breaking in and busting out: cell-penetrating peptides and the endosomal escape problem.Biomol Concepts, 2017, 8(3/4): 131–141. |
| [35] | Al Soraj M, He L, Peynshaert K, et al. siRNA and pharmacological inhibition of endocytic pathways to characterize the differential role of macropinocytosis and the actin cytoskeleton on cellular uptake of dextran and cationic cell penetrating peptides octaarginine (R8) and HIV-Tat.J Control Release, 2012, 161(1): 132–141.DOI: 10.1016/j.jconrel.2012.03.015 |
| [36] | Conner SD, Schmid SL. Regulated portals of entry into the cell.Nature, 2003, 422(6927): 37–44.DOI: 10.1038/nature01451 |
| [37] | Nakase I, Tadokoro A, Kawabata N, et al. Interaction of arginine-rich peptides with membrane-associated proteoglycans is crucial for induction of actin organization and macropinocytosis.Biochemistry, 2007, 46(2): 492–501.DOI: 10.1021/bi0612824 |
| [38] | Bloomfield G, Kay RR. Uses and abuses of macropinocytosis.J Cell Sci, 2016, 129(14): 2697–2705.DOI: 10.1242/jcs.176149 |
| [39] | Tanaka G, Nakase I, Fukuda Y, et al. CXCR4 stimulates macropinocytosis: implications for cellular uptake of arginine-rich cell-penetrating peptides and HIV.Chem Biol, 2012, 19(11): 1437–1446.DOI: 10.1016/j.chembiol.2012.09.011 |
| [40] | Watkins CL, Schmaljohann D, Futaki S, et al. Low concentration thresholds of plasma membranes for rapid energy-independent translocation of a cell-penetrating peptide.Biochem J, 2009, 420(2): 179–189. |
| [41] | Pae J, S??lik P, Liivam?gi L, et al. Translocation of cell-penetrating peptides across the plasma membrane is controlled by cholesterol and microenvironment created by membranous proteins.J Control Release, 2014, 192: 103–113.DOI: 10.1016/j.jconrel.2014.07.002 |
| [42] | Islam MZ, Sharmin S, Moniruzzaman M, et al. Elementary processes for the entry of cell-penetrating peptides into lipid bilayer vesicles and bacterial cells.Appl Microbiol Biotechnol, 2018, 102(9): 3879–3892.DOI: 10.1007/s00253-018-8889-5 |
| [43] | Mishra A, Lai GH, Schmidt NW, et al. Translocation of HIV TAT peptide and analogues induced by multiplexed membrane and cytoskeletal interactions.Proc Natl Acad Sci USA, 2011, 108(41): 16883–16888.DOI: 10.1073/pnas.1108795108 |
| [44] | Ciobanasu C, Siebrasse JP, Kubitscheck U. Cell-penetrating HIV1 TAT peptides can generate pores in model membranes.Biophys J, 2010, 99(1): 153–162.DOI: 10.1016/j.bpj.2010.03.065 |
| [45] | Swiecicki JM, Bartsch A, Tailhades J, et al. The efficacies of cell-penetrating peptides in accumulating in large unilamellar vesicles depend on their ability to form inverted micelles.Chembiochem, 2014, 15(6): 884–891.DOI: 10.1002/cbic.v15.6 |
| [46] | Thorén PEG, Persson D, Isakson P, et al. Uptake of analogs of penetratin, Tat(48–60) and oligoarginine in live cells.Biochem Biophys Res Commun, 2003, 307(1): 100–107.DOI: 10.1016/S0006-291X(03)01135-5 |
| [47] | Herce HD, Garcia AE, Cardoso MC. Fundamental molecular mechanism for the cellular uptake of guanidinium-rich molecules.J Am Chem Soc, 2014, 136(50): 17459–17467.DOI: 10.1021/ja507790z |
| [48] | Clift D, McEwan WA, Labzin LI, et al. A method for the acute and rapid degradation of endogenous proteins.Cell, 2017, 171(7): 1692–1706.e18.DOI: 10.1016/j.cell.2017.10.033 |
| [49] | Lakshmaiah Narayana J, Chen JY. Antimicrobial peptides: possible anti-infective agents.Peptides, 2015, 72: 88–94.DOI: 10.1016/j.peptides.2015.05.012 |
| [50] | Bolhassani A, Jafarzade BS, Mardani G. In vitro and in vivo delivery of therapeutic proteins using cell penetrating peptides.Peptides, 2017, 87: 50–63.DOI: 10.1016/j.peptides.2016.11.011 |
| [51] | Araki D, Takayama K, Inoue M, et al. Cell-penetrating D-isomer peptides of p53 C-terminus: long-term inhibitory effect on the growth of bladder cancer.Urology, 2010, 75(4): 813–819.DOI: 10.1016/j.urology.2009.10.002 |
| [52] | Snyder EL, Meade BR, Saenz CC, et al. Treatment of terminal peritoneal carcinomatosis by a transducible p53-activating peptide.PLoS Biol, 2004, 2(2): e36.DOI: 10.1371/journal.pbio.0020036 |
| [53] | Perea SE, Reyes O, Puchades Y, et al. Antitumor effect of a novel proapoptotic peptide that impairs the phosphorylation by the protein kinase 2 (casein kinase 2).Cancer Res, 2004, 64(19): 7127–7129.DOI: 10.1158/0008-5472.CAN-04-2086 |
| [54] | Dawidczyk CM, Russell LM, Searson PC. Recommendations for benchmarking preclinical studies of nanomedicines.Cancer Res, 2015, 75(19): 4016–4020.DOI: 10.1158/0008-5472.CAN-15-1558 |
| [55] | Aroui S, Brahim S, De Waard M, et al. Efficient induction of apoptosis by doxorubicin coupled to cell-penetrating peptides compared to unconjugated doxorubicin in the human breast cancer cell line MDA-MB 231.Cancer Lett, 2009, 285(1): 28–38.DOI: 10.1016/j.canlet.2009.04.044 |
| [56] | Rompicharla SVK, Kumari P, Ghosh B, et al. Octa-arginine modified poly(amidoamine) dendrimers for improved delivery and cytotoxic effect of paclitaxel in cancer.Artif Cells Nanomed Biotechnol, 2018, 46(S2): 847–859. |
| [57] | Dubikovskaya EA, Thorne SH, Pillow TH, et al. Overcoming multidrug resistance of small-molecule therapeutics through conjugation with releasable octaarginine transporters.Proc Natl Acad Sci USA, 2008, 105(34): 12128–12133.DOI: 10.1073/pnas.0805374105 |
| [58] | Lindgren M, Rosenthal-Aizman K, Saar K, et al. Overcoming methotrexate resistance in breast cancer tumour cells by the use of a new cell-penetrating peptide.Biochem Pharmacol, 2006, 71(4): 416–425.DOI: 10.1016/j.bcp.2005.10.048 |
| [59] | Yang WJ, Xia YF, Fang Y, et al. Selective cell penetrating peptide-functionalized polymersomes mediate efficient and targeted delivery of methotrexate disodium to human lung cancer in vivo.Adv Healthc Mater, 2018, 7(7): e1701135.DOI: 10.1002/adhm.201701135 |
| [60] | Aroui S, Brahim S, De Waard M, et al. Cytotoxicity, intracellular distribution and uptake of doxorubicin and doxorubicin coupled to cell-penetrating peptides in different cell lines: a comparative study.Biochem Biophys Res Commun, 2010, 391(1): 419–425.DOI: 10.1016/j.bbrc.2009.11.073 |
| [61] | Mansur AAP, Carvalho SM, Lobato ZIP, et al. Design and development of polysaccharide-doxorubicin-peptide bioconjugates for dual synergistic effects of integrin-targeted and cell-penetrating peptides for cancer chemotherapy.Bioconjugate Chem, 2018, 29(6): 1973–2000.DOI: 10.1021/acs.bioconjchem.8b00208 |
| [62] | Reissmann S. Cell penetration: scope and limitations by the application of cell-penetrating peptides.J Pept Sci, 2014, 20(10): 760–784.DOI: 10.1002/psc.v20.10 |
| [63] | Olson ES, Aguilera TA, Jiang T, et al. In vivo characterization of activatable cell penetrating peptides for targeting protease activity in cancer.Integr Biol, 2009, 1(5/6): 382–393. |
| [64] | Aguilera TA, Olson ES, Timmers MM, et al. Systemic in vivo distribution of activatable cell penetrating peptides is superior to that of cell penetrating peptides.Integr Biol, 2009, 1(5/6): 371–381. |
| [65] | Tang BQ, Zaro JL, Shen Y, et al. Acid-sensitive hybrid polymeric micelles containing a reversibly activatable cell-penetrating peptide for tumor-specific cytoplasm targeting.J Control Release, 2018, 279: 147–156.DOI: 10.1016/j.jconrel.2018.04.016 |
| [66] | Kamei N, Aoyama Y, Khafagy ES, et al. Effect of different intestinal conditions on the intermolecular interaction between insulin and cell-penetrating peptide penetratin and on its contribution to stimulation of permeation through intestinal epithelium.Eur J Pharm Biopharm, 2015, 94: 42–51.DOI: 10.1016/j.ejpb.2015.04.030 |
| [67] | Yu J, Rupasinghe C, Wilson JL, et al. Targeting receptor tyrosine kinases and their downstream signaling with cell-penetrating peptides in human pulmonary artery smooth muscle and endothelial cells.Chem Biol Drug Des, 2015, 85(5): 586–597.DOI: 10.1111/cbdd.2015.85.issue-5 |
| [68] | Stalmans S, Bracke N, Wynendaele E, et al. Cell-penetrating peptides selectively cross the blood-brain barrier in vivo.PLoS ONE, 2015, 10(10): e0139652.DOI: 10.1371/journal.pone.0139652 |
| [69] | Kamei N, Onuki Y, Takayama K, et al. Mechanistic study of the uptake/permeation of cell-penetrating peptides across a Caco-2 monolayer and their stimulatory effect on epithelial insulin transport.J Pharm Sci, 2013, 102(11): 3998–4008.DOI: 10.1002/jps.23708 |
| [70] | Liang JF, Yang VC. Insulin-cell penetrating peptide hybrids with improved intestinal absorption efficiency.Biochem Biophys Res Commun, 2005, 335(3): 734–738.DOI: 10.1016/j.bbrc.2005.07.142 |
| [71] | Kamei N, Nielsen EJB, Khafagy ES, et al. Noninvasive insulin delivery: the great potential of cell-penetrating peptides.Ther Deliv, 2013, 4(3): 315–326.DOI: 10.4155/tde.12.164 |
| [72] | Kamei N, Morishita M, Takayama K. Importance of intermolecular interaction on the improvement of intestinal therapeutic peptide/protein absorption using cell-penetrating peptides.J Control Release, 2009, 136(3): 179–186.DOI: 10.1016/j.jconrel.2009.02.015 |
| [73] | Khafagy ES, Morishita M, Ida N, et al. Structural requirements of penetratin absorption enhancement efficiency for insulin delivery.J Control Release, 2010, 143(3): 302–310.DOI: 10.1016/j.jconrel.2010.01.019 |
| [74] | Khafagy ES, Iwamae R, Kamei N, et al. Region-dependent role of cell-penetrating peptides in insulin absorption across the rat small intestinal membrane.AAPS J, 2015, 17(6): 1427–1437.DOI: 10.1208/s12248-015-9804-y |
| [75] | Lin KH, Hong ST, Wang HT, et al. Enhancing anticancer effect of gefitinib across the blood-brain barrier model using liposomes modified with one α-helical cell-penetrating peptide or glutathione and tween 80.Int J Mol Sci, 2016, 17(12): 1998.DOI: 10.3390/ijms17121998 |
| [76] | Kang SJ, Park SJ, Mishig-Ochir T, et al. Antimicrobial peptides: therapeutic potentials.Expert Rev Anti Infect Ther, 2014, 12(12): 1477–1486.DOI: 10.1586/14787210.2014.976613 |
| [77] | Zasloff M. Antimicrobial peptides of multicellular organisms.Nature, 2002, 415(6870): 389–395.DOI: 10.1038/415389a |
| [78] | Ganz T. The role of antimicrobial peptides in innate immunity.Integr Comp Biol, 2003, 43(2): 300–304.DOI: 10.1093/icb/43.2.300 |
| [79] | Zhao XW, Wu HY, Lu HR, et al. LAMP: a database linking antimicrobial peptides.PLoS ONE, 2013, 8(6): e66557.DOI: 10.1371/journal.pone.0066557 |
| [80] | Copolovici DM, Langel K, Eriste E, et al. Cell-penetrating peptides: design, synthesis, and applications.ACS Nano, 2014, 8(3): 1972–1994.DOI: 10.1021/nn4057269 |
| [81] | Keogan S, Passic S, Krebs FC. Infection by CXCR4-tropic human immunodeficiency virus type 1 is inhibited by the cationic cell-penetrating peptide derived from HIV-1 tat.Int J Pept, 2012, 2012: 349427. |
| [82] | Tiwari V, Liu J, Valyi-Nagy T, et al. Anti-heparan sulfate peptides that block herpes simplex virus infection in vivo.J Biol Chem, 2011, 286(28): 25406–25415.DOI: 10.1074/jbc.M110.201103 |
| [83] | Farkhani SM, Valizadeh A, Karami H, et al. Cell penetrating peptides: efficient vectors for delivery of nanoparticles, nanocarriers, therapeutic and diagnostic molecules.Peptides, 2014, 57: 78–94.DOI: 10.1016/j.peptides.2014.04.015 |
| [84] | Dinca A, Chien WM, Chin MT. Intracellular delivery of proteins with cell-penetrating peptides for therapeutic uses in human disease.Int J Mol Sci, 2016, 17(2): 263.DOI: 10.3390/ijms17020263 |
