
 , 张浩4, 常泓5
, 张浩4, 常泓5

1 山西农业大学 动物科技学院,山西 太谷 030801;
2 中国食品药品检定研究院,北京 102629;
3 北京农业职业学院畜牧兽医系,北京 102442;
4 山西农业大学 食品科学与工程学院,山西 太谷 030801;
5 山西农业大学 生命科学院,山西 太谷 030801
收稿日期:2017-11-18;接收日期:2018-02-05; 网络出版时间:2018-02-28 基金项目:国家自然科学基金(No. 31201347),山西省回国留学人员项目(No. 2014-042)资助
摘要:为进一步提高羊骨酶解液的营养价值和生物利用度,探讨乳酸菌发酵对钙离子释放、短肽形成以及酶解液抗氧化活性的影响。首先从7株乳酸菌中筛选出了产蛋白酶能力最强的植物乳杆菌,接种羊骨酶解液,以发酵液中Ca2+浓度为指标,响应面法优化得到发酵工艺:酶解液中添加1%的麦芽糖,调节起始pH为5.5,以4%接种量接种驯化好的植物乳杆菌,37 ℃摇床发酵14 h。发酵过程中,植物乳杆菌活菌数与Ca2+含量(R=0.495,P < 0.01)和短肽得率(R=0.655,P < 0.01)呈极显著正相关,而多肽生成量与短肽得率呈负相关(R=–0.013)。发酵液中的Ca2+浓度(P < 0.05)、水解度(P < 0.01)、短肽得率(P < 0.01)、羟脯氨酸含量(P < 0.01)均显著高于酶解液(P < 0.01),植物乳杆菌活菌数达到94.6×108 CFU/mL。发酵还可使酶解液对DPPH、·OH、O2-·三种自由基的清除能力显著提高(P < 0.01,P < 0.05)。综上所述,以植物乳杆菌发酵羊骨酶解液可进一步促进骨钙的转化和胶原短肽的生成并显著提高其体外抗氧化能力,短肽和Ca2+反过来促进植物乳杆菌的繁殖,增强了酶解液的益生功能,乳酸菌产生的维生素、胞外多糖等物质使羊骨酶解液更富营养。
关键词:骨粉 植物乳杆菌 钙离子释放 抗氧化活性 短肽
Fermentation of sheep bone enzymatic hydrolysates by Lactobacillus plantarum
Keguang Han1, Fengping Pang2, Jing Cao3, Nairui Huo1

 , Hao Zhang4, Hong Chang5
, Hao Zhang4, Hong Chang5

1 College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, Shanxi, China;
2 National Institutes for Food and Drug Control, Beijing 102629, China;
3 Husbandry and Veterinary Department, Beijing Vocational College of Agriculture, Beijing 102442, China;
4 College of Food Science and Engineering, Shanxi Agricultural University, Taigu 030801, Shanxi, China;
5 College of Life Sciences, Shanxi Agricultural University, Taigu 030801, Shanxi, China
Received: November 18, 2017; Accepted: February 5, 2018; Published: February 28, 2018
Supported by: National Natural Science Foundation of China (No. 31201347), Shanxi Scholarship Council of China (No. 2014-042)
Corresponding author:Nairui Huo. Tel: +86-354-6288335; E-mail: tgnrhuo@163.com
Hong Chang. Tel: +86-354-6289092; E-mail: 941004578@qq.com
Abstract: In order to improve the nutritional value and bio-availability of sheep bone enzymatic hydrolysates, we tried to ferment the hydrolysates with lactic acid bacteria (LAB) to enhance free Ca2+, to generate oligopeptide and antioxidative activity. First, we isolated 7 LAB strains from commercial starters and selected Lactobacillus plantarum as the starter for its highest protease-producing ability. The content of released Ca2+ was evaluated when the fermenting conditions were optimized by the method of responsive surface design. When supplemented with 1% maltose and inoculated 4% L. plantarum, at initial pH 5.5 and 37 ℃ for 14 h, Ca2+ content in the hydrolysates increased significantly (P < 0.05), as well as the generation oligopeptide (P < 0.01), and the content of hydroxyproline (P < 0.01). The count of L. plantarum in the fermented hydrolysates reached to 94.6×108 CFU/mL. L. plantarum fermentation significantly enhanced the ability to scavenge free radicals DPPH, ·OH and O2-· (P < 0.01, P < 0.05). Therefore, fermenting sheep bone hydrolysates by L. plantarum can increase free Ca2+, oligopeptide and antioxidative ability.
Key words: bone powder Lactobacillus plantarum release of ionic calcium antioxidative activity oligopeptide
骨粉中的钙以羟磷灰石晶体和无定型磷酸氢钙两种形式存在,蛋白质主要以三螺旋结构的骨胶原形式存在,二者很难被机体吸收和利用[1]。骨胶原在蛋白酶作用下降解为肽和少量氨基酸的同时,骨矿中的钙以离子形式释放出来。Ca2+是可被机体直接吸收的有效钙,作为二价矿物营养,参与体内神经传导、骨骼生长等许多重要生理过程[2-3],是维持机体全面健康的必需常量元素。经不同水解工艺制备的骨胶原肽,肠道对其的吸收率远高于蛋白质,且具有促进脂质代谢、降低血液胆固醇浓度、促进机体免疫力等生理功能[4],还可促进机体对钙的吸收[5-6],所以酶解不仅使骨粉的生物利用度和营养价值大大提高,还赋予了其某些生理功能。
植物乳杆菌Lactobacillus plantarum属肠道正常菌群,食用安全且具有多种益生功能,能通过胃并在消化道上皮细胞定殖,改善肠道微环境[7-8],有利于肠道对营养物质的消化吸收[9],缓解高脂饮食引起的肥胖症状[9-10],是泡菜中的优势乳酸菌[11],也是基因工程中常用的表达宿主细胞[7, 12]。在补充了碳源的骨粉酶解液中,植物乳杆菌以肽类、氨基酸等为氮源生长繁殖,分泌的蛋白酶和肽酶可将多肽进一步水解为短肽和氨基酸,同时产生胞外多糖、维生素、有机酸、抑菌物质等代谢产物[13]。肽链越短,越不易引发超敏反应,经口摄入就越安全,且大多生理功能强的活性肽均为短肽,所以羊骨酶解液经过植物乳杆菌发酵,营养将更丰富和全面,功能性将更强,并且还具有了一定数量的益生菌,骨腥味也可得到部分掩蔽。
目前国内外有关骨粉和骨粉酶解液乳酸菌发酵的研究极少。课题组前期研究发现,碱性蛋白酶和风味蛋白酶均是水解羊骨粉的良好工具酶[14],且二者复合水解的效果最佳[15]。本研究将以筛选出的产蛋白酶能力最强的乳酸菌对羊骨的碱性蛋白酶和风味蛋白酶复合酶解液进行发酵,以游离Ca2+为指标,优化发酵工艺,考察发酵对酶解液多肽总量、短肽得率、羟脯氨酸含量及体外抗氧化活性的影响,为禽畜骨的高值利用和新产品开发提供新思路,可带来可观的经济收益,并促进养殖产业链的延伸。
1 材料与方法1.1 乳酸菌菌株及试剂瑞士乳杆菌Lactobacillus helveticus编号为ATCC 15009,副干酪乳杆菌Lactobacillus paracasei编号为CGMCC 1.2284,购自中国科学院微生物研究所菌种保藏中心。
清酒乳杆菌Lactobacillus sakei分离自Lyocarni BOM-13,该发酵剂由清酒乳杆菌组成。弯曲乳杆菌Lactobacillus curvatus分离自Lyocarni VBL-97,该发酵剂由肉葡萄球菌、木糖葡萄球菌、清酒乳杆菌和弯曲乳杆菌组成,分离时通过个体形态观察将杆菌和球菌区别开来,清酒乳杆菌海藻糖发酵试验阳性,弯曲乳杆菌呈阴性。植物乳杆菌Lactobacillus plantarum分离自Lyocarni SHI-59,分离时直接通过个体形态将其与该发酵剂中的木糖葡萄球菌和戊糖片球菌区分开来。乳酸片球菌Pediococcus acidilactici和戊糖片球菌Pediococcus pentosaceus分离自Lyocami VBM-60,该发酵剂中还含有肉葡萄球菌和木糖葡萄球菌,分离时通过个体形态观察将片球菌和葡萄球菌鉴别开来,乳酸片球菌海藻糖发酵试验阳性,戊糖片球菌呈阴性。
碱性蛋白酶(Activity≥200 000 U/g)和风味蛋白酶(Activity≥20 U/mg)为Solarbio产品;1, 1-二苯基-2-苦基苯基(DPPH)为Sigma产品;无水乙醇、福林酚等其他化学试剂为分析纯。
1.2 仪器及设备722可见光分光光度计(上海精密科学仪器)、PHS-3C型精密pH计(上海雷磁分析仪器)、HF160W Heal Force二氧化碳培养箱(香港力康生物)、Lambda 850紫外可见分光光度计(美国PerkinElmer)等。
1.3 方法1.3.1 各菌株产蛋白酶能力比较将乳酸菌各菌株在MRS培养基中活化,以对数生长期菌体作为菌种,考察接种量(1%、2%、3%、4%、5%)、培养温度(30 ℃、35 ℃、37 ℃、40 ℃、42 ℃、45 ℃)、培养基起始pH (4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)、培养时间(12、18、24、30、36、42 h)、碳源(1%葡萄糖、蔗糖、果糖、乳糖、可溶性淀粉)对各菌株产蛋白酶能力的影响,确定各菌株产蛋白酶的较适条件。
将各菌株对数生长期菌悬液的OD600值调节成等值,并以体积比3%的接种量接种于MRS培养基,在各自较适产蛋白酶条件下培养,收集培养液,离心(8 400 r/min,4 ℃,15 min),测定上清液(粗酶液)的蛋白酶活力并进行比较。
蛋白酶活力测定:将50 μL浓度为1%的牛血清蛋白,450 μL待测样品,与1.5 mL乙酸钠缓冲液(0.1 mol/L,pH 7.0)混合,37 ℃孵育5 min,以0.5 mL 10%的三氯乙酸终止反应,280 nm处测吸光值。37 ℃每分钟水解牛血清蛋白产生1 μmoL色氨酸所需的酶量即为一个酶活单位。酶活(U/mL)=(K×W)/(V×T),式中K为样品稀释倍数;W为生成的色氨酸量(μmoL);V为反应液体积(mL);T为反应时间(min)。
1.3.2 羊骨酶解液的制备与植物乳杆菌发酵新鲜羊骨经清洗后加水50% (质量比),高压(125 ℃,30 min)并剔除骨表面的残留物,破碎去除骨髓,加水二次蒸煮去油脂,沥干后110 ℃干燥6 h,粉碎后过80目筛制得骨粉。酶解时骨粉的质量百分数为12%,碱性蛋白酶的添加量为4.25%,调节pH至9,45 ℃水解400 min后添加3.65%的风味蛋白酶,调节pH至6,55 ℃水解240 min后杀菌灭酶活[15]。
羊骨酶解液中添加1%麦芽糖,逐步增加MRS培养基中羊骨酶解液的比例(10%、20%、30%?100%),对植物乳杆菌进行驯化。将驯化后的菌种以一定体积接种到添加1%麦芽糖的羊骨酶解液中,按响应面试验设计进行实验,硅胶塞封口,摇床培养。
1.3.3 水解指标测定多肽生成总量的测定[15]:多肽分子量小于10 kDa,不被10%三氯乙酸(TCA)沉淀,其数值为样品中TCA可溶性总氮(NTAC)与氨基态氮(NAA)的mg数之差与6.25的乘积。NTAC测定时将酶解液或发酵液与10%的TCA等体积混合,5 000 r/ min离心15 min,取上清液按照福林-酚法测定;NAA用中性甲醛滴定法测定。
短肽得率的测定:短肽不被15%的TCA沉淀,其数值(%)为在15% TCA中可溶性氮含量(福林-酚法,方法同上)与样品中的总氮含量(凯氏定氮法)的比值乘100%。
钙离子含量的测定:精确称取1.25 g干燥至恒重的CaCO3,加盐酸助溶于100 mL水中,低温煮沸2 min去除CO2,冷却后用10% NaOH中和pH至6-8,定容至500 mL,此即1 mg/mL的钙标准溶液。吸取25 mL钙标准溶液,加水25 mL,用2 mol/L的NaOH溶液调节至pH 7左右,再加入10 mL NaOH溶液(2 mol/L),加入钙指示剂,立即用1% EDTA滴定,每毫升EDTA溶液相当的钙毫克数(X)等于钙标准溶液的体积(25 mL)除以滴定时EDTA消耗的毫升数。取酶解液或发酵液样品5 mL,加入蒸馏水20 mL,用2 mol/L的NaOH溶液调节pH至7左右,加水补充至50 mL,再加入3 mL三乙酰胺和2-3滴铬黑T指示剂,摇匀后立即滴定,直至溶液变成淡蓝色,记录样品滴定时所消耗的EDTA标准溶液的毫升数(V),每毫升样品中含有钙的毫克数Y= (V-V0) ×X×1/5,V0表示空白样消耗的EDTA体积。
水解度测定:蛋白酶每水解一个肽键就会释放一个游离氨基,游离氨基与OPA反应生成一种黄色络合物,通过测定该络合物在340 nm处的吸光度,再根据下面3个公式计算水解度:
 |
OPA试剂现配现用;配置丝氨酸标准溶液时将100 mg丝氨酸用去离子水溶解并定容至1 000 mL。
羟脯胺酸(Hyp)含量根据文献[16]中的方法测定。
1.3.4 体外抗氧化活性的测定DPPH清除能力:将发酵上清液与DPPH溶液(0.1 mol/L)等体积混合,室温避光反应30 min,517 nm处测定吸光值A1,空白组以等体积95%乙醇代替,记为A2;对照组以等体积去离子水代替,记作A0,DPPH清除率=[1-(A1-A2)/A0]× 100%[17]。
·OH清除能力:3支具塞比色管,管1和管2中均加入等体积等浓度(1 mL,6 mmol/L)的FeSO4溶液(A)、H2O2溶液(B)和水杨酸溶液,再分别加入1 mL蒸馏水和1 mL酶解液;管3中加入等体积的A、B、蒸馏水和酶解液。3支比色管的吸光度值依次记录为A0、A1和A2,·OH清除率的计算公式同上[18]。
O2-·清除能力:3支具塞比色管中均加入4.5 mL 0.05 mol/L的Tris-HCl (pH 8.2)和2.0 mL无水乙醇,混匀后25 ℃水浴20 min。管1加入0.3 mL经25 ℃预热的3 mmol/L邻苯三酚;管2加邻苯三酚后再加入经25 ℃预热的0.2 mL酶解物;管3再加入0.2 mL酶解物;置室温准确反应4 min后立即用1.5 mL HCl溶液(10 mmol/L)终止反应,3支比色管在321 nm处的吸光度值依次记录为A0、A1和A2,O2-·清除率的计算公式同上[19]。
1.3.5 乳酸菌活菌计数测发酵液的OD600值,估计其中的菌体数量,选择适宜稀释度涂MRS平板,进行活菌计数。
1.3.6 植物乳杆菌发酵的工艺优化单因素试验时,将培养至对数生长期的植物乳杆菌,分别以1%、2%、3%、4%、5%的体积比接种至MRS肉汤中,37 ℃培养24 h,测定发酵液的蛋白酶活,确定较适接种量。以4%接种量接种MRS肉汤,分别在30 ℃、35 ℃、37 ℃、40 ℃、42 ℃、45 ℃培养24 h,测定酶活,确定较适培养温度。以4%接种量接种,调节MRS肉汤的起始pH至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,37 ℃培养24 h,测定酶活,确定较适pH。调节MRS肉汤的起始pH为5.0,以4%接种量接种,37 ℃培养,分别于12、18、24、30、36、42 h取样测定发酵液的蛋白酶活,确定较适培养时间。分别以1%的蔗糖、果糖、乳糖、可溶性淀粉代替MRS配方中的葡萄糖,并调节起始pH为5.0,以4%接种量接种,37 ℃培养12 h,测定发酵液的蛋白酶活,确定较适碳源。
运用Diesign-Expert V 8.0.61软件的Box- Behnken Design中心组合设计4因素3水平响应面试验(表 1)。表中X1为培养温度(℃),-1、0、1三水平分别为30 ℃、37 ℃和45 ℃;X2为pH,三水平分别为4、5、6;X3为培养时间(h),三水平分别为10 h、12 h和15 h;X4为接种量,三水平分别为3%、4%和5%。以发酵液中的Ca2+含量为响应值,在Diesign-Expert. V8.0.61软件中使用编码单位对数据进行多元回归拟合,建立模型,并对模型进行显著性检验。
表 1 植物乳杆菌发酵羊骨酶解液的Box-Behnken设计方案及4因素3水平Table 1 Box-Behnken design and 3 levels of 4 factors for L. plantarum fermentation of sheep bone hydrolysates
| Tests | X1 | X2 | X3 | X4 | Tests | X1 | X2 | X3 | X4 | Tests | X1 | X2 | X3 | X4 |
| 1 | 1 | 1 | 0 | 0 | 11 | 1 | –1 | 0 | 0 | 21 | 0 | 0 | –1 | 1 |
| 2 | 0 | –1 | 0 | –1 | 12 | 1 | 0 | 1 | 0 | 22 | 0 | –1 | 0 | 1 |
| 3 | 0 | 1 | 0 | –1 | 13 | –1 | 1 | 0 | 0 | 23 | –1 | 0 | –1 | 0 |
| 4 | 1 | 0 | –1 | 0 | 14 | 0 | 0 | 1 | –1 | 24 | 0 | 0 | 0 | 0 |
| 5 | –1 | 0 | 0 | –1 | 15 | 0 | 0 | 1 | 1 | 25 | 1 | 0 | 0 | –1 |
| 6 | –1 | 0 | 0 | 1 | 16 | 0 | 0 | –1 | –1 | 26 | 0 | 1 | –1 | 0 |
| 7 | 0 | 0 | 0 | 0 | 17 | 0 | –1 | 1 | 0 | 27 | 0 | 0 | 0 | 0 |
| 8 | 0 | 0 | 0 | 0 | 18 | 0 | 0 | 0 | 0 | 28 | 0 | 1 | 1 | 0 |
| 9 | –1 | 0 | 1 | 0 | 19 | 0 | 1 | 0 | 1 | 29 | 1 | 0 | 0 | 1 |
| 10 | –1 | –1 | 0 | 0 | 20 | 0 | –1 | –1 | 0 |
表选项
1.4 统计分析对响应面试验29组试验结果中的各指标(多肽生成量、短肽得率、Ca2+含量、活菌数)采用IBM SPSS statistics V21.0软件进行相关性分析。应用Prism、Statistix 8.1软件对水解指标和抗氧化指标数据进行方差分析,P < 0.01差异极显著,P < 0.05差异显著。
2 结果与分析2.1 植物乳杆菌产酶条件的单因素试验及各菌株产酶能力比较由图 1可知,单因素试验中,L. plantarum所产蛋白酶的活性越来越高,确定其较适产酶条件(表 2)并用于响应面分析的水平设定。由于以麦芽糖为碳源利于L. plantarum产蛋白酶,故后续研究中以1%麦芽糖代替MRS肉汤中的葡萄糖。
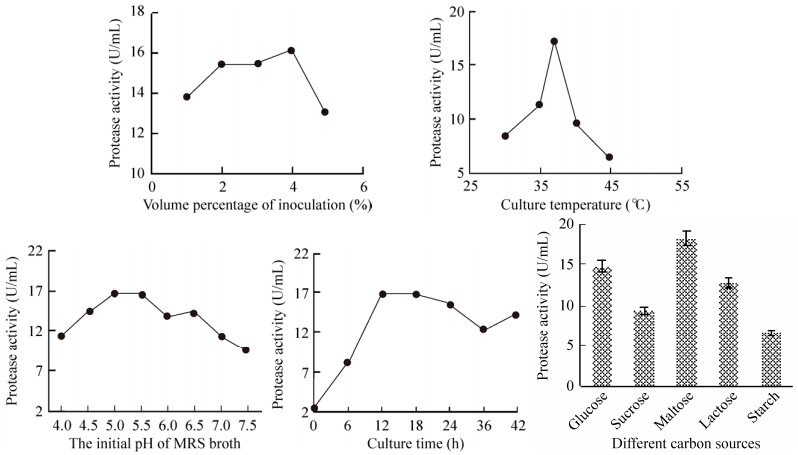 |
| 图 1 植物乳杆菌发酵的单因素试验结果 Figure 1 Results of single factor tests of L. plantarum fermentation. |
| 图选项 |
用同样方法确定的其他乳酸菌的较适产酶条件见表 2。
表 2 产蛋白酶乳酸菌受试菌株的较适培养条件Table 2 Suitable culture conditions for protease-producing lactic acid bacteria strains tested
| Test strains | Inoculation amount (%) | Initial pH | Temperature (℃) | Culture time (h) | Carbon sources |
| L. helveticus | 3 | 7.0 | 37 | 40 | Glucose |
| L. paracasei | 1 | 6.5 | 40 | 6 | Lactose |
| L. sakei | 3 | 6.5 | 37 | 42 | Sucrose |
| L. curvatus | 2 | 7.0 | 37 | 30 | Glucose |
| L. plantarum | 4 | 5.0 | 37 | 12 | Maltose |
| P. pentosaceus | 1 | 7.0 | 40 | 30 | Glucose |
| P. acidilactici | 3 | 7.0 | 40 | 30 | Glucose |
表选项
接种量相同,在确定的较适培养条件下培养,经测定各受试菌株的产蛋白酶能力不同,如图 2所示,植物乳杆菌发酵液中蛋白酶活力最高,戊糖片球菌和瑞士乳杆菌次之。
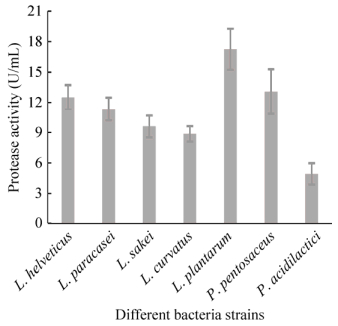 |
| 图 2 乳酸菌各受试菌株产蛋白酶能力比较 Figure 2 Comparison of protease producing ability of different lactic acid bacteria strains tested. |
| 图选项 |
2.2 植物乳杆菌发酵条件的响应面优化响应面试验结果如表 3所示,利用Design- Expert软件,以Ca2+含量为响应值,对表 3中的数据进行多元回归拟合,得到二次多项回归模型:Y (Ca2+)=2 179+108.50X1–1.33X2+3.75X3– 6.58X4–238.88X12–222.13X22–79.76X32–106.26X42–68.5X1X2+2.5X1X3–42.5X1X4+50.25X2X3+75.75X2X4+ 36X3X4。
表 3 植物乳杆菌发酵羊骨酶解液的响应面试验结果Table 3 Results of responsive surface design of fermenting the enzymatic hydrolysates of sheep bone by L. plantarum
| Tests | Polypeptide yield (mg/g) | ORO (%) | Ca2+ content (mg/100 mL) | Bacteria count (×108 CFU/mL) | Tests | Polypeptide yield (mg/g) | ORO (%) | Ca2+ content (mg/100 mL) | Bacteria count (×108 CFU/mL) |
| 1 | 72.39 | 84.47 | 1 798 | 39 | 16 | 99.46 | 84.83 | 2 036 | 37 |
| 2 | 107.28 | 86.12 | 1 976 | 47 | 17 | 97.69 | 96.50 | 1 648 | 79 |
| 3 | 97.21 | 72.45 | 1 685 | 24 | 18 | 124.35 | 94.84 | 2 118 | 105 |
| 4 | 71.47 | 88.36 | 1 922 | 49 | 19 | 84.40 | 77.62 | 1 846 | 74 |
| 5 | 100.42 | 92.80 | 1 689 | 70 | 20 | 86.47 | 76.43 | 1 934 | 104 |
| 6 | 91.19 | 95.48 | 1 742 | 103 | 21 | 114.72 | 83.71 | 1 947 | 58 |
| 7 | 121.60 | 93.08 | 2 207 | 109 | 22 | 84.84 | 70.85 | 1 834 | 44 |
| 8 | 116.70 | 93.07 | 2 145 | 68 | 23 | 96.33 | 92.46 | 1 649 | 63 |
| 9 | 81.66 | 73.42 | 1 763 | 54 | 24 | 109.81 | 97.01 | 2 279 | 114 |
| 10 | 93.53 | 87.82 | 1 587 | 61 | 25 | 89.18 | 88.12 | 1 953 | 72 |
| 11 | 95.63 | 72.59 | 1 918 | 50 | 26 | 94.43 | 90.64 | 1 948 | 92 |
| 12 | 88.40 | 88.87 | 2 046 | 64 | 27 | 102.40 | 85.31 | 2 144 | 80 |
| 13 | 96.52 | 81.06 | 1 741 | 32 | 28 | 83.28 | 71.73 | 1 863 | 41 |
| 14 | 90.24 | 96.51 | 2 053 | 120 | 29 | 98.46 | 74.86 | 1 836 | 32 |
| 15 | 106.27 | 90.00 | 2 108 | 101 | |||||
| Note: ORO stands for obtaining rate of oligopeptide. | |||||||||
表选项
方差分析结果(表 4)表明,所建立的模型达到显著水平(P < 0.05),且失拟项不显著(P > 0.05),说明可用此模型来分析和预测植物乳杆菌发酵羊骨酶解液中的钙离子释放情况。并且可知工艺参数中温度的线性效应、交互项X1X4和X2X3对Ca2+浓度的影响显著(P < 0.05)。R2=0.953 9,表明方程可充分拟合实验数据。
表 4 L. plantarum发酵羊骨酶解液发酵条件回归方程的方差分析结果Table 4 Variance analysis of the regression equation for ossein hydrolysate fermentation conditions of L. plantarum
| Source of variance | Sum of square of deviations | Degrees of freedom | Sum of square of deviations | F | Prob > F |
| X1 | 141 000.00 | 1 | 141 000.00 | 14.55 | 0.001 9 |
| X2 | 21.33 | 1 | 21.33 | 0.00 | 0.963 3 |
| X3 | 168.75 | 1 | 168.75 | 0.02 | 0.897 |
| X4 | 520.08 | 1 | 520.08 | 0.05 | 0.820 3 |
| X12 | 18 769.00 | 1 | 18 769.00 | 1.93 | 0.186 2 |
| X22 | 25.00 | 1 | 25.00 | 0.00 | 0.960 3 |
| X32 | 7 225.00 | 1 | 7 225.00 | 0.74 | 0.402 9 |
| X42 | 10 100.25 | 1 | 10 100.25 | 1.04 | 0.325 1 |
| X1X2 | 22 952.25 | 1 | 22 952.25 | 2.36 | 0.146 5 |
| X1X3 | 5 184.00 | 1 | 5 184.00 | 0.53 | 0.477 1 |
| X1X4 | 370 000.00 | 1 | 370 000.00 | 38.11 | < 0.000 1 |
| X2X3 | 320 000.00 | 1 | 320 000.00 | 32.95 | < 0.000 1 |
| X2X4 | 41 263.08 | 1 | 41 263.08 | 4.25 | 0.058 4 |
| X3X4 | 73 237.84 | 1 | 73 237.84 | 7.54 | 0.015 8 |
| Model | 795 000.00 | 14 | 56 750.17 | 5.84 | 0.001 1 |
| Error term | 136 000.00 | 14 | 9 712.37 | ||
| Lack of fit | 119 000.00 | 1 | 11 908.79 | 2.82 | 0.164 7 |
| Pure error | 16 885.20 | 4 | 4 221.30 | ||
| Sum | 931 000.00 | 28 | R2=0.953 9 | Radj2=0.967 7 | CV=1.16 |
表选项
通过Design-Expert软件,得出发酵的最佳工艺参数为:pH 5.25,植物乳杆菌的接种量为4.23%,37.32 ℃发酵13.59 h,预测的发酵液中游离Ca2+含量为21.7 mg/mL。验证实验调整起始pH 5.5、4%接种量、37 ℃发酵14 h,发酵液中实际Ca2+含量为19.8 mg/mL,比较接近预测值,说明采用响应面法优化得到的工艺参数具有一定的实用价值。经测定,优化工艺下发酵液中的多肽生成总量为112.8 mg/g、短肽得率为92.0%、活菌数为94.6×108 CFU/mL。
2.3 发酵过程中各指标间相关性分析由表 5可知,发酵液中的活菌数与Ca2+含量和短肽得率呈极显著正相关(P < 0.01),说明酶解和发酵过程中释放的Ca2+和短肽可促进植物乳杆菌生长繁殖,由其分泌的蛋白酶和肽酶反过来进一步促进Ca2+的释放和短肽的生成。相关性分析结果还表明,多肽含量与短肽得率呈负相关,此结果与羊骨粉酶解结果一致[15]。本研究中多肽生成量与乳酸菌活菌数呈负相关,而短肽得率与活菌数呈正相关,充分说明真正促进乳酸菌生长的是短肽,短肽可作为植物乳杆菌的生长因子。另外乳酸菌产生的诱导酶将多肽水解为短肽的同时,所产生的游离氨基酸也可作为乳酸菌的生长因子,促进其生长繁殖。
表 5 羊骨酶解液植物乳杆菌发酵过程中各指标相关性分析(n=29)Table 5 Correlation analysis for indices during L. plantarum fermentation of ossein hydrolysates
| Parameters | ORO | Ca2+ content | Bacteria count |
| Yield of polypeptide | –0.013 | 0.070 | –0.048 |
| ORO | 1 | 0.297 | 0.655** |
| Ca2+ content | 1 | 0.495** | |
| Note: ORO stands for obtaining rate of oligopeptide; ** represents significant correlation at the level of 0.01. | |||
表选项
2.4 发酵前后各指标变化由表 6可知,发酵使羊骨酶解液的水解度和Ca2+浓度显著增加(P < 0.01,P < 0.05),所以对酶解液进一步发酵可大幅提高骨钙的生物利用度。需要指出的是,骨胶原在水解过程中可形成一些能与矿物离子螯合的肽[20],电镜面扫描分析结果表明这些肽与溶出的Ca2+确实形成了螯合钙[21],所以在酶解过程中实际释放的Ca2+要大于实测值。和在乳中相同,钙在羊骨酶解液或发酵液中也以螯合钙和游离钙两种形式存在[13]。
表 6 植物乳杆菌发酵对羊骨酶解液各指标的影响Table 6 Effects of L. plantarum fermentation on the indices of the sheep bone hydrolysates
| Samples | Ca2+ (mg/mL) | DH (%) | Yield of polypeptides (mg/g) | Obtaining rate of oligopeptides (%) | Content of hydroxyproline (g/L) |
| Ferment | 19.81±2.13* | 51.34±4.91** | 92.75±7.13 | 52.16±4.14** | 3.45±0.25** |
| Non-ferment | 11.05±1.19 | 31.25±2.96 | 88.41±5.17 | 94.91±6.23 | 2.13±0.18 |
| ** represents significant different compared to the values of the hydrolysate at the level of 0.01, * means significant at the level of 0.05. | |||||
表选项
羟脯氨酸是骨胶原蛋白的特征性氨基酸,其含量在发酵液上清液中极显著增加(P < 0.01),说明植物乳杆菌所产生的蛋白酶和肽酶,其作用位点和/或方式不同于碱性蛋白酶和风味蛋白酶,也进一步解释了发酵使水解度和短肽得率增加的原因。短肽由多肽降解而来,发酵液中短肽得率极显著增加(P < 0.01),多肽总量却没有显著变化(P > 0.05),说明酶解还不彻底,植物乳杆菌发酵可使更多的羊骨胶原转化为肽,从而有利于骨粉的高效转化和充分利用。
2.5 发酵前后体外抗氧化活性比较自由基非常活跃,几乎可与所有细胞成分发生反应,其中氧自由基是人类许多疾病和衰老过程的重要病理介质[22],这也是为什么具有抗氧化功能的食品当前受到人们日益重视的原因[23]。自由基在体内的蓄积置机体于氧化胁迫的危险状态,而人工合成抗氧化剂往往具有健康风险,所以自然来源的抗氧化食品极其珍贵[23]。
体外抗氧化活性测定结果(图 3)表明,发酵后酶解液对三种氧自由基的清除能力显著提高,特别是对·OH的清除能力极显著提高。抗氧化能力的显著提高可能是由乳酸菌的代谢产物、抗氧化肽和具有抗氧化作用的游离氨基酸导致。乳酸菌分泌的胞外多糖能够增加发酵液的粘度,改善羊骨酶解-发酵液的风味和口感。
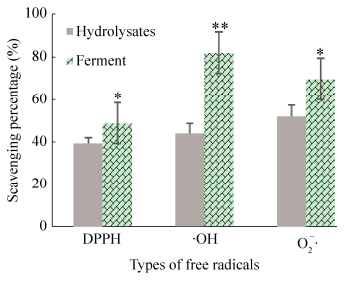 |
| 图 3 植物乳杆菌发酵对羊骨酶解液体外抗氧化活性的影响 Figure 3 Effects of L. plantarum fermentation on the in vitro anti-oxidant activity of sheep bone hydrolysates. |
| 图选项 |
利用植物乳杆菌发酵植物性食品,促进抗氧化肽产生和抗氧化物质释放的研究很多[24-25],但用于动物性食材发酵的研究报道很少,本研究进行了有益的尝试。
3 结论本研究从分离自发酵菌剂的7株乳酸菌中筛选出了产蛋白酶能力最强的植物乳杆菌。对其进行驯化,以释放的Ca2+浓度为指标,通过响应面法优化了其发酵羊骨酶解液的工艺。发酵过程中,植物乳杆菌的活菌数与Ca2+含量和短肽得率呈极显著正相关。植物乳杆菌发酵可使羊骨酶解液中的多肽进一步水解为短肽,并释放出更多的游离Ca2+和羟脯氨酸,发酵还可使酶解液对DPPH、·OH、O2-·三种自由基的清除能力显著增强。综上所述,以植物乳杆菌发酵羊骨酶解液可进一步促进骨钙的转化和胶原短肽的生成,并显著提高其体外抗氧化能力;生成的短肽和Ca2+反过来可促进植物乳杆菌的繁殖,酶解液的益生功能相应增强;乳酸菌产生的维生素、胞外多糖等物质使羊骨酶解发酵液更富营养。总之本研究用植物乳杆菌对羊骨酶解液进行发酵,使其兼具了抗氧化食品、益生食品、补钙食品的特性,实现了羊骨的高值利用,为将来相关功能产品的研发奠定了基础。
参考文献
| [1] | Pang FP, Huo NR. Study of Lactobacillus paracasei fermentation of sheep bone enzymatic hydrolysate to improve its antioxidant activity in vitro.J Shanxi Agric Univ: Nat Sci Ed, 2017, 37(2): 126–129.(in Chinese). 庞丰平, 霍乃蕊. 副干酪乳杆菌发酵提高羊骨酶解液体外抗氧化活性的研究.山西农业大学学报:自然科学版, 2017, 37(2): 126-129. |
| [2] | Bass J Kirk, Chan Gary M. Calcium nutrition and metabolism during infancy.Nutrition (Burbank, Los Angeles County, Calif.), 2006, 22(10): 1057–1066.DOI: 10.1016/j.nut.2006.05.014 |
| [3] | Guo L, Harnedy PA, Li B, et al. Food protein-derived chelating peptides: Biofunctional ingredients for dietary mineral bioavailability enhancement.Trends Food Sci Tech, 2014, 37(2): 92–105.DOI: 10.1016/j.tifs.2014.02.007 |
| [4] | Zhang Q, Zhen SY, Huo NR. The study on the hydrolysis of alcalase and protemex to sheep bone powder.J Shanxi Agric Univ: Nat Sci Ed, 2017, 37(2): 121–125.(in Chinese). 张琪, 甄守燕, 霍乃蕊. 碱性蛋白酶和复合蛋白酶双酶水解羊骨粉的工艺研究.山西农业大学学报:自然科学版, 2017, 37(2): 121-125. |
| [5] | Zhe P, Hu H, Kai Z, et al. Effect of calcium-binding peptide from Pacific cod (Gadus macrocephalus) bone on calcium bioavailability in rats.Food Chem, 2017, 221: 373–378.DOI: 10.1016/j.foodchem.2016.10.078 |
| [6] | Zhao L, Huang S, Cai X, et al. A specific peptide with calcium chelating capacity isolated from whey protein hydrolysate.J Funct Foods, 2014, 10(3): 46–53. |
| [7] | Zhong ZM, Lai Q, Yu XY, et al. Expression and characterization of porcine epidermal growth factor in Lactobacillus plantarum.Chin J Biotech, 2015, 31(9): 1325–1334.(in Chinese). 钟泽民, 赖强, 余希尧, 等. 猪表皮生长因子在植物乳杆菌中的表达及其活性检测.生物工程学报, 2015, 31(9): 1325-1334. |
| [8] | Park S, Ji Y, Jung HY, et al. Lactobacillus plantarum HAC01 regulates gut microbiota and adipose tissue accumulation in a diet-induced obesity murine model.Appl Microbiol Biotechnol, 2017, 101(4): 1–10. |
| [9] | Ha??ík P, Trembecká L, Bobko M, et al. Evaluation of meat quality after application of different feed additives in diet of broiler chickens.Potr Sci J Food Indus, 2015, 9(1): 174–182. |
| [10] | Park JE, Oh SH, Cha YS. Lactobacillus plantarum LG42 isolated from gajami sikhae decreases body and fat pad weights in diet-induced obese mice.J Appl Microbiol, 2014, 116(1): 145–156.DOI: 10.1111/jam.2013.116.issue-1 |
| [11] | Wang X, Li MS. Isolation and identification of Lactobacillus Plantarum from naturally fermented northeast sauerkraut.J Heilongjiang Bayi Agric Univ, 2013, 25(3): 63–66.(in Chinese). 王欣, 李卯生. 自然发酵东北酸菜中植物乳杆菌的分离与鉴定.黑龙江八一农垦大学学报, 2013, 25(3): 63-66. |
| [12] | Yu H, Jiang YP, Cui W, et al. Comparison of expression and antibacterial activities of recombinant porcine lactoferrin expressed in four Lactobacillus species.Chin J Biotech, 2014, 30(9): 1372–1380.(in Chinese). 于慧, 姜艳平, 崔文, 等. 猪乳铁蛋白在4种重组乳杆菌中的表达及抑菌活性比较.生物工程学报, 2014, 30(9): 1372-1380. |
| [13] | Luo J, Ren FZ, Wang ZW, et al. Advances in control technology of cheese quality and texture.Transactions ASAE, 2016, 47(1): 190–201.(in Chinese). 罗洁, 任发政, 王紫薇, 等. 干酪质构与风味控制技术研究进展.农业机械学报, 2016, 47(1): 190-201.DOI:10.6041/j.issn.1000-1298.2016.01.025 |
| [14] | Han KG, Zhen SY, Gao WW, et al. Comparison of hydrolyzing effect of sheep bone powder by different proteases and correlation analysis for hydrolysis indicators.Food Sci Technol, 2016, 41(29): 110–114.(in Chinese). 韩克光, 甄守艳, 高文伟, 等. 单酶水解羊骨粉效果比较及水解指标相关性分析.食品科技, 2016, 41(29): 110-114. |
| [15] | Zhen SY. Preparation of sheep bone collagen polypeptide enzymatically and preparation of calcium chelated polypeptide[D]. Taigu: Shanxi Agricultural University, 2015 (in Chinese). 甄守艳. 羊骨胶原肽的酶法制备及肽钙螯合研究[D]. 太谷: 山西农业大学, 2015. |
| [16] | GB/T 9695. 23-2008/ISO 3496: 1994. Determination of hydroxyproline content of meat and meat products. Beijing: Standards Press of China, 2008 (in Chinese). GB/T 9695. 23-2008/ISO 3496: 1994. 肉与肉制品羟脯胺酸的测定[S]. 北京: 中国标准出版社, 2008. |
| [17] | Wu CL, Wu RB, Liu D, et al. Preparation and antioxidant activity detection of collagen peptide from Cirrhinus molitorella skin.Chin J Biotech, 2016, 32(12): 1727–1734.(in Chinese). 武翠玲, 吴日帮, 刘丹, 等. 鲮鱼皮胶原肽的制备及其抗氧化活性的检测.生物工程学报, 2016, 32(12): 1727-1734. |
| [18] | Xu N, Zhang TZ, Chen XF, et al. Separation, purification and antioxidant activity of polysaccharide from Coprinus comatus.Chin J Biotech, 2017, 33(5): 808–816.(in Chinese). 许女, 张天震, 陈旭峰, 等. 鸡腿菇子实体多糖的分离纯化、理化性质及抗氧化活性.生物工程学报, 2017, 33(5): 808-816. |
| [19] | Fu XS, Li XH, Wang K, et al. Preparation and antioxidative activity of sheep bone hydrolysate with high yield of short peptides.J Shanxi Agric Sci, 2017, 45(7): 1157–1161.(in Chinese). 傅鑫森, 李秀华, 王凯, 等. 高短肽得率羊骨酶解物的制备及其体外抗氧化活性.山西农业科学, 2017, 45(7): 1157-1161. |
| [20] | Torresfuentes C, Alaiz M, Vioque J. Affinity purification and characterisation of chelating peptides from chickpea protein hydrolysates.Food Chem, 2011, 129(2): 485–490.DOI: 10.1016/j.foodchem.2011.04.103 |
| [21] | Han KG, Zhen SY, Fan H, et al. Preparation and characteristic analysis of calcium-chelated ossein peptide.Transactions CSAE, 2015, 31(21): 301–307.(in Chinese). 韩克光, 甄守艳, 范华, 等. 钙螯合羊骨胶原多肽的制备及表征分析.农业工程学报, 2015, 31(21): 301-307.DOI:10.11975/j.issn.1002-6819.2015.21.040 |
| [22] | Wang L, Liang Q, Chen Q, et al. Hydrolysis kinetics and radical-scavenging activity of gelatin under simulated gastrointestinal digestion.Food Chem, 2014, 163: 1–5.DOI: 10.1016/j.foodchem.2014.04.083 |
| [23] | Skrzypczak KW, Gustaw WZ, Jab?ońska-Ry? ED, et al. Antioxidative properties of milk protein preparations fermented by Polish strains of Lactobacillus helveticus.Acta Sci Pol Technol Aliment, 2017, 16: 199–207.DOI: 10.17306/J.AFS |
| [24] | Hunaefi D, Akumo DN, Hunaefi D, et al. The effect of lactobacillus plantarum ATCC 8014 and Lactobacillus acidophilus ncfm fermentation on antioxidant properties of selected in vitro sprout culture of orthosiphon aristatus (java tea) as a model study.Antioxid, 2012, 1(1): 4–32.DOI: 10.3390/antiox1010004 |
| [25] | Mechmeche M, Kachouri F, Ksontini H, et al. Production of bioactive peptides from tomato seed isolate by lactobacillus plantarum fermentation and enhancement of antioxidant activity.Food Biotechnol, 2017, 31(2): 94–113.DOI: 10.1080/08905436.2017.1302888 |
