
 , 陈珊珊, 孙佼文, 史仲平
, 陈珊珊, 孙佼文, 史仲平

江南大学 生物工程学院,江苏 无锡 214122
收稿日期:2017-05-09;接收日期:2017-07-11; 网络出版时间:2017-09-06 基金项目:国家自然科学基金(No. 21606106),江苏省自然科学基金(Nos. BK20150127, BK20160162)资助
摘要:重组毕赤酵母生产表达外源蛋白的过程中,一般在细胞达到高密度后开始启动甲醇诱导。也有报道指出,在较低细胞浓度下,启动甲醇诱导可以有效地控制整个发酵过程的溶解氧浓度,缓解毒副产物的积累,促进目标蛋白的表达。但是,该操作策略下,甲醇/能量调控机制不明,相关研究报道很少。文中以生产表达monellin (甜味蛋白)的重组毕赤酵母为模式菌株,通过在线分析计量甲醇消耗速率、CO2释放速率和O2摄取速率,探讨了不同细胞浓度下启动甲醇诱导和外源蛋白表达体系的甲醇/能量代谢模式。结果表明,在较低细胞浓度(50 g DCW/L)启动诱导并将温度控制在30 ℃,走向合成monellin前体物质途径的碳流最大(65%),且能与用于ATP再生的碳流形成最佳匹配;monellin的比合成速率与细胞比生长速率完全耦联,且耦联系数最大,比生长速率也较高;理论NADH (能量)利用效率η最高,η在甲醇诱导的绝大部分时段(89%)处于高水平(≥0.8),可以为monellin合成提供足够的能量。因此,该操作条件下,monellin浓度达到2.62 g/L的最高水平,是高细胞密度(100 g DCW/L)启动诱导策略下monellin浓度的2.5?4.9倍。
关键词:碳代谢比 诱导 monellin NADH利用效率 毕赤酵母
Optimizing carbon/energy metabolism to enhance monellin production by Pichia pastoris
Qiangqiang Huai, Luqiang Jia, Jian Ding

 , Shanshan Chen, Jiaowen Sun, Zhongping Shi
, Shanshan Chen, Jiaowen Sun, Zhongping Shi

School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: May 9, 2017; Accepted: July 11, 2017; Published: September 6, 2017
Supported by: National Natural Science Foundation of China (No. 21606106), Natural Science Foundation of Jiangsu Province (Nos. BK20150127, BK20160162)
Corresponding author:Jian Ding. Tel/Fax: +86-510-85326276; E-mail: dingjian@jiangnan.edu.cn
Zhongping Shi. Tel/Fax: +86-510-85918292; E-mail: zpshi@jiangnan.edu.cn
Abstract: In heterologous protein productions by Pichia pastoris, methanol induction is generally initiated when cell density reaches very high level. However, this traditional strategy suffers with the problems of difficulty in DO control, toxic by-metabolites accumulation and low targeted protein titer. Therefore, initiating methanol induction at lower cell concentration is considered as an alternative strategy to overcome those problems. However, the methanol/energy regulation mechanisms of initiating induction at lower concentration are not clear and seldom reported. In this article, with monellin production as a prototype, we analyzed the methanol/energy metabolism in protein expression process using the strategies of initiating induction at both higher/lower cells concentrations. We attempted to interpret the advantages of the "alternative" strategy, via online measurements of methanol consumption, CO2 production and O2 uptake rates. When adopting this "alternative" strategy and maintaining temperature at 30 ℃, carbon flux ratio directing into monellin precursors synthesis reached the highest level of 65%. In addition, monellin synthesis was completely associated with cell growth.
Key words: carbon metabolism ratios induction monellin NADH utilization efficienty Pichia pastoris
Monellin 是西非植物 Dioscoreophyllum cumminsii 浆果中的一种天然甜味蛋白,它的甜度是相同质量蔗糖的3 000倍[1]。与其他的甜蛋白(如pentadin,thaumatin等)相类似,monellin也是一种非碳水化合物甜味剂,对于那些患有严重糖尿病但却嗜好传统糖类食品的人群而言是一种健康食品[2]。Monellin可以制作成安慰甜味剂或甜酵母片供糖尿病人食用[3-4]。Monellin纯品价格昂贵,Sigma公司销售的纯度为95%的monellin价格为$100/100 mg (http://www.zhenghe.cn/JiShuTong/CG_TechnologyInfo_T.aspx?key=24ccc46229984a019028ee1a95034ac3)。Monellin也能够通过微生物的生化反应方法合成。在最新报道中,Chen等利用含有 sacB 启动子和信号肽的枯草芽孢杆菌生产monellin,monellin最大浓度达到0.29 g/L[5]。Liu等在重组酿酒酵母中表达monellin,monellin的最高浓度为0.675 g/L[6]。Leone等利用重组大肠杆菌表达monellin,其浓度大约为0.18 g/L[7]。
甲醇营养型毕赤酵母被认为是一种高效的外源蛋白表达系统[8],该系统具有分子遗传操作方便、细胞易于达到高密度、外源蛋白的表达水平相对较高的特性。重组毕赤酵母表达外源蛋白的过程主要分为两个阶段:生长阶段,以甘油为碳源、获取大量的功能性细胞;诱导阶段,通过流加甲醇来诱导表达重组蛋白[9]。通常情况下,当细胞达到高密度(100?130 g DCW/L)时,将碳源从甘油切换成甲醇,并将甲醇浓度维持在适宜水平开始诱导[10-11]。然而,这种“标准”型外源蛋白表达策略有以下缺点:1)高耗氧特性,通空气供氧、培养后期/诱导期的溶氧浓度(DO)无法控制;2)如果追求高细胞浓度,在细胞培养后期乙醇会积累,导致外源蛋白生产表达的不稳定[12];3)在较低温度(20 ℃)下诱导有利于外源蛋白的表达,可以增强AOX的活性,缓解目标蛋白的降解,但是低温诱导会增加热交换压力与氧气供应的负担/成本[13],特别是在夏季;4)能量(NADH)物质的无效生成可造成过多/无效的甲醇消耗,降低整个发酵性能[9, 14]。为了解决上述问题,人们提出了另一种在低细胞浓度下启动甲醇诱导的操作策略。Wang等使用该策略表达碱性果胶酶,发现在低细胞浓度56.7 g DCW/L下启动甲醇诱导,蛋白生产效率(Qv)最大,比在细胞浓度83.39或124.9 g DCW/L启动诱导的Qv高11.6%和18.4%[15]。Jia等报道指出,在低细胞浓度60 g DCW/L时启动诱导,同时将诱导温度控制在22 ℃的较低水平,提高了聚(乙烯醇)脱氢酶的产量,且DO一直处于可控范围(5%–20%)内[16]。然而,在低/高细胞浓度下启动甲醇诱导时,甲醇/能量变化模式的相关报道很少,诱导性能得到优化的机制/机理尚不明确。
文中分析了在不同细胞浓度(50、100 g DCW/L)及其不同的诱导温度(20、30 ℃)下,毕赤酵母表达monellin的甲醇/能量代谢模式,试图解释在较低细胞浓度下启动诱导的控制策略可以促进monellin表达的原因,为毕赤酵母表达外源蛋白的过程控制提供一些有用信息。
1 材料与方法1.1 菌株甲醇利用慢型重组毕赤酵母 Pichia pastoris KM71菌株由武汉轻工业大学构建并提供。表达载体为pPICZαA,重组质粒为pPICZαA-Mon。
1.2 培养基培养基(g/L)的组成如下所示:YPD培养基(葡萄糖20,酵母提取物10,蛋白胨20)用于种子培养。分批发酵培养基:甘油20,(NH4)2SO4 5,H3PO4 2 (%,V/V),MgSO4 1,CaSO4 0.1,K2SO4 1;PTM1 10 (mL/L),pH 6.0。生长流加培养基:甘油500,(NH4)2SO4 0.5,KH2PO4 0. 5,MgSO4 0.03;PTM1 10 (mL/L),pH 6.0。诱导流加培养基:纯甲醇;PTM1 10 (mL/L),pH 6.0。
1.3 在5 L发酵罐中分批培养毕赤酵母表达monellin毕赤酵母分批培养在5 L发酵罐(百仑生物科技有限公司,BLBIO-5GJ-3-H)中进行,由1个显示屏/控制柜同时驱动2个5 L发酵罐。初始装液量为2.0 L。接种量和通气量分别为14% (V/V)和3 vvm。在细胞生长期,手动提高搅拌转速至700 r/min将DO维持在10%以上。采用标准或改进型DO-Stat[12]策略进行甘油流加,实现细胞高密度培养。如果最大搅拌转速下,DO基线仍不能维持在10%以上,则需要通入纯氧。用5% (V/V)的氨水将pH维持在6.0。甘油/乙醇(副产物)完全耗尽后,开始流加纯甲醇,进入诱导期,并根据需要将诱导温度控制在30 ℃或20 ℃,pH维持不变。使用配有多通道A/D-D/A转换器(台湾研华科技有限公司,PCL-812PG)的工控机,根据甲醇(上海苏泊公司,FC-2002)和DO电极在线测量结果驱动蠕动泵(河北保定兰格有限公司,BT00-50M)进行甲醇/甘油流加。在诱导期,采用甲醇ON-OFF控制策略将甲醇浓度控制在5–7 g/L的范围。甲醇电极也能够在线测量生长期的乙醇浓度并且与DO测量[12]相结合来调节甘油流加速率。利用尾气分析仪(韩国Lokas公司,LKM2000A)在线检测尾气(通入空气)中O2和CO2分压。O2消耗速率(OUR)和CO2释放速率(CER)可通过标准计算公式[17]确定。
1.4 测量细胞/甲醇/monellin浓度和相应的生长/消耗/合成速率细胞浓度通过测量波长600 nm (OD600)处的吸光值测定,根据细胞干重(DCW/L)与OD600值的线性关系曲线(DCW/L=0.25×OD600)计算DCW/L。甲醇和乙醇浓度通过气相色谱仪(上海精密科学仪器有限公司,GC112A,FID检测器;Alpha-Col AC20毛细管柱,澳大利亚SGE国际有限公司)进行测定。中间代谢产物甲醛和甲酸的浓度通过高效液相色谱仪(反向ZORBAX SB C18柱,254 nm,紫外检测器)进行测定。流动相是20 mmol/L的Na2PO4溶液(99%)和乙腈(1%)。进样量10 μL,柱温为28 ℃。电泳板的Marker泳道加入20 μL分子量已知的蛋白溶液。聚丙烯酰胺凝胶电泳(12%分离胶)以标准分子量作为基准直至溴酚蓝达到分离胶的底部。经过聚丙烯酰胺凝胶电泳分析后,通过G:Box生物成像系统和基因工具软件(英国SynGene公司)对发酵moenllin的浓度进行定量。每个条带扫描三次取平均值作为定量结果。此外,以10 g/L的蔗糖溶液为对照,对无细胞发酵上清液进行甜味检测。电子天平(上海海康电子仪器厂,JA1102)通过RS232通信接口与工控机连接,通过测量甲醇流加瓶的重量减少量在线检测甲醇消耗量(g/L)。细胞浓度(X)、甲醇消耗量(S)和monellin浓度(P)分别与独立变量(诱导)时间进行二次多项式拟合,以浓度对时间t进行微分(dX/dt,dS/dt,dP/dt),确定细胞生长/甲醇消耗/monellin合成的比速率。
1.5 碳分配比率计算如图 1所示,碳(甲醇)代谢用于4个不同部分:细胞生长、维持代谢、monellin合成和供能。其中,根据经典生物工程教科书[18-20],用于细胞生长和维持代谢的碳流比率可由式1确定。
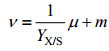 | (1) |
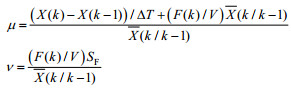 | (2) |
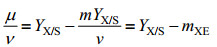 | (3) |
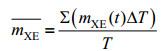 | (4) |
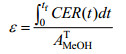 | (5) |
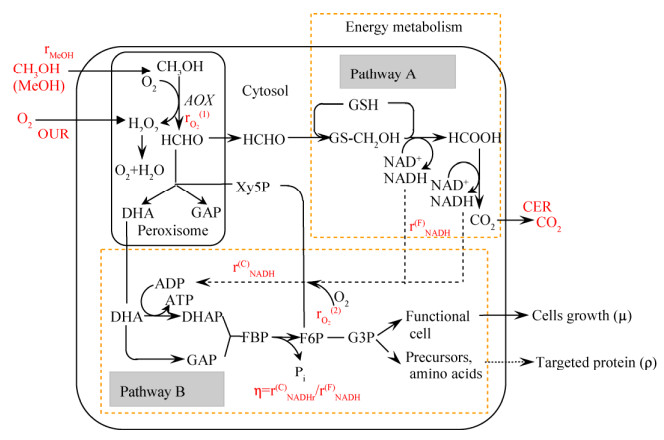 |
| 图 1 甲醇营养型毕赤酵母表达monellin简化代谢途径 Figure 1 Simplified methanol metabolic pathways by P. pastoris for monellin production |
| 图选项 |
式中的CER,tf和AMeOHT分别表示CO2释放速率、总诱导时间和甲醇总消耗量。最后,用于monellin合成(前体)的甲醇消耗比率(γ)可由式6确定。
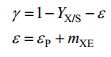 | (6) |
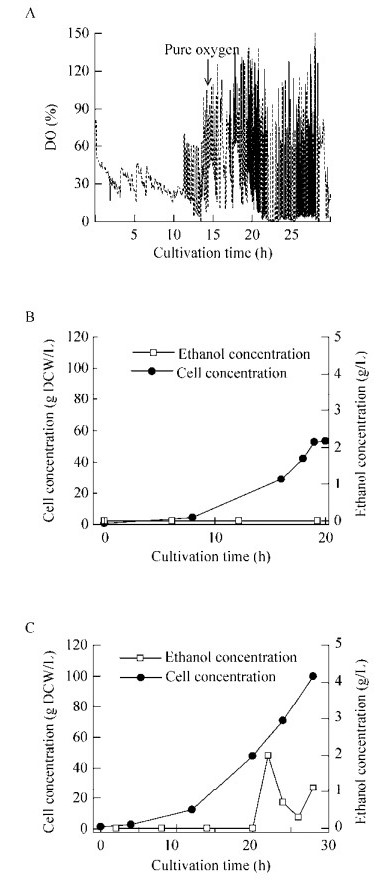 |
| 图 2 不同甘油流加/通气控制策略下细胞生长期内的DO、细胞和乙醇浓度的变化 Figure 2 Time courses of DO, cell, ethanol concentrations within growth phase with different glycerol feeding/aeration strategies |
| 图选项 |
具体的诱导操作策略如下:批次#1?2在高细胞浓度(100 g DCW/L)下启动甲醇诱导,诱导温度分别是30 ℃ (批次#1)和20 ℃ (批次#2);批次#3?4在低细胞浓度(50 g DCW/L)下开始诱导,并将诱导温度控制在30 ℃ (批次#3)和20 ℃ (批次#4)。批次#3中,monellin浓度达到了2.62 g/L的最高水平;其次是批次#4,monellin浓度为1.87 g/L (图 3C)。但是,当采用标准诱导策略(高细胞浓度下启动诱导)时,monellin浓度分别为1.04 g/L (批次#2,20 ℃)和0.54 g/L (批次#1,30 ℃),发酵性能很差。上述结果也总结归纳于表 1中。此外,收集无细胞发酵上清液检测其甜度。双盲测试结果表明,批次#3中收集得到的上清液甜度明显高于其他批次中的上清液甜度。图 3B和3D是批次#1?4中monellin浓度随时间变化的SDS-PAGE图,Monellin分子量为10.7 kDa。批次#3?4中,monellin表达量随诱导时间逐渐增加,而批次#1?2中的monellin浓度基本不变。此外,无论胞内还是胞外,甲醇代谢的中间毒副产物甲醛和甲酸均未检测到(数据未显示)。
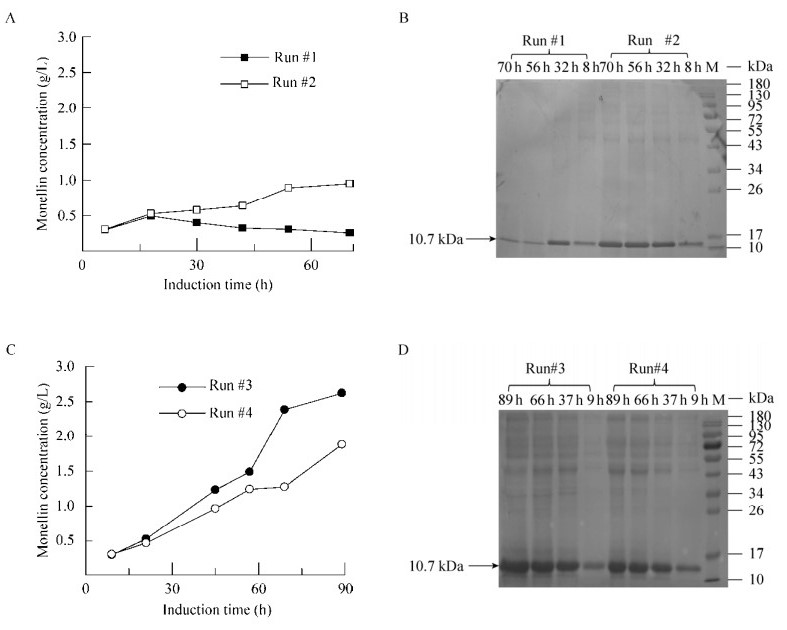 |
| 图 3 不同诱导策略下monellin浓度和SDS分析结果 Figure 3 Monellin concentrations and SDS analysis results with different induction strategies |
| 图选项 |
表 1 不同诱导策略下毕赤酵母表达monellin的发酵性能比较Table 1 Fermentation performance of monellin synthesis by Pichia pastoris using different induction strategies
| Run# | Induction temperature(℃) | Initial DCW*(g/L) | Induction time (h) | Max monellin concentration(g/L) | Average MeOHconcentration (g/L) | Average DO(%) | YP/S+(%) |
| 1 | 30 | 97.5 | 70 | 0.54 | ~5.0 | ~0 | 0.11 |
| 2 | 20 | 106.0 | 70 | 1.04 | ~5.0 | ~0 | 0.29 |
| 3 | 30 | 55.6 | 89 | 2.62 | ~5.0 | 0~10 | 0.75 |
| 4 | 20 | 53.4 | 89 | 1.87 | ~5.0 | ~0 | 0.33 |
| 1) DCW: dry cells weight; MeOH: methanol; 2)*: cell concentration when methanol induction was initiated; 3) +: monellin yield on methanol. monellin concentrations and methanol consumption data at induction time 70 h were used for unified purpose. | |||||||
表选项
如图 1所示,碳(甲醇)代谢用于4个不同部分:细胞生长、维持代谢、monellin合成和供能。碳流分配比率可由公式1?6确定。另外,我们假定monellin比合成速率(ρ)和细胞比生长速率(μ)遵从Luedeking-Piret模型,即
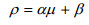 | (7) |
一般认为,乙醇、乳酸等初级代谢产物发酵生产属于代谢产物合成/细胞生长完全耦联型,氨基酸、某些有机酸等发酵生产属于代谢产物合成/细胞生长半耦联型,而抗生素等次级代谢产物的发酵生产则属于代谢产物合成/细胞生长非耦联型。
2.2 不同诱导策略下毕赤酵母表达monellin的碳代谢模式图 4是不同诱导策略下的μ、v和ρ的变化模式。其中,图 4B和图 4C也间接显示了二级发酵参数YX/S、α和β的差异。表 2则总结归纳了不同诱导策略(批次)下主要二级发酵参数YX/S、mXE、εP、γ、α和β的差异和变化。
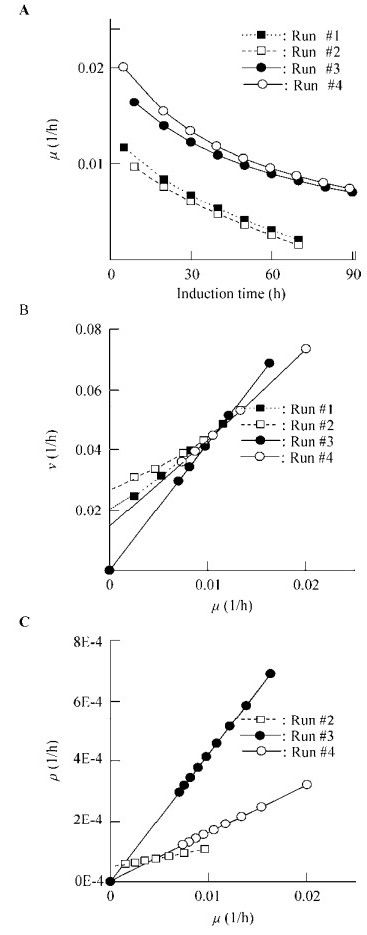 |
| 图 4 不同诱导策略下毕赤酵母表达monellin的碳代谢模式 Figure 4 Carbon metabolism modes for monellin synthesis by P. pastoris with different induction strategies |
| 图选项 |
上述结果表明,采用低细胞浓度下启动诱导的策略,1)细胞比生长速率高但用于细胞生长的碳流较少(图 4B中,斜率1/YX/S较大)。2) 30 ℃下monellin的比合成速率与细胞比生长速率完全耦联、耦联系数(α)最大,且细胞比生长速率μ也较高(第二大),这可能是批次#3中monellin浓度达到最大的一个原因。3)甲醇供能途径A中用于能量NADH合成的甲醇消耗比率εP较大(用于为monellin合成供能)。低细胞浓度下诱导,εP=22.7%?29.2%;高细胞浓度下诱导,εP=14.0%?19.0%,整个代谢过程中的细胞/monellin合成有足够的能量支撑。4) 30 ℃下用于monellin前体合成的甲醇利用比率γ最大(65.2%),而且与较高的能量支撑相匹配。此时,应该有较多的前体物质(氨基酸等)[22]可用于甜味蛋白monellin合成。
需要说明的是,在批次#1中,由于诱导表达后产生的monellin立即降解(图 3A),数据不符合Luedeking-Piret模型,因此相应参数未在图 4和表 2中显示。
表 2 不同诱导策略下、毕赤酵母表达monellin发酵过程的主要二级发酵参数Table 2 Major secondary parameters in monellin fermentation by Pichia pastoris using different induction strategies
| Carbon distribution ratios (%) | Monellin synthesisparameters (×10-5) | η distribution(%) | ||||||
| Run# | Cells growth YX/S | MaintenancemXE | EnergyεP | Precursorsγ | α | β | η > 0.8 | 0≤η≤0.8 |
| 1 | 18.9 | 19.3 | 14.0 | 47.8 | – | – | 0.0 | 100.0 |
| 2 | 29.3 | 40.2 | 19.0 | 11.5 | 610 | 4 | 33.9 | 66.1 |
| 3 | 12.1 | 0.0 | 22.7 | 65.2 | 3 650 | 0 | 88.8 | 11.2 |
| 4 | 16.5 | 10.1 | 29.2 | 44.2 | 1 590 | 0 | 62.8 | 37.2 |
| Runs # coincided with those in Table 1. | ||||||||
表选项
2.3 不同诱导策略下毕赤酵母表达monellin的能量利用效率能量利用效率是增强毕赤酵母表达monellin的另一个重要因素。碳代谢和能量代谢必须相匹配才能提高发酵性能。如表 2所示,批次#1和批次#3中走向前体物质合成途径的碳流比率相差较大(γ=48%,批次#1;γ=65%,批次#3),走向能量代谢(用于monellin合成)的碳流比率相差也很大(批次#1,εP=14%;批次#3,εP=23%)。因此,批次#3中的甲醇/能量代谢比例是比较匹配的。另外,能量利用效率在毕赤酵母代谢甲醇的过程中是非常重要的。该效率取决于氧化磷酸化反应中的氧气消耗速率,并直接影响到用于细胞生长/ monellin合成的能量供给-ATP再生速率。如图 1所示,在甲醇代谢过程中有两个耗氧步骤。第一步是甲醇经AOX酶的催化生成甲醛(HCHO),这是甲醇代谢的中枢和第一个代谢反应。这个步骤中O2消耗速率(rO2(1))由式9确定。
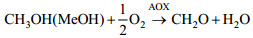 | (8) |
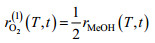 | (9) |
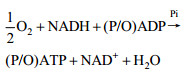 | (10) |
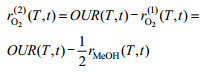 | (11) |
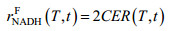 | (12) |
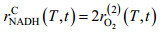 | (13) |
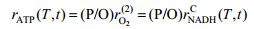 | (14) |
理论上ATP再生速率rATP取决于公式14中的rO2(2)或rNADHC。假设不同诱导温度下P/O比例恒定不变,ATP再生速率rATP可由rATP=(P/O)rNADHC表示。这里,我们定义一个新参数η来表示能量利用效率。
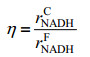 | (15) |
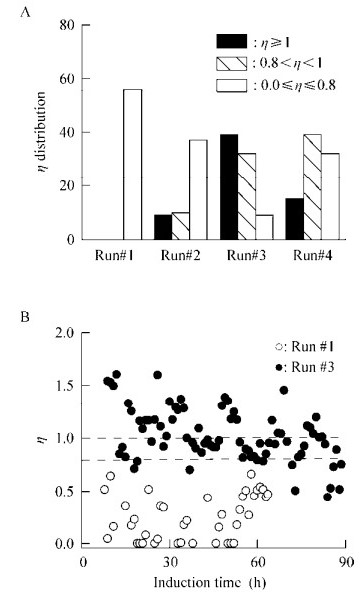 |
| 图 5 不同诱导策略下毕赤酵母表达monellin过程的能量(NADH)效率η分布模式 Figure 5 5 Energy (NADH) distribution patterns η in monellin production by P. pastoris with different induction strategies |
| 图选项 |
如图 3和表 1所示,批次#1中表达monellin浓度最低,且诱导表达后立即降解。原因可能有两个:1)批次#1中,用于供能/蛋白合成的甲醇利用比例(εP/γ)较低,εP/γ=0.29,供能/蛋白合成的碳流比率低;而批次#3的εP/γ较高,εP/γ=0.35,供能/蛋白合成的碳流比率相对匹配。2)批次#1中的NADH利用效率η低于0.8 (η≤0.8)的比例为100%,极低的能量效率是导致最低monellin浓度的另一个重要原因。相反,批次#3中、η数据的绝大多数(89%)都高于0.8 (η≥0.8),表明途径A中产生的NADH能高效地用于ATP再生以支撑monellin合成。综合这两个因素,发酵批次#3的monellin浓度达到2.62 g/L的最高水平。
需要指出的是,η > 1是不符合实际的(η=1是理论上的最大值)。不符实际数据(η > 1)的产生源于OUR、CER和甲醇消耗速率的在线测量。因为这些在线测量系统是独立的,同时在实际操作过程中OUR和CER对于尾气分析仪干燥剂(硅胶)的频繁更换非常敏感。另外,计量甲醇添加量的电子天平的零点漂移较大,每10 h “负漂移”在10?20 g左右。由于低细胞密度诱导条件下,甲醇添加速度较慢,monellin能持续表达,诱导时间长,根据公式11、13和15,该“负漂移”实际上间接加大了η计算公式的分子且贡献较大,导致η > 1数据的频繁出现。相反,在高细胞密度下启动甲醇诱导,甲醇添加速度相对快。这时,零点漂移虽然也加大了η计算公式的分子,但贡献率相对较低。同时,该条件下,能量利用效率参数η也确实低,所以在观察窗口内η > 1的数据一个都没有出现。总之,大多数η > 1的数据均处于1.00-1.25,稍高于1的区域内。考虑到大多数发酵过程中严重的测量噪声,因此,上述数据还是可以接受的。虽然批次#3中有许多η的数据大于1,但是批次#1中所有η的数据均未超过0.8。这些数据至少可以解释这两个极端批次(#1和#3)中NADH利用效率与monellin浓度的关联性。
最后,必须承认目标蛋白(monellin)对甲醇的得率YP/S低下,仅有0.11%-0.75% (表 1)。其中,批次#3的得率最高,达到0.75%。这与许多文献中目标蛋白/抗体对甲醇的得率低是相一致的(0.020%-0.093%)[12, 23-26]。目标产物产量与甲醇消耗量比例(得率)很低,但并不意味着走向目标蛋白合成前体途径的碳代谢比例也如此低。因为考虑到不正确的蛋白折叠/糖基化修饰等因素,大部分合成前体并不能有效地转化成目标蛋白。
3 结论毕赤酵母表达monellin过程中,在低细胞浓度下启动甲醇诱导,并将诱导温度控制在30 ℃的发酵策略最优,monellin浓度最高。我们分析了此诱导策略与其他诱导策略下的甲醇/能量代谢模式。结果表明,采用该最优策略时,用于monellin前体物质合成和NADH合成的碳流充足;用于支撑monellin合成的能量(NADH)利用效率最高;monellin合成与细胞生长完全耦联,耦联系数α最大且细胞生长速率较高,monellin合成速率最大。该诱导策略还可以缓解热交换压力和供氧负担,有利于降低发酵成本。
参考文献
| [1] | Kondo K, Miura Y, Sone H, et al. High-level expression of a sweet protein, monellin, in the food yeast Candida utilis.Nat Biotechnol, 1997, 15(5): 453–457.DOI: 10.1038/nbt0597-453 |
| [2] | Temussi PA. Why are sweet proteins sweet? Interaction of brazzein, monellin and thaumatin with the T1R2-T1R3 receptor.FEBS Lett, 2002, 526(1/3): 1–4. |
| [3] | Masuda T, Kitabatake N. Developments in biotechnological production of sweet proteins.J Biosci Bioeng, 2006, 102(5): 375–389.DOI: 10.1263/jbb.102.375 |
| [4] | Peon J, Pal SK, Zewail AH. Hydration at the surface of the protein monellin: dynamics with femtosecond resolution.Proc Nat Acad Sci USA, 2002, 99(17): 10964–10969.DOI: 10.1073/pnas.162366099 |
| [5] | Chen ZJ, Heng C, Li ZY, et al. Expression and secretion of a single-chain sweet protein monellin in Bacillus subtilis by sacB promoter and signal peptide.Appl Miocrobiol Biotechnol, 2007, 73(6): 1377–1381.DOI: 10.1007/s00253-006-0609-x |
| [6] | Liu J, Yan DZ, Zhao SJ. Expression of monellin in a food-grade delivery system in Saccharomyces cerevisiae.J Sci Food Agric, 2015, 95(13): 2646–2651.DOI: 10.1002/jsfa.2015.95.issue-13 |
| [7] | Leone S, Sannino F, Tutino ML, et al. Acetate: friend or foe? Efficient production of a sweet protein in Escherichia coli BL21 using acetate as a carbon source.Microb Cell Fact, 2015, 14: 106.DOI: 10.1186/s12934-015-0299-0 |
| [8] | Spadiut O, Zalai D, Dietzsch C, et al. Quantitative comparison of dynamic physiological feeding profiles for recombinant protein production with Pichia pastoris.Bioprocess Biosyst Eng, 2014, 37(6): 1163–1172.DOI: 10.1007/s00449-013-1087-z |
| [9] | Ding J, Zhang CL, Gao MJ, et al. Enhanced porcine circovirus Cap protein production by Pichia pastoris with a fuzzy logic DO control based methanol/sorbitol co-feeding induction strategy.J Biotechnol, 2014, 177: 35–44.DOI: 10.1016/j.jbiotec.2014.02.018 |
| [10] | Hong F, Meinander NQ, J nsson LJ. Fermentation strategies for improved heterologous expression of laccase in Pichia pastoris.Biotechnol Bioeng, 2002, 79(4): 438–449.DOI: 10.1002/bit.v79:4 |
| [11] | Lee CY, Lee SJ, Jung KH, et al. High dissolved oxygen tension enhances heterologous protein expression by recombinant Pichia pastoris.Process Biochem, 2003, 38(8): 1147–1154.DOI: 10.1016/S0032-9592(02)00280-7 |
| [12] | Ding J, Gao MJ, Hou GL, et al. Stabilizing porcine interferon-α production by Pichia pastoris with an ethanol on-line measurement based DO-Stat glycerol feeding strategy.J Chem Technol Biotechnol, 2014, 89(12): 1948–1953.DOI: 10.1002/jctb.2014.89.issue-12 |
| [13] | Jin H, Liu GQ, Dai KK, et al. Improvement of porcine interferon-α production by recombinant Pichia pastoris via induction at low methanol concentration and low temperature.Appl Biochem Biotechnol, 2011, 165(2): 559–571.DOI: 10.1007/s12010-011-9275-2 |
| [14] | Gao MJ, Dong SJ, Yu RS, et al. Improvement of ATP regeneration efficiency and operation stability in porcine interferon-α production by Pichia pastoris under lower induction temperature.Korean J Chem Eng, 2011, 28(6): 1412–1419.DOI: 10.1007/s11814-010-0527-6 |
| [15] | Wang HL, Li JH, Liu L, et al. Increased production of alkaline polygalacturonate lyase in the recombinant Pichia pastoris by controlling cell concentration during continuous culture.Bioresour Technol, 2012, 124: 338–346.DOI: 10.1016/j.biortech.2012.08.027 |
| [16] | Jia DX, Liu L, Wang HL, et al. Overproduction of a truncated poly (vinyl alcohol) dehydrogenase in recombinant Pichia pastoris by low-temperature induction strategy and related mechanism analysis.Bioprocess Biosyst Eng, 2013, 36(8): 1095–1103.DOI: 10.1007/s00449-012-0863-5 |
| [17] | Jin S, Ye KM, Shimizu K. Metabolic pathway analysis of recombinant Saccharomyces cerevisiae with a galactose-inducible promoter based on a signal flow modeling approach.J Ferment Bioeng, 1995, 80(6): 541–551.DOI: 10.1016/0922-338X(96)87729-4 |
| [18] | Bailey JE, Ollis DF. Biochemical Engineering Fundamentals.2nd ed.New York, USA: McGraw-Hill Co. Ltd., 1986: 390. |
| [19] | 山根恒夫. 生物反応工学.2nd ed.日本東京: 産業図書株式会社, 1991: 171. |
| [20] | Blanch HW, Clark DS. Biochemical Engineering.New York, USA: Marcel Dekker Inc., 1996: 200-201. |
| [21] | Jungo G, Schenk J, Pasquier M, et al. A quantitative analysis of the benefits of mixed feeds of sorbitol and methanol for the production of recombinant avidin with Pichia pastoris.J Biotechnol, 2007, 131(1): 57–66.DOI: 10.1016/j.jbiotec.2007.05.019 |
| [22] | ?el?k E, ?al?k P, Oliver SG. Metabolic flux analysis for recombinant protein production by Pichia pastoris using dual carbon sources: effects of methanol feeding rate.Biotechnol Bioeng, 2010, 105(2): 317–329.DOI: 10.1002/bit.v105:2 |
| [23] | Fujiki Y, Kumada Y, Kishimoto M. Phase analysis in single-chain variable fragment production by recombinant Pichia pastoris based on proteomics combined with multivariate statistics.J Biosci Bioeng, 2015, 120(2): 187–192.DOI: 10.1016/j.jbiosc.2014.12.015 |
| [24] | Katakura Y, Zhang WH, Zhuang GQ, et al. Effect of methanol concentration on the production of human-β2-glycoprotein I domain V by a recombinant Pichia pastoris: A simple system for the control of methanol concentration using a semiconductor gas sensor.J Ferment Bioeng, 1998, 86(5): 482–487.DOI: 10.1016/S0922-338X(98)80156-6 |
| [25] | Gurramkonda C, Adnan A, Gaebel T, et al. Simple high-cell density fed-batch technique for high-level recombinant protein production with Pichia pastoris: application to intracellular production of Hepatitis B surface antigen.Microb Cell Fact, 2009, 8: 13.DOI: 10.1186/1475-2859-8-13 |
| [26] | Trinh LB, Phue JN, Shiloach J. Effect of methanol feeding strategies on production and yield of recombinant mouse endostatin from Pichia pastoris.Biotechnol Bioeng, 2003, 82(4): 438–444.DOI: 10.1002/(ISSN)1097-0290 |
