

中国农业大学 植物病理系, 北京 100193
收稿日期:2017-04-12;接收日期:2017-07-14 基金项目:国家自然科学基金(Nos.31272082,31572045),国家重点基础研究发展计划(973计划)(No.2015CB150605),国家重点研发计划重点专项(No.2017YFD0201108)资助
作者简介:张力群 2001年毕业于日本神户大学, 获得博士学位。现任中国农业大学植物保护学院植物病理系教授, 博士生导师。主要研究方向为植物病害生物防治和植物相关细菌分子遗传, 主要研究领域包括假单胞菌Pseudomonas抗生素的合成与调控、抗逆信号传导和病害生物防治机制; 植物病原细菌Ⅲ型分泌系统和群体感应系统抑制剂的筛选和抑制机制。主持国家自然科学基金课题7项, 发表SCI论文20余篇
摘要:群体感应(Quorum sensing,QS)是细菌在进化过程中形成的依赖于群体密度的细菌间交流方式。许多革兰氏阴性细菌以N-酰基高丝氨酸内酯(AHL)为信号分子,感应自身群体密度并调控致病基因表达。因此,淬灭AHLs信号分子可防治此类细菌引起的植物病害。本实验室前期已筛选得到了一株具有AHLs信号降解能力的不动杆菌菌株Acinetobacter sp.77,本研究通过基因组文库筛选,自菌株77中克隆得到具有AHLs降解活性的基因aidE。该基因编码268个氨基酸。序列一致性比较发现aidE的氨基酸序列与吉伦伯不动杆菌Acinetobacter gyllenbergii CIP110306中β-内酰胺酶一致性高达95%,但与已知的AHLs降解酶序列一致性较低,最高为缓黄分支杆菌Mycobacterium lentiflavum中AHL内酯酶AttM/AiiB家族蛋白(CQD23908.1),一致性仅为33%。通过高压液相色谱(HPLC)分析AidE蛋白处理N-己酰基高丝氨酸内酯(C6-HSL)的反应产物,证明aidE为AHL内酯酶。序列比对研究发现,aidE基因在不动杆菌属中并不保守,其在菌株77基因组中的上下游的基因排列存在菌株水平的特异性,且aidE基因下游存在疑似IS插入序列,上述证据表明aidE基因有可能是通过水平转移进入Acinetobacter sp.77基因组中,或其在基因组中的位置发生过重排。表达aidE的软腐果胶杆菌Z3-3中完全检测不到AHLs信号产生,且致病力明显降低。综上所述,aidE为新发现的AHL内酯酶。在防治依赖QS系统表达致病性的细菌病害中具有应用潜力。
关键词:群体感应 酰基高丝氨酸内酯 不动杆菌 aidE
AidE encodes an N-acyl homoserine lactonase in Acinetobacter
Liu Chunyan, Guo Song, Turak Ali, Zhang Junwei, Zhang Liqun


Department of Plant Pathology, China Agricultural University, Beijing 100193, China
Received: April 12, 2017; Accepted: July 14, 2017
Supported by: National Natural Science Foundation of China (Nos. 31272082, 31572045), National Basic Research Program of China (973 Program) (No. 2015CB150605), National Key Research and Development Program (No. 2017YFD0201108)
Corresponding author:Liqun Zhang.Tel:+86-10-62731464;E-mail:zhanglq@cau.edu.cn
Abstract: Quorum sensing (QS) is a cell-cell communication mechanism that allows bacterial populations to coordinate gene expression in response to cell density.N-acylhomoserine lactones (AHL) are used as quorum-sensing signal molecules by many Gram negative bacteria.Acinetobacter sp.77, an AHL-degrading bacterium, was isolated in our previous work. The gene aidE for AHL inactivation was cloned in this study by screening a genomic DNA library.The deduced protein AidE is 268 amino acids in length and shares a high identity (95%) with the beta-lactamase family protein in Acinetobacter gyllenbergii CIP110306, but low identities with known AHL-degrading enzymes.HPLC analysis of the AidE-degraded C6-HSL products revealed that AidE functioned as an AHL lactonase.Sequences alignment suggested that the aidE gene is not conserved in Acinetobacter species, flanking sequences of aidE and their arrangement are specific in Acinetobacter sp. 77 genome, and some IS insertion sequences were found downstream of the aidE gene.These evidences indicated that the aidE gene might be foreign DNA taken up via horizontal gene transferring or had changed its relative location due to the genome rear-arrangement.Expression of the aidE gene in Pectobacterium carotovorum subsp.carotovorum Z3-3 significantly reduced its AHL production as well as the pathogenicity on host plants, indicating that AidE was able to effectively quench quorum sensing-dependent functions in bacteria.In conclusion, aidE is a newfound AHL-lactonase with a potential for suppression of bacterial infections.
Key words: quorum sensing (QS) N-acylhomoserine lactones (AHL) Acinetobacter sp. aidE
群体感应(Quorum sensing,QS)是细菌间典型的群体密度依赖型交流方式。具有QS系统的细菌能够合成并向胞外分泌小分子信号。信号分子在胞外环境中积累并被细菌识别,用来检测自身群体密度。当细菌的群体密度达到一定阈值时,信号分子和相应受体蛋白结合,启动下游相关基因的表达[1]。
QS系统在革兰氏阴性细菌中广泛存在,植物病原细菌中绝大多数以N-酰基高丝氨酸内酯(AHL)为信号分子,调控致病性的表达,如:胡萝卜软腐果胶杆菌Pectobacterium carotovorum中植物细胞壁降解酶等毒力因子的表达[2];根癌土壤杆菌Agrobacterium tumefaciens中Ti质粒的转移[3];西瓜食酸菌Acidovorax citrulli的游动性和在甜瓜植株及果实上的致病力[4];丁香假单胞菌Pseudomonas syringae pv. syringae在宿主植物上的定殖及致病性[5]等。因此,淬灭AHL信号分子以破坏细菌QS调控功能是防治此类病害的可行策略。
目前已发现的AHLs信号降解酶包括内酯酶(AHL-lactonase)、酰基转移酶(AHL-acylase)和氧化还原酶(Oxidoreductases)三大类[6-8]。AHL内酯酶通过水解AHLs的内酯键产生脂酰高丝氨酸,破坏信号分子结构。已报道的AHL内酯酶根据其蛋白结构及金属离子依赖性的差异可分为不同类群,包括以蜡样芽胞杆菌Bacillus cereus 240B1中AiiA240B1为代表的金属-β-内酰胺类降解酶[9],苍白杆菌Ochrobactrium sp. T63中AidH[10]所属的α/β-水解酶家族降解酶,红串红球菌Rhodococcus erythropolis中磷酸三脂酶家族的QsdA[11],根瘤菌Rhizobium sp. strain NGR234中双烯内酯水解酶家族的DhlR[8]等。近年来利用宏基因组学方法的研究增加了AHLs降解酶的多样性。2008年Riaz等从宏基因组文库中筛选到编码AHL-内酯酶活性的qlcA基因。2009年Schipper等通过宏基因组学筛选到4个AHL-内酯酶:BpiB01、BpiB04、BpiB07和BpiB05,其中BpiB07与已知的内酯酶具有一致性,为双烯内酯水解酶家族蛋白,BpiB04为糖基水解酶家族蛋白,而BpiB01和BpiB05则与已报道的AHL-内酯酶没有明显的同源性[12-13]。表达aiiA基因的软腐果胶杆菌P. carotovorum AHLs产量明显减少,在马铃薯、白菜、茄子、胡萝卜和芹菜上造成的软腐症状明显减弱[9]。表达AiiA内酯酶的转基因植物马铃薯、烟草、拟南芥等提高了对软腐病菌的侵染抗性,植物不发病或发病时间延后[14-17]。
本实验室在新疆阿瓦提县植物根围土壤中筛选到了一株具有AHLs信号分子降解能力的菌株77,经16S rRNA基因序列分析鉴定为不动杆菌属Acinetobacter细菌。本文通过基因组文库筛选和亚克隆分析,得到具有AHL信号降解功能的基因aidE,明确了AidE降解AHL信号的机制,并初步研究了其生物学及生物防治功能,为植物病害生防提供新的资源。
1 材料与方法1.1 细菌菌株、质粒及生长条件本实验中所用菌株和质粒分别列于表 1。不动杆菌77、荧光假单胞菌2P24和软腐果胶杆菌Z3-3在LB (Luria-Bertani)培养基(蛋白胨10 g/L,酵母提取物5 g/L,NaCl 5 g/L)中28 ℃培养;大肠杆菌DH5α、BL21及其衍生菌株在LB培养基中37 ℃培养;土壤杆菌NTL4 (pZLR4) 在ABM基本培养基(每100 mL中含20×盐溶液5 mL、20×缓冲液5 mL、10%甘露醇2 mL和无菌水88 mL。其中20×盐溶液:NH4Cl 20 g/L、KCl 3 g/L、MgSO4·7H2O 6 g/L、CaCl2·2H2O 0.2 g/L、FeSO4·7H2O 0.06 g/L,调节pH为7.2;20×缓冲液:NaH2PO4 23 g/L、K2HPO4 60 g/L,调节pH为7.0;储存液分别高压灭菌保存)中28 ℃培养。抗生素使用终浓度分别为:氨苄青霉素(Ap) 50 μg/mL,卡那霉素(Km) 50 μg/mL,氯霉素(Cm) 20 μg/mL,庆大霉素(Gm) 30 μg/mL。5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-Gal)使用终浓度40 μg/mL。
表 1 菌株和质粒Table 1 Strains and plasmids
| Strains and plasmids | Characteristics | Source or reference |
| Strains | ||
| Agrobacterium tumefaciens NTL4 (pZLR4) | Gmr; A. tumefaciens NT1 derivative carrying a traG::lacZ reporter fusion | [18] |
| Escherichia coli | ||
| DH5α | φ80 lacZ Δ M15 Δ (lacZYA-argF) U169 hsdR17 recA1 endA1 thi-1 | [19] |
| Pectobacterium carotovorum | ||
| P. carotovorum subsp. carotovorum Z3-3 | Wild-type | Laboratory stock |
| Z3-3 (pBBR1MCS-2) | Kmr; strain Z3-3 containing pBBR1MCS-2 | This paper |
| Z3-3 (pB77E) | Kmr; strain Z3-3 containing pB77E | This paper |
| Acinetobacter sp. 77 | Wild-type | This paper |
| Acinetobacter sp. 77Δ aidE | Derivative of Acinetobacter sp.77, aidE in-frame deletion | This paper |
| Plasmids | ||
| pBluescript Ⅱ SK(+) | Apr, ColE1 origin | Stratagene |
| pMD18 | Apr; ColE1 origin, cloning vector | Laboratory stock |
| pQ30 | Apr; pMD18 containing a 8.0-kb fragment with AHL-degrading activity | This paper |
| pHSG399 | Cmr; ColE1 origin | TaKaRa |
| pCH6 | Cmr; pHSG399 containing a 1.2-kb Hin d Ⅲ fragment with aidE gene | This paper |
| pBBR1MCS-2 | Kmr; Escherichia -Pseudomonas shuttle vector | [20] |
| pB77E | Kmr; pBBR1MCS-2 containing a 1.2-kb Hin d Ⅲ fragment With aidE gene | This paper |
| pET-22b(+) | Apr; expression vector | Novagen |
| pETAidE | Apr; pET-22b(+) containing aidE gene | This study |
| pSR47Δ aidE | Kmr; Suicide plasmid pSR47s containing deleted aidE gene | This paper |
| pRK600 | Cmr; Col E1 replicon with RK2 transfer region, helper plasmid | [21] |
| Apr, Kmr, Gmr and Cmr indicate resistance to ampicillin, kanamycin, gentamycin and chloromycetin, respectively. | ||
表选项
1.2 方法1.2.1 DNA试验操作细菌染色体及质粒DNA的提取、限制性内切酶酶切分析和PCR参见分子克隆实验技术手册。核苷酸测序由北京三博远志生物技术有限责任公司完成。核苷酸及其编码的氨基酸序列通过NCBI (http://www. ncbi. nlm. nih. gov)中的软件分析。
1.2.2 aidE基因的筛选与克隆Acinetobacter sp. 77基因组文库的构建参照文献[22]。随机挑取菌株77基因组文库转化子,接种到180 μL液体LB培养基中,于28 ℃、140 r/min振荡培养12 h;随后加入15 μL (10 μmol/L) N-3-氧代辛酰基高丝氨酸内酯(C8-oxo-HSL)信号分子,混匀后置于摇床上140 r/min、28 ℃振荡培养6 h,分别用信号纯品及纯水作对照;取3 μL培养液滴于预先制备的报告菌平板上(见1.2.5),选取阳性克隆并提取质粒,经过限制性内切酶酶切分析后确定目的片段,将其连接至质粒pMD18并测序(北京三博远志生物技术有限责任公司)。
1.2.3 aidE基因缺失突变体构建及AHL信号降解功能检测根据aidE基因及侧翼序列的测序结果,设计两对引物77-a、77-b和77-c和77-d (表 2),分别以pQ30为模板,PCR扩增得到aidE基因上下两段侧翼序列。PCR扩增条件为:94 ℃变性5 min;94 ℃变性40,55 ℃复性40,72 ℃延伸1 min,循环数为35;72 ℃充分延伸10 min。两条PCR产物经相应限制性内切酶酶切后连接同一载体pSR47s,得到重组自杀载体pSR47ΔaidE (图 1)。将pSR47ΔaidE转化DH5α(λ-pir),利用三亲交配将pSR47ΔaidE转入Acinetobacter sp. 77,筛选二次重组突变体,并用检测引物AidE-F、AidE-R (表 2)进行PCR验证,最终得到aidE基因缺失菌株。为检测相关菌株AHL信号降解功能,利用Agrobacterium tumefaciens NTL4 (pZLR4) 信号检测系统,在野生型Acinetobacter sp. 77和aidE基因缺失突变体Acinetobacter sp. 77 ΔaidE发酵液中分别加入4 μL 100 μmol/L的C8-oxo-HSL信号分子纯品共培养4 h,设置dd H2O处理的信号纯品作对照。
表 2 引物序列Table 2 Primer sequences
| Primer name | Primer sequence (5′-3′)a | Size (bp) |
| 77-a | TCGAGCTCGTGACGGGGCATGCACC | 1 131 |
| 77-b | TTGGATCCGCCACATCCTCACCGGG | |
| 77-c | TTGGATCCGGACATGATCCTGAGCAATCG | 1 247 |
| 77-d | TTGTCGACGCAGCCCGTGTATTGGG | |
| AidE-F | TAACATATGATGGAAGAAGTTAAATTATATGCC | 350 |
| AidE-R | TAACTCGAGCAGACTAGCTAGAGTCTCTGAGG | |
| pQ30-2335 | CGCCTTTGTTCTTTATGGAC | 1 241 |
| pQ30-3556 | CGTGTATTGGGTATTAGTCG | |
| a Bold fonts indicate the recognition sites of the corresponding restriction enzymes. | ||
表选项
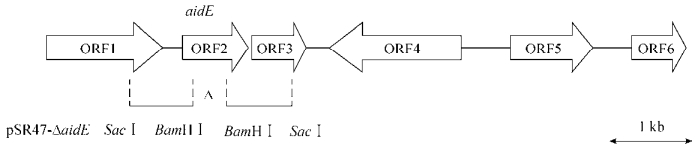 |
| 图 1 质粒pQ30 (ORF2为aidE)功能片段的物理图谱及aidE基因的缺失结构 Figure 1 Physical map of the functional fragment in pQ30 (the ORF2 represents for aidE) and the structure of aidE gene deletion mutant. |
| 图选项 |
1.2.4 生长曲线的测定软腐果胶杆菌Z3-3及其相应衍生菌接种于5 mL的LB培养液中,28 ℃、140 r/min水浴摇培至稳定生长期;按1:1 000 (V:V)的比例接于50 mL的LB培养液中,28 ℃,130 r/min气浴摇培培养;培养8 h后开始取样,测定其在600 nm处的吸光值(OD600),每3 h取样1次,重复3次。
1.2.5 AHLs信号检测AHL信号检测平板的制备:将报告菌根癌土壤杆菌Agrobacterium tumefaciens NTL4 (pZLR4) 接种于含有30 μg/mL庆大霉素(Gm)的液体ABM培养基中,28 ℃培养16-24 h后待用;100 mL的ABM基本培养基冷却至50 ℃左右,加入5 mL A. tumefaciens NTL4培养液、终浓度为30 μg/mL的Gm和40 μg/mL的X-Gal,混匀后制备报告菌平板[18]。
AHL信号分子测定:取0.5 mL软腐果胶杆菌Z3-3及其衍生菌培养液,加入等体积的乙酸乙酯充分混匀萃取信号分子,12 000 r/min离心15 min,吸取上清液,萃取3次。循环水式真空泵真空抽干,加入100 μL甲醇溶解;取2 μL上述所得信号提取液,加入400 μL A. tumefaciens NTL4 (pZLR4) 培养液(OD600=0.8),28 ℃、130 r/min培养4 h;12 000 r/min离心1 min,弃上清,加100 μL dd H2O悬浮细胞;检测A. tumefaciens NTL4 (pZLR4) 中β-半乳糖苷酶活性[10],以酶活强弱表示AHLs信号分子浓度高低。
1.2.6 致病性的检测将软腐果胶杆菌Z3-3及其衍生菌接种于LB培养基,在28 ℃条件下130 r/min培养至OD600=1.0;萝卜和马铃薯清水洗净后晾干,用70%的酒精对表面进行消毒处理后切成厚度一致的组织切块。在培养皿中铺一层灭菌吸水纸保湿,喷洒无菌水后将组织切块置于中央,组织切块中央针刺接种5 μL细菌培养液,28 ℃培养箱培养;大白菜去掉外层叶片,将内层大小一致的健康叶片置于塑料培养盒中(盒底部铺两层灭菌纱布),表面消毒后针刺接种5 μL细菌培养液于叶柄中央,盒子四角放置吸水棉球,28 ℃培养箱密封培养。方差分析应用DPS分析软件,95%置信区间。
1.2.7 AidE降解机制分析通过Ni-NTA亲和层析和AKTA-Purifier (GE Healthcare)层析系统得到精细纯化的AidE蛋白。200 μL精细纯化的AidE蛋白溶液(0.3 mg/mL)与30 μL (0.05 mol/L)信号分子C6-HSL在1 mL反应缓冲液(50 mmol/L Tris-Cl,400 mmol/L NaCl,pH 7.0) 中于37 ℃反应2 h;200 μL二甲基亚砜(DMSO)和200 μL 1 mol/L NaOH混合,加入30 μL (0.05 mol/L)信号分子C6-HSL,37 ℃反应30 min,利用NaOH溶液破坏AHLs信号分子的内酯环结构形成降解产物N-酰基高丝氨酸,作为产物对照;设不加信号分子的蛋白溶液及未处理的C6-HSL信号纯品作空白对照;上述反应溶液分别用等体积的乙酸乙酯萃取3次,取上清,真空抽干后用100 μL甲醇溶解;用高压液相色谱(HPLC)分析反应产物。HPLC使用C18反向色谱柱(4.6 mm×150 mm;Agilent TC-18),扫描波长210 mm;进样体积5 μL;流动相为:甲醇:水(V/V)=40:60,0.1%磷酸;流量:0.25 mL/min。
1.2.8 aidE基因序列在不动杆菌中特异性分析pQ30中aidE上下游基因位置关系与已知不动杆菌中基因的排列均不相同。为检测上述特异性基因排列关系是否是由于建库过程中Sau3AⅠ酶切后的片段拼接错误,设计引物pQ30-2335、pQ30-3556 (表 2)分别以pQ30、菌株77基因组和单菌落为模板进行PCR反应。PCR扩增条件为:94 ℃变性5 min;94 ℃变性40 s,55 ℃复性40 s,72 ℃延伸1 min,循环数为30;72 ℃充分延伸10 min。
2 结果与分析2.1 aidE基因的克隆与序列分析Acinetobacter sp. 77分离自新疆阿瓦提县的植物根围土壤,能够降解AHLs信号分子。利用Agrobacterium tumefaciens NTL4 (pZLR4) 信号检测系统,通过对Acinetobacter sp. 77基因组文库的筛选,从2 000个转化子中筛选到1个具有AHL信号降解功能的粘粒克隆pF38。对pF38进一步的EcoRⅠ亚克隆筛选得到具有AHLs信号降解功能的阳性克隆pQ30,该质粒克隆了约8 kb的外源片段,该序列已提交至GenBank (登录号为MF074213)。
测序分析表明8 kb片段(图 1)编码6个开放阅读框(ORF)。ORF1为编码490个氨基酸的琥珀酸半醛脱氢酶(Succinate-semialdehyde dehydrogenase);ORF2为编码268个氨基酸的内酰胺酶家族蛋白(Beta-lactamase);ORF3编码一个含有191个氨基酸的假定蛋白;ORF4、ORF5、ORF6编码的分别为含有575个氨基酸的转录调控因子(Transcriptional regulator)、含有331个氨基酸的苯酚羟化酶(Phenol hydroxylase) P1蛋白和酚-2-单氧酶(Phenol-2-monooxygenase)的部分序列,三者同为酚合成基因簇的组成部分。
用Hind Ⅲ对pQ30进一步亚克隆,得到包含约1.2 kb有信号降解功能片段的阳性克隆pCH6,序列分析表明,pCH6中仅含有一个完整的开放阅读框,即上述ORF2。据此确定orf 2即为编码AHL信号降解酶的基因,命名为aidE (Autoinducers degrading)。
aidE基因共807 bp,编码268个氨基酸,推测分子量为29.48 kDa。序列一致性比较发现,aidE的氨基酸序列与已知的AHLs降解酶的氨基酸序列一致性较低,最高为AttM/AiiB家族蛋白(Mycobacterium lentiflavum,CQD23908.1),一致性仅为33%。然而该蛋白与β-内酰胺酶类家族蛋白高度一致,与Acinetobacter gyllenbergii CIP110306中的β-内酰胺酶类家族蛋白(EPF70788.1) 一致性高达95%,与恶臭假单胞菌Pseudomonas putida中的β-内酰胺酶类家族蛋白(KEX94407.1) 一致性为93%,与海单胞菌Marinomonas sp. MWYL1中的β-内酰胺酶类结构域蛋白(ABR69113.1) 一致性为90%。AidE中具有β-内酰胺酶类蛋白的特征序列105-HLHFDHAG-112以及与金属水解酶特征序列一致的177-HTPGHOSL-184。将AidE与已报道的AHL内酯酶进行氨基酸序列比对(图 2),AidE与β-内酰胺酶蛋白家族类的AHL内酯酶一致性较高。
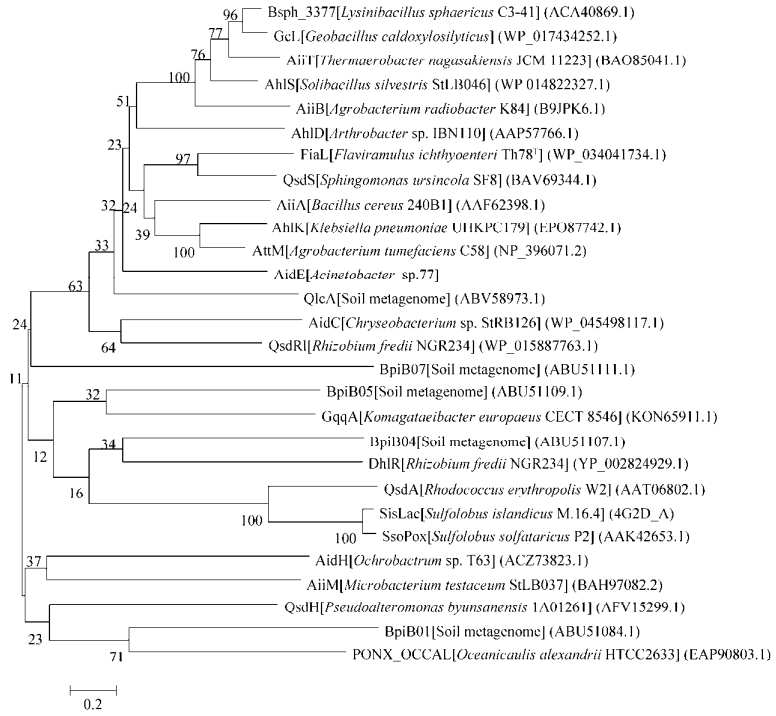 |
| 图 2 aidE与已发表AHL内酯酶氨基酸序列的系统进化分析 Figure 2 Phylogenetic analysis of the aidE and other published AHL-lactonases. The dendrogram was constructed after ClustalW alignment using Neighbor-Joining and and Kimura two-parameter methods subjected to 1 000 bootstrap trials with MEGA 5.05. [9-11, 12, 13, 22-40]. |
| 图选项 |
为进一步验证aidE基因是否为菌株77中唯一发挥信号降解功能的基因,本实验构建了aidE基因缺失471 bp片段的突变体(图 3A)。实验结果发现,aidE基因缺失后,菌株77失去信号降解功能(图 3B)。由此可见,aidE基因的正常表达是菌株77具有信号降解能力的决定性因素。
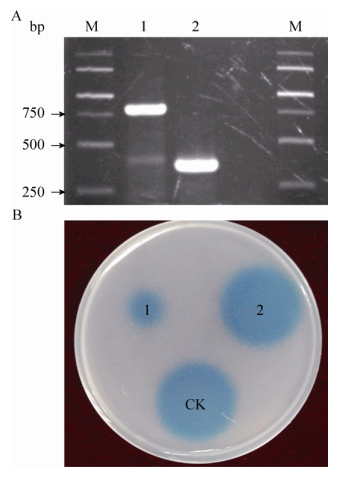 |
| 图 3 aidE基因缺失突变体的构建及其功能验证 Figure 3 In-frame deletion of the aidE gene (A) and determining the AHL-inactivating function (B) of wild-type Acinetobacter sp. 77 (1) and the aidE gene deletion mutant Acinetobacter sp. 77 DaidE (2). M: marker; dd H2O as negative control (CK). |
| 图选项 |
2.2 aidE蛋白降解机制解析利用表达载体pETAidE表达并精细纯化得到融合的AidE-His6蛋白(图 4),分子量与预测结果相同,约30 kDa。用精细纯化的AidE蛋白处理信号分子C6-HSL,以NaOH处理C6-HSL作为对照[41],通过高压液相色谱(HPLC)对反应产物进行检测分析。结果显示,在本实验条件下,信号分子C6-HSL的保留时间(Retention time)为26.0 min (图 5A),C6-HSL经NaOH处理的降解产物N-己酰基-高丝氨酸(C6-HS)保留时间为21.9 min (图 5C)。用纯化的AidE蛋白与C6-HSL信号分子反应后,出现保留时间为22.0 min和25.9 min的两种化合物(图 5D)。比对分析可知二者分别为AidE蛋白作用于C6-HSL的降解产物C6-HS (图 5D),与未反应的C6-HSL信号分子(图 5D)。通过降解产物分析可知,AidE为AHL-内酯酶。AidE蛋白作用于AHLs信号分子的内酯键,形成降解产物C6-HS。
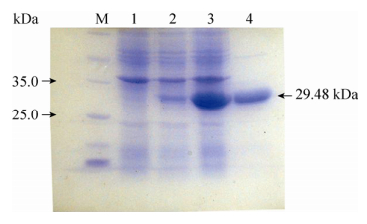 |
| 图 4 aidE蛋白的表达与纯化 Figure 4 Expression and purification of aidE. 1: E. coli BL21 (pET-22b)(+); 2: E. coli BL21 (pETAidE) without induction; 3: E. coli BL21 (pETAidE) after induction by IPTG for 4 h in 37 ℃; 4: purified AidE protein; M: marker. |
| 图选项 |
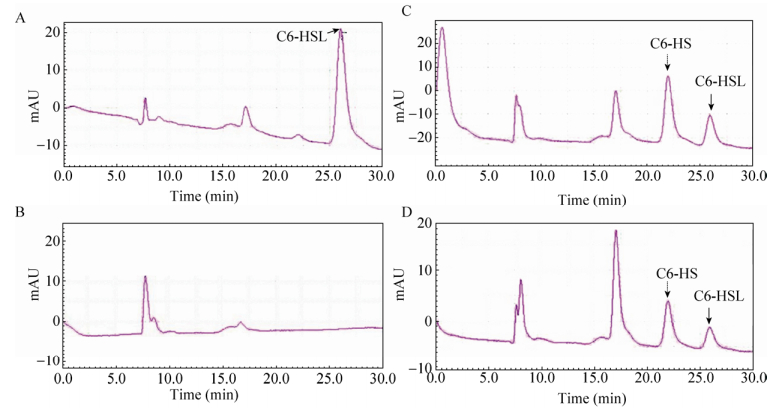 |
| 图 5 HPLC分析AidE降解C6-HSL机制 Figure 5 HPLC analysis of the AidE-degraded product of N-hexanoyl-L-homoserine lactone (C6-HSL). (A) Reaction buffer containing C6-HSL. (B) Reaction buffer containing pure AidE protein. (C) C6-HSL degraded by NaOH. (D) C6-HSL degraded by AidE, the solid and dotted arrows represent for C6-HSL and its degraded product N-hexanoyl-L-homoserine(C6-HS), respectively. |
| 图选项 |
除C6-HSL信号外,AidE对C10-HSL、N-3-氧代己酰基高丝氨酸内酯(3-oxo-C6-HSL)、3-oxo-C8-HSL和提取自荧光假单胞2-79的N-羟基高丝氨酸内酯类信号分子混合物具有降解活性,表明其AHL降解活性没有明显的底物特异性(数据未显示)。
2.3 aidE基因表达对软腐果胶杆菌Z3-3生物学性状及致病性影响胡萝卜软腐欧文氏菌Z3-3能够引起胡萝卜、白菜、马铃薯等多种作物的软腐病。其毒力因子植物细胞壁降解酶等的合成受到QS系统严格调控[42]。将携带有aidE基因的载体pB77E导入菌株Z3-3中,检测其生长趋势、AHLs信号的产生以及对致病性的影响。
结果显示,表达aidE基因的菌株Z3-3 (pB77E)的生长趋势与野生型菌株Z3-3及空载体对照菌株Z3-3 (pBBR1MCS-2) 在各个阶段均无明显差异(图 6A),说明aidE基因的表达对菌株Z3-3的生长没有影响。菌株Z3-3和Z3-3 (pBBR1MCS-2) 在培养前期信号产量较大,培养18-21 h时信号产量达到最大值,而后随着培养时间的增加信号产量逐步降低,而在菌株Z3-3 (pB77E)中始终未检测到信号产生(图 6B)。说明aidE基因的表达能够完全降解菌株Z3-3合成的信号分子。以上菌株针刺接种白萝卜、马铃薯和大白菜,结果显示接种菌株Z3-3和Z3-3 (pBBR1MCS-2) 后能够在上述植物组织上形成明显的软腐症状,而aidE基因的表达能显著降低病原菌Z3-3的致病能力(图 6C,表 3)。综上,aidE基因能够通过降解细菌产生的AHLs信号分子影响其群体感应系统,从而抑制群体感应系统调控的致病性。
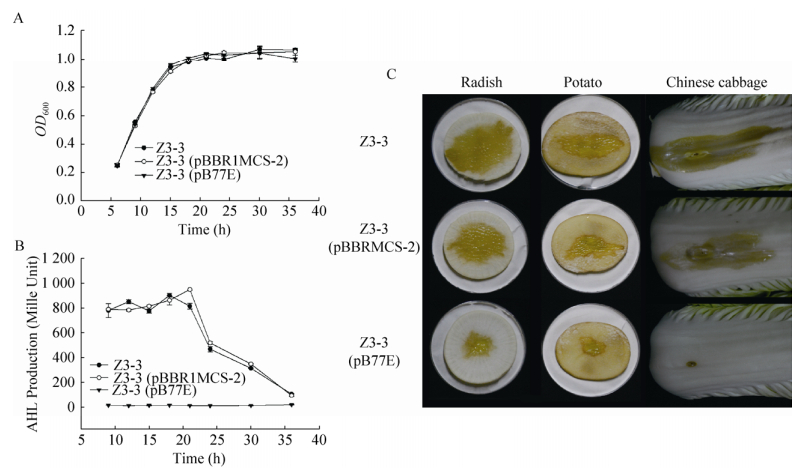 |
| 图 6 aidE对软腐果胶杆菌Z3-3生长、AHL产量和致病性的影响 Figure 6 Effect of aidE on bacterial growth (A), extracellular AHLs accumulation (B) and pathogenicity (C) in P. carotovorum subsp. carotovorum Z3-3. |
| 图选项 |
表 3 果胶杆菌对植物组织致病性分析Table 3 Pathogenicity assay of P. carotovorum subsp. carotovorum strains on plant tissues
| Plant | Tissue | Maceration area (cm2) | ||
| Z3-3 | Z3-3 (pBBR1MCS-2) | Z3-3 (pB77E) | ||
| Radish | Root | 28.68±7.35 a | 20.17±2.20 a | 6.13±0.31 b |
| Potato | Tuber | 8.43±1.13 a | 6.83±1.00 a | 3.89±0.49 b |
| Chinese cabbage | Leaf | 7.64±4.76 a | 6.44±0.42 a | 0.27±0.04 b |
| All experiments were performed in triplicate, and the mean x±s are indicated; a, b indicate statistically significant differences (P < 0.05). | ||||
表选项
2.4 aidE基因序列在不动杆菌中特异性分析通过对AidE氨基酸序列一致性比对发现,aidE基因在不动杆菌属中并不保守。在已知不动杆菌基因组中,仅在Acinetobacter gyllenbergii和鲍氏不动杆菌A. baumannii 144107中找到一致性较高的编码基因。与其他属细菌对比发现,P. putida与Marinomonas sp. MWYL1中也含有一致性较高的aidE同源基因。
对pQ30中aidE上下游基因结构进行一致性比对分析发现,上游琥珀酸半醛脱氢酶(ORF1) 基因在不动杆菌属中不保守,虽然在A. gyllenbergii中发现该基因的存在,但不动杆菌其他种中并未发现该基因。下游假定蛋白(ORF3) 基因在不动杆菌属中不保守,只在A. baumannii 144107和A. gyllenbergii种的一些菌株中发现该基因。下游转录调控因子(ORF4)、苯酚羟化P1蛋白(ORF5) 和酚-2-单氧酶(ORF6) 组成的酚合成基因簇在不动杆菌中却是保守存在的。虽然在A. gyllenbergii和A. baumannii 144107中未发现酚合成基因簇相关基因,但在不动杆菌其他种中,酚合成基因簇下游基因高度保守,上游基因在种间存在差异,但均未发现AidE一致性高的蛋白及其他β-内酰胺酶类蛋白。
pQ30中AidE上下游基因位置关系与已知不动杆菌中基因的排列均不相同。为了检测上述特异性基因排列关系是否是由于文库构建过程中Sau3AⅠ酶切后拼接错误,利用引物pQ30-2335和pQ30-3556分别以pQ30、菌株77基因组和单菌落为模板进行PCR反应。结果显示,pQ30、菌株77基因组和单菌落中均能扩增出相同条带(图 7B),说明aidE基因在菌株77基因组中的上下游的基因排列与pQ30中的亚克隆片段分析结果相同,菌株77基因组中存在一段与其他已知不动杆菌不同的特异性序列。
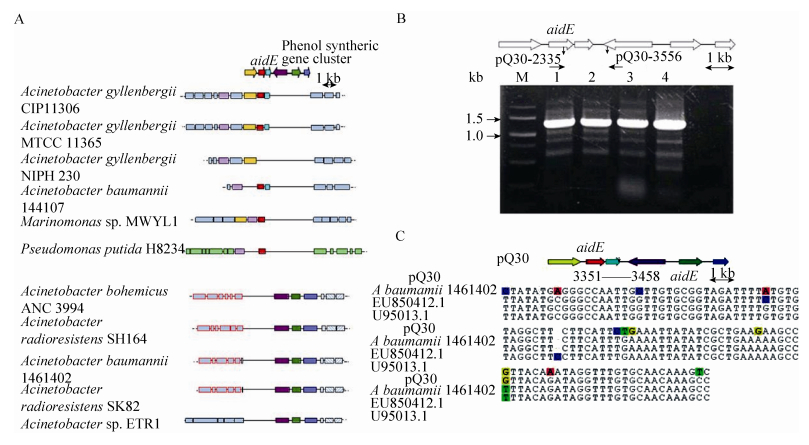 |
| 图 7 aidE基因的特异性分析 Figure 7 The specificity analysis of the aidE gene. A: Localization of the aidE and its neighboring genes in genomes of different bacterial species. B: The specificity detection of the fragment which has the function of AHL signal degradation in pQ30. C: Nucleotide consistency of the suspected IS sequence in pQ30 with its homologous in A. baumannii 1461402, insertion sequence IS17 TnpA (tnpA) gene (EU850412.1) in A. baumannii and insertion sequence IS17 putative transposase gene (U95013.1) in A. haemolyticus. |
| 图选项 |
对pQ30中的亚克隆片段核苷酸序列进一步分析发现,在aidE基因(pQ30:1624-2431) 下游919 bp (pQ30-3350) 处存在一段107 bp的疑似IS插入序列(图 7C),与A. baumannii中的IS插入序列基因ISAba9 TnpA (tnpA)、IS17 TnpA (tnpA) (EU850412.1) 和溶血不动杆菌(A. haemolyticus)中的IS插入序列IS17假定转座酶基因(U95013.1) 一致性高达97%。在A. baumannii 1461402中,在酚合成基因簇下游同样发现了两段与pQ30中疑似IS插入序列一致性高达97%的同向重复序列,二者间隔约20 kb,且一致性高的片段附近基因编码转座酶家族蛋白增变(Mutator)家族转座酶蛋白(EXB34237.1) 等。而P. putida H8234中AidE一致性较高蛋白上下游存在多个转座酶基因,推测在P. putida H8234基因组中此位置可能来源于基因的水平转移。aidE基因在不动杆菌属中的不保守存在,可能是水平转移或基因组重排的结果。
3 讨论病原细菌的群体感应系统调控多种与致病性密切相关的生物学功能。应用AHL信号降解酶防治植物细菌病害的策略主要包括两个方面:1) 构建转基因植物,降解病原菌的AHL,从而抑制病原菌侵染[43];2) 以AHL降解细菌为生防菌防治植物病害[8, 44]。
序列相似性比较发现,aidE的氨基酸序列与已知AHLs降解酶的氨基酸序列相似性较低(小于33%),但与金属依赖性水解酶(β-内酰胺类家族蛋白)相似度高达95%,并具有β-内酰胺类蛋白的特征序列105-HLHFDHAG-112以及与金属水解酶特征序列相似的177-HTPGHTPGH-185[45]。2004年Wang等研究表明,AiiA为典型的Zn2+依赖型降解酶,能够降解10种不同侧链长度和C3取代基不同的信号分子[46]。AidH是本实验室前期研究得到的具有AHLs降解活性的Mn2+依赖性内酯酶,对多种类型的AHLs信号分子具有降解活性;与之相比,AidE对于金属离子的依赖性较低,外源添加Zn2+和Mg2+,其降解活性增强幅度较小(数据未显示)。然而,表达aidE基因的胡萝卜软腐欧文氏菌株Z3-3的致病性明显下降,表明利用AidE降解信号分子进而降低病原菌致病性具有潜在的应用价值。
aidE基因不是不动杆菌属中的保守基因,aidE基因的上下游的基因排列与已测序不动杆菌均不相同。aidE基因下游保守的酚合成基因簇序列比对表明,在波西米亚不动杆菌Acinetobacter bohemicus、抗辐射不动杆菌A. radioresistens和A. baumannii中该基因簇上游基因在不动杆菌中保守性较低,可能在进化过程中较为活跃,在不同属细菌间水平转移概率较大。此外在P. putida H8234中与aidE一致性高的蛋白编码基因上下游存在多个转座酶基因,也说明基因有可能是通过水平转移的方式进入P. putida H8234中的。与此同时,在aidE基因下游919 bp (pQ30-3350) 处发现的一段107 bp的IS插入序列,虽然在其基因附近未发现明确的转座酶基因,但不排除该区域基因发生过水平转移的可能性。信号降解酶基因通过基因水平转移的方式进入细菌基因组并非无迹可寻,在Acinetobacter sp. Ooi2中发现的AHL酰基转移酶AmiE上游存在转座酶家族蛋白,表明该基因可能通过水平转移而来[47]。综上,aidE基因可能是通过水平转移进入菌株77基因组中,或是aidE基因在基因组中的位置发生过重排。菌株77自身并未检测到AHL信号产生,外源获得具有信号降解功能的基因可能有利于增强其在环境中的生存优势。
针对群体感应系统的植物细菌性病害防治是近些年的研究热点。对群体感应淬灭的研究近年来更倾向于小分子抑制物的筛选和利用,但AHLs信号降解酶仍具有开发和应用潜力。AidE的发现丰富了信号降解酶的来源和种类,为生物防治提供了新资源。
参考文献
| [1] | Fuqua WC, Winans SC. A LuxR-LuxI type regulatory system activates Agrobacterium Ti plasmid conjugal transfer in the presence of a plant tumor metabolite.J Bacteriol, 1994, 176(10): 2796–2806.DOI: 10.1128/jb.176.10.2796-2806.1994 |
| [2] | Bainton NJ, Stead P, Chhabra SR, et al. N-(3-oxohexanoyl)-L-homoserine lactone regulates carbapenem antibiotic production in Erwinia carotovora.Biochem J, 1992, 288(3): 997–1004.DOI: 10.1042/bj2880997 |
| [3] | Blankschien MD, Potrykus K, Grace E, et al. TraR, a homolog of a RNAP secondary channel interactor, modulates transcription.PLoS Genet, 2009, 5(1): e1000345.DOI: 10.1371/journal.pgen.1000345 |
| [4] | Ren ZG, Lin M, Jiang WJ, et al. Influence of quorum-sensing system on the virulence of Acidovorax citrulli MH21 on melon seedlings.Acta Phytopathol Sin, 2012, 42(6): 608–619.(in Chinese). 任争光, 林敏, 姜文君, 等. 群体感应系统对甜瓜果斑病菌MH21致病力的影响.植物病理学报, 2012, 42(6): 608-619. |
| [5] | Dumenyo CK, Mukherjee A, Chun W, et al. Genetic and physiological evidence for the production of N-acyl homoserine lactones by Pseudomonas syringae pv. syringae and other fluorescent plant pathogenic Pseudomonas species.Eur J Plant Pathol, 1998, 104(6): 569–582.DOI: 10.1023/A:1008651300599 |
| [6] | Waters CM, Bassler BL. Quorum sensing:cell-to-cell communication in bacteria.Annu Rev Cell Dev Biol, 2005, 21: 319–346.DOI: 10.1146/annurev.cellbio.21.012704.131001 |
| [7] | Dong YH, Zhang LH. Quorum sensing and quorum-quenching enzymes.J Microbiol, 2005, 43: 101–109. |
| [8] | Krysciak D, Schmeisser C, Preu? S, et al. Involvement of multiple loci in quorum quenching of autoinducer I molecules in the nitrogen-fixing symbiont Rhizobium (Sinorhizobium) sp. strain NGR234.Appl Environ Microbiol, 2011, 77(15): 5089–5099.DOI: 10.1128/AEM.00112-11 |
| [9] | Dong YH, Xu JL, Li XZ, et al. AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora.Proc Natl Acad Sci USA, 2000, 97(7): 3526–3531.DOI: 10.1073/pnas.97.7.3526 |
| [10] | Mei GY, Yan XX, Turak A, et al. AidH, an alpha/beta-hydrolase fold family member from an Ochrobactrum sp. strain, is a novel N-acylhomoserine lactonase.Appl Environ Microbiol, 2010, 76(15): 4933–4942.DOI: 10.1128/AEM.00477-10 |
| [11] | Uroz S, Oger PM, Chapelle E, et al. A Rhodococcus qsdA-encoded enzyme defines a novel class of large-spectrum quorum-quenching lactonases.Appl Environ Microbiol, 2008, 74(5): 1357–1366.DOI: 10.1128/AEM.02014-07 |
| [12] | Riaz K, Elmerich C, Raffoux A, et al. Metagenomics revealed a quorum quenching lactonase QlcA from yet unculturable soil bacteria.Commun Agric Appl Biol Sci, 2008, 73(2): 3–6. |
| [13] | Schipper C, Hornung C, Bijtenhoorn P, et al. Metagenome-derived clones encoding two novel lactonase family proteins involved in biofilm inhibition in Pseudomonas aeruginosa.Appl Environ Microbiol, 2009, 75(1): 224–233.DOI: 10.1128/AEM.01389-08 |
| [14] | Dong YH, Wang LH, Xu JL, et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase.Nature, 2001, 411(6839): 813–817.DOI: 10.1038/35081101 |
| [15] | Ban HF, Chai XL, Lin YJ, et al. Transgenic Amorphophallus konjac expressing synthesized acyl-homoserine lactonase (aiiA) gene exhibit enhanced resistance to soft rot disease.Plant Cell Rep, 2009, 28(12): 1847–1855.DOI: 10.1007/s00299-009-0788-x |
| [16] | Vanjildorj E, Song SY, Yang ZH, et al. Enhancement of tolerance to soft rot disease in the transgenic Chinese cabbage (Brassica rapa L. ssp. pekinensis) inbred line, Kenshin.Plant Cell Rep, 2009, 28(10): 1581–1591.DOI: 10.1007/s00299-009-0757-4 |
| [17] | Chai XL, Zhou Y, Lin YJ, et al. Regeneration of transgenic Amorphophallus konjac expressing synthesized acyl-homoserine lactonase (aiiA) gene from Bacillus thuringiensis.Mol Plant Breed, 2007, 5(5): 613–618.(in Chinese). 柴鑫莉, 周盈, 林拥军, 等. 苏云金芽胞杆菌抗软腐病aiiA基因转花魔芋研究.分子植物育种, 2007, 5(5): 613-618. |
| [18] | Cha C, Gao P, Chen YC, et al. Production of acyl-homoserine lactone quorum-sensing signals by gram-negative plant-associated bacteria.Mol Plant Microbe Interact, 1998, 11(11): 1119–1129.DOI: 10.1094/MPMI.1998.11.11.1119 |
| [19] | Hanahan D. Studies on transformation of Escherichia coli with plasmids.J Mol Biol, 1983, 166(4): 557–580.DOI: 10.1016/S0022-2836(83)80284-8 |
| [20] | Kovach ME, Elzer PH, Hill DS, et al. Four new derivatives of the broad-host-range cloning vector pBBR1MCS, carrying different antibiotic-resistance cassettes.Gene, 1995, 166(1): 175–176.DOI: 10.1016/0378-1119(95)00584-1 |
| [21] | Kessler B, de Lorenzo V, Timmis KN. A general system to integrate lacZ fusions into the chromosomes of gram-negative eubacteria:regulation of the Pm promoter of the TOL plasmid studied with all controlling elements in monocopy.Mol Gen Genet, 1992, 233(1/2): 293–301. |
| [22] | Keen NT, Tamaki S, Kobayashi D, et al. Improved broad-host-range plasmids for DNA cloning in gram-negative bacteria.Gene, 1988, 70(1): 191–197.DOI: 10.1016/0378-1119(88)90117-5 |
| [23] | Haudecoeur E, Tannières M, Cirou A, et al. Different regulation and roles of lactonases AiiB and AttM in Agrobacterium tumefaciens C58.Mol Plant Microbe Interact, 2009, 22(5): 529–537.DOI: 10.1094/MPMI-22-5-0529 |
| [24] | Khan SR, Farrand SK. The BlcC (AttM) lactonase of Agrobacterium tumefaciens does not quench the quorum-sensing system that regulates Ti plasmid conjugative transfer.J Bacteriol, 2009, 191(4): 1320–1329.DOI: 10.1128/JB.01304-08 |
| [25] | Zhang HB, Wang LH, Zhang LH. Genetic control of quorum-sensing signal turnover in Agrobacterium tumefaciens.Proc Natl Acad Sci USA, 2002, 99(7): 4638–4643.DOI: 10.1073/pnas.022056699 |
| [26] | Carlier A, Uroz S, Smadja B, et al. The Ti plasmid of Agrobacterium tumefaciens harbors an attM-paralogous gene, aiiB, also encoding N-acyl homoserine lactonase activity.Appl Environ Microbiol, 2003, 69(8): 4989–4993.DOI: 10.1128/AEM.69.8.4989-4993.2003 |
| [27] | Park SY, Lee SJ, Oh TK, et al. AhlD, an N-acylhomoserine lactonase in Arthrobacter sp., and predicted homologues in other bacteria.Microbiology, 2003, 149(6): 1541–1550.DOI: 10.1099/mic.0.26269-0 |
| [28] | Wang WZ, Morohoshi T, Someya N, et al. AidC, a novel N-acylhomoserine lactonase from the potato root-associated Cytophaga-Flavobacteria-Bacteroides (CFB) group bacterium Chryseobacterium sp. strain StRB126.Appl Environ Microbiol, 2012, 78(22): 7985–7992.DOI: 10.1128/AEM.02188-12 |
| [29] | Wang WZ, Morohoshi T, Ikenoya M, et al. AiiM, a novel class of N-acylhomoserine lactonase from the leaf-associated bacterium Microbacterium testaceum.Appl Environ Microbiol, 2010, 76(8): 2524–2530.DOI: 10.1128/AEM.02738-09 |
| [30] | Huang W, Lin YJ, Yi SY, et al. QsdH, a novel AHL lactonase in the RND-Type inner membrane of marine Pseudoalteromonas byunsanensis strain 1A01261.PLoS ONE, 2012, 7(10): e46587.DOI: 10.1371/journal.pone.0046587 |
| [31] | Bijtenhoorn P, Schipper C, Hornung C, et al. BpiB05, a novel metagenome-derived hydrolase acting on N-acylhomoserine lactones.J Biotechnol, 2011, 155(1): 86–94.DOI: 10.1016/j.jbiotec.2010.12.016 |
| [32] | Bar-Rogovsky H, Hugenmatter A, Tawfik DS. The evolutionary origins of detoxifying enzymes:the mammalian serum paraoxonases (PONs) relate to bacterial homoserine lactonases.J Biol Chem, 2013, 288(33): 23914–23927.DOI: 10.1074/jbc.M112.427922 |
| [33] | Bergonzi C, Schwab M, Elias M. The quorum-quenching lactonase from Geobacillus caldoxylosilyticus:purification, characterization, crystallization and crystallographic analysis.Acta Crystallogr F Struct Biol Commun, 2016, 72(9): 681–686.DOI: 10.1107/S2053230X16011821 |
| [34] | Garge SS, Nerurkar AS. Attenuation of quorum sensing regulated virulence of Pectobacterium carotovorum subsp. carotovorum through an AHL lactonase produced by Lysinibacillus sp. Gs50.PLoS ONE, 2016, 11(12): e0167344.DOI: 10.1371/journal.pone.0167344 |
| [35] | Hiblot J, Gotthard G, Chabriere E, et al. Structural and enzymatic characterization of the lactonase SisLac from Sulfolobus islandicus.PLoS ONE, 2012, 7(10): e47028.DOI: 10.1371/journal.pone.0047028 |
| [36] | Hiblot J, Gotthard G, Elias M, et al. Differential active site loop conformations mediate promiscuous activities in the lactonase SsoPox.PLoS ONE, 2013, 8(9): e75272.DOI: 10.1371/journal.pone.0075272 |
| [37] | Valera MJ, Mas A, Streit WR, et al. GqqA, a novel protein in Komagataeibacter europaeus involved in bacterial quorum quenching and cellulose formation.Microb Cell Fact, 2016, 15(1): 88.DOI: 10.1186/s12934-016-0482-y |
| [38] | Morohoshi T, Sato N, Iizumi T, et al. Identification and characterization of a novel N-acyl-homoserine lactonase gene in Sphingomonas ursincola isolated from industrial cooling water systems.J Biosci Bioeng, 2017, 123(5): 569–575.DOI: 10.1016/j.jbiosc.2016.12.010 |
| [39] | Morohoshi T, Tominaga Y, Someya N, et al. Complete genome sequence and characterization of the N-acylhomoserine lactone-degrading gene of the potato leaf-associated Solibacillus silvestris.J Biosci Bioeng, 2012, 113(1): 20–25.DOI: 10.1016/j.jbiosc.2011.09.006 |
| [40] | Zhang YH, Liu JW, Tang KH, et al. Genome analysis of Flaviramulus ichthyoenteri Th78T in the family Flavobacteriaceae:insights into its quorum quenching property and potential roles in fish intestine.BMC Genomics, 2015, 16(1): 38.DOI: 10.1186/s12864-015-1275-0 |
| [41] | Yates EA, Philipp B, Buckley C, et al. N-acylhomoserine lactones undergo lactonolysis in a pH-, temperature-, and acyl chain length-dependent manner during growth of Yersinia pseudotuberculosis and Pseudomonas aeruginosa.Infect Immun, 2002, 70(10): 5635–5646.DOI: 10.1128/IAI.70.10.5635-5646.2002 |
| [42] | Abbott DW, Boraston AB. Structural biology of pectin degradation by Enterobacteriaceae.Microbiol Mol Biol Rev, 2008, 72(2): 301–316.DOI: 10.1128/MMBR.00038-07 |
| [43] | Toth IK, Bell KS, Holeva MC, et al. Soft rot erwiniae:from genes to genomes.Mol Plant Pathol, 2003, 4(1): 17–30.DOI: 10.1046/j.1364-3703.2003.00149.x |
| [44] | Jafra S, Jalink H, van der Schoor R, et al. Pectobacterium carotovorum subsp. carotovorum strains show diversity in production of and response to N-acyl homoserine lactones.J Phytopathol, 2006, 154(11/12): 729–739. |
| [45] | Holmquist M. Alpha/Beta-hydrolase fold enzymes:structures, functions and mechanisms.Curr Protein Pept Sci, 2000, 1(2): 209–235.DOI: 10.2174/1389203003381405 |
| [46] | Wang LH, Weng LX, Dong YH, et al. Specificity and enzyme kinetics of the quorum-quenching N-acyl homoserine lactone lactonase (AHL-lactonase).J Biol Chem, 2004, 279(14): 13645–13651.DOI: 10.1074/jbc.M311194200 |
| [47] | Ochiai S, Yasumoto S, Morohoshi T, et al. AmiE, a novel N-acylhomoserine Lactone acylase belonging to the amidase family, from the activated-sludge isolate Acinetobacter sp. strain Ooi24.Appl Environ Microbiol, 2014, 80(22): 6919–6925.DOI: 10.1128/AEM.02190-14 |
