
 , 贾燕涛1
, 贾燕涛1

1 中国科学院微生物研究所 植物基因组学国家重点实验室, 北京 100101;
2 中国科学院大学, 北京 100049
收稿日期:2017-02-28;接收日期:2017-05-05; 网络出版时间:2017-05-24 基金项目:国家重点基础研究发展计划(973计划)(No.2015CB150604),国家重点研发计划(No.2016YFD0100601),国家自然科学基金(No.31370161)资助
作者简介:方荣祥 中国科学院微生物研究所研究员, 博士生导师, 中国科学院院士, 《生物工程学报》副主编。研究方向为:植物基因表达的调控机制及其在植物生物技术上的应用, 植物病原细菌致病相关基因的表达调控, 植物病毒致病因子的功能分析及其与寄主防卫系统的相互作用。在国内外学术期刊上发表论文110余篇。2016年获得"中国植物病理学会终身成就奖";
贾燕涛博士, 中国科学院微生物研究所研究员。研究方向为植物与病原菌互作分子机理。曾参加野油菜黄单胞菌全基因组序列分析工作, 是该项目的主要完成人之一, 目前主要从事细菌群体感应跨界信号途径及植物抗病机理方面的研究
摘要:生物被膜是微生物附着在生物或非生物表面所形成的一种三维结构,细胞被其自身所产生的胞外聚合物所包围,生物被膜的形成被认为是微生物应对生物和非生物胁迫时所产生的一种自我防御机制。众多微生物能够在植物叶、维管束和根等组织中生长,并在植物不同组织表面附着形成生物被膜,病原细菌的生物被膜随植物内部环境动态变化是其有效发挥致病作用的关键,研究植物病原细菌生物被膜调控机制是认识植物-病原菌互作的重要方面。文中将系统地介绍植物病原细菌生物被膜特征、组成成分、分子调控机制及最新研究进展。
关键词:植物病原细菌 生物被膜 胁迫 调控机制
Function of biofilms in phytopathogenic bacterial-host interactions
Song Liyang1,2, Fang Rongxiang1

 , Jia Yantao1
, Jia Yantao1

1 State Key Laboratory of Plant Genomics, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
2 University of Chinese Academy of Sciences, Beijing 100049, China
Received: February 28, 2017; Accepted: May 5, 2017; Published: May 24, 2017
Supported by: National Basic Research Program of China (973 Program) (No. 2015CB150604), National Key Research and Development Program of China (No. 2016YFD0100601), National Natural Science Foundation of China (No. 31370161)
Corresponding author:Rongxiang Fang.E-mail:fangrx@im.ac.cn
Yantao Jia.Tel:+86-10-64861838;Fax:+86-10-64858245;E-mail:jiayt@im.ac.cn
Abstract: Biofilms are complex three-dimensional bacterial assemblages that attach to biotic or abiotic solid surfaces, and frequently embed within a self-produced matrix of extracellular polymeric substances. Biofilm formation is a microbial defense response to biotic and abiotic stresses, and a key factor for survival in adverse environments. A wide variety of microorganisms can colonize distant tissues of higher plants, such as leaves, vascular network and roots, and adhere to the surface of the tissues to form biofilms. The dynamic processes in forming biofilms in response to plant internal environment are key steps required for full virulence of phytopathogenic bacteria. Exploring the mechanisms involved in regulation of bacterial biofilms is important for understanding the plant-pathogens interactions. In this review, we summarized the research progresses related to the biofilms of bacterial phytopathogens, including biofilm characteristics, essential regulatory mechanisms and key signals affecting the transition between a planktonic lifestyle and multicellular behavior.
Key words: phytopathogenic bacteria biofilms stress regulatory mechanism
在自然界中,生物被膜的形成是影响大多数微生物定殖与生存的重要机制之一。处于生物被膜中的细菌彼此相互接触,被细菌自身产生的胞外聚合物所包围。这些胞外聚合物的主要成分有胞外多糖、胞外DNA (eDNA)、蛋白质和脂质等[1],形成复杂的三维结构。微生物利用生物被膜附着在生物或非生物表面,以应对外界自然环境、与其他微生物竞争以及与宿主相互识别等[1-3]。针对病原细菌铜绿假单胞菌Pseudomonas aeruginosa生物被膜已有较系统的研究,研究人员发现生物被膜的形成是一个动态过程,包括细菌起始粘附期、形成单层细胞结构的粘附期、菌落生长期、复杂菌落结构成熟期和浮游细胞播散期,而处于生物被膜中的细菌在各阶段具有不同的生理生化特性[2, 4-5]。当细菌处于恶劣环境时,生物被膜可以保护其内部的细胞,聚集的细胞群落表现出不同于浮游单细胞的特性,并提高对环境的适应力[6],无论是植物或动物病原细菌在不同的组织表面所形成的生物被膜,都可以增强细菌对抗生素的抗性,以及帮助细菌逃逸宿主的免疫反应[7-8]。植物病原细菌借助生物被膜可以成功地在叶、茎、种子或根等组织生存和定殖。植物病原细菌生物被膜的形成除了作为细菌应对胁迫的重要手段,还成为细菌致病过程中的重要致病因素,例如,葡萄皮尔斯病病原菌苛养木杆菌Xylella fastidiosa (Xf)和十字花科黑腐病病原菌野油菜黄单胞菌Xanthomonas campestris pv. campestris (Xcc)的生物被膜阻塞植物维管束组织,造成叶片萎蔫和焦枯[3, 9-10]。
目前对于植物病原细菌生物被膜的研究尚有待进一步深入,特别是在植物-病原细菌相互识别过程中,细菌生物被膜形成和维持稳态的分子调控机制等的研究是值得特别关注的问题。文中将集中阐述参与植物病原细菌生物被膜的遗传调控机制方面的研究进展。
1 植物病原细菌生物被膜组成成分生物被膜中的细菌包埋于自身所产生的胞外聚合物中,这种聚合状态影响细菌生理生态特征,包括细胞间相互作用、营养利用、细菌群体环境适应力等[11]。由于细菌种类和生物被膜所处环境不同,胞外聚合物的组成也会有所变化。
1.1 胞外多糖胞外多糖是生物被膜网络结构的重要结构成分,帮助细菌附着在生物或非生物表面,抵抗各种环境胁迫[12]。研究发现处于不同环境中的不同细菌,其胞外多糖成分不同,有些是由单一的同多糖组成,如根癌农杆菌Agrobacterium tumefaciens的纤维素;大部分的胞外多糖是异多糖,如斯氏泛菌Pantoea stewartii的斯氏多糖、解淀粉欧文氏菌Erwinia amylovora的胞外多糖、P. aeruginosa的海藻酸、Xcc的黄原胶[1, 13]。P. aeruginosa作为动物和植物共同的病原细菌,生物被膜中主要有3种胞外多糖:海藻酸、Pel多糖和Psl多糖[14]。海藻酸主要在生物被膜形成初期和维持成熟生物被膜结构稳定中具有重要作用[1, 15];Pel多糖由pel操纵子编码合成,是富含葡萄糖的多糖,它对生物被膜的形成起着至关重要的作用[16];Psl多糖由psl操纵子编码合成,是甘露糖、葡萄糖和鼠李糖组成的戊多糖,参与细菌与生物或非生物表面的接触和维持生物被膜结构[17]。在很多细菌中,胞外多糖是生物被膜形成不可或缺的[18]。在一定生长条件下,Xcc胞外多糖黄原胶合成基因簇gum突变,影响生物被膜的形成[19]。
1.2 蛋白质在生物被膜基质中含有大量的蛋白质,包括一些酶类和结构蛋白。生物被膜中的胞外酶可参与降解生物聚合物或作为细菌毒力因子发挥作用。大多数病原细菌Ⅱ型分泌系统分泌的酶可以降解植物细胞壁的不同组分[20],使植物感病,如Xcc分泌的蛋白酶和木聚糖酶[21];Xf Ⅱ型分泌系统分泌的脂肪酶LesA,与生物被膜网状结构有关,可作为一个关键的毒力因子触发葡萄皮尔斯病[22]。另外一些非酶类的胞外蛋白:菌毛结构蛋白,是生物被膜组分之一;Bap (Biofilm-associated protein)家族蛋白或位于细胞表面、或被分泌到胞外,通过与邻近细胞表面蛋白结合,将细胞固定于生物被膜内;另一类蛋白,与凝集素和糖结合,可以识别其碳水化合物部分,通过结合基质中的多糖成分或其他细胞表面的糖基促进细胞-基质或细胞-细胞的相互作用[12]。
1.3 eDNAeDNA是大多数细菌生物被膜基质的重要组分,如在P. aeruginosa生物被膜中就有大量的eDNA[23]。eDNA可以减少细胞与接触物表面的排斥力、维持结构稳定性、诱导细胞运动性,所以eDNA对生物被膜的形成和稳定性至关重要[24]。eDNA还可与阳性螯合离子Mg2+结合,诱导特定基因表达,从而增加细菌对宿主抗菌肽或抗生素的抗性[25]。用DNA酶处理成熟的P. aeruginosa生物被膜,生物被膜瓦解,也证明了在生物被膜中eDNA的重要性[23]。生物被膜中的eDNA主要来源是细胞主动分泌或细胞裂解释放的基因组DNA[23, 26]。
1.4 脂质在生物被膜基质中也发现了脂质[1]。脂质在生物被膜中通常具有一定的生物功能,例如具有表面活性剂特性,提高对疏水物质的生物利用效率,抗细菌和抗真菌,调节细菌表面吸附和脱离等[27]。脂质可在生物被膜发展的不同阶段起作用,包括与接触物表面相互作用、微菌落形成、生物被膜结构维持和消散等[28]。在A. tumefaciens中,卵磷脂缺失降低细菌的运动性,促进生物被膜形成,减弱其致病性,不利于根瘤的形成;而鸟氨酸脂缺失的细菌能够使宿主防御反应降低,促进根瘤的快速形成和发育[29]。
2 植物病原细菌的生物被膜植物病原细菌可以通过植物表面进入组织内部,并在应对宿主植物环境时形成复杂的多层复合体,从小型聚集体到三维结构化的生物被膜复合体。对植物病原细菌生物被膜形成过程显微观察发现,成熟的生物被膜包裹多层细胞,形成纤维网状结构[30-31]。病原细菌生物被膜的结构、动态变化及内部细胞密度因植物类型、植物组织、生长阶段、环境条件等不同而不同,其变化对植物造成不同程度的影响[21]。细菌生物被膜的形成是一个高度协调的过程,此过程还受其他众多因素的影响,包括环境温度、水饱和度、pH值和营养成分等[2]。
2.1 叶际病原细菌与生物被膜病原细菌从植物叶表面入侵时,光、热、干燥等因素对于细菌定殖均造成不利影响,单个细胞分散在叶表面并不利于细菌存活,观察发现一些细菌聚集体常常出现在植物叶片的气孔、表皮毛和叶脉周围,这些细菌聚集的位置具有湿度较大和营养物质浓度较高的特点,有利于细菌存活[32]。以引起拟南芥、豆科植物褐斑病的丁香假单胞菌Pseudomonas syringae为例,细菌主要以聚集体的形式附着在叶片表面,聚集体形式的细胞适应干燥的能力显著强于单个细胞[32]。研究还发现,在草莓叶片定殖的P. syringae和成团泛菌Pantoea agglomerans,形成包含众多细胞的聚集体,聚集体内部细胞受细菌释放的信号分子调控,这些信号不仅调控细菌的聚集状态,还能帮助细菌抵抗竞争菌[30]。可见,生物被膜使细菌的聚集状态更有利于协调细菌的群体行为,增强对环境的适应能力。
2.2 植物维管束病原细菌与生物被膜某些病原细菌通过直接入侵、从受伤组织入侵或由刺吸式昆虫传播进入植物维管组织,并利用生物被膜粘附在植物的木质部和韧皮部。高密度的生物被膜和胞外多糖阻塞植物木质部导管,造成组织损伤。例如,玉米细菌枯萎病的病原细菌P. stewartii、葡萄皮尔斯病的病原细菌Xf、十字花科植物黑腐病的病原细菌Xcc、马铃薯软烂病菌Pectobacterium carotovorum subsp. brasiliense和马铃薯环腐病菌Clavibacter michiganensis subsp. sepedonicus在植物维管组织中形成生物被膜,阻塞并破坏受感染的组织[21, 30, 33-34]。生物被膜甚至在昆虫传播病原细菌的过程中也起到重要作用,如Xf可在叶蝉肠道组织形成生物被膜[22],有效保护病原细菌传播到植物体内[20]。成功定殖的病原细菌还能通过平衡细胞聚集和扩散状态以利于其扩大侵染范围。例如Xf的凝集素介导细胞间的联系,凝集素缺失导致生物被膜形成受阻,但是由于突变体能够较快地在植物体内散播,可导致宿主植物组织更严重的损伤[35]。类似的现象也存在于Xcc致病过程中,β-1, 4-甘露聚糖酶促进细菌由聚集状态转变为浮游状态,有利于Xcc在宿主植物中有效扩散[9]。
2.3 根际病原细菌与生物被膜植物根际病原细菌与根际促生细菌在根部定殖的方式相似,但是致病性假单胞菌较益生假单胞菌形成更厚的生物被膜,这种不同可能是由于致病菌更需要利用生物被膜抵抗植物根部产生的抗菌物质[36-37]。A. tumefaciens可造成宿主植物冠瘿病,从受伤的根部感染植物。A. tumefaciens一旦接触根组织就可形成生物被膜,但是生物被膜在其致病过程中的作用机制还不清楚,推测生物被膜可能与促进细菌接近植物根部合适的侵染位置,或逃避局部植物防御反应有关[38-39]。具有类似特性的根际病原细菌还有发根土壤杆菌Agrobacterium rhizogenes和葡萄土壤杆菌Agrobacterium vitis。
3 生物被膜相关的调控机制3.1 群体感应与群体淬灭群体感应(Quorum sensing,QS)是一种细胞间信息交流的调控机制,细菌通过感知细胞密度和周围微生物群落的物种组成变化调控自身基因表达,而通常细菌生物被膜受群体感应系统调控[40],因此通过干扰QS来影响细菌生物被膜形成,为防治植物细菌病害提供了一个重要手段。植物病原细菌中有几种不同的QS信号分子,如酰基高丝氨酸内酯(AHLs)、呋喃酰硼酸二酯(AI-2)、丁酸内酯和甲基正十二烷酸(DSF)等,细胞通过感应信号分子密度调控细胞种间和种内信息交流,促进细菌在植物体内定殖与致病[41-42]。
P. syringae利用AHLs信号控制其在宿主叶片上胞外多糖的合成和细菌的运动性,AHL合成酶基因缺失突变体胞外多糖合成途径受损,细菌运动性增强[43]。有趣的是在高等植物中存在细菌QS信号分子的类似物,该类似物能够被植物病原细菌QS系统识别,干扰细菌对自身产生的信号的响应[44-45]。植物产生的迷迭香酸(Rosmarinic acid,RA)是高丝氨酸内酯(HSL)的类似物,它可与P. aeruginosa的QS调节子RhiR结合,相比于细菌的HSL可更有效地激活RhiR介导的转录,诱导QS基因表达,促进生物被膜的形成和绿脓菌素及弹性蛋白的产生[46]。因为RA产生于被致病菌感染的植物根部,Corral-Lugo等假设RA的作用可能与植物防御机制相契合,但需要进行实验来验证[46-47]。此外,最近Hazan等发现P. aeruginosa产生的小分子化合物2-庚基-4-羟基喹啉-N-氧化物(HQNO)可以破坏细胞色素bc1复合体电子传递,引起氧爆,从而破坏细胞膜的完整性,最终导致细菌QS调节分子介导的细胞程序性死亡——自噬,细胞发生自溶和DNA释放[26]。而自噬释放的胞外DNA随后促进生物被膜的形成、增加细菌对抗生素的耐受性,因此这种细菌QS调节分子引起的自噬对其本身生存是有益的,可促进细菌长期慢性感染[26]。如果能有效地干扰这个过程,将为干扰植物病原细菌生物被膜形成、减弱其致病力提供新的途径。
破坏QS调控系统有望成为阻止细菌产生致病性的一种有效方式,破坏QS的方法称为群体淬灭(Quorum quenching,QQ)[48],主要有3种途径:抑制与QS信号合成相关酶的表达或抑制其活性,直接破坏QS信号分子和抑制其信号分子积累及其受体活性[49-53]。抑制或酶解AHLs是控制革兰氏阴性病原细菌致病性和生物被膜形成的有效措施。目前主要有3类群体淬灭酶:水解酶、内酯酶、氧化还原酶[54-55]。例如,植物病原细菌黑胫病菌Pectobacterium atrosepticum (PaPVA)和A. tumefaciens所产生的青霉素酰化酶(Penicillin V acylase,PVA)降解长链AHLs,可以抑制铜绿假单胞菌绿脓菌素的产生和生物被膜的形成,从而削弱细菌的致病力[56];P. syringae B728a有2个AHLs酰化酶HacA和HacB,通过断裂AHLs酰胺键而使底物分子失活,从而影响周围细菌的生物被膜状态和致病力[57]。此外益生菌淬灭病原细菌QS是一种有效的生物防治方法,芽孢杆菌Bacillus是从土壤中鉴定到的第一个具有QQ功能的细菌,其产生的AiiA酶可使胡萝卜软腐欧文氏菌Erwinia carotovora QS信号AI失活,降低病原细菌致病性[58]。胡萝卜软腐果胶杆菌Pectobacterium carotovorum subsp. Carotovorum (Pcc)病原细菌能够在马铃薯等寄主上引起严重的细菌性软腐病,Garge等分离到了3种Bacillus菌株,可高效降解Pcc产生的AHLs并显著降低其致病性,利用Bacillus进行生物防治的方法已在许多植物病害防治中得到应用[59]。另外,将细菌AHL降解酶在植物中表达可以减缓细菌毒力因子的产生,同时可增强植物的抗病能力[58]。未来可以进一步关注对宿主植物无害的QS信号分子降解酶的发掘,为更好地利用这种生物防治方法提供有效资源。
3.2 离子通道介导的电信号细菌可以通过不同的通讯方式协调它们的行为,2015年,Süel实验室发现了一种新的细胞间信息交流机制:生物被膜群落中的细菌彼此间在电学上通过被称作“离子通道”的蛋白进行通信,这种离子通道实施远程电信号,协调生物被膜内部和外周细胞的代谢状态[60-61]。最近Süel实验室又发现细菌生物被膜包裹的细胞群落能够通过远程电信号招募不同细菌物种到它们的生物被膜中[62],他们将实验数据与数学建模整合,发现由枯草芽孢杆菌Bacillus subtilis单个菌株组成的生物被膜能够通过电信号招募另一不同菌株P. aeruginosa[62]。生物被膜这种特性,无论是对人类健康还是植物健康都具有较高的应用价值,比如破坏病原细菌电信号使其不能招募周围的细菌,从而抑制其生物被膜的生长。
3.3 Cyclic dimeric (3′→5′) GMPCyclic dimeric (3′→5′) GMP (c-di-GMP)环二鸟苷酸是细菌内重要的第二信使,1987年首次发现其在木醋杆菌Acetobacter xylinum中可激活纤维素合酶[63]。随后的研究发现,c-di-GMP可参与多种细菌生理过程的调控,包括毒力、细胞周期和分化、胞外多糖的合成、从浮游状态转变到聚集状态和生物被膜形成[64-65]。细菌一旦与生物或非生物表面接触,迅速改变它们的行为,释放粘附素,激活细胞表面的细胞器,产生细胞外基质并保护正在生长的菌落。例如,c-di-GMP可以参与调控多种细菌的表面粘附和运动细胞器——Ⅳ型菌毛(Type Ⅳ pili,T4P)的合成[66]。细胞内的c-di-GMP水平由双鸟苷酸环化酶(DGCs)和磷酸二酯酶(PDEs)控制,带有GGDEF结构域的DGCs合成c-di-GMP,带有EAL或HD-GYP结构域的PDEs则起降解作用[67-70],增加或减少c-di-GMP都会改变细菌的生物被膜状态。高浓度的c-di-GMP诱导胞外多糖的生物合成,随后促进生物被膜形成,反之,则抑制生物被膜的形成。在动、植物病原细菌中c-di-GMP调控生物被膜的分子机制是保守的[71],这也反映了生物被膜在细菌感侵宿主过程中起着非常重要的作用。
在植物病原细菌E. amylovora中过表达DGCs能够提高细胞内c-di-GMP水平,促进胞外多糖合成和生物被膜形成;而c-di-GMP合成基因的缺失突变导致细菌运动性增强,生物被膜减少,致病能力增强,推测该突变体运动性增强,促进了E. amylovora从叶片侵染部位迅速扩散[72]。此外,c-di-GMP可与E. amylovora纤维素合成酶亚基BcsA结合,正调控纤维素的合成,纤维素含量影响生物被膜的三维结构,生物被膜有助于细菌系统地侵染宿主[73]。Xcc毒力因子的合成与生物被膜的扩散受一个双组分系统和细胞可扩散信号分子(DSF)正调控,双组分系统由带有HD-GYP结构域的RpfG和同源的RpfC组成。由于RpfG带有HD-GYP结构域,所以它具有降解c-di-GMP的作用,ΔrpfG突变体生物被膜增加,证实了c-di-GMP对生物被膜的形成具有正调控作用[74]。先前研究报道,细菌在高细胞密度时,信号分子DSF可以被RpfC感知,从而激活RpfG降解c-di-GMP,并激活毒力相关基因表达[9, 75-76]。最近有证据表明DSF分子可直接结合在RpfC蛋白N端的一段长22个氨基酸的信号感应区上,激活RpfC蛋白的激酶活性[77]。Engl等在丁香假单胞菌番茄变种Pseudomonas syringae pv. tomato DC3000中也发现c-di-GMP可以诱导细菌生物被膜形成和逃避宿主免疫。在这个病原细菌中Chp8的表达受植物信号诱导,基因产物具有合成和降解c-di-GMP的双重功能,但是chp8突变使细胞内c-di-GMP水平降低,抑制胞外多糖的合成及生物被膜的形成,诱导病原相关分子模式(Pathogen-associated molecular patterns,PAMP)鞭毛蛋白的表达,由于植物识别PAMP而积累水杨酸(Salicylic acid,SA),启动植物免疫反应[11]。
3.4 分泌系统病原细菌具有多种分泌系统,而一些分泌系统跟细胞聚集和生物被膜形成相关。Ⅲ型分泌系统(T3SS)是一种非常重要的动植物分泌系统,是大部分革兰氏阴性病原细菌致病所必需的,P. syringae T3SS缺失突变体不能在宿主烟草叶片上聚集,并且致病力减弱[38]。同样柑桔溃疡病菌Xanthomonas citri subsp. citri T3SS缺失突变体ΔhrpB不能在植物叶表面形成生物被膜[78]。此外能够调节T3SS的基因,也参与生物被膜合成相关基因的表达调控。例如,E. amylovora HrpL不仅可以调控T3SS结构元件的表达,还可调控其他基因——脂蛋白基因nlpl和转录因子基因ydcN的转录,这两个基因的突变导致细菌表现出更加聚集的表型,及生物被膜的增加[79]。虽然T3SS与生物被膜形成之间有一定关系,但是在植物病原细菌中尚未发现明确的或特殊的T3SS效应蛋白参与调控生物被膜形成[80]。
某些革兰氏阴性菌依赖Ⅵ型分泌系统(T6SS)发挥毒力作用,T6SS可以正调控应激反应调节因子和QS调节因子表达,增加细菌对环境的适应能力[81],影响生物被膜的形成[82]。瓜类果斑病菌Acidovorax citrulli,一种可以引起瓜类蔬菜细菌性果斑病的病原细菌,在其基因组中有一个编码T6SS的基因簇,其包含17个基因,分别单独敲除这17个基因,其中4个T6SS关键基因突变体ΔvasD、ΔimpK、ΔimpJ和ΔimpF在甜瓜种子上定殖和形成生物被膜的能力减弱,但这并不影响它们对幼苗组织的致病力,说明T6SS可能在细菌致病早期起作用[83]。
3.5 其他信号病原细菌在与宿主植物互作时,其生物被膜的形成依赖于对植物的营养状态、植物的特殊代谢产物、QS信号分子、金属离子和氧浓度等的感应。其中一些关键营养元素被证实可控制细菌聚集及在介质表面附着,如在大多数细菌中存在的PhoR-PhoB双组分系统,调节细菌在缺磷胁迫下细胞的附着和生物被膜形成,A. tumefaciens利用此双组分系统在缺磷胁迫下增加细胞在介质表面附着量、聚集体平均厚度、平均覆盖率,促进形成生物被膜[84]。斯氏泛菌斯氏亚种Pantoea stewartii subsp. stewartii是造成甜玉米萎蔫病的致病菌,其在缺铁状态下,产生载铁蛋白帮助捕获铁元素,若载铁蛋白缺失突变,则细菌在宿主植物表面的运动性降低[85],而运动性对细菌的生物被膜形成的初始阶段、细菌在宿主木质部移动和致病性都至关重要[36]。细菌在植物体内的运动依赖于载体蛋白的合成,更重要的是载体蛋白捕获铁元素的功能是发挥毒力所必需的,因此活性铁是这个重要的木质部定殖的病原细菌致病性所必不可少的元素[85]。Cruz等还发现在Xf中钙离子浓度可以影响细菌附着、细胞运动性、细胞聚集及生物被膜厚度[86];此外钙离子与胞外DNA的结合也可促进细胞聚集及生物被膜的形成[87]。
在植物病原细菌中,氧也影响生物被膜的形成。在Xf 和A. tumefaciens中,翼状螺旋蛋白BigR是金属传感器ArsR/SmtB家族的一员,其通过占据RNA聚合酶结合位点抑制bigR操纵子的转录,参与生物被膜形成[88],而BigR作为一种新的氧化还原开关,在有氧的条件下抑制bigR操纵子转录[89]。细菌在木质部或根部定殖形成生物被膜,被膜内部细菌处于缺氧状态,硫化氢含量增加,细菌细胞色素c氧化酶活性受到抑制,此时BigR解除对bigR操纵子转录的抑制,bigR操纵子表达对硫化氢解毒是非常重要的,去除硫化氢可以使细菌在缺氧的条件下进行有氧生长[89]。在P. aeruginosa中,氧化还原代谢产物吩嗪参与调控生物被膜形成、毒性、慢性感染等过程,吩嗪以多种形式存在,其中绿脓菌素是最常见的一种形式[90-95]。Costa等研究发现偶发分歧杆菌Mycobacterium fortuitum分泌的一种名为绿脓菌素脱甲基酶(Pyocyanin demethylase,PodA)的小分子蛋白,可以将绿脓菌素的甲基氧化为醛基,当将PodA酶加入到培养基中,绿脓杆菌生物被膜的形成被阻断。由于生物被膜成熟后,位于被膜更深层次的细胞逐渐面临缺氧和氧化还原胁迫,绿脓菌素可缓解该胁迫,利于细菌生存;外加PodA酶则可抑制绿脓菌素的作用,限制成熟生物被膜内的细菌数量[96]。
病原细菌与植物之间复杂的相互识别过程可以改变宿主内部环境,影响细菌生物被膜相应生长阶段及调节生物被膜相关基因表达[2, 80]。例如,X. citri自然变种X. citri AT,具有与A型致病菌X. citri T大于90%的遗传相似性而被命名为X. citri AT[37],由于细菌触发了宿主植物柠檬特异性免疫反应,导致植物转录重编程,造成植物细胞壁增厚、氧化爆发、SA和酚类化合物积累,所以生物被膜生成和细菌生长受到阻滞,致使细菌致病力减弱[97]。研究表明植物SA免疫途径与其自噬机制有关,尽管X. citri AT可在叶片表面及叶肉组织的细胞间隙定殖,但细菌诱导植物产生的自噬空泡释放水解酶,抑制细菌生物被膜的成熟[97]。
4 展望病原细菌在植物各组织表面形成生物被膜对细菌致病性、细菌与宿主互作、宿主植物生理特性、生物被膜外围其他细菌物种都有深远的影响。已有的研究揭示了一些与生物被膜密切相关的机制,如QS、离子通道介导的电信号、第二信使c-di-GMP和分泌系统等,均能调控生物被膜的形成和消解;另外,生物被膜的形成还依赖于细菌对宿主植物信号和细菌胞外非生物环境条件的识别(图 1)。这些影响生物被膜形成因素之间的相互调控关系仍需要进一步研究,以充分阐释细菌关键信号通路之间的相互作用,揭示生物被膜群落和复杂的多菌种组合形成的机理。植物信号分子是调控植物表面生物被膜至关重要的因素,在病原细菌与宿主植物相互识别过程中具有重要作用,宿主植物产生的信号分子对细菌生物被膜代谢调控的分子机理值得进一步探索。
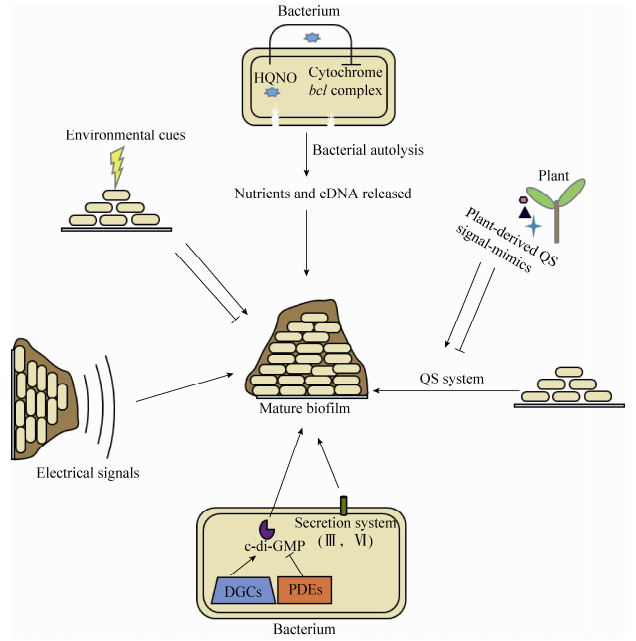 |
| 图 1 影响植物病原细菌生物被膜形成的因素(HQNO为2-庚基-4-羟基喹啉-N-氧化物,可以抑制细胞色素bc1复合体电子传递,导致细菌细胞自溶,释放营养物质和eDNA,释放的eDNA促进生物被膜形成;植物所产生的群体感应(QS)信号分子类似物具有促进或干扰细菌QS系统的作用,影响生物被膜的形成;DGCs和PDEs分别为双鸟苷酸环化酶和磷酸二酯酶,它们分别具有合成和消解c-di-GMP的功能,而c-di-GMP正调控生物被膜的形成;细菌的分泌系统促进形成生物被膜,如Ⅲ和Ⅵ型分泌系统;细菌生物被膜包裹的细胞群落能够通过远程电信号招募周围细菌;不同的环境因素也可影响细菌生物被膜的形成。) Figure 1 Diverse factors regulating bacterial biofilm formation. HQNO, 2-n-heptyl-4-hydroxyquinoline-N-oxide, can inhibit bacterial respiration via the cytochrome bc1 complex, then causes bacterial autolysis leading to release of nutrients and eDNA and promoting biofilm formation. Plant-derived quorum sensing (QS) signal-mimics have the ability to affect bacterial QS system which also influences bacterial biofilm formation. High level of c-di-GMP promotes biofilm formation. The Intracellular level of c-di-GMP is controlled by diguanylate cyclases (DGCs) and phosphodiesterases (PDEs), DGCs synthesize c-di-GMP, whereas PDEs carry out its degradation. Type Ⅲ and Ⅵ secretion systems are essential for bacterial biofilm formation. Pre-existing bacterial biofilms mediate ion-channel-based electrical signaling which recruits surrounding cells into the biofilm community. Some environmental cues can also affect biofilm formation. |
| 图选项 |
参考文献
| [1] | Flemming HC, Wingender J. The biofilm matrix.Nat Rev Microbiol, 2010, 8(9): 623–633. |
| [2] | Hall-Stoodley L, Costerton JW, Stoodley P. Bacterial biofilms:from the natural environment to infectious diseases.Nat Rev Microbiol, 2004, 2(2): 95–108.DOI: 10.1038/nrmicro821 |
| [3] | Ramey BE, Koutsoudis M, von Bodman SB, et al. Biofilm formation in plant-microbe associations.Curr Opin Microbiol, 2004, 7(6): 602–609.DOI: 10.1016/j.mib.2004.10.014 |
| [4] | Sauer K, Camper AK, Ehrlich GD, et al. Pseudomonas aeruginosa displays multiple phenotypes during development as a biofilm.J Bacteriol, 2002, 184(4): 1140–1154.DOI: 10.1128/jb.184.4.1140-1154.2002 |
| [5] | Stoodley P, Sauer K, Davies DG, et al. Biofilms as complex differentiated communities.Annu Rev Microbiol, 2002, 56: 187–209.DOI: 10.1146/annurev.micro.56.012302.160705 |
| [6] | Bogino P, Abod A, Nievas F, et al. Water-limiting conditions alter the structure and biofilm-forming ability of bacterial multispecies communities in the alfalfa rhizosphere.PLoS ONE, 2013, 8(11): e79614.DOI: 10.1371/journal.pone.0079614 |
| [7] | Danhorn T, Fuqua C. Biofilm formation by plant-associated bacteria.Annu Rev Microbiol, 2007, 61: 401–422.DOI: 10.1146/annurev.micro.61.080706.093316 |
| [8] | Parsek MR, Singh PK. Bacterial biofilms:an emerging link to disease pathogenesis.Annu Rev Microbiol, 2003, 57: 677–701.DOI: 10.1146/annurev.micro.57.030502.090720 |
| [9] | Dow JM, Crossman L, Findlay K, et al. Biofilm dispersal in Xanthomonas campestris is controlled by cell-cell signaling and is required for full virulence to plants.Proc Natl Acad Sci USA, 2003, 100(19): 10995–11000.DOI: 10.1073/pnas.1833360100 |
| [10] | Newman KL, Almeida RPP, Purcell AH, et al. Use of a green fluorescent strain for analysis of Xylella fastidiosa colonization of Vitis vinifera.Appl Environ Microbiol, 2003, 69(12): 7319–7327.DOI: 10.1128/AEM.69.12.7319-7327.2003 |
| [11] | Engl C, Waite CJ, McKenna JF, et al. Chp8, a diguanylate cyclase from Pseudomonas syringae pv. tomato DC3000, suppresses the pathogen-associated molecular pattern flagellin, increases extracellular polysaccharides, and promotes plant immune evasion.mBio, 2014, 5(3): e01168–14. |
| [12] | Karatan E, Watnick P. Signals, regulatory networks, and materials that build and break bacterial biofilms.Microbiol Mol Biol Rev, 2009, 73(2): 310–347.DOI: 10.1128/MMBR.00041-08 |
| [13] | Bogino PC, de las Mercedes Oliva L, Sorroche FG, et al. The role of bacterial biofilms and surface components in plant-bacterial associations.Int J Mol Sci, 2013, 14(8): 15838–15859.DOI: 10.3390/ijms140815838 |
| [14] | Ryder C, Byrd M, Wozniak DJ. Role of polysaccharides in Pseudomonas aeruginosa biofilm development.Curr Opin Microbiol, 2007, 10(6): 644–648.DOI: 10.1016/j.mib.2007.09.010 |
| [15] | Boyd A, Chakrabarty AM. Pseudomonas aeruginosa biofilms:role of the alginate exopolysaccharide.J Ind Microbiol, 1995, 15(3): 162–168.DOI: 10.1007/BF01569821 |
| [16] | Colvin KM, Gordon VD, Murakami K, et al. The pel polysaccharide can serve a structural and protective role in the biofilm matrix of Pseudomonas aeruginosa.PLoS Pathog, 2011, 7(1): e1001264.DOI: 10.1371/journal.ppat.1001264 |
| [17] | Byrd MS, Sadovskaya I, Vinogradov E, et al. Genetic and biochemical analyses of the Pseudomonas aeruginosa Psl exopolysaccharide reveal overlapping roles for polysaccharide synthesis enzymes in Psl and LPS production.Mol Microbiol, 2009, 73(4): 622–638.DOI: 10.1111/mmi.2009.73.issue-4 |
| [18] | Limoli DH, Jones CJ, Wozniak DJ. Bacterial extracellular polysaccharides in biofilm formation and function.Microbiol Spectr, 2015, 3(3).DOI: 10.1128/microbiolspec.MB-0011-2014 |
| [19] | Katzen F, Ferreiro DU, Oddo CG, et al. Xanthomonas campestris pv. campestris gum mutants:effects on xanthan biosynthesis and plant virulence.J Bacteriol, 1998, 180(7): 1607–1617. |
| [20] | Newman KL, Almeida RP, Purcell AH, et al. Cell-cell signaling controls Xylella fastidiosa interactions with both insects and plants.Proc Natl Acad Sci USA, 2004, 101(6): 1737–1742.DOI: 10.1073/pnas.0308399100 |
| [21] | Eberl L, von Bodman SB, Fuqua C. Biofilms on plant surfaces. The Biofilm mode of life:mechanisms and adaptation.Environ Microbiol, 2007, 12: 215–234. |
| [22] | Brlansky RH, Timmer LW, French WJ, et al. Colonization of the sharpshooter vectors, Oncometopia nigricans and Homalodisca coagulata, by xylem-limited bacteria.Phytopathology, 1983, 73(4): 530–535.DOI: 10.1094/Phyto-73-530 |
| [23] | Corral-Lugo A, Daddaoua A, Ortega A, et al. Rosmarinic acid is a homoserine lactone mimic produced by plants that activates a bacterial quorum-sensing regulator.Sci Signal, 2016, 9(409): ra1.DOI: 10.1126/scisignal.aaa8271 |
| [24] | Whitchurch CB, Tolker-Nielsen T, Ragas PC, et al. Extracellular DNA required for bacterial biofilm formation.Science, 2002, 295(5559): 1487.DOI: 10.1126/science.295.5559.1487 |
| [25] | Okshevsky M, Meyer RL. The role of extracellular DNA in the establishment, maintenance and perpetuation of bacterial biofilms.Crit Rev Microbiol, 2015, 41(3): 341–352.DOI: 10.3109/1040841X.2013.841639 |
| [26] | Mulcahy H, Charron-Mazenod L, Lewenza S. Extracellular DNA chelates cations and induces antibiotic resistance in Pseudomonas aeruginosa biofilms.PLoS Pathog, 2008, 4(11): e1000213.DOI: 10.1371/journal.ppat.1000213 |
| [27] | Hazan R, Que YA, Maura D, et al. Auto poisoning of the respiratory chain by a quorum-sensing-regulated molecule favors biofilm formation and antibiotic tolerance.Curr Biol, 2016, 26(2): 195–206.DOI: 10.1016/j.cub.2015.11.056 |
| [28] | Ron EZ, Rosenberg E. Natural roles of biosurfactants.Environ Microbiol, 2001, 3(4): 229–236.DOI: 10.1046/j.1462-2920.2001.00190.x |
| [29] | Pamp SJ, Tolker-Nielsen T. Multiple roles of biosurfactants in structural biofilm development by Pseudomonas aeruginosa.J Bacteriol, 2007, 189(6): 2531–2539.DOI: 10.1128/JB.01515-06 |
| [30] | Aktas M, Danne L, M?ller P, et al. Membrane lipids in Agrobacterium tumefaciens:biosynthetic pathways and importance for pathogenesis.Front Plant Sci, 2014, 5: 109. |
| [31] | Koutsoudis MD, Tsaltas D, Minogue TD, et al. Quorum-sensing regulation governs bacterial adhesion, biofilm development, and host colonization in Pantoea stewartii subspecies stewartii.Proc Natl Acad Sci USA, 2006, 103(15): 5983–5988.DOI: 10.1073/pnas.0509860103 |
| [32] | Koczan JM, McGrath MJ, Zhao YF, et al. Contribution of Erwinia amylovora exopolysaccharides amylovoran and levan to biofilm formation:implications in pathogenicity.Phytopathology, 2009, 99(11): 1237–1244.DOI: 10.1094/PHYTO-99-11-1237 |
| [33] | Monier JM, Lindow SE. Aggregates of resident bacteria facilitate survival of immigrant bacteria on leaf surfaces.Microb Ecol, 2005, 49(3): 343–352.DOI: 10.1007/s00248-004-0007-9 |
| [34] | Kubheka GC, Coutinho TA, Moleleki N, et al. Colonization patterns of an mCherry-tagged Pectobacterium carotovorum subsp. brasiliense strain in potato plants.Phytopathology, 2013, 103(12): 1268–1279.DOI: 10.1094/PHYTO-02-13-0049-R |
| [35] | Marques LLR, de Boer SH, Ceri H, et al. Evaluation of biofilms formed by Clavibacter michiganensis subsp. sepedonicus.Phytopathology, 2003, 93: S57. |
| [36] | Guilhabert MR, Kirkpatrick BC. Identification of Xylella fastidiosa antivirulence genes:hemagglutinin adhesins contribute to X. fastidiosa biofilm maturation and colonization and attenuate virulence.Mol Plant Microbe Interact, 2005, 18(8): 856–868.DOI: 10.1094/MPMI-18-0856 |
| [37] | Bais HP, Fall R, Vivanco JM. Biocontrol of Bacillus subtilis against infection of Arabidopsis roots by Pseudomonas syringae is facilitated by biofilm formation and surfactin production.Plant Physiol, 2004, 134(1): 307–319.DOI: 10.1104/pp.103.028712 |
| [38] | Walker TS, Bais HP, Déziel E, et al. Pseudomonas aeruginosa-plant root interactions. Pathogenicity, biofilm formation, and root exudation.Plant Physiol, 2004, 134(1): 320–331.DOI: 10.1104/pp.103.027888 |
| [39] | Schell J, van Montagu M. Transfer, maintenance, and expression of bacterial Ti-plasmid DNA in plant cells transformed with A. tumefaciens.Brookhaven Symp Biol, 1977(29): 36–49. |
| [40] | Zambryski P, Holsters M, Kruger K, et al. Tumor DNA structure in plant cells transformed by A. tumefaciens.Science, 1980, 209(4463): 1385–1391.DOI: 10.1126/science.6251546 |
| [41] | Fuqua C, Greenberg EP. Listening in on bacteria:acyl-homoserine lactone signalling.Nat Rev Mol Cell Biol, 2002, 3(9): 685–695.DOI: 10.1038/nrm907 |
| [42] | von Bodman SB, Bauer WD, Coplin DL. Quorum sensing in plant-pathogenic bacteria.Annu Rev Phytopathol, 2003, 41: 455–482.DOI: 10.1146/annurev.phyto.41.052002.095652 |
| [43] | Zhang WW, Li CH. Exploiting quorum sensing interfering strategies in gram-negative bacteria for the enhancement of environmental applications.Front Microbiol, 2015, 6: 1535. |
| [44] | Qui?ones B, Dulla G, Lindow SE. Quorum sensing regulates exopolysaccharide production, motility, and virulence in Pseudomonas syringae.Mol Plant Microbe Interact, 2005, 18(7): 682–693.DOI: 10.1094/MPMI-18-0682 |
| [45] | Teplitski M, Robinson JB, Bauer WD. Plants secrete substances that mimic bacterial N-acyl homoserine lactone signal activities and affect population density-dependent behaviors in associated bacteria.Mol Plant Microbe Interact, 2000, 13(6): 637–648.DOI: 10.1094/MPMI.2000.13.6.637 |
| [46] | Bauer WD, Robinson JB. Disruption of bacterial quorum sensing by other organisms.Curr Opin Biotechnol, 2002, 13(3): 234–237.DOI: 10.1016/S0958-1669(02)00310-5 |
| [47] | Corral-Lugo A, Daddaoua A, Ortega A, et al. So different and still so similar:the plant compound rosmarinic acid mimics bacterial homoserine lactone quorum sensing signals.Commun Integr Biol, 2016, 9(2): e1156832.DOI: 10.1080/19420889.2016.1156832 |
| [48] | Uroz S, Dessaux Y, Oger P. Quorum sensing and quorum quenching:the yin and yang of bacterial communication.Chembiochem, 2009, 10(2): 205–216.DOI: 10.1002/cbic.v10:2 |
| [49] | Chernin L, Toklikishvili N, Ovadis M, et al. Quorum-sensing quenching by rhizobacterial volatiles.Environ Microbiol Rep, 2011, 3(6): 698–704.DOI: 10.1111/emi4.2011.3.issue-6 |
| [50] | Czajkowski R, Jafra S. Quenching of acyl-homoserine lactone-dependent quorum sensing by enzymatic disruption of signal molecules.Acta Biochim Pol, 2009, 56(1): 1–16. |
| [51] | Dong YH, Wang LH, Xu JL, et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase.Nature, 2001, 411(6839): 813–817.DOI: 10.1038/35081101 |
| [52] | Dong YH, Wang LY, Zhang LH. Quorum-quenching microbial infections:mechanisms and implications.Philos Trans R Soc Lond B Biol Sci, 2007, 362(1483): 1201–1211.DOI: 10.1098/rstb.2007.2045 |
| [53] | Helman Y, Chernin L. Silencing the mob:disrupting quorum sensing as a means to fight plant disease.Mol Plant Pathol, 2015, 16(3): 316–329.DOI: 10.1111/mpp.2015.16.issue-3 |
| [54] | Park SY, Hwang BJ, Shin MH, et al. N-acylhomoserine lactonase producing Rhodococcus spp. with different AHL-degrading activities.FEMS Microbiol Lett, 2006, 261(1): 102–108.DOI: 10.1111/fml.2006.261.issue-1 |
| [55] | Uroz S, Chhabra SR, Cámara M, et al. N-acylhomoserine lactone quorum-sensing molecules are modified and degraded by Rhodococcus erythropolis W2 by both amidolytic and novel oxidoreductase activities.Microbiology, 2005, 151(10): 3313–3322.DOI: 10.1099/mic.0.27961-0 |
| [56] | Sunder AV, Utari PD, Ramasamy S, et al. Penicillin V acylases from gram-negative bacteria degrade N-acylhomoserine lactones and attenuate virulence in Pseudomonas aeruginosa.Appl Microbiol Biotechnol, 2017, 101(6): 2383–2395.DOI: 10.1007/s00253-016-8031-5 |
| [57] | Shepherd RW, Lindow SE. Two dissimilar N-acyl-homoserine lactone acylases of Pseudomonas syringae influence colony and biofilm morphology.Appl Environ Microbiol, 2009, 75(1): 45–53.DOI: 10.1128/AEM.01723-08 |
| [58] | Dong YH, Xu JL, Li XZ, et al. AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora.Proc Natl Acad Sci USA, 2000, 97(7): 3526–3531.DOI: 10.1073/pnas.97.7.3526 |
| [59] | Garge SS, Nerurkar AS. Evaluation of quorum quenching Bacillus spp. for their biocontrol traits against Pectobacterium carotovorum subsp. carotovorum causing soft rot.Biocatal Agric Biotechnol, 2017, 9: 48–57. |
| [60] | Liu JT, Prindle A, Humphries J, et al. Metabolic co-dependence gives rise to collective oscillations within biofilms.Nature, 2015, 523(7562): 550–554.DOI: 10.1038/nature14660 |
| [61] | Prindle A, Liu JT, Asally M, et al. Ion channels enable electrical communication in bacterial communities.Nature, 2015, 527(7576): 59–63.DOI: 10.1038/nature15709 |
| [62] | Humphries J, Xiong LY, Liu JT, et al. Species-independent attraction to biofilms through electrical signaling.Cell, 2017, 168(1/2): 200–209. |
| [63] | Ross P, Weinhouse H, Aloni Y, et al. Regulation of cellulose synthesis in Acetobacter xylinum by cyclic diguanylic acid.Nature, 1987, 325(6101): 279–281.DOI: 10.1038/325279a0 |
| [64] | R?mling U, Galperin MY, Gomelsky M. Cyclic di-GMP:the first 25 years of a universal bacterial second messenger.Microbiol Mol Biol Rev, 2013, 77(1): 1–52.DOI: 10.1128/MMBR.00043-12 |
| [65] | Ryan RP. Cyclic di-GMP signalling and the regulation of bacterial virulence.Microbiology, 2013, 159(7): 1286–1297. |
| [66] | Jenal U, Reinders A, Lori C. Cyclic di-GMP:second messenger extraordinaire.Nat Rev Microbiol, 2017, 15(5): 271–284.DOI: 10.1038/nrmicro.2016.190 |
| [67] | Christen M, Christen B, Folcher M, et al. Identification and characterization of a cyclic di-GMP-specific phosphodiesterase and its allosteric control by GTP.J Biol Chem, 2005, 280(35): 30829–30837.DOI: 10.1074/jbc.M504429200 |
| [68] | Chan C, Paul R, Samoray D, et al. Structural basis of activity and allosteric control of diguanylate an operon implicated in biofilm growth.J Bacteriol, 2007, 189(17): 6185–6194.DOI: 10.1128/JB.00331-07 |
| [69] | Schmidt AJ, Ryjenkov DA, Gomelsky M. The ubiquitous protein domain EAL is a cyclic diguanylate-specific phosphodiesterase:enzymatically active and inactive EAL domains.J Bacteriol, 2005, 187(14): 4774–4781.DOI: 10.1128/JB.187.14.4774-4781.2005 |
| [70] | Ryjenkov DA, Tarutina M, Moskvin OV, et al. Cyclic diguanylate is a ubiquitous signaling molecule in bacteria:insights into biochemistry of the GGDEF protein domain.J Bacteriol, 2005, 187(5): 1792–1798.DOI: 10.1128/JB.187.5.1792-1798.2005 |
| [71] | Sadiq FA, Flint S, Li Y, et al. New mechanistic insights into the motile-to-sessile switch in various bacteria with particular emphasis on Bacillus subtilis and Pseudomonas aeruginosa:a review.Biofouling, 2017: 1–21. |
| [72] | Edmunds AC, Castiblanco LF, Sundin GW, et al. Cyclic di-GMP modulates the disease progression of Erwinia amylovora.J Bacteriol, 2013, 195(10): 2155–2165.DOI: 10.1128/JB.02068-12 |
| [73] | Castiblanco LF, Sundin GW. Cellulose production, activated by cyclic di-GMP through BcsA and BcsZ, is a virulence factor and an essential determinant of the three-dimensional architectures of biofilms formed by Erwinia amylovora Ea1189.Mol Plant Pathol, 2016.DOI: 10.1111/mpp.12501 |
| [74] | Ryan RP, Fouhy Y, Lucey JF, et al. Cell-cell signaling in Xanthomonas campestris involves an HD-GYP domain protein that functions in cyclic di-GMP turnover.Proc Natl Acad Sci USA, 2006, 103(17): 6712–6717.DOI: 10.1073/pnas.0600345103 |
| [75] | Deng YY, Wu JE, Tao F, et al. Listening to a new language:DSF-based quorum sensing in Gram-negative bacteria.Chem Rev, 2011, 111(1): 160–173.DOI: 10.1021/cr100354f |
| [76] | Tao F, He YW, Wu DH, et al. The cyclic nucleotide monophosphate domain of Xanthomonas campestris global regulator Clp defines a new class of cyclic di-GMP effectors.J Bacteriol, 2010, 192(4): 1020–1029.DOI: 10.1128/JB.01253-09 |
| [77] | Cai Z, Yuan ZH, Zhang H, et al. Fatty acid DSF binds and allosterically activates histidine kinase RpfC of phytopathogenic bacterium Xanthomonas campestris pv. campestris to regulate quorum-sensing and virulence.PLoS Pathog, 2017, 13(4): e1006304.DOI: 10.1371/journal.ppat.1006304 |
| [78] | Zimaro T, Thomas L, Marondedze C, et al. The type Ⅲ protein secretion system contributes to Xanthomonas citri subsp. citri biofilm formation.BMC Microbiol, 2014, 14: 96.DOI: 10.1186/1471-2180-14-96 |
| [79] | McNally RR, Toth IK, Cock PJA, et al. Genetic characterization of the HrpL regulon of the fire blight pathogen Erwinia amylovora reveals novel virulence factors.Mol Plant Pathol, 2012, 13(2): 160–173.DOI: 10.1111/mpp.2012.13.issue-2 |
| [80] | Castiblanco LF, Sundin GW. New insights on molecular regulation of biofilm formation in plant-associated bacteria.J Integr Plant Biol, 2016, 58(4): 362–372.DOI: 10.1111/jipb.12428 |
| [81] | Weber B, Hasic M, Chen C, et al. Type Ⅵ secretion modulates quorum sensing and stress response in Vibrio anguillarum.Environ Microbiol, 2009, 11(12): 3018–3028.DOI: 10.1111/emi.2009.11.issue-12 |
| [82] | Aschtgen MS, Gavioli M, Dessen A, et al. The SciZ protein anchors the enteroaggregative Escherichia coli Type Ⅵ secretion system to the cell wall.Mol Microbiol, 2010, 75(4): 886–899.DOI: 10.1111/mmi.2010.75.issue-4 |
| [83] | Tian YL, Zhao YQ, Wu XR, et al. The type Ⅵ protein secretion system contributes to biofilm formation and seed-to-seedling transmission of Acidovorax citrulli on melon.Mol Plant Pathol, 2015, 16(1): 38–47.DOI: 10.1111/mpp.2015.16.issue-1 |
| [84] | Danhorn T, Hentzer M, Givskov M, et al. Phosphorus limitation enhances biofilm formation of the plant pathogen Agrobacterium tumefaciens through the PhoR-PhoB regulatory system.J Bacteriol, 2004, 186(14): 4492–4501.DOI: 10.1128/JB.186.14.4492-4501.2004 |
| [85] | Burbank L, Mohammadi M, Roper MC. Siderophore-mediated iron acquisition influences motility and is required for full virulence of the xylem-dwelling bacterial phytopathogen Pantoea stewartii subsp. stewartii.Appl Environ Microbiol, 2015, 81(1): 139–148.DOI: 10.1128/AEM.02503-14 |
| [86] | Cruz LF, Cobine PA, de la Fuente L. Calcium increases Xylella fastidiosa surface attachment, biofilm formation, and twitching motility.Appl Environ Microbiol, 2012, 78(5): 1321–1331.DOI: 10.1128/AEM.06501-11 |
| [87] | Das T, Sehar S, Koop L, et al. Influence of calcium in extracellular DNA mediated bacterial aggregation and biofilm formation.PLoS ONE, 2014, 9(3): e91935.DOI: 10.1371/journal.pone.0091935 |
| [88] | Barbosa RL, Benedetti CE. BigR, a transcriptional repressor from plant-associated bacteria, regulates |
| [89] | Guimar?es BG, Barbosa RL, Soprano AS, et al. Plant pathogenic bacteria utilize biofilm growth-associated repressor (BigR), a novel winged-helix redox switch, to control hydrogen sulfide detoxification under hypoxia.J Biol Chem, 2011, 286(29): 26148–26157.DOI: 10.1074/jbc.M111.234039 |
| [90] | Turner JM, Messenger AJ. Occurrence, biochemistry and physiology of phenazine pigment production.Adv Microb Physiol, 1986, 27: 211–275.DOI: 10.1016/S0065-2911(08)60306-9 |
| [91] | Wang Y, Kern SE, Newman DK. Endogenous phenazine antibiotics promote anaerobic survival of Pseudomonas aeruginosa via extracellular electron transfer.J Bacteriol, 2010, 192(1): 365–369.DOI: 10.1128/JB.01188-09 |
| [92] | Glasser NR, Kern SE, Newman DK. Phenazine redox cycling enhances anaerobic survival in Pseudomonas aeruginosa by facilitating generation of ATP and a proton-motive force.Mol Microbiol, 2014, 92(2): 399–412.DOI: 10.1111/mmi.2014.92.issue-2 |
| [93] | Price-Whelan A, Dietrich LEP, Newman DK. Pyocyanin alters redox homeostasis and carbon flux through central metabolic pathways in Pseudomonas aeruginosa PA14.J Bacteriol, 2007, 189(17): 6372–6381.DOI: 10.1128/JB.00505-07 |
| [94] | Ramos I, Dietrich LEP, Price-Whelan A, et al. Phenazines affect biofilm formation by Pseudomonas aeruginosa in similar ways at various scales.Res Microbiol, 2010, 161(3): 187–191.DOI: 10.1016/j.resmic.2010.01.003 |
| [95] | Wang Y, Wilks JC, Danhorn T, et al. Phenazine-1-carboxylic acid promotes bacterial biofilm development via ferrous iron acquisition.J Bacteriol, 2011, 193(14): 3606–3617.DOI: 10.1128/JB.00396-11 |
| [96] | Costa KC, Glasser NR, Conway SJ, et al. Pyocyanin degradation by a tautomerizing demethylase inhibits Pseudomonas aeruginosa biofilms.Science, 2017, 355(6321): 170–173.DOI: 10.1126/science.aag3180 |
| [97] | Roeschlin RA, Favaro MA, Chiesa MA, et al. Resistance to citrus canker induced by a variant of Xanthomonas citri ssp. citri is associated with a hypersensitive cell death response involving autophagy-associated vacuolar processes.Mol Plant Pathol, 2016.DOI: 10.1111/mpp.12489 |
