
 , 史劲松1, 许正宏2
, 史劲松1, 许正宏21 江南大学 药学院,江苏 无锡 214122;
2 江南大学 生物工程学院,江苏 无锡 214122
收稿日期:2017-01-13;接收日期:2017-03-29; 网络出版时间:2017-04-11 基金项目:国家高技术研究发展计划(863计划) (No. 2011AA02A211),江苏省普通高校学术学位研究生科研创新计划项目(No. KYLX16_0826) 资助
摘要:以实验室前期筛选得到的分枝杆菌(Mycobacterium sp. LY-1) 为出发菌株,采用等离子诱变(ARTP)技术选育出能高效转化植物甾醇为重要甾体药物中间体9α-羟基雄甾-4-烯-3, 17-二酮(9α-OH-AD)的菌株,并对其转化工艺进行优化。经过ARTP诱变选育得到遗传稳定性较好的分枝杆菌突变株Mycobacterium sp. C33,当底物植物甾醇投料浓度为15 g/L时,转化生成9α-OH-AD的摩尔得率达到15.5%,较原始菌株提高34.8%。继而采用正交实验设计方法,对突变菌的发酵培养基组分进行优化,并建立了油水双相转化体系,进一步提高了突变菌株C33的产物摩尔得率,最高达到47.0%,较优化前(15.5%)提高了2倍。
关键词:分枝杆菌 植物甾醇 9α-OH-AD 等离子诱变 生物转化
Mutation breeding of high 9α-hydroxy-androst-4-ene-3, 17-dione transforming strains from phytosterols and their conversion process optimization
Yang Ma1, Xiangdong Wang1, Menghui Wang1, Hui Li1

 , Jinsong Shi1, Zhenghong Xu2
, Jinsong Shi1, Zhenghong Xu2 1 School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, Jiangsu, China;
2 School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: January 13, 2017; Accepted: March 29, 2017; Published: April 11, 2017
Supported by: National High Technology Program of China (863 Program) (No. 2011AA02A211), Jiangsu College and University Academic Degree Graduate Research and Innovation Program (No. KYLX16_0826)
Corresponding author:Hui Li. Tel: +86-510-85326883; Fax: +86-510-85328177; E-mail: lihui@jiangnan.edu.cn
Abstract: In order to improve transformation efficiency of phytosterols into 9α-hydroxylation of 4-androstene-3, 17-dione (9α-OH-AD) by Mycobacterium sp. LY-1, we studied the strains breeding using atmospheric and room temperature plasma (ARTP) technology and optimized their conversion process. A high production strain named C33 with a good genetic stability was selected and the product molar yield reached to 15.5%, 34.8% higher than that of original strain with 15 g/L phytosterols. Furthermore, the fermentation medium was optimized through the design of orthogonal experiment. Besides, oil-water bidirectional transformation system was set up to improve the 9α-OH-AD molar yield of mutant strain C33. With adding 12 mL soybean oil to each 1 g phytosterols, the molar yield of 9α-OH-AD reached 47.0%, which increased twice than that of control (15.5%).
Key words: Mycobacterium sp. phytosterol 9α-OH-AD atmospheric and room temperature plasma biotransformation
甾体激素类药物主要包括性激素、肾上腺皮质激素和蛋白同化激素三大类[1]。甾体激素药物最首要的药效体现在对人类生育能力的改善[2-4],其次还具有显著的抗肿瘤、抗炎抗敏、抗菌抗病毒、抗痉挛等效果[5-7]。由于甾类激素药物对人体机体发挥着十分重要的调节作用,因此该类药物现已成为仅次于抗生素的第二大品种。由于传统化学合成法带来严重的工业污染,并且存在收率低、成本高等问题,极大地限制了甾体激素在药物领域的发展,故近年来利用微生物转化逐渐成为主要发展趋势[8]。
植物甾醇是大豆榨油后的下脚料,作为新的甾体资源,由于其来源丰富、价格低廉,使得产品价格大幅度下降,为甾体激素药物产品带来了新的市场。植物甾醇是一类疏水性化合物,它的低溶解性导致的传质限制是其转化的瓶颈问题之一[9]。双相转化体系一定程度上为解决这个问题提供了有力的技术保障,采用天然油脂能够增加甾醇溶解度,且对微生物的伤害较低[10-13]。
9α-羟基雄甾-4-烯-3, 17-二酮(9α-OH-AD)是一种重要的甾体药物中间体[14],其9α位作为被羟基化的位点,在进行简单的卤化反应后便可引入F或Cl等卤素取代基,从而有效提升某些皮质类激素(如地塞米松、倍他米松、糠酸莫米松及氯地米松等药物)的药效[15],因此研究由植物甾醇转化生成9α-OH-AD具有广阔的市场前景。但利用微生物转化植物甾醇生成9α-OH-AD仍存在转化率低、产物得率低及产物纯度不高等诸多问题。要切实提高转化率,可行的措施主要包括:一是通过诱变筛选方法获得优势菌株,二是通过基因工程技术进行菌株改造,三是通过优化调整转化工艺。由于在分子操作方面尚存在一定难度,我们尝试以实验室1株可转化植物甾醇生成9α-OH-AD的分枝杆菌Mycobacterium sp. LY-1作为出发菌株,采用诱变结合工艺调整和优化的方法提升转化效率,以提高目的产物9α-OH-AD的浓度。
1 材料与方法1.1 材料1.1.1 菌种分枝杆菌Mycobacterium sp. LY-1,由本实验室保藏。
1.1.2 试剂植物甾醇(β-谷甾醇47.0%,菜油甾醇24.6%,豆甾醇15.5%,菜籽甾醇3.4%)购自湖北巨胜科技有限公司;9α-羟基雄甾-4-烯-3, 17-二酮(9α-OH-AD)购自上海瀚香生物科技,纯度为98.0%以上。
1.1.3 培养基PDA斜面培养基(g/L):土豆200,葡萄糖20,琼脂20。
种子培养基(g/L):NaNO3 5.4,酵母粉15,甘油2,(NH4)2HPO4 0.6。
发酵培养基(g/L):NaNO3 5.4,玉米浆20,(NH4)2HPO4 0.6,植物甾醇15,pH 8.0。
1.2 方法1.2.1 菌株的培养将PDA斜面保存的分枝杆菌菌体接种于无菌种子培养基,120 r/min、30 ℃摇床培养72 h。
1.2.2 菌株诱变时间的选择将斜面上挑取的分枝杆菌移至100 mL种子培养基中,30 ℃、120 r/min摇床培养72 h至菌体的对数生长期,取0.01 mL菌液均匀地涂在金属载片上。把装有样品的金属载片平板放到ARTP诱变系统操作室里,逐渐增加诱变时间(15–210 s)进行诱变。诱变结束后,用镊子把金属载片移至装有1 mL培养基的EP管里,制成新的菌悬液。对新的菌悬液进行后培养7 d,培养结束后记录下各平板的菌落数,计算诱变致死率,如下式,确定最佳诱变时间。
 |
1.2.4 突变株的遗传稳定性评价将筛选出的优势突变株分别进行转化培养,测定其9α-OH-AD的生成能力,将保种管中的突变菌株分区划线于PDA固体培养基上培养7 d,挑取单菌落于种子培养基中,120 r/min、30 ℃摇床培养72 h,转接发酵培养基7 d后测定9α-OH-AD得率,再将该种子液重新划线于PDA固体培养基上培养7 d,挑取单菌落于种子培养基,按上述步骤重复5次,比较每次9α-OH-AD得率,以考察突变菌株的遗传稳定性。
1.2.5 菌体生物量测定菌体生物量以每升转化液中的菌体干重来表示。取洁净的离心管75 ℃烘干至恒重,称重记为W1。准确量取1 mL的待测菌液置于离心管中,12 000 r/min离心3 min后弃上清,用乙酸乙酯清洗菌体3遍。将含菌体的离心管再次烘干至恒重,称量得到菌体与离心管的重量之和,记为W2。W2与W1之差即为1 mL的待测菌液中的菌体干重。
1.2.6 产物提取准确量取0.5 mL待测发酵液,用等体积乙酸乙酯反复萃取6遍,合并萃取后的上清液,将上清液烘干得到底物、副产物、产物的混合物,用8倍体积的乙腈复溶稀释后,0.22 μm有机滤膜过滤除杂,HPLC分析转化液中底物、副产物、产物含量。
1.2.7 分析方法采用高效液相色谱法(HPLC)检测产物,配制0.5 g/L的9α-OH-AD标准品,利用外标法计算目的产物的浓度。色谱柱,Agilent TC-C18 (4.6 mm× 250 mm,5 μm);流动相,乙腈/水(7:3,体积比);柱温30 ℃;检测波长254 nm;流速0.5 mL/min;进样10 μL。
产物摩尔得率计算方法:
 |
1.2.8 正交实验设计筛选最佳培养基组分根据原始培养基组分设计3因素3水平正交试验(表 1)。按照实验设计分别配制发酵培养基。以1.0%的接种量将种子液转接到发酵培养液中,30 ℃、120 r/min摇床培养7 d。采用统计学方法分析实验结果,确定最优培养基配方。
表 1 正交试验设计Table 1 Orthogonal test design
| Levels | NaNO3 (g/L) | Corn steep liquor (g/L) | (NH)2HPO4 (g/L) |
| A | B | C | |
| 1 | 4 | 15 | 0.4 |
| 2 | 5 | 20 | 0.6 |
| 3 | 6 | 25 | 0.8 |
表选项
1.2.9 油水双相转化体系的建立按照每投加1 g底物,加入16 mL的油量向发酵培养基中加入大豆油、菜籽油、葵花籽油、橄榄油,并与无油转化进行对比,比较5种条件下9α-OH-AD的积累量。
选择最佳的油水转化方式后,对油的添加浓度进行梯度优化,当投加每1 g底物时,分别加入4、8、12、16、20 mL油量进行转化,30 ℃,120 r/min培养7 d后,乙酸乙酯萃取发酵液进行HPLC检测,根据9α-OH-AD得率,确定最优的油添加浓度。
2 结果与分析2.1 分枝杆菌Mycobacterium sp. LY-1的ARTP诱变2.1.1 最佳诱变时间的确定将分枝杆菌Mycobacterium sp. LY-1经ARTP诱变照射不同时间后进行再生培养,根据再生单菌落数计算其致死率,结果如图 1所示。随着ARTP诱变时间的延长,菌体致死率迅速增加。当照射时间为150 s时,菌体致死率达到98.0%左右,当达到180 s时,平板无菌体生长,由于等离子诱变在致死率较高时比较易发生正向突变,故选择150 s作为原生质体的处理时间。
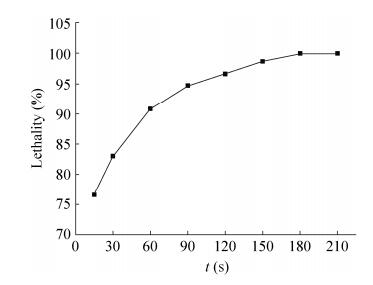 |
| 图 1 不同诱变时间菌体的致死率 Figure 1 The lethality of the cells in different mutagenic time. |
| 图选项 |
2.1.2 突变菌株的选育及转化能力验证在ARTP诱变系统操作室对菌体照射150 s后,涂布于PDA平板上培养7 d,从单菌落中挑取150株突变株,测定各突变株的9α-OH-AD得率。如图 2、3所示,通过摇瓶转化实验验证,最终筛选得到8株正向突变菌株C3、C12、C21、C25、C27、C33、C39、C49,其中C33产物得率较野生菌提高最多,9α-OH-AD摩尔得率达到15.5%。
 |
| 图 2 优势突变菌株的筛选 Figure 2 Screening of dominant mutant strains. |
| 图选项 |
 |
| 图 3 产物HPLC检测图谱(A:9α-OH-AD标样,B:出发菌株LY-1,C:诱变菌株C33) Figure 3 Detection of the product by HPLC (A: 9α-OH-AD standard, B: original strain LY-1, C: mutagenic strain C33). |
| 图选项 |
2.1.3 最佳诱变时间的确定将突变株C33进行传代培养,以考察其遗传稳定性。如图 4所示,经过连续5代的培养,确定其为1株稳定性好且转化率高的菌株。
 |
| 图 4 突变菌株C33的遗传稳定性 Figure 4 Genetic stability of mutant strain C33. |
| 图选项 |
2.2 突变菌株的转化工艺优化2.2.1 培养基组分的优化培养基的组分、配比、缓冲能力都对微生物的生长和产物形成有重要的影响。本试验采用正交实验设计方法,在摇瓶中对分枝杆菌转化植物甾醇的培养基组分(NaNO3、玉米浆和(NH4)2HPO4)进行优化,进一步研究各组分对菌种转化能力的影响。设计了三因素三水平的正交试验,以9α-OH-AD的浓度为指标,选用L9(33)正交表进行培养基的进一步优化,并进行极差分析。正交试验结果见表 2。
表 2 正交试验结果Table 2 The results of orthogonal test
| Group | A | B | C | 9α-OH-AD yield (%) |
| 1 | 1 | 1 | 1 | 13.71 |
| 2 | 1 | 2 | 2 | 13.88 |
| 3 | 1 | 3 | 3 | 12.44 |
| 4 | 2 | 1 | 2 | 15.42 |
| 5 | 2 | 2 | 3 | 11.81 |
| 6 | 2 | 3 | 1 | 14.61 |
| 7 | 3 | 1 | 3 | 12.89 |
| 8 | 3 | 2 | 1 | 9.56 |
| 9 | 3 | 3 | 2 | 15.06 |
| Average 1 | 1.48 | 1.55 | 1.40 | |
| Average 2 | 1.55 | 1.30 | 1.64 | |
| Average 3 | 1.39 | 1.56 | 1.37 | |
| Mean square (R) | 0.16 | 0.26 | 0.27 |
表选项
由极差R值可知,(NH)2HPO4浓度对转化产物的形成影响最为显著,然后依次是玉米浆、NaNO3。正交实验得到的理论最佳培养基配方为A2B3C2,即NaNO3 5 g/L,玉米浆25 g/L,(NH)2HPO4 0.6 g/L,此条件下9α-OH-AD得率最高。
2.2.2 油水双相转化体系的构建及优化油水双相转化体系的建立:构建油水双相体系可以很大程度地提高9α-OH-AD的积累量,两相体系中用到的大豆油脂,能够有效增加甾醇溶解度,且相比有机溶剂对微生物的伤害性更低。在转化过程中,加入油脂可以提高甾醇的投料量和菌体的活力[16-17],因此采用该体系,利用突变菌株C33转化植物甾醇,从图 5可以看出,大豆油-水双相体系下9α-OH-AD的得率最高,并且大豆油的价格相对也较低,故采用大豆油进行后续实验。从图 6可以看出,9α-OH-AD浓度在转化7 d左右的时间达到最高,摩尔得率达到43.0%以上。
 |
| 图 5 油水双相体系中油类的筛选 Figure 5 Screening of oil in biphasic system. |
| 图选项 |
 |
| 图 6 突变菌株C33油水双相体系转化参数 Figure 6 Batch conversion process of oil-water biphasic system with C33. |
| 图选项 |
大豆油添加浓度的优化:在建立油水双相体系并大大提高9α-OH-AD得率后,本实验对大豆油进行了进一步的浓度优化,结果如图 7所示。当大豆油的添加量为每1 g植物甾醇添加12 mL时,9α-OH-AD的摩尔得率最高,达到47.0%以上。
 |
| 图 7 不同油梯度的转化效果 Figure 7 Effects of different soybean oil concentrations on product yield. |
| 图选项 |
3 结论本实验以实验室保存的分枝杆菌Mycobacterium sp. LY-1为出发菌株,采用等离子诱变技术(ARTP)对菌株进行诱变选育。通过筛选,成功获得了1株遗传稳定性良好,且能高效转化植物甾醇产9α-OH-AD的突变菌株C33,并对诱变菌的发酵培养基进行了正交实验优化,确定了最适培养基组分为:NaNO3 5 g/L,玉米浆25 g/L,(NH4)2HPO4 0.6 g/L。此外,建立了油水双相转化体系,优化后得到当每1 g植物甾醇添加12 mL大豆油时9α-OH-AD得率最高,投加15 g/L底物时,9α-OH-AD摩尔得率可达到47.0%以上。
目前利用微生物转化植物甾醇的产物多为AD与ADD,或以AD为底物转化生成9α-OH-AD,直接由植物甾醇生成9α-OH-AD的报道相对较少,后续研究希望通过提高底物投料量,为工业化生产创造更大的价值。本实验中大豆油的作用机制尚不明确,仅了解到其对底物起到助溶作用,但对菌体细胞膜结构是否存在影响从而增强了底物传质效率,仍需要进一步实验探究。本文的研究结果可作为大豆油作用机制的研究基础,对于其他微溶于水底物的生物转化研究也具有一定的参考价值。
参考文献
| [1] | Wang M. Study on the 11β-hydroxylation of steroids by Curvularia lunata[D]. Tianjin: Tianjin University of Science and Technology, 2001 (in Chinese). 王敏. 新月弯孢霉的甾体11β-羟基化作用研究[D]. 天津: 天津科技大学, 2001.http://cdmd.cnki.com.cn/article/cdmd-10057-2003062165.htm |
| [2] | AsselinLabat ML, Vaillant F, Sheridan JM, et al. Control of mammary stem cell function by steroid hormone signalling.Nature, 2010, 465(7299): 798–802.DOI: 10.1038/nature09027 |
| [3] | Callewaert F, Boonen S, Vanderschueren D. Sex steroids and the male skeleton: a tale of two hormones.Trends Endocrinol Metab, 2010, 21(2): 89–95.DOI: 10.1016/j.tem.2009.09.002 |
| [4] | Rubtsov AV, Rubtsova K, Kappler JW, et al. Genetic and hormonal factors in female-biased autoimmunity.Autoimmun Rev, 2010, 9(7): 494–498.DOI: 10.1016/j.autrev.2010.02.008 |
| [5] | B ckstr m T, Haage D, L fgren M, et al. Paradoxical effects of GABA-A modulators may explain sex steroid induced negative mood symptoms in some persons.Neuroscience, 2011, 191(Special issue): 46–54. |
| [6] | Douglas M. Neurology of endocrine disease.Clin Med, 2010, 10(4): 387–390.DOI: 10.7861/clinmedicine.10-4-387 |
| [7] | Garcia-Segura LM, Balthazart J. Steroids and neuroprotection: new advances.Front Neuroendocrinol, 2009, 30(2): 5–9. |
| [8] | Chen DJ, Zhu BQ. Application of microbial transformation in modern pharmaceutical industry.Chin J Antibiot, 2006, 31(2): 112–118.(in Chinese). 陈代杰, 朱宝泉. 微生物转化技术在现代医药工业中的应用.中国抗生素杂志, 2006, 31(2): 112-118. |
| [9] | Donova MV, Egorova OV. Microbial steroid transformations: current state and prospects.Appl Micobiol Biotechnol, 2012, 94(6): 1423–1447.DOI: 10.1007/s00253-012-4078-0 |
| [10] | Laane C, Boeren S, Vos K, et al. Rules for optimization of biocatalysis in organic solvents.Biotechnol Bioeng, 2010, 30(1): 81–87. |
| [11] | Yang Y. Research on study on bioconversion of phytosterols into steroid medicine intermediates by Mycobacterium sp. [D]. Hefei: Hefei University of Technology, 2009 (in Chinese). 杨英. 微生物转化植物甾醇制备甾体药物关键中间体研究[D]. 合肥: 合肥工业大学, 2009.http://cdmd.cnki.com.cn/Article/CDMD-10359-2010037032.htm |
| [12] | Xu YG. Side-chain cleavage of phytosterols by Mycobacterium sp. MB 3683[D]. Hangzhou: Zhejiang University, 2014 (in Chinese). 徐阳光. 分枝杆菌降解植物甾醇侧链过程基础研究[D]. 杭州: 浙江大学, 2014.http://cdmd.cnki.com.cn/Article/CDMD-10335-1014226049.htm |
| [13] | Gao XQ, Feng JX, Hua Q, et al. Biotransformation of phytosterols to 9α-hydroxyandrostenedione by Mycobacterium sp. in oil-water emulsion system.J East China Univ Sci Technol: Nat Sci Ed, 2014, 40(4): 433–437.(in Chinese). 高兴强, 冯建勋, 花强, 等. 油水乳化体系中分枝杆菌转化植物甾醇产9α-羟基雄甾烯酮工艺研究.华东理工大学学报:自然科学版, 2014, 40(4): 433-437. |
| [14] | Rheenen VV, Shephard KP. Chemlnform abstract: new synthesis of cortico steroids from 17-keto steroids: application and stereochemical study of the unsaturated sulfoxide-sulfenate rearrangement.J Org Chem, 1979, 44(9): 1582–1584.DOI: 10.1021/jo01323a054 |
| [15] | Yang YL, Yang SK, Wu ZL. Development of 9α-hydroxy-androst-4-ene-3, 17-dione (9α-OH-AD) through cleaving sterol sidechain by fermentation of Mycobacteriumfortuitum.Chin J Appl Environ Biol, 2015, 21(2): 256–262.(in Chinese). 杨亚力, 杨顺楷, 吴中柳. 偶发分枝杆菌发酵断甾醇侧链积累9α-羟基雄烯二酮.应用与环境物学报, 2015, 21(2): 256-262. |
| [16] | Ceen EG, Herrmann JPR, Dunnill P. Solvent damage during immobilised cell catalysis and its avoidance: studies of 11α-hydroxylation of progesterone by Aspergillusochraceus.Appl Microbiol Biotechnol, 1987, 9(6): 365–368. |
| [17] | Phase N, Patil S. Natural oils are better than organic solvents for the conversion of the conversion of soybean sterols to 17-ketosteroids by Mycobacteriumfortuitum.World J Microbiol Biotechnol, 1994, 10(2): 228–229.DOI: 10.1007/BF00360894 |
