
 , 张译元1, 王立民1, 唐红1, 李迎利2, 周平1
, 张译元1, 王立民1, 唐红1, 李迎利2, 周平1

1 省部共建绵羊遗传改良与健康养殖国家重点实验室 新疆农垦科学院畜牧兽医研究所,新疆 石河子 832000;
2 石河子市兽医卫生检疫所,新疆 石河子 832000
收稿日期:2016-08-18;接收日期:2017-03-17; 网络出版时间:2017-04-12 基金项目:国家转基因生物新品种培育重大专项(No. 2016zx08008-001),国家自然科学基金(No. 31271597),绵羊繁育重点实验室开放课题(No. 2013KLS05),新疆生产建设兵团院士基金专项(No. 2014BB023) 资助
摘要: 目前绵羊体细胞克隆效率仍然很低,本研究拟对去核前的操作环节进行优化。主要为卵巢保存时间(3 h和3–5 h)、卵母细胞体外成熟时间(18 h和24 h)、供核细胞贴壁率(10%和30%)和盲吸法去核时间(16 hpm和18 hpm)等4个方面优化。以成熟率、融合率和重构胚胎发育能力作为评价参数。结果表明:在卵巢保存方面,卵巢保存3 h组卵母细胞成熟率显著高于3–5 h组卵母细胞成熟率(60.18% vs 52.50%) (P < 0.05),重构胚胎发育力差异不显著(P > 0.05);在体外成熟时间方面,体外成熟18 h组和24 h组卵母细胞成熟率差异极显著(53.81% vs 89.06%) (P < 0.01),胚胎发育力差异不显著(P > 0.05);在融合率方面,贴壁率30%组极显著高于贴壁率10%组(80.85% vs 57.69%) (P < 0.01),在克隆胚胎发育率方面没有显著差异(P > 0.05),具有贴比率差异性的细胞在细胞生长平台期表现出差异性;在去核时间方面,16 hpm组和18 hpm组胚胎卵裂率差异显著,囊胚发育力差异不显著(P > 0.05),16 hpm组获得一只克隆羊,重复16 hpm获得4只妊娠克隆羊。组织微卫星序列经SDS-PAGE分析,DNA指纹与供体细胞相同。结论:去核前程序的优化保证了材料的质量,为提高克隆胚胎数量和质量奠定基础,可以获得体细胞克隆羊。
关键词: 核移植 卵巢保存时间 贴壁率 去核时间 克隆羊
Program optimization before enucleation on ovine somatic cell nuclear transfer
Yanhua Guo1

 , Yiyuan Zhang1, Limin Wang1, Hong Tang1, Yingli Li2, Ping Zhou1
, Yiyuan Zhang1, Limin Wang1, Hong Tang1, Yingli Li2, Ping Zhou1

1 Institute of Animal Husbandry and Veterinary, Xinjiang Academy of Agricultural and Reclamation Sciences, State Key Laboratory of Sheep Genetic Improvement and Healthy Production, Shihezi 832000, Xinjiang, China;
2 Animal and Medical Quarantine Station of Shihezi, Shihezi 832000, Xinjiang, China
Received: August 18, 2016; Accepted: March 17, 2017; Published: April 12, 2017
Supported by: National Major Special Projects on New Cultivation for Transgenic Organisms (No. 2016zx08008-001), National Natural Science Foundation of China (No. 31271597), Opening Foundation of Sheep Genetic Improvement and Healthy Production Laboratory (No. 2013KLS05), Foundation of Academician in Production and Construction of Xinjiang (No. 2014BB023)
Corresponding author:Yanhua Guo. Tel: +86-993-6683627; E-mail: guoyanhuatlr@sohu.com
Ping Zhou. Tel: +86-993-6683759; E-mail: zhpxqf@163.com
Abstract: Ovine somatic cell nuclear transfer (SCNT) efficiency remains lower. Therefore, we optimized the program before oocyte enucleation on ovine SCNT. Four experiments were done including exposure duration of ovaries (3 h or 3 to 5 h), duration of oocytes maturation (18 h and 24 h), rate of donor adherent and enucleation time of maturate oocyte. The maturation rates of oocyte, fusion rates and cleavation rates of cloned embryos were used to assess the efficiency of different procedures. The maturation rates of ovaries with 3 h exposure was higher than that of 3 to 5 h (60.18% vs 52.50%) (P < 0.05). Embryonic development competence had no significant difference (P > 0.05). The maturation rates were significantly different between group18 h and 24 h (53.81% vs 89.06%, P < 0.01). Embryonic development competence had no significant difference (P > 0.05); fusion rates of donor adherent 30% group was higher than that of 10% group. Embryonic development competence had no significant difference (P > 0.05). Different adherent donor characterizes the difference in plateau phase. The cleavation rates of 18 hpm group was higher than that of 16 hpm group. Embryonic development competence had no significant difference (P > 0.05), the enucleation of 16 hpm group obtained one clone fetus, we got four clone fetus to repeat the 16 hpm group. Five microsatellite was analyzed by PAGE, the bands indicated that fingerprint of cloned fetus were completely the same as those of donor cells. Our data therefore suggests program optimization before enucleation assurance quality of material which be able to improve the quantity and quality of clone embryos, and optimized scheme can obtain clone sheep offspring.
Key words: nuclear transfer exposure duration of ovaries adherent rate enuclation time clone sheep offspring
绵羊体细胞克隆胚胎的成功重构是提高克隆效率的重要步骤,在重构前期,材料的选择、处理与优化直接决定了重构质量,对后期胚胎发育也会产生间接的影响,因此控制材料质量对提高克隆效率具有重要意义。自从首例克隆羊多莉诞生以来[1],已有16种克隆动物相继出世[2],然而克隆效率仍然较低。研究人员从重构胚胎的方法、去核与注核、融合、激活等方面进行了大量的探索,同时运用比较学在胚胎形态、遗传学、基因表达和表观遗传学方面[3]也进行了深入的研究,以提高克隆效率,但关于体细胞核移植去核时间各不相同,对供核细胞和受体卵母细胞质量快速控制方面并无较明确的观点。首先,在离体卵巢控制方面,早期的研究中多为关于卵巢的保存温度研究[4-5],仅关注保存温度而忽视保存时间是不够的,且关于卵巢保存时间的准确界定也较少。卵巢在牛羊屠宰后会随胴体降到室温,卵巢完成采集与运输后,卵丘卵母细胞复合体获取时间的长短即卵巢保存时间就成为影响卵母细胞体外成熟的主要因素。其次,卵母细胞的体外成熟时间长短对后续胚胎发育也有间接影响[4-5],但卵母细胞不同成熟时间制作的克隆胚胎发育潜力,除了在成熟18 hpm和更长时间具有比较之外[6-7],更早时间进行处理尚无数据予以支持,且获取的卵母细胞在卵泡内成熟度具有差异[8],因此体外成熟时间存在差异性,需要对制作克隆胚胎的卵母细胞成熟时间进行细致划分。再次,成熟卵母细胞去核时间和方法的选择也极为重要,目前多数文献关于去核时间多为18 h或者无准确的时间控制,因为去核时间的选择不仅与去核方法有联系[9-12],而且对后期胚胎发育也有间接的影响[13]。最后,供体细胞的生理状态直接决定重构胚的融合效率[14],即供核细胞的细胞膜特性,是影响重构胚基础数量的重要因素。因此本研究以核移植去核前程序的优化为切入点,提供一种快速控制方法从源头上以提高克隆胚胎重构数量和质量,提高克隆效率。
1 材料与方法1.1 试剂与仪器试剂除特别说明外,均为日本和光药业株式会社药品。M199 (GIBCO),DMEM (GIBCO),FCS (Hyclone),胰酶(Gbico),四孔板(NUNC),60 mm培养皿(NUNC),显微操作针,石蜡油(Sigma M8410),体式显微镜(Nikon SMZ800),拉针仪(NARISHIGE PN-30),磨针仪(NARISHIGE EG-400),煅烧仪(NARISHIGE MF-900),显微操作仪(Eppendorf Transferman NK2),CO2培养箱(New Branswick Galaxy 170S),融合仪(Voltain EP-1 Australia),0.5 mm融合槽(BTX)。
1.2 卵母细胞的采集从新疆石河子市活畜屠宰场收集绵羊卵巢,投入生理盐水中,用0.4 L保温壶收集卵巢后运回实验室。室温平衡30 min后,清洗1次后剪去输卵管连接部及多余的结缔组织,用生理盐水再清洗3–4次,供采卵用。刺剖法采集[8]:简述如下,卵巢沥干放入加好采卵液(M199+ 0.1% BSA+0.1 mg/mL肝素+0.1 mg/mL庆大霉素)的100 mm培养皿中,左手持尖头眼科镊子将卵巢固定在采卵液中,右手持手术刀片将突出卵巢皮质、明亮的卵泡刺破并多剖数刀使其进入采卵液中,采完的卵巢在采卵液中轻轻晃动防止黏附。沉淀数分钟后弃去上清液,用手拉巴氏管在体式显微镜下选取形态正常、胞质均匀的卵丘卵母细胞复合体(Cumulus-oocyte complexs,COCs)进行成熟。卵巢保存时间以运回实验室记时开始,至卵丘卵母细胞复合体采集结束。将保存时间划分为≤3 h和3–5 h组。牛羊屠宰车间屠宰活畜,卵巢温度通常会随胴体体温缓慢下降,采集卵巢离体到结束通常需要一段时间,我们设定为2 h,温度变化为28–33 ℃ (资料记录)。
1.3 卵母细胞的成熟与处理将采集到的COCs用采卵液清洗2–3遍,然后用成熟液清洗1–2遍,放入预平衡2 h的四孔板成熟液中(M199+15% FBS+0.1 IU/mL FSH+ 0.2 IU/mL LH+1.0 μg/mL雌二醇),培养密度80枚/mL,培养条件为38.5 ℃、5% CO2、饱和湿度。体外成熟18 h后,将扩散的颗粒细胞用移液器吹打除去,0.1%透明质酸酶消化1 min后继续吹打以除尽颗粒细胞,用成熟液清洗2–3次,移入预先平衡于60 mm平皿的成熟培养滴中,在体式显微镜下挑出排有第一极体的成熟卵母细胞以备用。
1.4 供体细胞的处理用刀片剔除3岁龄萨福克公羊耳部边缘的绒毛,75%酒精棉球擦洗耳组织2–3次,消毒30 s后,用取样钳夹取耳组织投入生理盐水(含双抗)中带回实验室,移入超净台用眼科剪和镊子剔除软骨组织,生理盐水清洗4–5次,再投入75%酒精中浸15–20 s,移入30 mm平皿中剪碎耳部皮肤组织,组织块法培养,培养液为DMEM加15% FCS。原代培养3–5 d后观察组织块贴壁和成纤维细胞迁出情况,每隔2 d换液1次。待原代成纤维细胞生长至80%–90%连成片后,用胰酶消化3 min,用含15% FBS的DMEM培养液(含EGF 10 ng/mL,IGF 10 ng/mL)进行传代培养,每2 d换液1次,传3–5代之后冻存。供体细胞使用前3 d解冻到24孔板培养,使用前PBS清洗1–2次,胰酶消化,2 500 r/mim离心收集至1.5 mL EP管,100 μL培养液重悬浮供体细胞以备用。
1.5 供体细胞贴壁率计算在核移植前,将收集的供体细胞吸取微量置于操作液中停留15 min,观察供体细胞的贴壁情况,细胞变扁平或有伪足贴在培养皿底部为贴壁细胞,将未贴壁的细胞移入另一培养皿,两组细胞用10 μg\mL hoechst33342染色分别在显微镜下计数。贴壁率=贴壁细胞/(未贴壁细胞+贴壁细胞)×100%,以细胞贴壁率作为提高重构胚胎融合效果的早期判断标准。
1.6 细胞生长曲线消化培养的细胞制成细胞悬液,计数后用培养液稀释,将浓度调整至大约4×104个/mL,接种培养于24孔板,每孔0.5 mL,之后每12 h消化收取4孔的细胞用于计数,求取平均数,绘制生长曲线。贴比率高的记为A细胞,贴比率低的记为B细胞。
1.7 卵母细胞与供核细胞的重构用60 mm培养皿制作操作液(M199+25 mmol/L Hepes+20% FBS)并覆盖石蜡油,移入显微操作台将注射针与固定针移入操作视野内。将受体卵母细胞用含7.5 μg/mL CB的成熟液培养10 min,用巴氏管将供体细胞和卵母细胞移入操作液中进行盲吸去核,固定针吸住卵母细胞,第一极体指向12点方向,去核针刺入剜除极体及周围少量细胞质,吐出卵母细胞质,吸取供体细胞放入11点方向。
1.8 融合、激活与培养将重构的卵母细胞-供核细胞复合体放入成熟液中恢复30 min后,移入融合液中平衡2 min,然后把卵子放入覆盖融合液(0.3 mol/L甘露醇+0.5 mmol/L Hepes+0.1 mmol/L CaCl2+0.1 mmol/L MgCl2)的融合槽电极之间,调整细胞膜的接触面与电极平行,施加直流电脉冲,融合参数根据试验调整脉冲场强120 V,脉冲次数2次,脉冲时程20 μs。每批5–8枚/次,操作完后卵子/供核细胞复合体放入培养液,30–60 min后观察融合情况,剔除没有融合的复合体。放回培养箱内继续培养,从重构胚融合完计时2 h后进行激活,激活液与激活时间分别为7%乙醇7 min、2 μmol/L 6-DMAP 4 h,激活完毕后移入SOFaa清洗3遍。38.5 ℃、5% CO2、饱和湿度培养,培养2 d和7 d后检查卵裂率和囊胚率并统计。
1.9 孤雌胚胎的制作将成熟的卵母细胞用7%乙醇7 min、2 μmol/L 6-DMAP 4 h进行激活,完毕后移入SOFaa清洗3遍。38.5 ℃、5% CO2、饱和湿度培养,培养2 d和7 d后统计卵裂率和囊胚率。
1.10 胚胎移植激活完毕后记时,将发育36 h以后的克隆胚胎,以手术法移植到同期发情的受体绵羊有黄体一侧的子宫角前1/3处,移植后注意观察受体母羊身体状况,妊娠45–60 d B超检查妊娠,对发生妊娠的受体母羊进行分群护理。
1.11 微卫星鉴定收集体细胞克隆羊过期妊娠胎儿、受体羊组织,将克隆羊胎儿组织分解分管冷冻,收集齐材料后备用,加700 μL组织裂解液(10 mmol/L Tris-HCl,0.1 mol/L EDTA,20 μg/mL蛋白酶K,0.5% SDS),50 ℃消化过夜后,酚仿抽提。收集适量的供核细胞系,PBS漂洗2次后加入700 μL组织裂解液,酚仿抽提,提取基因组1%琼脂糖凝胶电泳检测。根据前人[15-16]研究结果,筛选出5个微卫星位点,引物名称与序列见表 1,引物由Invitrogen公司合成。PCR扩增产物经PAGE后,利用Quantity One软件根据DNA Marker分析片段大小并进行基因分型,计算亲权指数和父子关系相对机会。
表 1 微卫星位点引物名称与序列Table 1 The names and sequence of microsatellite primers
| Primer name | Locus | Primer sequence (5′–3′) | Temperature (℃) |
| BM1818 | 14 | ATT TGC ACA AGC TAA ATC TAA CC AAA CCA CAG AAA TGC TTG GAAG | 56 |
| BM203 | 26 | GGG TGT GAC ATT TTG TTC CC CTG CTC GCC ACT AGT CCT TC | 59 |
| OarCP0049 | 17 | GAG ACA CGG CTT AGC AAC TAA ACG C GTG GGG ATG AAT ATT CCT TCA TAA GG | 63 |
| McM0527 | 5 | GTC CAT TGC CTC AAA TCA ATT C AAA CCA CTT GAC TAC TCC CCA A | 55 |
| NRA0005 | 10 | TTC AGG CAT ACC CTA CAC CAC ATG AAA TAT TAG CCA ACT GAA AAC TGG G | 60 |
表选项
1.12 统计分析试验数据用spass18.0进行卡方(X2)检验,P < 0.01为差异极显著;0.01 < P < 0.05为差异显著;P > 0.05为差异不显著。
2 结果与分析2.1 卵巢体外保存时间对重构胚体外发育的影响结果如表 2所示,卵巢保存时间3–5 h会降低卵母细胞成熟率,差异显著(60.52% vs 52.50%) (P < 0.05),而融合率(58.76% vs 55.78%)、卵裂率(94.73% vs 91.51%)和囊胚率(6.79% vs 7.21%)差异不显著(P > 0.05)。结果表明在卵巢保存时间方面,3–5 h成熟组比≤3 h组的卵母细胞成熟率低,而重构胚融合、发育方面差异不显著。
表 2 卵巢保存时间对重构胚体外发育的影响Table 2 Effect of exposure duration of ovaries at ambient temperature on development of reconstructed embryos in vitro
| Exposure duration | No. oocytes | Mature rate | Couplets | Fusion rate | Cleavage rate | Blastocyst rate |
| ≤3 | 540 | 60.18%a (325) | 291 | 58.76% (171) | 94.73% (162) | 6.79% (11) |
| 3–5 | 400 | 52.50%b (210) | 190 | 55.78% (106) | 91.51% (97) | 7.21% (7) |
| Note: Values in the same column with different lowercase superscripts differ significantly (P < 0.05). | ||||||
表选项
2.2 卵母细胞体外成熟时间对卵母细胞成熟、胚胎发育的影响选择18 h和24 h作为卵母细胞的成熟时间,以此作为体细胞核移植的去核时间,比较卵母细胞成熟质量和后期胚胎发育力的材料质量关系。结果如表 3所示,18 h与24 h卵母细胞成熟率差异极显著(53.81 vs 89.06) (P < 0.01),激活率(86.28 vs 82.11)、卵裂率(85.12 vs 88.89) 和囊胚率(15.06 vs 15.86) 差异不显著(P > 0.05)。
表 3 成熟时间对孤雌胚胎体外发育的影响Table 3 Effect of mature duration on parthenogenetic development in vitro
| Mature duration | No. oocytes | Mature rate | Action rate | Cleavage rate | Blastocyst rate |
| 18 h | 420 | 53.81%A (226) | 86.28% (195) | 85.12% (166) | 15.06% (25) |
| 24 h | 320 | 89.06%B (285) | 82.11% (234) | 88.89% (208) | 15.86% (33) |
| Note: values in the same column with different capital superscripts differ significantly (P < 0.01). | |||||
表选项
2.3 不同贴壁效率供体细胞对重构胚体外发育的影响结果如表 4,供体细胞贴壁率10%组与30%组的融合率差异(57.69% vs 80.85%)极显著(P < 0.01),而卵裂率(89.16% vs 92.11%)和囊胚率(6.54% vs 5.71%)差异不显著(P > 0.05)。以上结果表明,细胞贴壁率在30%以上的供体细胞可以极显著提高重构卵的融合率。
表 4 供体细胞贴壁率对重构胚体外发育的影响Table 4 Effect of adherent cells on development of reconstructed embryos in vitro
| Adherent cells | Couplets | Fusion rate | Cleavage rate | Blastocyst rate |
| 10 | 208 | 57.69%A (120) | 89.16% (107) | 6.54% (7) |
| 30 | 141 | 80.85%B (114) | 92.11% (105) | 5.71% (6) |
| Note: values in the same column with different capital superscripts differ significantly (P < 0.01). | ||||
表选项
2.4 成纤维细胞的生长曲线细胞生长曲线呈“S”型,即潜伏期、指数期和平台期3个过程,分别为0–24 h、24–48 h和48–72 h,结果见图 1。刚接种的供体细胞生长缓慢,接种24 h后细胞开始进入指数生长期,倍增时间约在36 h以后,48 h后A细胞进入平台期,表现为缓慢的上升型,而B细胞进入平台期后表现为缓慢的下降型,两株细胞的平台期表现出差异性。
 |
| 图 1 绵羊成纤维细胞生长曲线 Figure 1 The growth curve of sheep skin fibroblast. |
| 图选项 |
2.5 不同去核时间对绵羊卵母细胞去核率的影响如表 5所示,去核时间起点选至体外成熟时间的16 h和18 h进行,16 hpm组的去核率与18 hpm组的去核率差异不显著(P > 0.05),但有高于18 hpm组的趋势。
表 5 去核时间对绵羊卵母细胞去核率的影响Table 5 Enucleation time on enucleated rate of ovine oocytes
| Postonset of maturation | No experiments | No oocyte treated | No.oocytes enucleated | Enucleated rate |
| 18 hpm | 4 | 122 | 110 | 90.16% (110/122)a |
| 16 hpm | 4 | 114 | 110 | 96.49% (111/114)a |
表选项
2.6 去核时间对重构胚发育的影响因各文献报道中,牛、羊卵母细胞的去核时间各不相同,因此将去核时间起点(Hour postonset of maturation,hpm)选至体外成熟18 hpm和16 hpm进行,时程均为4 h,比较不同去核时间对重构胚的融合率、卵裂率、囊胚率和移植妊娠的影响。结果如表 6所示,去核时间18 hpm组和16 hpm组在重构胚融合率(80.01% vs 77.96) 方面差异不显著(P > 0.05),卵裂率(97.51% vs 84.78%)影响差异极显著(P < 0.01),在早期发育阶段,囊胚率差异不显著(12.31% vs 10.25%),但18 hpm组高于16 hpm组;在移植受体后妊娠方面,18 hpm组和16 hpm有差异(0 vs 0.05%),再次重复16 h去核组,与18 h去核组相比,4只受体羊获得妊娠,对妊娠有影响(0.00% vs 25.00%)。
表 6 核移植时程对重构胚体外发育的影响Table 6 Enucleation time on development of reconstructed embryos in vitro
| Postonset of maturation | Couplets | Fusion rate | Cleavage rate | Blastocyst rate | Surrogacys | Pregnancy rate |
| 18 hpm | 156 | 83.33% (130) | 95.28%A (124) | 12.31% (16) | ||
| 18 hpm | 201 | 80.01% (161) | 97.51%A (157) | 17 | 0 | |
| 16 hpm | 162 | 72.22% (117) | 82.90%B (97) | 10.25% (12) | ||
| 16 hpm | 236 | 77.96% (184) | 84.78%B (156) | 19 | 0.05% (1)A | |
| 16 hpm | 258 | 74.03% (191) | 84.82% (162) | 16 | 25.00% (4)B | |
| Note: values in the same column with different capital superscripts differ significantly (P < 0.01). | ||||||
表选项
2.7 移植后胎儿出生情况重构胚体外培养36–48 h后,将卵裂的571枚重构胚经手术法移入同期发情的代孕母羊输卵管中。共移植代孕母羊52只,移植后60 d B超检查妊娠情况,对于发生妊娠的代孕母羊转群加强护理。至出生时,由于克隆羊胎儿超过预产期(150 d) 9 d,出生后表现出体表黄染、羊水量少、胎儿腹部腹围增大,出生后呼吸微弱,30 min停止呼吸死亡。解剖后发现胎儿胃内有大量羊水,其余组织正常。重复16 hpm组4只妊娠克隆胎儿在101、120、135、140 d相继流产。
2.8 过期妊娠胎儿的分子生物学检测如图 2所示,5个微卫星BM1818、BM203、OarCP0049、NRA0005、McM0527标记,在各样本上有特异性PCR产物,克隆羊与供体细胞基因型一致,而与代孕母羊和对照组的基因型差异较大。由此判定克隆羊来自供体细胞。
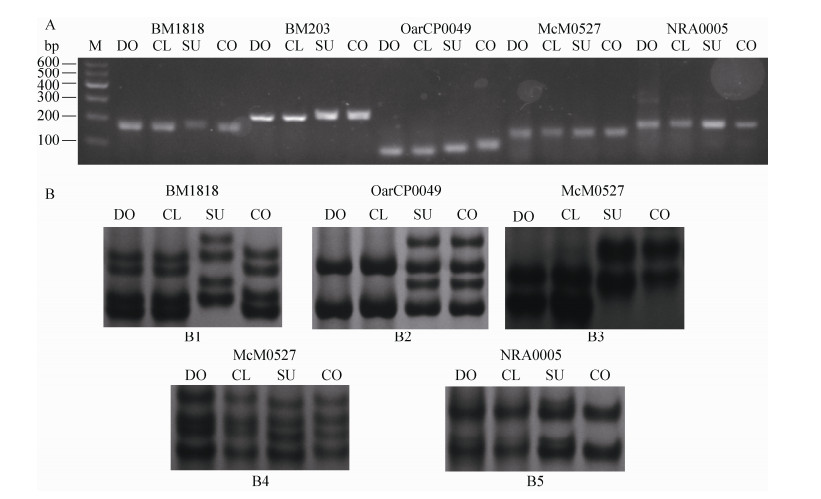 |
| 图 2 DNA水平上的鉴定(A:电泳检测;B:微卫星位点电泳. B1:样品BM1818位点电泳图;B2:样品BM203位点电泳图;B3:样品OarCP0049位点电泳图;B4:样品McM0527位点电泳图;B5:样品NRA0005位点电泳图;M:DNA分子质量标准;DO:供体细胞;CL:克隆羊;SU:代孕母羊;CO:受体对照) Figure 2 PCR result of microsatellite on agarose (A) and PAGE (B). B1: BM1818 locus in samples; B2: BM203 locus in samples; B3: OarCP0049 locus in amples; B4: McM0527 locus in samples; B5: NRA0005 locus in sample; M: DNA ladder; DO: donor; CL: clone offspring; SU: surrogate; CO: control. |
| 图选项 |
3 讨论体细胞核移植技术重构过程主要为卵母细胞去核、注核、融合和激活等几个过程,而前期的处理主要指卵丘卵母细胞复合体的采集、卵母细胞体外成熟时间、供核细胞处理和核移植卵母细胞的去核准备。卵丘卵母细胞复合体采集前,卵巢的正确处理能提高体细胞核移植的材料质量,卵巢的处理主要分为保存温度和离体时间。牛羊等活畜宰杀后,卵巢会随胴体一同降温。如果卵巢保存温度过高会直接形成高温外环境,Krishna等[4]将卵母细胞用不同温度热处理后发现这会严重影响卵母细胞的成熟效果,而后的胚胎发育基因表达也发生紊乱。
Nakao等[17]研究认为室温(20 ℃,3 h+5 h)处理下可以获得理想的囊胚发育效果,采卵后39 ℃保存5 h进行成熟,胚胎发育更为理想,但最好的发育效果却是获得卵巢后立即进行体外成熟,成熟、发育效果也优于以上组别。Kim等[5]将采卵温度(即保存温度30–33 ℃,4 h)过渡到室温(25 ℃,6 h)后处理发现,虽然卵母细胞形态方面表现正常,与立即采卵成熟组囊胚率发育方面差异不显著,但过长的保存时间后,卵巢表现较高的自溶而影响卵母细胞的成熟。在卵巢保存时间方面,研究结果显示,卵巢保存时间由≤3 h增加到3–5 h会显著降低卵母细胞成熟率,这与Kim等的研究结果相同[5]。因此在卵巢温度控制方面,我们认为体温和低温不是理想的运输温度,建议采用卵巢混合后的温度,而卵巢保存时间控制方面我们认为卵巢收集、保存至采集卵丘卵母细胞进行成熟的总体时间不宜超过5 h,尽量做到运回实验室立即采卵收集用于体外成熟。
在体细胞核移植中,盲吸法是以能观察到第一极体进行去核的,而文献报道中关于盲吸法进行卵母细胞去核的时间各不相同(15–20 hpm),若成熟至24 h后再构建克隆胚,操作过程相对延长了成熟时间,这不仅会引起卵母细胞的老化,同时也会引发部分卵母细胞的主动孤雌激活而不利于克隆胚胎的重构。在早期的研究中[7],我们发现有腔卵泡中直径较大的卵泡卵母细胞的成熟时间较早,24 h成熟比率也较高,而小腔卵泡卵母细胞的成熟过程较长、较晚。在体细胞核移植中,所有卵母细胞的成熟过程并不是一个同步进行的过程,因此在成熟率方面会随着时间的推移而有上升的趋势。我们将24 h组的卵母细胞在成熟18 h时除去颗粒细胞,之后继续成熟至24 h,与18 h组比较成熟率和胚胎发育率,结果表明两组成熟率差异显著。我们观察发现18 h组由于成熟时间的选择,在形态和成熟质量上都获得了较好的卵母细胞。而24 h组卵母细胞在体外成熟18 h后,剩余未成熟的卵母细胞在成熟发生进程中,虽然存在有细胞形态规则和不规则的、胞质均匀和不均匀的,但是也能完成体外成熟而增加了成熟卵的数量。我们认为形态不规则、胞质不均匀的卵母细胞是由直径相对较小的卵泡和采集机械损伤产生的,因此成熟时间较长。在胚胎发育方面,两组囊胚率差异不显著,说明体外成熟18 h开始去核或者激活并不影响后期的发育。
在早期的研究中,研究人员认为供体细胞核的周期是决定重构胚染色体倍型的关键因素,研究发现不论血清饥饿还是接触抑制法均可以达到细胞周期G0同期化[18],以提高核移植成功率。然而,也有研究认为供体细胞G0期并不是核移植成功的关键因素,利用生长期旺盛的供体细胞同样能获得克隆动物[19],且效果并不比供体细胞饥饿得到的克隆动物低[20]。但不论是接触抑制、血清饥饿处理的供体细胞,还是生长旺盛的供体细胞,在重构胚电融合方面都是靠细胞膜的微孔相互融合而形成克隆胚的。多数研究报道认为重构胚的融合与融合液、融合电压有关,而有关供体细胞对融合方面的影响,除了细胞类型、传代次数[21]、细胞极端处理[22]之外,对供体细胞细胞膜生理状态差异引起的融合率差异研究较少。汇合100%的供体细胞虽然会由于长时间的接触抑制降低胚胎发育潜力、增加胚胎细胞的凋亡[23],但潘晓燕等[24]研究发现供体细胞70%–80%汇合时比汇合100%的供体细胞组在融合方面稍有优势。在早期的研究中我们认为细胞膜的融合是关键所在,王二耀等[25]研究含有完整膜的卵丘细胞注入受体卵后的重构胚卵裂不能进一步发育,而去掉膜的供体细胞注入卵母细胞后,重构胚卵裂可以进一步发育,反之可以推测,完整的膜尤其是具有较高光泽性的细胞膜对胚胎融合具有重要的影响。在我们早期的研究中,通过对供体细胞进行差速消化选择后,发现重构胚融合率有所提高,为了进一步提高融合率,提高材料利用率,达到快速预知供体细胞的融合效果,我们通过实验比较观察了差速消化选择的细胞在传代2次后,对重构胚的融合效果和胚胎发育潜力的影响。结果显示贴壁率30%组与10%的融合率差异极显著(P < 0.01),而卵裂率和囊胚率差异不显著(P > 0.05)。因此我们认为一般生长特性较好的供体细胞在传代时贴壁较快,在做体细胞核移植融合前通过在操作液中移入供体细胞,停留15 min后观察贴壁率,可以快速判定供体细胞是否可以用于融合,以避免较低的融合率造成克隆胚胎数量少的情况,做到对供体细胞的融合效果的提前预知。通过对2株不同贴比率细胞的生长曲线研究发现,2株细胞在细胞潜伏期和生长期生长曲线接近一致,而在平台期贴比率高的A细胞仍在持续正向生长,而贴比率低的B细胞表现出缓慢的负增长,进一步观察发现B细胞在平台期出现较多的悬浮细胞,且细胞光泽性较差,我们认为这是细胞生长状态不良形成的细胞脱落,最终引起总体细胞数量的下降。因此在同等卵母细胞数量进行核移植时,贴壁率较高的供体细胞能获得更多数量的克隆胚胎,以降低工作量。以往在显微操作时供核细胞的挑选依据是细胞膜光泽性高,这在实际操作中主要依靠操作人员的经验而定,具有一定的局限性,通过该方法的提前预知能降低操作难度,提高效率。
卵母细胞在体外完成第一次减数分裂的成熟过程是一个动态过程,成熟过程主要分为GV (Germinal vesicle)、GVBD (Germinal vesicle break dowm)、MI (Metaphase of MⅠ)、AⅠ (Anaphase of MⅠ)、TⅠ (Telophase of MⅠ)、MⅡ (Metaphase of MⅡ)等核期。微管蛋白tubulin聚合拉伸形成纺锤体将减数分裂的染色体分开始于MⅠ期,终于MⅡ期,含有对半染色体的极体分离发生在AⅠ期,TⅠ期纺锤体牵拉的染色体距离进一步拉伸,MⅡ期纺锤体牵拉的染色体分离开形成含有大量胞质的次级卵母细胞和第一极体[26],因此在早期去核方面,纺锤体成像仪作为去核工具更具有优势[11],而hoechst33342染色在胞质边缘去核主要用于AⅠ/TⅠ期,随着成熟时间的推移,胞质染色体和极体染色体将会分离开进行到MⅡ期,这就增加了极体与染色体之间的位移,为hoechst33342染色去核增加了困难,增加了去核细胞质量,尤其是影响到盲吸法去核率,同时会影响MⅡ期MPF和MAPK峰值,也影响供核细胞核膜破裂(Nuclear envelope breakdown,NEBD)和供体核染色体浓缩(Premature chromosome condensation,PCC)重编程的能力。相反,成熟晚期MⅡ去核用脱羰秋水酰胺(Demecolcine)能100%成功去核[12, 27],但该方法除了成功应用在小鼠,尚未见到大型克隆动物的出生报道。Joon-Hee Lee等[28]通过比较AⅠ-TⅠ和MⅡ期两个阶段的去核,测量去核胞质量,在AⅠ-TⅠ期去核位移距离是(15.8±2.4)μm,而MⅡ期去核(35.2±3.1) μm,位移距离差异显著,去核胞质量差异显著,同时研究表明这种早期去核促进了MPF和MAPK活性的保留以促进供体核重编程。在早期的研究中我们积累了卵母细胞直径的测量数据,与Lee等的测量结果基本一致[9]。通过提前核移植去核时间,我们发现16 hpm组和18 hpm组在卵裂方面有差异,但卵裂率的显著差异无法充分说明问题,因此增加囊胚发育率,结果表明16 hpm组和18 hpm组在囊胚发育结果方面无显著差异。通过动物试验发现,16 hpm组获得一只克隆羊,而18 hpm组未获得克隆羊,该结果说明盲吸法16 hpm组在去核成功率方面比18 hpm具有优势,仅1例成功具有偶然性,因此重复盲吸法16 hpm去核组,结果4只受体母羊发生妊娠。反究18 hpm和16 hpm组囊胚率的差异性,我们推断,18 hpm囊胚率稍高的原因是去核成功率低,部分未去核干净的克隆胚仍能发育到囊胚,即形成多倍体胚胎,而16 hpm组的去核率却高于18 hpm组,去核更干净。hoechst33342染色去核相比盲吸法去核虽然具有准确性,但染色UV观察去核也会造成DNA双链的断裂,尤其是线粒体DNA而影响后期胚胎发育潜力[13],因而多采用盲吸法去核,之后染色观察剔除未去核干净的卵母细胞。因此绵羊的卵母细胞盲吸法去核时间提前到16 hpm或者是选择卵母细胞的AⅠ-TⅠ期核型更容易获得克隆羊。而hoechst33342染色去核则对AⅠ-TⅠ或MⅡ去核均有效,但成熟时间过长会增加总体卵母细胞MⅡ期的比率[29],在去核方面会增加去核胞质量,降低了重构胚的质量和发育潜力。
本研究选用新疆军垦型美利奴细毛羊作为克隆胚胎移植受体,结果只有16 hpm组得到1只克隆羊。重复16 hpm组又获得4只克隆羊。对获得1只克隆羊组克隆羊观察发现受体羊表现过期妊娠,超出预产期(150 d) 9 d,胎儿出生时出现产力难产、骨盆开张不全,经过人工助产分娩后,出生胎儿仅表现出有限的呼吸,之后因为口腔内存有大量的羊水而呼吸困难死亡。观察发现腹围增加,倒悬从口内流出羊水,经解剖后发现胃内吸入大量的羊水,其余组织均正常。而重复16 hpm组获得的4只克隆羊,在妊娠晚期相继发生流产,组织均正常,样本需要进一步分析。在我们的肉羊胚胎移植出生日统计资料中显示(内部资料),肉羊出生日程为145–155 d,高峰期表现在151 d,而黑头萨福克克隆羊在出生日方面表现出超过预产期9 d,胎盘内羊水量少、胎儿腹围增大,胃内有大量羊水等迹象,这些症状表明克隆羊为过期妊娠胎儿。在动物妊娠方面,妊娠足月的克隆牛[30]有些也表现出妊娠延期、推迟分娩的现象。在人类临床中为了规避早产或过期妊娠情况的发生,通常会对孕妇的孕周、羊水量、胎盘成熟度进行检查,以适时终止妊娠,即给予外源性糖皮质激素,这不仅可以促进胎儿肺成熟,而且可以提高胎儿生存几率和质量,这已经被广泛证实和接受,但在克隆家畜上沿用该做法的情况除了少数报道之外[31-32],并没有引起广泛的重视,同时对于过期妊娠克隆动物直接进行剖腹产会由于胎儿肺脏和肾脏的不成熟无法适应外界环境而增加产后出生的死亡风险,因此对出生日期应当适时干预,以提高动物生存质量[33]。
利用微卫星分析法对克隆动物个体的遗传物质进行鉴定来源于“Dolly”羊的出生[34],这种检测作为鉴别克隆动物的做法已经成为惯例。事实上新生克隆动物(Offspring)并非真正意义上的“克隆”,它只是供体细胞基因组的拷贝复制,因为它的线粒体mtDNA可能完全来源于受体卵[28],也可能是受体卵和供体细胞线粒体的异质复合体[35]。因此鉴定时多用微卫星序列与供体细胞的遗传信息进行同型分析,以此作为检测的主要手段,其次是对线粒体mtDNA进行检测。我们的研究结果说明5个微卫星与供体细胞基因型一致,而与代孕母羊基因型差异较大,结果表明萨福克克隆羊完全来自于供体细胞。
4 结论通过上述步骤的优化能提高克隆胚胎的重构数量和发育质量。即离体卵巢从运输到收集卵母细胞进行体外成熟的离体时间越短越好,以供体细胞贴壁率作为提高融合效果的早期判断具有实际指导意义,盲吸法去核时间提前到16 hpm,可以获得体细胞克隆羊。
参考文献
| [1] | Wilmut I, Schniek AE, McWhir J, et al. Viable offspring derived from fetal and adult mammalian cells.Nature, 1997, 385(6619): 810–813.DOI: 10.1038/385810a0 |
| [2] | Kues WA, Niemann H. Advances in farm animal transgenesis.Prev Vet Med, 2011, 102(2): 146–156.DOI: 10.1016/j.prevetmed.2011.04.009 |
| [3] | Mason K, Liu ZC, Aguirre-Lavin T, et al. Chromatin and epigenetic modifications during early mammalian development.Anim Reprod Sci, 2012, 134(1/2): 45–55. |
| [4] | Pavani KC, Baron E, Correia P, et al. Gene expression, oocyte nuclear maturation and developmental competence of bovine oocytes and embryos produced after in vivo and in vitro heat shock.Zygote, 2016, 24(5): 748–759.DOI: 10.1017/S0967199416000071 |
| [5] | Kim HJ, Choi SH, Son DS, et al. Effect of exposure duration of ovaries and oocytes at ambient temperature on parthenogenetic development of porcine follicular oocytes.J Reprod Dev, 2006, 52(5): 633–638.DOI: 10.1262/jrd.17103 |
| [6] | Dong YJ, Bai XJ, Varisanga MD, et al. Investigation of cloning cattle through somatic cells nuclear transfer under the system of negative air pressure.Sci Agric Sin, 2002, 35(8): 988–994.(in Chinese). 董雅娟, 柏学进, VarisangaMD, 等. 应用负压气相培养系统生产体细胞克隆牛的研究.中国农业科学, 2002, 35(8): 988-994. |
| [7] | Li YQ, Zhang X, An ZX, et al. Bovine oocytes enucleation and artificial activation.J Northwest Sci Tech Univ Agric For: Nat Sci Ed, 2004, 32(11): 6–10.(in Chinese). 李裕强, 张琇, 安志兴, 等. 牛卵母细胞的去核与激活.西北农林科技大学学报:自然科学版, 2004, 32(11): 6-10. |
| [8] | Guo YH, Zhou P, Shi GQ, et al. The characteristics of ovine oocytes from different diameter follicles and chromatin configuration analysis.Xinjiang Agric Sci, 2012, 49(7): 1307–1314.(in Chinese). 郭延华, 周平, 石国庆, 等. 绵羊不同直径卵泡卵母细胞特征及染色体形态分析.新疆农业科学, 2012, 49(7): 1307-1314.DOI:10.6048/j.issn.1001-4330.2012.07.022 |
| [9] | Lee JH, Campbel KHS. Effects of enucleation and caffeine on maturation-promoting factor (MPF) and mitogen-activated protein kinase (MAPK) activities in ovine oocytes used as recipient cytoplasts for nuclear transfer1.Biol Reprod, 2006, 74(4): 691–698.DOI: 10.1095/biolreprod.105.043885 |
| [10] | Choi I, Campbell KHS. Treatment of ovine oocytes with caffeine increases the accessibility of DNase Ⅰ to the donor chromatin and reduces apoptosis in somatic cell nuclear transfer embryos.Reprod Fertil Dev, 2010, 22(6): 1000–1014.DOI: 10.1071/RD09144 |
| [11] | Lei AM, Ma XL, Gao ZM, et al. Program optimization for bovine somatic cells nuclear transfer.Chin J Biotech, 2009, 25(9): 1424–1432.(in Chinese). 雷安民, 马晓玲, 高志敏, 等. 牛体细胞核移植显微操作环节的优化.生物工程学报, 2009, 25(9): 1424-1432. |
| [12] | Tani T, Shimada H, Kato Y, et al. Demecolcine-assisted enucleation for bovine cloning.Clon Stem Cells, 2006, 8(1): 61–66.DOI: 10.1089/clo.2006.8.61 |
| [13] | Lee JH, Peters A, Fisher P, et al. Generation of mtDNA homoplasmic cloned lambs.Cell Reprogram, 2010, 12(3): 347–355.DOI: 10.1089/cell.2009.0096 |
| [14] | Guo YH, Wang LM, Tang H, et al. The effect of receptor, donor and pulsed strength on the fusion rate of somatic cell nuclear transfer in ovine.Xinjiang Agric Sci, 2014, 51(1): 136–142.(in Chinese). 郭延华, 王立民, 唐红, 等. 绵羊体细胞核移植融合效率影响因素的研究.新疆农业科学, 2014, 51(1): 136-142.DOI:10.6048/j.issn.1001-4330.2014.01.020 |
| [15] | Dai R, Zhou P, Shen SJ, et al. Parentage identification of sheep from gene transferred somatic cells.Anim Husb Vet Med, 2010, 42(11): 16–19.(in Chinese). 代蓉, 周平, 沈思军, 等. 转基因克隆绵羊的亲子鉴定.畜牧与兽医, 2010, 42(11): 16-19. |
| [16] | Tan XY, Jia WW, Gao ZM, et al. Effects of culturing time before electrical fusion and chemical activation on constructed sheep embryos.J Agric Biotechnol, 2009, 17(2): 269–275.(in Chinese). 谭晓颖, 贾文文, 高志敏, 等. 电融合化学激活前培养时间对绵羊重构胚发育的影响.农业生物技术学报, 2009, 17(2): 269-275. |
| [17] | Nakao H, Nakatsuji N. Effects of storage conditions of bovine ovaries and oocytes on the success rate of in vitro fertilization and culture.J Reprod Dev, 1992, 38(1): 11–13.DOI: 10.1262/jrd.38.11 |
| [18] | Hayes O, Ramos B, Rodríguez LL, et al. Cell confluency is as efficient as serum starvation for inducing arrest in the G0/G1 phase of the cell cycle in granulosa and fibroblast cells of cattle.Anim Reprod Sci, 2005, 87(3/4): 181–182. |
| [19] | Bosch P, Hodges CA, Stice SL. Generation of transgenic livestock by somatic cell nuclear transfer.Biotecnol Aplic, 2004, 21(3): 128–136. |
| [20] | Peura TT, Hartwich KM, Hamilton HM, et al. No differences in sheep somatic cell nuclear transfer outcomes using serum-starved or actively growing donor granulosa cells.Reprod Fertil Dev, 2003, 15(3): 157–165.DOI: 10.1071/RD02092 |
| [21] | Bhuiyan MMU, Cho J, Jang G, et al. Effect of transfection and passage number of ear fibroblasts on in vitro development of bovine transgenic nuclear transfer embryos.J Vet Med Sci, 2004, 66(3): 257–261.DOI: 10.1292/jvms.66.257 |
| [22] | Wakayama S, Ohta H, Hikichi T, et al. Production of healthy cloned mice from bodies frozen at -20℃ for 16 years.Proc Natl Acad Sci USA, 2008, 105(45): 17318–17322.DOI: 10.1073/pnas.0806166105 |
| [23] | Nagashima H, Fujimura T, Takahagi Y, et al. Development of efficient strategies for the production of genetically modified pigs.Theriogenology, 2003, 59(1): 95–106.DOI: 10.1016/S0093-691X(02)01261-X |
| [24] | Pan XY, Yang M, Zhang HY, et al. Effects of argali (Ovis ammon) donor cells on interspecies nuclear transfer.Sci Agric Sin, 2008, 41(9): 2798–2805.(in Chinese). 潘晓燕, 杨梅, 张寒莹, 等. 盘羊供体细胞对异种核移植效率的影响.中国农业科学, 2008, 41(9): 2798-2805. |
| [25] | Wang EY, Yu Y, Li XM, et al. Effect of intact donor cell membrane and cytoplasm of cumulus on development of mouse somatic clones in vitro.Hereditas, 2007, 29(2): 218–224.(in Chinese). 王二耀, 于洋, 李雪梅, 等. 完整的供体细胞膜及供体胞质对小鼠体细胞克隆胚发育的影响.遗传, 2007, 29(2): 218-224. |
| [26] | Cao X, Zhou P, Luo HL, et al. The effect of VEGF on the temporal-spatial change of α-tubulin and cortical granules of ovine oocytes matured in vitro.Anim Reprod Sci, 2009, 113(1/4): 236–250. |
| [27] | Pan XY, Wang ZC, Li ZX, et al. Effect of the chemically assisted enucleation on the enucleation of sheep oocytes and the development of their reconstructed embryos.Chin J Biotech, 2009, 25(4): 503–508.(in Chinese). 潘晓燕, 王正朝, 李质馨, 等. 化学辅助去核法对绵羊卵母细胞去核率和重构胚发育率的影响.生物工程学报, 2009, 25(4): 503-508. |
| [28] | Bohrer RC, Duggavathi R, Bordignon V. Inhibition of histone deacetylases enhances DNA damage repair in SCNT embryos.Cell Cycle, 2014, 13(3): 2138–2148. |
| [29] | Xue L, Cheng L, Zhang L, et al. Sheep cloning and analysis of the problems involved.J Inner Mongol Univ: Nat Sci Ed, 2011, 42(2): 196–203.(in Chinese). 雪莲, 程磊, 张立, 等. 克隆绵羊遇到的问题及其分析.内蒙古大学学报:自然科学版, 2011, 42(2): 196-203. |
| [30] | Hirayama H, Sawai K, Moriyasu S, et al. Excess estrogen sulfoconjugation as the possible cause for a poor sign of parturition in pregnant cows carrying somatic cell clone fetuses.Reproduction, 2008, 136(5): 639–647.DOI: 10.1530/REP-08-0157 |
| [31] | Wells DN, Forsyth J T, McMillan V, et al. Review: the health of somatic cell cloned cattle and their offspring.Clon Stem Cells, 2004, 6(2): 101–110.DOI: 10.1089/1536230041372300 |
| [32] | Ptak G, Clinton M, Tischner M, et al. Improving delivery and offspring viability of in vitro-produced and cloned sheep Embryos.Biol Reprod, 2002, 67(6): 1719–1725.DOI: 10.1095/biolreprod.102.006171 |
| [33] | Alexander B, Coppola G, Mastromonaco GF, et al. Early pregnancy diagnosis by serum progesterone and ultrasound in sheep carrying somatic cell nuclear transfer-derived pregnancies.Reprod Dom Anim, 2008, 43(2): 207–211.DOI: 10.1111/rda.2008.43.issue-2 |
| [34] | Ashworth D, Bishop M, Campbell K, et al. DNA microsatellite analysis of Dolly.Nature, 1998, 394(6691): 329. |
| [35] | Burgstaller JP, Schinogl P, Dinnyes A, et al. Mitochondrial DNA heteroplasmy in ovine fetuses and sheep cloned by somatic cell nuclear transfer.BMC Dev Biol, 2007, 7(1): 141.DOI: 10.1186/1471-213X-7-141 |
