
 , 单艳, 王子鸿, 蔡挺, 江雪
, 单艳, 王子鸿, 蔡挺, 江雪宁波市第二医院,浙江 宁波 315010
收稿日期:2016-08-30;接收日期:2017-01-18; 网络出版时间:2015-02-16 基金项目:宁波市自然科学基金 (No. 2016A610139),宁波科技创新团队项目 (No. 2011B82016) 资助
摘要: 构建人IL-34真核表达载体并将其转染到人骨髓间充质干细胞,观察高表达IL-34的骨髓间充质干细胞对THP-1细胞的影响。PCR扩增IL-34 DNA,并将其克隆到真核表达载体pIRES2-EGFP;将构建成功的重组体转染到骨髓间充质干细胞,Western blotting和ELISA分析IL-34在细胞中的表达;用高表达IL-34的骨髓间充质干细胞培养上清液来培养THP-1细胞,Real-time PCR分析THP-1细胞中IL-10和TNFα的表达变化。经双酶切和测序鉴定,成功构建了pIRES2-EGFP-IL-34重组体;转染至骨髓间充质干细胞的IL-34可以促进THP-1细胞表达IL-10和TNFα。结果表明,骨髓间充质干细胞表达分泌的IL-34对THP-1有调节作用。
关键词: 人骨髓间充质干细胞 白细胞介素-34 THP-1细胞 白细胞介素-10 肿瘤坏死因子-α
Effects of interleukin-34 expressed by human bone marrow derived mesenchymal stem cells on THP-1 cells
Xueming Gao*, Shun Zhang*, Zhaojun Xu

 , Yan Shan, Zihong Wang, Ting Cai, Xue Jiang
, Yan Shan, Zihong Wang, Ting Cai, Xue Jiang Ningbo No.2 Hospital, Ningbo 315010, Zhejiang, China
Received: August 30, 2016; Accepted: January 18, 2017; Published: February 16, 2015
Supported by: Ningbo Municipal Natural Science Foundation (No. 2016A610139), Project of Scientific Innovation Team of Ningbo (No.2011B82016)
* These authors contributed equally to this study
Abstract: To construct recombinant eukaryotic expression plasmid vector of human IL-34 gene, and to study the effects of IL-34 expressed by human bone marrow-derived mesenchymal stem cells (hBM-MSCs) on THP-1 cells. Full-length IL-34 encoding sequence was amplified by PCR. And this fragment was cloned into the plasmid pIRES2-EGFP. Western blotting and ELISA were used to analyze the expression of IL-34 in hBM-MSCs. THP-1 cells were cultured with hBM-MSCs medium containing IL-34 protein. Real-time PCR detected the effects of IL-34 on the expression of IL-10 and TNFα in THP-1 cells. Restrictive enzyme analysis and sequencing demonstrated that IL-34 eukaryotic expression vector was successfully constructed. IL-34 protein expressed by hBM-MSCs could promote IL-10 and TNFα expression in THP-1 cells. Those results show that IL-34 expressed by hBM-MSCs has regulating effect on THP-1 cells.
Key words: human bone marrow derived mesen chymal stem cells IL-34 THP-1 cells IL-10 TNFα
近十几年来,研究发现间充质干细胞 (Mesenchymal stem cells,MSCs) 可以促进慢性创伤愈合,并且已经应用于临床试验,同时研究者发现MSCs也可以促进烧伤和放射损伤创面愈合[1-4]。MSCs作用于伤口,可以加速伤口愈合并促进肉芽组织和血管形成[5]。MSCs在促进伤口愈合过程中并不是通过分化并替代损伤的组织来修复创面,而是通过分泌可溶性细胞因子来调节多种细胞应答皮肤损伤。MSCs通过分泌细胞因子和生长因子促进血管再生、减少细胞死亡量并促进创面处疤痕形成[6]。MSCs也可以分泌免疫抑制因子来抑制免疫细胞增殖,如T细胞、B细胞和NK细胞。外源性MSCs能够促进伤口愈合、肉芽组织形成和新血管形成;进一步研究发现MSCs通过分泌细胞因子调节巨噬细胞、角质细胞、真皮成纤维细胞和上皮细胞,进而促进伤口愈合[5]。
尽管已经有研究发现MSCs可以募集巨噬细胞到达创面处[7],但是两种细胞之间的作用关系并不清楚。研究者利用牙龈间充质干细胞研究发现,在体外MSCs与巨噬细胞共培养可以促进巨噬细胞分化为具有抗炎作用的M2型巨噬细胞,这些巨噬细胞具有较强的吞噬功能,并且可以分泌抗炎因子以及抑制促炎因子的表达[8]。有****用骨髓间充质干细胞进行研究得到相同的效果[9-11]。在MSCs-巨噬细胞共培养体系中抑制白细胞介素6 (Interleukin-6,IL-6) 和粒细胞巨噬细胞集落刺激因子 (GM-CSF) 的活性可以抑制M2巨噬细胞的形成,这说明MSCs分泌的这些细胞因子在调节巨噬细胞表型过程中有重要作用。
虽然MSCs可以趋化巨噬细胞并促进巨噬细胞表型转换,但是对于其中的具体机制尚不完全清楚。特别是近年来发现白细胞介素34 (Interleukin-34,IL-34),它作为一个新的细胞因子,和巨噬细胞集落刺激因子 (M-CSF) 以及GM-CSF都可以调节巨噬细胞的功能。M-CSF和IL-34有共同的受体CSF-1R,这两个因子都可以诱导单核细胞分化为IL-10(高) IL-12(低) 免疫调节巨噬细胞,这种细胞与卵巢癌中的肿瘤相关巨噬细胞类似。M-CSF诱导型巨噬细胞 (M-CSF-Mφ)、IL-34诱导型巨噬细胞 (IL-34-Mφ) 和肿瘤相关巨噬细胞都可以促进CD4(+) T细胞分化为CCR4(+) CCR6(+) CD161(+) Th17细胞,而GM-CSF诱导型巨噬细胞可以促进其分化为Th1细胞;膜型IL-1α可以调节记忆T细胞分化为Th17细胞,M-CSF、IL-34诱导型巨噬细胞和肿瘤相关巨噬细胞都可以表达膜型IL-1α[12]。因此证明巨噬细胞通过促进CD4(+) T细胞极化来调节免疫应答。研究发现IL-34蛋白可以刺激单核细胞分化为CD14(高) CD163 (高) CD1a (-) 巨噬细胞;受LPS刺激后,IL-34-Mφ转变为IL-10(高) IL-12(低) M2表型,同时共刺激分子CD80和CD86表达降低,因此IL-34-Mφ对T细胞的激活作用欠佳,具有潜在的免疫抑制作用;IL-34-Mφ和M-CSF-Mφ的表型及功能相似,但是IL-34-Mφ的形成是通过CSF-1R介导的,而不依赖于M-CSF,IL-6可以促进该细胞形成;IFNγ和GM-CSF都可以抑制IL-34诱导单核细胞分化为免疫抑制型巨噬细胞,此外,IFNγ还可以促进IL-34-Mφ转变为免疫调节型Mφ[13]。
为了研究IL-34在人骨髓间充质干细胞 (hBM-MSCs) 调节巨噬细胞功能过程中的作用,特别是hBM-MSCs高表达IL-34对单核巨噬细胞的影响,我们构建IL-34真核表达载体pIRES2-EGFP-IL-34,然后将该载体转染到hBM-MSCs中,利用转染pIRES2-EGFP-IL-34的BM-MSCs上清液培养THP-1细胞,Real-time PCR分析白细胞介素-10 (IL-10) 和肿瘤坏死因子α (TNFα) 在THP-1细胞中的表达变化。研究结果将为进一步探究IL-34对单核/巨噬细胞的调节作用奠定基础。
1 材料与方法1.1 材料人骨髓组织标本取自于宁波市第二医院风湿免疫科病人,实验开展前已经取得病人同意,并经宁波市伦理委员会批准;THP-1细胞购自上海中科院细胞库。pIRES2-EGFP和大肠杆菌DH5α购自上海Invitrogen公司。pcDNA3.1-IL-34为本实验室保存。
1.2 试剂RNA提取试剂盒RNeasy Mini Kit购自QIAGEN公司。PrimeScriptTM RT Master Mix、Prime ATAR Max DNA polymerase、EcoRⅠ、BamHⅠ、DL2000 DNA marker、SYBR? Premix Ex TaqTM (Tli RNase H Plus) 和DNA Ligation Kit Ver.2.1购自TaKaRa公司。Gel Extraction Kit、Endo-Free Plasmid Mini Kit和Plasmid Mini Kit Ⅰ购自OMEGA公司。NanoFectin Transfection Reagent购自上海依科赛生物制品有限公司。抗生素、胎牛血清,胰酶和分化培养基购自GIBCO公司。干细胞培养基购自Sciencell公司。流式抗体购自优宁维生物科技有限公司。油红O、甲苯胺蓝和茜素红购自Solarbio公司。SANTA CRUZ鼠抗人IL-34单克隆抗体 (sc-517217)。WB试剂购自上海生工生物有限公司。ELISA试剂盒购自上海桥杜生物有限公司 (REN001)。细菌培养基购自OXOID公司。实验过程中用到的所有引物由华大测序公司合成 (表 1)。
表 1 Real-time PCR引物序列Table 1 Sequences of the primers for real-time PCR
| Primer name | Primer sequences (5′-3′) |
| IL-34-froward | GCAGAATGAGGAGTGCACTG |
| IL-34-reverse | ACCAAGACCCACAGATACCG |
| TNFα-froward | CCATGTTGTAGCAAACCCTCAA |
| TNFα-reverse | CTTGAAGAGGACCTGGGAGTAG |
| IL-10-froward | TCCATTCCAAGCCTGACCAC |
| IL-10-reverse | ATCCCTCCGAGACACTGGAA |
| GAPDH-froward | GGAGTCAACGGATTTGGTCGTAT |
| GAPDH-reverse | AGCCTTCTCCATGGTGGTGAAGAC |
表选项
1.3 pIRES2-EGFP-IL-34质粒的构建与鉴定利用Primer 5设计一对IL-34特异性引物,上游引物:5′-CCGGAATTCGCCACCATGCCCC GGGCTT-3′,引物序列含有一个EcoR I酶切位点和一个Kozak序列;下游引物:5′-CGCGGATCCT CAGGGCAAGAGGCCCTCGC-3′,引物序列含有1个BamHⅠ酶切位点。
以本实验室保存的pcDNA3.1-IL-34质粒为模板,用上述引物扩增出IL-34表达序列,利用EcoRⅠ和BamHⅠ将目的基因和pIRES2-EGFP空载体分别进行酶切,待酶切结束后,进行电泳回收;将回收的IL-34基因和pIRES2-EGFP大片段进行连接,然后转化DH5α感受态菌株;将转化后的DH5α菌株涂布于含有卡那霉素的平板,37 ℃培养12-16 h,观察菌落生长状态,并挑取单菌落进行菌落PCR鉴定,挑取经PCR鉴定为阳性的菌落并接种到含抗生素的LB培养基中,过夜培养并提取质粒,然后进行酶切鉴定,送华大公司进行测序鉴定。
1.4 hBM-MSCs分离培养及鉴定用PBS缓冲液与骨髓组织液1:1混合,缓慢颠倒均匀,向干净无菌的15 mL离心管中加入3 mL Ficoll分离液,然后再向离心管中缓慢加入稀释后的骨髓液6 mL,2 000 r/min离心15 min,将中间层的白色细胞轻轻吸取并转移到新的离心管中,用PBS缓冲液清洗细胞2次,最后用Sciencell完全干细胞培养基将细胞混合吹散,接种到培养皿中。CO2浓度为5%,37℃培养,12-24 h观察细胞生长情况,同时更换培养基,去除未贴壁的细胞,每间隔3 d更换一次培养基,待细胞汇合度达到80%时,进行细胞传代。
当细胞培养至第3或4代,消化并收集细胞,进行流式分析鉴定以及分化鉴定。取部分细胞,分别孵育CD90、CD105、CD73、CD79a、CD34、CD11b、CD19、CD14、CD45和HLA-DR抗体,上机检测细胞表面标记性分子的表达情况;CD90、CD105和CD73在细胞表面阳性表达,而其他的标记分子则阴性表达。另外再取一部分细胞,分成3组,分别进行成脂、成软骨和成骨分化培养,培养后分别用油红O、甲苯胺蓝和茜素红进行染色鉴定。
1.5 IL-34基因在hBM-MSC中的表达分析复苏培养hBM-MSC细胞,当细胞密度达到90%时,将细胞转接到6孔板中。分别用LPS (100 ng/mL) 和TNFα (100 ng/mL) 刺激培养hBM-MSC。培养6 h、24 h和48 h后提取细胞总RNA,经逆转录合成cDNA。Real-time PCR分析hBM-MSC细胞中IL-34表达变化。
1.6 pIRES2-EGFP-IL-34转染hBM-MSCs及表达提取无内毒素pIRES2-EGFP-IL-34和pIRES2-EGFP质粒。复苏hBM-MSCs,培养汇合度至80%传代,细胞换液,2 h后按照NanoFectin Transfection Reagent说明书操作,将两种质粒分别转染至hBM-MSCs。培养24 h后,观察荧光蛋白在细胞中的表达情况。培养48 h后收集细胞培养上清液备用,提取细胞总蛋白,Western blotting检测IL-34蛋白在hBM-MSCs中的表达情况。实验所使用的一抗为SANTA CRUZ鼠抗人IL-34单克隆抗体 (sc-517217),抗体使用浓度为1:500;二抗为HRP标记的羊抗鼠IgG,使用浓度为1:8 000;ECL显色拍照。利用收集到的细胞培养上清液进行ELISA实验,检测IL-34蛋白在培养液中的浓度。
1.7 转染pIRES2-EGFP-IL-34的hBM-MSCs培养上清液对THP-1细胞的影响用上述收集的两种上清液 (pIRES2-EGFP-hIL-34+hBM-MSCs和pIRES2-EGFP+hBM-MSCs) 分别培养THP-1细胞,分别在24 h和48 h收集THP-1细胞并提取总RNA,经逆转录合成cDNA,然后Real-time PCR检测两组THP-1细胞中IL-10和TNFα的表达变化。
2 结果与分析2.1 IL-34真核表达载体构建pIRES2-EGFP载体 (图 1A) 用来构建IL-34基因真核表达载体。在pIRES2-EGFP载体的多克隆位点 (MCS) 和增强型绿色荧光蛋白 (EGFP) 编码区之间含有一段脑心肌炎病毒的内部核糖体进入序列 (IRES),因此可以使MCS中插入的外源基因和EGFP在同一条mRNA上进行翻译。在pIRES2-EGFP载体中还含有卡那霉素和新霉素编码基因,用于克隆筛选和稳定细胞表达株筛选。
 |
| 图 1 重组质粒pIRES2-EGFP-IL-34构建结果 Figure 1 The results of pIRES2-EGFP-IL-34 construction. (A) Plasmid map of pIRES2-EGFP. (B) Plasmid map of pIRES2-EGFP-IL-34. (C) The products of colony PCR. (D) pIRES2-EGFP-IL-34 digested with EcoR I and BamH I. |
| 图选项 |
通过PCR特异性扩增出IL-34基因编码序列726 bp,然后与pIRES2-EGFP载体分别进行EcoR I和BamH I双酶切,将IL-34基因片段与pIRES2-EGFP载体连接 (图 1B)。将连接产物转化到DH5α感受态中,涂布在含有卡那霉素的平板筛选阳性克隆。菌落PCR可以扩增出一条约750 bp的片段 (图 1C);重组质粒经双酶切可以形成两条片段,小片段大小约为750 bp (图 1D);将重组质粒送测序,测序结果与GenBank中的IL-34序列 (GenBank Accession No. NM_152456.2) 对比完全匹配。
2.2 hBM-MSCs分离培养及鉴定利用Ficoll分离液从骨髓组织中分离单核细胞,然后接种在细胞培养皿中,培养24 h后换液,观察细胞形态,hBM-MSCs为成纤维状。细胞培养生长至汇合度为80%时,进行传代,细胞培养至第3代用于流式鉴定以及多向分化鉴定。分别检测细胞上CD90、CD105、CD73、CD79a、CD34、CD11b、CD19、CD14、CD45和HLA-DR标记性分子的表达情况,分别检测细胞向脂肪、成骨和软骨分化的能力。结果显示我们分离出的细胞90%以上表达CD90、CD105和CD73,而CD79a、CD34、CD11b、CD19、CD14、CD45和HLA-DR几乎不表达 (图 2A),并且该细胞可以向脂肪、成骨和软骨分化 (图 2B),这说明我们成功地分离出hBM-MSCs。
 |
| 图 2 hBM-MSCs表面标记物流式细胞术鉴定和三系分化结果 Figure 2 The flow cytometry results of cell surface markers on hBM-MSCs, and the ability of hBM-MSCs differentiate into adipocytes, osteoblasts and chondrocytes. (A) The hBM-MSCs exhibit a CD90+CD105+CD73+ and CD79a-CD34-CD11b-CD19-CD14-CD45-HLA-DR- phenotype. (B) The hBM-MSCs could differentiate into adipocytes, osteoblasts and chondrocytes. |
| 图选项 |
2.3 IL-34基因在hBM-MSCs中的表达分析分别用LPS和TNFα刺激培养hBM-MSCs,在培养6 h、24 h和48 h后提取总RNA并逆转录合成cDNA。Real-time PCR分析细菌脂多糖 (LPS) 和TNFα在不同时间对hBM-MSCs表达IL-34的影响。结果发现在不同时间段LPS可以显著抑制IL-34的mRNA的表达;而TNFα可以明显刺激IL-34 mRNA表达 (图 3)。
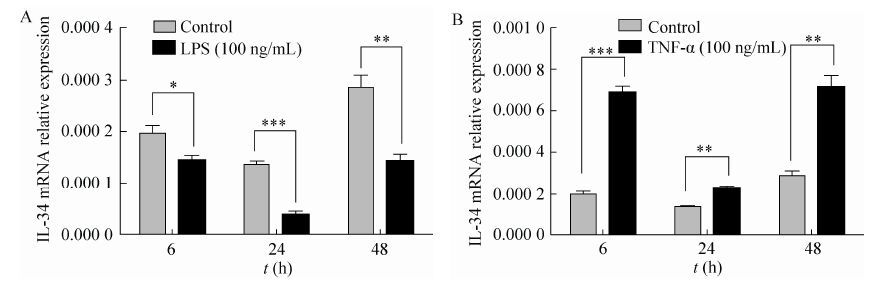 |
| 图 3 Real-time PCR分析IL-34在hBM-MSCs中的表达分析 Figure 3 Analysis of IL-34 expression in hBM-MSCs by real-time PCR. The expression of IL-34 mRNA was significantly decreased after LPS stimulation. The level of IL-34 mRNA in hBM-MSCs can be obviously increased by TNFα. *P < 0.05; **P < 0.01; ***P < 0.001. |
| 图选项 |
2.4 pIRES2-EGFP-IL-34在hBM-MSCs中的表达将pIRES2-EGFP-IL-34转染hBM-MSCs后,24 h观察细胞中有绿色荧光表达 (图 4A,B);经Western blotting鉴定,pIRES2-EGFP-IL-34可以在hBM-MSCs中高表达IL-34蛋白质;我们利用SANTA CRUZ鼠抗人单克隆抗体 (sc-517217) 1:500浓度4 ℃过夜孵育以及成像仪曝光检测在未转染的hBM-MSCs中也有微量的IL-34蛋白 (图 4C)。ELISA结果证明hBM-MSCs可以表达并分泌IL-34,重组载体pIRES2-EGFP-IL-34可以在hBM-MSCs中高表达IL-34并分泌到细胞外 (图 4D)。
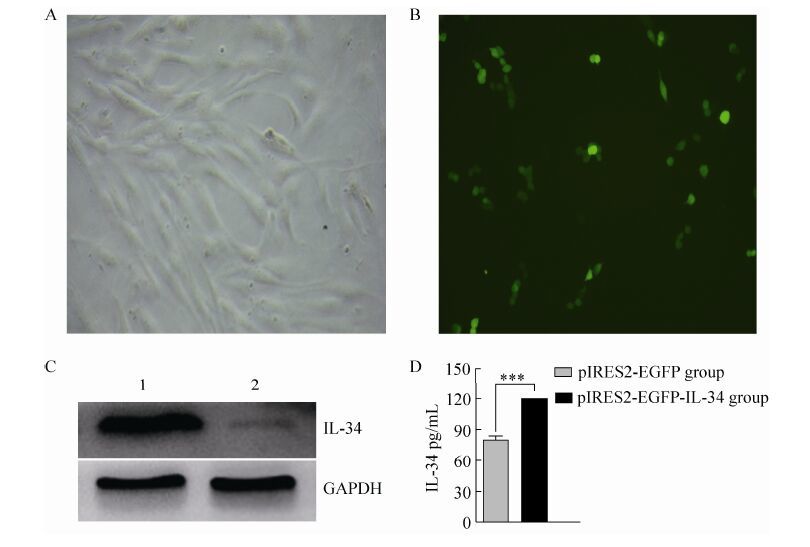 |
| 图 4 pIRES2-EGFP-IL-34在hBM-MSCs细胞中的表达 Figure 4 The results of pIRES2-EGFP-IL-34 expression in hBM-MSCs. (A) MSCs were derived from human bone marrow. (B) The expression of green fluorescence protein was analyzed by fluorescence microscope in hBM-MSCs. (C) The expression of IL-34 protein was analyzed by Western blotting in hBM-MSCs after 48 h. 1: pIRES2-EGFP-IL-34 group, 2: pIRES2-EGFP group. (D) ELISA analyzed the expression of IL-34 in hBM-MSCs. *P < 0.05; **P < 0.01; ***P < 0.001. |
| 图选项 |
2.5 hBM-MSCs高表达IL-34促进THP-1细胞表达IL-10和TNFα用转染pIRES2-EGFP-IL-34的hBM-MSCs的细胞培养上清液培养THP-1细胞,然后提取总RNA,Real-time PCR分析IL-10和TNFα的表达变化。与对照组相比,高表达IL-34的hBM-MSCs上清液培养THP-1细胞48 h后可以明显地刺激THP-1表达IL-10和TNFα (图 5)。结果说明我们不仅成功地克隆了IL-34真核表达载体,同时该载体可以在hBM-MSCs中表达具有活性的IL-34蛋白。
 |
| 图 5 hBM-MSCs过表达IL-34促进THP-1细胞表达IL-10 (A) 和TNFα (B) Figure 5 IL-34 expressed by hBM-MSCs could promote IL-10 (A) and TNFα (B) expression in THP-1 cells. *P < 0.05; **P < 0.01; ***P < 0.001. |
| 图选项 |
3 讨论IL-34是一个新发现的细胞因子,它与M-CSF没有同源序列,但是它们有共同的受体CSF-1R,这两种细胞因子的生物学功能相似但不完全相同[14]。IL-34可以通过与受体CSF-1R结合来调节单核细胞和巨噬细胞的增殖、分化及生存[12-13, 15]。研究证明,IL-34不仅参与调节细胞生物活性,而且在多种炎症性疾病的发生和发展过程中也起重要作用[16-17]。IL-34在很多组织中都有表达,多种炎症因子都可以诱导IL-34表达。Kawabe等[18]发现TNFα可以刺激牙周膜细胞表达IL-34和M-CSF。Ciccia等[17]用TNFα刺激MC3T3-E1细胞15 min后,核转录因子NF-κB从细胞质转移到细胞核,同时IL-34的表达量升高;利用NF-κB抑制剂CAPE可以明显抑制TNFα诱导IL-34表达,因此证明TNFα是通过转录因子NF-κB诱导IL-34的表达。Bostr?m等[19]发现IL-34在牙龈成纤维细胞中表达,TNFα和IL-1β刺激牙龈成纤维细胞,通过调节NF-κB和JNK信号分子使IL-34 mRNA表达量增高。
Eda等[20]用IL-1β、IL-6、IL-17和TNFα 4种炎症因子分别刺激成骨细胞后,只有IL-1β和TNFα可以显著诱导细胞表达IL-34 mRNA;IL-1β和TNFα可以激活细胞内MAPKs通路 (p44/42 MAPK、p38、JNK和NF-κB等信号分子);JNK抑制剂可以显著抑制IL-1β和TNFα诱导IL-34 mRNA表达,而MEK-1/2抑制剂不能抑制IL-34 mRNA表达,令人惊奇的是,两种抑制剂同时作用可以更明显地抑制IL-34 mRNA表达;IL-1β和TNFα也可以诱导成骨细胞表达M-CSF mRNA,p38、JNK和MEK-1/2抑制剂对其表达并没有影响,但是NF-κB抑制剂可以显著抑制M-CSF mRNA表达。上述结果说明炎症性因子IL-1β和TNFα是通过JNK和P44/42 MAPK信号通路诱导成骨细胞表达IL-34,而不是通过P38通路;p38和JNK等信号分子并不参与诱导M-CSF表达。我们的研究结果也证实了TNFα可以促进IL-34的表达;在本研究结果中,我们发现LPS可以显著抑制IL-34表达,但是作用机制尚不清楚。有研究表明LPS与炎症细胞 (包括单核/巨噬细胞) 上的受体结合后,可启动一系列快速反应,最终导致p38 MAPK的激活,进而作用于下游的激酶、转录因子等靶蛋白[21-25]。但是根据已知结果证明IL-34表达并不受p38途径调控,LPS对IL-34的具体调控机制有待进一步深入研究。
为了探究IL-34在hBM-MSCs调节巨噬细胞表型过程中的作用机制,我们首先将IL-34基因克隆到pIRES2-EGFP载体中,并在hBM-MSCs中表达IL-34蛋白质。我们利用转染pIRES2-EGFP-IL-34的hBM-MSCs培养上清液培养THP-1细胞,结果证明pIRES2-EGFP-IL-34载体可以在hBM-MSCs中表达具有生物活性的IL-34蛋白质,在此过程中,IL-34蛋白可以促进THP-1细胞表达IL-10和TNFα。IL-34可以通过ERK促进肠固有层单核细胞表达TNFα[26],但是对于IL-34促进IL-10表达的作用机制还不清楚。综上所述,我们成功地构建了IL-34在hBM-MSCs中的表达体系,这为后续研究hBM-MSCs对巨噬细胞表型的调节作用奠定了基础。
参考文献
| [1] | U.S. National Institutes of Health Registry of Clinical Trials. http://clinicaltrials.gov. |
| [2] | Butler KL, Goverman J, Ma H, et al. Stem cells and burns: review and therapeutic implications.J Burn Care Res, 2010, 31(6): 874–881.DOI: 10.1097/BCR.0b013e3181f9353a |
| [3] | Fran ois S, Bensidhoum M, Mouiseddine M, et al. Local irradiation not only induces homing of human mesenchymal stem cells at exposed sites but promotes their widespread engraftment to multiple organs: a study of their quantitative distribution after irradiation damage.Stem Cells, 2006, 24(4): 1020–1029.DOI: 10.1634/stemcells.2005-0260 |
| [4] | Benderitter M, Gourmelon P, Bey E, et al. New emerging concepts in the medical management of local radiation injury.Health Phys, 2010, 98(6): 851–857.DOI: 10.1097/HP.0b013e3181c9f79a |
| [5] | Hocking AM, Gibran NS. Mesenchymal stem cells: paracrine signaling and differentiation during cutaneous wound repair.Exp Cell Res, 2010, 316(14): 2213–2219.DOI: 10.1016/j.yexcr.2010.05.009 |
| [6] | Ankrum J, Karp JM. Mesenchymal stem cell therapy: two steps forward, one step back.Trends Mol Med, 2010, 16(5): 203–209.DOI: 10.1016/j.molmed.2010.02.005 |
| [7] | Chen LW, Tredget EE, Wu PYG, et al. Paracrine factors of mesenchymal stem cells recruit macrophages and endothelial lineage cells and enhance wound healing.PLoS ONE, 2008, 3(4): e1886.DOI: 10.1371/journal.pone.0001886 |
| [8] | Zhang QZ, Su WR, Shi SH, et al. Human gingiva-derived mesenchymal stem cells elicit polarization of m2 macrophages and enhance cutaneous wound healing.Stem Cells, 2010, 28(10): 1856–1868.DOI: 10.1002/stem.v28:10 |
| [9] | Kim J, Hematti P. Mesenchymal stem cell-educated macrophages: a novel type of alternatively activated macrophages.Exp Hematol, 2009, 37(12): 1445–1453.DOI: 10.1016/j.exphem.2009.09.004 |
| [10] | Maggini J, Mirkin G, Bognanni I, et al. Mouse bone marrow-derived mesenchymal stromal cells turn activated macrophages into a regulatory-like profile.PLoS ONE, 2010, 5(2): e9252.DOI: 10.1371/journal.pone.0009252 |
| [11] | Ohtaki H, Ylostalo JH, Foraker JE, et al. Stem/progenitor cells from bone marrow decrease neuronal death in global ischemia by modulation of inflammatory/immune responses.Proc Natl Acad Sci USA, 2008, 105(38): 14638–14643.DOI: 10.1073/pnas.0803670105 |
| [12] | Foucher ED, Blanchard S, Preisser L, et al. IL-34-and M-CSF-induced macrophages switch memory T cells into Th17 cells via membrane IL-1α.Eur J Immunol, 2015, 45(4): 1092–1102.DOI: 10.1002/eji.201444606 |
| [13] | Foucher ED, Blanchard S, Preisser L, et al. IL-34 induces the differentiation of human monocytes into immunosuppressive macrophages antagonistic effects of GM-CSF and IFNγ.PLoS ONE, 2013, 8(2): e56045.DOI: 10.1371/journal.pone.0056045 |
| [14] | Lin HS, Lee E, Hestir K, et al. Discovery of a cytokine and its receptor by functional screening of the extracellular proteome.Science, 2008, 320(5877): 807–811.DOI: 10.1126/science.1154370 |
| [15] | Chihara T, Suzu S, Hassan R, et al. IL-34 and M-CSF share the receptor Fms but are not identical in biological activity and signal activation.Cell Death Differ, 2010, 17(12): 1917–1927.DOI: 10.1038/cdd.2010.60 |
| [16] | Hwang SJ, Choi B, Kang SS, et al. Interleukin-34 produced by human fibroblast-like synovial cells in rheumatoid arthritis supports osteoclastogenesis.Arthritis Res Ther, 2012, 14(1): R14.DOI: 10.1186/ar3693 |
| [17] | Ciccia F, Alessandro R, Rodolico V, et al. IL-34 is overexpressed in the inflamed salivary glands of patients with Sj gren's syndrome and is associated with the local expansion of pro-inflammatory CD14brightCD16+ monocytes.Rheumatology, 2013, 52(6): 1009–1017.DOI: 10.1093/rheumatology/kes435 |
| [18] | Kawabe M, Ohyama H, Kato-Kogoe N, et al. Expression of interleukin-34 and colony stimulating factor-1 in the stimulated periodontal ligament cells with tumor necrosis factor-α.Med Mol Morphol, 2015, 48(3): 169–176.DOI: 10.1007/s00795-014-0094-8 |
| [19] | Bostr m EA, Lundberg P. The newly discovered cytokine IL-34 is expressed in gingival fibroblasts, shows enhanced expression by pro-inflammatory cytokines, and stimulates osteoclast differentiation.PLoS ONE, 2013, 8(12): e81665.DOI: 10.1371/journal.pone.0081665 |
| [20] | Eda H, Shimada H, Beidler DR, et al. Proinflammatory cytokines, IL-1β and TNF-α, induce expression of interleukin-34 mRNA via JNK-and p44/42 MAPK-NF-κB pathway but not p38 pathway in osteoblasts.Rheumatol Int, 2011, 31(11): 1525–1530.DOI: 10.1007/s00296-010-1688-7 |
| [21] | Teed HJ, Mcgrath BP, Desilva L, et al. Isoflavones reduce arterial stiffness: aplacebo-controlled study in men and postmenopausal women.Arterioscler Thromb Vasc Biol, 2003, 23(6): 1066–1071.DOI: 10.1161/01.ATV.0000072967.97296.4A |
| [22] | Fessler MB, Malcolm KC, Duncan MW, et al. A genomic and proteomic analysis of activation of the human neutrophil lipopolysaccharide and its mediation by p38 mitogen-activated protein kinase.J Biol Chem, 2002, 277(35): 31291–31302.DOI: 10.1074/jbc.M200755200 |
| [23] | Ma W, Lim W, Gee K, et al. The p38 mitogen-activated kinase pathway regulates the human interleukin-10 promoter via the activation of Sp1 transcription factor in lipopolysaccharide-stimulated human macrophages.J Biol Chem, 2001, 276(17): 13664–13674. |
| [24] | Mancuso G, Midri A, Beninati C, et al. Mitogen-activated protein kinases and NF-κB are involved in TNF-α responses to group B Streptococci.Immunol, 2002, 169(3): 1401–1409.DOI: 10.4049/jimmunol.169.3.1401 |
| [25] | Dean JL, Brook M, Clark AR, et al. p38 mitogen-activated protein kinase regulates cyclooxygenase-2 mRNA stability and transcription in lipopolysaccharide-treated human monocytes.J Biol Chem, 1999, 274(1): 246–269. |
| [26] | Franzè E, Monteleone I, Cupi ML, et al. Interleukin-34 sustains inflammatory pathways in the gut.Clin Sci, 2015, 129(3): 271–280.DOI: 10.1042/CS20150132 |
