

江南大学 生物工程学院, 江苏 无锡 214122
收稿日期:2017-02-20;接收日期:2017-05-09 基金项目:国家高技术研究发展计划(863计划) (No. 2015AA021004),国家自然科学基金(No. 31570085),江苏省自然科学基金(No.BK20161292),江苏省****基金(No. BK20150002)资助
摘要:以大肠杆菌BL21(DE3)为表达宿主,构建两株分别表达L-苏氨酸脱氨酶(LTD,基因来源大肠杆菌)和共表达亮氨酸脱氢酶(LDH,来源蜡样芽孢杆菌)/葡萄糖脱氢酶(GDH,来源枯草芽孢杆菌)的重组大肠杆菌,在此基础上,构建了一种以L-苏氨酸和D-葡萄糖为底物联产L-2-氨基丁酸(L-ABA)和D-葡萄糖酸的全细胞转化系统。通过转化条件(温度、pH、细胞通透性和菌体量)优化,并采用分批补料策略,164 g/L L-苏氨酸和248 g/L D-葡萄糖最终转化得到141.6 g/L的L-ABA和269.4 g/L的D-葡萄糖酸,时空得率分别达到7.1 g/(L?h)和13.5 g/(L?h),得率超过99%。本研究使用价格低廉的大宗化学品高效率生产出有较高附加值的产物,全细胞转化系统无需额外添加昂贵的辅酶,更适用于工业化生产。
关键词:全细胞转化 L-2-氨基丁酸 D-葡萄糖酸 脱氨酶 脱氢酶
Whole-cell biotransformation for simultaneous synthesis of L-2-aminobutyric acid and D-gluconic acid in recombinant Escherichia coli
Caizhe Zhang, Taowei Yang, Junping Zhou, Junxian Zheng, Meijuan Xu, Xian Zhang, Zhiming Rao


School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: February 20, 2017; Accepted: May 9, 2017
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2015AA021004), National Natural Science Foundation of China (No. 31570085), Natural Science Foundation of Jiangsu Province of China (No. BK20161292), Excellent Youth Foundation of Jiangsu Scientific Committee (No. BK20150002)
Corresponding author:Zhiming Rao. Tel: +86-510-85916881; E-mail: raozhm@jiangnan.edu.cn
Abstract: A whole-cell catalyst using Escherichia coli BL21(DE3) as a host, expressing L-threonine dehydratase from Escherichia coli, and co-expressing leucine dehydrogenase from Bacillus cereus and glucose dehydrogenase from Bacillus subtilis for cofactor regeneration, was constructed and used for one-pot production of L-2-aminobutyric acid (L-ABA) and D-gluconic acid from L-threonine and D-glucose. We used shake-flask culture to study the whole-cell catalytic condition including temperature, pH, proper permeabilization of cells and optimal wet cells amount. Moreover, the whole-cell catalyst was cultured in 5-L fermentor by fed-batch fermentation, and 164 g/L L-threonine and 248 g/L D-glucose were converted to 141.6 g/L L-ABA and 269.4 g/L D-gluconic acid. The whole-cell catalyst is promising to fulfill industrial requirements for L-ABA and D-gluconic acid.
Key words: whole-cell catalyst L-2-aminobutyric D-gluconic acid dehydratase dehydrogenase
L-2-氨基丁酸(L-ABA)是一种非天然氨基酸,可以作为重要的前体物质合成多种手性药物,包括用于结核病治疗的乙胺丁醇和布瓦西坦,以及抗癫痫药物左乙拉西坦[1]。目前已开发出诸多L-ABA的生物合成途径[2-4],主要通过脱氢酶或者转氨酶来催化制备,但不对称还原反应需要等当量的辅酶参与,烟酰胺腺嘌呤二核苷酸(即还原型辅酶Ⅰ,NADH)是氧化还原反应中重要的辅酶[5],作为电子供体,1分子NADH可以提供2个电子用于羰基等基团的还原,由于辅酶价格昂贵,限制了其在工业水平的应用,所以需要另一种底物和酶偶联对辅酶进行再生循环,以解决辅酶限制[6-7]。常用的酶偶联法NAD(P)H辅酶循环体系有两种[8]。一种是甲酸/FDH再生NADH体系。甲酸脱氢酶(Formate dehydrogenase,FDH)是一种广泛存在于甲醇利用型的细菌及酵母中的酶,也是目前还原NAD+的脱氢酶中国内外研究最多的酶之一[9]。FDH可以使甲酸氧化生成CO2,同时将氧化态的辅酶NAD+还原为NADH。另一种是葡萄糖/GDH再生NAD(P)H体系,葡萄糖脱氢酶(Glucose dehydrogenase,GDH)是一种氧化还原酶,催化D-葡萄糖得到D-葡萄糖酸,同时将氧化态的辅酶NAD+或NADP+还原为NADH或NADPH。在某些情况下,NAD+作为辅酶时,GDH的酶促效率相比NADPH作为辅酶时要低[10]。多数研究采用基因工程技术对GDH进行克隆和在大肠杆菌中过表达来解决野生菌中酶活水平不高的问题,实现氧化还原酶辅酶循环再生[11]。
例如Galkin等以2-酮丁酸为底物,通过偶联亮氨酸脱氢酶(LDH)和辅酶(NADH)循环再用酶生甲酸脱氢酶(FDH),最终获得36 g/L的L-ABA,产物得率为88%[12];Tao等以L-苏氨酸为底物,利用L-苏氨酸脱氨酶、亮氨酸脱氢酶、甲酸脱氢酶一锅法转化L-苏氨酸产L-2-氨基丁酸,在50 L规模上30 mol L-苏氨酸转化为29.2 mol L-ABA,实现了97.3%的得率,产率达到了6.37 g/(L?h),此方法在工业化生产L-ABA有较大潜力[13]。多数报道均以酶法转化为基础,需要细胞破碎等繁琐步骤,并且需要外源添加一定数量的辅酶(NAD+等)。本文构建了包括辅酶原位再生的偶联酶反应的途径,以L-苏氨酸为底物,D-葡萄糖为辅底物,以LTD和LDH一起构建包括辅酶NADH循环再生的多酶催化体系,全细胞转化联产L-ABA和D-葡萄糖酸(图 1)。其中的偶联反应产物D-葡萄糖酸及其系列衍生物(如葡萄糖酸盐、葡萄糖酸δ-内酯)是一类多用途的重要有机产品,在食品工业中被广泛用作酸味剂、发酵剂、防腐剂、营养增补剂、色调保持剂、蛋白质凝固剂等[14]。
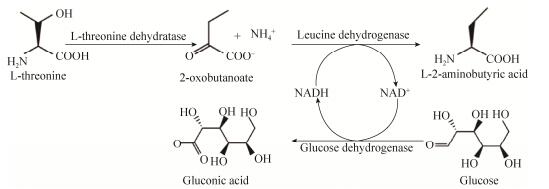 |
| 图 1 全细胞转化合成途径[13] Figure 1 Scheme of the reaction catalyzed by the whole-cell catalyst[13]. |
| 图选项 |
1 材料与方法1.1 菌株和质粒pMD18-T克隆载体购自TaKaRa宝生物工程(大连)有限公司;pET28a(+)表达载体购自Novagen公司;大肠杆菌BL21(DE3)购自Invitrogen公司。
1.2 主要试剂和仪器分子生物学工具酶、DNA markers购自TaKaRa宝生物工程(大连)有限公司。L-苏氨酸、L-ABA、D-葡萄糖酸标准样品购自Sigma公司;质粒抽提试剂盒、基因组提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自上海捷瑞生物工程有限公司;引物合成与核酸序列测定由上海生工生物工程公司完成;其他试剂均购自国药集团。
高速冷冻离心机购自HITACHI公司;高效液相色谱、氨基酸柱、有机酸柱购自Agilent公司;酶标仪购自Thermo公司;超声破碎仪购自SONICS公司;PCR仪购自Bio-Rad公司;5 L发酵罐购自上海保兴生物设备工程有限公司。
1.3 重组质粒构建根据已报道的L-苏氨酸脱氨酶基因ltd序列[15] (GenBank登录号:948287)设计引物T1和T2 (文中所用引物见表 1),上游引物T1的5′端引入BamHⅠ酶切位点,下游引物T2的5′端引入Hind Ⅲ酶切位点。
表 1 本研究所用PCR扩增引物Table 1 Primers for PCR amplication used in this study
| Primer name | Primer sequence(5′–3′) | Restriction site |
| T1 | ACCGGGATCCATGGCT GACTCGCAACCCCT | BamHⅠ |
| T2 | CCCAAGCTTTTAACCC GCCAAAAAGAACCTG | Hind Ⅲ |
| F1 | CGGGATCCATGACATT AGAAATCTTCG | BamHⅠ |
| F2 | CGAGCTCTTAGCGAC GGCTAATAATATC | SacⅠ |
| R1 | CGGGATCCATGTATCC GGATTTAAAAGG | BamHⅠ |
| R2 | CCCAAGCTTTTAACCG CGGCCTGCCTGG | Hind Ⅲ |
| G1 | ACATGCATGCCGATCC CGCGAAATTAATAC | SphⅠ |
| G2 | GAAGATCTTTAACCGC GGCCTGCCTGG | Bgl Ⅱ |
| The underlined sequences are restriction enzyme sites. | ||
表选项
根据已报道的蜡样芽孢杆菌的亮氨酸脱氢酶基因ldh序列[16] (GenBank登录号:1206507)设计引物F1和F2,上游引物F1的5′端引入BamHⅠ酶切位点,下游引物F2的5′端引入SacⅠ酶切位点。
根据已报道的枯草芽孢杆菌的葡萄糖脱氢酶基因gdh序列[17] (GenBank登录号:938261)设计引物R1和R2,上游引物R1的5′端引入BamHⅠ酶切位点,下游引物R2的5′端引入Hind Ⅲ酶切位点。
分别以大肠杆菌、蜡样芽孢杆菌、枯草芽孢杆菌基因组DNA为模板,进行PCR扩增,PCR产物经过试剂盒纯化后,分别按酶切位点进行双酶切,回收片段,连接到克隆载体pMD18-T,随后再连接到表达载体pET28a(+),转化入菌株E. coli BL21(DE3),利用卡那霉素筛选重组质粒pET28a(+)-ltd、pET28a(+)-ldh、pET28a(+)-gdh,然后再设计串联引物G1和G2,上游引物G1的5′端引入酶切位点SphⅠ,下游引物G2的5′端引入酶切位点Bgl Ⅱ。
以重组质粒pET28a(+)-gdh为模板,进行PCR扩增,按酶切位点进行双酶切,回收片段,与双酶切重组质粒pET28a(+)-ldh连接,转化入菌株E. coli BL21(DE3)中,利用卡那霉素筛选重组质粒pET28a(+)-ltd/gdh。
将上述重组质粒进行酶切验证,且通过上海生工生物完成测序,验证正确后表明重组质粒构建成功。
1.4 培养基与培养条件种子培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L。
发酵培养基:胰蛋白胨12 g/L,酵母提取物8 g/L,K3PO4 4 g/L,NaCl 3 g/L,一水合柠檬酸2.1 g/L,柠檬酸铁铵0.3 g/L,甘油10 g/L,(NH4)2SO4 2.5 g/L,MgSO4·7H2O 0.5 g/L。
种子液培养:甘油菌以1%比例接种于5 mL种子培养基,卡那霉素终浓度100 μg/L,37 ℃、200 r/min摇床培养10 h。
发酵罐二级种子培养:将种子液按1%比例接种到150 mL LB培养基中,卡那霉素终浓度100 μg/L,37 ℃、200 r/min摇床培养6 h。
5 L发酵罐发酵:二级种子液以5%比例接种于2.5 L发酵培养基中。初始温度为37 ℃,pH为7.0,转速200 r/min,通气量1vvm,发酵过程中pH调控采用50%氨水自动流加。当溶氧下降时上调转速,保持溶氧在20%以上。3 h后转速逐渐升至600 r/min,溶氧停止下降,此时开始补料,补料培养基为甘油400 g/L,胰蛋白胨25 g/L,酵母提取物50 g/L,通过补料使溶氧控制在10%以上。当OD600大于18时,加入0.2 mmol/L IPTG进行诱导,温度降低至28 ℃,继续培养15 h。发酵结束后,发酵液经低温离心(8 000 r/min,15 min),然后–20 ℃保存。
1.5 酶活性的测定离心后的菌体用无菌水洗涤两次后,用0.1 mol/L的磷酸缓冲液重新悬浮,然后在4 ℃下用匀浆仪进行细胞破碎,离心取上清得到粗酶液。LTD、LDH、GDH的酶活性测定分别参考Umbarger和Brown[18]、Ansorge和Kula[19]、Fujita[20]等的报道。
1.6 全细胞催化条件在摇瓶中进行全细胞催化条件优化,转速为180 r/min,温度为30 ℃,pH控制在7.5,0.1 mol/L磷酸盐缓冲液,曲拉通x-100浓度0.3% (V/V),湿菌体量为40 g/L,工程菌BL21-LDH与BL21-LDH/GDH配比为1:5,底物L-苏氨酸与D-葡萄糖添加比例为1:1 (mol/mol),即L-苏氨酸15 g/L,D-葡萄糖22.7 g/L,反应体积为50 mL。
2 结果与分析2.1 重组菌的构建与表达按前述方法构建得到了重组菌株BL21-LTD和BL21-LDH/GDH,分别携带重组质粒pET28a(+)-ltd,pET28a(+)-ldh/gdh,测序验证正确后表明重组质粒构建成功。BL21-LTD和BL21-LDH/GDH的蛋白电泳图谱如图 2A、B所示,LTD、LDH、GDH蛋白分子量分别为56.2、39.9、28.1 kDa。
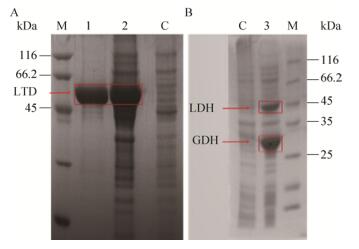 |
| 图 2 蛋白电泳图(A: BL21-LTD; B: BL21-LDH/GDH) Figure 2 SDS-PAGE analysis of BL21-LTD (A) and BL21-LDH/ GDH (B). M: marker; C: control; 1: LTD purified by IMAC; 2: soluble fraction of LTD; 3: co-expressing of LDH and GDH. |
| 图选项 |
2.2 全细胞转化联产L-ABA和D-葡萄糖酸条件优化2.2.1 温度与pH对催化效率的影响首先考察了温度对偶联反应的影响。温度是影响酶反应的重要因素,同时高温也会对酶的稳定性产生负面影响[21]。如图 3A所示,考察了25–50 ℃下的全细胞转化反应,反应条件为pH 7.5,0.1 mol/L磷酸盐缓冲液,曲拉通x-100浓度0.3% (V/V),湿菌体量为40 g/L,工程菌BL21-LTD与BL21-LDH/GDH配比为1:5,底物L-苏氨酸与D-葡萄糖添加比例为1:1 (mol/mol),即L-苏氨酸15 g/L,D-葡萄糖22.7 g/L,反应体积为50 mL。发现最优反应温度为30 ℃,80 min时底物完全转化。
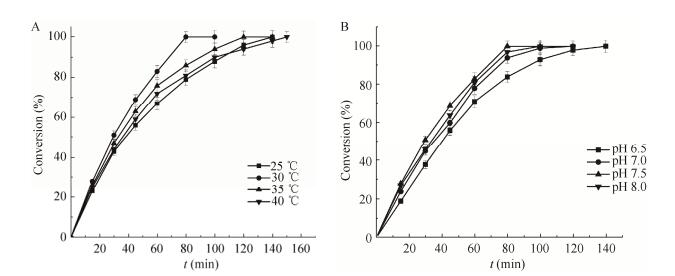 |
| 图 3 温度(A)和pH (B)对转化反应的影响 Figure 3 Effect of reaction temperature (A) and buffer pH (B) on the whole-cell catalyst. (B) Effect of buffer pH on whole-cell catalyst. |
| 图选项 |
众所周知,每一种酶在单独作为生物催化剂时都有一个最佳催化效果的pH值,但是在多酶催化的体系中,每一种酶的最优pH值不同,所以需要综合考虑pH对转化反应的影响。以单位时间内反应转化率为衡量标准进行考察。如图 3B所示,考察了pH 6.5–8.0下的全细胞转化反应,其他反应条件同上。可以看出,最优反应pH为7.5。
2.2.2 细胞通透剂对转化速率的影响此反应为两种工程菌混合进行全细胞转化,底物L-苏氨酸先由BL21-LTD转化为2-酮丁酸,2-酮丁酸再进入BL21-LDH/GDH转化为L-ABA,故细胞通透性的改变可能会影响转化反应的效率。为了克服由于细胞壁、细胞膜存在而形成的渗透壁障,可以通过物理、化学等方法改变细胞壁、膜的通透性。通过处理后的细胞通常仍保持其形态上的完整性,但由于其细胞壁、膜受到了一定的破坏,其对低分子量物质的渗透障碍被部分或完全解除。改变细胞通透性的方法很多,其中去污剂是一种较常用的方法[22]。由于去污剂分子可穿透活性细胞细胞膜,可作为细胞膜的通透剂,所以选取曲拉通x-100、CTAB、吐温-80进行研究。首先在不同浓度下测试这3种通透剂的效果,可以看出曲拉通x-100作为细胞通透剂效果最好,吐温-80和CTAB在0.2%浓度下催化效率最高,但都不如曲拉通x-100 (图 4A)。然后考察了0–0.6% (V/V)曲拉通x-100浓度的全细胞转化反应。可以看出曲拉通x-100的最优浓度为0.3% (图 4B),不添加细胞通透剂会影响细胞间物质交换,导致转换率过低;同时过高的浓度会使膜蛋白从细胞膜裂解,破坏细胞导致酶的稳定性下降。
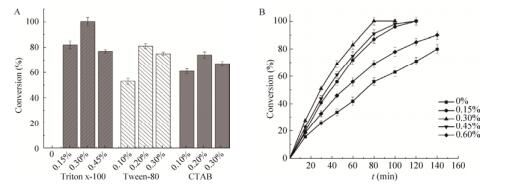 |
| 图 4 不同细胞通透剂(A)和不同浓度曲拉通x-100 (B)对转化反应的影响 Figure 4 Effect of different permeabilization medium (A) and different concentration of triton x-100 (B) on whole-cell catalyst. |
| 图选项 |
2.2.3 菌体量配比及不同菌体量浓度对转化的影响由于是混菌转化,所以要对两种重组菌BL21/pET28a-ltd与BL21/pET28a-ldh/gdh的菌体量进行合适的配比,以便达到合适的酶活比例,提高生产效率。通过测量一定菌体量下对L-苏氨酸/2-酮丁酸的转化速率来确定,两种工程菌分别进行全细胞转化,菌体量为30 g/L (湿重)。转化效率如图 5A所示,工程菌BL21-LTD对L-苏氨酸的每小时转化效率约为25 g/L,BL21-LDH/GDH转化2-酮丁酸为L-ABA的每小时效率约为5 g/L,故菌体量配比定为1:5 (LTD、LDH、GDH三种酶的酶活比为12:10:25)。
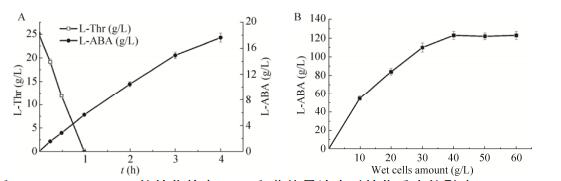 |
| 图 5 BL21-LTD和BL21-LDH/GDH的转化效率(A)和菌体量浓度对转化反应的影响(B) Figure 5 The catalytic efficiency of LTD and LDH/GDH (A) and effect of wet cells amount on the reaction (B). |
| 图选项 |
单位体积内酶活与菌体浓度成正比,但转化效率并不会随菌体浓度的增加而一直增加,为了体现高效经济性,需要得知在达到最高转化效率时的菌体量。考察了0–60 g/L的湿细胞浓度的全细胞转化反应,其他反应条件同上。如图 5B所示,湿菌体浓度为40 g/L (酶量为分别为4 800、4 000、10 000 U/L)时,可以达到最高转化效率。随着细胞浓度的继续增加,转化效率也不再提高。
2.3 在5 L发酵罐上进行全细胞转化联产L-ABA与D-葡萄糖酸经过上述条件优化,最终反应条件为温度30 ℃,pH 7.5,曲拉通x-100浓度0.3% (V/V),湿菌体量为40 g/L,工程菌BL21-LTD与BL21-LDH/GDH配比为1:5,在0.1 mol/L的磷酸盐缓冲液中反应,反应体积为2 L,转速为200 r/min,采取分批补料,每小时添加L-苏氨酸15 g/L,D-葡萄糖23 g/L (8 h后逐渐减少补料量)。反应20 h后,反应体系中L-ABA浓度达141.6 g/L,D-葡萄糖酸浓度达269.7 g/L,底物转化率 > 99% (图 6)。
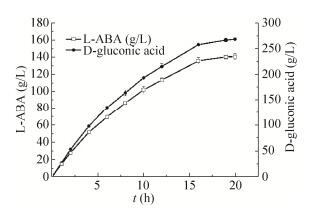 |
| 图 6 5 L发酵罐上进行全细胞转化联产L-ABA与D-葡萄糖酸 Figure 6 Whole-cell catalyst production of L-ABA and D-gluconic acid on 5 L fermenter. |
| 图选项 |
生物法合成L-ABA的同类工作见表 2,其中Tao等[13]同样利用LTD、LDH和GDH,以L-苏氨酸、D-葡萄糖为底物进行转化并完成辅酶循环,也获得了较高的产量(124.8 g/L),但其用细胞破碎液进行转化,并添加20 mg/L的NAD+,本研究使用全细胞进行转化,省去了细胞破碎工艺;另外,在一般生长条件下,大肠杆菌胞内NAD+和NADH的浓度大约为0.4 mmol/L[23-24],在此浓度下不需额外添加辅酶NAD+,并且获得更高的产量和得率。
表 2 生物合成L-ABA同类工作对比Table 2 Comparison between this work and other reported biosynthesis of L-ABA
| Source | Enzyme | Substrate/Co-substrate | Cofactor (mg/L) | Production of L-ABA (g/L) | Yield (%) | Productivity (g/(L·h)) |
| This study | LTD, LDH and GDH | L-threonine/D-glucose | 0 | 141.6 | 99 | 7.1 |
| Galkin et al [12] | LDH and FDH | 2-oxobutanoate/formic acid | 0 | 36.0 | 88 | 3.0 |
| Tao et al[13] | LTD, LDH and GDH | L-threonine/D-glucose | 20 (NAD+) | 124.8 | 93 | 8.3 |
| Tao et al[13] | LTD, LDH and FDH | L-threonine/formic acid | 30 (NAD+) | 100.2 | 97 | 6.9 |
表选项
由表 3可知,Tao等采用FDH以甲酸为底物进行辅因子循环生产L-ABA,其副产物是二氧化碳,其优点是产物分离方便;但是甲酸一般对酶具有较强的毒害作用,造成酶失活速率较快,从而造成生产延续性较差,L-ABA最大产量只有100 g/L,生产效率为6.9 g/(L?h),该结果显著低于本研究获得的结果(141.6 g/L,7.08 g/(L?h));另外,在工业化生产方面,以甲酸为原料需要建设防爆车间,可能会存在安全隐患和增加生产成本,不利于工业化生产。本研究采用GDH和葡萄糖进行辅因子循环生产L-ABA,同时获得共产物葡萄糖酸,虽然在分离提取方面会造成一定的困难,但是所添加底物葡萄糖对酶基本没有毒害作用,有利于生产的持续性,这也是本研究结果较为理想的重要原因,另外,葡萄糖酸本身是一种重要的原料,广泛利用于食品及医药行业,同时没有二氧化碳的产生,减少了工业化生产过程中对温室效益的危害。
3 结论本研究成功构建了一种基于脱氢酶的生物转化途径,并在大肠杆菌中偶联了NADH再生系统,共表达LDH与GDH,首次报道实现了全细胞转化L-苏氨酸、D-葡萄糖联产L-ABA与D-葡萄糖酸。通过优化转化条件,采用分批补料策略,164 g/L的L-苏氨酸和248 g/L的D-葡萄糖转化为141.6 g/L的L-ABA和269.4 g/L的D-葡萄糖酸,时空得率分别达到7.1 g/(L?h)和13.5 g/(L?h),得率超过99%。
尽管全细胞转化和酶法转化一样,都存在长时间使用下酶活性下降的问题,但在相同的条件下全细胞内的催化系统依旧比酶法更加稳定[24]。不仅如此,相比酶法转化需要额外添加昂贵的辅因子(NAD+、NADP+等),无需辅因子的全细胞系统在高产的同时更具价格吸引力[25],所以本研究构建的全细胞转化系统更适用于工业化生产。
参考文献
| [1] | Shin JS, Kim BG. Transaminase-catalyzed asymmetric synthesis of L-2-aminobutyric acid from achiral reactants.Biotechnol Lett, 2009, 31(10): 1595–1599.DOI: 10.1007/s10529-009-0057-7 |
| [2] | Park E, Kim M, Shin JS. One-pot conversion of L-threonine into L-homoalanine: biocatalytic production of an unnatural amino acid from a natural one.Adv Synth Catal, 2010, 352(18): 3391–3398.DOI: 10.1002/adsc.v352.18 |
| [3] | Seo YM, Mathew S, Bea HS, et al. Deracemization of unnatural amino acid: homoalanine using D-amino acid oxidase and ω-transaminase.Org Biomol Chem, 2012, 10(12): 2482–2485.DOI: 10.1039/c2ob07161d |
| [4] | Taylor PP, Pantaleone DP, Senkpeil RF, et al. Novel biosynthetic approaches to the production of unnatural amino acids using transaminases.Trends Biotechnol, 1998, 16(10): 412–418.DOI: 10.1016/S0167-7799(98)01240-2 |
| [5] | Zhao HM, van der Donk WA. Regeneration of cofactors for use in biocatalysis.Curr Opin Biotechnol, 2003, 14(6): 583–589.DOI: 10.1016/j.copbio.2003.09.007 |
| [6] | Chenault HK, Whitesides GM. Regeneration of nicotinamide cofactors for use in organic synthesis.Appl Biochem Biotechnol, 1987, 14(2): 147–197.DOI: 10.1007/BF02798431 |
| [7] | Geueke B, Riebel B, Hummel W. NADH oxidase from Lactobacillus brevis: a new catalyst for the regeneration of NAD.Enzyme Microb Technol, 2003, 32(2): 205–211.DOI: 10.1016/S0141-0229(02)00290-9 |
| [8] | Lv CQ, Jiang ZY, Wang J. Progress in regeneration of NAD(P) + and NAD(P)H.Chin J Org Chem, 2004, 24(11): 1366–1379.(in Chinese). 吕陈秋, 姜忠义, 王姣. 烟酰型辅酶NAD(P)~+和NAD(P)H再生的研究进展.有机化学, 2004, 24(11): 1366-1379.DOI:10.3321/j.issn:0253-2786.2004.11.005 |
| [9] | Zhou XY. Cloning and expression of a formate dehydrogenase in Escherchia coli cells and high cell density cultivation of the recombinant strain[D]. Hangzhou: Zhejiang University, 2008(in Chinese). 周小艳. 甲酸脱氢酶基因的克隆表达及重组菌的高密度培养[D]. 杭州: 浙江大学, 2008. |
| [10] | Inose K, Fujikawa M, Yamazaki T, et al. Cloning and expression of the gene encoding catalytic subunit of thermostable glucose dehydrogenase from Burkholderia cepacia, in Escherichia coli.Biochim Biophys Acta, 2003, 1645(2): 133–138.DOI: 10.1016/S1570-9639(02)00534-4 |
| [11] | XU JH, Yang LR, Sun ZH, et al. Rapid advancement of asymmetric biocaalysis technology.Chin J Bioprocess Eng, 2005, 3(3): 1–6.(in Chinese). 许建和, 杨立荣, 孙志浩, 等. 迅速发展中的不对称生物催化技术.生物加工过程, 2005, 3(3): 1-6. |
| [12] | Galkin A, Kulakova L, Yoshimura T, et al. Synthesis of optically active amino acids from α-keto acids with Escherichia coli cells expressing heterologous genes.Appl Environ Microbiol, 1997, 63(12): 4651–4656. |
| [13] | Tao RS, Jiang Y, Zhu FY, et al. A one-pot system for production of L-2-aminobutyric acid from L-threonine by L-threonine deaminase and a NADH-regeneration system based on L-leucine dehydrogenase and formate dehydrogenase.Biotechnol Lett, 2014, 36(4): 835–841.DOI: 10.1007/s10529-013-1424-y |
| [14] | Guo FH, Liu CJ. Progresses in the synthesis of gluconic acid.Chem Ind Eng, 2007, 24(2): 173–177.(in Chinese). 郭凤华, 刘昌俊. 葡萄糖酸合成方法研究进展.化学工业与工程, 2007, 24(2): 173-177. |
| [15] | Chen L, Chen Z, Zheng P, et al. Study and reengineering of the binding sites and allosteric regulation of biosynthetic threonine deaminase by isoleucine and valine in Escherichia coli.Appl Microbiol Biotechnol, 2013, 97(7): 2939–2949.DOI: 10.1007/s00253-012-4176-z |
| [16] | Stoyan T, Recktenwald A, Kula MR. Cloning, sequencing and overexpression of the leucine dehydrogenase gene from Bacillus cereus. J Biotechnol, 1997, 54(1): 77–80.DOI: 10.1016/S0168-1656(97)01670-2 |
| [17] | LampeL KA, Uratani B, Chaudhry CR, et al. Characterization of the developmentally regulated Bacillus subtilis glucose dehydrogenase gene.J Biotechnol, 1986, 166(1): 238–243. |
| [18] | Umbarger HE, Brown B. Threonine deamination in Escherichia coli. Ⅱ. Evidence for two L-threonine deaminases.J Bacteriol, 1957, 73(1): 105–112. |
| [19] | Ansorge MB, Kula MR. Production of recombinant L-leucine dehydrogenase from Bacillus cereus in pilot scale using the runaway replication system E. coli[pIET98]. Biotechnol Bioeng, 2000, 68(5): 557-562. |
| [20] | Fujita Y, Ramaley R, Freese E. Location and properties of glucose dehydrogenase in sporulating cells and spores of Bacillus subtilis. J Bacteriol, 1977, 132(1): 282–293. |
| [21] | Guillén M, Benaiges MD, Valero F. Biosynthesis of ethyl butyrate by immobilized recombinant Rhizopus oryzae lipase expressed in Pichia pastoris.Biochem Eng J, 2012, 65: 1–9.DOI: 10.1016/j.bej.2012.03.009 |
| [22] | Luo J. Cell permeabilized and it's application.Acta Microbiol Sin, 2001, 41(3): 386–389.(in Chinese). 罗杰. 细胞通透性的改变及其应用.微生物学报, 2001, 41(3): 386-389. |
| [23] | Walton AZ, Stewart JD. Understanding and improving NADPH-dependent reactions by nongrowing Escherichia coli cells.Biotechnol Prog, 2004, 20(2): 403–411. |
| [24] | Richter N, Neumann M, Liese A, et al. Characterization of a whole-cell catalyst co-expressing glycerol dehydrogenase and glucose dehydrogenase and its application in the synthesis of L-glyceraldehyde.Biotechnol Bioeng, 2010, 106(4): 541–552.DOI: 10.1002/bit.v106:4 |
| [25] | Gr?ger H, May O, Werner H, et al. A "second-generation process" for the synthesis of L-neopentylglycine: asymmetric reductive amination using a recombinant whole cell catalyst.Org Process Res Dev, 2006, 10(3): 666–669.DOI: 10.1021/op0501702 |
