
 , 吴蕾2, 郭慧2, 杨仕平1
, 吴蕾2, 郭慧2, 杨仕平1
 , 金庆辉1,2
, 金庆辉1,21 上海师范大学 生命与环境科学学院,上海 200234;
2 中国科学院上海微系统与信息技术研究所 传感技术联合国家重点实验室,上海 200050
收稿日期:2016-08-10;接收日期:2016-11-21; 网络出版时间:2016-12-1 基金项目:国家重点基础研究计划(973计划) (No. 2012CB933303),国家自然科学基金(Nos. 81472751,81470875),中科院装备研制项目(No.YZ201337),上海市自然科学基金(No. 15ZR1447000),江苏省生物材料与器件重点实验室开放研究基金(No. LBMD201401) 资助
摘要: 设计一种具有“微坝”和“微缝”结构的微流控芯片,能够物理隔离不同细胞,而且培养基中小分子营养物质可以自由流通。实验结果表明在芯片上可以共培养人肺腺癌细胞(A549)、人胚肺成纤维细胞(HLF-1) 和人内皮细胞(HUVECs) 三种细胞,在72 h培养后三种细胞生长状态良好,具有细胞图形化的特点和功能,为下一步开展多种细胞相互作用等相关研究提供重要的技术平台。
关键词: 细胞共培养 微流控芯片 微坝和微缝结构
Design and fabrication of a microfluidic chip for the co-culture of three cell types
Shuaichao Wang1,2, Yuqing Ge2

 , Lei Wu2, Hui Guo2, Shiping Yang1
, Lei Wu2, Hui Guo2, Shiping Yang1
 , Qinghui Jin1,2
, Qinghui Jin1,2 1 College of Life and Environmental Sciences, Shanghai Normal University, Shanghai 200234, China;
2 State Key Laboratories of Transducer Technology, Shanghai Institute of Microsystem and Information Technology, Chinese Academy of Sciences, Shanghai 200050, China
Received: August 10, 2016; Accepted: November 21, 2016; Published: December 1, 2016
Supported by: National Basic Research Program of China (973 Program) (No. 2012CB933303), National Natural Science Foundation of China (Nos. 81472751, 81470875), the Instrument Developing Project of the Chinese Academy of Sciences (No. YZ201337), the Science and Technology Commission of Shanghai Municipality (No. 15ZR1447000), Jiangsu Key Laboratory for Biomaterials and Devices (No. LBMD201401)
Corresponding authors:Yuqing Ge. Tel: +86-21-62511070-8703; E-mail: Yqge@mail.sim.ac.cn
Shiping Yang. Tel: +86-21-64322281; E-mail: shipingy@shnu.edu.cn
Abstract: Here a microfluidic chip with 'micro-dam' and 'micro-gap' has been designed and fabricated. It could isolate different cells and flow of medium in each region. It was found that the chip could realize the cells co-culture and patterning of human lung adenocarcinoma cell (A549), human embryonic lung fibroblast (HLF-1) and human endothelial cells (HUVECs), respectively. After 72 hours of culture, three kinds of cells grew well. It provided a developing technical platform for cell related research.
Key words: co-culture of cell microfluidic chip micro dam and micro gap
1 方法1.1 微通道内流体力学分析在流体力学中,流体流态一般用雷诺数[9](Re) 表示:
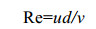 |
 |
| 图 1 芯片内部微通道流体流向三维示意图 Figure 1 Three dimensional schematic diagrams of the liquid flow inside the chip channel. (A) and (C) show the channel with and without culture medium respectively. (B) and (D) indicate the micro-dam and micro-gap respectively. |
| 图选项 |
1.2 细胞共培养微结构的设计及芯片工作原理本设计中,要求微流控芯片能够有效在特定位点“截留”细胞。通过在对应区域设计“微坝”结构拦截不同种类细胞而不互相混杂,从而实现不同细胞间的物理隔离。通过不足10 μm的微缝隙拦截到直径大于10 μm的细胞个体。细胞尺寸量级在10-100 μm[9],与光刻胶厚度量级契合,在尺度上可与微流控芯片良好结合,可通过控制涂胶厚度实现不同大小的细胞的实验研究需求。图 2为微流控芯片单元设计示意图,图A为微通道剖面图,示意含有细胞的培养液流经聚二甲基硅氧烷[10](PDMS) 与玻璃基底之间的通道,可较好地被微通道内部突起的C型拦截坝截留;微缝宽度不到10 μm,可拦截细胞;图B表明细胞能够停留在目标区域,即C型拦截坝。由于微缝的作用,培养基中小分子营养物质可以自由流通,实现各个区域细胞的独立培养。
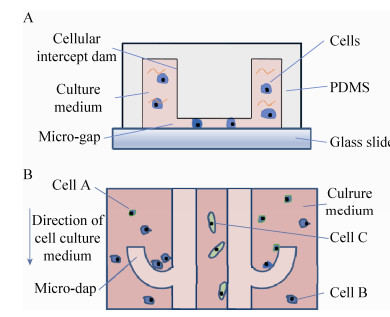 |
| 图 2 芯片结构示意图 Figure 2 Schematic diagrams of chip structure. (A) Side view. (B) Top view. |
| 图选项 |
2 微流控芯片2.1 微流控芯片的制作方法采用piranha清洗[11]方法(浓硫酸和过氧化氢比例为7:3) 对硅片表面进行清洁处理。根据设计要求将涂覆有SU8光刻胶的硅片置于甩胶机上,分预甩和甩胶两步,在其表面旋涂致密均匀的既定厚度的胶膜;采用热板加热的方式来对硅片进行前烘处理,前烘是为了去除胶体中适量溶剂,增强光刻胶的粘黏性[12]。采用直接接触式曝光,根据胶膜厚度不同选择相应的曝光时间,确保掩膜板的光面与硅基衬底紧密贴合,这一过程可将掩膜板上的图形转移到硅片上。后烘可促进光刻胶内部化学反应的进行,从而使其部分区域交联[13];将后烘过的硅片放置于盛有丙二醇甲醚醋酸酯溶液(PGMEA) 中进行显影反应,可将硅片放入异丙醇溶液中,如果没有出现白膜则说明反应已完全[14]。然后用去离子水洗净,N2吹干。为了降低硅基模具表面亲和性,便于后续工艺脱模,将硅片放置在含有少量氟硅烷溶液的真空干燥器中,于通风橱中抽真空后,静置过夜后得到芯片模具。其制备工艺流程如图 3所示。将PDMS与固化剂按10:1(重量比) 混合均匀,于真空干燥器抽真空至气泡完全消失,在水平台面上浇注PDMS,置于热板85 ℃烘焙30 min,自然冷却至室温,小心从衬底上剥离,打孔切片后备用。将制备好的PDMS芯片与1 mm载玻片表面进行等离子处理[15],然后键合得到微流控芯片。
 |
| 图 3 微流控芯片制备工艺 Figure 3 Preparation process of the microfluidic chip. |
| 图选项 |
2.2 微流控芯片相关表征芯片内部通道的连通性,使用红色染料灌注测试,如图 4A所示,微通道内部高低错落,结构分明,图 4B中可以看出,通道内部的深红色表明主流流经区域,而通道之间的浅红色部分表明各通道相应区域本质“连通”。连通的液体可为物理隔离的各种细胞提供生长所需的营养物质,维持其生命活动。其中细胞培养单元中细胞拦截区域即“C型坝”半径为90 μm,“坝高”约为42 μm,微通道宽度为80 μm,高约50 μm。
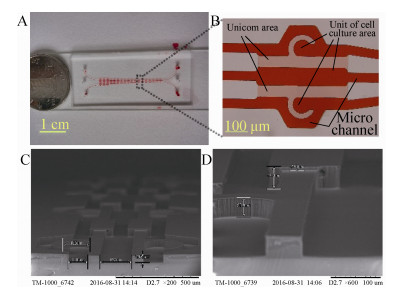 |
| 图 4 细胞芯片图像(A:实物图;B:单元光学图;C和D:SEM图像) Figure 4 Images of cell chip. (A) Photograph of the integrated chip. (B) Photograph of cell culture chamber. (C-D) SEM of cell culture chamber. |
| 图选项 |
3 基于微流控平台的细胞共培养3.1 前处理对于微流控芯片,其前处理主要目的是在芯片内部营造适宜细胞生长、繁殖的微环境,步骤主要包括:灭菌及孵育[16]。将芯片在75%乙醇溶液中浸泡1 h,抽真空处理,置于紫外灯下光照灭菌。使用注射泵以一定流速向芯片内部通道注入完全培养基,于CO2培养箱孵育过夜。
3.2 细胞导入和培养本实验采用人胚肺成纤维细胞(HFL1,中国科学院上海细胞库)、人肺腺癌细胞(A549,中国科学院上海细胞库)、人脐静脉内皮细胞(HUVECs,ATCC) 三种细胞共培养,共培养培养基采用DMEM细胞培养基(10%胎牛血清、0.1%链青双抗),培养温度设定37.0 ℃,CO2浓度为5%。
将培养皿中已贴壁细胞进行消化,离心后重悬,得到适宜浓度的细胞重悬液(浓度约1×106cells/mL);采用注射泵正压注入的方法向经前处理的芯片中导入细胞,由于细胞悬液长时间放置很容易产生细胞聚沉,造成细胞进样的不稳定及不连续性。通过多次进行实验探究,将导入过程控制在10 min以内较有利于实验进行;同时通过对实验过程中芯片内部各区域的观察,也确定了细胞悬液进样速率与区域分布的关系,如表 1所示。将进样速率控制在0.3-0.8 mL/h既能够使细胞充分填布相应拦截区域,又不至于通道内部流速过大将其“冲走”。图 5A中流速0.2 mL/h,为过填充,图 5B流速0.5 mL/h,为理想填充,图 5C流速1.2 mL/h,表明细胞溢出相应区域。
表 1 细胞悬液进样流速控制Table 1 Effects of cell loading with various velocities
| Serial number | Velocity setting (mL/h) | Phenomenon and effect |
| 1 | 0.2 | Too much congestion inside the initial region |
| 2 | 0.5 | Good dispersion, the end part of the filling deficiencies |
| 3 | > 1.0 | More disorderly, and rushed out of the block area easily |
表选项
 |
| 图 5 不同流速控制下细胞进样图像 Figure 5 The images of cell loading with controlled flow rates. (A) 0.2 mL/h. (B) 0.5 mL/h. (C) 1.2 mL/h. |
| 图选项 |
4 结果与分析基于微流控平台的芯片制备,结合本实验室相关制备条件参数,经过清洗、烘干、涂胶、甩胶、前烘、曝光、后烘、显影和坚膜等一系列工艺步骤之后,得到硅基芯片模具。通过在模具上浇注PDMS,热烘固化后使用等离子清洗机对PDMS和玻璃载玻片进行表面处理后即为不可逆键合,最终得到一批较为良好的微流控细胞共培养芯片。对所得微流控芯片进行相应生物学处理,主要目的在于灭菌,使其内部通道微环境适于细胞生长增殖。在细胞悬液灌注过程中,可明显看到微通道内部分细胞依次停留在“微坝”区域,且排列紧凑(图 6),具有细胞构图的功能。在导入细胞悬液后,经过一定时间(不同细胞贴壁时间有所差异),细胞贴壁生长。细胞贴壁后,其形态发生变化,表现出增殖、迁移等行为。将HUVECs、HFL-1及A549共培养于微流控芯片中,细胞生长状况良好(图 7,8)。
 |
| 图 6 细胞导入过程图 Figure 6 The cell loading process. A-I show the images of cell distribution within 1 minute. |
| 图选项 |
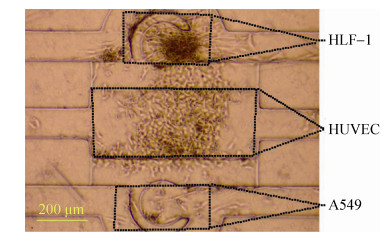 |
| 图 7 三种细胞在芯片腔体内共培养(24 h) Figure 7 Co-culture of three cell types in the chamber (24 h). |
| 图选项 |
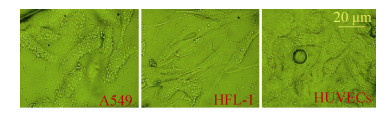 |
| 图 8 在芯片腔体内各细胞形态图(24 h) Figure 8 The morphology of three cell types in the chamber (24 h). |
| 图选项 |
本文基于微流控制作平台,通过软光刻技术,制备一批用于细胞共培养的微流控芯片。Chung等[17]通过在微芯片内部放置凝胶物质,探究了共培养环境下细胞向凝胶内部迁移行为。Patel等[18]通过设计灌注有聚乙二醇的中间通道验证两侧微腔室内相关癌细胞旁分泌相互作用。本文中具有“微坝”结构连通区域的芯片可起到在特定区域拦截细胞的作用;通过设计“微坝”及“微缝”位置及结构,实现无内置凝胶状态下,同一空间特定位置培养特定细胞层,有效避免细胞共培养中无序混合,掺杂生长等问题。在此基础上,我们将进一步探究各种类细胞间相互作用,连续、动态、实时观察其相互作用后的形态学变化。本研究为共培养过程中细胞迁移及相互作用、肿瘤微环境模拟提供一种新的有效实验思路,而且也可为后续开展药物筛选、新药研发提供支持。
参考文献
| [1] | Zhuang QC, Ning RZ, Ma Y, et al. Recent development in microfluidic chips for in vitro cell-based research.Chin J Anal Chem, 2016, 44(4): 522–532.(in Chinese). 庄琪琛, 宁芮之, 麻远, 等. 微流控技术应用于细胞分析的研究进展.分析化学, 2016, 44(4): 522-532.DOI:10.1016/S1872-2040(16)60919-2 |
| [2] | Zheng FY, Fu FF, Cheng Y, et al. Organ-on-a-chip systems: microengineering to biomimic living systems.Small, 2016, 12(17): 2253–2282.DOI: 10.1002/smll.201503208 |
| [3] | Kim L, Toh YC, Voldman J, et al. A practical guide to microfluidic perfusion culture of adherent mammalian cells.Lab Chip, 2007, 7(6): 681–694.DOI: 10.1039/b704602b |
| [4] | Cheng XH, Irimia D, Dixon M, et al. A microfluidic device for practical label-free CD4+ T cell counting of HIV-infected subjects.Lab Chip, 2007, 7(2): 170–178.DOI: 10.1039/B612966H |
| [5] | Zhou Q, Patel D, Kwa T, et al. Liver injury-on-a-chip: microfluidic co-cultures with integrated biosensors for monitoring liver cell signaling during injury.Lab Chip, 2015, 15(23): 4467–4478.DOI: 10.1039/C5LC00874C |
| [6] | Harper J, Sainson RCA. Regulation of the anti-tumour immune response by cancer-associated fibroblasts.Semin Cancer Biol, 2014, 25: 69–77.DOI: 10.1016/j.semcancer.2013.12.005 |
| [7] | Folkman J. Tumor angiogenesis: therapeutic implications.N Engl J Med, 1971, 285(21): 1182–1186.DOI: 10.1056/NEJM197111182852108 |
| [8] | Kane BJ, Zinner MJ, Yarmush ML, et al. Liver-specific functional studies in a microfluidic array of primary mammalian hepatocytes.Anal Chem, 2006, 78(13): 4291–4298.DOI: 10.1021/ac051856v |
| [9] | Tian WC, Finehout E. Microfluidics for Biological Applications.New York: Springer-Verlag, 1988. |
| [10] | Li L, Zhang YO, Ye DT. Cell cultures on a PDMS-glass microfluidic chip.J Tsinghua Univ: Nat Sci Ed, 2010, 50(3): 458–461.(in Chinese). 李雷, 张雅鸥, 叶大田. 在PDMS-玻璃微流控芯片上的细胞培养.清华大学学报:自然科学版, 2010, 50(3): 458-461. |
| [11] | Liu CJ, Zhao Q, Liu CX, et al. Theory and method of silicon wafer cleaning.Semicond Inform, 2000, 37(2): 30–36.(in Chinese). 刘传军, 赵权, 刘春香, 等. 硅片清洗原理与方法综述.半导体情报, 2000, 37(2): 30-36. |
| [12] | Zhang LG, Chen D, Yang F, et al. Research on SU-8 resist photolithography process.Opt Precis Eng, 2002, 10(3): 266–270.(in Chinese). 张立国, 陈迪, 杨帆, 等. SU-8胶光刻工艺研究.光学精密工程, 2002, 10(3): 266-270. |
| [13] | Du LQ, Zhu SM, Yu LC. Effect of post exposure bake temperature on thermal swelling and internal stress of SU-8 photoresist.Opt Precis Eng, 2008, 16(3): 500–504.(in Chinese). 杜立群, 朱神渺, 喻立川. 后烘温度对SU-8光刻胶热溶胀性及内应力的影响.光学精密工程, 2008, 16(3): 500-504. |
| [14] | San-Miguel A, Lu H. Microfluidics as a tool for C. elegans research.WormBook, 2013, 24: 1–19. |
| [15] | Duffy DC, McDonald JC, Schueller OJA, et al. Rapid prototyping of microfluidic systems in poly (dimethylsiloxane).Anal Chem, 1998, 70(23): 4974–4984.DOI: 10.1021/ac980656z |
| [16] | Shao JB, Wu L, Wu JZ, et al. A microfluidic chip for permeability assays of endothelial monolayer.Biomed Microdevices, 2010, 12(1): 81–88.DOI: 10.1007/s10544-009-9362-0 |
| [17] | Chung S, Sudo R, Mack PJ, et al. Cell migration into scaffolds under co-culture conditions in a microfluidic platform.Lab Chip, 2009, 9(2): 269–275.DOI: 10.1039/B807585A |
| [18] | Patel D, Gao YD, Son K, et al. Microfluidic co-cultures with hydrogel-based ligand trap to study paracrine signals giving rise to cancer drug resistance.Lab Chip, 2015, 15(24): 4614–4624.DOI: 10.1039/C5LC00948K |
