
 , 宋凯1, 王姣2, 位曙光1, 赵朋1, 赵萍1
, 宋凯1, 王姣2, 位曙光1, 赵朋1, 赵萍11 西南大学 家蚕基因组生物学国家重点实验室,重庆 400715;
2 西南大学 生物技术学院,重庆 400715
收稿日期:2017-02-14;接收日期:2017-05-31; 网络出版时间:2017-09-14 基金项目:国家自然科学基金(Nos. 31402139, 31572465),国家自然科学基金重点项目(No. 31530071),重庆市基础科学与前沿技术研究专项(Nos. cstc2015jcyjA00040, cstc2015jcyjBX0035),中央高校基本科研业务费(No. XDJK2013A019),西南大学博士基金(No. SWU112111)资助
摘要:蛋白酪氨酸磷酸酶(Protein tyrosine phosphatase, PTP, EC 3.1.3.48)特异性地催化去除磷酸化修饰的酪氨酸残基上的磷酸基团,导致蛋白去磷酸化,从而调控了细胞生长、增殖、分化和免疫等生命活动。家蚕Bombyx mori蛋白酪氨酸磷酸酶h (BmPTP-h)参与了核型多角体病毒(Nucleopolyhedrovirus,NPV)在家蚕体内的复制过程,但目前对于BmPTP-h结构和性质的了解并不多。本文从家蚕中肠克隆了BmPTP-h基因编码序列,分析了BmPTP-h的基因组结构、mRNA结构、序列特征、二级结构和溶液中的状态。同源氨基酸序列比对分析表明BmPTP-h与多种昆虫NPV的PTP序列具有高相似度,暗示了它们可能具有共同的起源和相似的功能。文中构建了原核表达载体,通过大肠杆菌在25 ℃下表达获得了可溶性的重组BmPTP-h,利用Ni-NTA亲和层析纯化了BmPTP-h。凝胶过滤分析显示BmPTP-h在溶液中可以形成聚集体和单体。圆二色光谱分析显示重组的BmPTP-h包含α螺旋结构,升高温度导致BmPTP-h的α螺旋结构去折叠,α螺旋结构含量下降。这些研究为深入研究BmPTP-h的结构和调控机理提供了基础。
关键词:家蚕 蛋白酪氨酸磷酸酶 克隆 表达纯化 结构
Cloning, expression, purification and structure analysis of protein tyrosine phosphatase of Bombyx mori
Huawei He1,2, Yejing Wang1,2

 , Kai Song1, Jiao Wang2, Shuguang Wei1, Peng Zhao1, Ping Zhao1
, Kai Song1, Jiao Wang2, Shuguang Wei1, Peng Zhao1, Ping Zhao1 1 State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400715, China;
2 College of Biotechnology, Southwest University, Chongqing 400715, China
Received: February 14, 2017; Accepted: May 31, 2017; Published: September 14, 2017
Supported by: National Natural Science Foundation of China (Nos. 31402139, 31572465), State Key Program of National Natural Science of China (No. 31530071), Chongqing Research Program of Basic Research and Frontier Technology (Nos. cstc2015jcyjA00040, cstc2015jcyjBX0035), Fundamental Research Funds for the Central Universities (No. XDJK2013A019), Start-up Grant from Southwest University (No. SWU112111)
Corresponding author:Yejing Wang. Tel: +86-23-68251575; E-mail: yjwang@swu.edu.cn
Abstract: Protein tyrosine phosphatase (PTP, EC 3.1.3.48) specifically catalyzes the removal of phosphate groups from phosphorylated tyrosine residues, resulting in protein dephosphorylation, thus regulates life activities such as cell growth, proliferation, differentiation and immunization. Protein tyrosine phosphatase h of Bombyx mori (BmPTP-h) is involved in the replication of nucleopolyhedrovirus (NPV) in Bombyx mori, but the structure and properties of BmPTP-h are little known so far. In this study, the coding sequence of BmPTP-h gene was cloned from the midgut of Bombyx mori, and its genomic structure, mRNA structure, sequence signature, secondary structure and the state in solution were analyzed. Homologous amino acid sequences alignment analysis indicated that BmPTP-h had a high similarity to PTP sequences of numbers of insect NPVs, implying that they may have a common ancestor and similar function. We constructed a prokaryotic expression vector, expressed and obtained the soluble recombinant BmPTP-h in Escherichia coli at 25 ℃, and purified BmPTP-h using Ni-NTA affinity chromatography. Gel filtration analysis showed that BmPTP-h was able to form aggregate and monomer in solution. Circular dichroism spectroscopy analysis showed that the recombinant BmPTP-h contained α-helix structure. Increasing temperature resulted in the unfolding of the α-helix structure of BmPTP-h and the decrease of the α-helix structure content of BmPTP-h. These studies provide a basis to better study the structure and regulation mechanism of BmPTP-h.
Key words: Bombyx mori protein tyrosine phosphatase cloning expression and purification structure
蛋白质的磷酸化与去磷酸化反应是生物体内最重要的生化反应之一,在调控细胞生长、增殖、分化和免疫等方面发挥着至关重要的作用[1-4]。磷酸化主要由蛋白激酶介导,去磷酸化是通过蛋白磷酸酶来实现。蛋白酪氨酸磷酸酶(Protein tyrosine phosphatase,PTP,EC 3.1.3.48)是一类超家族磷酸酶,通过特异性地催化去除磷酸化修饰的酪氨酸残基上的磷酸基团来改变其磷酸化状态,从而实现对细胞功能的调控[4]。PTPs通常分为3大类:特异性PTPs、双特异性PTPs和低分子量PTPs。特异性和低分子量PTPs的底物是含有酪氨酸的蛋白,而双特异性PTPs的底物除了含有酪氨酸的蛋白,还可以是含有丝氨酸和苏氨酸的蛋白。双特异性PTPs包括促分裂素原活化蛋白激酶磷酸酶、细胞分裂周期蛋白Cdc25和肿瘤抑制因子PTEN等[5]。尽管氨基酸序列和底物各不相同,大多数的PTPs都具有一个保守的结构模体(Motif) (H/V)C(X)R(S/T)。该结构模体对PTP的催化活性具有关键作用[6]。PTPs功能异常与多种疾病相关,包括Ⅱ型糖尿病、癌症、免疫功能紊乱等[2, 4, 7-8],如PTEN基因突变可以导致脑癌、胸癌和前列腺癌等癌症的发生[9]。PTP1B可以负调控胰岛素信号通路,有望作为治疗Ⅱ型糖尿病、胰岛素功能受阻和肥胖症的有效分子靶标[10]。因此,PTPs成为了当前药物研究的热点靶标之一。
PTPs普遍存在于动物、微生物和病毒中。在哺乳动物中,PTPs因其重要的功能引起了广泛的关注,然而昆虫PTPs的研究相对关注度则较低。1998年,Takagi等首次发现苜蓿银纹夜蛾核型多角体病毒(Argyrogramma agnata nucleopolyhedrovirus,AaNPV)编码的PTP不仅具有去磷酸酶活性,还具有RNA加帽酶活性[11]。随后的研究发现病毒编码的PTP在病毒侵染昆虫细胞的过程中发挥重要作用。例如一个来自烟草夜蛾Heliothis assulta幼虫体内寄生物Toxoneuron nigriceps布拉卡病毒的PTP可能通过破坏宿主前胸腺组织中关键蛋白磷酸化平衡,从而影响了宿主的前胸腺功能[12];侧沟茧蜂Microplitis demolitor的布拉卡病毒入侵宿主后,其编码的PTP-H2和PTP-H3抑制了宿主免疫细胞的吞噬作用[13],PTP-H2还可以诱导宿主部分免疫应答相关细胞的凋亡,从而导致宿主免疫应答沉默[14];在甜菜夜蛾Spodoptera exigua的血细胞中瞬时表达菜蛾绒茧蜂Cotesia plutellae布拉卡病毒的PTP,发现其可以抑制宿主细胞免疫应答[15]。2005年,Kamita等发现家蚕NPV (BmNPV)编码的PTP可以增强被病毒感染的家蚕运动行为,敲除该基因后病毒在宿主细胞中的拷贝数明显下降。进一步研究发现家蚕细胞中存在一个与BmNPV编码的PTP同源的PTP (BmPTP-h),将BmPTP-h基因插入到BmNPV病毒中,可以部分恢复病毒感染导致的家蚕运动行为增强,推测BmNPV的PTP可能起源于其宿主家蚕,然后被选择性地保存于家蚕基因组中,从而有利于病毒的侵染和传播[16]。2016年,本实验室Wang等发现BmNPV病毒感染家蚕诱导了BmPTP-h在家蚕中的表达,通过RNAi和过表达证实了BmPTP-h可以促进BmNPV病毒在家蚕体内的复制[17]。
BmPTP-h在BmNPV病毒侵染家蚕的过程中发挥着重要作用,然而我们目前对BmPTP-h的结构和性质知之甚少。本文从家蚕中肠组织克隆获得了BmPTP-h基因,并将其构建到原核表达载体pSKB2进行表达,利用镍亲和层析的方法纯化获得了重组BmPTP-h蛋白。在此基础上,我们进一步分析了BmPTP-h的性质和结构,为深入理解其结构和调控机制提供了基础。
1 材料与方法1.1 材料和试剂实验所用家蚕品种为大造,由西南大学家蚕基因组生物学国家重点实验室家蚕基因资源库提供。5龄3天家蚕中肠组织cDNA由本实验室刘莉娜提供。原核表达载体pSKB2来自美国西南医学中心张学武教授实验室。pSKB2是基于pET-28a(+)载体改造而来,将pET-28a(+)中thrombin酶切位点替换为prescission酶切位点,其他保持不变。感受态细胞Trans1-T1和Trans BL21 (DE3)购自北京全式金生物技术有限公司。HiFi Taq DNA聚合酶购自Thermo Fisher Scientific公司,内切酶BamHⅠ和Hind Ⅲ购自New England Biolabs,T4 DNA连接酶购自TaKaRa公司。其他分子生物学试剂盒和试剂等购自生工生物工程(上海)股份有限公司。
1.2 序列和结构分析借助家蚕基因组数据库SilkDB (http://silkdb.org)和PubMed (http://www.ncbi.nlm.nih.gov/ pubmed/)分析家蚕BmPTP-h基因在家蚕基因组中的结构、mRNA组成和编码序列,利用Protparam工具(http://web.expasy.org/protparam/)分析BmPTP-h氨基酸组成、蛋白分子量、等电点和氨基酸疏水性,利用SMART (http://smart.embl-heidelberg.de/)预测其结构域,通过PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/)预测其二级结构和三级结构[18]。将BmPTP-h氨基酸序列提交BLAST进行氨基酸同源序列比对分析,然后利用Mega构建进化树比较不同物种的PTP之间的相似性[19]。
1.3 重组表达载体构建根据BmPTP-h基因的编码序列,利用Primer Premier设计引物,正、反向引物分别为5′-CGGGATCCATGCCTAAACTTCCCGAT-3′和5′-CCCAAGCTTTTAACGATACCTTCTTCTAGTTG-3′,其中下划线分别表示BamHⅠ和Hind Ⅲ的酶切位点。以5龄3天家蚕中肠组织cDNA为模板[20],通过PCR扩增获得BmPTP-h基因,进行1%琼脂糖凝胶电泳分析,将获得的DNA片段切胶,通过试剂盒纯化回收,将pSKB2载体与目的DNA片段分别利用BamHⅠ和Hind Ⅲ进行双酶切,再利用T4 DNA连接酶将二者连接构建重组载体。将连接产物转化Trans1-T1,并利用菌落PCR、双酶切和基因测序对重组载体进行验证。
1.4 蛋白表达根据本实验室之前的方案[6, 21-23],对BmPTP-h重组蛋白进行表达纯化。首先将测序验证后的重组质粒转化Trans BL21 (DE3)细胞,选择单菌落在37 ℃过夜培养,继续扩大培养至OD600约0.6-1.0,加入0.1 mmol/L IPTG在25 ℃下培养20 h诱导BmPTP-h表达,然后4 ℃、12 000 r/min离心20 min收集细胞,加入缓冲液(20 mmol/L Tris-HCl,pH 8.0,500 mmol/L氯化钠,10%甘油)悬浮细胞,冰浴超声破碎,然后于4 ℃下12 000 r/min离心20 min,分别收集细胞破碎后的上清和沉淀,进行SDS-PAGE分析。
1.5 蛋白纯化在25 ℃下大量诱导重组BmPTP-h蛋白表达,收集细胞,冰浴超声破碎,然后离心收集细胞破碎后的上清,过滤后在4 ℃下利用Ni-NTA亲和层析纯化。利用包含不同咪唑浓度的缓冲液分别洗脱,收集洗脱液,进行SDS-PAGE分析,然后选择较纯的BmPTP-h蛋白组分浓缩,利用HiPrep 26/10脱盐柱除去咪唑,收集脱盐后的蛋白溶液,浓缩后于-80 ℃冻存。
1.6 凝胶过滤分析将纯化的蛋白在4 ℃以12 000 r/min离心20 min,然后取上清0.5 mL载入Superdex 20010/300 GL凝胶层析柱进行凝胶过滤分析,流速0.5 mL/min,收集相应蛋白组分,进行SDS-PAGE分析。
1.7 二级结构分析将纯化的BmPTP-h蛋白通过超滤浓缩离心管置换到磷酸缓冲液PBS中,然后利用圆二色光谱仪MOS-500分析BmPTP-h蛋白的二级结构。测试温度设定为25 ℃,波谱扫描范围为190-250 nm,比色皿光程为1 cm,蛋白浓度为0.1 mg/mL,扫描速度为240 nm/min。
为分析温度对BmPTP-h蛋白二级结构的影响,从5 ℃逐渐升高温度到80 ℃,记录BmPTP-h蛋白在不同温度下的圆二色光谱。以222 nm处的椭圆度绝对值|θ222|代表BmPTP-h蛋白的α螺旋结构含量,然后对温度作图,分析温度对BmPTP-h蛋白α螺旋结构的影响。
2 结果与分析2.1 BmPTP-h基因克隆与分析以5龄3天家蚕中肠组织cDNA为模板,设计引物进行PCR扩增,获得长度约为639 bp的序列。将获得的DNA片段与pSKB2载体分别双酶切,然后连接,转化Trans1-T1细胞,分别利用菌落PCR (图 1A)和双酶切对构建的重组质粒进行验证,最后通过基因测序确认克隆构建成功。
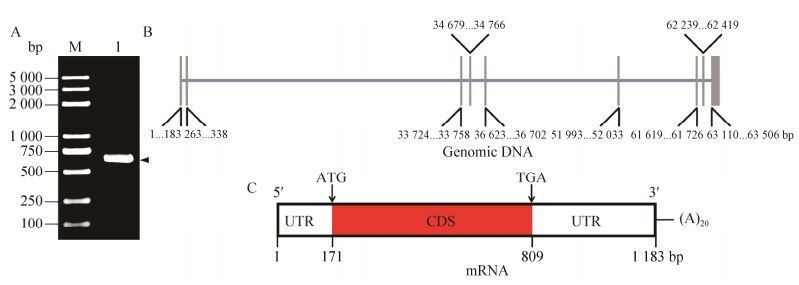 |
| 图 1 BmPTP-h基因克隆和分析(A:琼脂糖凝胶分析菌落PCR产物;B:BmPTP-h基因在基因组中的序列分析;C:BmPTP-h基因mRNA结构示意图) Figure 1 Cloning and analysis of BmPTP-h gene. (A) Agarose gel analysis of the product of colony PCR. M: DNA molecular standard; 1: the product of colony PCR. (B) Analysis of BmPTP-h gene sequences in the genomic. The length of horizontal line represents the length of the genomic sequence, the vertical blocks represent different length exons. (C) Diagram of the mRNA structure of BmPTP-h gene. ATG: start codon; TGA: stop codon; UTR: untranslated region; CDS: coding DNA sequence. |
| 图选项 |
BmPTP-h基因(GenBank登录号692515)全长63 506 bp,由9个外显子和8个内含子组成(图 1B)。mRNA全长1 203 bp,其中5′末端包含一段长170 bp的非翻译区序列(5′-UTR),3′末端包含一段长373 bp的非翻译区序列(3′-UTR)和一段由20个A组成的polyA加尾信号,中间为长639 bp的编码区序列(图 1C)。
2.2 BmPTP-h蛋白序列和结构分析BmPTP-h蛋白包含212个氨基酸残基,分子量为24.58 kDa,等电点为9.68。BmPTP-h蛋白中大多数氨基酸为亲水性氨基酸,其总体亲水性(Grand average of hydropathicity,GRAVY)平均值为-0.640 (图 2A)。SMART分析发现BmPTP-h蛋白主要由1个典型的双特异性磷酸酶(Dual specificity phosphatases,DSP)结构域(40-173位氨基酸)组成,C末端200-212位氨基酸残基为一段低复杂度区域(Low complexity region) (图 2B)。PubMed分析表明BmPTP-h属于蛋白酪氨酸磷酸酶超家族一员,其中第46-156位氨基酸残基组成了决定其酶学活性的催化结构域(Protein tyrosine phosphatase catalytic domain,PTPc) (图 2C)。二级结构和三级结构预测显示BmPTP-h蛋白由3个显著部分组成,其中N末端由两段长长的柔性无规则结构包裹一段短的β片层结构组成,C末端由一段长长的柔性无规则结构组成,中间是由多段α螺旋结构包裹一些短的β片层结构组成(图 2D-E)。
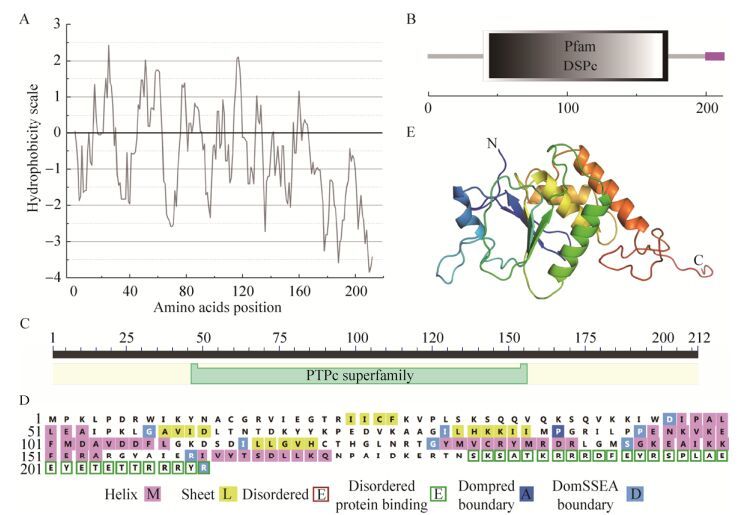 |
| 图 2 BmPTP-h蛋白序列和结构分析(A:氨基酸疏水性分析;B:结构域预测;C:保守结构域分析;D:预测BmPTP-h蛋白二级结构;E:预测BmPTP-h蛋白三级结构) Figure 2 Analysis of the sequences and structure of BmPTP-h protein. (A) Analysis of the hydrophobicity. (B) Domain prediction. (C) Analysis of the conserved domain. (D) Prediction of the secondary structures of BmPTP-h protein. (E) Prediction of the tertiary structure of BmPTP-h protein. |
| 图选项 |
2.3 BmPTP-h蛋白同源序列比对和系统发生分析以BmPTP-h氨基酸序列为模板进行BLAST分析,选取与BmPTP-h序列高度相似的PTP序列进行多序列比对分析,结果如图 3A所示。从图中可以看出,PTP包含两部分相对高度保守的区域:N末端区域(残基1-30,N30)和靠近C末端的区域(残基118-165,C48),其中N30与PTP催化功能结构域(残基46-156)没有关系,C48与PTP催化功能结构域密切相关。其实,PTP催化功能结构域在不同物种中相对保守,其中C48高度保守,表明C48可能对PTP发挥催化功能具有至关重要的作用。
选取30种与BmPTP-h序列同源的物种的PTP进行多序列比对分析,然后以此为基础构建系统发生树(图 3B)。结果显示,BmPTP-h与同为鳞翅目昆虫的棉铃虫Helicoverpa armigera PTP序列相似度最高,二者聚为一支。除此之外,BmPTP-h还与多种昆虫NPV编码的PTP序列高度相似,暗示了昆虫与NPV的PTP序列可能有着共同的起源和相似的功能。
 |
| 图 3 BmPTP-h与其他同源PTP蛋白的多序列比对和系统发生分析(A:多序列比对;B系统发生分析) Figure 3 Multiple sequences alignment and phylogenetic analysis of BmPTP-h and other homologous PTPs. (A) Multiple sequences alignment. (B) Phylogenetic analysis. |
| 图选项 |
2.4 BmPTP-h蛋白表达纯化将克隆的BmPTP-h基因与pSKB2载体连接,构建重组表达载体,如图 4A所示。经测序验证后,将重组载体转化Trans BL21 (DE3)细胞,在16 ℃、25 ℃和37 ℃下,分别加入0.1 mmol/L IPTG诱导重组蛋白BmPTP-h的表达,发现在16 ℃和37 ℃下,BmPTP-h在细胞裂解后上清中的表达量不如25 ℃下的表达量高,因此选择在25 ℃下加入0.1 mmol/L IPTG大量诱导目的蛋白表达。图 4B显示了BmPTP-h在Trans BL21 (DE3)细胞中在25 ℃下的表达情况。收集细胞,在4 ℃下通过Ni-NTA亲和层析柱纯化重组蛋白,分别利用包含50-500 mmol/L咪唑的缓冲溶液洗脱目的蛋白。SDS-PAGE结果显示,含有250和500 mmol/L咪唑的缓冲溶液洗脱下来的目的蛋白纯度超过了95% (图 4C,泳道7和8)。收集泳道7和8所对应的蛋白洗脱组分,脱盐后浓缩,于-80 ℃冻存。
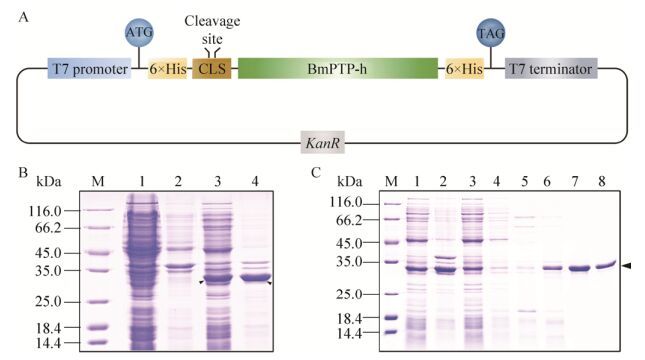 |
| 图 4 BmPTP-h表达纯化(A:BmPTP-h重组表达载体构建示意图;B:BmPTP-h在25 ℃下的表达分析;C:Ni-NTA亲和层析纯化BmPTP-h) Figure 4 Expression and purification of BmPTP-h. (A) Diagram of the recombinant expression vector of BmPTP-h. KanR: Kanamycin resistance gene. (B) Analysis of BmPTP-h expression at 25 ℃. M: protein molecular weight standard; 1: supernatant without induction; 2: pellet without induction; 3: supernatant with induction; 4: pellet with induction. The arrows indicate the locations of BmPTP-h. (C) Purification of BmPTP-h via Ni-NTA affinity chromatography. M: protein molecular weight standard; 1: supernatant; 2: pellet; 3: flow-through; 4-8: elutions of buffers with 0, 50, 100, 250 and 500 mmol/L imidazole. The arrow indicates the location of BmPTP-h. |
| 图选项 |
2.5 BmPTP-h蛋白溶液状态分析将纯化的BmPTP-h蛋白流经凝胶过滤层析柱,分析其在溶液中的折叠状态,结果如图 5A所示。凝胶过滤图谱显示了两个峰,SDS-PAGE分析表明第1个和第2个峰代表的都是重组BmPTP-h蛋白(图 5B)。根据凝胶过滤层析柱手册和图 5A中这2个峰的洗脱位置,可以推断出第1个峰代表的是BmPTP-h的聚集形式,第2个峰代表的是BmPTP-h的单体形式,分子量约为30 kDa,表明重组表达的BmPTP-h在溶液中部分形成了聚集体,部分以单体形式存在。比较两个峰的面积可以发现,BmPTP-h单体形式所占的比例大于其聚集体形式的比例。
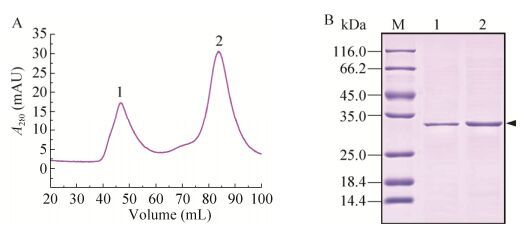 |
| 图 5 BmPTP-h溶液状态分析(A:凝胶过滤层析分析. 1和2分别表示紫外吸收峰的位置. B:SDS-PAGE分析. M:蛋白分子量标准;1和2分别表示图A中对应吸收峰的蛋白样品) Figure 5 Analysis of BmPTP-h state in solution. (A) Gel filtration analysis. 1 and 2 represent the locations of the UV absorption peak, respectively. (B) SDS-PAGE analysis. M: protein molecular weight standard; 1 and 2 represent the corresponding protein samples from the absorption peak in Figure A, respectively. |
| 图选项 |
2.6 BmPTP-h二级结构分析利用圆二色光谱分析BmPTP-h蛋白的二级结构,结果如图 6A所示。圆二色光谱图显示,在约208 nm和222 nm处有两个明显的负峰,这是α螺旋结构代表性的圆二色光谱峰形,表明纯化的重组BmPTP-h蛋白含有α螺旋结构。如果将BmPTP-h的圆二色光谱看作一定百分比含量的α螺旋、β-折叠和无规则卷曲构象的圆二色光谱的线性叠加,利用软件可以计算出BmPTP-h中α螺旋、β-折叠和无规则卷曲构象的百分比含量分别为24%、6%和70%。因此,BmPTP-h中大多数氨基酸残基形成了无规则卷曲结构,其次为α螺旋结构,只有极少数氨基酸残基形成了β-折叠结构。
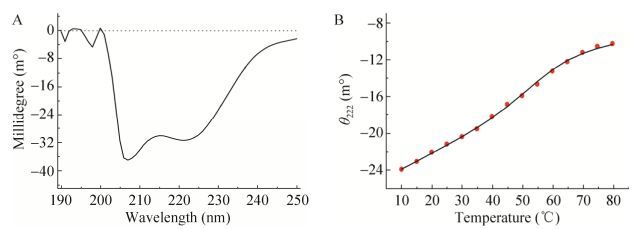 |
| 图 6 BmPTP-h二级结构及其热稳定性分析(A:圆二色光谱分析BmPTP-h二级结构;B:圆二色光谱分析温度对BmPTP-h α螺旋结构的影响) Figure 6 Analysis of the secondary structure and thermostability of BmPTP-h. (A) Analysis of the secondary structure of BmPTP-h by circular dichroism spectroscopy. (B) Analysis of the effects of temperature on the α-helix structures of BmPTP-h by circular dichroism spectroscopy. |
| 图选项 |
圆二色光谱中222 nm处的椭圆度绝对值(|θ222|)通常可以用来代表蛋白中α螺旋构象的含量。以θ222值对温度的变化作图,从而研究BmPTP-h中α螺旋结构的热稳定性,结果如图 6B所示。从图中可以看出,随着温度的升高,θ222绝对值从24逐渐下降到10,表明在温度的作用下,BmPTP-h蛋白的α螺旋结构逐渐去折叠解螺旋,从而导致α螺旋结构的含量逐渐下降。
3 讨论蛋白酪氨酸磷酸化与去磷酸化反应在调控生命活动的过程中发挥着极其重要的作用。PTP通过特异性地去磷酸化反应参与对生命活动的调控[4-7]。过去的研究表明,BmPTP-h参与了病毒入侵宿主细胞的免疫应答过程[16-17],但是这一过程的具体机制并不清楚。本文从家蚕中肠组织克隆了BmPTP-h基因,表达纯化了BmPTP-h蛋白,分析了其溶液状态和结构,为理解BmPTP-h的结构和生物学功能提供了基础。
序列分析显示,BmPTP-h蛋白等电点高达9.68。BmPTP-h的N末端和C末端富含碱性的精氨酸(R)和赖氨酸(K)残基,二者对其等电点具有较大贡献。除此之外,C末端还包含多个酸性的天冬氨酸(D)和谷氨酸(E)残基,以及数个极性氨基酸残基丝氨酸(S)、苏氨酸(T)和酪氨酸(Y)。结构预测分析表明,BmPTP-h的N末端和C末端形成了无规则卷曲结构,这些无规则结构中的带电荷氨基酸残基和极性氨基酸残基暴露于溶液中,彼此之间可能会发生相互作用,从而影响到蛋白质的表达和蛋白结构的稳定。本文研究发现,BmPTP-h在25 ℃下表达获得的可溶性蛋白含量较高。凝胶过滤分析显示纯化的蛋白部分形成了聚集体,表明BmPTP-h蛋白分子之间容易发生相互作用,影响蛋白的表达和结构稳定,这与之前序列和结构的分析结果一致。
圆二色光谱分析表明BmPTP-h中α螺旋、β-折叠和无规则卷曲构象的百分比含量分别为24%、6%和70%。二级结构预测显示,BmPTP-h蛋白α螺旋、β-折叠和无规则卷曲构象的百分比含量分别为25%、8%和67%。理论预测值与实验值比较一致,表明预测的BmPTP-h二级结构具有较高的可信度。典型β-折叠构象的圆二色光谱在215-220 nm之间会出现一个明显的负峰。然而我们并没有在BmPTP-h的圆二色光谱中发现该峰的存在,这可能是因为β-折叠构象在BmPTP-h中所占比例较低。无规则卷曲构象的圆二色光谱在220 nm附近会出现一个小而宽的正峰。在α螺旋和无规则卷曲构象都存在的情况下,圆二色光谱通常会显示出α螺旋构象的特征谱峰。比较而言,BmPTP-h的圆二色光谱中α螺旋构象的特征峰更加明显,因此我们选择了α螺旋构象特征峰之一的θ222绝对值来反映温度对BmPTP-h蛋白中α螺旋结构的影响。
二级结构分析表明BmPTP-h蛋白含有大量的无规则卷曲结构。三级结构预测BmPTP-h的N末端和C末端形成了无规则卷曲结构。在温度的作用下,BmPTP-h蛋白α螺旋结构含量逐渐减少,这可能是因为BmPTP-h中N末端和C末端暴露的无规则卷曲结构在温度的影响下,诱导了与其相邻的α螺旋结构逐渐发生去折叠从而解螺旋,暗示了这些无规则结构可能对BmPTP-h结构稳定性有重要影响。本实验室刘春利用基因芯片在家蚕后部丝腺中鉴定到一个特异表达的碱性螺旋-环-螺旋转录因子,将其命名为Bmsage。序列分析显示,Bmsage的N末端和C末端由富含带电荷氨基酸和极性氨基酸残基组成,形成了无规则卷曲结构,中间部分为螺旋-环-螺旋组成的DNA结合结构域。这样的结构特点与BmPTP-h较为相似。Bmsage在大肠杆菌中难以形成可溶性表达,在溶液中结构不稳定,易形成聚集体[24]。这些性质与BmPTP-h的性质比较类似,可能与Bmsage的N末端和C末端无规则卷曲结构相关。因此,去除BmPTP-h中N末端和C末端的无规则卷曲结构,可能会有助于BmPTP-h在大肠杆菌中的可溶性表达,并增加其结构的稳定性,但并不清楚这些结构对BmPTP-h的酶学活性和生物学功能是否会产生其他未知的影响,这是将来值得探究的研究内容。
Kamita等推断BmNPV的PTP起源于BmPTP-h,认为BmPTP-h参与了BmNPV病毒在宿主细胞中的复制[16]。氨基酸同源比对分析显示,BmPTP-h与多种昆虫NPV的PTP序列具有高度相似性,与BmNPV的PTP序列也具有较高相似性,暗示了这些PTPs可能具有共同的起源,并且发挥着相似的功能。关于昆虫PTPs与病毒PTPs的起源与功能等,仍然需要有更多的实验证据来揭示二者之间的关系。因此,研究BmPTP-h的结构和功能,对于揭示昆虫与病毒的互作和协同进化具有重要的研究意义和科学价值。
凝胶过滤层析分析表明,BmPTP-h在溶液中可以形成单体。圆二色光谱分析显示纯化的BmPTP-h包含有24%的α螺旋结构,与二级结构预测的结果比较一致。这些结果表明通过原核细胞表达纯化的BmPTP-h可以折叠形成一定的空间构象。结构域分析显示,BmPTP-h包含有典型的PTP催化结构域,可能具有蛋白酪氨酸磷酸酶催化活性。本实验室薛仁举从家蚕大造克隆了BmPTP-h基因。表达谱分析发现BmPTP-h基因从蚁蚕到蛾期都有表达,在家蚕所有组织中都表达,在5龄3天脂肪体中表达量最高。序列和结构分析表明,BmPTP-h属于双特异性蛋白酪氨酸磷酸酶亚家族。系统发生分析表明BmPTP-h与昆虫病毒PTP同源性较高,提示BmPTP-h可能与昆虫病毒PTP具有类似的功能[25],这些研究与我们的分析结果比较一致。他们构建了原核表达载体,但没有纯化获得蛋白,而是通过真核细胞表达获得了具有活性的BmPTP-h蛋白[17]。我们利用Wang等[6]建立的测活方法都没有检测到BmPTP-h的酶学活性,这可能是因为原核细胞表达的BmPTP-h缺乏真核细胞表达的蛋白翻译后修饰,这些修饰可能对酶活至关重要;或者是原核细胞表达的BmPTP-h在溶液中容易聚集而不易检测到活性;或者是测活方法不当导致无法检测到活性。酶学活性是一个酶最基本、最关键的性质之一,因此,尽快研究清楚无法检测到原核细胞表达的BmPTP-h酶学活性的原因是我们今后的研究工作首先需要解决的问题。
总之,建立快速准确地分析BmPTP-h酶学活性的方法,并利用该方法分析BmPTP-h的酶学性质如米氏常数Km、酶促反应的最适pH、最适温度、温度对BmPTP-h酶学活性的影响等,对于深入研究BmPTP-h的结构和功能尤为关键,这是我们今后需要继续努力的方向。尽管真核细胞可以表达获得具有活性的BmPTP-h蛋白[17],但真核细胞表达周期长,成本高,不利于大规模表达纯化获得目的蛋白。本文建立了BmPTP-h蛋白原核表达纯化的方法,为系统深入地研究BmPTP-h蛋白结构及其调控机理提供了基础。
参考文献
| [1] | Denu JM, Dixon JE. Protein tyrosine phosphatases: mechanisms of catalysis and regulation.Curr Opin Chem Biol, 1998, 2(5): 633–641.DOI: 10.1016/S1367-5931(98)80095-1 |
| [2] | Paul S, Lombroso PJ. Receptor and nonreceptor protein tyrosine phosphatases in the nervous system.Cell Mol Life Sci, 2003, 60(11): 2465–2482.DOI: 10.1007/s00018-003-3123-7 |
| [3] | Mustelin T, Vang T, Bottini N. Protein tyrosine phosphatases and the immune response.Nat Rev Immunol, 2005, 5(1): 43–57.DOI: 10.1038/nri1530 |
| [4] | Tonks NK. Protein tyrosine phosphatases: from genes, to function, to disease.Nat Rev Mol Cell Biol, 2006, 7(11): 833–846. |
| [5] | Alonso A, Pulido R. The extended human ptpome: a growing tyrosine phosphatase family.FEBS J, 2016, 283(8): 1404–1429.DOI: 10.1111/febs.13600 |
| [6] | Wang YJ, He HW, Liu LN, et al. Inactivation and unfolding of protein tyrosine phosphatase from Thermus thermophilus hb27 during urea and guanidine hydrochloride denaturation.PLoS ONE, 2014, 9(9): e107932.DOI: 10.1371/journal.pone.0107932 |
| [7] | Hendriks WJAJ, Elson A, Harroch S, et al. Protein tyrosine phosphatases in health and disease.FEBS J, 2013, 280(2): 708–730.DOI: 10.1111/febs.2013.280.issue-2 |
| [8] | Tsou RC, Bence KK. Central regulation of metabolism by protein tyrosine phosphatases.Front Neurosci, 2013, 6: 192. |
| [9] | Di Cristofano A, Pandolfi PP. The multiple roles of PTEN in tumor suppression.Cell, 2000, 100(4): 387–390.DOI: 10.1016/S0092-8674(00)80674-1 |
| [10] | Zachar M, Dorsey A, Mckinney T, et al. PTP1b inhibitors for type 2 diabetes treatment.FASEB J, 2016, 30(1 Suppl.1): lb144. |
| [11] | Takagi T, Taylor GS, Kusakabe T, et al. A protein tyrosine phosphatase-like protein from baculovirus has RNA 5′-triphosphatase and diphosphatase activities.Proc Natl Acad Sci USA, 1998, 95(17): 9808–9812.DOI: 10.1073/pnas.95.17.9808 |
| [12] | Falabella P, Caccialupi P, Varricchio P, et al. Protein tyrosine phosphatases of Toxoneuron nigriceps bracovirus as potential disrupters of host prothoracic gland function.Arch Insect Biochem Physiol, 2006, 61(3): 157–169.DOI: 10.1002/(ISSN)1520-6327 |
| [13] | Pruijssers AJ, Strand MR. PTP-H2 and PTP-H3 from Microplitis demolitor bracovirus localize to focal adhesions and are antiphagocytic in insect immune cells.J Virol, 2007, 81(3): 1209–1219.DOI: 10.1128/JVI.02189-06 |
| [14] | Suderman RJ, Pruijssers AJ, Strand MR. Protein tyrosine phosphatase-H2 from a polydnavirus induces apoptosis of insect cells.J Gen Virol, 2008, 89(6): 1411–1420.DOI: 10.1099/vir.0.2008/000307-0 |
| [15] | Ibrahim AMA, Kim Y. Transient expression of protein tyrosine phosphatases encoded in Cotesia plutellae bracovirus inhibits insect cellular immune responses.Naturwissenschaften, 2008, 95(1): 25–32. |
| [16] | Kamita SG, Nagasaka K, Chua JW, et al. A baculovirus-encoded protein tyrosine phosphatase gene induces enhanced locomotory activity in a lepidopteran host.Proc Natl Acad Sci USA, 2005, 102(7): 2584–2589.DOI: 10.1073/pnas.0409457102 |
| [17] | Wang F, Xue RJ, Li XY, et al. Characterization of a protein tyrosine phosphatase as a host factor promoting baculovirus replication in silkworm, Bombyx mori.Dev Comp Immunol, 2016, 57: 31–37.DOI: 10.1016/j.dci.2015.12.002 |
| [18] | Buchan DWA, Minneci F, Nugent TCO, et al. Scalable web services for the psipred protein analysis workbench.Nucleic Acids Res, 2013, 41(W1): W349–W357.DOI: 10.1093/nar/gkt381 |
| [19] | Kumar S, Stecher G, Tamura K. MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets.Mol Biol Evol, 2016, 33(7): 1870–1874.DOI: 10.1093/molbev/msw054 |
| [20] | Suetsugu Y, Futahashi R, Kanamori H, et al. Large scale full-length cDNA sequencing reveals a unique genomic landscape in a lepidopteran model insect, Bombyx mori.G3 (Bethesda), 2013, 3(9): 1481–1492.DOI: 10.1534/g3.113.006239 |
| [21] | Liu LN, Wang YJ, Li Y, et al. LBD1 of vitellogenin receptor specifically binds to the female-specific storage protein sp1 via LBR1 and LBR3.PLoS ONE, 2016, 11(9): e0162317.DOI: 10.1371/journal.pone.0162317 |
| [22] | Wang YJ, Liu LN, Gao CY, et al. Gene cloning, sequence structrue, expression pattern and subcelluar localization of silk gland factor SGF-1 of Bombyx mori.Sci Sericult, 2016, 42(2): 219–227.(in Chinese). 王叶菁, 刘莉娜, 高春雁, 等. 家蚕丝腺因子SGF-1的基因克隆及序列结构和表达特征与亚细胞定位.蚕业科学, 2016, 42(2): 219-227. |
| [23] | Zhao P, Wang YJ, Wei SG, et al. Interaction of bHLH transcription factor bmdimm and bmchip in Bombyx mori.Sci Agric Sin, 2016, 49(10): 2027–2038.(in Chinese). 赵朋, 王叶菁, 位曙光, 等. 家蚕bHLH转录因子Bmdimm与Bmchip的相互作用.中国农业科学, 2016, 49(10): 2027-2038.DOI:10.3864/j.issn.0578-1752.2016.10.018 |
| [24] | He HW, Wei SG, Wang YJ, et al. Soluble expression, purification and structural analysis of the bHLH transcription factor Bmsage of Bombyx mori.Chin J Biotech, 2016, 32(10): 1395–1407.(in Chinese). 何华伟, 位曙光, 王叶菁, 等. 家蚕bHLH转录因子Bmsage可溶性表达、纯化与结构分析.生物工程学报, 2016, 32(10): 1395-1407. |
| [25] | Xue RJ. Identification and characterization of immunological function of BmPTP in silkworm, Bombyx mori.[D]. Chongqing: Southwest University, 2015 (in Chinese). 薛仁举. 家蚕蛋白酪氨酸鱗酸酶BmPTP鉴定与免疫功能研究[D]. 重庆: 西南大学, 2015. |
