

1 辽宁省糖脂代谢研究重点实验室 大连大学 生命科学与技术学院,辽宁 大连 116000;
2 内蒙古医科大学 组织胚胎教研室,内蒙古 呼和浩特 010000
收稿日期:2016-04-29;接收日期: 2016-11-21 基金项目:国家自然科学基金 (No. 81270361) 资助。
摘要: 通过酵母重组P.rβ2-GPI-DV (β2糖蛋白I第5结构域) 蛋白的荧光、圆二色谱及分子对接模拟,分析血浆糖蛋白β2-GPI-DV分子结构域与ox-LDL的结合机制。SDS-PAGE、Western blotting验证重组蛋白 P.rβ2-GPI-DV表达正确性及纯度;荧光、圆二色光谱、分子对接模拟解析重组蛋白与oxLDL、oxLDL配体oxLig-1可能存在的结合机制和位点。SDS-PAGE、Western blotting显示,在12 kDa大小处有目的蛋白存在且与特异性抗体结合;荧光、圆二色谱的发色基团、二级结构的变化趋势及分子对接模拟结果揭示,P.rβ2-GPI-DV的Cys281-Lys-Asn-Lys-Glu-Lys-Lys287和Leu313-Ala-Phe-Trp316区域组成的活性口袋与oxLig-1的ω-COOH羧基是实现二者结合的关键。以上结果表明,β2-GPI通过其第5结构域 (DV) 的赖氨酸阳性区域与ox-LDL的ω-COOH基团识别结合,为血清中β2-GPI特异性结合ox-LDL的机制研究提供理论依据。
关键词: β2-糖蛋白Ⅰ 重组β2-GPI第五结构域 氧化低密度脂蛋白 oxLig-1配体 结合机制
Binding of glycoprotein β2-GPI with oxidized low density lipoprotein
Zhang He1, Li Jingda1, Chen Amei2, Liu Qingping1


1 Key Laboratory of the glucolipid metabolism, college of life science and technology, Dalian university, Dalian 116000, Liaoning, China;
2 Department of Histology and Embryology, Inner Mongolia medical university, Hohhot 010000, Inner Mongolia, China
Received: April 29, 2016; Accepted: November 21, 2016
Supported by:National Natural Science Foundation of China (No. 81270361).
Corresponding authors:Qingping Liu. Tel: +86-411-88709369; E-mail:qingpingliu40@126.com
Abstract: We analyzed the binding of P.rβ2-GPI-DV with ox-LDL by fluorescence, molecular simulation and circular dichroism. We used SDS-PAGE and Western blotting to identify the purity of P.rβ2-GPI-DV, fluorescence, circular dichroism spectroscopy and molecular docking simulation to analyze the binding between P.rβ2-GPI-DV and oxLDL. P.rβ2-GPI-DV was specifically recognized by anti-His antibody at 12 kDa position. The chromophoric groups, the changes of secondary structure and the molecular docking simulations revealed that the active pocket formed by Cys281-Lys-Asn-Lys-Glu-Lys-Lys287 and Leu313-Ala-Phe-Trp316 of P.rβ2-GPI-DV and the -COOH carboxyl of oxLig-1 were the key for binding. P.rβ2-GPI combined with ox-LDL via the fifth functional domain and the -COOH group. Our findings provide theoretical basis to further study the binding between β2-GPI and ox-LDL in serum.
Key words: β2-glycoprotein I recombinant fifth domain of β2-glycoprotein I oxidized low density lipoprotein 7-ketocholesteryl-9-carboxynonanoate ligand binding mechanism
β2糖蛋白Ⅰ (β2-glycoproteinⅠ,β2-GPI) 是一种血浆中的单糖链蛋白,由326个氨基酸残基组成,包含4个短的重复结构域 (SCR) 和在C端的第5个结构域。其中第5结构域由86个氨基酸残基组成,4个反向平行的β折叠和2个短的α螺旋形成一个中心,在该区末端形成一个约20个氨基酸残基组成的疏水袢[1]。在功能上β2-GPI能与多种带负电的物质结合,如磷脂(phospholipids,PL)、心磷脂 (cardiolipin,CL)、氧化低密度脂蛋白 (oxidized low density lipoprotein,ox-LDL)、肝素、活化血小板的膜和凝血酶原等,在与阴性电荷物质相互结合的过程中,其第5结构域发挥着关键作用。Hunt、蔡国平以及Haider等分别应用基因突变手段,证实了第5功能域中发挥结合活性的片段,也证实了DV就是其与阴性离子如心磷脂 (cardiolinpin,CL) 结合的关键结构域[2-4]。2011年,Kolyada等成功应用原核体系表达并结晶了重组β2-GPI-DV蛋白,并提出284、286和287位的赖氨酸残基是与肝素形成氢键结合的关键位置[5]。2014年,Li等用酵母重组表达β2-GPI第5结构域 (P.rβ2-GPI-DV),研究发现其特异性结合系统性红斑狼疮 (SLE) 和抗磷脂综合征 (APS) 患者血清ox-LDL,进一步显示了β2-GPI第5结构域DV特异性结合ox-LDL的结构特征,但其结合的分子结构基础以及具体结合位点并未详尽地研究分析[6]。2001年,Kobayashi等在划分ox-LDL脂类成分时,分离出一种能与β2-GPI结合的特异配体,分析其成分为7-酮基胆固醇-9-羧基壬酸酯 (7-ketocholesteryl- 9-carboxynonanoate,oxLig-1),并证实了该配体在连接β2-GPI和ox-LDL的过程中起到了关键作用[7]。Huang等首次在国内合成oxLig-1,并揭示oxLig-1作为ox-LDL的表位结构,在ox-LDL与血液中β2-GPI形成复合物参与动脉粥样硬化、系统性红斑狼疮、血栓进程中发挥重要作用[8]。
以往研究揭示,血液中高浓度的β2-GPI与ox-LDL的复合物严重危害人类的健康[9-11]。由于ox-LDL复合物的特性,国内很少关于β2-GPI与ox-LDL结合机制分析的研究报道。因此,本文将应用荧光光谱 (fluorescence spectrum)、圆二色 (circular dichroism) 及分子模拟 (molecular docking) 对接技术,通过实验室酵母重组表达的P.rβ2-GPI-DV蛋白和实验室自主合成的特异性配体oxLig-1对β2-GPI与ox-LDL的结合机制进行分析,为研究血液中β2-GPI/ox-LDL复合物的形成机制及以该复合物为靶点的研究提供理论数据。
1 材料与方法1.1 材料与试剂 P.rβ2-GPI-DV蛋白的Pich酵母表达菌株X-33由本实验室构建保存;Cu2+-ox-LDL由本实验室使用铜离子自行氧化获得;LDL购于北京协生生物科技有限公司;心磷脂 (CL) 购于德国Sigma公司;氧化低密度脂蛋白的脂类成分oxLig-1由本实验室化学合成获得。重组蛋白的缓冲稀释液PB (0.05 nmol/L,pH 7.4) 及溶解脂类物质的无水乙醇 (分子级别) 均购于上海生工。分子模拟软件AutoDock 4.2.6,圆二色光谱仪J-810为日本Jasco公司生产。
1.2 方法1.2.1 P.rβ2-GPI-DV重组蛋白的表达纯化 P.rβ2-GPI-DV的表达纯化按照实验室前期建立的表达进行[6]。取X-33酵母表达菌株接种于BMGY生长培养基,30 ℃、220 r/min过夜培养24 h;将过夜培养酵母菌以1∶100扩大培养至1 L BMGY中,30 ℃、220 r/min过夜培养24 h;将菌液1∶50的比例浓缩至200 mL的BMMY诱导培养基中,每天补加1.5%甲醇诱导剂,30 ℃、220 r/min连续培养96 h。之后,4 ℃、 6 000 r/min离心20 min,取菌液上清,经镍柱亲和层析的方法对重组蛋白进行纯化。
1.2.2 SDS-PAGE和Western blotting 取15 μg纯化后的蛋白,加适量的上样缓冲液,沸水煮5 min,离心1 min。按照常规方法进行15% SDS-PAGE电泳,一块胶进行考马斯亮蓝染色,一块电转于醋酸纤维素膜上进行免疫杂交。加鼠抗的抗His抗体 (1∶1 000) 进行孵育,洗膜后再加辣根过氧化物酶标记的羊抗鼠IgG (1∶3 000) 二抗孵育,最后加显色液显色,拍照。
1.2.3 荧光光谱检测 荧光光谱检测条件:狭缝宽度3 mm、5 mm,激发光波长280 nm,检测波长290-500 nm,扫描速度为500 nm/min;响应时间2 s;检测灵敏度为中等。将纯化好的P.rβ2-GPI-DV蛋白溶剂换成0.2 mol/L的PBS缓冲溶液,蛋白浓度确定为1 mg/mL;取1.2 mL配制好的蛋白溶液置于1 cm的石英比色皿中,置于UV-Vis吸收光谱仪中测定;将比色皿中的溶液取出加入10 μL的oxLig-1,37 ℃孵育30 min,再次置于UV-Vis吸收光谱仪中测定;在此基础上在溶液中加入10 μL的心磷脂,37 ℃孵育30 min,置于UV-Vis吸收光谱仪中测定。
1.2.4 圆二色谱检测 圆二色可以灵敏地反映出蛋白的构象变化,已广泛用于蛋白质二级结构的研究中。本文运用圆二色谱对分子模拟软件分析P.rβ2-GPI-DV重组蛋白结构及结合功能进行验证,分析其结构功能特征。
实验中的圆二色光谱检测条件:狭缝宽度0.5 mm;扫描波长范围190-250 nm;扫描速度50 nm/min;响应时间1 s,累计扫描3次。
将稀释好的P.rβ2-GPI-DV重组蛋白 (900 μg/ml) 加入0.5 mm石英比色池中检测,得到蛋白的CD光谱;向蛋白质溶液中加入oxLig-1后37 ℃孵育30 min,再次测定;向比色皿中的溶液中继续加入CL,37 ℃孵育30 min,再次测定;比较3次CD光谱的波谱变化。
改变加入oxLig-1与CL试剂的顺序后,按照上述方法重新测定,比较结果变化。
1.2.5 ELISA检测P.rβ2-GPI-DV与ox-LDL结合特性 将ox-LDL、LDL、oxLig-1、me-oxLig-1各2.5 μg包被于ELISA板,每个物质设3个复孔;按照常规ELISA方法,封闭后加入P.rβ2-GPI-DV孵育1 h,以抗His抗体为一抗加入孵育1 h,洗板后加入HRP标记的二抗孵育1 h,OPD显色,492 nm下观察结果。
1.2.6 分子模拟分析β2-GPI-DV蛋白与ox-LDL结合机制 从蛋白质数据库 (Protein data bank) 中获得含配体的P.rβ2-GPI-DV复合物的晶体结构 (PDB编号分别为3OP8)。首先将配体从复合物中剥离抽出,将受体导入到AUTODOCK 4.2.6 软件包中进行必要的结构修改,包括去除水分子、加入氢原子以及加入Gasteiger-Marsili电荷等。之后分别将P.rβ2-GPI-DV和oxLig-1、me-oxLig-1分子保存为PDBQT格式 (包含原子类型和电荷) 的文件,利用 AutoDock 4.2.6软件包对受体β2-GPI-DV和oxLig-1、me-oxLig-1分子进行半柔性对接。分子对接中P.rβ2-GPI-DV与oxLig-1、me-oxLig-1分子按1∶1比例结合。在进行半柔性对接模拟前,使用AUTOGRID 计算网格,每一次对接所用的网格长、宽和高均为100个网格点,网格包含oxLig-1分子可能作用的所有活性氨基酸残基。模拟对接过程中β2-GPI-DV结构视为刚性,oxLig-1、me-oxLig-1分子为柔性,oxLig-1、me-oxLig-1分子内的旋转键由AUTODOCK程序识别并可以在搜索过程中任意旋转,分子对接在AutoDock软件包中进行,对接使用Lamarchian遗传算法与局部能量搜索相结合 (GALS) 对β2-GPI-DV-oxLig-1、β2-GPI-DV-me-oxLig-1复合物构象进行搜索。每一次均进行了100次对接计算,最终的计算结果从软件生成的输出文件中抽提出来[12]。
2 结果与分析2.1 P.rβ2-GPI-DV重组蛋白的表达纯化结果根据实验室前期建立的表达纯化方法,成功表达纯化了P.rβ2-GPI-DV重组蛋白。SDS-PAGE检测结果表明,P.rβ2-GPI-DV在SDS-PAGE中的显示位置与设计大小一致 (图 1A);Western blotting结果表明,P.rβ2-GPI-DV蛋白可被抗His抗体特异性地识别,在12 kDa大小处出现了特异性反应条带,经镍柱纯化后纯度达90%以上 (图 1B)。
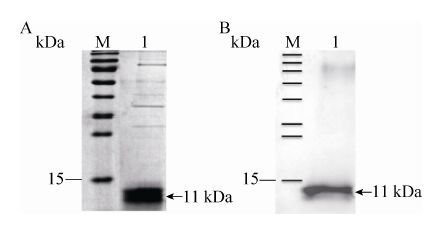 |
| 图 1 重组P.rβ2-GPI-DV蛋白的表达纯化 Figure 1 Expression and purification of the P.rβ2-GPI-DV. |
| 图选项 |
2.2 荧光光谱结果 蛋白质的荧光来源于蛋白质色氨酸、酪氨酸以及苯丙氨酸生色基团,其荧光峰分别在 348 nm、303 nm、282 nm处。P.rβ2-GPI-DV在280 nm处的紫外吸收峰是其肽链上的色氨酸和酪氨酸的苯杂环π-π*跃迁引起的[13]。P.rβ2-GPI-DV蛋白质的荧光光谱如图 2A所示,在310 nm处存在荧光峰,表明重组蛋白中存在生色氨基酸基团;在加入oxLig-1、CL等阴性物质后,P.rβ2-GPI-DV荧光峰位发生红移且强度增加 (图 2B、C)。这是因为色氨酸和酪氨酸的微环境变得极性增强,π-π*跃迁能量减小,从而最大发射波长红移,同时芳香族生色基团处于蛋白质的内部,在蛋白质变性的过程中芳香族氨基酸分子的侧链基团逐渐暴露于水溶液中,所处环境的极性逐渐增加,荧光发射峰λnm也逐渐增大。
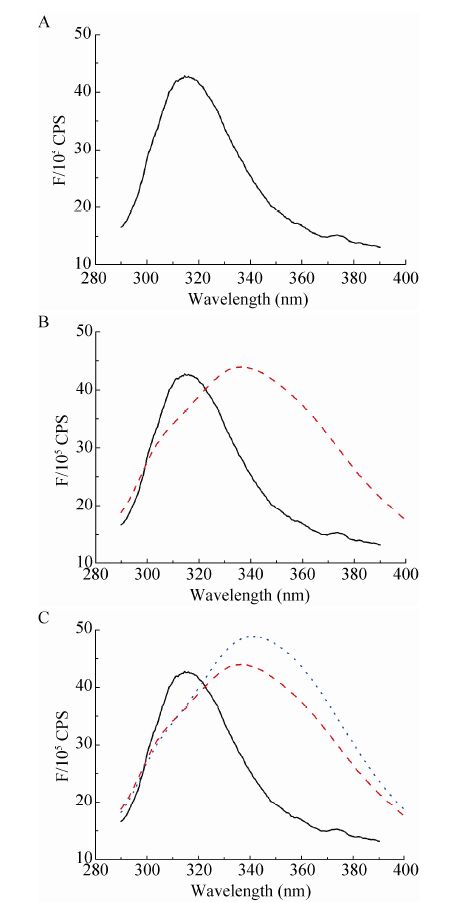 |
| 图 2 重组P.rβ2-GPI-DV蛋白荧光光谱 Figure 2 UV-Vis spectra of the P.rβ2-GPI-DV. (a) Fluorescence spectrum of P.rβ2-GPI-DV. (B) Black solid line: fluorescent spectrum of P.rβ2-GPI-DV. red dotted: fluorescence spectrum of P.rβ2-GPI-DV with oxlig-1. (C) Fluorescent spectrum of P.rβ2-GPI-DV. red dotted,black line: fluorescence spectrum of P.rβ2-GPI-DV with oxlig-1; blue dotted line: fluorescence spectrum of P.rβ2-GPI-DV with oxLig-1 then CL adding. |
| 图选项 |
2.3 圆二色谱结果分析 P.rβ2-GPI-DV重组蛋白的CD光谱结果显示 (图 3A),在208 nm和222 nm处有2个负向峰,192 nm处有1个正向峰,这是一个典型的蛋白质的α螺旋的CD谱特征,还有少量的β折叠。根据杨氏方程fα=-([θ]208+4 000)/29 000计算得出α螺旋占整个蛋白二级结构的84%;在向P.rβ2-GPI-DV蛋白溶液中加入oxLig-1,再加入CL后,随着蛋白质构象的改变,CD光谱的α螺旋、β折叠发生改变 (图 3B);当改变加入oxLig-1、CL的顺序后,CD光谱中α螺旋、β折叠也发生类似的改变 (图 3C)。
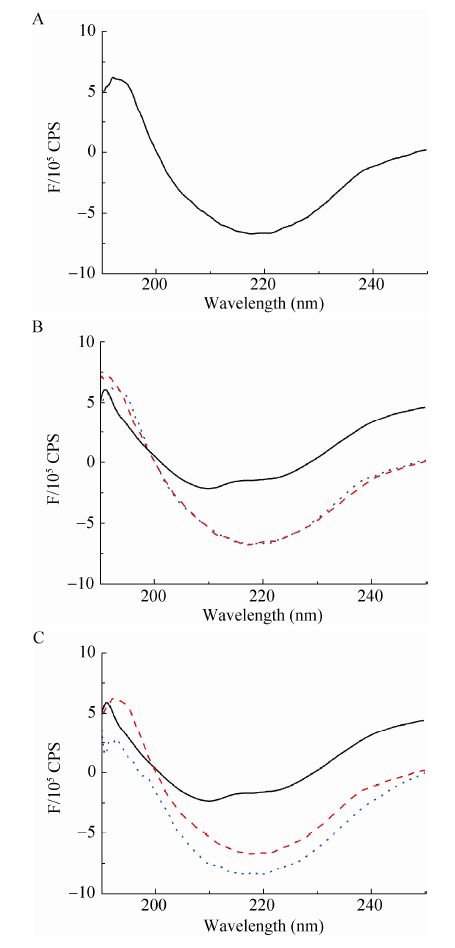 |
| 图 3 重组P.rβ2-GPI-DV蛋白CD光谱 Figure 3 CD spectra of P.rβ2-GPI-DV. (a) CD spectrum of P.rβ2-GPI-DV. (B) Black lines: CD spectrum of P.rβ2-GPI-DV. red and blue dotted line: CD spectrum of P.rβ2-GPI-DV with oxLig-1 then CL adding. (C) Black lines: CD spectrum of P.rβ2-GPI-DV. red and blue line: CD spectra of P.rβ2-GPI-DV with CL then oxLig-1 adding. |
| 图选项 |
2.4 P.rβ2-GPI-DV蛋白与ox-LDL结合的ELISA结果圆二色谱显示,P.rβ2-GPI-DV蛋白可与ox-LDL的特异性表位oxLig-1结合,为了分析oxLig-1在P.rβ2-GPI-DV与ox-LDL结合中的作用,我们进行了P.rβ2-GPI-DV蛋白的ELISA结合实验。结果如图 4所示,P.rβ2-GPI-DV蛋白与ox-LDL、oxLig-1有明显的特异结合活性,但不与甲基化后的oxLig-1结合。这一结果说明,oxLig-1参与介导了ox-LDL与P.rβ2-GPI-DV的结合,且其甲基化对结合有关键的影响作用。
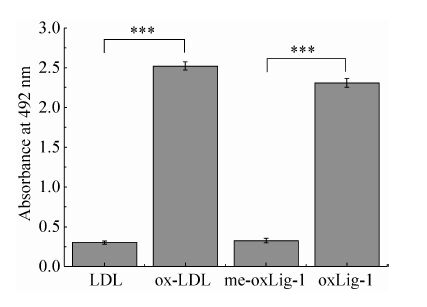 |
| 图 4 oxLIg-1介导重组P.rβ2-GPI-DV蛋白与ox-LDL结合机制 Figure 4 OxLig-1 mediated the combining mechanism of P.rβ2-GPI-DV and ox-LDL. ***P<0.001. |
| 图选项 |
2.5 分子模拟分析 β2-GPI-DV经AUTODOCK对接后,oxLig-1进入由Cys281-Lys-Asn-Lys-Glu-Lys-Lys287区域及Leu313-Ala-Phe-Trp316区域组成的活性口袋 (图 5中红色区域) 后,其ω-COOH能够接近阳性氨基酸残基位点,与284及308位点中的赖氨酸形成氢键;另外,我们还发现其疏水核心母核中两个-COOH中的氧原子能够分别与283及284位Lys形成氢键。me-oxLig-1甲基化修饰的关系,其ω-COOH的活性被甲基所掩盖,未能如oxLig-1一样进入由Cys281-Lys-Asn-Lys- Glu-Lys-Lys287区域及Leu313-Ala-Phe-Trp316区域组成的活性口袋中,仅能结合于活性口袋的边缘,未能与周边氨基酸残基形成氢键。结合能量显示 (图 6),me-oxLig-1整体结合能量为-4.8 Kcal/mol,明显大于oxLig-1的结合能量-5.41 Kcal/mol。因此,其羧基端在结合过程中发挥了关键的作用。
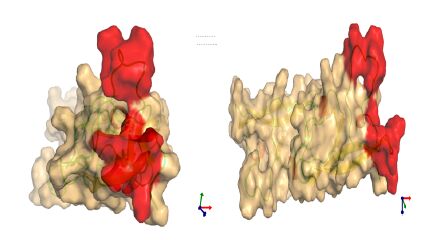 |
| 图 5 β2-GPI-DV与oxLig-1结合示意图 Figure 5 Schematic diagram of binding between β2-GPI-DV and oxLig-1. |
| 图选项 |
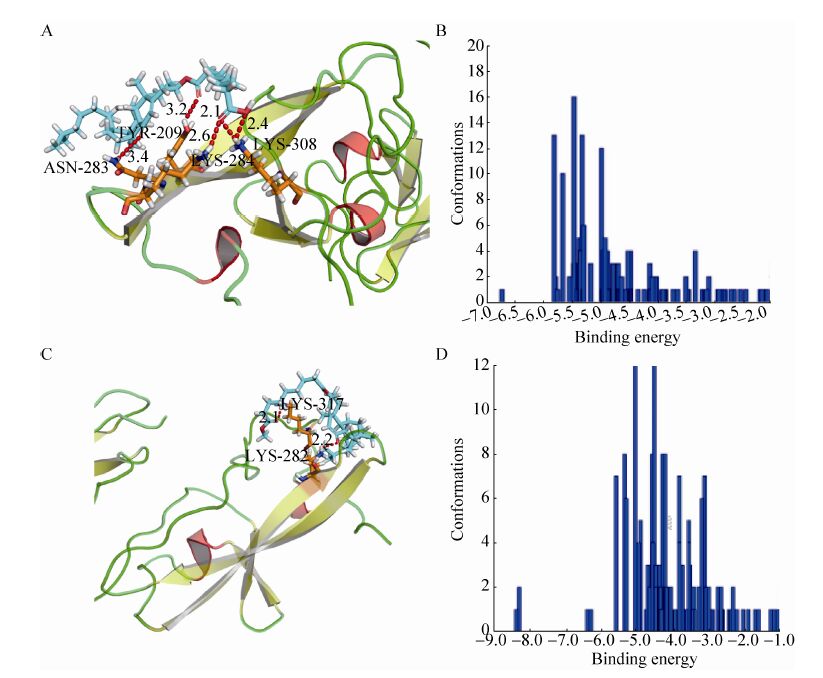 |
| 图 6 重组P.rβ2-GPI-DV蛋白的分子对接 Figure 6 The docking of P.rβ2-GPI-DV with oxLig-1 and me-oxLig-1. (A) Docking conformation figure of P.rβ2-GPI-DV and oxLig-1. (B) Clustering results figure of P.rβ2-GPI-DV and the oxlig-1. (C) Docking conformation figure of P.rβ2-GPI-DV and me-oxLig-1. (D) Clustering results figure of P.rβ2-GPI-DV and me-oxLig-1. |
| 图选项 |
3 讨论 β2-GPI可与血液中的脂质结合,参与脂类物质的转运,因此又称载脂蛋白H (apoH)。β2-GPI是一种亲磷脂糖蛋白,其作为aCL的辅因子,能通过与带有负电荷的磷脂的结合,抑制依赖磷脂的凝血过程,故起抗凝作用,被认为是人体内的天然抗凝物[14];另一方面,在ox-LDL的介导的情况下,anti-β2-GPI可以直接造成血管内皮免疫损伤,还可诱导血管内皮或单核细胞表达促凝物质促进血栓形成[15-16];β2-GPI的第5结构域还可通过结合外翻的磷脂酰丝氨酸(phosphatidylserine,PS)清除凋亡细胞和体内异物[17]。以往研究数据显示,β2-GPI在与磷脂、肝素、细胞膜、凋亡细胞及ox-LDL结合时,第5结构域发挥重要作用,但其具体部位部分****认为发生在Cys281-Cys288附近[18-19],也有****认为Leu313-Trp316起关键作用[20-21]。而这两个区域都有一个共同的特征,那就是都因富含赖氨酸残基而带有大量正电荷,因此易于结合阴性磷脂。同时,在β2-GPI第5结构域与阴性离子结合后,暴露出隐藏在第1、4结构域的抗原决定簇,诱导机体产生β2-GPI抗体,形成β2-GPI/anti-β2-GPI二元复合物;β2-GPI还可与ox-LDL特异性结合形成ox-LDL/β2-GPI/ anti-β2-GPI三元复合物。这两种复合物可被巨噬细胞所吞噬,导致泡沫化继而病变,从而参与动脉硬化 (arteriosclerosis,AS)、APS等一类自身免疫性疾病的发生和发展。
近年来的研究结果显示,β2-GPI第5结构域能够介导β2-GPI蛋白与ox-LDL的结合作用,其Cys281-Lys-Asn-Lys-Glu-Lys-Lys287Leu313- Ala-Phe-Trp316肽段由于含有大量碱性氨基酸残基,因此在结合过程中发挥了活性口袋的作用[22-24]。氧化低密度脂蛋白 (ox-LDL) 作为伴有高动脉粥样硬化自身免疫性疾病的生物标记物,一直都被认为是此类疾病的危险信号,研究表明β2-GPI与ox-LDL组合并通过共价结合形成复合体,但不与低密度脂蛋白 (LDL) 结合,通过自身anti-β2-GPI识别该复合体然后再被巨噬细胞所吞噬,最终导致了细胞的泡沫化并发生病变。另一方面,本课题组在前期研究中成功分离得到了ox-LDL的表位结构oxLig-1,经结构鉴定后推测其可能为ox-LDL的胆固醇氧化修饰衍生物,并证明了其在β2-GPI与ox-LDL的结合过程中同样发挥了关键作用[8]。为了进一步研究β2-GPI与ox-LDL的结合机制,确定二者结合的关键位点,在本研究中,我们成功表达及纯化得到了β2-GPI-DV蛋白[6],并通过圆二色及分子对接模拟等实验手段,进一步研究了二者在相互结合过程中的作用机制。
在圆二色谱实验中,我们发现在加入oxLig-1后,P.rβ2-GPI-DV 的荧光光谱谱峰出现红移现象,说明oxLig-1与P.rβ2-GPI-DV发生结合反应,使蛋白质的构象发生改变,暴露出了大量的发色氨基酸;之后我们向体系中加入了CL,结果发现谱峰没有发生明显的红移或蓝移,但荧光强度增加,因此证明加入CL后DV蛋白结构没有发生明显改变,确认二者结合DV蛋白上的同一位点,均位于DV结构中Cys281-Lys- Asn-Lys-Glu-Lys-Lys287Leu313-Ala-Phe-Trp316肽段上的阳性氨基酸上[25]。另一方面,通过oxLig-1的结构分析可以发现其尾部的羧基端具有阴性电荷的性质,因此我们推测,此羧基端为结合P.rβ2-GPI-DV 的关键位点。为了验证此推测,我们进行了分子对接模拟实验,结果显示,在oxLig-1与P.rβ2-GPI-DV结合的过程中,oxLig-1的羧基端能够与P.rβ2-GPI-DV的283、284、308位氨基酸残基形成稳定的氢键,键长分别为3.2、2.6、2.4,而甲基化修饰后的oxLig-1由于其羧基端被封闭,则不能形成此氢键;在结合能量方面,oxLig-1表现为甲基化oxLig-1需要更少的结合能量 (oxLig-1结合能量为-5.41 Kcal/mol,me-oxLig-1整体结合能量为-4.8 Kcal/mol)。通 过以上圆二色谱及分子对接实验可以发现,oxLig-1能够定位于β2-GPI-DV结构域Cys281- Lys-Asn-Lys-Glu-Lys-Lys287所形成阳性电荷凹槽内,其羧基端能够与283、284、308位赖氨酸残基发生结合形成稳定的氢键,在整个结合过程中起到锚定的作用。
综上所述,本研究证明了β2-GPI的DV功能结构域上的Cys281-Lys-Asn-Lys-Glu-Lys-Lys287及Leu313-Ala-Phe-Trp316能够与ox-LDL表面胆固醇氧化衍生物oxLig-1的羧基端发生结合并形成氢键,由此介导了β2-GPI与ox-LDL的结合。本研究为β2-GPI/ox-LDL复合物的形成、含量测定及以复合物为靶点的研究奠定了基础。
参考文献
| [1] | Bouma B, de Groot PG, van den Elsen JMH, et al. Adhesion mechanism of human β2-glycoprotein I to phospholipids based on its crystal structure.EMBO J, 1999, 18(19): 5166–5174.DOI: 10.1093/emboj/18.19.5166 |
| [2] | Sanghera DK, Wagenknecht DR, McIntyre JA, et al. Identification of structural mutations in the fifth domain of apolipoprotein H (β2-glycoprotein I) which affect phospholipid binding.Hum Mol Genet, 1997, 6(2): 311–316.DOI: 10.1093/hmg/6.2.311 |
| [3] | Rahgozar S, Yang QX, Giannakopoulos B, et al. Beta2-glycoprotein I binds thrombin via exosite I and exosite II: anti-β2-glycoprotein I antibodies potentiate the inhibitory effect of β2-glycoprotein I on thrombin-mediated factor XIa generation.Arthritis Rheum, 2007, 56(2): 605–613.DOI: 10.1002/(ISSN)1529-0131 |
| [4] | Mehdi H, Naqvi A, Kamboh MI. Recombinant hepatitis B surface antigen and anionic phospholipids share a binding region in the fifth domain of β2-glycoprotein I (apolipoprotein H).Biochim Biophys Acta, 2008, 1782(3): 163–168.DOI: 10.1016/j.bbadis.2008.01.001 |
| [5] | Kolyada A, Lee CJ, De Biasio A, et al. A novel dimeric inhibitor targeting beta2-GPI in beta2GPI/ Antibody complexes implicated in antiphospholipid syndrome.PLoS ONE, 2010, 5(12): e15345.DOI: 10.1371/journal.pone.0015345 |
| [6] | Li JD, Chi Y, Liu SQ, et al. Recombinant domain V of β2-glycoprotein I inhibits the formation of atherogenic ox-LDL/β2-glycoprotein I complexes.J Clin Immunol, 2014, 34(6): 669–676.DOI: 10.1007/s10875-014-0063-y |
| [7] | Kobayashi K, Matsuura E, Liu Q, et al. A specific ligand for β2-glycoprotein I mediates autoantibody- dependent uptake of oxidized low density lipoprotein by macrophages.J Lipid Res, 2001, 42(5): 697–709. |
| [8] | Huang ZY, Li WZ, Wang RJ, et al. 7-ketocholesteryl-9-carboxynonanoate induced nuclear factor-kappa B activation in J774A.1 macrophages.Life Sci, 2010, 87(19/22): 651–657. |
| [9] | Nowak B, Szmyrka-Kaczmarek M, Durazińska A, et al. Anti-ox-LDL antibodies and anti-ox-LDL/β2- GPI antibodies in patients with systemic lupus erythematosus.Adv Clin Exp Med, 2012, 21(3): 331–335. |
| [10] | Liu L, Liu ZZ, Chen H, et al. Oxidized low-density lipoprotein and β-glycerophosphate synergistically induce endothelial progenitor cell ossification.Acta Pharmacol Sin, 2011, 32(12): 1491–1497.DOI: 10.1038/aps.2011.128 |
| [11] | Zhang CN, Luo Y, Huang ZW, et al. Elevated serum β2-GPI-Lp(a) complexes levels in children with nephrotic syndrome.Clin Chim Acta, 2012, 413(19/20): 1657–1660. |
| [12] | Liu QP, Li WZ, Liu YY. A natural surfactant of an peroxide multiplieation activated receptor-γ: China, CN16090726. 2016-04-10 (in Chinese) 刘庆平, 李文哲, 刘媛媛. 一种过氧化物增殖物激活受体-γ的天然活性剂: 中国, CN16090726. 2016-04-10. |
| [13] | Wu D, Xu GY. Study on protein-surfactant interaction by spectroscopic methods.Acta Physico-Chim Sin, 2006, 22(2): 254–260.(in Chinese). 吴丹, 徐桂英. 光谱法研究蛋白质与表面活性剂的相互作用.物理化学学报, 2006, 22(2): 254-260. |
| [14] | Nimpf J, Wurm H, Kostner GM. β2-glycoprotein I(apo-H) inhibits the release reaction of human platelets during ADP-induced aggregation.Atherosclerosis, 1987, 63(2-3): 109–114.DOI: 10.1016/0021-9150(87)90110-9 |
| [15] | Kamboh MI, Sanghera DK, Mehdi H, et al. Single nucleotide polymorphisms in the coding region of the apolipoprotein H (β2-glycoprotein I) gene and their correlation with the protein polymorphism, anti-β2-glycoprotein I antibodies and cardiolipin binding: description of novel haplotypes and their evolution.Ann hum genet, 2004, 68(4): 285–299.DOI: 10.1046/j.1529-8817.2004.00097.x |
| [16] | Bonetti PO, Lerman LO, Lerman A. Endothelial dysfunction: a marker of atherosclerotic risk.Arterioscler Thromb Vasc Biol, 2003, 23(2): 168–175.DOI: 10.1161/01.ATV.0000051384.43104.FC |
| [17] | Okkels H, Rasmussen TE, Sanghera DK, et al. Structure of the human β2-glycoprotein I (apolipoprotein H) gene.Eur J Biochem, 1999, 259(1/2): 435–440. |
| [18] | Lopez LR, Kobayashi K, Matsunami Y, et al. Immunogenic oxidized low-density lipoprotein/β2- glycoprotein I complexes in the diagnostic management of atherosclerosis.Clin Rev Allergy Immunol, 2009, 37(1): 12–19.DOI: 10.1007/s12016-008-8096-8 |
| [19] | Chou MY, Hartvigsen K, Hansen LF, et al. Oxidation-specific epitopes are important targets of innate immunity.J Intern Med, 2008, 263(5): 479–488.DOI: 10.1111/j.1365-2796.2008.01968.x |
| [20] | Shi T, Iverson GM, Qi JC, et al. β2-Glycoprotein I binds factor XI and inhibits its activation by thrombin and factor XIIa: loss of inhibition by clipped β2-glycoprotein I.Proc Nat Acad Sci USA, 2004, 101(11): 3939–3944.DOI: 10.1073/pnas.0400281101 |
| [21] | Matsuura E, Hughes GRV, Khamashta MA. Oxidation of LDL and its clinical implication.Autoimmun Rev, 2008, 7(7): 558–566.DOI: 10.1016/j.autrev.2008.04.018 |
| [22] | Sheng Y, Sali A, Herzog H, et al. Site-directed mutagenesis of recombinant human β2-glycoprotein I identifies a cluster of lysine residues that are critical for phospholipid binding and anti-cardiolipin antibody activity.J Immunol, 1996, 157(8): 3744–3751. |
| [23] | Ohkur N, Hagihara Y, Yoshimura T, et al. Plasmin can reduce the function of human β2 glycoprotein I by cleaving domain V into a nicked form.Blood, 1998, 91(11): 4173–4179. |
| [24] | Mehdi H, Naqvi A, Kamboh MI. A hydrophobic sequence at position 313-316 (Leu-Ala-Phe-Trp) in the fifth domain of apolipoprotein H (β2-glycoprotein I) is crucial for cardiolipin binding.Eur J Biochem, 2000, 267(6): 1770–1776.DOI: 10.1046/j.1432-1327.2000.01174.x |
| [25] | Hunt JE, Simpson RJ, Krilis SA. Identification of a region of β2-glycoprotein I critical for lipid binding and anti-cardiolipin antibody cofactor activity.Proc Natl Acad Sci USA, 1993, 90(6): 2141–2145.DOI: 10.1073/pnas.90.6.2141 |
